Журнал общей биологии, 2022, T. 83, № 1, стр. 62-70
Свет и 13C: отличаются ли орхидеи от других сосудистых растений по реакции на затенение?
В. Г. Онипченко 1, *, Дж. Х. Корнелиссен 2, М. Г. Вахрамеева 1, Л. Д. Захарова 3, А. А. Ахметжанова 1, М. И. Хомутовский 1, Р. ван Логтестин 2, Н. А. Судзиловская 4
1 Московский государственный университет им. М.В. Ломоносова, биологический факультет,
кафедра экологии и географии растений
119234 Москва,
Ленинские горы, 1, стр. 12, Россия
2 Амстердамский свободный университет, факультет наук о Земле и жизни, отделение экологических наук
1081 HV Амстердам, Де Белелаан, 1085, Нидерланды
3 Государственный Дарвиновский музей
117292 Москва, ул. Вавилова, 57, Россия
4 Лейденский университет, Институт наук об окружающей среде (CML)
2333 CC Лейден, Эйнштейнвег, 2, Нидерланды
* E-mail: vonipchenko@mail.ru
Поступила в редакцию 15.10.2021
После доработки 26.10.2021
Принята к публикации 01.11.2021
- EDN: XQRGFK
- DOI: 10.31857/S0044459622010067
Аннотация
Орхидеи имеют симбиотические отношения с эктомикоризными или сапротрофными (“ризоктония”) грибами, которые обеспечивают растения питательными веществами. Степень зависимости растений от грибов в плане обеспечения органическим веществом отражается в показателях величины δ13C в тканях растений. Мало что известно о том, насколько широко распространена частичная микогетеротрофия (ЧМГ) среди орхидей в природе, и вопрос о том, обладают ли орхидеи, ассоциированные с ризоктонией, микогетеротрофией, остается открытым. Используя орхидеи с эктомикоризными грибами и виды орхидей, ассоциированные с ризоктонией, мы проверили гипотезу о том, что наземные зеленые орхидеи снижают свои значения δ13C в ответ на затенения меньше, чем соседние сосудистые растения, не относящиеся к орхидным (доказательство ЧМГ). Мы исследовали восемь пар видов растений (орхидея в паре с эталонным автотрофным растением, растущим рядом) в условиях хорошо освещенного и затененного участков на площадках в европейской части России. На каждом участке регистрировали уровень освещенности и исследовали листья растений на величины δ13C. Обнаружено, что все протестированные орхидеи показали сходную более слабую реакцию содержания 13C на относительную освещенность в отличие от значимо более сильной реакции у контрольных (не орхидных) растений, что свидетельствует о широком распространении ЧМГ среди орхидей. У орхидей с эктомикоризными грибами и орхидей, ассоциированных с ризоктонией, не отмечено существенной разницы в реакции δ13C на тень, что подтверждает микогетеротрофные механизмы переноса углерода к растениям у орхидей, ассоциированных с “ризоктониевыми” грибами. Доля углерода, полученного от грибов, для отдельных видов орхидей варьировала от 3 до 50%. Орхидеи снижали плотность устьиц в ответ на затенение меньше или так же, как автотрофные растения, что позволяет предположить, что микогетеротрофные растения могут быть несколько менее лимитированы доступностью воды, чем автотрофные виды, что, возможно, связано с поступлением воды от грибов. Наши данные подтверждают широкую распространенность ЧМГ среди орхидей и существование ЧМГ у орхидей, ассоциированных с “ризоктониевыми” грибами. Полученные результаты расширяют представления о важном экологическом значении микоризных ассоциаций в подземных пищевых сетях.
Для растений из сем. Orchidaceae Juss. характерен микоризный симбиоз, по крайней мере на ранних стадиях онтогенеза (Dearnaley, 2007). Типичная микориза – это симбиотические отношения между растениями и грибами, при которых растения обеспечивают грибы углеводами, а грибы снабжают растения элементами минерального питания и водой (Allen, 1991). Однако многие фотосинтезирующие орхидеи могут также получать органический углерод (C) из внешних источников через микоризные грибы и поэтому могут рассматриваться как частичные микогетеротрофы (ЧМГ) или миксотрофы (Girlanda et al., 2011; Sommer et al., 2012; Merckx, 2013; Selosse, Martos, 2014; Gebauer et al., 2016; Selosse et al., 2017; Suetsugu et al., 2018; Těšitel et al., 2018). Грибной углерод часто обогащен 13C (Billings, Richter, 2006; Bowling et al., 2008; Merckx et al., 2010, но см. Selosse, Martos, 2014) по сравнению с автотрофными растениями, поэтому растения, получающие углерод через грибной путь, имеют более высокое содержание 13C в тканях (Mayor et al., 2009; Hynson et al., 2013). Например, в бореальном лесу в Эстонии ЧМГ орхидеи имеют значения δ13C в диапазоне от –30 до –27.8‰, т.е. промежуточные между полными автотрофами, которые обычно имеют диапазон значений δ13C от –32 до –30.5‰, и полностью микогетеротрофными растениями, например, диапазон δ13C от –26.1 до –25.5‰ у Monotropa hypopithys из сем. Ericaceae (Tedersoo et al., 2007).
При выращивании в тени автотрофные C3-растения обычно снижают плотность устьиц (Salisbury, 1928). Это приводит к уменьшению устьичной проводимости, увеличению отношения мольной доли межклеточного CO2 к мольной доле CO2 в окружающей среде (ci/ca) и снижению δ13C в листьях (Brooks et al., 1997; Duursma, Marshall, 2006; Preiss et al., 2010; Zhu et al., 2010; Zhou et al., 2011; Cernusak et al., 2013). Тенденция к снижению δ13C в тени ожидается и для орхидей, но благодаря их способности получать обогащенные 13C органические вещества от грибов, снижение значения δ13C в тканях орхидей в условиях тени может быть меньше, чем снижение δ13C в тканях полностью автотрофных растений. Действительно, для отдельных растений орхидей было показано (Hynson et al., 2013), что (1) из-за поглощения углерода, обогащенного δ13C, из грибов листья орхидей с ЧМГ имеют более высокие значения δ13C, чем полностью автотрофные растения, и (2) доля углерода, полученного из грибов, увеличивается у орхидей в условиях тени (Preiss et al., 2010). Однако сохраняются ли такие связи между несколькими видами орхидей и другими сосудистыми видами, и выдерживают ли они полевые условия, где другие факторы динамики углерода могут нарушить закономерности, обнаруженные в лабораторных исследованиях? В данном исследовании мы описываем метод проверки частичной микогетеротрофии in situ, основанный на сравнении содержания 13C у хорошо освещенных растений и в тени.
Орхидеи образуют специфический тип микоризы, названный “орхидным” типом, с широким спектром ассоциированных микоризных грибов, которые могут быть эктомикоризными с другими растениями и/или сапротрофными (с так называемыми ризоктониевыми) грибами (Smith, Read, 2008). Ризоктонивые грибы включают несколько филогенетически разнообразных групп (Dearnaley et al., 2012). Если в более ранних исследованиях считалось, что орхидеи, образующие микоризные ассоциации с эктомикоризными (Martos et al., 2009; Lallemand et al., 2019) грибами (орхидеи с ЭМГ, но они часто содержат и ризоктониевые грибы), обладают миксотрофными свойствами, то Селоссе и Мартос (Selosse, Martos, 2014) предположили, что орхидеи, ассоциированные с ризо-ктонией (R-орхидеи), также являются ЧМГ. Однако у R-орхидей микогетеротрофию трудно обнаружить, поскольку она не отражается в высоких абсолютных значениях δ13C в тканях, как у орхидей с ЭМГ. Это связано с тем, что абсолютные значения δ13C в тканях R-орхидей низкие (Stöckel et al., 2014) из-за более низких величин δ13C грибов ризоктонии по сравнению с таковыми в ЭМГ (Selosse, Martos, 2014). Это приводит к тому, что значения δ13C R-орхидей довольно близки к значениям δ13C автотрофных C3-растений. Учитывая сложность обнаружения микогетеротрофии по содержанию δ13C в тканях, альтернативный метод с использованием изотопа 2H (дейтерия) был предложен Гебауэр с соавт. (Gebauer et al., 2016) и Швайгер с соавт. (Schweiger et al., 2018), которые подтвердили микогетеротрофию R-орхидей. Швайгер с соавт. (Schweiger et al., 2018) подтвердили частичную микогетеротрофию нескольких R-орхидей путем сравнения изотопного состава между подземными проростками, взрослыми орхидеями и автотрофными растениями. Другим сильным, хотя и косвенным, источником доказательств микогетеротрофии орхидей является реакция 13C на тень: разница в содержании δ13C между растениями в хорошо освещенной и затененной среде должна быть меньше у (частично) микогетеротрофных орхидей по сравнению с разницей у соседних полностью автотрофных растений (Hynson et al., 2013). Здесь мы предполагаем, что реакция δ13C на тень у R-орхидей так же мала, как и у других орхидей, что является дополнительным полевым доказательством (частичной) микогетеротрофии R-орхидей.
Таким образом, мы проверим гипотезу о том, что наземные зеленые орхидеи в ответ на тень снижают свои значения δ13C меньше, чем соседние “неорхидные” сосудистые растения.
МАТЕРИАЛЫ И МЕТОДЫ
Исследуемые растения и отбор проб. Восемь пар видов растений, т.е. по одной орхидее и одному эталонному “неорхидному” виду, растущему рядом, были изучены в полевых условиях в нескольких местах европейской части России (табл. 1). Растения каждой пары собирали в пределах популяций как на свету, так и в тени. Для одной пары видов (Dactylorhiza fuchsii и Convallaria majalis) собрали растения из пяти популяций в пределах трансекты в 5 км, для других пар видов (каждая пара была отобрана пять раз на свету и пять раз в тени) расстояния между точками отбора составляли несколько сотен метров. В данной точке отбора проб орхидею и соответствующее контрольное растение собирали как можно ближе друг к другу, всегда на расстоянии 20–100 см друг от друга, чтобы убедиться, что они развивались в схожих условиях освещения. Для оценки 13C (нефотосинтезирующих) полностью микогетеротрофных (МГ) растений в качестве эталона собирали листья Neottia nidus-avis (n = 6) в тех же точках отбора проб, что и пары D. fuchsii и C. majalis. Рядом с другими исследованными видами не было жизнеспособных полностью МГ растений, но δ13C для N. nidus-avis был похож на значения для полностью МГ растений в других умеренных регионах (Gebauer, Meyer, 2003; Tedersoo et al., 2007). Поэтому мы использовали полученные значения для приблизительной оценки доли углерода, получаемого орхидным растением от грибов, с помощью линейной смешанной модели с двумя источниками (Gebauer, Meyer, 2003).
Таблица 1.
Описание участка, средние условия освещенности для “световой” и “теневой” популяции и исследованные пары видов
| Популяция №* | Местоположение** | Местонахождение | Сообщество | % открытого неба – свет | % открытого неба – тень | Орхидея и контрольный вид | ТМГ орхидей*** |
|---|---|---|---|---|---|---|---|
| 1 (50) | МО, Приокско-террасный заповедник | 54°54′ с.ш. 37°37′ в.д. |
Смешанные бореальные леса | 43.1 | 19.8 | Dactylorhiza fuchsii | R |
| Convallaria majalis | |||||||
| 2 (10) | ВО, Национальный парк “Русский Север” | 59°53′ с.ш. 38°17′ в.д. |
Разнотравный луг с кустарниками | 100 | 62.9 | Listera ovata | E |
| Fragaria vesca | |||||||
| 3 (10) | ВО, Национальный парк “Русский Север” | 59°53′ с.ш. 38°17′ в.д. |
Разнотравный луг с кустарниками | 100 | 72.2 | Gymnadenia conopsea | R |
| Fragaria vesca | |||||||
| 4 (10) | КО, Национальный парк “Куршская коса” | 55°06′ с.ш. 20°44′ в.д. |
Сосновый лес на песчаной почве | 76.3 | 36.5 | Epipactis atrorubens | E |
| Hieracium umbellatum | |||||||
| 5 (10) | МО, Звенигородская биологическая станция, Луцино | 55°42′ с.ш. 36°46′ в.д. |
Разнотравный луг с кустарниками | 94.6 | 43 | Platanthera bifolia | E |
| Taraxacum officinale | |||||||
| 6 (10) | ВО, Национальный парк “Русский Север” | 59°53′ с.ш. 38°17′ в.д. |
Разнотравный луг с кустарниками | 100 | 37.8 | Epipactis helleborine | E |
| Fragaria vesca | |||||||
| 7 (10) | МО, Пущино | 54°49′ с.ш. 37°36′ в.д. |
Вторичный березовый лес | 22.3 | 12.5 | Epipactis helleborine | E |
| Convallaria majalis | |||||||
| 8 (10) | КЧР, Тебердинский государственный заповедник, 2400 м над ур. м. | 43°26′ с.ш. 41°42′ в.д. |
Субальпийское болото | 92.4 | 18.6 | Dactylorrhiza euxina | R |
| Carex nigra |
Примечание. * – в скобках указано количество образцов растений на пару. ** – Московская область (МО), Вологодская область (ВО), Калининградская область (КО), Карачаево-Черкесская Республика (КЧР). Тип микоризных грибов (ТМГ) орхидей на основе молекулярных анализов, о которых сообщалось в ранее опубликованных работах (Hadley, 1970; Rasmussen, 1995; Tedersoo et al., 2007; Selosse, Roy, 2009, и др.). *** R – R-орхидеи, E – орхидеи с ЭМГ, но, возможно, имеющие также некоторые ризоктонии.
Обычный метод сравнения изотопного состава целевого вида с эталонными заключается в том, что вместе с целевым видом отбирают по крайней мере три соседних автотрофных эталонных вида, чтобы отобразить происходящую вариацию в автотрофных растениях (Gebauer, Meyer, 2003). Этот подход имеет очевидные достоинства, но не очень точен, когда межвидовые и пространственные вариации высоки. Но у нас не было специальной задачи сравнить содержание 13С между орхидными и “неорхидными” видами, а разница между освещенными и затененными растениями (популяциями) локальна. Для такого сравнения было практически невозможно использовать более одного эталонного вида, чтобы охватить сходные условия освещения с целевыми растениями орхидей.
С каждого растения был собран один хорошо развитый типичный стеблевой лист (без черешков, кончиков и базальных частей). Произвольная половина листа была высушена на воздухе для дальнейшего анализа 13C.
Оценка открытого неба (освещенности). Для оценки условий освещенности в точках отбора проб были сделаны цифровые фотографии кустарников или полога деревьев над изучаемыми особями растений. Камера Panasonic Lumix DMC-FZ100 (14 000 Мп) была установлена на палке на высоте 25 см от поверхности почвы (т.е. примерно на высоте листьев орхидеи). Было сделано по пять фотографий из каждой точки: зенит (Z), 45° от зенита на юг (S), запад (W), восток (E) и север (N) соответственно. Фотографии были сделаны в конце июня–июле 2012 г. Фотографии были изучены с помощью программы ImageJ для расчета процента открытого неба. В центрально-западной части России прямое солнечное и диффузное излучение неба приблизительно равны (Абакумова и др., 2012), поэтому мы использовали следующее уравнение для расчета общего процента открытого неба для каждой точки:
13C-анализ. Изотопный состав углерода исследовали с помощью элементного анализатора (NC2500, ThermoQuest Italia, Родана, Италия), соединенного с масс-спектрометром (Delta Plus, Thermo-Quest Finnigan, Бремен, Германия). Для калибровки использовались USGS 40 и USGS 41 (L-глутаминовая кислота; Геологическая служба США). Воспроизводимость анализа δ13C была определена путем повторного анализа внутреннего стандарта (растительный материал с 45.7% C и δ13C = –28.50‰), который изменялся только в пределах 0.15‰ (n = 3). Содержание стабильных изотопов определяли с помощью формулы:
где Rsample и Rstandard обозначают отношения 13C/12C образца и стандарта Vienna PeeDee Belemnite (VPDB) соответственно.Статистика. Мы проверили гипотезу с помощью двух взаимодополняющих тестов. Сначала подвергли данные по δ13C трехстороннему полнофакторному ANOVA с затенением (да или нет), типом растения (орхидея или контроль) и идентичностью пары видов орхидея–контроль (восемь пар видов), проверяя значимость взаимодействия между факторами “затенение” и “тип растения” (орхидея или контроль). Затем исследовали корреляции Пирсона между δ13C и интенсивностью света для орхидей и автотрофных растений соответственно.
Среди изученных растений некоторые виды орхидей рассматриваются как частичные микогетеротрофы, имеющие симбиотические связи с эктомикоризными грибами (Epipactis atrorubens, Platanthera bifolia, Listera ovata – Tedersoo et al., 2007; E. helleborine, L. ovata – Selosse, Roy, 2009). Для Dactylorhiza spp. и Gymnadenia conopsea в качестве микоризных грибов были отмечены в основном Rhizoctonias s.l. Мы сравнили реакцию на тень для этих R-орхидей с другими изученными орхидеями, подвергнув видовые средние значения δ13C орхидей и парных автотрофных растений трехфакторному дисперсионному анализу (ANOVA) для изучения значимости взаимодействия микоризных грибов (R-орхидеи против орхидей с ЭМГ), типа растения (орхидея против автотрофного растения) и доступности света (свет против условий затенения).
РЕЗУЛЬТАТЫ
Трехфакторный дисперсионный анализ выявил значимое взаимодействие между затенением и принадлежностью растений к орхидеям (орхидея против контроля; Fdf = 1.223 = 4.19, P = 0.041), указывающее на то, что орхидеи реагировали на затенение иначе, чем контрольные растения, демонстрируя лишь незначительное снижение значений δ13C на 0.84 ± 0.39‰ (среднее ± SE по восьми видам), по сравнению с восемью парными автотрофными видами растений, которые снизили средние значения δ13C на 2.38 ± 0.40‰ (рис. 1).
Рис. 1.
Характеристики δ13C растений в ответ на затенение для видов орхидей и их парных автотрофных видов сосудистых растений (средние значения и стандартные ошибки). Светло-голубой – δ13C у контрольного автотрофного растения, растущего в тени; розовый – δ13C у контрольного автотрофного растения, растущего в светлых условиях; темно-синий – δ13C у орхидеи, растущей в тени; красный – δ13C у орхидеи, растущей в хорошо освещенной среде. Cтолбики срезаны при значении δ13C = –25‰, что близко к значению δ13C, зарегистрированному для полностью микогетеротрофных растений (Gebauer, Meyer, 2003; Tedersoo et al., 2007).
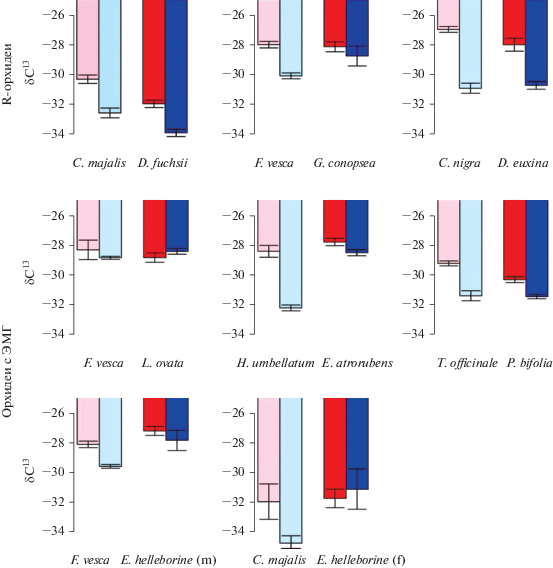
При объединении средних значений для всех восьми пар изученных видов обнаружена значительная, но довольно слабая положительная корреляция между процентом открытого неба и значениями δ13C листьев для орхидей (r 2 = 0.44, P = = 0.0017), в то время как для контрольных растений корреляция была намного сильнее (r 2 = 0.74, P < 0.0001). Таким образом, полученные данные подтвердили ожидания более сильной корреляции между δ13C и относительной освещенностью для контрольных растений, чем для орхидей.
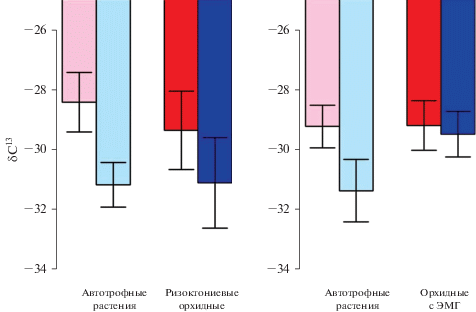
Реакция R-орхидей на тень была довольно похожа на реакцию орхидей с ЭМГ. Значения δ13C в ответ на тень у R-орхидей (три вида) снижались немного больше, чем у орхидей с ЭМГ (пять видов), но все же меньше, чем у их парных автотрофных растений (рис. 2). Взаимодействие между типом микоризы, типом растения и доступностью света не было значимым (F1.28 = 0.091, P = 0.8), что подтверждает предположение о том, что R‑орхидеи реагируют на тень аналогично другим орхидеям и оба типа орхидей отличаются по реакции от автотрофных растений.
Рис. 2.
Значения δ13C растений в ответ на затенение для R-орхидей и орхидей с ЭМГ и их парных автотрофных сосудистых растений. Светло-голубой – δ13C у контрольного автотрофного растения, растущего в тени; розовый – δ13C у контрольного автотрофного растения, растущего в хорошо освещенных условиях; темно-синий – δ13C у орхидей, растущих в тени; красный – δ13C у орхидей, растущих в хорошо освещенных условиях.
ОБСУЖДЕНИЕ
13C в тени
Мы продемонстрировали на широком спектре видов орхидей в сравнении с другими сосудистыми видами и в полевых условиях, что частично микогетеротрофные орхидеи снижают содержание δ13C в тканях меньше, чем полностью автотрофные растения (не орхидеи), в ответ на теневые условия. Это сильное косвенное доказательство предположения о том, что частично микогетеротрофные орхидеи зависят от углерода почвенных грибов в условиях, когда их собственная фотосинтетическая продукция ограничена. Некоторые предыдущие исследования продемонстрировали аналогичные закономерности для отдельных видов орхидей. Например, Прайс и соавторы (Preiss et al., 2010) отметили положительную корреляцию между δ13C и перехватом света для “неорхидных” автотрофов, но не обнаружили такой же корреляции для видов р. Cepha-lanthera (ЧМГ).
Полностью микогетеротрофные растения в лесах умеренной зоны имеют относительно схожие значения δ13C. Neottia nidus-avis в нашем исследовании имела значение δ13C –24.67 ± 0.27‰ (n = 6), что несколько выше, чем у МГ Monotropa hypopithys (δ13C –25.9 ± 0.2‰), о котором сообщали Тедерсу с соавт. (Tedersoo et al., 2007), но ниже, чем у N. nidus-avis в Баварии (δ13C –22.8 ± 0.2‰; Gebauer, Meyer, 2003). Согласно линейной смешанной модели с двумя источниками (Gebauer, Meyer, 2003), в хорошо освещенной среде в нашем исследовании доля углерода грибного происхождения колебалась для двух популяций E. helleborine от 4 до 27%, в то время как для E. atrorubens это значение составляло 16%. В тенистых условиях расчетные значения доли углерода грибного происхождения были следующими: D. euxina – 3%, E. atrorubens – 49%, E. helleborine – 36%, G. conopsea – 25%, L. ovata – 9%. Доля углерода, полученного с помощью грибов, была выше в тени, чем при хорошем освещении.
Чтобы уменьшить потерю воды через диффузию из устьиц, сосудистые растения обычно уменьшают плотность устьиц в тенистых условиях, где фотосинтез ограничен доступностью света, а не скоростью поглощения CO2 (Peat, Fitter, 1994). Орхидеи, благодаря частичной микогетеротрофии, менее зависимы от собственного фотосинтеза, чем полностью автотрофные растения, особенно в условиях тени, где они увеличивают долю углерода, получаемого от грибов (Preiss et al., 2010). Поэтому ожидается, что в тени они будут снижать плотность устьиц даже сильнее, чем полностью автотрофные растения. Действительно, полностью гетеротрофные растения обычно не имеют или имеют очень ограниченное число устьиц из-за независимости от собственного фотосинтеза (Leake, 1994). Мы провели дополнительное исследование плотности устьиц в двух парах растений: D. fuchsii – C. majalis и E. atrorubens – H. umbellatum. В обоих случаях мы наблюдали снижение устьичной плотности в условиях затенения, но вопреки ожиданиям это снижение было выше или сходным у контрольных растений, чем у орхидей: не было значительных различий для пары E. atrorubens – H. umbellatum, а D. fuchsii даже показал меньшее снижение устьичной плотности в ответ на затенение, чем C. majalis (F1.96 = 9.5273, P = 0.003). Таким образом, предварительные данные не подтвердили априорные ожидания о более выраженном сокращении устьиц у орхидей по сравнению с другими видами в условиях затенения. Это может быть объяснено меньшей пластичностью растений ЧМГ по сравнению с полностью автотрофными растениями в отношении устьичной плотности. Таким образом, на пути к полной микогетеротрофии плотность устьиц является относительно консервативным признаком. Наблюдения за полностью гетеротрофными альбиносными (т.е. нефотосинтезирующими) формами Cephalanthera damasonium показали сходную плотность устьиц для зеленых и альбиносных растений (Roy et al., 2013). Более того, у растений-альбиносов этого вида устьичная проводимость была в 2 раза выше (Julou et al., 2005) по сравнению с автотрофными растениями. Таким образом, плотность устьиц, с одной стороны, в целом эволюционно относительно консервативна, а с другой – менее пластична у орхидей по сравнению с другими растениями. Мы предполагаем, что последнее может быть связано с обеспечением растений водой от симбиотических грибов. Известно, что арбускулярная микориза, а также эктомикоризные грибы могут улучшать водный режим своих растений-хозяев (Augé, 2001; Smith et al., 2010). Транспорт воды микоризными грибами орхидей изучен недостаточно хорошо (Smith, Read, 2008), но мы не обнаружили никаких признаков ингибирования такого транспорта. Если грибы поставляют значительное количество воды растениям, транспирация орхидей может быть менее ограниченной, чем у контрольных растений, и может привести к меньшему снижению плотности устьиц в более затененных условиях.
Орхидеи, ассоциированные с ризоктонией, в сравнении с другими орхидеями
Согласно Селоссе и Мартосу (Selosse, Martos, 2014), ЧМГ орхидеи могут не изменять δ13C по сравнению с другими растениями, если они образуют симбиоз с грибами ризоктонии, которые не обогащены δ13C. Наши результаты согласуются с предположением о том, что реакция на тень (разница в δ13C между растениями в хорошо освещенной и затененной среде) у R-орхидей сходна с реакцией орхидей с ЭМГ (из-за меньшей зависимости от фотосинтеза) и отличается от “неорхидных” видов. Когда свет становится ограничивающим фактором, некоторые, но не все зеленые орхидеи могут увеличить поступление углерода от грибов: обнаружено для двух видов Cephalanthera (Preiss et al., 2010), не обнаружено для Goodyera (Liebel et al., 2015) и Cypripedium calceolus (Preiss et al., 2010). Среди исследованных нами видов некоторые орхидеи считаются частично микогетеротрофными (E. atrorubens, P. bifolia, L. ovata – Tedersoo et al., 2007; E. helleborine, L. ovata – Selosse, Roy, 2009; E. helleborine, G. conopsea, P. bifolia – Schiebold et al., 2018). На основании полученных результатов можно поддержать мнение Селоссе и Мартоса (Selosse, Martos, 2014) о том, что в условиях затенения все изученные наземные орхидеи могут быть ЧМГ, но иногда это может быть не распознано по значениям δ13C из-за сходства δ13C у симбиотических грибов ризоктонии и зеленых растений. Наш метод (сравнение разницы в содержании δ13C между более и менее освещенными растениями в природе) позволил получить доказательства микогетеротрофии всех изученных орхидей. Таким образом, наше исследование предоставило эмпирические доказательства в поддержку точки зрения Штокеля с соавт. (Stöckel et al., 2014, p. 606) о том, что “частичная микогетеротрофия может быть гораздо более широко распространена среди орхидей, чем предполагалось до сих пор”, и дает новое понимание экологического значения микоризных ассоциаций у орхидей.
Список литературы
Абакумова Г.М., Горбаренко Е.В., Незваль Е.И., Шиловцева О.А., 2012. Климатические ресурсы солнечной энергии Московского региона. Москва: URSS. 310 с.
Allen M.F., 1991. The Ecology of Mycorrhizae. Cambridge: Cambridge Univ. Press. 200 p.
Augé R.M., 2001. Water relations, drought and vesicular-arbuscular mycorrhizal symbiosis // Mycorrhiza. V. 11. P. 3–42.
Billings S.A., Richter D.D., 2006. Changes in stable isotopic signatures of soil nitrogen and carbon during 40 years of forest development // Oecologia. V. 148. № 2. P. 325–333.
Bowling D.R., Pataki D.E., Randerson J.T., 2008. Carbon isotopes in terrestrial ecosystem pools and CO2 fluxes // New Phytol. V. 178. № 1. P. 24–40.
Brooks J.R., Flanagan L.B., Buchmann N., Ehleringer J.R., 1997. Carbon isotope composition of boreal plants: Functional grouping of life forms // Oecologia. V. 110. № 3. P. 301–311.
Cernusak L.A., Ubierna N., Winter K., Holtum J.A.M., Marshall J.D., Farquhar G.D., 2013. Environmental and physiological determinants of carbon isotope discrimination in terrestrial plants // New Phytol. V. 200. № 4. P. 950–965.
Dearnaley J.D.W., 2007. Further advances in orchid mycorrhizal research // Mycorrhiza V. 17. P. 475–486.
Dearnaley J.D.W., Martos F., Selosse M.-A., 2012. Orchid mycorrhizas: molecular ecology, physiology, evolution and conservation aspects // Fungal Associations. The Mycota IX / Ed. Hock B. Berlin: Springer Verlag. P. 207–230.
Duursma R., Marshall J., 2006. Vertical canopy gradients in δ13C correspond with leaf nitrogen content in a mixed-species conifer forest // Trees Struct. Funct. V. 20. № 4. P. 496–506.
Gebauer G., Meyer M., 2003. 15N and 13C natural abundance of autotrophic and myco-heterotrophic orchids provides insight into nitrogen and carbon gain from fungal association // New Phytol. V. 160. № 1. P. 209–223.
Gebauer G., Preiss K., Gebauer A.C., 2016. Partial mycoheterotrophy is more widespread among orchids than previously assumed // New Phytol. V. 211. № 1. P. 11–15.
Girlanda M., Segreto R., Cafasso D. et al., 2011. Photosynthetic Mediterranean meadow orchids feature partial mycoheterotrophy and specific mycorrhizal associations // Am. J. Bot. V. 98. № 7. P. 1148–1163.
Hadley G., 1970. Non-specificity of symbiotic infection in orchid mycorrhiza // New Phytol. V. 69. № 4. P. 1015–1023.
Hynson N.A., Madsen T.P., Selosse M.-A., Adam I.K.U., Ogura-Tsujita Y. et al., 2013. The physiological ecology of mycoheterotrophy // Mycoheterotrophy: The Biology of Plants Living on Fungi / Ed. Merckx V.S.F.T. N.-Y.: Springer. P. 297–342.
Julou T., Burghardt B., Gebauer G., Berveiller D., Damesin C., Selosse M.-A., 2005. Mixotrophy in orchids: Insights from a comparative study of green individuals and non-photosynthetic mutants of Cephalanthera damasonium // New Phytol. V. 166. № 2. P. 639–653.
Lallemand F., Figura T., Damesin C., Fresneau C., Griveau C. et al., 2019. Mixotrophic orchids do not use photosynthates for perennial underground organs // New Phytol. V. 221. № 1. P. 12–17.
Leake J.R., 1994. The biology of myco-heterotrophic ('saprophytic') plants // New Phytol. V. 127. № 2. P. 171–216.
Liebel H.T., Bidartondo M.I., Gebauer G., 2015. Are carbon and nitrogen exchange between fungi and the orchid Goodyera repens affected by irradiance? // Ann. Bot. V. 115. № 2. P. 251–261.
Martos F., Dulormne M., Pailler T., Bonfante P., Faccio A. et al., 2009. Independent recruitment of saprotrophic fungi as mycorrhizal partners by tropical achlorophyllous orchids // New Phytol. V. 184. № 3. P. 668–681.
Mayor J.R., Schuur E.A.G., Henkel T.W., 2009. Elucidating the nutritional dynamics of fungi using stable isotopes // Ecol. Lett. V. 12. № 2. P. 171–183.
Merckx V.S.F.T., 2013. Mycoheterotrophy: an introduction // Mycoheterotrophy: The Biology of Plants Living on Fungi / Ed. Merckx V.S.F.T. N.-Y.: Springer. P. 1–17.
Merckx V., Stockel M., Fleischmann A., Bruns T.D., Gebauer G., 2010. 15N and 13C natural abundance of two mycoheterotrophic and a putative partially mycoheterotrophic species associated with arbuscular mycorrhizal fungi // New Phytol. V. 188. № 2. P. 590–596.
Peat H.J., Fitter A.H., 1994. A comparative study of the distribution and density of stomata in the British flora // Biol. J. Linn. Soc. V. 52. № 4. P. 377–393.
Preiss K., Adam I.K.U., Gebauer G., 2010. Irradiance governs exploitation of fungi: Fine-tuning of carbon gain by two partially myco-heterotrophic orchids // Proc. Roy. Soc. Lond. B. Biol. Sci. V. 277. № 1686. P. 1333–1336.
Rasmussen H.N., 1995. Terrestrial Orchids: From Seed to Mycotrophic Plant. Cambridge: Cambridge Univ. Press. 444 p.
Roy M., Gonneau C., Rocheteau A. et al., 2013. Why do mixotrophic plants stay green? A comparison between green and achlorophyllous orchid individuals in situ // Ecol. Monogr. V. 83. № 1. P. 95–117.
Salisbury E.J., 1928. On the causes and ecological significance of stomatal frequency, with special reference to the woodland flora // Philos. Trans. Roy. Soc. Lond. B. V. 216. P. 1–65.
Schiebold J.M.-I., Bidartondo M.I., Lenhard F., Makiola A., Gebauer G., 2018. Exploiting mycorrhizas in broad daylight: Partial mycoheterotrophy is a common nutritional strategy in meadow orchids // J. Ecol. V. 106. № 1. P. 168–178.
Schweiger J.M.-I., Bidartondo M.I., Gebauer G., 2018. Stable isotope signatures of underground seedlings reveal the organic matter gained by adult orchid from mycorrhizal fungi // Funct. Ecol. V. 32. № 4. P. 870–881.
Selosse M.-A., Martos F., 2014. Do chlorophyllous orchids heterotrophically use mycorrhizal fungal carbon? // Trends Plant Sci. V. 19. № 11. P. 683–685.
Selosse M.-A., Roy M., 2009. Green plants that feed on fungi: Facts and questions about mixotrophy // Trends Plant Sci. V. 14. № 2. P. 64–70.
Selosse M.-A., Charpin M., Not F., 2017. Mixotrophy everywhere on land and in water: The grand ecart hypothesis // Ecol. Lett. V. 20. № 2. P. 246–263.
Smith S.E., Read D., 2008. Mycorrhizal Symbiosis. L.: Elsevier. 800 p.
Smith S.E., Facelli E., Pope S., Smith F.A., 2010. Plant performance in stressful environments: Interpreting new and established knowledge of the roles of arbuscular mycorrhizas // Plant Soil. V. 326. № 1. P. 3–20.
Sommer J., Pausch J., Brundrett M.C., Dixon K.W., Bidartondo M.I., Gebauer G., 2012. Limited carbon and mineral nutrient gain from mycorrhizal fungi by adult Australian orchids // Am. J. Bot. V. 99. № 7. P. 1133–1145.
Stöckel M., Tesitelova T., Jersáková J., Bidartondo M.I., Gebauer G., 2014. Carbon and nitrogen gain during the growth of orchid seedlings in nature // New Phytol. V. 202. № 2. P. 606–615.
Suetsugu K., Ohta T., Tayasu I., 2018. Partial mycoheterotrophy in the leafless orchid Cymbidium macrorhizon // Am. J. Bot. V. 105. № 9. P. 1595–1600.
Tedersoo L., Pellet P., Koljalg U., Selosse M.-A., 2007. Parallel evolutionary paths to mycoheterotrophy in understorey Ericaceae and Orchidaceae: Ecological evidence for mixotrophy in Pyroleae // Oecologia. V. 151. № 2. P. 206–217.
Těšitel J., Těšitelová T., Minasiewicz J., Selosse M.-A., 2018. Mixotrophy in land plants: Why to stay green? // Trends Plant Sci. V. 23. № 8. P. 656–659.
Zhou Y., Fan J., Zhang W., Harris W., Zhong H., et al., 2011. Factors influencing altitudal patterns of C3 plant foliar carbon isotope composition of grasslands on the Qinghai-Tibet Plateau, China // Alp. Bot. V. 121. № 2. P. 79–90.
Zhu Y., Siegwolf R.T.W., Durka W., Körner C., 2010. Phylogenetically balanced evidence for structural and carbon isotope responses in plants along elevational gradients // Oecologia. V. 162. № 4. P. 853–863.
Дополнительные материалы отсутствуют.
Инструменты
Журнал общей биологии



