Журнал общей биологии, 2022, T. 83, № 1, стр. 51-61
Морфотипы мух-кровососок (Diptera, Hippoboscidae) по морфологии пульвилл и эмподиев в контексте широты круга хозяев
А. А. Яцук 1, *, А. Ф. Сафонкин 1, А. В. Матюхин 1, Т. А. Триселева 1
1 Институт проблем экологии и эволюции им. А.Н. Северцова РАН
119071 Москва, Ленинский пр., 33, Россия
* E-mail: sasha_djedi@mail.ru
Поступила в редакцию 08.09.2021
После доработки 13.10.2021
Принята к публикации 19.10.2021
- EDN: WKYYGX
- DOI: 10.31857/S0044459622010079
Аннотация
На 13 видах из 7 родов мух-кровососок (Crataerina hirundinis, L., 1758, Hippobosca equina, L., 1758, Icosta ordea, Macquart, 1835, Lipoptena cervi, L., 1758, L. fortisetosa, Maa, 1965, Ornithoica stipeturi, Schinner, 1868, O. turdi, Latreille, 1812, O. unicolor, Speiser, 1900, Ornithomya avicularia, L., 1758, Or. chloropus, Bergroth, 1901, Or. comosa, Austen, 1930, Or. fringillina, Curtis, 1836, Pseudolinhia canariensis, Macquart, 1840) подробно изучена морфология пульвилл и эмподиев, а также их морфометрические показатели: длина, ширина пульвилл, длина и расстояние между щетинками эмподия. Впервые описаны щетинковидные выросты на пульвиллах у исследованных видов, определена высота, толщина и расстояние между ними. Выдвинуто предположение, что пульвиллы позволяют кровососкам прикрепляться к перьям или шерсти хозяина по принципу специфичной для основного хозяина “ленты-липучки”. По морфологии двулопастных крючков на щетинковидных выростах пульвилл выделено четыре морфотипа, по морфологии эмподиев выделено пять морфотипов. Проведено сопоставление морфотипов с широтой круга хозяев. Морфология эмподия характеризует родовой уровень. Широта круга хозяев больше связана с морфологией этой структуры. Наиболее заметные морфологические отличия отмечены между родами кровососок, обитающих на млекопитающих и птицах. Морфология крючков более консервативна. Статистический анализ размерных характеристик пульвилл и эмподиев показал возможность идентификации большинства исследованных видов и родов Hippoboscidae по этим структурам с вероятностью от 65.5 до 100%. Наличие видоспецифичных признаков пульвилл и эмподиев для родов и видов кровососок позволяет классифицировать виды, а морфометрические показатели могут быть использованы при идентификации поврежденных экземпляров.
Представители сем. Hippoboscidae, Samouelle, 1819 – это высокоспециализированные облигатные кровососущие эктопаразиты млекопитающих и птиц, распространенные повсеместно (Досжанов, 1980). В семействе описано 213 видов (Dick, 2006; Obona et al., 2019), разделенных на три подсемейства: Ornithomyinae, Hippoboscinae и Lipopteninae (Maa, Peterson, 1987). Мухи Hippoboscidae имеют серьезное эпидемиологическое значение, так как являются переносчиками многих опасных заболеваний (Bequaert, 1954; Досжанов, 1980) как у млекопитающих (Ganez et al., 2004; Farajollahi et al., 2005), так и у птиц (Хаметова и др., 2018).
Становление паразитизма и гематофагии у этих насекомых связано с трофической специализацией. Предположительно, эволюция питания мух-кровососок шла от копрофагии через факультативную гематофагию к облигатной гематофагии, что сопровождалось возникновением комплекса различных адаптаций к длительному обитанию на покровах хозяина (Балашов, 2005, 2011; Чайка, 2015).
Поскольку мухи-кровососки живут среди шерсти и перьев своих хозяев, в ходе эволюции у них возник механизм надежного прикрепления к подобным покровам, включающий морфологические структуры на лапках: коготки, пульвиллы и эмподий (Досжанов, 1980; Andreani et al., 2020).
Пульвиллы – это мягкие подушечки, позволяющие прикрепляться к покровам хозяина (Досжанов, 1980; Andreani et al., 2020). Они располагаются на склеротизированном щитке и прикреплены к мембранному основанию претарзуса (Досжанов, 2003). У представителей родов Lipoptena, Nitzsch, 1818 (L. cervi, L., 1758 и L. fortisetosa, Maa, 1965) и Hippobosca, L., 1758 (H. equina, L., 1758) пульвиллы и коготки на каждой лапке с одной стороны развиты больше, чем с другой, а у вида Pseudolinhia canariensis, Macquart, 1840 левая и правая пульвиллы похожи по размеру и форме (Andreani et al., 2020).
Эмподии – это длинные непарные выросты, располагающиеся между пульвиллами и покрытые щетинками. Они представляют собой небольшие шпоры, позволяющие захватывать волоски хозяина (Досжанов, 1980; Andreani et al., 2020). По данным литературы, эмподии у P. canariensis покрыты бóльшим количеством щетинок, чем у H. equina, L. cervi и L. fortisetosa (Andreani et al., 2020).
В аспекте связи с хозяином и межвидовых различий по лапкам мух-кровососок подробно изучена только морфология коготков (Andreani et al., 2020).
Настоящая работа посвящена исследованию морфологических отличий пульвилл и эмподиев у представителей сем. Hippoboscidae, различающихся широтой круга хозяев, на видовом и родовом уровнях.
МАТЕРИАЛЫ И МЕТОДЫ
Исследование проведено на самцах 13 видов из 7 родов: Crataerina hirundinis, L., 1758 (5 экз.), Hippobosca equina, L., 1758 (3 экз.), Icosta ordea, Macquart, 1835 (2 экз.), Lipoptena cervi, L., 1758 (2 экз.), L. fortisetosa, Maa, 1965 (2 экз.), Ornithoica stipeturi, Schinner, 1868 (1 экз.), O. turdi, Latreille, 1812 (2 экз.), O. unicolor, Speiser, 1900 (1 экз.), Ornithomya avicularia, L., 1758 (3 экз.), Or. chloropus, Bergroth, 1901 (2 экз.), Or. comosa, Austen, 1930 (2 экз.), Or. fringillina, Curtis, 1836 (2 экз.), Pseudolinhia canariensis, Macquart, 1840 (3 экз.). Идентификация видов произведена по определительному ключу Т.Н. Досжанова (2003).
Фотографии препаратов лапок были получены с использованием оборудования ЦКП “Инструментальные методы в экологии” при ИПЭЭ РАН: установки S150A Sputter Coater (Edwards, UK) с напылением золота в ручном режиме и электронного микроскопа TESCAN MIRA 3 LMH (TESCAN, Czech Republic), оснащенного системой энергодисперсионного анализа AZtecOne X-act (Oxford Instruments, UK) и катодом Шоттки.
При исследовании пульвилл проведены измерения их длины и ширины, высоты, толщины и расстояния между щетинковидными образованиями, располагающимися на них. При исследовании эмподиев измерена длина щетинок, располагающихся на эмподии, и расстояние между ними. Так как у представителей р. Ornithoica щетинки имеют ребристую структуру, дополнительно измерена ширина и расстояние между ребрами. Обсчет размеров произведен по фотографиям.
Статистическая обработка материала проведена с помощью программы Statistica 10 (StatSoft Inc., USA). Были применены следующие анализы: дискриминантный анализ (в качестве показателя уровня вклада переменной в разделительную силу модели используется λp (Partiallambda), в качестве показателя уникальности признака – R2 (1-Toler.)); MANOVA, поскольку основная часть переменных может коррелировать между собой, с апостериорным сравнением средних (post-hoc) тестом Тьюки для неравных N.
РЕЗУЛЬТАТЫ
Предварительные анализы показали отсутствие достоверных различий между особями каждого вида мух. У исследованных экземпляров каждого вида между всеми лапками не выявлено достоверных различий по эмподиям и пульвиллам.
Анализ морфологии лапок мух-кровососок показал различия на уровне видов и родов.
С помощью электронного микроскопа на подушечках пульвилл выявлены щетинковидные выросты, располагающиеся продольными рядами и оканчивающиеся плоскими двулопастными крючками (рис. 1–4). У видов C. hirundinis, I. ordea, O. turdi, O. stipeturi, O. unicolor, Or. avicularia, Or. fringillina, Or. comosa и P. canariensis длинные двулопастные крючки. Их внутренние стороны скругленные (рис. 4в). У Or. chloropus скругленными являются внешние стороны крючков (рис. 4г). У видов H. equina, L. cervi и L. fortisetosa лопасти у крючков короткие (рис. 4а, б). Расположение щетинковидных выростов на пульвиллах у P. canariensis отличается от других родов. Они собраны в пучки по три–пять штук в каждом (рис. 4е).
Рис. 1.
Коготки, пульвиллы, эмподиум мух-кровососок родов Crataerina, Ornithomya и Pseudolinhia. а – Or. avicularia; б – Or. chloropus; в – Or. comosa; г – Or. fringillina; д – P. canariensis; е – C. hirundinis. К – коготь, П – пульвилла, Э – эмподиум (для рис. 1–3). Масштаб: а, б, в, д – 100 мкм, г – 50 мкм, е – 200 мкм.
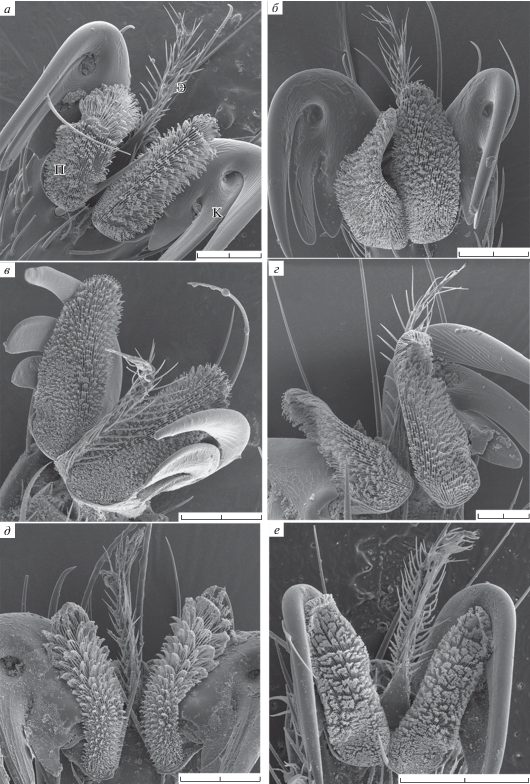
Рис. 2.
Коготки, пульвиллы, эмподиум мух-кровососок р. Ornithoica. а, б – O. turdi; в – O. stipeturi; г – O. unicolor. ПС – поперечные складки. Масштаб: а, в, г – 50 мкм, б – 10 мкм.

Рис. 3.
Коготки, пульвиллы, эмподиум мух-кровососок родов Hippobosca, Icosta и Lipoptena. а – H. equine; б – I. ordea; в – L. cervi; г – L. fortisetosa. Масштаб: а – 200 мкм, б, в – 50 мкм, г – 100 мкм.

Рис. 4.
Щетинковидные выросты с крючками на пульвиллах лапок мух-кровососок. а – H. equine; б – L. fortisetosa; в – Or. avicularia; г – Or. chloropus; д – O. stipeturi; е – P. canariensis. К – крючок, Щ – щетинковидный вырост, ВНЕ – внешняя сторона крючка, ВНУ – внутренняя сторона крючка. Масштаб: 20 мкм.

Поскольку левая и правая пульвиллы у представителей Lipoptena и Hippobosca имеют разную длину, виды этих родов рассматривались отдельно. На основе размерных характеристик данной структуры (табл. 1) дискриминантный анализ позволяет правильно определить виды и роды с вероятностью 100%. При идентификации видов важны длина длинной пульвиллы (λp = 0.97; F = 65.1, p < 0.000, R2 = 0.17), высота щетинковидных выростов (λp = 0.27; F = 19, p < 0.000, R2 = 0.57) и расстояние между ними (λp = 0.56; F = 5.4, p < 0.018, R2 = 0.5), а родов – высота щетинковидных выростов (λp = 0.28; F = 38, p < 0.000, R2 = 0.74) и расстояние между ними (λp = 0.56; F = 11.6, p < 0.004, R2 = 0.67). Анализ MANOVA подтвердил различия между видами (λw = 0.0006; p < 0.000) и родами (λw = 0.134; p < 0.000).
Таблица 1.
Размерные показатели пульвилл у представителей родов Hippobosca и Lipoptena (Хср ± Sхср, мкм)
| Вид (n = число промеров) | Пульвиллы | Щетинковидные выросты | ||||
|---|---|---|---|---|---|---|
| длина | ширина | расстояние между выростами | высота | толщина | ||
| длинные | короткие | |||||
| Hippobosca equina (30) | 324.0 ± 2.5 | 136.0 ± 6.3 | 116.0 ± 25.0 | 2.7 ± 0.4 | 12.8 ± 0.5 | 1.0 ± 0.2 |
| Lipoptena fortisetosa (33) | 193.3 ± 4.6 | 64.6 ± 2.1 | 45.7 ± 5.2 | 2.4 ± 0.8 | 13.7 ± 1.3 | 1.8 ± 0.4 |
| Lipoptena cervi (24) | 295.9 ± 2.9 | 123.9 ± 11.5 | 85.3 ± 5.0 | 3.9 ± 1.2 | 17.5 ± 2.7 | 1.4 ± 0.4 |
На основе размерных характеристик пульвилл (табл. 2) дискриминантный анализ позволяет правильно идентифицировать представителей остальных изученных родов Crataerina, von Olfers, 1816, Icosta, Ornithoica, Ornithomya и Pseudolinhia: вида с вероятностью 98% и рода с вероятностью 94%. При этом важны все показатели, но наиболее значимыми при определении видов являются длина пульвилл (λp = 0.4; F = 551, p < 0.000, R2 = 0.06), толщина щетинковидных выростов (λp = 0.5; F = 21, p < 0.005, R2 = 0.05) и расстояние между ними (λp = 0.58; F = 17, p < 0.000, R2 = 0.07), а при определении родов – длина (λp = 0.31; F = 117.6, p < 0.000, R2 = 0.68) и ширина (λp = 0.51; F = 50, p < 0.000, R2 = 0.68) пульвилл. Анализ MANOVA подтвердил различия между видами (λw = 0.00004; p < 0.000) и родами (λw = 0.0085; p < 0.000).
Таблица 2.
Размерные показатели пульвилл (Хср ± Sхср, мкм)
| Вид (n = число промеров) | Пульвиллы | Щетинковидные выросты | |||
|---|---|---|---|---|---|
| длина | ширина | расстояние между выростами | высота | толщина | |
| Crataerina hirundinis (24) | 131.0 ± 0.9 | 39.5 ± 2.0 | 2.7 ± 0.7 | 16.0 ± 1.5 | 1.0 ± 0.1 |
| Icosta ordea (24) | 142.1 ± 7.0 | 33.0 ± 3.6 | 2.3 ± 0.6 | 9.3 ± 1.8 | 0.9 ± 0.2 |
| Ornithoica stipeturi (24) | 107.9 ± 5.0 | 44.5 ± 6.0 | 2.0 ± 0.5 | 11.2 ± 1.3 | 0.8 ± 0.1 |
| O. turdi (18) | 113.0 ± 3.0 | 40.0 ± 2.0 | 1.4 ± 0.1 | 11.4 ± 1.0 | 1.0 ± 0.3 |
| O. unicolor (18) | 142.8 ± 2.9 | 40.0 ± 2.0 | 2.3 ± 0.5 | 9.0 ± 1.6 | 0.8 ± 0.2 |
| Ornithomya avicularia (24) | 213.0 ± 4.7 | 81.2 ± 4.0 | 2.4 ± 0.3 | 20.0 ± 2.0 | 1.7 ± 0.4 |
| Or. chloropus (24) | 230.5 ± 3.9 | 81.1 ± 5.5 | 2.1 ± 0.4 | 18.6 ± 1.5 | 1.2 ± 0.4 |
| Or. comosa (24) | 229.9 ± 3.0 | 75.8 ± 3.0 | 1.5 ± 0.2 | 14.0 ± 3.5 | 0.8 ± 0.3 |
| Or. fringillina (28) | 171.0 ± 6.0 | 49.9 ± 1.8 | 2.0 ± 0.3 | 16.6 ± 1.1 | 1.2 ± 0.3 |
| Pseudolinhia canariensis (20) | 224.0 ± 1.8 | 50.6 ± 3.0 | 5.4 ± 1.1 | 31.7 ± 3.0 | 1.3 ± 0.3 |
Изучение эмподия показало, что у видов C. hirundinis, O. stipeturi, O. turdi, O. unicolor, Or. avicularia, Or. chloropus, Or. comosa, Or. fringillina, P. canariensis эмподий покрыт продольными рядами одинаковых длинных щетинок (рис. 1, 2).
На основе размерных характеристик щетинок эмподиев (табл. 3) дискриминантный анализ позволяет правильно определить эти виды с вероятностью 81% и роды с вероятностью 65.5%. Плохо идентифицировались виды Or. comosa (67%), O. unicolor (67%), O. turdi (20%) и р. Pseudolinhia, Bequaert, 1926 (0%). При определении видов и родов важен как размер щетинок (λp = 0.029; F = 188, p < 0.000, R2 = 0.019 и λp = 0.47; F = 19, p < 0.000, R2 = 0.26 соответственно), так и расстояние между ними (λp = 0.1; F = 49, p < 0.000, R2 = 0.019 и λp = 0.74; F = 6, p < 0.001, R2 = 0.26). Анализ MANOVA подтвердил значимые различия между видами (λw = 0.002; p < 0.000) и родами (λw = 0.34; p < 0.000). У вида O. turdi ни по одному из показателей не было значимых отличий от Or. fringillina, а у Or. comosa – от Or. chloropus. Длина щетинок у O. unicolor совпадает с Or. fringillina. У р. Pseudolinhia по данным морфометрическим показателям не выявлено значимых различий с р. Ornithomya, Latreille, 1802.
Таблица 3.
Размерные показатели щетинок эмподиев (Хср ± Sхср, мкм)
| Вид (n = число промеров) | Длина щетинок | Расстояние между щетинками |
|---|---|---|
| Crataerina hirundinis (104) | 53.0 ± 1.4 | 7.7 ± 1.2 |
| Pseudolinhia canariensis (144) | 56.0 ± 2.4 | 13.2 ± 0.7 |
| Ornithomya avicularia (120) | 62.9 ± 1.7 | 19.8 ± 1.6 |
| Or. chloropus (94) | 55.2 ± 3.98 | 10.35 ± 1 |
| Or. comosa (64) | 52.4 ± 1.5 | 12.2 ± 1.5 |
| Or. fringillina (102) | 31.0 ± 1.9 | 11.4 ± 1 |
| Ornithoica stipeturi (54) | 23.95 ± 1.5 | 7.4 ± 0.4 |
| O. turdi (100) | 30.7 ± 2.3 | 10.9 ± 0.6 |
| O. unicolor (60) | 30.6 ± 2.4 | 13.75 ± 1 |
У представителей р. Ornithoica, Rondani, 1878 на эмподии кроме щетинок имеются поперечные складки (рис. 2б), а сами щетинки имеют ребристую поверхность. На основе размерных характеристик поперечных складок (табл. 4) дискриминантный анализ позволяет правильно определить виды с вероятностью 100%. При этом важны как ширина складок (λp = 0.85; F = 48, p < 0.000, R2 = 0.68), так и расстояние между ними (λp = 0.107, F = 36, p < 0.000, R2 = 0.68). Анализ MANOVA подтвердил различия между видами (λw = 0.0117; p < 0.000).
Таблица 4.
Размерные показатели поперечных складок на эмподиях у представителей Ornithoica (Хср ± Sхср, мкм)
| Вид (n = число промеров) | Ширина поперечных складок | Расстояние между поперечными складками |
|---|---|---|
| O. turdi (60) | 30.2 ± 4 | 55.2 ± 12.8 |
| O. stipeturi (58) | 3.0 ± 0.3 | 3.75 ± 0.5 |
| O. unicolor (61) | 9.2 ± 1.99 | 12.6 ± 1.99 |
Щетинки на эмподии у представителей Icosta, Speiser, 1905 могут быть разделены на короткие и длинные (рис. 3б). У представителей Lipoptena в базальной части эмподия расположены длинные щетинки, а в апикальной части – короткие треугольные щетинки, плотно прилегающие к поверхности эмподия (рис. 3в, г). У H. equina эмподии имеет сплющенную форму. Краевые щетинки эмподия длинные, стоящие торчком, щетинки, располагающиеся в центре, – короткие, прилегающие к поверхности (рис. 3а).
На основе размерных характеристик данной структуры (табл. 5) дискриминантный анализ позволяет правильно различить эти виды и три рода с вероятностью 100%. При определении видов и родов важны все показатели: размер длинных щетинок (λp = 0.06; F = 116.5, p < 0.000, R2 = 0.23 и λp = 0.07; F = 153, p < 0.000, R2 = 0.12 соответственно), расстояние между ними (λp = 0.27; F = 20, p < 0.002, R2 = 0.13 и λp = 0.5; F = 12, p < 0.000, R2 = 0.76), размер коротких щетинок (λp = 0.57; F = 5, p < 0.004, R2 = 0.1 и λp = 0.7; F = 4.7, p < 0.019, R2 = 0.19) и расстояние между ними (λp = 0.18; F = 34, p < 0.000, R2 = 0.23 и λp = 0.3; F = 26.6, p < 0.000, R2 = 0.78). Анализ MANOVA подтвердил наличие значимых различий между видами (λw = 0.00019; p < 0.000) и родами (λw = 0.0028; p < 0.000).
Таблица 5.
Размерные показатели щетинок эмподиев (Хср ± Sхср, мкм)
| Вид (n = число промеров) | Длина длинных щетинок | Расстояние между длинными щетинками | Длина коротких щетинок | Расстояние между короткими щетинками |
|---|---|---|---|---|
| Hippobosca equina (130) | 30.0 ± 1.5 | 9.6 ± 0.8 | 6.6 ± 1.5 | 6.0 ± 1.8 |
| Icosta ordea (102) | 38.9 ± 1.99 | 20.8 ± 2 | 13.3 ± 0.96 | 5.6 ± 0.8 |
| Lipoptena fortisetosa (133) | 18.5 ± 1.4 | 14.3 ± 1 | 11.5 ± 0.92 | 11.8 ± 0.9 |
| Lipoptena cervi (120) | 19.0 ± 1.5 | 7.3 ± 1 | 9.8 ± 1.3 | 18.3 ± 1.5 |
ОБСУЖДЕНИЕ
Способ прикрепления мух-кровососок к покровам своего хозяина определяется морфологией лапок. Коготки представляют собой структуру для первичного прикрепления к покровам, а для более прочного сцепления с ними служат пульвиллы. Ранее на примере C. pallida Latreille, 1812 было показано, что бороздки на коготках вместе с работой коготков по принципу зажимов создают огромную силу трения. Щетинковидные выросты с двулопастными крючками ориентированы по-разному в зависимости от их местоположения на пульвилле. Было показано, что такая сложная система позволяет мухе спокойно перемещаться не только в покровах хозяина, но и по другим субстратам. Несмотря на то, что эмподий имеет удлиненные щетинки и мог бы работать как аналог коготков, было высказано предположение, что эмподий имеет функцию очищения коготков и возвращения двулопастных крючков в состояние готовности к прикреплению, а основным механизмом прикрепления к покровам хозяина являются коготки (Petersen et al., 2018).
Результаты наших исследований показали, что пульвиллы всех исследованных видов снабжены щетинковидными выростами, на конце которых располагаются двулопастные крючки, различающиеся по морфологии. Мы предполагаем, что пульвиллы позволяют кровососкам прикрепляться к перьям или шерсти хозяина с помощью этих крючков по принципу специфичной для основного хозяина “ленты-липучки”, а эмподии, которые также имеют специфичную морфологию, в свою очередь, дополнительно захватывают волоски на теле хозяина.
Известно, что у других групп мух прикрепительный аппарат также включает в себя когти, пульвиллы и эмподии, однако морфология этих структур имеет отличия от кровососок. Так, у Tabanidae эмподий имеет вид еще одной подушечки-пульвиллы (Chainey, 1993). Это может говорить о том, что именно пульвиллы являются у мух основной структурой для прикрепления к субстратам. При этом эмподий напрямую участвует в процессе прикрепления и не несет функцию очищения когтей и пульвилл. Щетинковидные выросты на пульвиллах у представителей Muscidae (Niederegger, Gorb, 2003), Calliphoridae (Gorb et al., 2012) и Syrphidae (Gorb et al., 2001) оканчиваются плоскими пластинами-присосками, на которых выделяется адгезирующее вещество, позволяющее мухам передвигаться по любым поверхностям. Плотность расположения щетинок на пульвиллах у разных видов может различаться. Например, у Syrphidae это связано с размерами особей (Gorb et al., 2001). Когти, имеющие более простую форму, нежели когти кровососок, как показано в работе по Muscidae (Niederegger, Gorb, 2003), используются не только для сцепления с макроскопическими неровностями субстратов, но в некоторых случаях и для отсоединения пульвилл от поверхностей. На фотографиях, приведенных в той же работе, эмподий не имеет длинных щетинок. Таким образом, у мух прослеживается специализация пульвилл и эмподиев под особенности среды обитания.
На основе морфологии двулопастных крючков щетинковидных выростов пульвилл исследованные нами виды кровососок были разделены на четыре морфотипа:
1) Крючки длинные со скругленными внутренними сторонами: C. hirundinis, I. ordea, O. turdi, O. stipeturi, O. unicolor, Or. avicularia, Or. fringillina и Or. comosa;
2) Крючки длинные со скругленными внешними сторонами: Or. chloropus;
3) Крючки длинные со скругленными внутренними сторонами, щетинковидные образования собраны в пучки: P. canariensis;
4) Крючки с короткими лопастями: H. equina, L. cervi и L. fortisetosa.
По морфологии эмподиев у исследованных видов кровососок можно выделить пять морфотипов:
1) Эмподий покрыт длинными одинаковыми щетинками: представители родов Crataerina, Ornithomya и Pseudolinhia;
2) Эмподий покрыт длинными одинаковыми щетинками и поперечными складками, вероятно обеспечивающими дополнительные возможности для прикрепления: р. Ornithoica;
3) Щетинки базальной и апикальной частей эмподия различаются по морфологии и длине: р. Lipoptena;
4) На эмподиях есть как короткие, так и длинные щетинки, расположенные вперемешку: I. ordea;
5) На эмподиях существуют краевые и центральные зоны, щетинки на которых имеют разную морфологию и длину: H. equina.
Статистический анализ размерных характеристик морфологических структур пульвилл и эмподиев показал, что, основываясь на них, можно идентифицировать большинство исследованных видов и родов Hippoboscidae.
Одним из наиболее значимых показателей при разделении видов, наравне с размерами щетинковидных выростов и расстоянием между ними, является длина самих пульвилл. То же касается и родов.
При идентификации видов и родов по размерным характеристикам структур эмподия важны все показатели. При этом для р. Ornithoica одними из главных показателей при разделении видов являются размеры поперечных складок. Наиболее хорошо размерные показатели щетинок работают при определении видов из Crataerina, Icosta, Lipoptena и Hippobosca и самих родов.
Известно, что первые насекомые, паразитирующие в шерстяных и перьевых покровах хозяев, появились еще в меловом периоде (Gao et al., 2019). Среди современных насекомых, живущих внутри шерсти и перьев хозяина, наиболее известны блохи (Siphonaptera Latreille, 1825) и вши (Anoplura Leach, 1815). В отряде блох, в основном паразитирующих на млекопитающих, реже специализирующихся на птицах, преобладают виды, способные паразитировать на нескольких видах-хозяевах. Адаптации блох для жизни среди шерстяного и перьевого покровов включают как общую морфологию тела, так и хорошо развитые коготки на лапках и щетинки, позволяющие им прикрепляться к покровам. Число и размер этих щетинок изменяется в зависимости от типа хозяина (норные млекопитающие, млекопитающие без постоянных убежищ, особо подвижные (в том числе хищные) млекопитающие, птицы, морские птицы). На основе морфотипов по перечисленному комплексу признаков было выделено шесть групп блох, соответствующих типам их хозяев (Medvedev, 2017).
Аналогичная биологическая значимость элементов прикрепительного аппарата, позволяющая классифицировать виды, выявлена нами для мух-кровососок.
В табл. 6 приведены данные по видам кровососок, выделенным нами морфотипам и данные по видам их хозяев согласно работам Т.Н. Досжанова (2003), А.В. Матюхина и С.И. Гашкова (2020). Как видно из таблицы, морфология эмподия характеризует родовой уровень. Широта круга хозяев больше связана с морфологией именно этой структуры. Наиболее заметные морфологические отличия отмечены между родами кровососок, обитающих только на птицах, и родами, имеющими широкий круг хозяев.
Таблица 6.
Морфотипы кровососок по отношению к кругу хозяев
| Вид мух | Виды хозяев | Морфотипы | |
|---|---|---|---|
| эмподий | пульвиллы | ||
| Crataerina hirundinis | Ласточки | 1 | 1 |
| Hippobosca equina | Очень широкий круг хозяев: лошади, верблюды, свиньи, кролики, сыч, дятел, коршун, голубь и т.д. | 5 | 4 |
| Icosta ordea | Цаплевые | 4 | 1 |
| Lipoptena cervi | Копытные, иногда птицы | 3 | 4 |
| L. fortisetosa | Копытные, иногда птицы | 3 | 4 |
| Ornithoica stipeturi | Очень широкий круг хозяев-птиц | 2 | 1 |
| O. turdi | Соколообразные, курообразные, голубеобразные, кукушкообразные, совообразные, козодоеобразные, ракшеобразные, дятлообразные, воробьинообразные | 2 | 1 |
| O. unicolor | Соколообразные, голубеобразные, воробьинообразные. Предпочитает совообразных | 2 | 1 |
| Ornithomya avicularia | Крупные птицы: ворона, грач, лунь | 1 | 1 |
| Or. chloropus | Воробьинообразные | 1 | 2 |
| Or. comosa | Ласточки | 1 | 1 |
| Or. fringillina | Воробьинообразные | 1 | 1 |
| Pseudolinhia canariensis | Голубеобразные | 1 | 3 |
Морфология крючков щетинковидных выростов пульвилл более консервативна, поскольку половина исследованных видов имеет длинные крючки со скругленными внутренними сторонами. Некоторый уровень специализации выявлен для Or. chloropus.
Род Hippobosca имеет наиболее широкий круг хозяев, что, возможно, связано с морфологией эмподиев, отличной от других родов. Особая морфология крючков на пульвиллах позволяет H. equina, а также представителям р. Lipoptena (L. cervi и L. fortisetosa) прикрепляться к шерсти млекопитающих и паразитировать на них.
Представители р. Ornithoica, связанные с очень широким кругом хозяев, имеют на эмподиях дополнительные поперечные складки.
Более простое устройство эмподиев у представителей родов Crataerina, Ornithomya и Pseudolinhia предположительно связано с небольшим кругом их хозяев. Узкоспециализированные виды P. canariensis (паразитирующие на голубеобразных) и Or. chloropus (на воробьинообразных) имеют, кроме того, небольшие отличия от прочих видов по морфологии крючков пульвилл. Однако для Or. fringillina, предпочитающих тех же хозяев из отряда воробьинообразных, таких морфологических особенностей не обнаружено. Также не отмечено морфологической специализации для паразитирования на ласточках у Or. comosa и C. hirundinis.
Отсутствие статистических различий размерных характеристик щетинок на эмподиях между несколькими видами и родами может быть связано не столько с совпадением видов-хозяев, сколько со слабой изменчивостью данных морфологических структур. Так, хотя виды Or. comosa и Or. chloropus предпочитают разных основных хозяев, морфология их эмподиев совпадает, а морфология крючков на щетинковидных выростах пульвилл имеет лишь небольшие различия.
ЗАКЛЮЧЕНИЕ
Выявленные специфичные признаки по строению пульвилл и эмподиев для родов и видов кровососок, в том числе подробно описанные щетинковидные выросты на пульвиллах и поперечные складки на эмподиях, позволяют выделить морфотипы мух-кровососок по структурным элементам лапок. Результаты настоящей работы, как и в случае с изучением строения лапок блох, свидетельствуют о биологической значимости изучаемых структур, связанных с развитием связей “паразит–хозяин”. Использование морфометрических показателей может существенно облегчить работу при идентификации поврежденных экземпляров.
Список литературы
Балашов Ю.С., 2005. Экологические ниши эктопаразитов // Паразитология. Т. 39. № 6. С. 441–454.
Балашов Ю.С., 2011. Паразитизм и экологическая паразитология // Паразитология. Т. 45. № 2. С. 81–93.
Досжанов Т.Н., 1980. Мухи-кровососки (Diptera, Hippoboscidae) Казахстана. Алма-Ата: Наука КазССР. 280 с.
Досжанов Т.Н., 2003. Мухи-кровососки (Diptera, Hippoboscidae) Палеарктики. Алматы: КазгосИНТИ. 277 с.
Матюхин А.В., Гашков С.И., 2020. Первые сведения о мухах кровососках (Diptera, Hippoboscidae) Томска // XI Всероссийский диптерологический симпозиум (с международным участием), Воронеж, 24–29 августа 2020 г. / Отв. ред. Овчинникова О.Г., Шамшев И.В. СПб.: ЛЕМА. С. 132–134.
Хаметова А.П., Пичурина Н.Л., Забашта М.В., Романова Л.В., Орехов И.В. и др., 2018. Биоценотическая структура природного очага иксодового клещевого боррелиоза в Ростовской области // Мед. паразитол. и паразит. болезни. № 4. С. 33–39.
Чайка С.Ю., 2015. Значение трофической специализации членистоногих в эволюции возбудителей инфекционных заболеваний // Евразийский союз ученых. Т. 2. № 11. С. 70–72.
Andreani A., Sacchetti P., Belcari A., 2020. Evolutionary adaptations in four hippoboscid fly species belonging to three different subfamilies // Med. Vet. Entomol. V. 34. № 3. P. 344–363.
Bequaert J.C., 1954. The Hippoboscidae or louse-flies (Diptera) of mammals and birds. Part II. Taxonomy, evolution and revision of America genera and species // Entomol. Am. V. 34. P. 1–232.
Chainey J.E., 1993. Horse-flies, deer-flies and clegs (Tabanidae) // Medical Insects and Arachnids / Eds Lane R.P., Crosskey R.W. Dordrecht: Springer. P. 310–332.
Dick C.W., 2006. Checklist of world Hippoboscidae (Diptera: Hippoboscoidea). Department of Zoology, Field Museum of Natural History, Chicago. https://www.researchgate.net/publication/322578992
Farajollahi A., Crans V.J., Nickerson D., Bryant P., Wolf B., et al., 2005. Detection of West Nile virus RNA from the louse fly Icosta americana (Diptera: Hippoboscidae) // J. Am. Mosq. Control Assoc. V. 21. № 4. P. 474–476.
Ganez A.Y., Baker I.K., Lindsay R., Dibernardo A., McKeever K., Hunter B., 2004. West Nile virus outbreak in North American owls, Ontario, 2002 // Emerg. Infect. Dis. V. 10. № 12. P. 2135–2142.
Gao T., Yin X., Shih C., Rasnitsyn A.P., Xu X. et al., 2019. New insects feeding on dinosaur feathers in mid-Cretaceous amber // Nat. Commun. V. 10. https://doi.org/10.1038/s41467-019-13516-4
Gorb S., Gorb E., Kastner V., 2001. Scale effects on the attachment pads and friction forces in syrphid flies (Diptera, Syrphidae) // J. Exp. Biol. V. 204. P. 1421–1431.
Gorb S.N., Schuppert J., Walther P., Schwarz H., 2012. Contact behaviour of setal tips in the hairy attachment system of the fly Calliphora vicina (Diptera, Calliphoridae): a cryo-SEM approach // Zoology. V. 115. P. 142–150.
Maa T.C., Peterson B.V., 1987. Hippoboscidae // Manual of Nearctic Diptera. V. 2 / Eds McAlphine J.F., Peterson B.V., Shewell G.E., et al. Ottawa: Research Branch, Agriculture Canada. P. 1271–1281.
Medvedev S., 2017. Adaptations of fleas (Siphonaptera) to parasitism // Entomol. Rev. V. 97. P. 1023–1030.
Niederegger S., Gorb S., 2003. Tarsal movements in flies during leg attachment and detachment on a smooth substrate // J. Insect Physiol. V. 49. P. 611–620.
Obona J., Sychra O., Greš S., Heřman P., Manko P. et al., 2019. A revised annotated checklist of louse flies (Diptera, Hippoboscidae) from Slovakia // ZooKeys. V. 862. P. 129–152.
Petersen D.S., Kreuter N., Heepe L., Büsse S., Wellbrock A.H.J. et al., 2018. Holding tight to feathers – structural specializations and attachment properties of the avian ectoparasite Crataerina pallida (Diptera, Hippoboscidae) // J. Exp. Biol. V. 221. https://doi.org/10.1242/jeb.179242
Дополнительные материалы отсутствуют.
Инструменты
Журнал общей биологии


