Журнал общей биологии, 2022, T. 83, № 6, стр. 450-461
К природе развития естественных эндогенных гипоксических состояний у водных организмов
А. А. Солдатов *
Институт биологии южных морей им. А.О. Ковалевского РАН
299011 Севастополь, просп. Нахимова, 2, Россия
* E-mail: alekssoldatov@yandex.ru
Поступила в редакцию 17.08.2022
После доработки 21.10.2022
Принята к публикации 11.11.2022
- EDN: KKDIXU
- DOI: 10.31857/S0044459622060070
Аннотация
Рассматриваются эндогенные формы гипоксических состояний, отражающих специфику организации систем кислородного обеспечения у водных организмов, которые не свойственны наземным формам жизни. Они включают респираторный, циркуляторный и гемический компоненты. Анализируются исключительно естественные процессы, которые приводят к развитию ряда критических состояний на протяжении жизненного цикла гидробионтов, а также при адаптации к факторам водной среды (гипоксии, гипотермии, гиперосмии). Токсические эффекты, патологии и заболевания не учитываются. Описана группа процессов, приводящая к развитию артериальной гипоксемии, которая реализуется на уровне респираторных поверхностей (вентиляционная и парехиматозная гипоксия). Рассмотрены причины, ответственные за нарушение процессов микроциркуляции на тканевом уровне (ишемическая и застойная гипоксия). Определены механизмы, приводящие к периодическому понижению концентрации гемоглобина в крови (анемия), росту содержания метгемоглобина и изменению кинетических характеристик связывания кислорода кровью. Рассмотренные состояния не следует расценивать как аномальные, так как они отражают группу процессов, которые реализуются в организме гидробионтов в течение его жизнедеятельности.
Под гипоксическими состояниями понимают особый относительно устойчивый во времени комплекс физиологических и метаболических процессов, позволяющий организму определенный период времени существовать в условиях острой нехватки кислорода (Колчинская, 1991). Эти состояния особо актуальны для обитателей водной среды. Диффузия кислорода здесь протекает почти в 10 000 раз менее эффективно, чем на воздухе (Joyce, 2000). Не случайно В.И. Вернадский писал: “Борьба за существование в водных экосистемах – это, прежде всего, борьба за кислород!” (по: Кляшторин, 1982). Гипоксические зоны (oxygen-minimum zones, OMZ) широко представлены в водах Мирового океана (Levin, 2002; Middelburg, Levin, 2009; Gewin, 2010). Это придонные слои шельфа Северо-Западной и Юго-Западной Африки (Атлантический океан) (Duncombe-Rae et al., 2000; Karstensen et al., 2008), Персидского залива, шельфа Аравийского моря, Бенгальского залива и Андаманского моря (Индийский океан) (Paulmier, Ruiz-Pino, 2009; Banse et al., 2014). Особенно широкое распространение получили гипоксические акватории в Тихом океане. Они захватывают более 25% его шельфа (Karstensen et al., 2008; Paulmier, Ruiz-Pino, 2009). В массе эти зоны расположены на глубинах 400–1500 м, реже – 150–300 м (Karstensen et al., 2008; Paulmier, Ruiz-Pino, 2009). Концентрация кислорода в них не превышает 1.5 мгО2 л–1 (в среднем 0.5 мгО2 л–1) (Levin, 2002; Banse et al., 2014), при норме 7–8 мгО2 л–1. Для них характерно сочетанное действие острой гипоксии, гипербарии и гипотермии (Солдатов, 2019).
Гипоксические акватории широко представлены также в водах Черного и Балтийского морей. В первом случае они в основном являются следствием сероводородного заражения глубинных слоев воды (более 100–150 м), но могут развиваться и в шельфовой зоне (Дунай-Днестровский регион) в результате процессов эвтрофикации и апвеллинга (Орехова, Коновалов, 2018). Эвтрофирование глубинных слоев воды также является причиной развития гипоксии в Балтийском море. В последнее время они захватывают площадь около 49 000 км2, а содержание кислорода в них не превышает 2 мгО2 л–1 (Zillén et al., 2008).
Принято считать, что первичноводные формы жизни начинают ощущать дефицит кислорода при его концентрации менее 2 мгО2 л–1 (Rosenberg et al., 2001). Однако это справедливо в основном для бентосных организмов, обитающих в придонных слоях воды. У оксифильных видов (пелагические формы), не сталкивающихся с гипоксическими условиями среды, эти значения обычно выше (3–4 мгО2 л–1) (Vaquer-Sunyer, Duarte, 2008). Существование организмов в условиях дефицита кислорода сопровождается развитием комплекса процессов, направленных на оптимизацию кислородного режима тканей и переход к суббазальным скоростям метаболизма (Hochachka, Somero, 2002). Многие из них приспособились к существованию в условиях длительной аноксии (Fenchel, Finlay, 1995; Stoeck et al., 2003). В их тканях реализуются весьма эффективные метаболические схемы анаэробной генерации энергии (Bidinotto et al., 1997; Lutz, Nilsson, 1997; Chew et al., 2005; Bickler, Buck, 2007). К ним можно отнести прежде всего представителей типа Mollusca и класса Priapulida (Андреенко, 2014). Наиболее радикальные изменения отмечены в клеточных системах лорицифер: вместо митохондрий в них обнаружены гидрогеносомы (Danovaro et al., 2010).
Специфика физико-химических условий водной среды, а также особенности функциональной организации первичноводных организмов позволили пересмотреть классификацию гипоксических состояний, принятую в отношении наземных форм жизни (Soldatov, 2012). Это коснулось, прежде всего, экзогенных форм гипоксии. Для водной среды актуальными принято считать следующие процессы, приводящие к развитию внешнего дефицита кислорода: ограничение водообмена, эвтрофикация, гипертермия и гиперосмия (Soldatov, 2012). Последние два фактора имеют значение преимущественно для мелководных водоемов. При этом первичные формы гипоксии (тканевая гипоксия) в отношении водных и наземных организмов не были пересмотрены: дефицит субстратов окисления, недостаточность окисления, нарушение окисления, разобщение окисления и фосфорилирования (Soldatov, 2012).
В настоящей работе рассматриваются новые эндогенные формы гипоксических состояний, отражающих специфику организации респираторных, циркуляционных и гемических систем у водных организмов, которые не свойственны наземным формам жизни.
ЭНДОГЕННЫЕ ФОРМЫ ГИПОКСИИ
Эндогенные формы гипоксии могут развиваться в отсутствии внешнего дефицита кислорода и при полноценном функционировании дыхательной цепи митохондрий клеток. Поэтому их относят к вторичной группе гипоксических состояний (Колчинская, 1991; Soldatov, 2012). Они обычно сопровождаются понижением артериального напряжения кислорода (артериальная гипоксемия), ограничением величин массопереноса кислорода к тканям либо одновременным сочетанием обоих процессов. Данные формы гипоксии включают респираторный, циркуляторный и гемический компоненты. В дальнейшем предполагается рассмотреть исключительно группу естественных процессов, протекающих в организме гидробионтов и приводящих к развитию у них гипоксических состояний. Токсические эффекты, патологии и заболевания учитываться не будут.
РЕСПИРАТОРНЫЕ ФОРМЫ ГИПОКСИИ
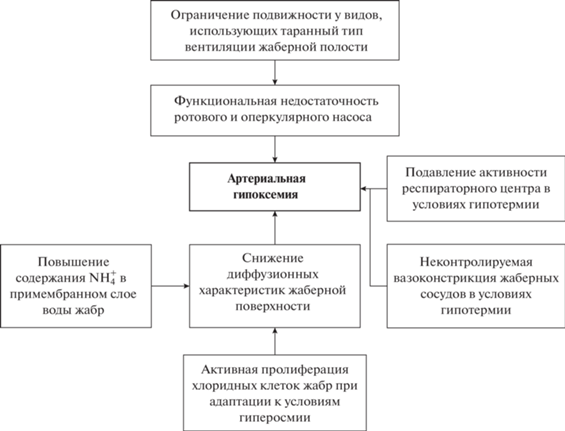
Данный вид гипоксических состояний развивается вследствие функциональной недостаточности респираторной системы. Он включает в основном две составляющие: вентиляционную и паренхиматозную.
Вентиляционная гипоксия связана с ограничением дыхательных объемов и сопровождается развитием артериальной гипоксемии. Это возможно в случае подавления функциональной активности респираторного центра. У рыб данное состояние часто наблюдается в условиях температурного шока, особенно холодового (Azuma et al., 1998; Maricondi-Massari et al., 1998). В естественных условиях оно может возникать при подъеме глубинных вод (апвеллинг) и затрагивать преимущественно представителей донных сообществ. Показано, что низкие температуры повышают число гипоксических зон в тканевых структурах костистых рыб (Солдатов, Парфенова, 2011).
В ряде случаев артериальная гипоксемия развивается на фоне увеличения вентиляции жаберных полостей. Это может быть либо следствием функциональной недостаточности дыхательных движений, либо понижением диффузионных характеристик водно-гематического барьера. Подобная ситуация была отмечена в условиях гипертермии (Fernandes et al., 1995; Glass, Soncini, 1995; Soncini, Glass, 1997). Чаще всего она встречается в мелководных хорошо прогреваемых водоемах и водоемах-охладителях ТЭС и АЭС.
К вентиляционным формам гипоксии следует отнести и состояние гиподинамии в отношении высокоподвижных представителей ихтиофауны. Ограничение подвижности снижает роль таранного типа вентиляции жаберной полости, который в той или иной степени используют подвижные виды рыб (Кляшторин, 1982). Это существенно повышает энергетическую стоимость дыхания. Ограничение подвижности делает работу жаберного насоса менее эффективной. Следствием этого должно быть снижение артериального напряжения кислорода. Данное состояние было зарегистрировано у тунцов, различных видов акул и скумбрий при их искусственном содержании (Perry, McDonald, 1993; Bushnell, Jones, 1994). Оно было отмечено и при садковом выращивании кефали-пиленгаса (Солдатов, Парфенова, 2009).
Паренхиматозная гипоксия определяется негативными изменениями характера диффузии кислорода на уровне водно-гематического барьера. Следствием этих процессов также является развитие артериальной гипоксемии. Водно-гематический барьер у гидробионтов включает три составляющие (Hills, Hughes, 1970): жаберную мембрану с примыкающим к ней неподвижным слоем воды и эндотелий капиллярной стенки. Структура водно-гематического барьера достаточно подробно описана для костистых рыб. Толщина жаберной мембраны у них варьирует в достаточно широких пределах 0.6–2.5 мкм (Hughes, Morgan, 1973; Bushnell, Jones, 1994). При этом максимальных значений она достигает у донных рыб. У пелагических рыб она существенно ниже, что определяется высокими кислородными потребностями их организма. Отмечены и возрастные изменения толщины жаберной мембраны в сторону увеличения, что должно осложнять диффузионные процессы (Dube, Datta-Munshi, 1974). Капиллярная стенка образована одним слоем эндотелиальных клеток и имеет толщину 0.04–0.05 мкм у костистых рыб и 0.1–0.5 мкм у круглоротых (Jasinski, 1973; Potter et al., 1995). Диффузионный слой воды, примыкающий к жаберной мембране, имеет непостоянную толщину, которая напрямую зависит от интенсивности вентиляции жаберной полости. Газообмен на уровне респираторных поверхностей в целом определяется их площадью, поперечным сечением, а также рядом переменных: интенсивностью жаберного кровотока, газотранспортными свойствами крови и химическим составом водно-гематического барьера (Soldatov, 2012).
Как уже отмечалось, поперечное сечение жаберной мембраны у донных видов рыб выше, чем у пелагических (Hughes, Morgan, 1973; Bushnell, Jones, 1994). Площадь респираторной поверхности, вентиляционные объемы, жаберный кровоток, напротив, ниже (Кляшторин, 1982). Это определяет более низкое напряжение кислорода в артериальной крови и тканевых структурах, а также повышенное сродство гемоглобина к кислороду у представителей донной ихтиофауны (Soldatov, 1997; Солдатов, 2018). Фактически организм данной экологической группы рыб адаптирован к функционированию в режиме гипоксического состояния. Оно позволяет ему существовать в придонных слоях воды, для которых в большинстве случаев характерно отсутствие активного перемешивания и, как следствие, низкая концентрация кислорода (Paulmier, Ruiz-Pino, 2009).
Жаберные поверхности у гидробионтов наряду с респираторной выполняют и ряд других сопутствующих функций, которые могут косвенно влиять на процессы газообмена. К ним можно отнести участие в регуляции водно-солевого и кислотно-щелочного баланса. Это обеспечивается присутствием в эпителии жабр хлоридных клеток, осуществляющих транспорт Ca2+ и Cl– (Perry, McDonald, 1993; Perry, 1997). Роль этих образований существенно повышается в период адаптаций организма к условиям повышенной солености. Отмечается активная пролиферация хлоридных клеток и рост их числа в жаберном эпителии. Толщина последнего при этом существенно повышается, что совпадает со снижением напряжения кислорода в артериальной крови (Bindon et al., 1994; Gilmour et al., 1995).
Гидробионты относятся к группе организмов, которые в качестве конечных продуктов белкового обмена экскретируют в воду ${\text{NH}}_{4}^{ + }$ в основном на уровне респираторных поверхностей (Wilkie, 2002; Henry et al., 2012). При ограничении вентиляционных объемов данное соединение может накапливаться в примыкающем к жаберной мембране водном слое и приводить к развитию локального ацидоза. Это может иметь несколько негативных следствий: снижать диффузию кислорода (Wilson et al., 1994) и уменьшать сродство гемоглобина к нему (Souza, Bonilla-Rodriguez, 2007). И то, и другое способствует развитию артериальной гипоксемии и переводит организм в режим гипоксического состояния. На рис. 1 представлена обобщенная схема рассмотренной выше информации.
ЦИРКУЛЯЦИОННАЯ ГИПОКСИЯ
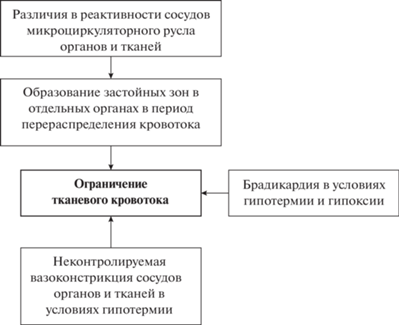
Данный вид гипоксического состояния предполагает ограничение величины объемного тканевого кровотока, которое не удовлетворяет действующий кислородный запрос тканей (Колчинская, 1991; Soldatov, 2012). В основе его могут лежать изменение тонуса гладкомышечной стенки сосуда (ишемическая гипоксия), реакции перераспределения крови и понижение функциональных кондиций миокарды сердца (застойная гипоксия).
Случаи естественной ишемической гипоксии отмечаются у гидробионтов в основном при адаптации к низким температурам (Soivio, Tuurala, 1981). Эффект затрагивает в основном сосуды жаберного аппарата и выражается в неконтролируемой вазоконстрикции их сосудистой стенки. Это ограничивает объемный кровоток в данном органе и сопровождается развитием артериальной гипоксемии. Аналогичные изменения отмечаются и при повышении концентрации ${\text{NH}}_{4}^{ + }$ в примембранном слое воды жабр, что приводит к развитию локального ацидоза (Sundin, Nilsson, 2000). Рост этот может происходить вследствие ограничения вентиляционных объемов, о чем говорилось выше (Wilkie, 2002; Henry et al., 2012).
Сходные изменения были отмечены в скелетных мышцах ряда теплолюбивых видов рыб (кефаль-сингиль, хамса) в условиях экспериментальной гипотермии (5°С и ниже) (Солдатов, 2010). Это выражалось в повышении тонуса гладкомышечной стенки сосудов микроциркуляторного русла и уменьшении плотности капиллярной сети в мышечной ткани. Следствием этого явился рост толщины диффузионного слоя и уменьшение площади диффузионной поверхности, что понижало тканевое напряжение кислорода (Солдатов, 2010). Сосуды при этом утрачивали способность реагировать на тестовые функциональные нагрузки (реакция на внешнюю гипоксию). Это происходило на фоне повышения концентрации свободного Са2+ в скелетных мышцах (Солдатов, 2010). Известно, что у клеток, чувствительных к гипотермии, в области низких температур происходит нарушение мембранных функций, приводящее к диссипации ионных градиентов, что сопровождается входом Ca2+ в клетки (Hochachka, 1986). Поступление внеклеточного Ca2+ в гладкомышечные клетки активирует базальный тонус сосудов (Шуба, Кочемасова, 1988). На этом фоне должна развиваться неконтролируемая вазоконстрикторная реакция, что, по-видимому, в действительности и имело место. Вазоконстрикторный эффект Ca2+ был выявлен в условиях гипоксии и у циклостомат (Russell et al., 2001).
В основе застойных форм гипоксии могут лежать два процесса: избирательное перераспределение крови в пользу отдельных органов, что ограничивает объемный кровоток в других органах, и ограничение функциональных кондиций миокарды сердца (Колчинская, 1991; Soldatov, 2012).
Наиболее реактивной группой сосудов у гидробионтов и рыб в частности являются сосуды оксифильных тканей: головного мозга, сердца и жаберных лепестков (Soivio, Tuurala, 1981; Gamperl et al., 1994; Renshaw, Dyson, 1999). В условиях внешней гипоксии кровоток в них может увеличиваться более чем в 2 раза (Gamperl et al., 1994; Yoshikawa et al., 1995; Soederstroem, Nilsson, 2000). При этом в остальных тканях (почки, печень, селезенка, скелетные мышцы, кишечник) он может существенно ограничиваться, приводя к понижению среднетканевого напряжения кислорода (Cameron, 1975; Axelsson, Fritsche, 1991).
Значительное влияние на перераспределение крови в организме гидробионтов оказывают факторы водной среды. Так, повышение температуры (6 → 18°С) увеличивало объемный кровоток в белых скелетных мышцах форели (Barron et al., 1987). В других органах (селезенка, печень, почки, кишечник, желчный пузырь) он явно подавлялся. При увеличении солености отмечен существенный рост кровотока в кожных покровах Pleuronectes platessa (Steffensen, Lomholt, 1985).
Функциональные состояния также могут оказывать существенное влияние на характер распределения кровотока в тканях. Чрезмерное потребление пищи, характерное для хищных донных рыб, значительно усиливает кровоток в желудочно-кишечном тракте (Shulman, Love, 1999). Плавательные нагрузки в крейсерском режиме сопровождаются повышением объемного кровотока в красной мышечной ткани (Axelsson, Fritsche, 1991). Определенное влияние оказывает и состояние нереста (Soldatov, 2006). Из представленной информации видно, что реакции перераспределения крови переводят функционирование отдельных органов и тканей гидробионтов в режим ограниченного кровоснабжения. Это, как следствие, может периодически усиливать в них анаэробные процессы, что характерно для тканевой гипоксии.
Застойные формы гипоксии могут развиваться у гидробионтов и на основе изменения функционального состояния сердечной мышцы. Значительную роль в этом играют факторы среды. Выраженная брадикардия и ограничение ударного объема крови у костистых рыб отмечается в условиях внешней гипоксии и гипотермии (Mourad et al., 1991; Kakuta, Murachi, 1992), что ограничивает величину объемного кровотока на организменном уровне в целом.
Недавно в условиях эксперимента описан феномен полного кратковременного подавления сердечной деятельности у морского ерша при предъявлении звуковых стимулов (реакция настороженности, “замирание”) (Kolesnikova et al., 2021). Он наблюдался на фоне прекращения движения оперкулярных крышек (остановка дыхания, апноэ). Длительность реакции составила от 31 до 50 сек. Остановка кровотока должна была сказаться прежде всего на состоянии оксифильных тканей (мозг, сердце). Предполагается, что в основе кратковременной задержки сердечной деятельности скорпены лежит явление кардио-респираторного сопряжения и синхронизации. Данный феномен следует рассматривать как естественное для данного вида состояние, которое в условиях плотной водной среды обеспечивает отсутствие акустических и электрических сигналов, демаскирующих местоположение хищника-засадчика.
Процессы, ответственные за развитие циркуляционной гипоксии, обобщены на схеме (рис. 2).
ГЕМИЧЕСКАЯ ГИПОКСИЯ
Данный вид гипоксических состояний может развиваться как следствие изменения респираторных характеристик циркулирующих сред (крови, гемолимфы). К ним можно отнести анемию, снижение доли функционально активного пигмента, изменение диффузионных свойств эритроцитарных мембран (Soldatov, 2012). У гидробионтов в результате естественных процессов могут периодически возникать указанные выше критические состояния.
Анемия, как следствие нерегулярности эритропоэтических процессов. По общему признанию, нерест является своеобразным “стержнем” большинства метаболических процессов, протекающих в организме гидробионтов на протяжении годового цикла (Shulman, Love, 1999). Состояние физиологических систем в этот период претерпевает наиболее радикальные изменения. Красная кровь не является исключением. Отмечено, что кислородная емкость крови в преднерестовый период и в начале нереста существенно понижается. Концентрация гемоглобина и число эритроцитов в крови падает (Raizada, Singh, 1981; Маслова, Тавровская, 1991), что фактически отражает развитие анемии. Эти результаты подтверждены также в экспериментах с искусственной стимуляцией нереста (инъекции вытяжек гипофиза карпа, гонадотропина, эстрогена, релизинг-факторов) (Ochiai et al., 1975; Hilge, Klinger, 1978). К концу нереста и в постнерестовый период (2–3 мес.), напротив, происходит существенное увеличение кислородной емкости крови, о чем свидетельствует повышение концентрации гемоглобина и числа циркулирующих эритроцитов (Маслова, Тавровская, 1991; Ranzani-Paiva, 1995). Известно, что при подготовке к нересту в организме гидробионтов происходит существенное перераспределение пластических ресурсов. Оно в той или иной степени отражается на состоянии большинства физиологических систем, в частности циркулирующей крови, и выражается в деградации части клеточной массы органов и тканей.
Известно, что белковая недостаточность всегда сопряжена с более или менее выраженной анемией у рыб (Kokkidis et al., 2000), которая способна индуцировать выработку эритропоэтинов (Weinberg et al., 1976; Houston et al., 1996; Rothmann et al., 2000). Впервые данные соединения были обнаружены у рыб с помощью иммунохимического анализа в почках, селезенке, печени и плазме крови (Wickramasinghe, 1993). Местом их образования, по-видимому, являются почки. Здесь была обнаружена самая высокая концентрация эритропоэтинов. Полная структура гена эритропоэтина в настоящее время аннотирована для Fugu rubripes (Chou et al., 2004). Выработка эритропоэтина и усиление эритропоэза в гемопоэтических тканях – это сравнительно инерционный процесс, требующий у гидробионтов определенного периода времени. Образование новых циркулирующих эритроцитов обычно происходит в течение 2–3 мес. (Soldatov, 2005). Это соответствует продолжительности жизни эритроцитов костистых рыб, определяемой по включению 3Н‑тимидина и флуоресцентных зондов (270–310 дней) (Золотова, 1987; Fischer et al., 1998). Отсюда следует, что интенсификация процессов пролиферации и дифференцировки клеток эритроидного ряда в кроветворной ткани в постнерестовый период является вполне закономерным следствием развития анемичного состояния, которое возникает у гидробионтов периодически на протяжении годового цикла. Степень развития этого состояния может иметь как индивидуальную, так и межвидовую специфику.
Метгемоглобинемия, как следствие нерегулярности эритропоэтических процессов. Процесс деоксигенации оксигемоглобина (HbO2) в норме сопровождается освобождением молекулярного кислорода с сохранением железа в геме в двухвалентном состоянии (ферро-форма) (Schechter, 2008):
Однако в ряде случаев это сопровождается окислением железа, которое переходит в трехвалентное состояние (Fe3+) (ферри-форма), и образованием супероксиданионрадикала (${\text{O}}_{2}^{ - }$) (Schechter, 2008):
Это соединение именуется метгемоглобином (MtHb). Оно снижает кислородную емкость крови в целом. В эритроцитах присутствует NADH-диафораза, которая препятствует развитию данного процесса. Она переносит электрон с NADH на цитохром b5, а затем на MtHb (Percy, Lappin, 2008):
Это приводит практически к 100%-му восстановлению окисленного пигмента. Окислению гемоглобина препятствуют также глутатион (GSH), аскорбиновая кислота, токоферол (Krishna, Venkataramana, 2007).
В эритроцитах гидробионтов (костистые рыбы) также присутствует данный молекулярный комплекс (Zikic et al., 1991; Schoore et al., 1995). Однако респираторные пигменты у них отличаются низкой устойчивостью к окислению в сравнении с высшими позвоночными (Powell, Perry, 1997; Blair et al., 2020). Они могут периодически переходить в ферри-форму без видимых признаков токсической метгемоглобинемии. Такое состояние было отмечено у отдельных видов на протяжении годового цикла (Hardig, Hoglund, 1983; Soldatov, Maslova, 1989). Максимальная концентрация метгемоглобина была выявлена у Gadus morhua – 27% (Graham, Fletcher, 1986). При этом сезонная динамика уровня метгемоглобина в крови имеет явно выраженную видовую специфичность и обычно не отражает естественный ход изменения температуры и фотопериода (Graham, Fletcher, 1986; Soldatov, Maslova, 1989).
Как показали наблюдения, уровень окисленного пигмента в крови коррелировал с изменением активности гемопоэтической ткани. В период активной пролиферации и дифференцировки эритроидных форм уровень метгемоглобина в крови был минимален (Soldatov, Maslova, 1989). Основной прирост приходился на период старения циркулирующей эритроцитарной массы, в основном в преднерестовый период. Это нашло отражение в смещении максимума кислотных эритрограмм влево и происходило на фоне снижения активности NADH-диафоразы (Soldatov, Maslova, 1989; Солдатов, 2005).
Из представленной информации следует, что нерегулярность эритропоэтических процессов в гемопоэтической ткани гидробионтов имеет два негативных следствия: развитие анемии и метгемоглобинемии (рис. 3). Это снижает кислородную емкость крови и способствует развитию состояния гипоксии, которое периодически возникает на протяжении годового цикла.
Рис. 3.
Группа естественных процессов, приводящая к ограничению доставки кислорода к тканям у гидробионтов.
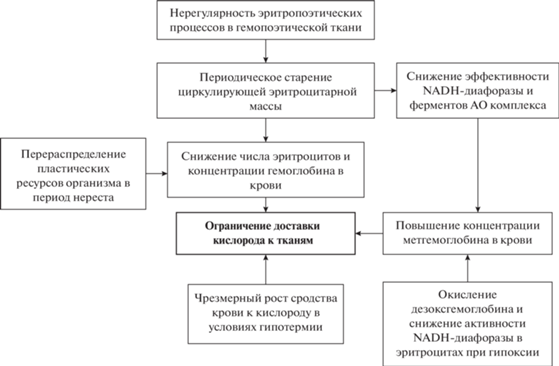
Влияние гипоксии и гипотермии. Как показали наблюдения, данные факторы могут снижать функциональные кондиции респираторных пигментов и способствовать развитию гемической гипоксии у гидробионтов (рис. 3).
При гипоксии повышается доля дезокс-формы гемоглобина. Железо в геме при этом находится в высокоспиновом состоянии (четыре неспаренных электрона). Это может способствовать отрыву электрона и переходу гемоглобина в мет-форму (автоокисление гемоглобина) (Jensen et al., 1998), что показано для высших и низших позвоночных (Affonso et al., 2002; Chen et al., 2017). Роль акцептора электрона при этом выполняет кислород венозной крови.
Эритроциты низших позвоночных содержат ядро и митохондрии (Boutilier, Ferguson, 1989; Phillips et al., 2000). В них активно протекают аэробные процессы. В условиях гипоксии в клетках красной крови усиливаются гликолитические процессы, что приводит к закислению внутриклеточной среды (Adragna et al., 2004). Это должно сопровождаться снижением активности NADH-диафоразы и приводить к росту содержания метгемоглобина.
Гипотермия оказывает негативное влияние преимущественно на гемоглобины теплолюбивых видов рыб. При температуре воды ниже 10°С тепловая зависимость реакции оксигенации крови у них значительно повышается, о чем свидетельствуют более высокие значения теплоты оксигенации пигмента (ΔH) (Солдатов, Парфенова, 2011). Это сопровождается значительным увеличением сродства цельной крови к кислороду, что существенно осложняет процесс ее деоксигенации на тканевом уровне. Допускается, что данная реакция определяется изменением характера взаимоотношений гемоглобина с внутриэритроцитарной средой, а не свойствами самого пигмента.
ЗАКЛЮЧЕНИЕ
Таким образом, специфика организации респираторных, циркуляционных и гемических систем у водных организмов может приводить к развитию естественных эндогенных гипоксических состояний, не свойственных высшим позвоночным. Они могут наблюдаться при сохранении внешнего оптимума условий среды, а также при адаптации к ряду физико-химических факторов (гипоксии, гипотермии, гипоосмии). При этом следует обратить внимание на следующую группу процессов:
• К респираторным формам гипоксии можно отнести: ограничение подвижности у пелагических рыб, использующих в той или иной степени таранный тип вентиляции жаберной полости; рост ${\text{NH}}_{4}^{ + }$ в примембранном слое воды жабр вследствие увеличения интенсивности процессов белкового катаболизма; подавление активности респираторного центра и неконтролируемую вазоконстрикцию сосудов микроциркуляции жабр в условиях гипотермии; рост толщины диффузионного слоя жабр как следствие повышенной пролиферации хлоридных клеток. Во всех случаях эти процессы приводят к развитию артериальной гипоксемии у гидробионтов.
• К циркуляционным формам гипоксии относятся: развитие чрезмерной брадикардии в условиях гипотермии и гипоксии; неконтролируемая вазоконстрикция сосудов микроциркуляции в ряде органов и тканей при гипотермии; различия в реактивности сосудов микроциркуляции органов и тканей, что может приводить к формированию застойных зон в момент перераспределения крови в организме. Эти процессы ограничивают приток крови к тканям, что усиливает течение в них анаэробных процессов.
• Гемические формы гипоксии в основном связаны с нерегулярностью функционирования гемопоэтической ткани. Это приводит к периодическому старению циркулирующей эритроцитарной массы, что сопровождается развитием анемии и метгемоглобинемии на протяжении годового цикла. В условиях гипотермии возможен неконтролируемый рост сродства гемоглобина к кислороду, что осложняет процесс диссоциации оксигемоглобина.
Рассмотренные выше состояния не свойственны наземным формам жизни. Их не следует рассматривать как аномальные, так как они являются естественными и отражают специфику функциональной организации организма гидробионтов и особенности их существования в водной среде.
Список литературы
Андреенко Т.И., 2014. Сравнительная оценка устойчивости гидробионтов к условиям внешней гипоксии и аноксии // Морской экол. журн. Т. 13. № 2. С. 14–23.
Золотова Т.Е., 1987. Экспериментальное исследование кроветворения у рыб. Автореф. дис. … канд. биол. наук. М.: МГУ. 24 с.
Кляшторин Л.Б., 1982. Водное дыхание и кислородные потребности рыб. М.: Легкая и пищ. пром-сть. 168 с.
Колчинская А.З., 1991. Кислород. Физическое состояние. Работоспособность. Киев: Наукова думка. 208 с.
Маслова М.Н., Тавровская Т.В., 1991. Динамика сезонных изменений в системе красной крови низших позвоночных: сезонная динамика эритропоэза у форели Salmo gairdneri // Журн. эвол. биохимии и физиологии. Т. 27. С. 796–798.
Орехова Н.А., Коновалов С.К., 2018. Кислород и сульфиды в донных отложениях прибрежных районов севастопольского региона Крыма // Океанология. Т. 58. № 5. С. 739−750.https://doi.org/10.1134/S0030157418050106
Солдатов А.А., 2005. Эритропоэз и концентрация метгемоглобина в крови кефали-сингиля (Liza aurata Risso) на протяжении годового цикла // Современные проблемы физиологии и биохимии водных организмов. Петрозаводск: Изд-во Ин-та биологии, КарНЦ РАН. С. 182–187.
Солдатов А.А., 2010. Влияние экспериментальной гипотермии на состояние капиллярной сети скелетных мышц морских рыб // Современные проблемы физиологии и биохимии водных организмов. Сб. научн. статей. Т. 1. Петрозаводск: КарНЦ РАН. С. 278–282.
Солдатов А.А., 2018. Кислородный режим скелетных мышц костистых рыб и механизмы его функциональной коррекции (краткий обзор) // Журн. общ. биологии. Т. 79. № 6. С. 471–481.
Солдатов А.А., 2019. Функциональные аспекты существования морских организмов в зонах острой гипоксии // Тр. ИБВВ РАН. Вып. 88 (91). С. 20–28. https://doi.org/10.24411/0320-3557-2019-10024
Солдатов А.А., Парфенова И.А., 2009. Развитие тканевой гипоксии у кефали-пиленгаса в условиях садкового содержания // Рибне господарство. Вип. 66. С. 180–184.
Солдатов А.А., Парфенова И.А., 2011. Связывание кислорода кровью морских рыб в условиях экспериментальной гипотермии // Укр. биохим. журн. Т. 83. № 1. С. 77–82.
Шуба М.Ф., Кочемасова Н.Г., 1988. Физиология сосудистых гладких мышц. Киев: Наукова думка. 252 с.
Adragna N.C., Di Fulvio M., Lauf P.K., 2004. Regulation of K-Cl cotransport: from function to genes // J. Membr. Biol. V. 201. P. 109–137. https://doi.org/10.1007/s00232-006-1002-5
Affonso E.G., Polez V.L., Corrêa C.F., Mazon A.F., Araújo M.R. et al., 2002. Blood parameters and metabolites in the teleost fish Colossoma macropomum exposed to sulfide or hypoxia // Comp. Biochem. Physiol. C. V. 133. P. 375–382. https://doi.org/10.1016/S1532-0456(02)00127-8
Axelsson M., Fritsche R., 1991. Effects of exercise hypoxia and feeding on the gastrointestinal blood flow in the Atlantic cod Gadus morhua // J. Exp. Biol. V. 158. P. 181–198. https://doi.org/10.1242/jeb.158.1.181
Azuma T., Chikushi Ya., Itazawa Ya., 1998. Effects of acute drop of ambient temperature on respiration and blood circulation of porgy // Fish Sci. V. 64. № 2. P. 270–275. https://doi.org/10.2331/fishsci.64.270
Banse K., Naqvi S.W.A., Narvekar P.V., Postel J.R., Jayakumar D.A., 2014. Oxygen minimum zone of the open Arabian Sea: Variability of oxygen and nitrite from daily to decadal timescales // Biogeosciences. V. 11. P. 2237–2261. https://doi.org/10.5194/bg-11-2237-2014
Barron M.G., Tarr B.D., Hayton W.L., 1987. Temperature-dependence of cardiac output and regional blood flow in rainbow trout, Salmo gairdneri R. // J. Fish Biol. V. 31. № 6. P. 735–744. https://doi.org/10.1111/J.1095-8649.1987.TB05276.X
Bickler P.E., Buck L.T., 2007. Hypoxia tolerance in reptiles, amphibians, and fishes: Life with variable oxygen availability // Annu. Rev. Physiol. V. 69. P. 145–170. https://doi.org/10.1146/annurev.physiol.69.031905.162529
Bidinotto P.M., Moraes G., Souza R.H.S., 1997. Hepatic glycogen and glucose in eight tropical freshwater teleost fish: A procedure for field determinations of micro samples // Bol. Tec. Cepta. V. 10. P. 53–60.
Bindon S.D., Gilmour K.M., Fenwick J.C., Perry S.F., 1994. The effects of branchial chloride cell proliferation on respiratory function in the rainbow trout Oncorhynchus mykiss // J. Exp. Biol. V. 197. P. 47–63. https://doi.org/10.1242/jeb.197.1.47
Blair B., Barlow C., Martin E., Schumaker R., McIntyre J., 2020. Methemoglobin determination by multi-component analysis in coho salmon (Oncorhynchus kisutch) possessing unstable hemoglobin // Methods. V. 7. https://doi.org/10.1016/j.mex.2020.100836
Boutilier R.G., Ferguson R.A., 1989. Nucleated red cell function: Metabolism and pH regulation // Can. J. Zool. V. 67. P. 2986–2993. https://doi.org/10.1139/z89-421
Bushnell P.G., Jones D.R., 1994. Cardiovascular and respiratory physiology of tuna: Adaptations for support of exceptionally high metabolic rates // Environ. Biol. Fishes. V. 40. № 3. P. 303–318.
Cameron J.N., 1975. Blood flow distribution as indicated by tracer microspheres in resting and hypoxic Arctic grayling (Thymallus arcticus) // Comp. Biochem. Physiol. A. Comp. Physiol. V. 52. № 3. P. 441–444. https://doi.org/10.1016/s0300-9629(75)80062-4
Chen N., Wu M., Tang G.-P., Wang H.-J., Huang C.-X. et al., 2017. Effects of acute hypoxia and reoxygenation on physiological and immune responses and redox balance of Wuchang bream (Megalobrama amblycephala Yih, 1955) // Front. Physiol. V. 8. P. 1–9. https://doi.org/10.3389/fphys.2017.00375
Chew S.F., Gan J., Ip Y.K., 2005. Nitrogen metabolism and excretion in the swamp eel, Monopterus albus, during 6 or 40 days of estivation in mud // Physiol. Biochem. Zool. V. 78. № 4. P. 620–629. https://doi.org/10.1086/430233
Chou C.-F., Tohari S., Brenner S., Venkatesh B., 2004. Erythropoietin gene from a teleost fish, Fugu rubripes // Blood. V. 104. P. 1498–1503. https://doi.org/10.1182/blood-2003-10-3404
Danovaro R., Dell’Anno A., Pusceddu A., Gambi C., Heiner I., Kristensen R.M., 2010. The first metazoa living in permanently anoxic conditions // BMC Biol. V. 8. https://doi.org/10.1186/1741-7007-8-30
Dube S.C., Datta-Munshi J.S., 1974. Studies on the blood-water diffusion barrier of secondary gill lamellae of an air-breathing fish, Arabas testudineus // Zool. Anz. V. 193. № 1–2. P. 35–41.
Duncombe-Rae C.M., Bailey G.W., Neumann T., Plas A., Mouton D. et al., 2000. Low oxygen expression and the poleward undercurrent on the Angola-Namibia shelf, July 1999 // 10th SAMSS, 2000: Wilderness (South Africa), 22–26 Nov 1999. Wilderness: Univ. of Port Elizabeth. Abstracts. 1 p.
Fenchel T., Finlay B.J., 1995. Ecology and Evolution in Anoxic Worlds. Oxford: Oxford Univ. Press. 276 p.
Fernandes M.N., Barrionuevo W.R., Rantin F.T., 1995. Effects of thermal stress on respiratory responses to hypoxia of a South American prochilodontid fish, Prochilodus scrofa // J. Fish. Biol. V. 46. № 1. P. 123–133. https://doi.org/10.1111/J.1095-8649.1995.TB05951.X
Fischer U., Ototake M., Nakanishi T., 1998. Life span of circulating blood cells in ginbuna crucian carp (Carassius auratus langsdorfii) // Fish Shellfish Immunol. V. 8. P. 339–349. https://doi.org/10.1006/fsim.1998.0144
Gamperl A.K., Pinder A.W., Grant R.R., Boutilier R.G., 1994. Influence of hypoxia and adrenaline administration on coronary blood flow and cardiac performance in seawater rainbow trout (Oncorhynchus mykiss) // J. Exp. Biol. V. 193. P. 209–232. https://doi.org/10.1242/jeb.193.1.209
Gewin V., 2010. Dead in the water // Nature. V. 466. № 7308. P. 812–814. https://doi.org/10.1038/466812a
Gilmour K.M., Fenwick J.C., Perry S.F., 1995. The effects of softwater acclimation on respiratory gas transfer in the rainbow trout Oncorhynchus mykiss // J. Exp. Biol. V. 198. № 12. P. 2557–2567. https://doi.org/10.1242/jeb.198.12.2557
Glass M.L., Soncini R., 1995. Regulation of acid-base status in ectothermic vertebrates: The consequences for oxygen pressures in lung gas and arterial blood // Braz. J. Med. Biol. Res. V. 28. № 11–12. P. 1161–1166.
Graham M.S., Fletcher G.L., 1986. High concentrations of methemoglobin in five species of temperate marine teleosts // J. Exp. Zool. V. 239. P. 139–142. https://doi.org/10.1002/jez.1402390117
Hardig J., Hoglund L.B., 1983. Seasonal and ontogenetic effects on methaemoglobin and reduced glutathione contents in the blood of reared Baltic salmon // Comp. Biochem. Physiol. A. Comp. Physiol. V. 76. № 1. P. 27–34.
Henry R., Lucu C., Onken H., Weihrauch D., 2012. Multiple functions of the crustacean gill: Osmotic/ionic regulation, acid-base balance, ammonia excretion, and bioaccumulation of toxic metals // Front. Physiol. V. 3. https://doi.org/10.3389/fphys.2012.00431
Hilge V., Klinger H., 1978. Changes in the hemogram of the male European eel (Anguilla anguilla) during induced maturation. Hamburg: ICES. 17 p.
Hills B.A., Hughes G.M., 1970. A dimensional analysis of oxygen transfer in the fish gills // Respir. Physiol. V. 9. P. 126–140. https://doi.org/10.1016/0034-5687(70)90065-4
Hochachka P., 1986. Defence strategies against hypoxia and hypothermia // Science. V. 231. P. 324–241. https://doi.org/10.1126/science.2417316
Hochachka P.W., Somero G.N., 2002. Biochemical Adaptation: Mechanism and Process in Physiological Evolution. N.-Y.: Oxford Univ. Press. 466 p.
Houston A.H., Roberts W.C., Kennington J.A., 1996. Hematological response in fish: Pronephric and splenic involvements in the goldfish // Fish Physiol. Biochem. V. 15. № 6. P. 481–489. https://doi.org/10.1007/BF01874922
Hughes G.M., Morgan M., 1973. The structure of fish gills in relation to their respiratory function // Biol. Rev. V. 48. P. 419–475. https://doi.org/10.1111/j.1469-185X.1973.tb01009.x
Jasinski A., 1973. Fine structure of capillaries in the respiratory intestine of the pond loach, Misqurnus fossilis // Ann. Med. Sec. Pol. Acad. Sci. V. 18. № 1. P. 74–76.
Jensen F.B., Fago A., Weber R.E., 1998. Hemoglobin structure and function // Fish Physiology. V. 17 / Eds Perry S.F., Tufts B.L. San Diego: Acad. Press. P. 1–40.
Joyce S., 2000. The dead zones: Oxygen-starved coastal waters // Environ. Health Perspect. V. 108. № 3. P. A120–A125. https://doi.org/10.1289/ehp.108-a120
Kakuta I., Murachi S., 1992. Effects of hypoxia on renal function in carp // Zool. Sci. V. 9. № 6. P. 1250.
Karstensen J., Stramma L., Visbeck M., 2008. Oxygen minimum zones in the eastern tropical Atlantic and Pacific Oceans // Prog. Oceanogr. V. 77. P. 331–350. https://doi.org/10.1016/j.pocean.2007.05.009
Kokkidis M.J., Goubier V., Martin M., Hardy I., Exbrayat J.M., 2000. Haematological changes in the blood of cultured black-bass (Micropterus salmoides) during an annual sexual reproductive cycle // Ichtyologie. V. 24. № 3S. P. 113–118.
Kolesnikova E.E., Kirin M.P., Soldatov A.A., Golovina I.V., 2021. Phenomenon of the complete suppression of cardiac activity in the Black Sea scorpionfish Scorpaena porcus (Scorpaenidae) during an alertness reaction // Mar. Biol. J. V. 6. № 3. P. 78–86. https://doi.org/10.21072/mbj.2021.06.3.08
Krishna M.S., Venkataramana G., 2007. Status of lipid peroxidation, glutathione, ascorbic acid, vitamin E and antioxidant enzymes in patients with pregnancy-induced hypertension // Indian J. Physiol. Pharmacol. V. 51. P. 284–288. https://doi.org/10.4103/0019-5359.29592
Levin L.A., 2002. Oxygen minimum zone influence on the community structure of deep-sea benthos // Fish Physiology, Toxicology, and Water Quality. Proc. 6th int. symp. (La Paz). Athens: Environmental Research Laboratory. P. 121.
Lutz P.L., Nilsson G.E., 1997. Contrasting strategies for anoxic brain survival – glycolysis up or down // J. Exp. Biol. V. 200. P. 411–419. https://doi.org/10.1242/jeb.200.2.411
Maricondi-Massari M., Kalinin A.L., Glass M.L., Rantin F.T., 1998. The effects of temperature on oxygen uptake. Gill ventilation and ECG waveforms in the Nile tilapia, Oreochromis niloticus // J. Therm. Biol. V. 23. № 5. P. 283–290.
Middelburg J.J., Levin L.A., 2009. Coastal hypoxia and sediment biogeochemistry // Biogeosci. Discuss. V. 6. P. 3655–3706. https://doi.org/10.5194/bgd-6-3655-2009
Mourad M.H., 1991. Effects of water temperature on the ECG; heart rate and respiratory rate of the eel Anguilla anguilla L. // Acta Ichthyol. Piscat. V. 21. № 1. P. 81–86. https://doi.org/10.3750/AIP1991.21.1.08
Ochiai A., Ogawa M., Umeda S., Taniguchi N., 1975. Change of blood properties of maturing japan eel at hormonal influences // Bull. Jap. Soc. Sci. Fish. V. 41. № 6. P. 609–614.
Paulmier A., Ruiz-Pino D., 2009. Oxygen minimum zones in the modern ocean // Prog. Oceanogr. V. 80. P. 113–128. https://doi.org/10.1016/j.pocean.2008.08.001
Percy M.J., Lappin T.R., 2008. Recessive congenital methaemoglobinaemia: cytochrome b5 reductase deficiency // Br. J. Haematol. V. 141. № 3. P. 298–308. https://doi.org/10.1111/j.1365-2141.2008.07017.x
Perry S.F., 1997. The chloride cell: Structure and function in the gills of freshwater fishes // Annu. Rev. Physiol. V. 59. P. 325–347. https://doi.org/10.1146/annurev.physiol.59.1.325
Perry S.F., McDonald G., 1993. Gas exchange // The Physiology of Fishes / Ed. Evans D.H. Boca-Raton: CRC Press. P. 251–278.
Phillips M.C.L., Moyes C.D., Tufts B.L., 2000. The effects of cell ageing on metabolism in rainbow trout (Oncorhynchus mykiss) red blood cells // J. Exp. Biol. V. 203. P. 1039–1045.
Potter L.C., Welsch U., Wright G.M., Honma Y., Chiba A., 1995. Light and electron microscope studies of the dermal capillaries in three species of hagfishes and three species of lampreys // J. Zool. V. 235. № 4. P. 677–688. https://doi.org/10.1111/J.1469-7998.1995.TB01777.X
Powell M.D., Perry S.F., 1997. Respiratory and acid-base pathophysiology of hydrogen peroxide in rainbow trout (Oncorhynchus mykiss) // Aquat. Toxicol. V. 37. P. 99–112.
Raizada M.N., Singh C.P., 1981. Seasonal variations in the erythrocyte counts and haemoglobin content of Cirrhinus mrigala (Ham.) // Proc. Indian Nat. Sci. Acad. V. 47. № 5. P. 656–658.
Ranzani-Paiva M.J.T., 1995. Hematological characteristics of the mullet, Mugil platanus G. from Cananeia lagoon-estuarine region // Bol. Inst. Pesca. V. 22. P. 1–22.
Renshaw G.M., Dyson S.E., 1999. Increased nitric oxide synthase in the vasculature of the epaulette shark brain following hypoxia // Neuroreport. V. 10. № 8. P. 1707–1712. https://doi.org/10.1097/00001756-199906030-00015
Rosenberg R., Nilsson H.C., Diaz R.J., 2001. Response of benthic fauna and changing sediment redox profiles over a hypoxic gradient // Estuar. Coast. Shelf Sci. V. 53. P. 343–350. https://doi.org/10.1006/ecss.2001.0810
Rothmann C., Levinshal T., Timan B., Avtalion R.R., Malik Z., 2000. Spectral imaging of red blood cells in experimental anemia of Cyprinus carpio // Comp. Biochem. Physiol. A. Mol. Integr. Physiol. V. 125. P. 75–83. https://doi.org/10.1016/s1095-6433(99)00157-9
Russell M.J., Pelaez N.J., Packer C.S., Forster M.E., Olson K.R., 2001. Intracellular and extracellular calcium utilization during hypoxic vasoconstriction of cyclostome aortas // Am. J. Physiol. Regul. Integr. Comp. Physiol. V. 281. № 5. P. R1506–R1513. https://doi.org/10.1152/ajpregu.2001.281.5.R1506
Schechter A.N., 2008. Hemoglobin research and the origins of molecular medicine // Blood. V. 112. № 10. P. 3927–3938. https://doi.org/10.1182/blood-2008-04-078188
Schoore E.J., Simco B.A., Davis K.B., 1995. Responses of blue catfish and channel catfish to environmental nitrite // J. Aquat. Anim. Health. V. 7. № 4. P. 304–311.
Shulman G.E., Love R.M., 1999. The biochemical ecology and marine fishes // Adv. Mar. Biol. V. 36. L.: Academic Press. 347 p.
Soederstroem V., Nilsson G.E., 2000. Brain blood flow during hypercapnia in fish: No role of nitric oxide // Brain Res. V. 857. № 1–2. P. 207–211. https://doi.org/10.1016/s0006-8993(99)02428-2
Soivio A., Tuurala H., 1981. Structural and circulatory responses to hypoxia in the secondary lamellae of Salmo gairdneri gills at two temperatures // J. Comp. Physiol. V. 145. № 1. P. 37–43.
Soldatov A.A., 1997. Oxygen-dissociation properties of blood and intraerythrocytic medium composition in sea fish with different motor activity // J. Evol. Biochem. Physiol. V. 33. № 6. P. 534–539.
Soldatov A.A., 2005. Peculiarities of organization and functioning of the fish red blood system // J. Evol. Biochem. Physiol. V. 41. P. 272–281. https://doi.org/10.1007/s10893-005-0060-0
Soldatov A.A., 2006. Organ blood flow and vessels of microcirculatory bed in fish (review) // J. Evol. Biochem. Physiol. V. 42. № 3. P. 243–252. https://doi.org/10.1134/S002209300603001X
Soldatov A.A., 2012. On the issue of classification of the hypoxic states of the aquatic organisms // Hydrobiol. J. V. 48. № 4. P. 3–17. https://doi.org/10.1615/HydrobJ.v48.i4.10
Soldatov A.A., Maslova M.N., 1989. Concentration of methemoglobin in blood of fish in the course of the annual cycle // J. Evol. Biochem. Physiol. V. 25. № 4. P. 317–321.
Soncini R., Glass M.L., 1997. The effects of temperature and hyperoxia on arterial PO2 and acid-base status in Piaractus mesopotamicus // J. Fish Biol. V. 51. № 2. P. 225–233. https://doi.org/10.1111/j.1095-8649.1997.tb01661.x
Souza P.C., de, Bonilla-Rodriguez G.O., 2007. Fish hemoglobins // Braz. J. Med. Biol. Res. V. 40. № 6. P. 769–778. https://doi.org/10.1590/s0100-879x2007000600004
Steffensen J.F., Lomholt J.P., 1985. Cutaneous oxygen uptake and its relation to skin blood perfusion and ambient salinity in the plaice, Pleuronectes platessa // Comp. Biochem. Physiol. A. Comp. Physiol. V. 81. № 2. P. 373–375. https://doi.org/10.1016/0300-9629(85)90150-1
Stoeck T., Taylor G.T., Epstein S.S., 2003. Novel eukaryotes from the permanently anoxic Cariaco Basin (Caribbean Sea) // Appl. Environ. Microbiol. V. 69. № 9. P. 5656–5663. https://doi.org/10.1128/AEM.69.9.5656-5663.2003
Sundin L., Nilsson G.E., 2000. Branchial and circulatory responses to serotonin and rapid ambient water acidification in rainbow trout // J. Exp. Biol. V. 287. № 2. P. 113–119.
Vaquer-Sunyer R., Duarte C.M., 2008. Thresholds of hypoxia for marine biodiversity // Proc. Natl. Acad. Sci. V. 105. P. 15452–15457. https://doi.org/10.1073/pnas.0803833105
Weinberg S.R., Lobue J., Siegel C.D., Gordon A.S., 1976. Hematopoiesis of the kissinggourami. Effects of starvation, bleeding and plasma-stimulating factors an its erythropoiesis // Can. J. Zool. V. 54. P. 1115–1127. https://doi.org/10.1139/z76-127
Wickramasinghe S.N., 1993. Erythropoietin and the human kidney: Evidence for an evolutionary link from studies of Salmo gairdneri // Comp. Biochem. Physiol. A. Comp. Physiol. V. 104. P. 63–65. https://doi.org/10.1016/0300-9629(93)90009-s
Wilkie M.P., 2002. Ammonia excretion and urea handling by fish gills: Present understanding and future research challenges // J. Exp. Zool. V. 293. P. 284–301. https://doi.org/10.1002/jez.10123
Wilson R.W., Wright P.M., Munger S., Wood C.M., 1994. Ammonia excretion in freshwater rainbow trout (Oncorhynchus mykiss) and the importance of gill boundary layer acidification: Lack of evidence for Na+/${\text{NH}}_{4}^{ + }$ exchange // J. Exp. Biol. V. 191. P. 37–58. https://doi.org/10.1242/jeb.191.1.3710.1242/jeb.191.1.37
Yoshikawa H., Ishida Y., Kawata K., Kawai F., Kanamori M., 1995. Electroencephalograms and cerebral blood flow in carp, Cyprinus carpio, subjected to acute hypoxia // J. Fish Biol. V. 46. № 1. P. 114–122. https://doi.org/10.1111/j.1095-8649.1995.tb05950.x
Zikic R.V., Stajn A., Petrovic V.M., 1991. Effect of dexamethasone on the activity of superoxide dismutase and catalase in the tissue and erythrocytes of goldfish // Acta Biol. Jugosl. C. V. 27. № 1. P. 45–51.
Zillén L., Conley D.J., Andrén T., Andrén E., Björck S., 2008. Past occurrences of hypoxia in the Baltic Sea and the role of climate variability, environmental change and human impact // Earth Sci. Rev. V. 91. P. 77–92.
Дополнительные материалы отсутствуют.
Инструменты
Журнал общей биологии