Океанология, 2020, T. 60, № 4, стр. 545-555
Пикофитопланктон залива Благополучия (архипелаг Новая Земля) и прилегающего района Карского моря
Т. А. Белевич 1, 2, *, И. А. Милютина 2, А. В. Троицкий 2, М. В. Флинт 3
1 Московский государственный университет им. М.В. Ломоносова, биологический факультет
Москва, Россия
2 Научно-исследовательский институт Физико-химической биологии им. А.Н. Белозерского, Московский государственный университет им. М.В. Ломоносова
Москва, Россия
3 Институт океанологии им. П.П. Ширшова РАН
Москва, Россия
* E-mail: belevich@mail.bio.msu.ru
Поступила в редакцию 10.02.2020
После доработки 06.03.2020
Принята к публикации 08.04.2020
Аннотация
Численность, биомасса и содержание хлорофилла “a” пикофитопланктона, вклад пикоформ в суммарное содержание хлорофилла и состав фотоавтотрофных пикоэукариот (размер клеток менее 3 мкм) оценены в заливе Благополучия и северо-западной части Карского моря в сентябре 2017 г. В заливе наибольшие значения численности и биомассы пикофитопланктона были приурочены к поверхностному слою и составили в среднем 0.75 × 109 кл/м3 и 1.49 мг С/м3 соответственно. В северо-западной части Карского моря максимальные значения численности и биомассы были выявлены на горизонте 8 м и составили 2.29 × 109 кл/м3 и 2.76 мг С/м3 соответственно. Вклад пикофракции в общий хлорофилл на станциях залива колебался от 12 до 24%, в Карском море достигал 46%. Метагеномное секвенирование области V4 гена 18S рРНК выявило присутствие таксонов фотоавтотрофных пикоэукариот, относящихся к восьми классам водорослей. По числу прочтений преобладали Mamiellophyceae. В составе сообществ пикофитопланктона выявлены как арктические (Micromonas polaris), так и космополитые (Bathycoccus prasinos) виды.
ВВЕДЕНИЕ
К пикофитопланктону (ПФ) относят эукариотические водоросли и цианобактерии с размерами клеток менее 3 мкм [31, 32]. ПФ является одним из ключевых компонентов планктона, дающим существенный вклад в биомассу фитопланктона и первичную продукцию в разных районах Мирового океана [8].
Климатические изменения, происходящие в последние десятилетия в Арктике, привели к существенным изменениям абиотических условий в шельфовых арктических морях [28, 35, 36], что повлияло на условия существования базового трофического звена арктических экосистем — фитопланктон. Прогнозируется, что изменения пелагической морской среды, происходящие в арктическом регионе, приведут к увеличению доли ПФ в суммарной биомассе планктонных водорослей [24] и изменению видового состава всех размерных групп фитопланктона, включая ПФ, за счет проникновения водорослей умеренных вод и исчезновения арктических эндемиков [25].
В арктических районах в составе ПФ доминируют фототрофные пикоэукариоты (ФПЭ) [23, 45]. При всей значимости ФПЭ они являются наименее изученной по таксономическому составу группой фитопланктона. Малый размер, отсутствие у многих таксонов выраженных морфологических признаков, разрушение нежных форм при фиксации – все это затрудняет идентификацию ФПЭ природного фитопланктона традиционными методами микроскопического анализа и ведет к недооценке их видового богатства. В настоящее время для выявления таксономического разнообразия ФПЭ с успехом применяются молекулярно-генетические методы. Генетическое разнообразие ФПЭ исследовано во многих районах Мирового океана, включая Арктику [21, 23, 30], однако сведения о составе ФПЭ Карского моря до настоящего времени отсутствовали.
Цель настоящей работы состояла в оценке численности и биомассы ПФ, содержания хлорофилла “a” (хл “а”) пикофракции, вклада пикоформ в суммарное содержание хлорофилла, а также в выявлении с использованием метагеномного подхода таксономического состава фотоавтотрофных пикоэукариот в заливе Благополучия архипелага Новая Земля и прилегающем районе Карского моря в осенний период.
МАТЕРИАЛЫ И МЕТОДЫ
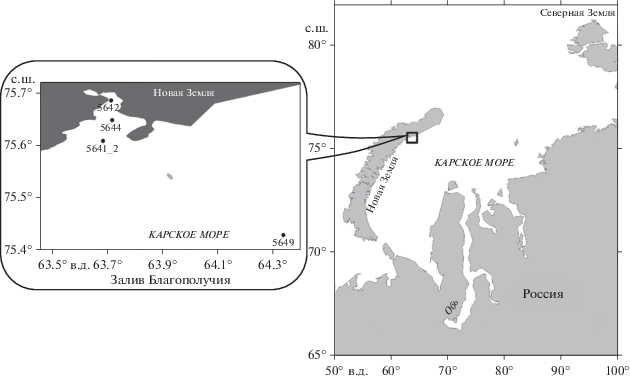
Материалом для работы послужили пробы, отобранные в ходе 69-го рейса НИС “Академик Мстислав Келдыш” в третьей декаде сентября 2017 г. на трех станциях (5642, 5644, 5641_2) в заливе Благополучия восточного побережья архипелага Новая Земля и на ст. 5649, расположенной в районе Новоземельской впадины в северо-западной части Карского моря (далее Карское море) (рис. 1).
Распределение температуры, солености, плотности воды и интенсивности флуоресценции хлорофилла оценивали на основании данных вертикального зондирования CTD-зондом SeaBird-911, оснащенным флуориметром. Интенсивность надводной и подводной облученности в диапазоне фотосинтетически активной радиации (ФАР) измеряли с использованием, соответственно, датчиков LI-190 и LI-192 (LI-COR, США). Подводная облученность определялась в режиме зондирования до глубин ~ 60–80 м, а на мелководных стациях – до дна. Данные зондирования подводной облученности были использованы для определения глубины эвфотической зоны (Zeu) (1% ФАР). На станциях, на которых не проводились зондирования, Zeu восстанавливали по региональной эмпирической зависимости значений коэффициента диффузного ослабления нисходящей облученности (Kd) от глубины видимости диска Секки [16]. Пробы воды отбирали батометрами комплекса SBE 32 в пределах эвфотической зоны: в верхнем квазиоднородном слое, в пикногалоклине и/или в слое максимума флуоресценции и с горизонтов ниже пикноклина. Всего было отобрано и проанализировано 14 проб.
Одновременно определяли концентрацию биогенных элементов – P-PO4, N-NO3, N-NO2, N-NH4 и Si(OH)4, согласно методам [18]. Далее по тексту все формы неорганического азота суммировали и обозначали Nнеорг.
Подсчет численности фотосинтезирующих пикоформ (цианобактерий и эукариот) проводили с использованием люминесцентного микроскопа Leica DM1000 по методике, изложенной в работе [12], а также проточного цитометра Accury C6 (BD Bioscience, США). Использование двух методов учета обусловлено тем, что цитометр Accury C6 дает заниженные оценки численности цианобактерий [39]. Для расчета биомассы содержание углерода в клетках цианобактерий принимали равным 470 фг С/кл [29], а в клетках эукариот определяли по клеточным объемам (Wкл) с использованием зависимости Скл = 0.433${\text{W}}_{{{\text{кл}}}}^{{0.863}}$ [29]. Объем клеток пикоэукариот рассчитывали, исходя из объема соответствующих стереометрических фигур [47].
При определении концентрации суммарного хл “a” (ХЛсум) пробы воды объемом 0.5–1 л фильтровали через фильтры GF/F. Для определения концентрации хл “a” пикофракции (ХЛпик) пробы воды объемом 0.5–1 л предварительно профильтровывали методом обратной фильтрации через фильтр с диаметром 3 мкм. Полученный фильтрат осаждали на фильтры GF/F. Концентрацию ХЛсум и ХЛпик определяли флуориметрически в ацетоновом экстракте [9], используя флуориметр Trilogy Turner Designs (США).
По величинам биомассы на отдельных горизонтах рассчитывали интегральные значения под 1 м2 в эвфотическом слое. Величина ошибки при расчете средних значений численности и биомассы ПФ, концентрации ХЛсум и ХЛпик составляла 20–30%.
Для оценки таксономического состава фотоавтотрофных пикоэукариот на станциях 5642 и 5649 были отобраны пробы воды объемом 2 л с поверхностного горизонта. Для удаления нано- и микропланктона воду предварительно пропускали через камеру обратной фильтрации (диаметр пор фильтра 3 мкм), фильтрат осаждали на картридж Sterivex (Millipore, Durapore, USA) с диаметром пор 0.2 мкм, заполняли его лизирующим раствором [11], замораживали и хранили в жидком азоте до дальнейшего анализа.
Для выделения ДНК использовали набор “Nucleospin Plant” (Macherey-Nagel, Germany), амплификацию проводили с праймерами на область V4 гена 18S рРНК: прямой – EuF-V4 и обратный – picoR2 [11], секвенирование ПЦР продуктов осуществлялось ООО “БиоСпарк” (http://biospark.pro) на платформе “Illumina MiSeq” (США). Прямые и обратные прочтения были объединены, отфильтрованы по качеству и проверены на наличие химер при помощи программного продукта MOTHUR [40]. Для идентификации операционных таксономических единиц (ОТЕ) нуклеотидные последовательности анализировали пакетом программ SILVAngs 1.2 (порог кластеризации 97%) [38], последовательности классифицировали при помощи BLASTn (version 2.2.30+) со стандартными установками.
Филогенетическое дерево филотипов ФПЭ по области V4 гена 18S рРНК построено методом максимального правдоподобия программой RAxML 8.2.10 [42] с использованием эволюционной модели GTRGAMMA и 1000 бутстреп-реплик.
При использовании фракционной фильтрации в фильтратах помимо пикоформ регистрируются организмы нано- и микропланктона, что обусловлено разрушением нежных форм даже при самой мягкой фильтрации, прохождением через поры фильтра простейших с эластичной клеточной оболочкой, а также присутствием в воде пула растворенной ДНК разных размерных групп организмов [46]. Хотя фракционная фильтрация не дает полного отделения пикофракции от нано- и микроорганизмов, при метагеномном секвенировании она способствует снижению риска недоучета пикоформ из-за малого числа копий их генов [52]. В пикофракции планктона также присутствует значительное число гетеротрофных простейших [46]. Поскольку целью настоящего исследования являлись фотоавтотрофные пикоэукариоты, то для дальнейшего анализа из выявленных в фильтратах таксонов были отобраны только те виды фотоавтотрофов, размеры клеток которых не превышают 3 мкм. Также в случаях идентификации до уровня рода и выше в анализ включали таксоны, в состав которых согласно опубликованным данным [46] входят виды, соответствующие по размерам пикофракции.
РЕЗУЛЬТАТЫ
Абиотические факторы. Температура и соленость поверхностного слоя воды колебались в пределах от –0.9 до 2.8°С и от 33.0 до 27.3‰ соответственно. Минимальные значения температуры и максимальные значения солености отмечены на ст. 5642, расположенной в кутовой части залива Благополучия. По мере продвижения в сторону моря поверхностная температура воды повышается, соленость снижается и на ст. 5649 их значения достигают максимального для температуры и минимального для солености (табл. 1). Анализ спутниковых данных показал, что район исследований полностью был свободен ото льда к середине августа 2017 г.
Таблица 1.
Глубина станций (Н, м), глубина эвфотической зоны (ФС, м), значения температуры (То, °С), солености (Sо, psu), концентрации неорганических форм азота, фосфора и кремния (мкг-ат/л) в поверхностном слое, средние значения этих параметров в эвфотическом слое (ФС) на станциях залива Благополучия и Карском море
| Станция | Н, м | ФС, м | ПС | ФС | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Т | S | P-PO4 | Nнеорг | Si-SiO4 | T | S | P-PO4 | Nнеорг | Si-SiO4 | |||
| 5642 | 112 | 6 | –0.9 | 33.0 | 0.4 | 5.4 | 4.63 | –0.9 | 33.5 | 0.45 | 5.52 | 4.46 |
| 5644 | 125 | 17 | 1.3 | 29.9 | 0.19 | 1.86 | 5.06 | 0.3 | 28.3 | 0.31 | 3.78 | 3.82 |
| 5641_2 | 68 | 14 | 0.9 | 30.9 | 0.2 | 1.55 | 4.24 | –0.3 | 35.3 | 0.30 | 3.02 | 4.06 |
| 5649 | 313 | 13 | 2.8 | 27.3 | 0.1 | 0.59 | 8.42 | 2.7 | 30.9 | 0.13 | 0.40 | 6.78 |
Глубина эвфотического слоя (1% ФАР) в заливе Благополучия колебалась от 6 до 17 м (табл. 1), в Карском море на ст. 5649 составляла 13 м.
Биогенные элементы. В заливе концентрация минеральных форм азота и фосфора в поверхностных водах была выше, а кремния – ниже, чем в поверхностном слое ст. 5649 в Карском море (табл. 1.). На всей исследованной акватории с глубиной содержание кремния снижалось, а фосфора возрастало. Концентрация минерального азота в заливе Благополучия увеличивалась с глубиной, в Карском море снижалась.
Количественные показатели пикофитопланктона. ПФ был представлен эукариотными водорослями. Исключение составила ст. 5649 в Карском море, где в поверхностном горизонте были выявлены цианобактерии, численность и биомасса которых составили 0.02 × 109 кл/м3 и 0.01 мг С/м3 соответственно. В заливе в поверхностном горизонте численность и биомасса ФПЭ составляла в среднем 0.75 × 109 кл/м3 и 1.49 мг С/м3 соответственно. С глубиной обилие ФПЭ снижалось (рис. 2г, д). Только на ст. 5642 на глубине 20 м биомасса пиководорослей соответствовала значениям, выявленным для поверхностного горизонта (рис. 2г, 2д). В Карском море максимальные значения численности (2.29 × 109 кл/м3) и биомассы (2.76 мг С/м3) выявлены на горизонте 8 м (рис. 2г, 2д).
Рис. 2.
Вертикальное распределение общего хлорофилла (ХЛсум) (а), хлорофилла пикофракции (ХЛпик) (б), вклад пикофитопланктона в общий хлорофилл (вклад ХЛпик, %) (в), численности (Nпик, ×109 кл/м3) (г) и биомассы (Впик, мг С/м3) (д) и интегральная биомасса пикофитопланктона в ФС (Впик, мг С/м2) (е) в заливе Благополучия и на шельфе Карского моря.
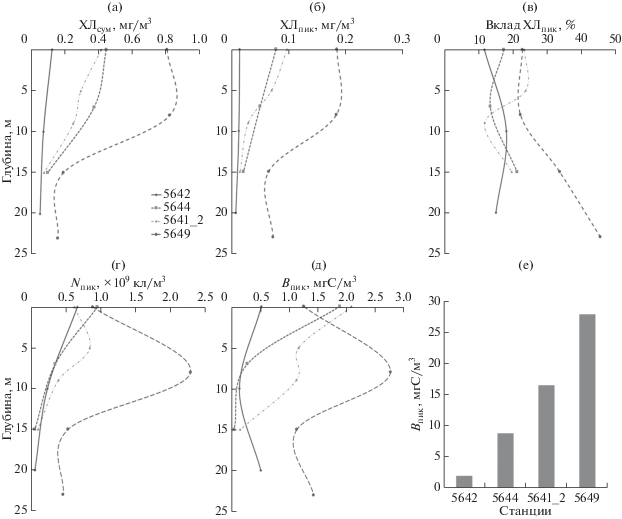
Интегральная биомасса пикофитопланктона в ФС возрастала по мере продвижения из кута залива в сторону шельфа и достигала наибольших значений на ст. 5649 Карского моря (рис. 2е).
Хлорофилл “a”. В заливе максимальные величины ХЛсум и ХЛпик отмечены в поверхностном горизонте (рис. 2а, 2б). Минимальные значения ХЛсум и ХЛпик выявлены в самой кутовой станции залива (ст. 5642), по мере продвижения в направлении от залива в сторону моря в поверхностном горизонте концентрации ХЛсум и ХЛпик возрастают, и наибольшие значения отмечены в Карском море на ст. 5649 (рис. 2). С глубиной на всех станциях залива ХЛсум и ХЛпик снижаются. В Карском море наибольшие концентрации ХЛсум и ХЛпик отмечены на горизонте 8 м. Вклад пикофракции в общий хлорофилл на станциях залива колебался от 12 до 24% и с глубиной существенно не менялся. В Карском море доля пикофитопланктона значительно возрастала с глубиной, достигая 46% на горизонте 23 м (рис. 2в).
Состав фотоавтотрофных пикоэукариот. Доля последовательностей ФПЭ в общем числе качественных прочтений пикофракции планктона как в заливе, так и в Карском море составила 8% (табл. 2). Число ОТЕ и выявленных таксонов в заливе и Карском море практически не различались (табл. 2).
Таблица 2.
Общее число прочтений (Rобщ), число качественных прочтений (rобщ), число прочтений ПФЭ (RФПЭ), число ОТЕ ПФЭ (ОТЕФПЭ) и число выявленных таксонов ПФЭ (ТФПЭ) на исследуемых станциях
| Станция | Rобщ | rобщ | RФПЭ | ОТЕФПЭ | ТФПЭ |
|---|---|---|---|---|---|
| 5642 | 396 507 | 150 341 | 12 398 | 200 | 22 |
| 5649 | 334 853 | 122 594 | 9592 | 197 | 23 |
Выявленные ОТЕ соответствовали таксонам, относящимся к четырем крупным филогенетическим группам, включающим 8 классов водорослей (табл. 3). По числу прочтений преобладали Chloroplastida, основной вклад на обеих станциях вносили представители класса Mamiellophyceae (табл. 3). В Карском море выявлены последовательности Trebouxiophyceae, в то время как представители Nephrophyceae и Pyramimonadophyceae не обнаружены. В заливе доля кокколитофорид существенно превышало таковую в Карском море (табл. 3).
Таблица 3.
Вклад различных таксонов в общее число прочтений в исследуемых пробах
| Таксономическая группа | % прочтений | ||
|---|---|---|---|
| ст. 5642 | ст. 5649 | ||
| Chloroplastida | Mamiellophyceae | 70.6 | 80.1 |
| Pyramimonadophyceae | 0.3 | – | |
| Nephrophyceae | 0.04 | – | |
| Trebouxiophyceae | – | 0.6 | |
| Stramenopile | Mediophyceae | 1.7 | 3.7 |
| Bolidophyceae | 5.7 | 4.4 | |
| Haptophyta | Coccolithophyceae | 21.4 | 10.3 |
| Cryptophyta | Cryptophyceae | 0.63 | 1.0 |
Наибольшим таксономическим разнообразием характеризовался класс Mamiellophyceae, в его составе выявлены представители родов Micromonas, Ostreococcus, Bathycoccus, Mantoniella, Mamiella, Crustomastix и Dolichomastix (табл. 4). Последовательности M. polaris и B. prasinos доминировали в общем числе прочтений пикоэукариот (RФПЭ), их вклад составил в среднем 36 и 16% соответственно.
Таблица 4.
Таксономическое разнообразие фотоавтотрофных пикоэукариот и их относительный вклад в общее число прочтений пикоформ (%) в исследованных пробах
| Таксон | № генбанка | Вклад, % | |
|---|---|---|---|
| 5642 | 5649 | ||
| Mamiellophyceae | |||
| Micromonas commoda | AY955010 | 1.2 | 5.3 |
| Micromonas clade F (В3) | MF589926 | – | 0.9 |
| Micromonas polaris | AY955000 | 60.9 | 26.3 |
| Bathycoccus prasinos | KT860937 | 3.5 | 39.1 |
| Ostreococcus tauri | AY329635 | – | 0.03 |
| Mantoniella squamata | X73999 | 2.8 | 5.9 |
| Mamiella gilva | FN562450 | 0.3 | 0.7 |
| Crustomastix sp. 1 | AB183628 | 0.1 | 0.1 |
| Crustomastix sp. 2 | HM997202 | 0.1 | 0.1 |
| Crustomastix sp. 3 | EU143396 | – | 0.03 |
| Dolichomastix tenuilepis | FN562449 | – | 0.5 |
| uncultured eukaryote | AB275081, AB275082, KT813127, KT814943, KT813974, KT816190, FN690721 | 1.7 | 1.2 |
| Coccolithophyceae | |||
| Phaeocystis pouchetii | KR091066 | 13.7 | 1.9 |
| Phaeocystis sp. | JX660765 | 0.4 | 0.3 |
| Chrysochromulina leadbeateri | AM491017 | 0.5 | 0.5 |
| Chrysochromulina sp. 1 | JF698782 | 1.4 | 0.3 |
| Chrysochromulina andersonii | AB180202 | 0.9 | 0.3 |
| uncultured haptophyte | JX680347, JX680441, KR338747, JX680404, JX680362, JX680340, JX680402, KR338713, KC488450, KY980263, JX680365, | 3.6 | 4.0 |
| uncultured eukaryote | KF129994, KF129692, HQ868612, HQ868969, HQ865286, KT812269, KT814416, KF130564, KR338515, MH914749, HQ868491 | 0.9 | 3.1 |
| Trebouxiophyceae | |||
| Nannochloris sp. | LC189144 | – | 0.6 |
| Picochlorum sp. | KT860890 | – | 0.03 |
| Pyramimonadophyceae | |||
| Pyramimonas sp. | JN934670 | 0.06 | – |
| uncultured eukaryote | KT815183, KT813749 | 0.2 | – |
| Nephrophyceae | |||
| Nephroselmis pyriformis | JN934688 | 0.04 | – |
| Mediophyceae | |||
| Minidiscus trioculatus | FJ590769 | 0.5 | 0.06 |
| Skeletonema marinoi | KR091067 | 0.08 | 0.08 |
| Skeletonema sp. 1 | JF698740 | 0.2 | 0.08 |
| Chaetoceros sp. 1 | KJ866910 | 0.4 | 3.4 |
| Chaetoceros cf. socialis | KX253957 | 0.2 | – |
| Chaetoceros sp. 2 | LC189089 | 0.2 | – |
| uncultured eukaryote | KC771196 | 0.1 | 0.04 |
| Bolidophyceae | |||
| Triparma strigata | KR998402 | 0.4 | 0.8 |
| uncultured bolidophyte | MF407361–MF407363, MF407365, MF407370, MF407373, MF407382, MF407391, MF407394–MF407396, MF589909, LC191048, | 4.72 | 2.5 |
| uncultured eukaryote | DQ062503, MK004502, KT816802, KT816497, HQ868963 | 1.75 | 1.94 |
| uncultured stramenopiles | FN690655 | 0.03 | – |
| Cryptophyceae | |||
| uncultured eukaryote | KJ763263, KT814465, JQ955905 | 0.63 | 1.0 |
Средний вклад представителей двух классов – Bolidophyceae и Mediophyceae, относящихся к группе Stramenopila, совокупно составил 8% RПФЭ. Класс Bolidophyceae был представлен родом Triparma, класс Mediophyceae – родами Chaetoceros, Skeletonema и Minidiscus. Среди Haptophyta идентифицированы последовательности класса Coccolithophyceae, относящиеся к двум родам – Phaeocystis и Chrysochromulina. Относительный вклад представителей каждого рода составил в среднем 8 и 2% RПФЭ соответственно. Класс Pyramimonadophyceae был представлен родом Pyramimonas, класс Trebouxiophyceae – родами Nannochloris и Picochlorum, класс Nephrophyceae – родом Nephroselmis. Доля представителей каждого рода не превышала 1% от общего числа RПФЭ.
Проведенный филогенетический анализ показал, что часть последовательностей, идентифицированная по базе NCBI как некультивируемые организмы, относилась к классам Mamiellophyceae, Coccolithophyceae, Pyramimonadophyceae, Mediophyceae, Bolidophyceae и Cryptophyceae (рис. 3).
Рис. 3.
Филогенетическое дерево филотипов ФПЭ, построенное по области V4 гена 18S рРНК методом максимального правдоподобия. Приведены бутстреп-значения поддержки узлов ≥50%. Жирным шрифтом отмечены филотипы, определенные до вида.
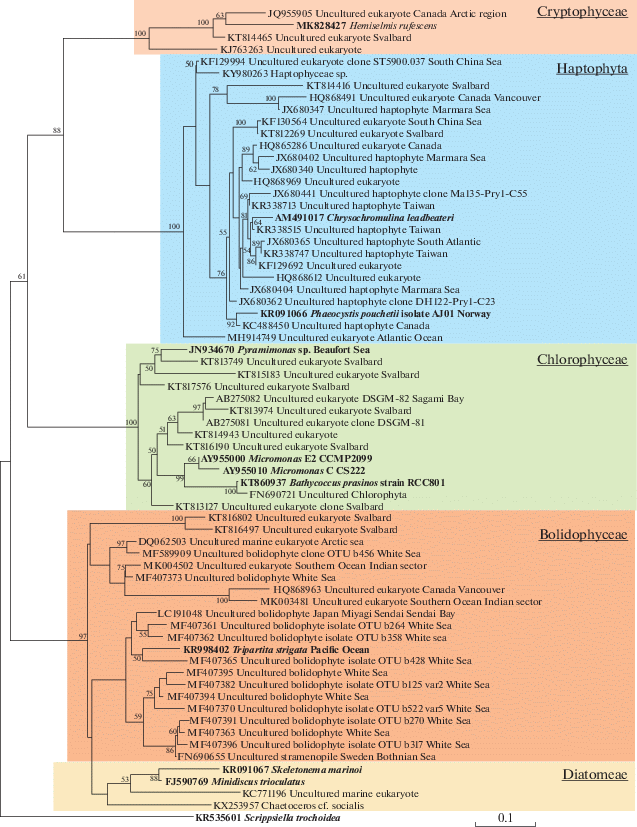
Общими для залива и Карского моря оказались 17 филотипов водорослей, относящихся к 11 родам (табл. 4). Некоторые виды, а также таксоны, идентифицированные до уровня рода и выше рангом, были выявлены только на одной из станций (табл. 4).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
В настоящей работе впервые охарактеризованы видовой состав ФПЭ, пространственное распределение численности, биомассы и содержания хл “a” ПФ, а также вклада пикоформ в суммарное содержание хлорофилла в заливе Благополучия и прилегающем шельфе Карского моря.
Обилие ПФ было невысоким. Средние значения численности и биомассы в заливе были более чем на порядок ниже таковых в северо-западном районе моря в сентябре 2011 г. (5.0 × 109 кл/м3, 1.8 мг С/м3) [6]. На ст. 5649 Карского моря биомасса была в два раза меньше, чем в северо-западном районе море в сентябре 2011 г. Наибольшая величина интегральной биомассы пикофитопланктона в слое 0–25 м в 2017 г. (ст. 5649, 41.3 мг С/м2) была в два раза ниже таковой в 2011 г. (83.1 мг С/м2). В заливе пикофракция фитопланктона была представлена исключительно эукариотами, в то время как в Карском море (ст. 5649) в поверхностном горизонте выявлены цианобактерии, их вклад в суммарную биомассу пикоформ был незначителен и не превышал 1%. Существенно более низкую биомассу цианобактерий по сравнению с эукариотами вплоть до полного их отсутствия отмечали во многих районах Арктики [14, 33, 45]. Согласно опубликованным данным в исследуемом районе Карского моря регулярно регистрируют поверхностную распресненную “линзу”, формирующуюся паводком рек Оби и Енисея [3, 7]. Пониженное значение солености верхнего 8–10-метрового слоя воды, а также более высокие значения концентрации кремния – показателя степени распреснения поверхностных вод, в исследуемом районе Карского моря по сравнению с заливом Благополучия может быть обусловлено остатками пресных вод “линзы”, которые постепенно смешиваются с солеными морскими водами. В полярных водах пикоцианобактерии представлены преимущественно видами рода Synechococcus, которые являются либо автохтонными [35], либо аллохтонными формами [15, 35, 48]. Ранее было показано, что в центральной части Карского моря пикоцианобактерии имеют автохтонное происхождение и основным источником их поступления является речной сток [2]. Таким образом, можно предположить, что выявленные цианобактерии в поверхностном слое Карского моря являются пресноводными формами, вносимыми речным стоком.
Концентрация ХЛсум в верхнем 50-метровом слое в заливе (4.74 мг/м2) была в 4 раза ниже, чем в сентябре 2013 г. (22.25 мг/м2), и в 2 раза ниже, чем в августе 2014 г. (11.80 мг/м2) [1]. Значение ХЛсум в фотическом слое Карского моря (9.52 мг/м2) соответствовало среднему значению этого параметра, полученному в этом районе в сентябре 2007 г. (11.40 мг/м2) [4].
Пределы колебания вклада пикофракции в суммарное содержание хл “а” в заливе (12–24%) соответствовали таковым во внешнем эстуарии реки Оби и прилегающем шельфе (4–23%) [2]. В Карском море доля пикофитопланктона была выше, что согласуется с данными, полученными ранее для западной части Карского моря, где отмечены более высокие величины вклада пикоформ в содержание хлорофилла – до 54% [2]. Согласно опубликованным данным, пикоформы могут вносить существенный вклад не только в содержание пигментов и биомассу фитопланктона, но и в его функциональные показатели. Так в северной части Карского моря в сентябре 2013 г. вклад мелкоклеточного (<5 мкм) фитопланктона в потребление СО2 варьировал от 34 до 69%, нитратов – от 56 до 89%, аммония – от 45 до 76% [14].
Как и во многих арктических районах [21, 30, 51], в заливе Благополучия и Карском море среди ФПЭ преобладали Chloroplastida. Наибольшее число прочтений принадлежало видам Micromonas polaris и Bathycoccus prasinos. M. polaris относится к арктическим видам, максимальное его обилие выявлено в районах с температурой воды около 0°C. Доминирование M. polaris ранее было отмечено в пикофракции летнего планктона моря Боффорта [10], в проливе Фрама его вклад в число последовательностей класса Mamiellophyceae достигал 66% [44]. В свою очередь B. prasinos относится к видам с широким ареалом распространения, последовательности B. prasinos выявлены как в тропических, так и полярных водах [44]. Высокий вклад B. prasinos согласуется с фактом приуроченности наибольшего обилия этого космополитного вида к прибрежным водам [46].
Филотипы Trebouxiophyceae выявлены только в Карском море и соответствовали родам Nannochloris и Picochlorum. Представители этих родов относятся как к пресноводным, так и солоноватоводным и морским видам. В холодных и соленых водах залива Благополучия Trebouxiophyceae полностью отсутствовали, в Карском море доля последовательностей этого класса водорослей была невысока. Учитывая, что воды в исследуемом районе моря могут иметь речное происхождение, можно предположить, что представители выявленных родов Nannochloris и Picochlorum относятся к пресноводным или солоноватоводным видам.
Относительно высокий вклад последовательностей Haptophyta в водах залива Благополучия, в частности Phaeocystis pouchetii, согласуется с регистрацией высокого обилия этого таксона в пикопланктоне атлантического сектора Арктики [30]. В Карском море доля Haptophyta была существенно ниже, что возможно связано с присутствием более пресных вод в этом районе. Положительная связь между числом прочтений Haptophyta и соленостью выявлено в проливе Скагерра́к, Северное море [17]. Часть ОТЕ Haptophyta не кластеризовалось с ОТЕ известных культивируемых видов, а относилась к некультивируемым гаптофитам и некультивируемым эукариотам. Последовательности этих некультивируемых организмов были ранее выделены из вод северной части Тихого океана, северной Атлантики, Мраморного и Южно-Китайского моря, а также Баренцева моря [27, 34, 41, 50].
Среди Bolidophyceae в составе пикофракции планктона доминировали некультивируемые болидофитовые водоросли, последовательности которых были выявлены во льду, подледной воде и летнем планктоне Белого моря [13]. Единственный представитель Bolidophyceae идентифицированный до вида – Triparma strigata, относится к холодолюбивым видам и не встречается в планктоне при температуре более 10°С [19, 20].
Диатомея Minidiscus trioculatus является широко распространенным видом и в ряде случаев достигает значительной численности [46]. Учитывая незначительное число выявленных прочтений M. trioculatus, а также тот факт, что ранее в планктоне Карского моря эта водоросль не была идентифицирована, ее следует отнести к редким видам карского планктона. Число прочтений диатомеи Skeletonema marinoi также было невысоким. Однако это обусловлено тем, что размер колоний Skeletonema превышает 3 мкм, и в пикофракцию попадают только отдельные клетки. В фитопланктоне юго-западной части Карского моря отмечена Skeletonema, ранее идентифицированная как S. costatum [5]. Настоящее исследование позволяет расширить список видов этого рода, входящих в состав фитопланктона Карского моря. Это первая регистрация S. marinoi в планктоне Карского моря.
Среди Cryptophyceae отсутствуют виды, имеющие размеры клеток <3 µm, за исключением водоросли Hillea marina [46], однако в генбанке NCBI последовательность данного вида отсутствует. Включение в анализ последовательностей криптофитовых водорослей обусловлено тем, что ранее Cryptophyceae регистрировались в пикофракции планктона при использовании фракционной фильтрации [26, 46]. Проведенный нами филогенетический анализ показал, что в летнем пикофитопланктоне Карского моря и залива Благополучия могут присутствовать криптофитовые водоросли. Однако уверенно утверждать, что выявленные ОТЕ относятся к пикофракции, а также являются фототрофными криптофитовыми водорослями, возможно только после выделения этих таксонов в культуру и их описания.
Таким образом, нами впервые дана оценка биомассы планктонных фотосинтезирующих пикоформ и их вклада в общее содержание хл “a” в заливе Благополучия архипелага Новая Земля. Выявленные значения оказались ниже, чем в западной части Карского моря, где пикофитопланктон играл существенную роль. Впервые получены данные по таксономическому составу пиководорослей в Карском море. Метагеномный анализ выявил представителей восьми классов водорослей, относящихся к 17 родам. В составе сообществ присутствовали как арктические виды, например, Micromonas polaris, так и виды космополиты – Bathycoccus prasinos, Skeletonema marinoi. Разнообразие пикофитопланктона в заливе Благополучия и Карском море определялось гидрологией районов – в менее соленых водах Карского моря вследствие разбавления их речными водами в пикофракции планктона выявлены цианобактерии и таксоны эукариотических водорослей, имеющие в своем составе солоноватоводные и пресноводные формы. Подчеркнем, что исследования были проведены в осенний период и только на четырех станциях. Для планктонных пикоавтотрофов характерна выраженная пространственно-временнáя изменчивость состава и обилия [22, 26, 43, 49]. Для полной оценки таксономического состава ФПЭ необходимы исследования с использованием молекулярных методов в другие периоды и в других районах моря.
Благодарности. Авторы благодарят П.Н. Маккавеева и С.А. Щуку за предоставленные материалы по гидрофизике и гидрохимии.
Источник финансирования. Работа выполнена в рамках Государственных заданий МГУ им. М.В. Ломоносова часть 2 (тема №АААА–А16–116021660052–0 и АААА-А17-117120540067-0), экспедиционные исследования выполнены при финансовой поддержке РФФИ (проект № 18–05–60069 Арктика), обработка и анализ полученных результатов – РФФИ (проект № 19–05–00026а).
Список литературы
Амелина А.Б., Дриц А.В., Сергеева В.М. и др. Зоопланктон заливов архипелага Новая Земля: состав, распределение, роль в выедании фитопланктона и биоседиментации // Океанология. 2018. Т. 58. № 6. С. 908–922.
Белевич Т.А., Ильяш Л.В., Демидов А.Б., Флинт М.В. Распределение пикофитопланктона на Обском разрезе и в западной части Карского моря // Океанология. 2019. Т. 59. № 6. С. 964–973.
Зацепин А.Г., Завьялов П.О., Кременецкий В.В. и др. Поверхностный опресненный слой в Карском море // Океанология. 2010. Т. 50. № 5. С. 698–708.
Мошаров С.А. Распределение первичной продукции и хлорофилла “а” в Карском море в сентябре 2007 г. // Океанология. 2010. Т. 50. № 6. С. 933–941.
Суханова И.Н., Флинт М.В., Сергеева В.М., Кременецкий В.В. Фитопланктон юго-западной части Карского моря // Океанология. 2011. Т. 51. № 6. С. 1039–1053.
Суханова И.Н., Флинт М.В., Дружкова Е.И. и др. Фитопланктон северо-западной части Карского моря // Океанология. 2015. Т. 55. № 4. С. 605–619.
Суханова И.Н., Флинт М.В., Сергеева В.М. Фитопланктон поверхностной опресненной линзы Карского моря // Океанология. 2012. Т. 52. № 5. С. 688–699.
Agawin N.S.R., Duarte C.M., Agusti S. Nutrient and temperature control of the contribution of picoplankton to phytoplankton biomass and production // Limnol. Oceanogr. 2000. V. 45. № 8. P. 1891–1899.
Arar E.J., Collins G.B. Method 445.0. in vitro determination of chlorophyll “a” and pheophytin “a” in marine and freshwater algae by fluorescence. Revision 1.2. Cincinnati: U.S. Environmental Protection Agency. 1997. 22 p.
Balzano S., Marie D., Gourvil P., Vaulot D. Composition of the summer photosynthetic pico and nanoplankton communities in the Beaufort Sea assessed by T-RFLP and sequences of the 18S rRNA gene from flow cytometry sorted samples // ISME J. 2012. V. 6. № 8. P. 1480–1498.
Belevich T.A., Ilyash L.V., Milyutina I.A. et al. Metagenomic Analyses of White Sea Picoalgae: First Data // Biochemistry. 2015. Vol. 80. № 11. P. 1514–1521.
Belevich T.A., Ilyash L.V., Milyutina I.A. et al. Phototrophic Picoeukaryotes of Onega Bay, the White Sea: Abundance and Species Composition // Moscow Univ. Biol. Sci. Bull. 2017. V. 72. № 3. P. 109–114.
Belevich T.A., Ilyash L.V., Milyutina I.A. et al. Metagenomics of Bolidophyceae in plankton and ice of the White Sea // Biochemistry. 2017. V. 82. № 6. P. 1917–1928.
Booth B.C., Horner R.A. Microalgae on the Arctic Ocean Section, 1994: species abundance and biomass // Deep-Sea Res. II. 1997. V. 44. № 8. P. 1607–1622.
Cottrell M.T., Kirchman D.L. Photoheterotrophic microbes in the arctic ocean in summer and winter // A-ppl. Environ. Microbiol. 2009. V. 75. № 15. P. 4958–4966.
Demidov A.B., Kopelevich O.V., Mosharov S.A. et al. Modelling Kara Sea phytoplankton primary production: development and skill assessment of regional algorithms // J. Sea Res. 2017. V. 125. P. 1–17.
Egge E.S., Johannessen T.V., Andersen T. et al. Seasonal diversity and dynamics of haptophytes in the Skagerrak, Norway, explored by high-throughput sequencing // Molecular Ecology. 2015. 24. P. 3026–3042.
Hansen H.P., Koroleff F. Determination of nutrients // Methods of seawater analysis. 3d, Completely Revised and Extended Edition / Eds. Grashoff K. et al. Wiley-VCH, Weinheim, NewYork, Chichester, Brisbane, Singapore, Toronto. 1999. P. 149–228.
Ichinomiya M., Kuwata A. Seasonal variation in abundance and species composition of the Parmales community in the Oyashio region, western North Pacific // Aquat. Microb. Ecol. 2015. V. 75. № 3. P. 207–223.
Ichinomiya M., Lopes dos Santos A., Gourvil P. et al. Diversity and oceanic distribution of the Parmales (Bolidophyceae), a picoplanktonic group closely related to diatoms // ISME J. 2016. V. 10. № 10. P. 2419–2434.
Kilias E.S., Noethig E-M., Wolf C., Metfies K. Picoeukaryote plankton composition off West Spitsbergen at the entrance to the Arctic ocean // J. Eukaryot. Microbiol. 2014. V. 61. № 6. P. 569–579.
Kilias E., Wolf C., Nothig E.M. et al. Protist distribution in the western Fram Strait in summer 2010 based on 454-pyrosequencing of 18S rDNA // J. Phycol. 2013. V. 49. № 5. P. 996–1010.
Kirkham A.R., Lepère C., Jardillier L.E. et al. A global perspective on marine photosynthetic picoeukaryote community structure // ISME J. 2013. V. 7. № 5. P. 922–936.
Li W.K.W., Carmack E.C., McLaughlin F. et al. Space-for-time substitution in predicting the state of picoplankton and nanoplankton in a changing Arctic Ocean // J. Geophys. Res. Oceans. 2013. V. 118. № 10. P. 5750–5759.
Lovejoy C., Vincent W.F., Bonilla S. et al. Distribution, phylogeny, and growth of cold-adapted picoprasinophytes in arctic seas // J. Phycol. 2007. V. 43. № 1. P. 78–89.
Majaneva M., Rintala J.M., Piisila M. et al. Comparison of wintertime eukaryotic community from sea ice and open water in the Baltic Sea, based on sequencing of the 18S rRNA gene // Polar Biol. 2012. V. 35. № 6. P. 875–889.
Marquardt M., Vader A., Stubner E.I. et al. Strong Seasonality of Marine Microbial Eukaryotes in a High-Arctic Fjord (Isfjorden, in West Spitsbergen, Norway) // Appl. Environ. Microbiol. 2016. V. 82. № 6. P. 1868–1880.
McLaughlin F. A., Carmack E. C. Deepening of the nutricline and chlorophyll maximum in the Canada Basin interior, 2003-2009 // Geophys. Res. Lett. 2010. V. 37. L24602. https://doi.org/10.1029/2010GL045459
Menden–Deuer S., Lessard E.J. Carbon to volume relationships for dinoflagellates, diatoms, and other protist plankton // Limnol. Oceanogr. 2000. V. 45. № 3. P. 569–579.
Metfies K., von Appen W-J., Kilias E. et al. Biogeography and photosynthetic biomass of arctic marine picoeukaryotes during summer of the record sea ice minimum 2016 // PLoS ONE. 2016. Vol. 11. № 2. P. 1–20.
Moon-van der Staay S.Y., De Wachter R., Vaulot D. Oceanic 18S rDNA sequences from picoplankton reveal unsuspected eukaryotic diversity // Nature. 2001. V. 409. P. 607–610.
Moreira-Turcq P.F., Cauwet G., Martin J.M. Contribution of flow cytometry to estimate picoplankton biomass in estuarine systems // Hydrobiologia. 2001. V. 462. № 1–3. P. 157–168.
Not F., Massana R., Latasa M. et al. Late summer community composition and abundance of photosynthetic picoeukaryotes in Norwegian and Barents Seas // Limnol Oceanogr. 2005. V. 50. № 5. P. 1677–1686.
Orsi W., Song Y.C., Hallam S., Edgcomb V. Effect of oxygen minimum zone formation on communities of marine protists // ISME J. 2012. V. 6. № 8. P. 1586–601.
Paulsen M.L., Doré H., Garczarek L., Seuthe L. et al. Synechococcus in the Atlantic Gateway to the Arctic Ocean // Front. Mar. Sci. 2016. V. 3. № 191. P. 191–205.
Peterson B.J., McClelland J., Curry R. et al. Trajectory shifts in the Arctic and subarctic freshwater cycle // Science. 2006. V. 313. P. 1061–1066.
Polyak L., Alley R.B., Andrews J.T. et al. History of sea ice in the Arctic // Quatern. Sci. Rev. 2010. V. 29. P. 1757–1778.
Quast C., Pruesse E., Yilmaz P. et al. The SILVA ribosomal RNA gene database project: improved data processing and web-based tools // Nucleic Acids Res. 2013. V. 41. № D1. P. D590–D596.
Ribeiro C.G., Dominique M.D., dos Santos A.L. et al. Estimating microbial populations by flow cytometry: Comparison between instruments // Limnol. Oceanogr: Methods. 2017. V. 14. № 11. P. 750–758.
Schloss P.D., Westcott S.L., Ryabin T. et al. Introducing mothur: open-source, platform-independent, community-supported software for describing and comparing microbial communities // Appl. Environ. Microbiol. 2009. V. 75. № 23. P. 7537–7541.
Simon M., López-García P., Moreira D., Jardillier L. New haptophyte lineages and multiple independent colonizations of freshwater ecosystems // Environ. Micro-biol. Rep. 2013. V. 5. № 2. P. 322-32.
Stamatakis A. RAxML version 8: a tool for phylogenetic analysis and post-analysis of large phylogenies // Bioinformatics. 2014. V.30. P. 1312–1313.
Terrado R., Scarcella K., Thaler M. et al. Small phytoplankton in Arctic seas: vulnerability to climate change // Biodiversity. 2013. V. 14. № 1. P. 2–18.
Tragin M., Vaulot D. Novel diversity within marine Mamiellophyceae (Chlorophyta) unveiled by metabarcoding // Sci. Rep. 2019. 9: 5190. https://doi.org/10.1038/s41598-019-41680-6
Tremblay G., Belzile C., Gosselin M. et al. Late summer phytoplankton distribution along a 3500 km transect in Canadian Arctic waters: strong numerical dominance by picoeukaryotes // Aquat. Microb. Ecol. 2009. V. 54. P. 55–70.
Vaulot D., Eikrem W., Viprey M., Moreau H. The diversity of small eukaryotic phytoplankton (≤3 mm) in marine ecosystems // FEMS Microb. Rev. 2008. V. 32. № 5. P. 795–820.
Verity P.G., Robertson C.Y., Tronzo C.R. et al. Relationship between cell volume and the carbon and nitrogen content of marine photosynthetic nanoplankton // Limnol. Oceanogr. 1992. V. 37. № 7. P. 1434–1446.
Waleron M., Waleron K., Vincent W.F., Wilmotte A. Allochthonous inputs of riverine picocyanobacteria to coastal waters in the Arctic Ocean // FEMS Microbiol. Ecol. 2007. V. 59. № 2. P. 356–365.
Worden A.Z. Picoeukaryote diversity in coastal waters of the Pacific Ocean // Aquat. Microb. Ecol. 2006. V. 43. P. 165–175.
Wu W., Huang B., Liao Y., Sun P. Picoeukaryotic diversity and distribution in the subtropical-tropical South China Sea // FEMS Microbiol. Ecol. 2014. V. 89. № 3. P. 563–79.
Zhang F., He J., Lin L., Jin H. Dominance of picophytoplankton in the newly open surface water of the central Arctic Ocean // Polar Biol. 2015. V. 38. № 7. P. 1081–1089.
Zhu F., Massana R., Not F. et al. Mapping of picoeucaryotes in marine ecosystems with quantitative PCR of the 18S rRNA gene // FEMS Microbiol. Ecol. 2005. V. 52. № 1. P. 79–92.
Дополнительные материалы отсутствуют.