Океанология, 2020, T. 60, № 4, стр. 528-544
Фитопланктон желоба св. Анны: влияние абиотических факторов
В. М. Сергеева 1, *, И. Н. Суханова 1, М. В. Флинт 1, А. А. Полухин 1, В. В. Кременецкий 1, А. В. Федоров 1, Е. Г. Сахарова 2, Е. Ю. Георгиева 3, Е. К. Ланге 1, С. А. Щука 1
1 Институт океанологии им. П.П. Ширшова РАН
Москва, Россия
2 Институт морских биологических исследований
им. А.О. Ковалевского РАН
Севастополь, Россия
3 Институт биологии внутренних вод им. И.Д. Папанина РАН
Ярославская обл., пос. Борок, Россия
* E-mail: vsergeeva@gmail.com
Поступила в редакцию 20.11.2018
После доработки 11.03.2020
Принята к публикации 08.04.2020
Аннотация
Материалы собраны в сентябре 2015 г. и июле–августе 2016 г. в районе желоба Святой Анны на севере Карского моря. На основе распределения солености и температуры выделены 4 области: шельф, прилегающий к желобу Св. Анны; бровка шельфа; верхняя и нижняя части континентального склона. Изменчивость структуры фитопланктонных сообществ проанализирована в связи с условиями среды в выделенных областях. Показано, что изменения видовой структуры фитопланктона в большей степени связаны с сезонными перестройками в сообществе, чем с влиянием на район речного стока и вод баренцевоморского и атлантического происхождения. В шельфовой области присутствие баренцевоморских зимних вод приводило к увеличению числа видов ранневесенних диатомей и возрастанию обилия ранне- и поздневесенних видов диатомовых. Увеличение численности и биомассы фитопланктона и изменения их вертикального распределения в середине июля– начале августа происходили на фоне влияния на район вод баренцевоморского и атлантического происхождения; в начале сентября – опреснения верхнего слоя под воздействием речного стока.
ВВЕДЕНИЕ
Исследования биологических процессов в области континентального склона арктических морей вызывают все больший интерес. Это вызвано относительно высокой продуктивностью этих районов и разнообразием биотопических условий на сравнительно небольшой по площади акватории, которое возникает под влиянием взаимодействия вод разного происхождения [13, 28]. В желобе Св. Анны взаимодействие опресненных шельфовых вод Карского моря, трансформированных атлантических и баренцевоморских вод, вместе с интенсивным присклоновым течением, формирует в широтном направлении на расстоянии менее 200 км сложную систему биотопов, разделенных хорошо выраженными фронтальными зонами [1, 2]. В предыдущих исследованиях было показано, что в разные годы в конце вегетационного сезона (вторая половина сентября) в западном и восточном отрогах желоба Св. Анны значительное – до в 1.5–3 раз увеличение численности и биомассы планктонных водорослей было приурочено к зонам максимальных горизонтальных градиентов гидрофизических характеристик во фронтальных зонах [6, 9]. В более ранний сезон – в конце августа исследования проводились только в восточном отроге желоба при менее выраженных пространственных градиентах температуры и солености. Увеличение численности и биомассы фитопланктона в это время определялось обилием ранневесенних диатомей в недавно освободившихся ото льда областях склона желоба Св. Анны [6].
Настоящая работа посвящена исследованию пространственной и временной изменчивости видового состава и обилия фитопланктона в западном отроге желоба Св. Анны во второй половине вегетационного сезона (в июле, августе и сентябре) и выявлению абиотических факторов среды, влияющих на изменения в структуре фитопланктонного сообщества.
РАЙОН ИССЛЕДОВАНИЙ, МАТЕРИАЛЫ И МЕТОДЫ
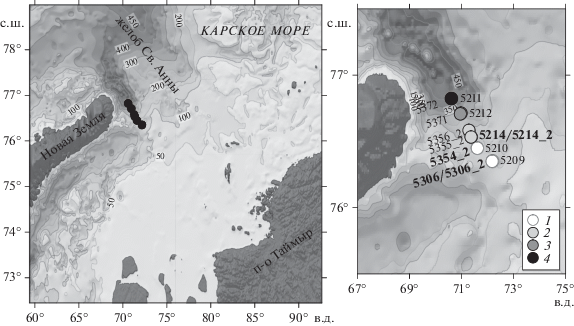
Работа основана на материале, собранном в течение двух периодов – в сентябре 2015 г. и июле– августе 2016 г. соответственно, в 63-м и 66-м рейсах на НИС “Академик Мстислав Келдыш”. Основной объем наблюдения был выполнен на квазимеридиональном разрезе в области желоба Св. Анны от прилежащего к желобу шельфа Карского моря в глубоководную часть (рис. 1). Разрезы был выполнен 2–3 сентября 2015 г. и 5 августа 2016 г. в пределах координат по широте 76°20.95′– 76°49.43′ с.ш. и долготе 70°36.35′–72°11.74′ в.д. Кроме этого в области кромки шельфа 3 и 23 сентября 2015 г. (станции 5214 и 5214_2) и на прилежащем к желобу шельфе 17 и 29 июля и 5 августа 2016 г. (станции 5306, 5306_2, 5354) были выполнены повторные гидрофизические наблюдения и сборы фитопланктона.
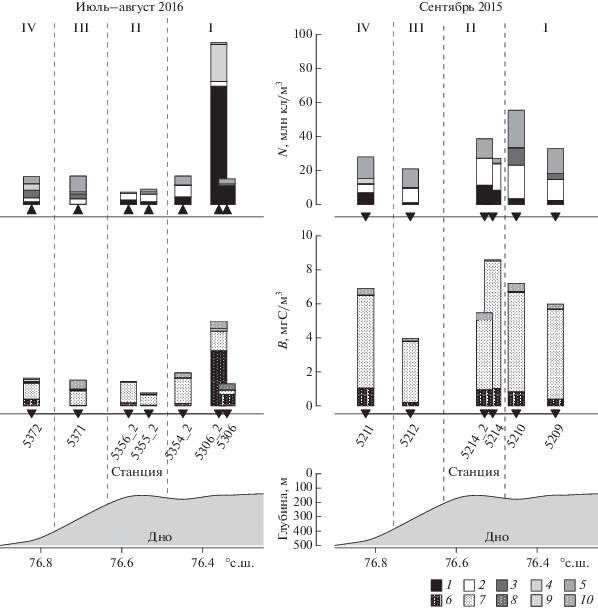
Рис. 1.
Район исследований и расположение станций. Выделенные области: 1 – шельф, прилегающий к желобу Св. Анны; 2 – бровка шельфа; 3 – верхняя часть континентального склона желоба Св. Анны; 4 – нижняя часть континентального склона желоба Св. Анны. Жирным выделены станции с повторами 5214 и 5214_2 (2015 г.) – через 20 суток, 5306, 5306_2 и 5354_2 (2016 г.) – через 12 и 7 суток.
Пробы для анализа фитопланктона отбирали 5–30 л батометрами Нискина комплекса SBE-32c, ассоциированного с CTD-зондом SeaBird 911. На каждой станции отбор проб фитопланктона проводили с 4–6-ти горизонтов, из разных слоев водного столба, выбранных в соответствии с вертикальным распределением солености, температуры и флуоресценции. Пробы отбирали в поверхностном слое на глубине 1–2 м, из слоев над и под пикноклином, в пикноклине или/и слое максимума флуоресценции, в слое температурного минимума и в квазиоднородном нижнем слое. В сентябре 2015 г. было отобрано 30 проб с 6-ти станций, в июле–августе 2016 г. – 36 проб с 7-ми станций.
Пробы воды объемом 2 л концентрировали при помощи камеры обратной фильтрации через лавсановый фильтр с диметром пор 1 мкм до 50–70 мл [8]. Обработка нефиксированных проб была выполнена в течение 2-х дней после отбора на судне, с использованием люминесцентных и световых микроскопов Jena Lumar и Leica. Для учета редких видов водорослей пробы фиксировали нейтральным раствором формалина (конечная концентрация 0.5–1%) и декантировали до 20–30 мл. Подсчет клеток и биомассы фитопланктона проводили по стандартным методикам, принятым в ИО РАН. Они подробно изложены в предыдущих публикациях [9]. Сырая биомасса (объем) водорослей рассчитывалась на основе принципа сходства формы клеток определенным геометрическим фигурам. Пересчет сырой биомассы в единицы углерода выполнен по аллометрическим зависимостям [21]. При анализе численности и биомассы фитопланктона не учитывали группу мелких таксономически неопределенных флагеллят <6 мкм.
Сходство таксономического состава оценивали на основании коэффициента Сёренсена-Чекановского [17], рассчитанного по формуле:
Для определения концентрации хлорофилла “а” (хл “а”) использовали стандартную методику [29]. Флуоресценцию экстрактов измеряли на флуориметре Trilogy Turner Designs (США), дальнейший расчет концентрации хл “а” и феофитина производили, используя стандартные зависимости [19].
В работе были использованы данные по ледовому покрытию (со спутника MODIS: ladsweb.nascom.nasa.gov), а также данные по концентрации биогенных элементов, вертикальному распределению температуры и солености, полученные параллельно с отбором фитопланктонных проб.
РЕЗУЛЬТАТЫ
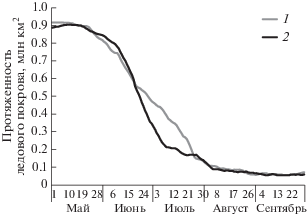
Гидрологические особенности района. Анализ спутниковых данных показал разную динамику отступления сезонного льда в Карском море в 2015 и 2016 гг. (рис. 2). В 2015 г. постепенное освобождение акватории ото льда началось в конце мая, и к концу июля плотный ледовый покров наблюдался лишь в восточной части бассейна восточнее 72° в.д. Ко времени наших работ (начало сентября) акватория Карского моря была свободна ото льда. В 2016 г. быстрое отступление льда началось в середине июня, и к середине июля и началу работ плотный ледовый покров наблюдался лишь восточнее 85° в.д. Эти данные свидетельствуют о том, что скорость отступления льда в Карском море в 2016 г. была выше, чем в 2015 г., и к началу исследований в области западного отрога желоба Св. Анны ледовая обстановка была сходной в середине июля 2016 г. и в начале сентября 2015 г. Во второй половине июля–начале августа 2016 г. температура верхнего слоя моря колебалась от +2.8 до +4.5°С. В сентябре 2015 г. верхний слой был прогрет до +3.6°С…+7°С.
Рис. 2.
Скорость отступления сезонного ледового покрова в Карском море: 1 – в 2015 и 2 – 2016 гг. по данным [18].
Особенности распределения солености и температуры на разрезах, выполненных в начале августа 2016 г. и начале сентября 2015 г. (рис. 3), позволили, как и в предыдущем исследовании [6], выделить 4 области с характерными гидрофизическими характеристиками: I – шельф, прилегающий к желобу Св. Анны; II – бровка шельфа; III – верхняя часть склона желоба Св. Анны; IV – нижняя часть склона желоба.
Рис. 3.
Распределение вдоль центрального отрога желоба Св. Анны (а) солености, (б) температуры в июле–августе 2016 г.; (в) солености (г) температуры в сентябре 2015 г. Пунктирные линии обозначают условные границы между выделенными областями: I – прилежащей к желобу Св. Анны шельф Карского моря, II – кромка шельфа, III – верхняя часть континентального склона желоба Св. Анны, IV – нижняя часть континентального склона желоба Св. Анны.
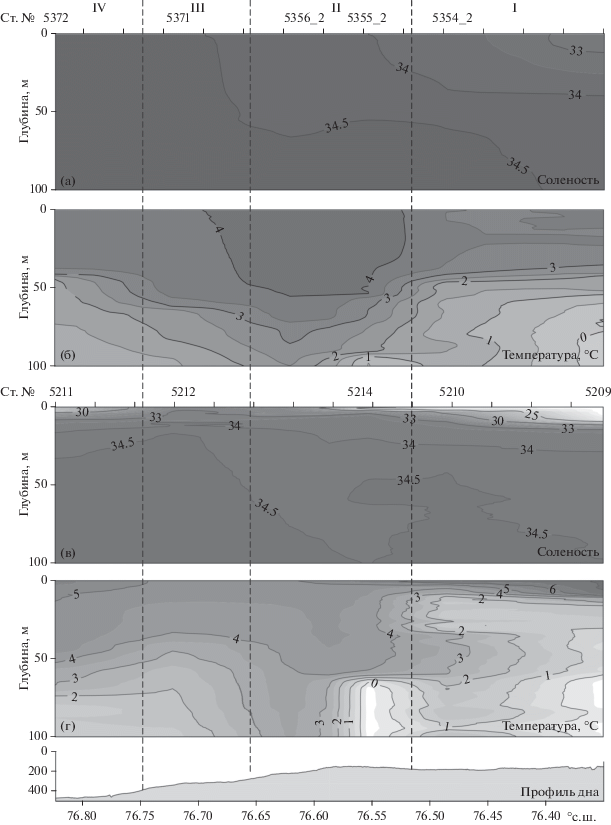
Наиболее выраженные различия в гидрологической структуре между выделенными областями проявились в сентябре 2015 г. Для I области было характерно сильное опреснение поверхностного слоя моря со значениями солености менее 25. Высокое содержание силикатов (>17 µМ/л) и высокие значения удельной щелочности (>0.08) свидетельствовали о хорошо выраженном влиянии речного стока [5]. В начале сентября при глубине верхнего перемешанного слоя от 1 до 10 м наблюдалось значительное опреснение поверхностного слоя, формируя градиент солености в пикноклине 0.9–1.3 на метр. Толщина верхнего перемешанного слоя в начале августа 2016 г. была значительно больше ~35 м, и градиент солености в пикноклине составлял всего 0.03 на метр. В августе в области внешнего шельфа на глубинах 50–100 м прослеживался слой вод с пониженной, вплоть до отрицательных значений, температурой и соленостью в ядре 34.2–34.5 (рис. 3а, 3б). Такие свойства характерны для зимних вод баренцевоморского происхождения [3, 24, 26]. Схожие характеристики этого слоя были зарегистрированы и в начале сентября (рис. 3 в, г). В области I на повторных станциях, выполненных в период с 17 июля по 5 августа 2016 г. (станции 5306, 5306_2 и 5354_2), наблюдалось увеличение солености верхнего перемешанного слоя с 31.8 до 33.7. При этом верхняя граница пикноклина заглубилась с 6 до 38 м. Опреснение поверхностного слоя, зарегистрированное в начале наблюдений, очевидно, происходило за счет таяния льда, что подтверждается низким содержанием силикатов в поверхностном слое (<1.5 µМ) и относительно низкими значениями удельной щелочности (<0.067). На ст. 5306_2 (29 июля) на глубине 20 м присутствие холодных зимних баренцевоморских вод прослеживалось наиболее явно. Здесь формировался хорошо выраженный термоклин с перепадом температуры от +2.8 до –1.4°С при вертикальном градиенте 0.3°С на 1 м.
Характерной особенностью области II было наблюдавшееся заглубление верхней границы пикноклина более чем на 50 м. 2 сентября 2015 г. здесь отмечен тонкий (<1 м) опресненный поверхностный слой. Повторные наблюдения 3 сентября (ст. 5214) и 23 сентября 2015 г. (ст. 5214_2) показали увеличение солености верхнего слоя с 22.4 до 33.7, сопровождавшееся уменьшением градиента солености в пикноклине с 1.3 до 0.5 на метр. Такая изменчивость гидрофизических характеристик указывает на то, что область II является зоной непосредственного взаимодействия шельфовых вод Карского моря и вод, поступающих с севера из Арктического бассейна.
Гидрофизические характеристики областей III и IV были схожи, за исключением того, что в области нижней части склона (область IV) в начале сентября наблюдалось влияние речного выноса, формировавшего тонкий опресненный поверхностный слой (<1 м) с соленостью 25. При этом градиент солености в пикноклине составлял в IV области 0.6 на метр, в III области – 0.1 на метр. На вертикальное распределение температуры и солености в верхней и нижней частях склона желоба Св. Анны на глубинах 50–70 м в период наблюдений оказывали влияние воды с положительными значениями температуры +2…+3°С и высокими значениями солености 34.7–34.8, указывающими на их атлантическое происхождение [30]. На шельфе Карского моря влияние этих вод зарегистрировано не было.
Пространственное распределение основных биогенных элементов (нитратов, фосфатов и силикатов) в оба года исследований было связано с распределением солености и температуры. В июле–августе 2016 г. в верхнем опресненном слое при температуре выше 3.5°С и относительно высоких значениях солености близких к 32 содержание нитратов изменялось от 0.05 до 0.7 µМ, фосфатов – от 0.02 до 0.1 µМ, силикатов – от 0.4 до 1.8 µМ. В сентябре 2015 г., при сильном влиянии речного стока и пониженных значениях солености в поверхностном слое (<25), концентрация нитратов колебалась от 0.2 до 0.5 µМ, фосфатов – от 0.05 до 0.14 µМ. При повышенных значениях солености (>33) на станциях 5212 и 5214-2 концентрация нитратов в поверхностном слое возросла до 1.8–3 µМ, концентрация фосфатов не изменилась. Наиболее сильная пространственная изменчивость в сентябре, связанная с влиянием речного стока, наблюдалась в распределении силикатов. При солености <25 концентрация силикатов превышала 15 µМ, при солености >33 концентрация силикатов в поверхностном слое была менее 2.2 µМ [5].
Вертикальные градиенты биогенных веществ были связаны с вертикальными градиентами гидрофизических параметров. Так, в июле–августе 2016 г. на прилежащем к желобу Св. Анны шельфе концентрации нитратов, фосфатов и силикатов были повышены в слое зимних вод баренцевоморского происхождения на глубинах 12–50 м и достигали значений 8.5, 0.5 и 6 µМ. Непосредственно в склоновых областях желоба Св. Анны при солености >34.7 и температуре от +0.5 до +1.5°С концентрация NO3, PO4 и SiO3 глубже 50 м возрастала до 14, 0.6 и 6 µМ, что, по-видимому, было связано с влиянием вод атлантического происхождения. Сходные тенденции в распределении биогенных элементов наблюдались в сентябре 2015 г.
Фитопланктон
Таксономический состав. В сентябре 2015 г. и июле–августе 2016 г. в составе фитоценоза было определено 99 видов планктонных водорослей, 47 форм были определены до рода, 8 – до более высокого систематического ранга. Согласно современной систематике простейших [15], все найденные таксоны фитопланктона принадлежали к 6-ти отделам: Ochrophyta (с классами Bacillariophyceae, Chrysophyceae, Dictyochophyceae, Xanthophyceae), Dinophyta, Haptophyta, Cryptophyta, Chlorophyta, Euglenophyta. Кроме того, в фитопланктоне был обнаружен вид Ebria tripartita (Protozoa), а также флагелляты и цисты водорослей неясного таксономического положения, линейный размер которых не превышал 10 мкм. Динофлагелляты составляли 53% видового богатства, диатомеи – 30%, остальные группы – 17%.
Видовое богатство и таксономическое разнообразие водорослей на уровне более высоких рангов в исследованных областях представлено в таблице 1. Во всех областях за исключением области II наблюдалась тенденция увеличения количества видов и таксономического разнообразия в целом от более раннего сезона (июль–начало августа) к более позднему (начало сентября). Во II области в августе 2016 г. таксономическое разнообразие было сходным с сентябрем 2015 г. Коэффициент Сёренсена, рассчитанный для каждой пары станций внутри исследованной области и для каждой пары станций на разрезах, показал сходство видовой структуры между сезонами внутри I, III и IV областей на уровне 19–30%, внутри II области – на уровне 40–48%. Сходство по разрезу для соседних районов в начале августа 2016 г. колебалось в диапазоне 46–60%, в начале сентября 2015 г. – 60–65%.
Таблица 1.
Число видов разных групп водорослей в выделенных областях в районе центрального отрога желоба Св. Анны
| Район | Дата | Ст. № | N видов | Ochro-DIAT | DINO | Ochro-OTHER | CRYP | HAPT | EUGL | CHLOR |
|---|---|---|---|---|---|---|---|---|---|---|
| I | 17.07.16 | 5306 | 21 | 11 | 8 | 1 | 1 | |||
| 29/07/16 | 5306_2 | 33 | 17 | 13 | 1 | 1 | 1 | |||
| 05/08/16 | 5354_2 | 26 | 10 | 12 | 1 | 1 | 1 | 1 | ||
| 02/09/15 | 5209/5210 | 67 | 15 | 36 | 3 | 3 | 1 | 4 | 5 | |
| II | 05/08/16 | 5355_2/5356_2 | 37 | 9 | 22 | 2 | 2 | 1 | 1 | |
| 03/09/15 | 5214 | 47 | 15 | 22 | 4 | 2 | 1 | 1 | 2 | |
| 23/09/15 | 5214_2 | 39 | 18 | 15 | 4 | 1 | 1 | |||
| III | 05/08/16 | 5371 | 20 | 3 | 11 | 1 | 2 | 2 | 1 | |
| 02/09/15 | 5212 | 45 | 13 | 25 | 3 | 2 | 1 | 1 | ||
| IV | 05/08/16 | 5372 | 19 | 7 | 8 | 1 | 2 | 1 | ||
| 02/09/15 | 5211 | 54 | 12 | 31 | 5 | 3 | 2 | 1 |
Примечание. I – на прилежащем к желобу шельфе Карского моря, II – в области кромки шельфа, III – в верхней части континентального склона желоба Св. Анны, IV – в нижней части континентального склона желоба Св. Анны. Ochro-DIAT – Ochrophyta, Bacillariophyceae (диатомовые); DINO – Dinophyta (динофлагелляты); Ochro-OTHER – Ochrophyta, Chrysophyceae, Dictyochophyceae, Xanthophyceae (золотистые, диктиоховые, желто-зеленые); CRYP – Cryptophyta (криптофитовые); HAPT – Haptophyta (гаптофитовые); EUGL – Euglanophyta (эвгленовые); CHLOR – Chlorophyta (зеленые).
На большинстве станций по числу видов преобладали динофлагелляты, их доля варьировала от 38 до 60% всего видового богатства планктонных водорослей. На двух станциях, выполненных 17 и 29 июля (станции 5306 и 5306_2) в I области, по числу видов доминировали диатомовые водоросли, составляя 52 и 55% видового богатства соответственно. На станции 5306 были встречены виды Fragillariopsis spp., Navicula pelagica, Chaetoceros socialis и Thalassiosira bioculata. На ст. 5306_2 помимо перечисленных видов диатомовых вожорослей были встречены диатомеи Bacterosira bathyomphala, и Navicula granii, которые не встречались на других станциях ни в августе 2016 г., ни в сентябре 2015 г.
В июле–августе 2016 г. наиболее встречаемыми видами были динофлагелляты Prorocentrum cordatum и Gymnodinium simplex и неидентифицированный вид, предположительно из отдела Euglenophyta. Перечисленные водоросли были встречены на 6 из 7 станций (частота встречаемости >85%).
В сентябре 2015 г. наиболее встречаемыми видами водорослей были диатомовые Thalassionema nitzschioides и Leptocylindrus danicus; автотрофные динофлагелляты Heterocapsa triquetra и Ceratium arcticum, гетеротрофные виды – Katodinium glaucum, Protoperidinium brevipes. Перечисленные виды были встречены на всех станциях (частота встречаемости 100%). На 5-ти станциях (частота встречаемости >80%) присутствовали диатомовые Chaetoceros compressus, Pseudo-nitzschia seriata и Rhizosolenia setigera, автотрофные динофлагелляты Dinophysis acuminata, Amphidinium cf. fusiforme, Scrippsiella trochoidea, гетеротрофы – Gyrodinium cf. pingue, Gyrodinium spirale, Protoperidinium pellucidum, а также цисты золотистых водорослей, Dinobryon balticum, Pyramimonas grossii и гетеротрофная криптомонада Leucocryptos marina.
В сентябре 2015 г. видовое богатство планктонных водорослей возрастало на станциях с относительно более низкой соленостью и высокой температурой поверхностного слоя (рис. 4). Здесь прослеживалось влияние речных вод, которое хорошо маркируется отношением щелочности к солености (Alk/S) [5]. На станциях с Alk/S выше 0.08 наблюдалось более высокое видовое разнообразие, по сравнению со станциями, где Alk/S было менее 0.068. Увеличение общего числа видов планктонных водорослей происходило в основном за счет появления и/или увеличения числа видов динофлагеллят из родов Cochlodinium, Diplopsalis, Gymnodinium, Protoperidinium и Warnowia. Число видов одной из основных групп фитопланктона – диатомовых водорослей, наоборот, уменьшалось при возрастании влияния речного стока.
Рис. 4.
Влияние речного опреснения на общее число видов фитопланктона (1), число видов диатомовых (2) и динофитовых водорослей (3) в сентябре 2015 г. Alk/S – щелочно-соленостное отношение.
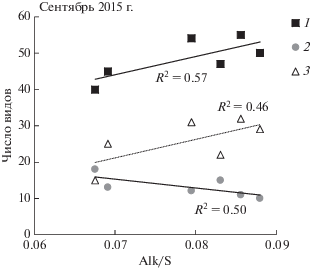
В июле–августе 2016 г. взаимосвязи числа видов с гидрологическими характеристиками не было выявлено.
Пространственное распределение интегральных количественных характеристик фитопланктона. При оценке пространственной и сезонной изменчивости количественных характеристик фитопланктона было проведено сравнение интегральных значений численности и биомассы водорослей в столбе воды с учетом веса горизонтов и далее нормированных на толщину исследованного слоя.
В июле–августе 2016 г. полученные интегральные значения численности фитопланктона колебались в широком диапазоне – от 7.4 до 95.4 млн кл/м3 (среднее значение 25 млн кл/м3, SD = 31 млн кл/ м3). При этом биомасса водорослей была относительно низкая – от 0.8 до 5 мгС/м3 (среднее значение 1.9 мгС/м3, SD = = 1.4 мгС/м3) (рис. 5). На разрезе, выполненном в начале августа, интегральные количественные показатели не превышали 20 млн кл/м3 и 2 мгС/м3. В областях I и II по численности доминировали динофлагелляты, составляя 40–52% от общего числа клеток. Их преобладание определялось обилием автотрофных представителей родов Gymnodinium, Prorocentrum, Heterocapsa, Amphidinium. Доля диатомовых в численности здесь достигала 18–37% за счет присутствия мелкоклеточных видов Skelethonema costatum, Chaetoceros sp., Leptocylindrus minimus. В областях III и IV по численности преобладали мелкие флагелляты отделов Chlorophyta (род Nephroselmis), Haptophyta (род Dicrateria), Ochrophyta (споры золотистых водорослей), а также жгутиковые 6–12 мкм неопределенного систематического положения. По биомассе во всех выделенных нами областях в начале августа доминировали динофлагелляты, составляя 57–86% от общей биомассы фитопланктона.
Рис. 5.
Пространственная изменчивость численности (N × 106 кл/м3) и биомассы (В мгС/м3), нормированных на глубину исследованного слоя, и вклад разных групп фитопланктона в июле–августе 2016 г. и в сентябре 2015 г. в разных областях центрального отрога желоба Св. Анны: I – на прилежащем к желобу шельфе Карского моря, II – в области кромки шельфа, III – в верхней части континентального склона желоба Св. Анны, IV – в нижней части континентального склона желоба Св. Анны. 1, 6 – Bacillariophyceae (диатомовые); 2, 7 – Dinophyta (динофлагелляты); 3, 8 – Chlorophyta (зеленые); 4, 9 – Haptophyta (гаптофитовые); 5, 10 – остальные.
В сентябре 2015 г. разброс интегральных количественных показателей фитопланктона составил от 21 до 55.5 млн кл/м3 (среднее значение 33.9 млн кл/м3, SD = 12 млн кл/ м3) и от 4 до 8.6 мгС/м3 (среднее значение 6.4 мгС/м3, SD = = 1.6 млн кл/ м3) (рис. 5). На большинстве станций в фитопланктонном сообществе доминировали динофлагелляты, составляя от 18 до 57% по численности и 75–90% по биомассе. При этом колебания численности и биомассы динофитовых водорослей в сентябре определялись обилием клеток автотрофного вида Heterocapsa triquetra. В области I наблюдалось увеличение численности зеленых жгутиконосцев рода Pyramimonas, которые составляли 10–18% от общего числа клеток водорослей. Вследствие небольших размеров клеток этого рода его обилие не оказывало существенного влияния на общую биомассу планктонных микроводорослей. В области II и IV в сообществе возрастала доля диатомовых, их вклад составлял 25-31% в общую численность и 12–17% в общую биомассу фитопланктона. Это происходило за счет увеличения численности в основном 4-х видов: Thalassiosira nordenskioeldii, Leptocylindrus danicus, Thalassionema nitzschioides, Chaetoceros compressus.
Вертикальное распределение фитопланктона на разрезах и его связь с абиотическими факторами. Пространственная и сезонная изменчивость вертикального распределения численности и биомассы фитопланктона и вклада разных групп водорослей в количественные характеристики продемонстрированы на рис. 6. В оба исследованных сезона во всех выделенных областях, за исключением области I в начале августа и III в начале сентября, вертикальное распределение численности и биомассы фитопланктона носило бимодальный характер. Более высокое обилие клеток наблюдалось в поверхностном слое и в слое 30–50 м под пикноклином. В августе в области I более высокие значения численности и биомассы фитопланктона наблюдались глубже 20 м, в сентябре в области III наибольшее обилие клеток отмечено в слое 40 м. В оба сезона основу биомассы формировали динофлагелляты, составляя от 60 до 95% во всех горизонтах, за исключением следующих двух случаев. В начале августа в области III (рис. 6, ст. 5371) на горизонте 50 м доля динофлагеллят составила 20%, а в фитопланктоне преобладали неидентифицированные флагелляты размером 8–12 мкм и кокколитофориды. В области IV в поверхностном диатомовые и динофлагелляты формировали близкий вклад в общую биомассу фитопланктона – от 37% и 30% соответственно. Вклад разных групп водорослей в общую численность планктонных микроводорослей значительно варьировал.
Рис. 6.
Вертикальное распределение численности (N × 103 кл/л) и биомассы (В мгС/м3) фитопланктона в августе 2016 г. и в сентябре 2015 г. в разных областях центрального отрога желоба Св. Анны: I – на прилегающем к желобу шельфе, II – над кромкой шельфа, III – в верхней части континентального склона желоба, IV – в нижней части континентального склона желоба. 1, 6 – Bacillariophyceae (диатомовые); 2, 7 – Dinophyta (динофлагелляты); 3, 8 – Chlorophyta (зеленые); 4, 9 – Haptophyta (гаптофитовые); 5, 10 – остальные.
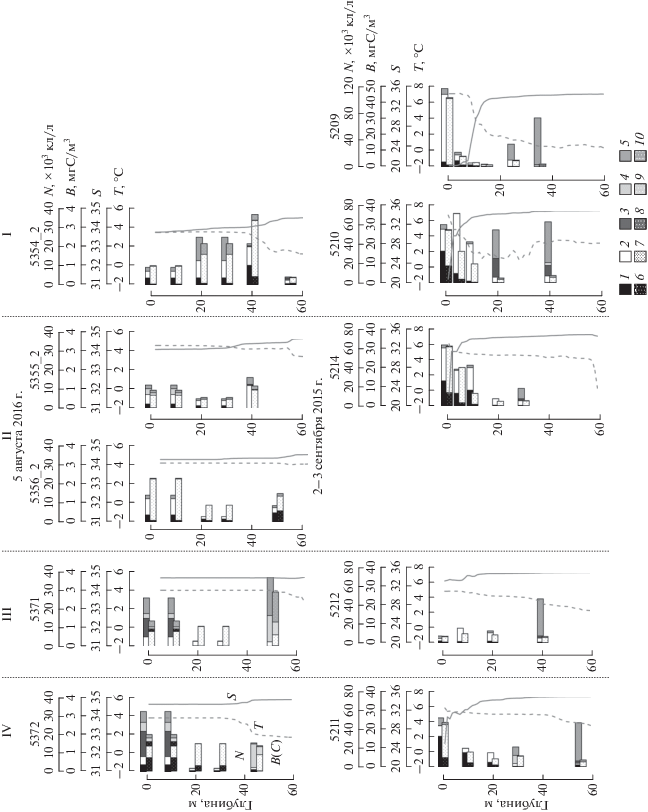
Основные изменения в структуре фитопланктонного сообщества в оба сезона происходили в двух слоях: в верхнем 10-метровом и в нижнем слое 40–50 м под пикноклином. В начале августа 2016 г. в верхнем 10 м слое на фоне низких значений численности и биомассы водорослей во всех слоях, численность фитопланктона постепенно увеличивалась от шельфовой зоны к внешней части склона желоба Св. Анны – от 9 × 103 кл/л до 32.6 × 103 кл/л. Изменения численности в верхнем 10 м слое происходили на фоне изменения возрастания солености этого слоя от 33.7 до 34.6. Общая биомасса фитопланктона варьировала здесь в пределах 0.9–2.3 мгС/м3. В шельфовых областях I и II (рис. 6, станции 5354_2-5356_2) основу сообщества составляли автотрофные динофлагелляты родов Gymnodinium, Prorocentrum, Amphidinium. Заметную долю общей численности (20–39%) формировали мелкоклеточные виды диатомей: Skelethonema costatum, Leptocylindrus minimus, которые не давали существенного вклада в биомассу фитопланктона. В склоновых областях III и IV (станции 5371 и 5372) увеличение численности фитопланктона происходило за счет мелких флагеллят отделов Chlorophyta, Haptophyta, Ochrophyta и жгутиковых с размером клеток 6–12 мкм неясного систематического положения. В IV области помимо динофлагеллят в сообществе наблюдалось появление крупноклеточных диатомей рода Chaetoceros – C. compressus, C. decipiens. Их вклад в биомассу достигал 37%.
На глубинах 40–50 м численность водорослей колебалась в пределах 8.4–36.8 × 103 кл/л, биомасса – 1.2–3.7 мгС/м3. Наибольшие величины численности и биомассы были зафиксированы в I и III областях (рис. 6, станции 5354_2 и 5371). При этом, также как и в верхнем 10 м слое, наблюдались хорошо выраженные широтные изменения доминирующих видов фитопланктона. В областях шельфа I и II основу сообщества составляли диатомеи Skeletonema costatum, Chaetoceros spp. и динофлагелляты Gymnodinium spp., Gyrodinium spp., Heterocapsa spp. и молодые неоформившиеся клетки динофитовых водорослей. Севернее, в области III в фитопланктоне преобладали неидентифицированные флагелляты 8–12 мкм и цисты золотистых водорослей. В области IV – по численности доминировали кокколитофориды, по биомассе – динофлагелляты рода Gymnodinium. Такие пространственные изменения структуры сообщества происходили на фоне изменения температуры и солености слоя 40–50 м, из-за проявления влияния вод атлантического происхождения в северной части исследованного района.
В начале сентября 2015 г. на разрезе в верхнем перемешанном слое диапазон колебаний количественных показателей планктонных водорослей был значительно шире по сравнению с августом 2016 г.: разброс численности составил 7.1 – 116.3 × × 103 кл/л, биомассы – 3.3–42.8 мгС/м3 (рис. 6). В сентябре в шельфовых областях I и II численность фитопланктона была выше в 5–13 раз, биомасса – в 14–43 раза, по сравнению с августом 2016 г. В склоновой части желоба наблюдалась менее выраженная сезонная изменчивость количественных показателей водорослей: в области III численность в сентябре была в 3.4 раза ниже, при этом биомасса в 2.5 раза выше; в области IV – численность и биомасса в сентябре были, соответственно, в 1.6 и в 12 раз выше по сравнению с августом. Увеличение обилия и биомассы фитопланктона в верхнем слое в сентябре происходило в основном за счет пяти видов: автотрофной динофлагелляты Heterocapsa triquetra и диатомей Leptocylindrus danicus, Thalassiosira nordenskioeldii, Thalassionema nitzschioides и Chaetoceros compressus. Их вклад в общую численность фитопланктона достигал 83%, в общую биомассу – 77%.
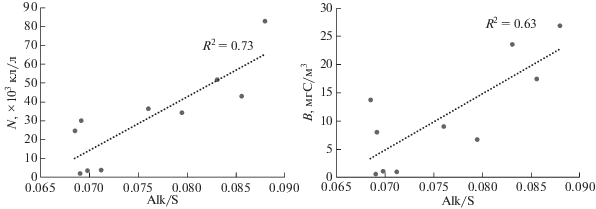
Пространственное распределение суммарной численности и биомассы этих видов (Heterocapsa triquetra, Leptocylindrus danicus, Thalassiosira nordenskioeldii, Thalassionema nitzschioides и Chaetoceros compressus) в верхних 10 м достоверно и прямо пропорционально зависело от уровня опреснения, вызванного речным стоком (рис. 7). Наиболее высокие количественные характеристики этих видов были зарегистрированы в опресненных областях I, II и IV. В III области на фоне резкого возрастания солености верхнего слоя до 33 численность и биомасса фитопланктона резко снижались (рис. 6, ст. 5212).
Рис. 7.
Зависимость суммарной численности (N × 103 кл/л) и биомассы (B мгС/м3) видов Heterocapsa triquetrum, Leptocylindrus danicus, Thalassiosira nordenskioeldii и Thalassionema nitzschioides от удельной щелочности (Alk/S) в верхних 10 м на квазимеридиональном разрезе от шельфа через область континентального склона желоба Св. Анны в начале сентября 2015 г.
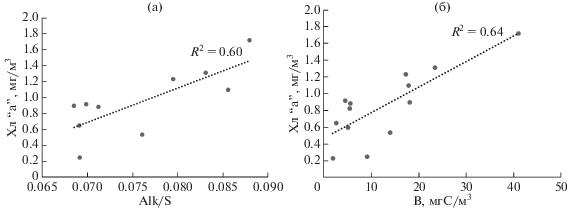
Распределение хл “а” также находилось в зависимости от опреснения. Концентрация фитопигментов возрастала прямо пропорционально с ростом удельной щелочности, характеризующей присутствие речных вод (рис. 8а). Кроме того, содержание хл “а” в верхних 10 м в большей степени зависело от обилия динофлагеллят, чем от обилия других групп водорослей (рис. 8б).
Рис. 8.
Зависимости концентрации хлорофилла “а” (Хл “а”, мг/м3) от (а) удельной щелочности (Alk/S) и (б) биомассы динофлагеллят (B, мгС/м3) в верхних 10 м на квазимеридиональном разрезе от шельфа через область континентального склона желоба Св. Анны в начале сентября 2015 г.
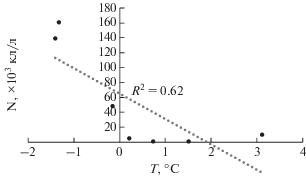
В исследованном районе Карского моря, на глубинах 40–50 м в начале сентября диапазон изменчивости количественных характеристик фитопланктона был сопоставим с наблюдавшимся в начале августа. Численность и биомасса изменялись в пределах 17.8–72.6 × 103 кл/л и 1.6–3.6 мг С/м3 соответственно. При относительно низких значениях температуры – +0.5°C и солености 34.2 на юге разреза (ст. 5209) и +3.7°C и 34.5–34.8 севернее на бровке шельфа и в склоновой области, в сообществе возрастала доля флагеллят отделов Chlorophyta, Ohrophyta (Chrysophyceae) и неидентифицированных жгутиковых с размером клеток 6–8 мкм. При возрастании температуры до +4.5°C и сохранении солености 34.2 численность этих групп резко снижалась. Таким образом, на всем разрезе в сентябре в нижних слоях под пикноклином, при отсутствии влияния речного опреснения численность фитопланктона, определялась в значительной степени температурой (рис. 9). При возрастании температуры численность жгутиковых водорослей, определяющая изменения общей численности водорослей, значительно снижалась.
Рис. 9.
Зависимость численности флагеллят (N × × 103 кл/л) от температуры (Т°С) под пикноклином на квазимеридиональном разрезе от шельфа через область континентального склона желоба Св. Анны в начале сентября 2015 г.
Изменения вертикального распределения фитопланктона при повторных наблюдениях на станциях. Повторы станций в июле–августе 2016 г. на прилегающем к желобу Св. Анны шельфе (I) и в сентябре 2015 г. в области кромки шельфа (II) позволили выявить изменчивость вертикального распределения фитопланктона на временных интервалах 7–20 суток.
В I области 17 июля при глубине верхнего перемешанного слоя 5–6 м наибольшие количественные показатели наблюдались на глубине 12 м в слое пикноклина при солености 33.9 и температуре 2.8°С, и достигали 68.1 × 103 кл/л и 5.1 мгС/м3 (рис. 10а). На остальных горизонтах численность и биомасса планктонных микроводорослей не превышали 19.7 × 103 кл/л и 1.5 мгС/м3 соответственно. В фитопланктонном сообществе доминировала диатомея Chaetoceros socialis, составляя 84% в общей численности и 27% в общей биомассе фитопланктона. Кроме того, заметный вклад по биомассе (47%) вносили диатомеи Thalassiosira bioculata и Chaetoceros convolutus.
Рис. 10.
Вертикальное распределение численности (N × 103 кл/л) и биомассы фитопланктона (В мгС/м3) при повторных наблюдениях на станциях (а, б) над кромкой шельфа в сентябре 2015 г. и (в–д) на прилегающем к желобу Св. Анны шельфе в июле–августе 2016 г. 1, 6 – Bacillariophyceae (диатомовые); 2, 7 – Dinophyta (динофлагелляты); 3, 8 – Chlorophyta (зеленые); 4, 9 – Haptophyta (гаптофитовые); 5, 10 – остальные.
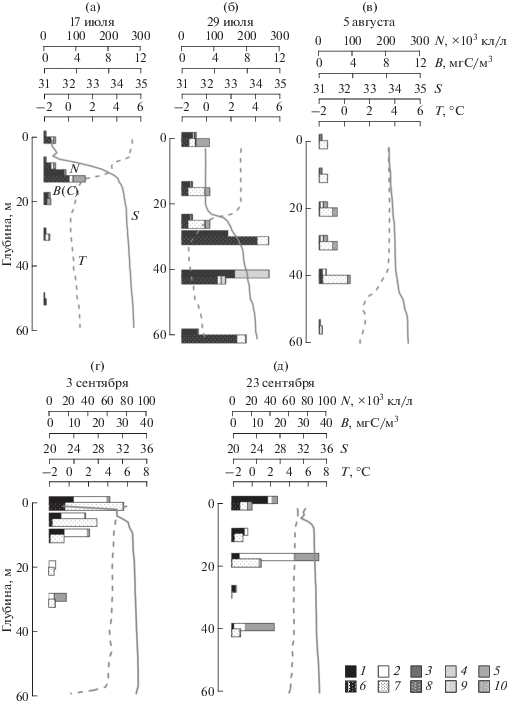
При повторе станции, выполненной на внешнем шельфе (область I) 29 июля через 12 дней, на фоне заглубления пикноклина наблюдалось существенное возрастание количественных характеристик водорослей на всех исследованных горизонтах (рис. 10б). В верхних 25 м численность фитопланктона колебалась от 33.6 × 103 кл/л до 45 × 103 кл/л, биомасса достигала 3.4 мгС/м3. Под пикноклином при снижении температуры до отрицательных значений (–1.3…–1.4°С) численность и биомасса фитопланктона были наибольшими во всем столбе воды, а также максимальными за все время исследований в июле–августе 2016 г. и колебались в пределах 141–267 × 103 кл/л и 5.4–10.6 мг С/м3 соответственно. Ниже, на глубине 60 м при увеличении солености до 34.1 и температуры до –0.15 численность клеток водорослей снизилась до 51 × 103 кл/л при биомассе 7.9 мгС/м3. В сообществе фитопланктона по численности доминировал Chaetoceros socialis на стадии спорообразования, составляя в верхних 25 м 67–72%, глубже 24–49%. По биомассе в верхних 25 м преобладали споры Chaetoceros socialis, динофитовые родов Gymnodinium, Prorocentrum, молодые клетки динофлагеллят. Их суммарный вклад в общую биомассу фитопланктона составил 58–85%. Под пикноклином, на глубинах 30–42 м 67–73% от общей биомассы составляли Bacterosira bathyomphala, Chaetoceros decipiens, C. socialis, Eucampia groenlandica, Fragillariopsis spp. На глубине 60 м в сообществе был отмечен вид Navicula pelagica, который формировал 31% от общей численности. По биомассе преобладала Thalassiosira bioculata (70%).
Через 7 суток 5 августа при увеличении глубины верхнего перемешанного слоя до 38 м, возрастании солености в нем до 33.7 численность и биомасса фитопланктона снизились и не превышали 24 × 103 кл/л и 3.7 мгС/м3 соответственно (рис. 10в). Изменения количественных характеристик фитопланктона здесь происходили за счет динофлагеллят Heterocapsa triquetra, Prorocentrum cordatum и кокколитофорид, которые в слое пикноклина на 40 м составляли 71% от общей численности и 74% от общей биомассы.
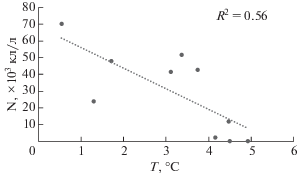
На горизонтах под пикноклином при повторных наблюдениях на станциях (с 17 июля по 5 августа 2016 г.) изменения количества диатомовых водорослей продемонстрировали связь с изменениями температуры воды (рис. 11). При уменьшении температуры до отрицательных значений численность и биомасса диатомей возросла и в сообществе среди доминант появились Bacterosira bathyomphala, Fragillariopsis spp., Navicula pelagica.
Рис. 11.
Зависимость численности диатомовых водорослей (N × 103 кл/л) от температуры воды (T°C) на горизонтах под пикноклином при повторных наблюдениях на станциях с 17.07 по 05.08.2016 г. на прилежащем к желобу Св. Анны шельфе Карского моря.
В сентябре 2015 г. основные изменения вертикальных профилей гидрофизических характеристик в области внешней кромки шельфа были связаны с влиянием речного стока. При сильном опреснении поверхностного слоя до 22.4, зарегистрированном 3 сентября, максимальные количественные характеристики фитопланктона наблюдались у поверхности (рис. 10г). Через 20 суток на этой станции при отсутствии сильного опреснения (соленость 32) максимальные значения численности и биомассы фитопланктона наблюдались в слое 18 м (рис. 10д). При этом состав фитопланктона практически не изменился. Относительно высокие значения численности и биомассы фитопланктона в верхнем 10 м слое формировались за счет Heterocapsa triquetra, Leptocylindrus danicus, L. minimus, Thalassiosira nordenskioeldii и Thalassionema nitzschioides, в слоях глубже – за счет динофлагеллят рода Gymnodinium, Heterocapsa triquetra, молодых перидиней, а также золотистых водорослей, представленных Ollicola vangoorii, Dinobryon balticum, цист и жгутиковых 6–8 мкм неясного таксономического положения.
ОБСУЖДЕНИЕ
Результаты настоящего исследования позволили детально описать пространственную и временную изменчивость состава и распределения фитопланктона в желобе Св. Анны и на прилежащем шельфе в середине вегетационного сезона с середины июля по начало сентября, что существенно дополняет имеющиеся данные предыдущих исследований в этом районе Карского моря [6, 9, 13 ]. Взаимодействие вод разного происхождения в склоновых районах создают сложную систему “переслоенных” в широтном направлении биотопов с разными гидрологическими характеристиками не только во второй половине вегетационного сезона, но и в более ранний период. Изменения в видовом составе и количественных характеристиках могут определяться не только закономерностями сезонной сукцессии фитопланктонного сообщества, но и адвекцией в район желоба Св. Анны вод разного происхождения: речного стока, зимних баренцевоморских вод и трансформированных вод атлантического происхождения. При повторных наблюдениях на станциях, выполненных на внешнем шельфе, прилежащем к западному отрогу желоба Св. Анны 17 июля и 5 августа, смена сезонных комплексов в сообществе водорослей наблюдалась на фоне изменений гидрофизических параметров водной толщи, включая заглубление верхней границы пикноклина с 5 до 45 м. В верхнем перемешанном слое преобладание диатомей Chaetoceros socialis, Thalassiosira bioculata, Chaetoceros convolutus, характерных для поздневесенней и летней стадий сезонной сукцессии в высоких широтах [4, 7, 16, 25], в течение второй половины июля сменялось преобладанием спор Chaetoceros socialis, автотрофных динофитовых родов Gymnodinium, Prorocentrum, молодых клеткок динофлагеллят и кокколитофорид, характерных для летнего сезона. В начале августа на фоне снижения количественных характеристик фитопланктона также, как и в конце июля, преобладало летнее сообщество с доминированием автотрофных перидиней Heterocapsa triquetra и Prorocentrum cordatum.
Глубже слоя пикноклина смена сезонных комплексов носила иной характер. Преобладание в середине июля диатомей Chaetoceros socialis, Thalassiosira bioculata, Chaetoceros convolutes сменилось в конце июля сообществом диатомей, в котором наряду с поздневесенними и летними видами (Chaetoceros decipiens, C.socialis, Thalassiosira bioculata) среди доминант были отмечены диатомовые Bacterosira bathyomphala, Fragillariopsis spp., Navicula pelagica, характерные для ранней весны в арктических широтах [4, 14, 25]. В начале августа в фитопланктоне преобладали летние формы, представленные автотрофными перидинеями Heterocapsa triquetra и Prorocentrum cordatum. Нарушение последовательной смены сезонных комплексов на прилежащем к желобу Св. Анны внешнем шельфе в конце июля (ст. 5306_2), вероятнее всего, было вызвано с присутствием обогащенных биогенными элементами холодных зимних вод баренцевоморского происхождения, верхняя граница которых лежала на глубине 25 м. При уменьшении температуры до отрицательных значений численность и биомасса диатомей возрастала, и в сообществе среди доминант появились ранневесенние виды.
В сентябре при повторных наблюдениях станциях (3 и 23 сентября 2015 г.) в области внешней кромки шельфа в фитопланктоне преобладали Heterocapsa triquetra, Gymnodinium spp., Leptocylindrus danicus, L. minimus, Thalassiosira nordenskioeldii, Thalassionema nitzschioides, Ollicola vangoorii, Dinobryon balticum, цисты золотистых водорослей и жгутиковые 6–8 мкм неясного таксономического положения, характерные для летне-осенней стадии сезонной сукцессии [6, 9, 14, 27]. Изменчивость вертикального распределения фитопланктона выражалась в изменениях количественных характеристик летне-осеннего комплекса видов. При более сильном опреснении поверхности, вызванном влиянием речного стока, максимальные значения численности и биомассы были приурочены к верхнему перемешанному слою, при отсутствии распреснения, максимумы наблюдались на глубине 18 м.
Нами выполнено сравнение индексов сходства видового состава фитопланктона для разных сезонов внутри выделенных областей (шельфовой, бровки шельфа, верхней и нижней частей склона желоба Св. Анны) и отдельных областей в пределах одного сезона. Сравнение выявило более высокий уровень сходства между областями в пределах одного сезона по сравнению с сезонными изменениями в сообществе водорослей в пределах одной области. В начале августа уровень пространственного сходства видовой структуры между областями был 46–60%, в начале сентября – 60–65%. Уровень сходства видовой структуры между сезонами внутри каждой из областей был значительно ниже и колебался в пределах 19–30%. Исключением была область бровки внешнего шельфа, где уровень сходства видовой структуры фитопланктона между сезонами был сопоставим с уровнем сходства между отдельными областями в начале августа (40–48%). Таким образом, можно заключить, что изменения видовой структуры водорослей на разрезе от шельфовой части Карского моря в глубоководную область желоба Св. Анны в большей степени были связаны в сезонными перестройками в сообществе фитопланктона, чем с влиянием адвекции речных и трансформированных атлантических вод на район исследований. В шельфовой области присутствие баренцевоморских зимних вод приводило к увеличению числа видов ранневесенних диатомей и к увеличению количественных характеристик ранне- и поздневесеннего диатомового комплексов.
В начале августа при отсутствии влияния речного стока сходство видовой структуры фитопланктона в выделенных нами областях разреза было ниже по сравнению с началом сентября. На шельфе в сообществе преобладали автотрофные динофлагелляты Heterocapsa triquetra, Prorocentrum spp., Amphidinium spp., Gymnodinium spp. Севернее, в склоновой части желоба Св. Анны, где наблюдался заток вод атлантического происхождения, происходила смена структуры фитопланктона. В сообществе доминировали флагелляты отдела Chlorophyta, цисты золотистых водорослей (Ohrophyta, Chrysophyceae), кокколитофориды и жгутиковые 6–12 мкм неясного таксономического положения. Расстояние между этими областями, занимаемыми разными сообществами, составляло всего около 11 км.
Более высокий уровень пространственного сходства видовой структуры в начале сентября, по сравнению с началом августа, по всей видимости, определялся значительным влиянием речного стока на опреснение верхнего слоя практически на всем разрезе. Степень опреснения верхнего слоя определяла количественные характеристики фитопланктона и сходство видовой структуры сообщества, которое сохранялось на уровне 60–65%. При этом при более сильном влиянии речного стока происходило увеличение общего числа видов планктонных водорослей. В верхнем 10 м слое по численности доминировали виды летне-осенний комплекса: Heterocapsa triquetrum, Leptocylindrus danicus, L. minimus, Thalassiosira nordenskioeldii, Thalassionema nitzschioides, Chaetoceros compressus. Под пикноклином (на глубинах 20–55 м) в сентябре изменчивость количественных характеристик фитопланктона была связана с температурой, которая формировалась под влиянием вод атлантического происхождения. При температуре +0.5…+1.7°С, характерной для атлантических вод, наблюдался рост численности флагеллят отдела Chlorophyta, цист золотистых водорослей (Ohrophyta, Chrysophyceae) и жгутиковых 6–8 мкм неясного таксономического положения.
Несмотря на значительное влияние речного стока на верхний перемешанный слой в районе исследования в начале сентября 2015 г., пресноводных и/или солоноватоводных видов в фитопланктонном сообществе встречено не было. Это хорошо согласуется с результатами предыдущих исследований фитопланктона, выполненными в августе–сентябре непосредственно в эстуарной области Оби и Енисея. Наблюдения показали присутствие исключительно морских видов планктонного альгоценоза севернее 76° с.ш. [10–12, 23]. На прилежащем к эстуарной области шельфе Карского моря в координатах 74°–75° с.ш. морские виды формировали основу биомассы фитопланктона [10–12, 20]. При этом доминирующей по биомассе группой были диатомеи (виды рода Thalassiosira), а общая сырая биомасса планктонных микроводослей достигала 5 мг/л [20], что при пересчете в единицы углерода составляет около 0.5 мгС/л. Эти значения биомассы в 10 раз превышают полученные нами максимальные значения в начале сентября в верхнем слое в более северной области Карского моря (0.05 мгС/л). Основу биомассы при этом в верхнем опресненном слое составляли динофлагелляты и диатомеи.
Результаты предыдущих исследований фитопланктона [6, 9] и настоящих исследований позволили проследить смену сезонных комплексов в фитопланктоне от июля до конца сентября в северной части Карского моря. В шельфовой зоне в июле–августе на сезонное состояние фитопланктона оказывали влияние обогащенные биогенными элементами зимние воды баренцевоморского происхождения. При их явном присутствии в сообществе преобладали ранне- и поздневесенние виды диатомей. В начале августа при отсутствии влияния речного стока в фитопланктоне доминировали автотрофные динофлагелляты. В начале сентября при хорошо выраженном влиянии пресноводного стока сообщество планктонных водорослей находилось на летне-осенней стадии сукцессии, и в нем наряду с автотрофными динофлагеллятами доминировали диатомеи родов Leptocylindrus, Thalassiosira, Thalassionema, Chaetoceros. В конце сентября со значительным уменьшением солнечной инсоляции и продолжительности светлого времени суток, фотосинтетическая активность водорослей значительно снижалась [22]. Диатомовые водоросли переходили в стадию спорообразования, в сообществе появились крупноразмерные динофлагелляты родов Torodinium и Protoperidinium, что, свидетельствовало о завершении вегетационного сезона.
На сообщество фитопланктона в области склона желоба Св. Анны оказывали влияние ледовый режим, воды атлантического происхождения и речной сток. В начале августа 2016 г., при быстром отступлении льда и влиянии вод атлантического происхождения во всем столбе воды преобладали флагелляты отдела Chlorophyta, цисты золотистых водорослей (Ohrophyta, Chrysophyceae), кокколитофориды и жгутиковые 6–12 мкм неясного таксономического положения. В конце августа 2014 г. при более низкой температуре верхнего 20 м слоя и позднем отступлении льда в склоновой части желоба Св. Анны на глубинах 35–45 м мы застали остатки ранневесеннего диатомового сообщества [6]. В начале сентября 2015 г. сообщество верхнего слоя находилось под влиянием речного выноса, и фитопланктон был представлен автотрофными динофлагеллятами и диатомовыми родов Leptocylindrus, Thalassiosira, Thalassionema, Chaetoceros. В конце сентябре 2007 и 2011 гг. на фоне низкой фотосинтетической активности сообщества планктонных микроводорослей [22] доминирующими по численности были жгутиковые отделов Chlorophyta, Haptophyta и неидентифицированные клетки флагеллят, по биомассе преобладали динофлагелляты и диатомовые преимущественно на стадии спорообразования [6, 9].
ЗАКЛЮЧЕНИЕ
Выявленные в ходе настоящего исследования закономерности пространственно-временнóй изменчивости состава и распределения фитопланктона в центральном отроге желоба Св. Анны и на прилежащем к желобу шельфе Карского моря дополняют представления о сезонных изменениях в сообществе планктонных микроводорослей в середине и конце вегетационного сезона и о влиянии абиотических факторов на изменчивость таксономического состава водорослей и их количественные характеристики.
Было показано, что на изменения видовой структуры фитопланктона в желобе Св. Анны и на прилежащем к желобу шельфе Карского моря в большей степени оказывают влияние сезонные сукцессионные перестройки в сообществе, чем адвекция в район речных и атлантических вод. Увеличение численности и биомассы фитопланктона и изменчивость их вертикального распределения в середине июля–начале августа связана с влиянием на район исследования зимних баренцевоморских вод и вод атлантического происхождения, в начале сентября – с опреснением верхнего слоя, связанным с воздействием речного стока. Изменения численности и биомассы планктонных водорослей в отдельных биотопах могут иметь временнóй масштаб 7–20 суток. Характеристики сообществ фитопланктона (видовой состав, численность, биомасса) во все исследованные месяцы вегетационного сезона с июля по сентябрь на прилежащем к желобу Св. Анны шельфе Карского моря отличаются от наблюдаемых в склоновой области желоба, при том, что расстояние между областями с разной структурой планктонных альгоценозов составляет всего 11 км.
Источник финансирования. Работа выполнена в рамках темы государственного задания ИО РАН № 0149-2019-0008, при финансовой поддержке проекта РФФИ № 18-05-60069 (анализ фитопланктона и гидрофизических данных) и гранта Президента Российской Федерации № МК-860.2020.5 (анализ гидрохимической структуры).
Список литературы
Зацепин А.Г., Морозов Е.Г., Пака В.Т. и др. Циркуляция вод в юго-западной части Карского моря в сентябре 2007 г. // Океанология. 2010. Т. 50. № 5. С. 683–697.
Зацепин А.Г., Поярков С.Г., Кременецкий В.В. и др. Гидрофизические характеристики глубоководных желобов западной части Карского моря // Океанология. 2015. Т. 55. № 4. С. 526–539.
Иванов В.В., Аксенов Е.О. трансформация атлантической воды в восточной части котловины Нансена по данным наблюдений и моделирования // Проблемы Арктики и Антарктики. 2013. № 1 (95). С. 72–87.
Ильяш Л.В., Житина Л.С., Федоров В.Д. Фитопланктон Белого моря. М.: Янус-К, 2003. 167 с.
Маккавеев П.Н., Полухин А.А., Костылева А.В. и др. Гидрохимические особенности акватории Карского моря летом 2015 г. // Океанология. 2017. Т. 57. № 1. С. 57–66.
Сергеева В.М., Суханова И.Н., Дружкова Е.И. и др. Структура и распределение фитопланктона в глубоководных районах северной части Карского моря // Океанология. 2016. Т. 56. № 1. С. 113–119.
Сергеева В.М., Суханова И.Н., Флинт М.В. и др. Структура фитопланктонного сообщества Западной Арктики в июле-августе 2003 г. // Океанология. 2010. Т. 50. №2. С. 203–217.
Суханова И.Н. Концентрирование фитопланктона в пробе. Современные методы количественной оценки распределения морского планктона. М.: Наука, 1983. С. 97–108.
Суханова И.Н., Флинт М.В., Дружкова Е.И. и др. Фитопланктон северо-западной части Карского моря // Океанология. 2015. Т. 55. № 4. С. 605–619.
Суханова И.Н., Флинт М.В., Мошаров С.А., Сергеева В.М. Структура сообществ фитопланктона и первичная продукция в Обском эстуарии и на прилежащем карском шельфе // Океанология. 2010. Т. 50. № 5. С. 785–800.
Суханова И.Н., Флинт М.В., Сахарова Е.Г. и др. Фитоценозы Обского эстуария и Карского шельфа в поздневесенний сезон // Океанология. 2018. Т. 58. № 6. С. 882–898.
Суханова И.Н., Флинт М.В., Сергеева В.М. и др. Структура сообществ фитопланктона Енисейского эстуария и прилежащего Карского шельфа // Океанология. 2015. Т. 55. № 6. С. 935–948.
Флинт М.В., Поярков С.Г., Тимонин А.Г., Соловьев К.А. Структура мезопланктонного сообщества в области континентального склона желоба Святой Анны (Карское море) // Океанология. 2015. Т. 55. № 4. С. 643–655.
Ширшов П.П. Планктон Арктических вод. М.: Наука, 1982. 255 с.
Adl S.M., Simpson A.G.B., Farmer M.A. et al. The New Higher Level Classification of Eukaryotes with Emphasis on the Taxonomy of Protists // J. of Eukaryotic Microbiology. 2005. V. 52. Iss. 5. P. 399–451.
Bursa A. Phytoplankton in coastal waters of the Arctic Ocean at Point Barrow, Alaska // Arctic. 1963. V. 16. P. 239–262.
Clarke K.R., Warwick R.M. () Change in Marine Communities: An Approach to Statistical Analysis and Interpretation. 2nd Edition. PRIMER-E. 2001. Plymouth. 172 p.
Fetterer F., Knowles K., Meier W. et al. 2017, updated daily. Sea Ice Index, Version 3. [Indicate subset used]. Boulder, Colorado USA. NSIDC: National Snow and Ice Data Center. [Date Accessed].https://doi.org/10.7265/N5K072F8
Holm-Hansen 0., Riemann B. Chlorophyll a determination: improvements in methodology // Oikos. 1978. V. 30. P. 438–447.
Makarevich P.R., Druzhkov N.V., Larionov V.V., Druzhkova E.I. The freshwater phytoplankton biomass and its role in the formation of a highly productive zone on the Ob Yenisei shallows (southern Kara Sea) // Siberian river run-off in the Kara Sea Characterisation, quantification, variability and environmental significance. Elsevier, 2003. P. 185–193.
Menden-Deuer S., Lessard E.J. Carbon to volume relationships for dinoflagellates, diatoms, and other protist plankton // Limnology Oceanography 2000. V. 45. № 3. P. 569–579.
Mosharov S.A., Sergeeva V.M., Kremenetskiy V.V. et al. Assessment of phytoplankton photosynthetic efficiency based on measurement of fluorescence parameters and radiocarbon uptake in the Kara Sea // Estuarine, Coastal and Shelf Science 2019. V. 218. P. 59–69.
Nothig E.M., Okolodkov Y., Larionov V.V., Druzhkova E.I. Phytoplankton distribution in the inner Kara Sea: A comparison of three summer // Siberian river run-off in the Kara Sea Characterisation, quantification, variability and environmental significance. Elsevier, 2003. P. 163–183.
Pivovarov S., Schlitzer R., Novikhin A. River run-off influence on the water mass formation in the Kara Sea // Siberian river run-off in the Kara Sea Characterisation, quantification, variability and environmental significance. Elsevier, 2003. P. 9–25.
Quillfeldt C. H. v. Common Diatom Species in Arctic Spring Blooms: Their Distribution and Abundance // Botanica Marina. 2005. V. 43. Iss. 6. P. 499–516.
Rudels B., Jones E.P., Schauer U., Eriksson P. Atlantic sources of the Arctic Ocean surface and halocline waters // Polar Res. 2004. V. 23(2). P. 181–208.
Saito K., Tanigushi A. Phytoplankton communities in the Bering Sea and adjacent seas. 11. Spring and summer communities in seasonally ice-covered areas // Astar-te. 1978. V. 11. P. 27–35.
Springer A.M., Flint M.V., McRoy C.P. The Bering Sea Green Belt: shelf edge processes and ecosystem production. // Fisheries Oceanography. 1996. V. 5. № 3/4. P. 205–223.
Strickland J.D.H., Parsons T.R. A practical handbook of seawater analysis. Pigment analysis // Bull. Fish. Res. Bd. Can. 1968. V. 167. P. 1–311.
Volkov V.A., Johannessen O.M., Borodachev V.E. et al. Polar Seas Oceanography. An integrated case study of the Kara Sea // Springer. 2012. P. 78–79.
Дополнительные материалы отсутствуют.


