Океанология, 2020, T. 60, № 4, стр. 556-563
Состав углеводородов в липидных фракциях массовых видов фитопланктона Азовского и Черного морей
Я. С. Ермакова 1, *, Л. Ф. Павленко 1, **, Т. О. Барабашин 1, А. Б. Боровков 2, Т. М. Новикова 2
1 Азово-Черноморский филиал всероссийского научно-исследовательского института
рыбного хозяйства и океанографии
Ростов-на-Дону, Россия
2 Институт биологии южных морей им. А.О. Ковалевского РАН
Севастополь, Россия
* E-mail: ynyla@mail.ru
** E-mail: pavlenko.lili@yandex.ru
Поступила в редакцию 23.01.2020
После доработки 03.02.2020
Принята к публикации 08.04.2020
Аннотация
Для учета биогенного фона углеводородов, без которого оценка уровня нефтяного загрязнения водных экосистем будет некорректной, предложено использовать данные о содержании углеводородов в фитопланктоне, попадающем в исследуемую пробу воды. Для накопления необходимой для анализа биомассы водоросли выращивали в стерильных колбах. Количество углеводородов, выделенных методом тонкослойной хроматографии из липидных фракций различных видов водорослей, варьировало в пределах 0.004–0.007 мг на 1 мг фитопланктона. Содержание липидов в различных видах фитопланктона варьировало от 4.5 до 6.2%, углеводороды составляли 8–11% от общей массы липидов. В составе парафиновых углеводородов в зависимости от вида фитопланктона преобладали нечетные н-алканы С17, С21, С25, С29, С31.
ВВЕДЕНИЕ
Осуществление контроля нефтяного загрязнения элементов водных экосистем относится к одной из самых трудных аналитических задач, стоящих перед специалистами при проведении экологического мониторинга загрязнения пресных и морских водных объектов. Основными проблемами оценки нефтяного загрязнения являются, во-первых, сложность, неопределенность и постоянная изменчивость состава нефти и нефтепродуктов при поступлении их в воду и, во-вторых, присутствие в природных водах углеводородов (УВ), образованных в результате естественных процессов, которые принято называть естественными или биогенными углеводородами. Вторая проблема в настоящее время становится все более актуальной в связи с уменьшением сброса нефти и нефтепродуктов, которое отмечается для всего Мирового океана, а также эвтрофикацией большинства водоемов вследствие хозяйственной деятельности человека. При этом количество продуцированных биогенных УВ, оцениваемое примерно в 12 млн т в год, остается практически постоянным и по некоторым оценкам превышает количество антропогенных УВ в 4–5 раз [27].
В местах массового цветения фитопланктона концентрации УВ могут превышать величину предельно допустимой концентрации нефтепродуктов в водных объектах рыбохозяйственного значения и получаемая информация об уровне нефтяного загрязнения исследуемого водного объекта оказывается некорректной [9, 28]. Количественно дифференцировать УВ по их происхождению чрезвычайно сложно, поскольку в исследуемых пробах обычно присутствует смесь УВ из разных источников, а существующие методики по определению углеводородной фракции, которой в настоящее время ограничено понятие “нефтепродукты”, регистрируют суммарное содержание нефтяных и биогенных углеводородов. Определение биогенного фона и принципа разделения фоновой и антропогенной составляющих углеводородов является важнейшей задачей, как при определении экологического состояния водных объектов, так и при определении влияния техногенной нагрузки.
Биогенные углеводороды делят на две подгруппы: первично-биогенные, которые являются продуктами биосинтеза в живом организме, и вторично-биогенные, представляющие собой продукты биогеохимического или геохимического преобразования различных не углеводородных соединений, которые входят в состав отмершей биомассы в почвах, водной среде, донных отложениях и осадочных горных породах [12].
Еще в 70-е годы прошлого века было установлено, что н-алканы, содержащиеся в составе УВ пресных и морских вод, являются определенными маркерами и могут свидетельствовать об источниках происхождения УВ. Так, н-алканы с преобладанием низкомолекулярных нечетных углеводородов (С15–С19) продуцируются морской альгофлорой, а наземные растения продуцируют н-алканы, содержащие преимущественно нечетные высокомолекулярные соединения – С27, С29, С31, сосудистые растения из морских и солоноватых водоемов продуцируют н-алканы со средним уровнем преобладания нечетных УВ [26].
В морских экосистемах бактерии также являются источником автохтонных углеводородов, но имеют второстепенное значение в их формировании. Для них характерен гомологический ряд алканов с доминированием н-С16, н-С20–С25. [20]. Некоторые виды бактерий содержат н-алканы с нечетным числом атомов углерода (С7–С17) и соответствующие жирные кислоты с четным числом атомов углерода (С8–С18). Предполагают, что подобные УВ могли образоваться как в процессе декарбоксилирования жирных кислот с четным числом атомов углерода, так и являться непосредственными продуктами метаболизма бактерий [26].
В многочисленных видах фитопланктона в качестве основного алкана был идентифицирован полиолефин НЕН – cis-3,6,9,12,15,18-генейкозанексан, доля которого может достигать 30–40% от общего количества УВ [19, 23].
Многие индивидуальные углеводороды, найденные в тканях гидробионтов, имеют тот же состав и строение, что и входящие в различные нефтяные фракции, поэтому провести дифференциацию их происхождения чрезвычайно трудно. Учет биогенных углеводородов в большинстве публикаций сводится, как правило, к поиску критериев их преобладания над антропогенными (нефтяными) углеводородами [6].
В качестве критериев происхождения углеводородов наиболее часто используется критерий CPI (Carbon Preference Index), так называемый индекс нечетности, который рассчитывается по отношениям углеводородов с нечетным и четным числом углеродных атомов. Отношение нечетных и четных алканов в низкомолекулярной области может служить индикатором интенсивности трансформации углеводородов микроорганизмами. Соотношение нечетных и четных н-алканов в высокомолекулярной области характеризует вклад аллохтонной (терригенной) составляющей биогенных УВ. Для аллохтонных углеводородов отношение нечетных к четным алканам всегда больше 1, так как в составе УВ высшей растительности значительно преобладают высокомолекулярные нечетные алканы. Отношение суммарных концентраций низкомолекулярных и высокомолекулярных н-алканов используется для характеристики соотношения между автохтонными УВ морского происхождения и аллохтонными УВ терригенного происхождения [11]. Однако по принятым критериям можно судить только о преобладании нефтяных или биогенных углеводородов, но не о количественном их содержании.
Основную долю в общую массу биогенных УВ вносит фитопланктон, ежегодно создающий (70–103) × 1015 г органического углерода [2]. Остальные организмы по уменьшению вклада располагаются в следующем порядке: бактериобентос > > бактериопланктон > зоопланктон [5].
Начиная с 2010 г., в Азовском море доминирующий комплекс фитопланктона представлен полигалобными видами диатомовых и динофитовых водорослей: Pseudosolenia calcaravis (M. Shultze) Schroeder, Thalassiosira excentrica (Ehr.) Cl., Thalassionema nitzschioides Grun, Leptocylindrus danicus Cl., Sceletonema costatum (Grev.) Cl. В 2013 г. большую долю в альгоценозе открытой части моря занял черноморский вселенец Actinoptychus undulatus (Bail) Ralfs. Биомасса фитопланктона в собственно море находилась на уровне 1200–1500 мг/м3. В Таганрогском заливе с 2007 до 2012 гг. биомасса фитопланктона возрастала с 3380 до 6020 мг/м3. Эти годы характеризовались повышенным температурным фоном и ветровой депрессией. Летом массовое развитие водорослей охватывало всю акваторию Таганрогского залива. Основу биомассы формировали синезеленые водоросли. Особенно мощные “цветения” отмечались в восточной и центральной части залива [13].
По данным многолетних наблюдений (2007–2014 гг.) в юго-восточном районе Азовского моря биомасса микроводорослей менялась в диапазоне 100–1600 мг/м3. В большинстве районов по биомассе и численности доминировали одни и те же виды динофитовых микроводорослей [3].
В открытой северо-восточной части Черного моря наибольший вклад, как в численность (40 и 23%), так и биомассу (55 и 42%) фитопланктона вносят диатомовые и динофитовые водоросли. Обилие планктонных водорослей в прибрежном районе моря в 2–3 раза выше, чем на глубоководных станциях. В верхнем горизонте моря обычно доминируют диатомовые и примнезиевые водоросли, с увеличением глубины в значениях биомассы значительно повышается роль крупных видов динофитовых водорослей [4, 16].
В статье [32] приводятся результаты интеркалибрационных исследований по содержанию фитопланктона в Черном море, проведенных лабораториями Болгарии, Украины и России, согласно которым общая биомасса фитопланктона в море составляет 1935–2974 мг/м3.
Для идентификации происхождения УВ используются данные хроматографического анализа н-алканов, являющиеся биологическими маркерами [21]. Их изучение позволяет с достаточной точностью определить является ли органическое вещество воды и донных отложений исследуемой акватории аллохтонным или автохтонным.
Анализ состава парафиновых УВ в воде Азовского и Черного морей, проведенный в различные сезоны 2011–2015 гг. показал, что в подавляющем большинстве исследованных проб воды присутствуют УВ, продуцированные водными организмами, что подтверждает необходимость учета биогенного углеводородного фона при оценке уровня нефтяного загрязнения [14].
В настоящее время количественная оценка биогенной составляющей в общем потоке нефтяного загрязнения в морской среде находится на стадии доработки.
Целью данной работы было изучение количественного состава УВ, содержащихся в массовых видах фитопланктона Азовского и Черного морей.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЙ
Все используемые в работе реактивы имели квалификацию “ос. ч.”.
В качестве объектов исследования использованы образцы фитопланктона, предоставленные Федеральным исследовательским центром Институт биологии южных морей имени А.О. Ковалевского РАН (ФИЦ ИнБЮМ). Образцы культур были разделены на две группы, которые культивировались при разных условиях. Первая группа образцов, включающая синезеленые (Spirulina platensis), зеленые (Tetraselmis viridis), диатомовые (Phaeodactylum tricornutum) водоросли, культивировалась в отделе биотехнологий и фиторесурсов ФИЦ ИнБЮМ.
Вторая группа образцов, включающая сине-зеленые (Synechococcus sp.), динофитовые (Prorocentrum cordatum) и диатомовые (Chaetoceros curvisetus) водоросли, выращивалась в лаборатории Азово-Черноморского филиала ФГБНУ “ВНИРО” (“АзНИИРХ”). Для накопления необходимой для анализа биомассы водоросли выращивали в стерильных колбах различного объема, наполненны искусственной морской водой при следующих условиях: соблюдение стерильности (помещения, посуды, питательной среды), аэрация воздухом колб с водорослями и освещенность от 7 до 40 микромолей квантов на квадратный метр в секунду в зависимости от культуры. Температура в боксе варьировала от +16 до +20°С соответственно в колбах была ниже на 2–3°С. Водородный показатель (рН) водной среды находился на уровне 8.0–8.2.
В зависимости от вида культуры пересев делали один раз на 4-ый, 7-ой и 20-ый день. Для предотвращения влияния плотностного фактора у водорослей. Посуду для пересева обрабатывали концентрированной соляной кислотой, затем стерилизовали в паровом стерилизаторе DGM-80 при 120°С под давлением 2 атмосферы в течение 3–4 часов.
Синезеленые микроводоросли культивировали на среде Zarrouk. Остальные микроводоросли культивировали на среде Конвея. Состав питательной среды Конвея был расширен, аналогично среде Guillard F/2. В среду были включены дополнительные питательные вещества (соединения кремния, мочевина) и витамины (В1, В6, В12). Среда готовилась на стерилизованной бидистиллированной воде.
Потребность микроводорослей в микро- и макроэлементах различна, поэтому при выращивании использовали универсальную питательную среду, на которой можно получить максимальные биомассы. Такие оптимальные условия были подобраны путем проведения экспериментов и расчета концентрации клеток в культурах. Концентрацию клеток определяли прямым расчетом в камере “Горяева” под микроскопом. Вид динофитовых водорослей Prorocentrum cordatum в данных условиях и на модернизированной среде Конвея увеличил концентрацию клеток с 0.1025 до 0.2808 мг/дм3 в течение нескольких суток.
Количество полученной биомассы фитопланктона определяли гравиметрическим методом после фильтрования через стекловолокнистые фильтры с диаметром пор 0.47 мкм. Содержание липидов определяли по весу после экстракции смесью ацетона с хлороформом (1 : 1) и выпаривания растворителей. Выделение УВ из полученных экстрактов осуществляли методом тонкослойной хроматографии.
Выпаренные элюаты углеводородов после взвешивания растворяли в 100 мкл гексана, 1 мкл сконцентрированного элюата микрошприцем вместимостью 10 мкл вводили в инжектор хроматографа. Состав выделенных углеводородов определяли на газовом хроматографе “Кристалл 2000М” (фирма “Хроматэк”, Россия) с пламенно-ионизационным детектором и капиллярной хроматографической колонкой длиной 30 м и сечением 0.25 мм (фаза NB 1701). Идентификацию УВ проводили по стандартному образцу смеси парафиновых углеводородов в гексане с массовой концентрацией каждого компонента 1000 мкг/см3 (фирма “SUPELCO”, США).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
В процессе образования биогенных углеводородов основное значение имеет липидно-углеводородный комплекс, который является составной частью органических веществ. После получения достаточной биомассы фитопланктона проводились эксперименты по выделению углеводородов из липидных фракций.
Извлечение УВ из липидных фракций культивированных видов фитопланктона проводили четыреххлористым углеродом с последующим концентрированием экстракта и выделением углеводородов в тонком слое оксида алюминия III степени активности в системе растворителей гексан–четыреххлористый углерод–уксусная кислота (70 : 30 : 2). После разделения слой оксида алюминия с зоной УВ (Rf = 0.7–0.9) счищали на фильтр и элюировали гексаном. Элюат переносили в лодочки из фольги для взвешивания и выпаривали до постоянного веса. Полученные весовым методом результаты показали, что в 1 мг разных видов фитопланктона содержится от 0.004 до 0.007 мг биогенных углеводородов (табл. 1). В работе [8] приводятся более высокие концентрации УВ в культивированных водорослях (три вида динофитовых и два вида зеленых водорослей) – от 12.5 до 19.2 мг/100 мг. Концентрации УВ определялись денситометрированием на силуфольных пластинках, что объясняет расхождения с результатами, полученными нами гравиметрическим методом, не зависящим от состава определяемых УВ.
Таблица 1.
Содержание УВ в липидных фракциях фитопланктона
| Виды фитопланктона |
Кол-во фитопланктона, мг | Содержание липидов, мг | Содержание УВ, мг | Содержание УВ в 1 мг фитопланктона, мг |
|---|---|---|---|---|
| Synechococcus sp. (синезеленые) |
131 | 7.26 | 0.76 | 0.006 |
| Prorocentrum cordatum (динофитовые) |
187 | 10.37 | 0.87 | 0.005 |
| Chaetoceros curvisetus (диатомовые) | 158 | 7.12 | 0.61 | 0.004 |
| Phaeodactylum tricornutum (диатомовые) |
190 | 9.45 | 0.75 | 0.004 |
| Spirulina platensis (синезеленые) |
109 | 6.55 | 0.72 | 0.007 |
| Tetraselmis viridis (зеленые) |
160 | 9.91 | 0.88 | 0.006 |
Содержание липидов в различных видах фитопланктона варьировало от 4.5 до 6.2%, а углеводороды составляли от 8 до 11% от общей массы липидов (табл. 2).
Таблица 2.
Относительное содержание УВ в липидных фракциях фитопланктона
| Виды фитопланктона | Содержание липидов, % | Содержание УВ в фито, % | Содержание УВ в липидной фракции, % |
|---|---|---|---|
| Synechococcus sp. (синезеленые) |
5.54 | 0.58 | 10.47 |
| Prorocentrum cordatum (динофитовые) |
5.55 | 0.46 | 8.39 |
| Chaetoceros curvisetus (диатомовые) | 4.51 | 0.39 | 8.57 |
| Phaeodactylum tricornutum (диатомовые) |
4.97 | 0.39 | 7.94 |
| Spirulina platensis (синезеленые) |
6.0 | 0.66 | 11.00 |
| Tetraselmis viridis (зеленые) |
6.20 | 0.55 | 8.88 |
Полученные нами результаты находятся в диапазоне значений, приведенных в литературе, согласно которым количество липидных фракций в различных видах водорослей варьирует в пределах 0.5–15%, а углеводороды составляют 7–12% от массы липидов [1, 18].
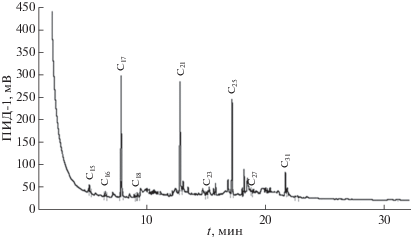
В составе углеводородов, выделенных из культивированных в лабораторных условиях синезеленых водорослей Synechococcus sp. Spirulina platensis, значительно преобладал гептадекан (рис. 1 и рис. 2). По данным [23] на долю С17 приходится до 90% от всех н-алканов.
Рис. 1.
Хроматограмма углеводородов, выделенных из синезеленых водорослей (Synechococcus sp.), культивированных в лабораторных условиях.
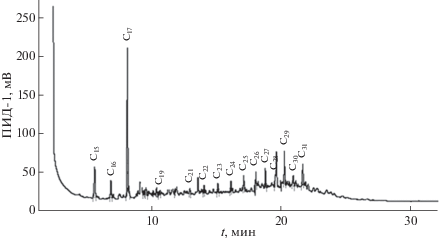
Рис. 2.
Хроматограмма углеводородов, выделенных из синезеленых водорослей (Spirulina platensis), культивированных в лабораторных условиях.
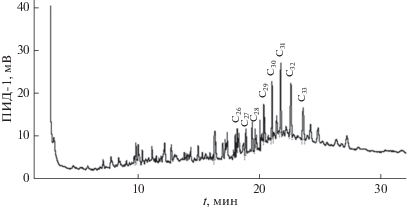
В составе н-алканов, выделенных из культуры зеленой водоросли Tetraselmis viridis, помимо С17 значительно преобладали углеводороды с нечетным числом атомов углерода, С21 и С25 (рис. 3). В морском фитопланктоне в большом количестве содержатся н-алканы с 15, 17 и 21 углеродными атомами [17, 29, 31]. Рядом авторов [10, 24, 25, 30] также было отмечено доминирование н-алканов С21, С23, С25, которые входят в воскоподобный слой клеточной оболочки, выполняющий у водорослей защитные функции.
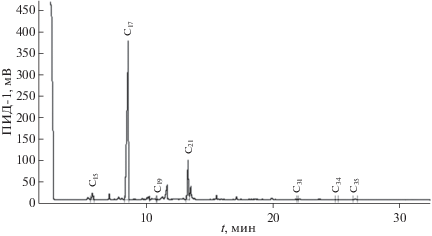
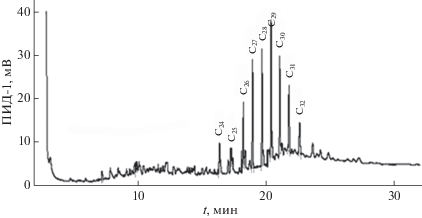
В составе углеводородов, выделенных из культуры диатомовой водоросли Phaeodactylum tricornutum, преобладал н-алкана С21. В диатомовой водоросли Chaetoceros curvisetus Cleve и динофитовой водоросли Prorocentrum cordatum (Ostenf) – состав УВ характеризовался монотонным распределением н-алканов в высокомолекулярной области с максимумом при С31 (рис. 4) и при С29 (рис. 5).
Рис. 5.
Хроматограмма углеводородов, выделенных из динофитовых водорослей (Prorocentrum cordatum (Ostenf.)).
Таким образом, при проведении исследований по оценке нефтяных загрязнений морской среды, для определения доли биогенных углеводородов в суммарном содержании УВ представляется возможным использовать данные о биомассе фитопланктона, попадающей в исследуемую пробу воды, а биомассу фитопланктона – рассчитать по концентрации хлорофилла “а” (хл “а”).
Существует зависимость, между количеством хл “а” и величиной продукции фитопланктона [7]. При мониторинговых исследованиях количество хл “а” чаще всего определяют спектрофотометрическим методом в соответствии с ГОСТ 17.1.04.02-90. В природных водах с низким содержанием хл “а” этот метод допускает существенные ошибки и требует большого объема анализируемых проб воды. Поэтому для определения хл “а” в водоемах с низкой продуктивностью целесообразно использовать более чувствительный люминесцентный метод [15].
ВЫВОДЫ
В местах массового цветения фитопланктона концентрации углеводородов, которыми в настоящее время при проведении экологического мониторинга ограничено понятие “нефтепродукты”, могут превышать величину предельно допустимой концентрации нефтепродуктов в водных объектах рыбохозяйственного значения. При этом получаемая информация об уровне нефтяного загрязнения исследуемого водного объекта оказывается некорректной.
Количество углеводородов в культивированных в лабораторных условиях массовых видов фитопланктона Азовского и Черного морей (синезеленых, зеленых, диатомовых и динофитовых) составляет 0.4–0.7 мг в 100 мг фитопланктона.
Состав УВ, выделенных из разных видов фитопланктона, характеризуется для диатомовых (Chaetoceros curvisetus Cleve, Phaeodactylum tricornutum) и динофитовых (Prorcentrum cordatum (Ostenf.)) водорослей преобладанием С21 и наличием гомологического ряда с максимумами С29 и С31, для зеленых (Tetraselmis viridis) и синезеленых (Synechococcus sp., Spirulina platensis) водорослей – преобладанием нечетных н-алканов С17, С21, С25.
Список литературы
Барашков Г.В. Химия водорослей. М.: Изд-во АН СССР, 1963. 142 с.
Виноградов М.Е., Лаппо С.С. Биологическая продуктивность океанических экосистем // Новые идеи в океанологии. 2004. Т. 1. С. 237–263.
Воловик С.П., Корпакова И.Г., Налетова Л.Ю., Барабашин Т.О. Фитопланктон и его изменения в юго-восточном районе Азовского моря летом 2007–2014 годов // Защита окружающей среды в нефтегазовом комплексе. 2015. № 11. С. 21–27.
Заремба Н.Б. Фитопланктонное сообщество южной части Керченского пролива в поздневесенний период 2009–2012 годов // Труды ЮГНИРО. 2013. Т. 51. С. 40–43.
Кленкин А.А. Павленко Л.Ф., Скрыпник Г.В., Ларин А.А. Биогенные углеводороды и их влияние на оценку нефтяного загрязнения Азовского моря // Водные ресурсы. 2010. Т. 37. № 5. С. 605–611.
Кленкин А.А. Корпакова И.Г., Павленко Л.Ф., Темердашев З.А. Экосистема Азовского моря: антропогенное загрязнение. Краснодар: Кубанский Государственный Университет, 2007. 324 с.
Минеева Н.М., Щур Л.А. Содержание хлорофилла “а” в единице биомассы фитопланктона (Обзор) // Альгология. 2012. Т. 22. С. 441–456.
Миронов О.Г., Миронов О.А., Муравьева И.П. Нефтяные углеводороды в микроперифитоне при низких уровнях нефтяного загрязнения морской воды // Защита окружающей среды в нефтегазовом комплексе. 2015. № 12. С. 13–16.
Миронов О.Г. Потоки нефтяных углеводородов через морские организмы // Морской экологический журнал. 2006. Т. 5. № 2. С. 5–14.
Миронов О.Г., Щекатурина Т.Л. Углеводороды в морских организмах // Гидробиологический журнал. 1976. Т. 12. № 6. С. 5–14.
Немировская И.А. Углеводороды в океане (снег–лед–вода–взвесь–донные осадки). М.: Научный мир, 2004. 328 с.
Пиковский Ю.И., Чернова Т.Г., Алексеева Т.А., Верховская З.И. О составе и природе углеводородов на участках современной серпентинизации в Океане // Геохимия. 2004. № 10. С. 1106–1112.
Сафронова Л.М., Лужняк О.Л. Трансформация фитопланктона Азовского моря в условиях современного осолонения // Материалы научно-практическая конференции “Морские биологические исследования: достижения и перспективы”, приуроченной к 145-летию Севастопольской биологической станции. Севастополь, 2016. С. 417–420.
Темердашев З.А., Павленко Л.Ф., Корпакова И.Г. и др. Генезис углеводородов в воде и донных отложениях Азовского и Черного морей / Под ред. Темердашев З.А. и др. // Экологическая химия. 2017. Т. 26. № 2. С. 101–108.
Темердашев З.А. Павленко Л.Ф., Ермакова Я.С. и др. Экстракционно-флуориметрическое определение хлорофилла “а” в природных водах / Под ред. Темердашев З.А. и др. // Аналитика и контроль. 2019. Т. 23. № 3. С. 323–333.
Ясакова О.Н. Современное состояние фитопланктона в бухтах городов Анапы и Геленджика, Чёрное море // Вестник Южного научного центра. 2014. Т. 10. № 1. С. 35–48.
Adeniji A.O., Okoh O.O., Okoh A.I. Analytical Methods for the Determination of the Distribution of Total Petroleum Hydrocarbons in the Water and Sediment of Aquatic Systems: A Review // Chemistry. 2017. 13 p.
Belyaeva A.N., Eglinton G. Lipid biomarker accumulation in the Kara Sea sediments // Oceanology. 1997. V. 37. № 5. P. 634–642.
Blumer M., Guillard R.R.L., Chass T. Hydrocarbons of marine phytoplankton // Marine Biology. 1971. V. 8. № 3б. P. 183–189.
Bouloubassi I., Saliot A. Investigation of anthropogenic and natural organic inputs in estuarine sediments using hydrocarbon markers (NAN, LAB, PAH) // Oceanologica Acta. 1993. V. 16. № 2. P. 145–161.
Brocks J.J., Summons R.E. Sedimentary Hydrocarbons, Biomarkers for Early Life // Treatise on geochemistry. 2003. V. 8. P. 63–115.
Clark R.C.J., Blumer M. Distribution of n-paraffin’s in marine organisms and sediment // Limnology and Oceanography. 1967. V. 12. P. 79–87.
Corner E.D. Pollution studies with marine plankton. Part 1. // Advances in marine biology. 1978. V. 15. P. 289–380.
Garetova L.A. Hydrocarbons in a lagoon estuary of the Tatar Strait // Izv. TINRO. 2013. V. 172. P. 196–207.
Hunt J.M. Petroleum geochemistry and geology. San Francisco: W.H. Freeman and Company, 1979. 617 p.
Ladygina N., Dedyukhina E.G., Vainshtein M.B. A review on microbial synthesis of hydrocarbons // Process Biochemistry. 2006. V. 41. № 5. P. 1001–1014.
NAS (National Academy of Sciences) // Oil in the Sea III: Inputs, Fates, and Effects. National Research Council. – Washington, D.C.: The National Academies Press, 2003. 265 p.
Nikanorov A.M., Stradomskaya A.G. The role of biogenic hydrocarbons in the assessment of oil pollution of freshwater bodies // Water Resources. 2009. V. 36. № 1. P. 61–67.
Penkoa L., Bajtb O. Aliphatic and polycyclic aromatic hydrocarbons in surface sea water of the GULF of Trieste (northern ADRIATIC) // Marine Pollution Bulletin. 2019. V. 142. P. 103–111.
Rostami S., Abessi O., Amini-Rad H. Assessment of the toxicity, origin, biodegradation and weathering extent of petroleum hydrocarbons in surface sediments of Pars Special Economic Energy Zone, Persian Gulf // Marine Pollution Bulletin. 2019. V. 138. P. 302–311.
Sakari M., Ting L.S., Houng L.Y. Urban effluent discharge into rivers; a forensic chemistry approach to evaluate the environmental deterioration // World Applied Sciences Journal. 2012. V. 20. №. 9. P. 1227–1235.
Moncheva S., Pantazi M., Pautova L., Boicenco L., Vasiliu D., Mantzosh L. Black Sea Phytoplankton Data Quality – Problems and Progress // Turkish Journal of Fisheries and Aquatic Sciences. 2012. V. 12. P. 417–422.
Дополнительные материалы отсутствуют.