Океанология, 2020, T. 60, № 4, стр. 515-527
Вариации содержания тяжелых металлов в тканях голотурии Eupentacta fraudatrix в прибрежных водах Японского моря: влияние физиологических и антропогенных факторов
Л. С. Долматова 1, *, Е. Н. Слинько 1, Л. Ф. Колосова 1
1 Тихоокеанский океанологический институт им. В.И. Ильичева ДВО РАН
Владивосток, Россия
* E-mail: dolmatova@poi.dvo.ru
Поступила в редакцию 18.02.2019
После доработки 16.10.2019
Принята к публикации 16.12.2019
Аннотация
Представлены данные по временны́м (июль и сентябрь) и межгодовым вариациям содержания ряда тяжелых металлов в стенке тела, гонаде и кишке голотурии Eupentacta fraudatrix, обитающей в прибрежных водах двух бухт зал. Петра Великого Японского моря с разным уровнем антропогенного загрязнения. Показано, что основной мишенью для накопления Zn, Fe, Cu и Cd является гонада, Mn и Pb – стенка тела. При этом до определенной степени увеличения содержания тяжелых металлов в кишке изменения содержания большинства из них в стенке тела и/или гонадах асинхронны с этими изменениями в кишке и обусловлены преимущественно физиологическими причинами в период нереста, но в постнерестовом периоде важное значение приобретает уровень загрязнения среды. При повышении содержания тяжелых металлов в кишке выше некоторого предела контроль за их распределением в тканях нарушается, о чем свидетельствует синхронность изменений содержания тяжелых металлов в кишке и органе. Наличие корреляции между содержанием свинца в кишке и гонаде свидетельствует о возможности определения этого металла в гонадах для биоиндикации загрязнения среды.
ВВЕДЕНИЕ
Голотурии (Echinodermata, Holothuroidea) широко распространены в Мировом океане, однако наибольшее разнообразие видов и запасы отмечены в Азиатско-Тихоокеанском регионе. Голотурии составляют значительную массовую долю макрозообентоса Мирового океана [42], в ряде случаев являясь представителями доминирующих таксонов. Так, по разным данным, в дальневосточных морях их массовая доля может варьировать от 6.3% в Охотском море [16] до 12.1% в зал. Петра Великого Японского моря [17]. Некоторые виды голотурий широко используются в странах Юго-Восточной Азии для питания и как сырье для фармацевтической индустрии, что делает их ценным коммерческим объектом [42]. При этом в зал. Петра Великого, испытывающем значительное антропогенное воздействие [22], с 2003 по 2011 г. биомасса голотурий снизилась более чем в 6 раз [17].
Многие виды голотурий обитают в прибрежных морских водах [17, 35], подвергающихся интенсивному загрязнению тяжелыми металлами (ТМ), что может сопровождаться аккумуляцией ТМ в тканях морских гидробионтов. Значительное повышение концентраций ТМ в тканях этих животных может быть опасно как для них самих, так и для человека, употребляющего продукцию из этих животных. В связи с этим особое значение имеет мониторинг содержания тяжелых металлов в тканях голотурий.
Такой мониторинг может иметь значение и для оценки загрязнения морской среды. Наличие целого ряда методических сложностей при определении концентрации ТМ в морской воде в прибрежной зоне обусловили исследования по биоиндикации загрязнений с использованием гидробионтов [21]. При этом различная резистентность видов к отдельным ТМ, различия в механизмах адаптации предполагают, что для более полного представления об уровне загрязненности и его последствиях необходимо использовать разные виды гидробионтов. Однако исследования по мониторингу содержания ТМ в тканях голотурий и данные о возможности использования последних для биоиндикации загрязнения среды единичны [33, 43, 45].
Снижение численности коммерчески ценных видов голотурий привлекает внимание ученых к другим видам, ранее не являвшимся объектами коммерческого вылова, но представляющим интерес в качестве потенциальных источников биологически активных веществ [42]. К таковым относится и голотурия Eupentacta fraudatrix (D’yakonov & Baranova in D’yakonov, Baranova & Savel’eva, 1958), обычный обитатель прибрежных вод Японского моря. В ее тканях обнаружено высокое содержание вторичных метаболитов, оказывающих выраженное противогрибковое, антибактериальное и иммуномодулирующее действие [11]. E. fraudatrix ведет малоподвижный образ жизни на небольших глубинах [9]. Эта особенность ее поселений позволяет проводить исследования в относительно постоянных биотопах, что, в свою очередь, представляет интерес и для исследований по мониторингу загрязнения среды. В двух бухтах зал. Петра Великого – б. Алексеева и б. Витязь – E. fraudatrix селится избирательно, преимущественно в части бухты, граничащей с открытым морем. При этом в б. Алексеева обнаружены две цветные формы E. fraudatrix – розовая и оранжевая, в б. Витязь – только оранжевая [9]. Эти две бухты находятся под воздействием различных уровней антропогенного стресса: б. Алексеева расположена на о. Попова, в 20 км от материковой части крупного промышленного города Владивостока, а б. Витязь граничит с Дальневосточным морским биосферным государственным природным заповедником, и в прилежащей материковой части практически отсутствует крупное промышленное или сельскохозяйственное производство.
Многие ТМ необходимы для жизнедеятельности живых организмов. К эссенциальным металлам относятся, в частности, железо (Fe), марганец (Mn), медь (Сu), цинк (Zn). В небольших концентрациях они участвуют в метаболизме, в частности, как кофакторы многих ферментов, но при определенных условиях становятся токсичными [1]. Некоторые ТМ не имеют физиологического значения и считаются исключительно токсичными для организма. Одними из наиболее токсичных ТМ являются свинец (Pb) и кадмий (Cd). Однако в последнее время появились данные, позволяющие говорить об “эссенциальности” и этих двух элементов. В частности, свинец участвует в синтезе белка и в формировании скелета у позвоночных [1].
Ранее показано, что у голотурий, как и некоторых других иглокожих [44], происходят сезонные изменения уровней ТМ в тканях, зависящие, по-видимому, от уровня их физиологической активности [45]. Такие физиологически обусловленные колебания, очевидно, необходимо дифференцировать от изменений, вызванных антропогенными факторами, для правильной оценки состояния загрязнения среды и тканей самой голотурии. Однако эта проблема остается недостаточно исследованной, и данные о содержании ТМ в тканях голотурий приводятся чаще всего безотносительно к периодам их физиологической активности [33, 43 ].
Цель работы – выявление особенностей временны́х (летне-осенних) и межгодовых вариаций содержания ТМ в тканях голотурий E. fraudatrix, обитающих в разных условиях антропогенного загрязнения, на примере двух бухт зал. Петра Великого.
МАТЕРИАЛ И МЕТОДЫ
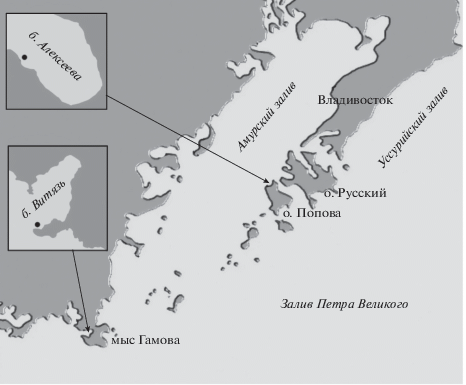
Сбор голотурии E. fraudatrix (оранжевая форма) проводили легководолазным способом в зал. Петра Великого Японского моря в б. Алексеева, в июле и сентябре 2008 г. (для сравнения данных использовали результаты измерений 2016 г. [10]), а также в б. Витязь в сентябре 2009 и сентябре 2017 гг. на глубине 1–1.5 м. Схема исследовательских станций представлена на рис. 1.
Температуру морской воды измеряли на глубине 1 м гидрологическим термометром с точностью до 0.1°C. Соленость определяли, используя солемер Guildline Portasal- 8410 (Ocean Scientific International Ltd, Великобритания), калибровку которого проводили с помощью стандартной морской воды IASPO. Для каждой пробы воды проводились 2 параллельных измерения. В б. Алексеева использовали 10 экземпляров голотурии в каждый из исследуемых периодов, в б. Витязь в сентябре 2009 г. – 20 экземпляров, в сентябре 2017 г. – 30 экземпляров. Органы трех-четырех животных (б. Алексеева) или пяти (б. Витязь) перед анализом объединяли. Учитывая, что у голотурии E. fraudatrix, сроки жизни которой не установлены, существует зависимость накопления ТМ от длины тела (минимальный и максимальный размеры при сборе животных составляли от 0.5 до 7 см, исключительно редко до 9 см [33], животных в выборке стандартизовали по длине тела. В данной работе использовали экземпляры с длиной тела 3.5–5.5 см как соответсвующие наиболее часто встречаемой размерности (до 80% от всех собираемых животных в августе), имеющие развитые гонады и наиболее высокую физиологическую активность в период нереста [8]. У голотурий выделяли стенку тела, кишку и гонаду (только у самок). Половую принадлежность определяли по цвету гонад [2]. Ткани голотурий высушивали до постоянной массы при 85°C. Высушенные ткани (0.2–1 г) гомогенизировали и минерализовали в смеси 16 M HNO3 и 11.3 M HClO4 (3 : 1, об./об.) как описано ранее [26]. Определение концентрации тяжелых металлов проводили методом атомно-абсорбционной спектрофотометрии (спектрофотометр Shimadzu 6800, Япония). Правильность анализов контролировали с использованием Европейского стандартного образца ERM-CE278 (mussel tissue) Института стандартных материалов и измерений (Бельгия). Измерения проводили в трех повторностях. Порог определения составил 0.25 мкг/г сухой массы для Cd, Cu, Zn, Mn и 0.5 мкг/г для Fe и Pb. Статистическую обработку проводили с использованием программ Excel (Microsoft Corporation) и GraphPad Prism v. 6.01 (GraphPad Software, Inc.). Результаты представлены как среднее значение ± стандартная ошибка среднего. Для определения нормальности распределения данных использовали тест Колмогорова–Смирнова. При анализе данных по временны́м изменениям содержания металлов в отдельных тканях и при оценке результатов, полученных в разных бухтах, достоверность различий определяли с использованием t-критерия Стьюдента (при соответствии данных предположению о нормальном распределении) или с использованием U-теста Манна-Уитни (в непараметрических выборках). Разницу между значениями считали достоверной при P < 0.05. Для выявления попарных корреляций между содержанием металлов в отдельных тканях использовали коэффициент Пирсона при нормальном распределении данных или, в отсутствие нормального распределения, непараметрический анализ Спирмана (P = 0.05).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Ранее было показано, что распределение ТМ в тканях E. fraudatrix, как и у других голотурий, органоспецифично, при этом различные металлы в весенне-осенний период накапливаются по-разному [9, 10, 33]. Однако в проведенных исследованиях либо не было дано оценки временны́м изменениям [9, 33], либо они изучались безотносительно к влиянию загрязняющих факторов внешней среды, что не позволяло в должной мере выявить вклад биотических факторов в динамику концентраций ТМ в тканях голотурии [10]. В настоящей работе было уделено внимание не только межсезонным, но и межгодовым вариациям концентраций ТМ в тканях с учетом разного уровня загрязнения в местах обитания вида.
Результаты определения содержания ТМ в тканях E. fraudatrix в летне-осенние периоды разных лет в б. Алексеева представлены в табл. 1.
Таблица 1.
Распределение тяжелых металлов в органах голотурии E. fraudatrix, обитающей в б. Алексеева
| Орган | Период наблюдений |
Концентрация тяжелых металлов, мкг/г сухой массы | |||||
|---|---|---|---|---|---|---|---|
| Cu | Zn | Fe | Mn | Cd | Pb | ||
| Стенка тела |
Июль 2008 | 4.00 ± 0.25 | 11.60 ± 1.11 | 39.14 ± 3.13 | 27.01 ± 3.62 | 0.15 ± 0.01 | 17.08 ± 1.12 |
| Июль 2016 | 0.65 ± 0.01**** | 17.85 ± 0.17** | 34.54 ± 1.32 | 29.60 ± 0.75 | 0.24 ± 0.01** | н/опр | |
| Сент. 2008 | 0.69 ± 0.23d | 19.88 ± 1.97d | 45.76 ± 11.45 | 22.83 ± 2.4 | 0.38 ± 0.03c | 5.01 ± 0.66d | |
| Сент. 2016 | 1.00 ± 0.03d | 20.33 ± 0.20 | 53.50 ± 2.36a | 29.10 ± 0.62 | 0.36 ± 0.04a | н/опр | |
| Кишка | Июль 2008 | 32.18 ± 1.98 | 128.1 ± 14.5 | 964.8 ± 121.9 | 30.65 ± 2.18 | 3.34 ± 0.08 | 6.48 ± 0.34 |
| Июль 2016 | 6.31 ± 0.12**** | 124.1 ± 17.0 | 122.9 ± 1.7**** | 2.71 ± 0.23*** | 1.85 ± 0.05*** | н/опр | |
| Сент. 2008 | 1.92 ± 0.23e | 65.04 ± 6.51d | 124.1 ± 13.1d | 2.14 ± 0.15c | 2.19 ± 0.11c | 5.75 ± 1.27 | |
| Сент. 2016 | 9.84 ± 0.11e, **** | 79.03 ± 7.65c | 144.5 ± 8.9 | 3.71 ± 0.21d, ** | 1.67 ± 0.08* | н/опр | |
| Гонада | Июль 2008 | 2.28 ± 0.11 | 63.17 ± 4.36 | 68.53 ± 4.25 | 8.52 ± 0.90 | 0.69 ± 0.04 | 2.45 ± 0.06 |
| Июль 2016 | 2.80 ± 0.09 | 65.18 ± 2.21 | 57.09 ± 2.31 | 1.76 ± 0.10*** | 0.60 ± 0.04 | н/опр | |
| Сент. 2008 | 1.78 ± 0.08 | 83.54 ± 1.25a | 257.5 ± 23.3c | 4.24 ± 0.55a | 0.91 ± 0.11 | 3.26 ± 0.17a | |
| Сент. 2016 | 5.03 ± 0.17d, **** | 107.4 ± 5.1d, * | 182.4 ± 19.1c | 3.96 ± 0.24c | 0.88 ± 0.05a | н/опр | |
Примечание. Курсивом выделены данные, опубликованные авторами ранее [10]. н/опр – ниже порога определения для метода. a – P < 0.05, b – P < 0.01, c – P < 0.005, d – P < 0.001, e – P < 0.0001 по сравнению с июлем. * P < 0.05. ** P < 0.01. *** P – < 0.005. **** P – < 0.001 по сравнению с 2008 г.
В июле 2008 г. в б. Алексеева наибольшая концентрация всех ТМ, кроме свинца, отмечена в кишке, что соответствует представлению о том, что ТМ поступают в организм голотурии преимущественно с пищей [36]. При этом основной мишенью для накопления Zn, Fe и Cd явилась гонада, а Pb, Mn и Cu накапливались преимущественно в стенке тела. Концентрация Pb в стенке тела была даже выше, чем в кишке. Для Pb его преимущественное содержание в стенке тела описано и для некоторых других голотурий [48] и, по-видимому, связано с детоксицирующей ролью связывания свинца цитоскелетоном [29]. Сходным образом, в июле 2016 г. концентрации Zn, Fe и Cd снижались в ряду кишка > гонада > стенка тела, а для Mn основной мишенью являлась стенка тела. Такая тропность Mn к стенке тела, по-видимому, объясняется его важной ролью в построении соединительной ткани и в работе мышц [27]. Основной мишенью для Cu в июле 2016 г. были уже гонады.
Июльский ряд распределения сохранялся и в исследуемые сентябрьские периоды для Cu и Cd, однако для Zn и Fe ряд убывания концентраций выглядел уже как гонада > кишка > стенка тела, что свидетельствует о том, что основное накопление этих металлов происходит в гонаде и направлено, по-видимому, на восстановление уровня этих металлов, израсходованных в период летнего нереста, к сентябрю уже заканчивающегося [13]. Гонада также заняла второе место после стенки тела в накоплении Mn, что указывает на восстановление уровня этого металла в постнерестовый период. В концентрировании же Pb кишка и стенка тела в сентябре 2008 г. поменялись местами, что возможно связано со снижением поступления свинца в организм по сравнению с июлем и снижением необходимости его секвестрации. Таким образом, для большинства металлов, кроме Mn и Pb, основной мишенью в исследованные периоды явилась гонада, при этом для таких важных эссенциальных металлов как Fe, Zn и Mn накопление в гонадах особенно возрастало осенью.
Однако в связи с наибольшей долей стенки тела в суммарной массе органов, самое большое количество всех металлов в различные периоды наблюдений находилось в стенке тела (табл. 2).
Таблица 2.
Распределение тяжелых металлов в органах голотурии E. fraudatrix, обитающей в б. Алексеева, исходя из доли в суммарной массе органов
| Орган | Период наблюдений/доля |
Концентрация тяжелых металлов, мкг/г сухой массы | |||||
|---|---|---|---|---|---|---|---|
| Cu | Zn | Fe | Mn | Cd | Pb | ||
| Стенка тела |
Июль 2008/0.83 | 3.32 | 9.63 | 32.49 | 22.42 | 0.12 | 14.18 |
| Июль 2016/0.69 | 0.45 | 12.31 | 23.83 | 20.42 | 0.17 | н/опр | |
| Сент. 2008/0.78 | 0.48 | 15.51 | 35.70 | 17.80 | 0.30 | 3.91 | |
| Сент. 2016/0.75 | 0.75 | 15.24 | 40.12 | 21.80 | 0.48 | н/опр | |
| Кишка | Июль 2008/0.04 | 1.29 | 5.12 | 38.60 | 1.23 | 0.13 | 0.26 |
| Июль 2016/0.04 | 0.25 | 4.96 | 4.90 | 0.11 | 0.07 | н/опр | |
| Сент. 2008/0.09 | 0.15 | 5.20 | 10.00 | 0.17 | 0.17 | 0.46 | |
| Сент. 2016/0.1 | 0.98 | 7.90 | 14.45 | 0.37 | 0.17 | н/опр | |
| Гонада | Июль 2008/0.13 | 0.29 | 8.20 | 8.90 | 1.11 | 0.09 | 0.32 |
| Июль 2016/0.27 | 0.76 | 17.60 | 15.41 | 0.48 | 0.16 | н/опр | |
| Сент. 2008/0.14 | 0.25 | 11.70 | 36.05 | 0.59 | 0.13 | 0.45 | |
| Сент. 2016/0.15 | 0.75 | 16.05 | 27.36 | 0.59 | 0.13 | н/опр | |
Эти данные сходны с таковыми, полученными для голотурии Holothuria tubulosa, стенка тела которой содержит основную часть (до 87%) общей нагрузки организма металлами [38]. При этом практически весь Mn и Pb находятся в стенке тела. В июле 2016 г. содержание Fe и Cd в стенке тела и кишке было примерно одинаковым. Гонада, по массе занимающая второе место, по содержанию большинства металлов в июле 2008 г. находилась на последнем месте, а в июле 2016 г. – на втором, для Cu – даже на первом месте.
Значительное повышение массовой доли гонады в июле 2016 г. по сравнению с июлем 2008 г. свидетельствует о том, что в эти периоды голотурии находились на разных стадиях размножения. Это подтверждается разным уровнем прогрева воды в эти периоды: температура воды при отборе проб составила в июле 2008 г. 17°С, в июле 2016 г. – 18.6°С. Учитывая данные Крючковой [13] о том, что благоприятным для нереста голотурий является температурный диапазон морской воды 19–21°С, можно предполагать, что при более высоких температурах в июле 2016 г. голотурии в момент сбора уже были готовы к нересту, в отличие от животных в 2008 г. По-видимому, с этим связано такое повышение вклада гонады в общее содержание ТМ организма, что соответствует данным, полученным Лобановой [15] о накоплении ТМ в гонадах у рыб в преднерестовом периоде.
В сентябрьские периоды гонада была также на втором месте после стенки тела по содержанию большинства эссенциальных металлов, но на третьем для Cd, содержание которого во все исследуемые периоды было наименьшим в гонаде, а также Pb (в сентябре 2008 г.).
При этом сравнение данных по содержанию эссенциальных ТМ в кишке E. fraudatrix в бухте Алексеева в июле и сентябре 2008 г. (табл. 1) показало, что в сентябре произошло значительное снижение содержания исследованных эссенциальных металлов: Cu – в 17, Zn – в 2, Fe – в 8, Mn – в 14 раз. Содержание же токсичных Cd и Pb снизилось в гораздо меньшей степени (Cd) или вообще не изменилось (Pb).
Поскольку голотурии являются преимущественно сестонофагами [5], ТМ могут попадать в кишку с микроорганизмами и мелким планктоном, накапливающими ТМ из воды. Накопление ТМ в планктоне определяется как общим уровнем загрязнения воды, так и содержанием биодоступных форм металлов [14]. При этом температура воды является определяющим фактором, влияющим на биодоступость металлов [6]. В сравниваемые периоды она имела близкие значения (в июле 2008 г. – 17°С, в сентябре 2008 г. – 17.8°С). Близкие значения имели и показатели тесно связанной с температурой солености: 29.3 и 31.6‰ в июле и сентябре соответственно. Кроме того, пик цветения планктона, который обычно сопровождается увеличением его потребления другими гидробионтами и увеличением содержания ТМ в их организмах, в зал. Петра Великого обычно наблюдается в августе [20], поэтому эти сезонные факторы с большой вероятностью можно исключить как причину снижения содержания ТМ в голотуриях в сентябре по сравнению с июлем. Можно предположить, что загрязнение морской воды в июле происходило за счет увеличения материкового стока вследствие ливней. Муссонный климат Приморского края определяет максимальное количество осадков в летний период, и в частности, сильные ливни наблюдались в июле накануне сбора голотурий. Это соответствует данным ряда авторов о преимущественном загрязнении воды ТМ в весенне-летний период по сравнению с осенне-зимним, связанным, по-видимому, с поступлением ТМ из почвы и рек в море в результате весеннего снеготаяния и/или интенсивных дождей [24].
При этом изменения концентраций ТМ в стенке тела и гонаде голотурии имели разнонаправленный характер. Так, в сентябре в стенке тела произошло достоверное снижение по сравнению с июлем уровня Cu и Pb, но возросло содержание Cd при неизменных концентрациях Mn и Fe. В гонаде же содержание Mn снизилось, а концентрации Fe, Zn и Pb возросли, содержание Cu и Cd не изменилось. При этом изменения концентрации металлов в этих органах были не столь велики, как в кишке, колеблясь от двух до четырекратных для разных металлов. Подобная дифференцированность сезонных изменений содержания ТМ в органах отмечена у моллюсков [28] и обусловлена, по-видимому, особенностями метаболической активности и востребованности ТМ в тканях и соответствующим перераспределением ТМ.
В сентябре 2016 г., напротив, отмечено достоверно повышенное содержание Cu и Mn в кишке по сравнению с таковым в июле, однако изменения не превышали двукратную величину. Концентрации Fe и Cd не изменились, а содержание Zn, как и в 2008 г., снизилось. В основе указанных изменений могут лежать различия гидрологических, климатических и биогеохимических условий в разные месяцы. Температурный режим в июле и сентябре 2016 г. значительно не различался: 18.6 и 19.6°С соответственно, что делает маловероятным различия в окислительно-восстановительных условиях в этот период и в соответствующих изменениях биодоступности ТМ [6]. Однако можно предполагать, что увеличение концентраций меди и марганца в кишке связано с увеличенным поступлением в бухту этих металлов с материковым стоком в летний период, особенно в августе, когда наблюдалась чрезвычайно высокая паводковая активность, связанная с большим количеством тайфунов, в том числе с тайфуном Лайонрок в конце августа 2016 г. Так, загрязнение вод Амурского залива, частью которого является б. Алексеева, Mn и Cu связывают со стоками из р. Раздольной [20]. В свою очередь, возросший уровень этих металлов обеспечивает достаточное потребление их планктоном во время пика его цветения в августе. Снижение же уровня цинка в кишке голотурии как в сентябре 2016 г., так и в сентябре 2008 г., по сравнению с июлем, по-видимому, является результатом снижения его концентрации в морской воде и в планктоне вследствие возрастания количества планктона в августе. Zn – наиболее востребованный металл при размножения планктона, и массовое цветение последнего может приводить к его дефициту [7].
При этом концентрации всех исследованных ТМ в гонадах превосходили июльские значения. В стенке тела в сентябре 2016 г. по сравнению с июлем концентрации ТМ также возрастали (Cu, Fe, Cd) или не изменялись (Zn, Mn). Изменения не превышали двукратную величину, за исключением таковых для Mn и Fe (возрастание концентрации в 2.3 и 3 раза соответственно) в гонадах. Возрастание уровня ТМ по окончании нерестового периода описано у моллюсков. В периоды максимальной физиологической активности, в частности, при нересте у них происходит значительное расходование ТМ, что вызывает последующую необходимость восстановления их содержания для поддержания физиологически необходимого уровня метаболизма, с чем, по-видимому, и связано повышение уровня ТМ в тканях гидробионтов в сентябре по сравнению с летним периодом [18]. Сезонные различия в содержании ТМ у голотурии могут быть также связаны с летним “эффектом разбавления” (снижением концентрации за счет увеличения массы), описанным у моллюсков [28]. Однако, принимая во внимание, что средние массы стенки тела голотурий в июле и сентябре 2016 г. практически не различались (1.24 ± 0.08 г в июле и 1.33 ± 0.09 г в сентябре), по-видимому, эффект разбавления можно отнести только к гонаде, поскольку двукратное превышение массовой доли гонады сопровождалось почти двукратным снижением концентрации большинства ТМ в июле по сравнению с сентябрем. При этом с учетом данных табл. 2, гонады содержали одинаковое количество этих ТМ в июле и сентябре. Только содержание Fe и Mn в гонаде в сентябре возрастало. Таким образом, в гонадах, независимо от сезона, поддерживалось стабильное содержание большинства ТМ, а восстановительное “запасание” в сентябре происходило преимущественно в стенке тела. Это свидетельствует в пользу предположения о физиологической основе накопления ТМ в сентябре в организме голотурии. Вместе с тем, накопление металлов происходило, по-видимому, на фоне сезонного повышения загрязнения среды этими металлами, как сказано выше, и это повышение могло оказывать влияние на степень накопления отдельных ТМ в тканях голотурии. Это предположение согласуется с данными, полученными на моллюсках, о том, что характер изменений ТМ (снижение или увеличение) в постнерестовом периоде у морских беспозвоночных может зависеть от степени загрязнения среды [23].
При этом асинхронность изменений концентраций ТМ в отдельных органах и кишке E. fraudatrix в течение летне-осеннего сезона была отмечена и в 2008 г. Сходные данные о разнонаправленных сезонных изменениях содержания ТМ в различных органах голотурий были продемонстрированы ранее Warnau et al. [49], на основании чего авторы сделали вывод о том, что сезонные изменения в аккумуляции металлов обусловлены в большей степени физиологическими, чем антропогенными факторами.
Для оценки влияния межгодовых вариаций было проведено сравнение концентраций ТМ в июле 2016 и 2008 гг. и в сентябре в эти же годы. Сравнение июльских значений содержания ТМ показало, что в 2016 г. в кишке голотурии содержание Cu было ниже, чем в 2008 г., в 5.5, Fe – в 8, Mn – в 11.3 раза. Концентрация Zn не изменилась. Такое значительное превышение содержания Cu, Fe и Mn, но не Zn в кишке в июле 2008 г. по сравнению с июлем 2016 г. подтверждает высказанное выше предположение о чрезвычайно высокой загрязненности воды и грунтов эссенциальными ТМ в бухте в июле 2008 г. В пользу этого предположения свидетельствуют и данные о значительном росте содержания ТМ в донных осадках в б. Алексеева в июне 2008 г. [33], обусловленном, по-видимому, возобновлением производственной активности. И напротив, снижение концентрации ТМ в кишке в 2016 г. по сравнению с 2008 г., по-видимому, связано с очищением б. Алексеева, наиболее вероятно, в связи с существенным сокращением объема городского промышленного производства после 2010 г. и улучшения экологической ситуации [19]. Тем не менее, в кишке в июле 2016 г. отмечено превышение уровня Cd по сравнению с 2008 г. в 1.8 раза. Это дает основания предполагать, что загрязнение морской среды Cd продолжается, что подтверждается данными измерений уровня кадмия в морской воде в зал. Петра Великого, показавшими значительный его рост в период после 2010 г. [19].
При этом в июле 2016 г. по сравнению с июлем 2008 г. в стенке тела содержание Fe и Mn не изменялось, Zn и Cd возрастало (в 1.5 и 1.6 раза соответственно), а Cu даже снижалось (в 5.8 раза). В гонадах не изменялось содержание ни одного из ТМ, кроме Mn (снижение в 5 раз). Эти данные подтверждают сделанный выше вывод о том, что у голотурий распределение ТМ по тканям является физиологически регулируемым, и свидетельствуют о том, что, несмотря на изменения в поступлении ТМ в организм голотурий, они были способны поддерживать определенный уровень ТМ в гонадах в летний период, когда обычен массовый нерест [13]. Этот уровень, который, по-видимому, был достаточным для обеспечения нерестовой активности и при этом не оказывал токсичного действия, можно определить как нормальный.
Сравнение же сентябрьских значений содержания ТМ в кишке показывает, что концентрации Cu и Mn в 2016 г. возрастали по сравнению с 2008 г. в 5.1 и в 1.7 раза соответственно, а концентрация Cd, наоборот, снижалась в 1.3 раза, ниже порога определения снизилось и содержание Pb, содержание Fe и Zn не изменялось. Диапазон изменений содержания ТМ, кроме Cu, был значительно ниже, чем при сравнении июльских значений 2008 и 2016 гг. Эти данные свидетельствуют в пользу предположения об очищении б. Алексеева по сравнению с 2008 г. от загрязнения ТМ, за исключением Cu и Mn.
При этом в сентябре 2016 г. по сравнению с сентябрем 2008 г. в стенке тела содержание всех ТМ, кроме Pb, достоверно не изменялось, а концентрация Pb снижалась ниже порога определения. В гонадах в 2016 г. отмечено достоверное возрастание содержания Cu в 2.8 раза, Zn – в 1.3 раза, а содержание Pb, напротив, значительно снижалось. Отсутствие существенных изменений концентраций ТМ в стенке тела в сентябре в разные годы, несмотря на их разницу в кишке, свидетельствует о том, что в стенке тела поддерживалась нормальная физиологическая концентрация. В гонадах же, в отличие от июльских значений, в сентябре 2016 г. происходил рост уровня Cu на фоне его повышения в кишке по сравнению с сентябрем 2008 г. Тот факт, что даже значительно меньшее увеличение содержания Cu в кишке при сравнении сентябрьских значений (5-кратное) по сравнению с многократным возрастанием при сравнении июльских значений (17-кратным) сопровождалось возрастанием уровня Cu в гонаде, позволяет предположить, что концентрация металла, необходимого для функционирования гонад [4], в сентябре может контролироваться менее строго, чем в период нереста. В то же время увеличение содержания Zn, другого элемента, важного для нормального функционирования гонад [4] и активно расходуемого во время нереста гидробионтов [18], в отсутствие изменения его концентрации в кишке, свидетельствует о физиологической причине такого накопления.
Для выявления значения фактора загрязненности воды в накоплении ТМ был проведен также сравительный анализ содержания ТМ в тканях голотурий, обитающих в акваториях с разным уровнем загрязненности, в период относительного физиологического покоя (отсутствие нереста) в сентябре. Для сравнения с результатами, полученными в бухте Алексеева, находящейся близко от крупного города, были исследованы ткани животных, обитающих в б. Витязь, находящейся на границе морского заповедника, с предполагаемым низким уровнем антропогенного загрязнения материковой части. Результаты этого исследования представлены в табл. 3.
Таблица 3.
Распределение тяжелых металлов в органах голотурии E. fraudatrix, обитающей в б. Витязь
| Орган | Период наблюдений |
Концентрация тяжелых металлов, мкг/г сухой массы | |||||
|---|---|---|---|---|---|---|---|
| Cu | Zn | Fe | Mn | Cd | Pb | ||
| Стенка тела |
Сент. 2009 | 3.71 ± 0.22 | 24.98 ± 2.63 | 39.58 ± 2.55 | 15.80 ± 0.92 | 0.44 ± 0.15 | 5.33 ± 1.65 |
| Сент. 2017 | 4.18 ± 0.20 | 16.52 ± 0.24* | 17.91 ± 0.52** | 27.73 ± 0.52*** | н/опр | 2.27 ± 0.03** | |
| Кишка | Сент. 2009 | 28.72 ± 2.15 | 83.13 ± 1.12 | 871.9 ± 109.2 | н/изм | 4.25 ± 0.53 | 24.33 ± 2.38 |
| Сент. 2017 | 3.04 ± 0.33**** | 109.0 ± 9.0* | 277.4 ± 20.2** | 19.36 ± 1.22 | н/опр | 1.38 ± 0.01*** | |
| Гонада | Сент. 2009 | 14.6 ± 0.13 | 87.56 ± 7.34 | 213.0 ± 23.2 | 9.65 ± 0.98 | 2.46 ± 0.18 | 10.48 ± 0.79 |
| Сент. 2017 | 3.85 ± 0.44**** | 246.7 ± 22.0** | 200.8 ± 15.4 | 17.21 ± 1.45** | н/опр | 0.34 ± 0.01*** | |
Анализ распределения металлов по органам показывает, что концентрация Mn в б. Витязь была, как и в б. Алексеева, максимальна в стенке тела в сентябре в оба исследуемых года, Pb-только в сентябре 2017 г. По содержанию большинства металлов, в отличие от б. Алексеева, в б. Витязь на первое место выходила кишка, вследствие, вероятно, повышенного содержания этих ТМ в воде и, соответственно, пище. Вместе с тем, как и в б. Алексеева, на втором месте находилась по накоплению ТМ гонада, а по концентрации Zn в 2017 г., как и в б. Алексеева, гонада находилась на первом месте. Таким образом, основной мишенью для ТМ, кроме Mn и Pb, в обеих исследованных бухтах в постнерестовый период является гонада.
Сравнение содержания ТМ у голотурии E. fraudatrix в б. Алексеева в сентябре 2008 г. с таковым в б. Витязь в сентябре 2009 г. показало, что концентрация Cu в кишке животных была выше в б. Витязь в 15 раз, Fe – в 7 раз, Cd – в 2 раза, Pb – в 4.5 раза, что с высокой вероятностью свидетельствует о значительно большей загрязненности б. Витязь по сравнению с б. Алексеева в 2009 г.
Температура воды в исследумые периоды в б. Витязь составила в сентябре 2009 г. – 19.2°С, а в сентябре 2017 г. – 20.8°С, что близко к таковой в сравниваемые периоды в б. Алексеева и свидетельствует в пользу наличия сходных сезонных биогеохимических условий в бухтах. При этом высокая концентрация ТМ в акватории юго-западной части зал. Посьета, несмотря на соседство с морским заповедником, по-видимому, связана с отмечаемым в то время интенсивным загрязнением залива водами р. Туманган [3]. Сходные данные о высоком уровне загрязнения ТМ тканей гидробионтов в б. Витязь были получены в 1990-х годах Коженковой и Христофоровой [12], показавших сопутствующее загрязнению воды возрастание накопления ТМ в водорослях.
При этом в стенке тела голотурии в б. Витязь содержание Cu достоверно превышало таковое в б. Алексеева в 1.4 раза, содержание других ТМ не отличалось. В гонаде голотурии в б. Витязь содержание Cu было в 8.2 раза, Mn – в 2, Cd – в 2.7, Pb – в 3 раза выше по сравнение с таковыми в б. Алексеева. Концентрации других ТМ были одинаковыми в гонадах голотурий из обеих бухт. Эти данные подтверждают результаты, полученные при межгодовых сравнениях сентябрьских концентраций ТМ в органах голотурии в б. Алексеева и свидетельствуют о том, что в постнерестовый период накопления ТМ в стенке тела не происходит даже при значительном повышении их концентраций в кишке, но при этом изменения происходят в гонаде, в которой, вслед за кишечником, значительно растет содержание ряда металлов. По-видимому, в сентябре происходит изменение в характере перераспределения металлов между органами, направленное преимущественно на накопление ТМ в гонаде. Об этом же свидетельствуют данные, представленные выше (табл. 2, 3), о возрастании накопления эссенциальных ТМ в гонадах осенью. При этом, по-видимому, накопительная тенденция регуляции распределения ТМ в гонаде в условиях загрязнения морской воды приводит к значительной аккумуляции металлов в тканях гонады. Сходным образом, при анализе 8-летних данных, осеннее увеличение содержания Cu в тканях моллюска Macoma baltica достигало максимальных значений при увеличении загрязнения воды [40].
Известно, что различная метаболическая активность органов/тканей морских беспозвоночных требует разного уровня ТМ для поддержания соответствующей физиологической активности, с чем и связано различие в распределении ТМ в тканях [22]. Это различие поддерживается на определенном уровне до тех пор, пока животные сохраняют способность регулировать их распределение, то есть до достижения порога концентрации того или иного ТМ [25]. Перераспределение ТМ в тканях является одним из способов избегания токсичного действия ТМ, направленным прежде всего на поддержание репродуктивной функции даже в значительно загрязненных районах [29, 49]. Однако механизмы такого распределения остаются мало изученными. Строгая регуляция содержания эссенциальных металлов, в частности, в моллюсках, осуществляется путем экскреции через гемолимфу и жабры [41]. Важнейшую роль в детоксикации ТМ играют металлотионеины, имеющие специфичность связывания с отдельными металлами в разных типах тканей [22]. При превышении концентрации, требуемой для метаболической активности ткани, избыток ТМ может связываться металлотионеинами, а также транспортироваться в другие ткани и органы, где этот ТМ может быть востребован или запасен. В активном транспорте ТМ отмечена роль фагоцитов [34] и транспортных белков (трансферринов) [30, 46]. Среди других механизмов регуляции у моллюсков обнаружен P-гликопротеин, молекулярная помпа, выводящая из организма ксенобиотики, работа которого ассоциирована с изменением антиоксидантной защиты [50]. При превышении же указанного порога динамика изменений уровня ТМ в тканях соответствует уровню поступления ТМ в организм. Показано, что высокие концентрации ТМ способны подавлять как связывание ТМ с металлотионеинами, так и транспорт ТМ [30, 46]. Однако сама величина этого порога у различных морских беспозвоночных не установлена. Исходя из полученных нами данных о том, что при значительном увеличении концентраций большинства ТМ в кишке у голотрии в б. Витязь в 2009 г. изменения в распределении металлов в тканях были синхронны с изменениями в кишке, тo есть переставали регулироваться, можно предполагать, что при этих концентрациях порог был уже превышен. В б. Витязь, в сравнении с б. Алексеева, в гонаде голотурии резко возрастало не только содержание большинства эссенциальных металлов, но и токсичных Cd и Pb. Это свидетельствует о том, что нахождение голотурий в загрязненной среде в постнерестовый период может быть даже более опасным для вида, чем в период нереста.
Однако в сентябре 2017 г. отмечено уже значительное снижение содержания ТМ в тканях голотурии в б. Витязь по сравнению с таковым в сентябре 2009 г. Так, достоверное снижение в кишке отмечено для концентраций Cu (в 10 раз), Fe (в 3 раза), Pb (18 раз), Cd (ниже порога определения). При этом в стенке тела достоверно снижено содержание Fe (в 2.2 раза), Pb (в 2.3 раза), Cd (ниже порога определения), Zn (в 1.5 раза), но повышено содержание Mn (в 2 раза). В гонаде снизилась концентрация Cu (в 3.7 раза), Pb (в 31 раз), Cd (ниже порога определения), но выросло содержание Zn (в 3 раза) и Mn (в 2 раза). Значительное снижение содержания Cu, Fe, Cd и Pb в кишке голотурии в 2017 г. по сравнению с соответствующими значениями в 2009 г. свидетельствует в пользу предположения о том, что произошло значительное снижение загрязнения этими ТМ б. Витязь. Об этом же свидетельствуют и результаты работы Христофоровой и Кобзарь [21], которые отметили значительное снижение концентрации Pb, Cu и Cd в водорослях и значительное улучшение экологической ситуации в зал. Посьета в 2016 г. В сентябре 2017 г. концентрации Cu, Cd и Pb в кишке голотурии в б. Витязь были уже значительно ниже, чем в сентябре 2016 г. в б. Алексеева. Однако содержание Fe и Zn в кишке голотурии в б. Витязь все же превышало таковое в б. Алексеева. По-видимому, загрязнение б. Витязь этими металлами сохраняется.
Несмотря на то, что вопросы использования разных видов живых организмов в качестве биоиндикаторов находятся в центре внимания экологов [21], возможности использования для биоиндикации загрязнения ТМ тканей голотурий исследованы недостаточно. Так, при исследовании голотурии Holothuria tubulosa не выявлено корреляции между содержанием Cd и Pb в стенке тела и грунте [45], однако эти данные лишь подтверждают полученные в настоящей работе данные о том, что, не все ткани голотурий можно использовать для биоиндикации отдельных ТМ. Проведенный анализ вариаций содержания ТМ в стенке тела и гонаде голотурии E. fraudatrix в различные временны́е периоды показал, что они находились в разной степени зависимости от направленности изменений уровня ТМ в кишке, свидетельствующих в большой мере о степени загрязнения среды (табл. 4).
Таблица 4.
Коэффициент попарных корреляций для концентраций ТМ в кишке и других органах (n = 18)
| Органы | Наименование металла | |||||
|---|---|---|---|---|---|---|
| Cu | Zn | Fe | Mn | Cd | Pb | |
| Кишка–гонада | 0.37 (Р = 0.50) | –0.49 (Р = 0.36) | –0.22 (Р = 0.67) | 0.65 (Р = 0.23) | 0.5 (Р = 0.45) | 0.99 (Р = 0.007) |
| Кишка–стенка тела | 0.59 (Р = 0.22) | –0.7 (P = 0.13) | –0.05 (Р = 0.92) | 0.06 (Р = 0.93) | 0.14 (Р = 0.82) | –0.05 (Р = 0.95) |
Так, содержание Fe в стенке тела и гонаде не коррелировало с его содержанием в кишке, при этом его концентрация в тканях зависела только от сезона, не меняясь в различные годы. Необходимо отметить, что концентрация Fe в тканях голотурии была самой высокой среди ТМ. Fe является одним из важнейших эссенциальных металлов, входящих в структуру многих ферментов и в состав гемоглобина у голотурий [31], и по-видимому, наиболее востребован у этих животных. Вместе с тем, его избыток может вызывать тяжелые патологии [1]. Этим, вероятно, объясняется важность относительно стабильного поддержания концентрации этого металла в тканях голотурии. Для Zn отмечена тенденция к снижению содержания концентрации металла в стенке тела при его возрастании в кишке, а для Mn–противоположная тенденция. Однако статистической значимости для этих пар значений не было выявлено. При этом низкие значения коэффициентов корреляции между содержанием Zn в гонаде и кишке, а также между содержанием Mn в стенке тела и кишке свидетельствуют о способности голотурий поддерживать стабильные концентрации Zn в гонаде и Mn в стенке тела. По-видимому, это определяется важностью Zn для гаметогенеза и Mn для активности мышц [4, 27]. Содержание Cu в стенке тела, но не в гонаде, имело тенденцию к возрастанию при увеличении содержания металла в кишке, однако корреляция была также недостоверна. Ранее Storelli et al. [43] на основании данных о наличии корреляции между содержанием Cu в теле голотурии Holothuria polii и в грунте предложили использовать определение уровня Cu в голотурии для биоиндикации загрязнения. Результаты настоящей работы свидетельствуют о том, что статистическая недостоверность корреляции между содержанием металла в органах и кишке E. fraudatrix при маленькой выборке и наличием значительных физиологических колебаний содержания Cu в тканях ограничивает использование данного вида с этой целью.
Специфичное распределение эссенциальных ТМ в стенке тела и гонаде в отсутствие значимой корреляции между содержанием большинства исследованных ТМ в этих органах и в кишке свидетельствует о том, что распределение ТМ в тканях зависело в большей степени от физиологических факторов, чем непосредственно от поступления ТМ в организм. Сходные выводы о влиянии физиологических факторов на распределение ТМ в тканях были сделаны рядом авторов [15, 47], исследовавших моллюсков. Таким образом, голотурии, как и другие организмы, контролирующие распределение ряда эсенциальных ТМ в тканях, очевидно, не могут служить биоиндикаторами загрязнения воды этими металлами.
Тенденция к возрастанию содержания Сd в гонадах, но не стенке тела, при увеличении его концентрации в кишке также не была статистически достоверна. Однако в отличие от звезды Asterias rubens, у которой отмечена низкая концентрация Cd в гонадах по сравнению с другими органами [32], у голотурии, как было показано выше (табл. 1), содержание Cd в гонаде было выше, чем в стенке тела. Cd также присутствовал в наибольших количествах в гонадах двух видов голотурий в Персидском заливе [39]. Эти данные свидетельствуют о том, что один из наиболее токсичных металлов имеет тропность к гонадам голотурий, и при повышении его концентрации в морской среде, по-видимому, в наибольшей степени накапливается в гонадах, хотя доля нагрузки гонад по отношению к организму этим элементом и остается самой низкой (табл. 2). Поскольку Cd оказывает поврежающее действие на гаметогенез и развитие потомства [37], это свидетельствует о высокой опасности загрязненности морской воды Cd для сохранения голотурий.
Вместе с тем, между содержанием Pb, который, как и Cd, способен оказывать эмбриотоксичный эффект у иглокожих [26], в кишке и гонадах имеется очень высокая положительная корреляция (P < 0.01), в то время как между содержанием металла в кишке и в стенке тела она практически отсутствует. По-видимому, голотурии не могут регулировать накопление Pb в гонадах. В связи с этим, гонада голотурии представляется перспективным объектом для биоиндикации содержания свинца в морской воде.
ЗАКЛЮЧЕНИЕ
Проведенные исследования показали, что у голотурии E. fraudatrix стенка тела, имеющая самую большую массовую долю среди других органов, является основным местом накопления изученных металлов. Концентрации Pb и Mn также, независимо от уровня загрязнения среды и сезона, были в ней максимальны по сравнению с таковыми в других органах. Однако такие эссенциальные элементы как Fe, Zn, Cu, а также токсичный Сd преимущественно концентрировались в гонаде, причем аккумуляция Fe и Zn значительно возрастала в постнерестовом периоде. Более токсичная Cu, как и Cd, при возрастании их содержания в среде обитания в большей степени распределялись в стенку тела, что обеспечивало определенную детоксикацию гонады. Эти данные необходимо принимать во внимание для выбора времени сбора и части тела животных при использовании в фармакологических целях.
Анализ сезонной и межгодовой зависимости выявленных асинхронных изменений содержания большинства ТМ в кишке и других органах подтвердил способность голотурий, как и многих других морских беспозвоночных, в определенной степени регулировать содержание ТМ в тканях, по-видимому, в условиях относительно низкой загрязненности морской среды. При этом впервые показано, что уровень регуляции носил сезонный характер: строгое ограничение роста содержания ТМ в гонаде даже при значительном возрастании концентрации ТМ в кишке/загрязнении среды наблюдалось только в период нереста (июль). Способность тканей голотурии (стенки тела и гонады) к регуляции содержания ТМ указывает на то, что этот вид не может использоваться для биоиндикации загрязнения среды большинством ТМ в этот период. В сентябре же при активном постнерестовом восстановлении концентрации ТМ степень регуляции, по-видимому, ослабевает, что в условиях повышения загрязнения среды сопровождается опасным для животных накоплением ТМ, в том числе, Cd и Pb, в гонаде. Таким образом, в постнерестовом периоде изменения уровня ТМ в гонадах, но не стенке тела, отражают влияние как физиологических, так и антропогенных факторов/факторов среды.
Содержание же ТМ в кишке, в силу преимущественного поступления ТМ с пищей, может быть в определенной степени индикатором степени загрязнения морской воды этими ТМ. При этом выявленная высокодостоверная положительная корреляции между накоплением Pb в кишке и гонадах свидетельствует о возможности использования определения содержания этого металла в гонадах для биоиндикации загрязнения среды.
Снижение содержания большинства металлов в кишке голотурии отмечено в 2016–2017 гг. по сравнению с 2008–2009 гг. в обеих исследованных бухтах, что, по-видимому, отражает наметившуюся тенденцию к снижению загрязненности морской воды. Однако, по-видимому, продолжается и возрастает загрязнение Fe и Zn в б. Витязь и Cu и Mn в б. Алексеева.
Наличие значительных временны́х вариаций в содержании ТМ определяет необходимость межгодового мониторинга за содержанием металлов в тканях голотурии в сходные периоды времени и с учетом стадии готовности гонад к нересту.
Благодарности. Авторы благодарят начальника морской экспериментальной станции “о. Попова” ТОИ ДВО РАН П.С. Зимина и начальника морской экспериментальной станции “м. Шульц” ТОИ ДВО РАН С.Б. Титаренко за помощь в организации экспедиционных исследований.
Источник финансирования. Работа выполнена в рамках госзадания Минобрнауки РФ (№ АААА-А17-117030110038-5).
Список литературы
Антонов А.Р., Ефремов А.В., Новоселов Я.Б. и др. Микроэлементозы: мониторинг, анализ и направления деятельности // Успехи современного естествознания. 2004. № 12. С. 105–106.
Белова Г.В., Викторовская Г.И. Морфометрическая характеристика половых клеток и сезонные изменения гонад самок Cucumaria japonica (Semper, 1868) (Echinodermata: Holothuroidea) из залива Петра Великого Японского моря // Биология моря. 2007. Т. 33. № 3. С. 209–216.
Вышкварцев Д.И. Трансграничный поток загрязнений с водами реки Туманной // Вестник ДВО РАН. 1997. № 2. С. 88–91.
Голованова И.Л., Фролова Т.В. Влияние меди, цинка и кадмия на активность карбогидраз водных беспозвоночных // Биол. внутр. вод. 2005. № 4. С. 77–83.
Горбатенко К.М., Кияшко С.И., Лаженцев А.Е. и др. Трофические отношения и бенто-пелагические связи на западнокамчатском шельфе Охотского моря по данным анализа содержимого желудков и стабильных изотопов 13С и 15N // Изв. ТИНРО. 2013. Т. 175. С. 3–25.
Давыдова О.А., Климов Е.С., Ваганова Е.С., Ваганов А.С. Влияние физико-химических факторов на содержание тяжелых металлов в водных экосистемах. Ульяновск: УлГТУ, 2014. 167 с.
Денисов Д.Б., Кашулин Н.А. Современное состояние водорослевых сообществ планктона в зоне влияния Кольской АЭС (оз. Имандра) // Тр. Кольского научного центра РАН. 2013. Т. 3 (16). С. 70–96.
Долматова Л.С., Заика О.А. Сезонные изменения активности антиоксидантных ферментов в целомической жидкости голотурий Eupentacta fraudatrix в бухте Алексеева (залив Петра Великого) // Современное состояние водных биоресурсов и экосистем морских и пресных вод: проблемы и пути решения: Мат. межд. науч. конф. Ростов-на-Дону: АзНИИРХ, 2010. С. 138–141.
Долматова Л.С., Слинько Е.Н., Колосова Л.Ф. Содержание тяжелых металлов в тканях голотурий Eupentacta fraudatrix в заливе Петра Великого // Известия Самарского научного центра Российской академии наук. 2010. Т.12. № 1(5). С. 1287–1291.
Долматова Л.С., Слинько Е.Н., Колосова Л.Ф. Особенности накопления тяжелых металлов в тканях двух цветных форм голотурии Eupentacta frudatrix в летне-осенний период // Вестник ДВО РАН. 2018. № 1. С. 71–78.
Долматова Л.С., Тимченко Н.Ф., Стасенко Н.Я. Характеристика состава и медико-биологические исследования комплекса биологически активных веществ из дальневосточных видов голотурий // Дальневосточные моря России. Кн. 2. Исследование морской экологии и биоресурсов. М.: Наука, 2007. С. 684–694.
Коженкова С.И., Христофорова Н.К. Биомониторинг содержания тяжелых металлов в морских прибрежных водах юго-западной части залива Петра Великого с использованием бурых водорослей // Экологическое состояние и биота юго-западной части залива Петра Великого и устья реки Туманной. Владивосток: Дальнаука, 2002. Т. 3. С. 33–41.
Крючкова Г.А. Краткий определитель личинок морских ежей, офиур и голотурий залива Петра Великого Японского моря: Препринт № 22. Владивосток: ИБМ ДВНЦ АН СССР, 1987. 56 с.
Леонова Г.А., Богуш A.A., Бычинский В.А., Бобров В.А. Оценка биодоступности и потенциальной опасности химических форм тяжелых металлов в экосистеме озера Большое Яровое (Алтайский край) // Экологическая химия. 2007. Т.16. № 1. С. 18–28.
Лобанова Т.А. Сезонные особенности накопления тяжелых металлов промысловыми видами рыб // Вестник КГУ им. Н.А. Некрасова. 2008. № 3. С. 18–21.
Надточий В.А., Будникова Л.Л., Безруков Р.Г. Некоторые результаты бонитировки бентоса в российских водах дальневосточных морей: состав и количественное распределение (Охотское море) // Изв. ТИНРО. 2007. Т. 149. С. 310–337.
Надточий В.А., Колпаков Н.В. Состав, распределение и ресурсы макробентоса в заливе Петра Великого в 2011 г. // Изв. ТИНРО. 2017. Т. 190. С. 101–118.
Павловская В.В. Сезонные изменения содержания тяжелых металлов в мягких тканях Dreissena polymorpha // Вест. РУДН. Сер. Экология и безопасность жизнедеятельности. 2008. № 2. С. 93–97.
Ростов И.Д., Рудых Н.И., Ростов В.И. Межгодовая динамика уровня загрязненности акваторий залива Петра Великого за последние 40 лет // Вестник ДВО РАН. 2015. № 6. С. 49–63.
Тищенко П.Я., Звалинский В.И., Шевцова О.В. Гидрохимические исследования эстуария река Раздольная-Амурский залив // Состояние морских экосистем, находящихся под влиянием речного стока. Владивосток: Дальнаука, 2005. С. 53–88.
Христофорова Н.К., Кобзарь А.Д. Оценка экологического состояния залива Посьета (Японское море) по содержанию тяжелых металлов в бурых водорослях-макрофитах // Самарский научный вестник. 2017. Т. 6. № 2 (19). С. 91–95.
Челомин В.П.. Бельчева Н.Н., Слинько Е.Н., Силина А.В. Характеристика микроэлементного состава донных беспозвоночных, находящихся под воздействием терригенного стока и антропогенным влиянием // Состояние морских экосистем, находящихся под влиянием речного стока. Владивосток: Дальнаука, 2005. С. 228–245.
Чернова Е.Н., Лысенко Е.В. Закономерности переноса микроэлементов по трофической цепи планктон– моллюски // Вест. Оренбургского государственного университета. 2016. № 10 (198). С. 87–92.
Шулькин В.М. Металлы в экосистемах морских мелководий. Владивосток: Дальнаука, 2004. 276 с.
Baudrimont M., Andres S., Metivaud J. et al. Field transplantation of the freshwater bivalve Corbicula fluminea along a polymetallic contamination gradient (river Lot, France): II. Metallothionein response to metal exposure // Environ. Toxicol. Chem. 1999. V. 18. P. 2472–2477.
Belcheva N.N., Zakhartsev M., Silina A.V. et al. Relationship between shell weight and cadmium content in digestive gland of Japanese scallop Patinopecten yessoensis (Jay) // Mar. Environ. Res. 2006. V. 61. P. 396–409.
Blowes L.M., Egertová M., Liu Y. et al. Body wall structure in the starfish Asterias rubens // J. Anat. 2017. V. 231(3). P. 325–341.
Boyden C.R., Phillips D.J.H. Seasonal variation and inherent variability of trace elements in oysters and their implications for indicator studies // Mar. Ecol. Progr. Ser. 1981. V. 5. P. 29–40.
Catarino A., Cabral H.N., Peeters K. et al. Metal concentrations, sperm motility, and RNA/DNA ratio in two echinoderm species from a highly contaminated fjord (the Sørfjord, Norway) // Environ. Toxicol. Chem. 2008. V. 27 (7). P. 1553–1560.
Chapman E.M., Lant B., Ohashi Y., Yu B. et al. A conserved CCM complex promotes apoptosis non-autonomously by regulating zinc homeostasis // Nat. Commun. 2019. V. 10(1):1791. https://doi.org/10.1038/s41467-019-09829-z
Christensen A.B., Herman J.L., Elphick M.R.et al. Phylogeny of echinoderm hemoglobins // PLoS ONE. 2015. V.10 (8): e0129668. https://doi.org/10.1371/journal.pone.0129668
Den Besten P.J., Herwig H.J., Zandee D.I., Voogt P.A. Cadmium accumulation and metallothionein-like proteins in the sea star Asterias rubens // Arch.Environ. Contam. Toxicol. 1990. V. 19. P. 858–862.
Dolmatova L., Zaika O., Slinko E., Kolosova L. Antioxidant enzyme defense and heavy metal accumulation in tissues of holothurians Apostichopus japonicus and Eupentacta fraudatrix: characteristics of body-length dependences during spring-summer period // Pacific Oceanography. 2010. V. 5. P. 96–105.
Homa J., Olchawa E., Stürzenbaum S.R. et al. Early-phase immunodetection of metallothionein and heat shock proteins in extruded earthworm coelomocytes after dermal exposure to metal ions // Environ. Pollution. 2005. V. 135 (2). P. 275–280.
Jinadasa B.K.K.K., Samanthi R.I., Wicramsinghe I. Trace metal accumulation in tissue of sea cucumber species; North-Western sea of Sri Lanka // Am. J. Public Health Res. 2014. V. 2. № 5A. P. 1–5.
Kumar A.K., Achyuthan H. Heavy metal accumulation in certain marine animals along the East Coast of Chennai, Tamil Nadu, India // J. Environ. Biol. 2007. V. 28. P. 637–643.
Manzo S., Buono S., Cremisini C. Cadmium, lead and their mixtures with copper: Paracentrotus lividus embryotoxicity assessment, prediction, and offspring quality evaluation // Ecotoxicology. V. 19. P. 1209–1223.
Michel W., Sandrine D., Gilles L. et al. Heavy metals in the sea cucumber Holothuria tubulosa (Echinodermata) from the Mediterranean Posidoniaoceanica ecosystem: body compartment, seasonal, geographical and bathymetric variations // Environ. Bioindicators. 2006. V. 1. P. 268–285.
Mohammadizadeh M., Bastami K.D., Ehsanpour M. et al. Heavy metal accumulation in tissues of two sea cucumbers, Holothuria leucospilota and Holothuria scabra in the northern part of Qeshm Island, Persian Gulf // Mar. Pollut. Bull. 2016. V. 103. P. 354–359.
Neff J.M. Bioaccumulation in marine organisms: effect of contaminants from oil well produced water. Amsterdam; London: Elsevier, 2002. 468 p.
Rainbow P.S. Trace metal concentrations in aquatic invertebrates: Why and so what? // Environ. Pollution. 2002. V.120. P. 497–507.
Sea cucumbers. A global review of fisheries and trade. FAO Fisheries and Aquaculture Technical Paper № 516 / Eds. Granda V., Lovatelli A., Vasconcellos M. Rome: FAO, 2008. 317 p.
Storelli M.M., Storelli A., Marcotrigiano G.O. Heavy metals in the aquatic environment of the Southern Adriatic Sea, Italy: macroalgae, sediments and benthic species // Environ. Int. 2001. V. 26. № 7–8. P. 505–509.
Temara A., Warnau M., Dubois Ph. Heavy metals in the sea star Asterias rubens (Echinodermata): basis for the construction of an efficient biomonitoring program // Environmental changes and radioactive tracers. Paris: IRD Editions, 2002. P. 71–91.
Turk C.S., Dereli H., Karaduman F.R., Culha M. Assessment of trace metal contamination in the sea cucumber (Holothuria tubulosa) and sediments from the Dardanelles Strait (Turkey) // Environ. Sci. Pollut. Res. Int. 2016. V. 23. № 12. P. 11584–11597.
Unuma T., Sawaguchi S., Yamano K., Ohta H. Accumulation of the major yolk protein and zinc in the agametogenic sea urchin gonad // Biol.Bull. 2011. V. 221(2). P. 227–237.
Vidal M.L., Bassères A., Narbonne J.F. Seasonal variations of pollution biomarkers in two populations of Corbicula fluminea (Müller) // Comp. Biochem. Physiol. C: Toxicol. Pharmacology. 2002. V. 131. № 2. P. 133–151.
Wang J., Ren T., Han Y.et al. The effects of dietary lead on growth, bioaccumulation and antioxidant capacity in sea cucumber, Apostichopus japonicus // Environ. Toxicol. Pharmacol. 2015. V. 40 (2). P. 535–540.
Warnau M., Dutrieux S., Ledent G. et al. Heavy metals in the sea cucumber Holothuria tubulosa (Echinodermata) from the Mediterranean Posidonia oceanica ecosystem: body compartment, seasonal, geographical and bathymetric variations // Environ. Bioindicators. 2006. V. 1. P 1–18.
Yang C., Liu Q., Li G., Meng X., Liu B. Effect of P-glycoprotein regulation on cadmium exhaustion from Crassostrea gigas // Mar. Pollut. Bull. 2019. V. 141. P. 307–312.
Дополнительные материалы отсутствуют.