Океанология, 2020, T. 60, № 4, стр. 564-575
Влияние факторов среды на распределение птеропод Limacina helicina (Phipps, 1774) в морях Сибирской Арктики
А. Ф. Пастернак 1, *, А. В. Дриц 1, М. В. Гопко 2, М. В. Флинт 1
1 Институт океанологии им. П.П. Ширшова РАН
Москва, Россия
2 Институт проблем экологии и эволюции им. А.Н. Северцова РАН
Москва, Россия
* E-mail: pasternakanna@hotmail.com
Поступила в редакцию 27.02.2020
После доработки 20.03.2020
Принята к публикации 08.04.2020
Аннотация
По результатам сборов зоопланктона в пяти рейсах (2007–2016 гг.) в Карском и Лаптевых морях установлена существенная неравномерность пространственного распределения биомассы птероподы Limacina helicina – одного из массовых компонентов арктического зоопланктона. В 2014–2016 гг. биомасса и численность моллюсков была значительно ниже, чем в более ранний период (2007 и 2011 гг.). Показано существование устойчивых скоплений L. helicina в области континентального склона Карского моря (желоб Святой Анны) с биомассой на порядок более высокой, чем в прилежащих районах. Образование скоплений лимацин было обусловлено сочетанием благоприятных для них факторов: высокой соленостью (≥33 psu), оптимальным диапазоном температуры (1–5°С) и локальными гидрофизическими процессами, ассоциированными со склоновой фронтальной зоной. Анализ с помощью обобщенной линейной смешанной модели (GLMM) показал, что биомасса моллюсков была связана, в первую очередь, с соленостью и температурой. Не выявлено связи между биомассой лимацин и средней концентрацией хлорофилла в верхнем слое. При этом в области скоплений биомасса моллюсков коррелировала с концентрацией хлорофилла в слое его максимума.
ВВЕДЕНИЕ
Пелагические крылоногие моллюски – один из важнейших компонентов морских сообществ высоких широт. Хотя их численность и биомасса в среднем ниже, чем у основной доминирующей в планктоне группы животных – копепод, локально они могут быть очень многочисленны и играть значительную роль в пищевых цепях и трансформации энергии [12, 36, 40]. Раковинные птероподы рода Limacina, широко распространенные в полярных и бореальных областях, обладают широким спектром питания, включающим объекты от мелких клеток фитопланктона до микрозоопланктона и копепод [4, 28, 38]. Они улавливают пищу с помощью слизистой сети, которую могут отбрасывать в случае опасности или когда сеть чрезмерно забивается. Такая сеть служит концентратором мелких органических частиц, а скорость седиментации Сорг в такой агрегации резко возрастает [38]. Помимо широкого спектра питания, птероподы отличаются от копепод высокой скоростью потребления пищи [4, 21]. В местах скоплений их вклад в выедание фитопланктона может составлять до 60 [3] и даже 89% [21] от общего потребления водорослей. Наряду со значительным вкладом в вертикальные потоки сброшенных ловчих сетей и фекальных пеллет крылоногих моллюсков, сами птероподы, отмершие к концу продуктивного сезона, могут составлять значительную часть органического содержимого седиментационных ловушек [14–16].
Все перечисленное позволяет говорить о значительной роли лимацин в трофодинамике планктонных сообществ высоких широт. Однако это справедливо только для тех районов, где птероподы образуют плотные скопления, так как при характерном для них неравномерном распределении, на остальной части ареала их концентрация обычно невысока. Вопрос о факторах среды и механизмах, способствующих образованию скоплений лимацин, остается открытым, хотя были получены результаты, указывающие на гидродинамическую основу формирования скоплений – за счет локальных конвергенций [5] и вихрей [44]. Также существуют сведения о связи концентрации лимацин с обилием фитопланктона и величиной первичной продукции [34, 43]. В Арктике обитают 2 вида лимацин, североатлантическая Limacina retroversa (Fleming, 1823) и арктическая L. helicina (Phipps, 1774). Отмечена приуроченность лимацин к узкому диапазону температуры воды с оптимум 2–7°C для “тепловодной” L. retroversa и от –1.6 до +4°C (с верхней границей 7°C) для “холодноводной” L. helicina [17, 23]. Выяснение закономерностей распределения лимацин в арктических морях привлекает особое внимание в связи с возможным повышением температуры воды, а также понижением pH в Арктике. Арагонитовая раковина лимацин легко разрушается при повышении кислотности среды [25]. Все это позволяет считать, что обилие птеропод может служить показателем изменений среды, ассоциированных с климатическими процессами.
Задачей нашей работы было выявить связь распределения биомассы L. helicina, единственного вида лимацин, населяющего моря Сибирской Арктики, с гидрофизическими параметрами и концентрацией пищи, а также выявить районы устойчивых скоплений этих моллюсков. Мы также попытались оценить межгодовую изменчивость обилия L. helicina и максимальное выедание ими фитопланктона в морях Карском и Лаптевых.
МАТЕРИАЛ И МЕТОДЫ
Материал собран в нескольких рейсах в Карское и Лаптевых моря: 54, 59, 63 и 66-й рейсы НИС “Академик Мстислав Келдыш” (сентябрь 2007 г., сентябрь–октябрь 2011 г., сентябрь–октябрь 2015 г. и июль–август 2016 г. соответственно) и 128-м рейсе НИС “Профессор Штокман” (август и сентябрь 2014 г.). Положение станций, где был собран зоопланктон и где были найдены птероподы, показано на рис. 1.
Рис. 1.
Верхняя панель: карта Карского моря и моря Лаптевых с указанием станций, где были собраны пробы зоопланктона. Нижняя панель: распределение биомассы Limacina helicina по исследованной акватории.

Пробы зоопланктона были собраны планктонной сетью Джеди 37/50 (ячея фильтрующего конуса 180 µм) из верхнего 50-метрового слоя водной толщи, где обитает основная часть популяции лимацин [14, 35]. Сбор зоопланктона проводили вертикальными ловами при скорости подъема сетей 0.6–0.8 м/с. Пробы фиксировали 4% нейтральным формалином, состав зоопланктона исследовался под бинокуляром при увеличении ×40. Индивидуальный сырой вес животных (за исключением птеропод) определяли по номограммам [11], сухой вес рассчитан по [2]. У птеропод измеряли диаметр раковины для расчета веса их тела. Вес животных рассчитывался по формуле:
DW = 0.257 D2.141, полученной для L. helicina [27],
где DW – сухой вес, мг инд-1, D – диаметр раковины, мм.
Полученные значения биомассы лимацин сопоставлялись со средними значениями температуры и солености в верхнем 50-метровом столбе воды, значениями этих показателей на поверхности, средними значениями концентрации хлорофилла в слое и значениями этого показателя в слое максимума, с градиентами солености и толщиной перемешанного слоя, общей глубиной на выполненных станций. Данные по температуре, солености, флуоресценции хлорофилла были получены при вертикальном зондировании CTD- зондом Sea Bird 19+ с разрешением 1 м. Средние значения в 50-м слое рассчитывались по этим данным. По вертикальным профилям показателей солености и температуры выделялись слои их резких изменений, пикно- и термоклина. Значения градиентов солености и температуры определялись как разница между максимальным и минимальным значением показателя в этом слое, отнесенная к его толщине.
Анализ данных. Анализ данных осуществлялся в R [41]. Была проанализирована связь численности и биомассы моллюсков со значениями температуры и солености воды в слое 0–50 м, из которого моллюски были отобраны, так как опубликованные данные [17, 23] указывают на важнейшее значение этих характеристик среды для L. helicina. Для оценки достоверности связей определен коэффициент корреляции Спирмена. Численность и биомасса лимацин в разные годы сравнивалась с помощью однофакторного дисперсионного анализа. Затем зависимость биомассы моллюсков от основных выделенных факторов оценивалась с помощью обобщенной линейной смешанной модели (GLMM, General Linear Mixed Model), где год сбора проб выступал случайным фактором, а средние величины концентрации хлорофилла, температуры и солености в верхнем 50-м слое были ковариатами. Рассматривались все попарные взаимодействия. Зависимая переменная была лог-трансформирована, чтобы остатки (residuals) соответствовали критерию нормальности (оценивалось с помощью критерия Шапиро — Уилка). Доля биомассы (численности) L. helicina от общей биомассы (численности) зоопланктона [1, 8–10, собственные данные] исследована с помощью смешанной бета регрессии с логит-функцией связи: lg(доля от общей биомассы) – от тех же факторов. В эти модели год был включен как категориальная переменная, а не случайный фактор. Это было сделано по техническим причинам, поскольку использовавшийся нами модуль betareg для R [41] не предназначен для построения смешанных моделей, однако к числу его достоинств относится то, что он позволяет моделировать зависимость дисперсии от регрессоров [26]. Другими словами, пакет betareg позволяет эффективно бороться с гетероскедастичностью (неодинаковой дисперсией случайной ошибки регрессионной модели), что было актуально для наших данных. В нашей модели дисперсия зависела от всех регрессоров, включенных в модель (см. подробнее в [26]).
После построения моделей были пошагово удалены статистически незначимые взаимодействия. В результате выяснилось, что в модели, где зависимой переменной была биомасса (численность) моллюсков, ни одно взаимодействие с участием переменной “средняя концентрация хлорофилла” не была значимой, как и эффект концентрации хлорофилла per se. То же относится к другим переменным (глубина станции, градиенты солености, значения температуры и солености в поверхностном слое, толщина перемешанного слоя). Поэтому эти переменные были удалены из окончательной модели.
P-значения для GLMM моделей получены с помощью тестов отношения правдоподобия (likelihood-ratio test) путем пошагового добавления факторов и их взаимодействий к нулевой модели, включавшей в себя только случайные эффекты [22, 46]. Решение о включении/исключении той или иной переменной в бета-регрессию производили также с помощью тестов отношения правдоподобия, используя модуль ‘lmtest’ [47] для R.
РЕЗУЛЬТАТЫ
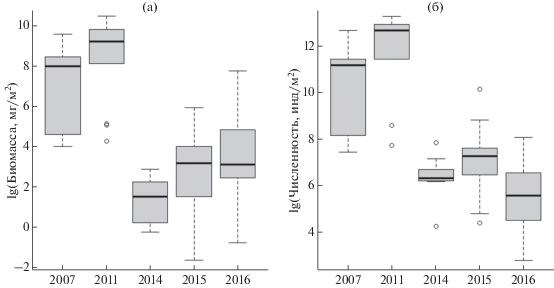
В разные годы показатели численности и биомассы моллюсков достоверно различались (one-way ANOVA, F(4, 57) > 26.7, p < 0.0001 в обоих случаях, рис. 2). Согласно полученным данным, выделяется два периода: 2007 и 2011 гг., когда биомасса и численность моллюсков была значительно выше, и 2014–2016 гг. с более низкой численностью и биомассой (Tukey HDS, p < 0.007 для обоих показателей). При этом численность и биомасса моллюсков в рамках первого (2007 и 2011 гг.) и второго (2014–2016 гг.) периодов достоверно не различались.
Рис. 2.
Биомасса (левая панель) и численность (правая панель) моллюсков в разные годы. Приведена медиана (жирная черная линия) с межквартильным размахом (МКР). Пунктирная линия – 1.5* МКР. Выбросы, связанные с несимметричным распределением данных, отличающимся от нормального, обозначены кружками.
Биомасса лимацин на всей исследованной акватории тесно коррелировала с их численностью (rs > 0.89, p < 0.001), что определялось небольшими изменениями среднего размера особей во всем массиве собранных данных: диаметр раковины варьировал от 0.3 до 0.7 мм (в среднем 0.4 ± 0.13 мм). Лишь на ст. 5297 (2016 г.) среди пойманных лимацин преобладали крупные особи диаметром 4.5–5 мм. Тесная связь биомассы моллюсков с их численностью позволяет нам при дальнейшем анализе оперировать только характеристиками биомассы.
Птероподы были распределены по исследованной акватории крайне неравномерно. В районах скоплений их биомасса достигала 34 128 мг/м2 (682 мг/м3) в верхнем 50-метровом слое, на остальной акватории лимацины не были столь обильны, и они вовсе не встречены в пробах из центральной части Карского моря и в области наибольшего влияния речного стока Оби, Енисея, Лены на арктический шельф. Из рис. 1 (нижняя панель) видно, что высокая биомасса птеропод приурочена в первую очередь к району континентального склона желоба Св. Анны. Биомасса моллюсков в этой области за все исследованные годы в среднем была на два порядка выше, чем во всех остальных районах (8161 ± ± 9126 мг/м2 и 92 ± 360 мг/м2, Mann-Whitney U test, p < 0.0001).
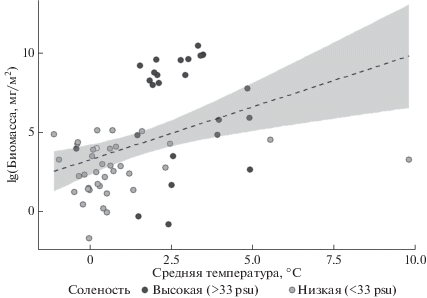
Полученные корреляции между биомассой моллюсков и температурой и соленостью верхнего 50-м слоя моря (рис. 3, rs = 0.51, p < 0.001) предполагают, что и в более сложных статистических моделях влияние этих факторов может оказаться значимым. Биомасса моллюсков достигает высоких величин лишь при солености выше 30 psu и в узком температурном интервале (1.8–5°С) (рис. 3). На этом основании мы условно выделили 2 группы станций: с высокой соленостью, где птероподы обильны, и с низкой соленостью, где их биомасса невелика.
Рис. 3.
Биомасса лимацин в зависимости от средних величин солености (левая панель) и температуры (правая панель) в верхнем 50-м слое воды. Пунктирная линия на верхней левой панели разделяет станции с высокой и низкой соленостью.
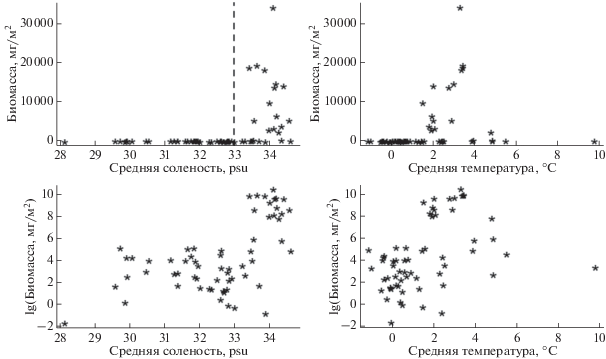
Биомасса моллюсков начинает резко расти при солености выше 33 psu, при этом в большинстве точек наблюдения биомасса L. helicina невысока: медианное значение — 52.2 мг/м2 (рис. 3). Из табл. 1 видно, что основной эффект средних для верхнего 50-м слоя значений солености и температуры статистически значим. С увеличением солености на одну единицу при средней для измеренных значений температуре 1.58°C (данные центрированы), численность моллюсков увеличивается в exp (0.79) = 2.20 раза (значения биомассы были лог-трансформированы), то есть, более чем вдвое. Аналогично для температуры — при средней солености повышение температуры на один градус приводит к увеличению биомассы моллюсков в exp (0.27) = 1.31 раза (или на 31%). Этот прирост не остается постоянным, а достоверно растет с увеличением солености, так как взаимодействие между температурой и соленостью значимо. Таким образом, с каждым дополнительным градусом положительное влияние солености на биомассу моллюсков усиливается. Если при средней температуре (1.58°С) увеличение солености на одну единицу приводит к увеличению биомассы в 2.20 раза, то при средней температуре, возросшей на 1°С (1.58 + 1 = 2.58°С) увеличение солености на одну единицу приводит к росту биомассы уже в exp (0.79 + 0.31) = 3 раза. Все это, однако, справедливо лишь в указанных интервалах температуры и солености.
Таблица 1.
Результаты тестов отношения правдоподобия для GLMM. Зависимой переменной была лог-траснформированная биомасса птеропод. Случайный фактор — год сбора проб. Таким образом, нулевая модель была следующей: lg(биомасса) ~ (1|год). К ней последовательно добавлялись такие факторы, как соленость, температура, средняя концентрация хлорофилла и их взаимодействия. Достоверность влияния фактора и необходимость его присутствия в модели оценивались с помощью тестов отношения правдоподобия. Взаимодействия, не увеличивавшие значимо долю объясненной дисперсии в модели, не включены в итоговую модель и в таблице не показаны. Коэффициенты представлены для итоговой модели
| Факторы | df | AIC | χ2 | p | Estimate | SE |
|---|---|---|---|---|---|---|
| Null model | 3 | 277.0 | ||||
| + Соленость ковариата | 1, 4 | 257.4 | 21.60 | <0.0001 | 0.80 | 0.14 |
| + Температура | 1, 5 | 251.9 | 7.47 | 0.006 | 0.27 | 0.16 |
| + Соленость * Температура | 1, 6 | 246.0 | 6.94 | 0.009 | 0.31 | 0.12 |
| 62 пробы, взятые за 5 лет | ||||||
Если использовать для характеристики солености в точках сбора проб качественную переменную (больше или меньше 33 psu), то результаты получаются схожими (табл. 2, рис. 4–5). Принципиальное различие состоит лишь в том, что взаимодействие факторов перестает быть статистически значимым. Повышение температуры на один градус приводит к увеличению биомассы моллюсков в 1.46 раза. При этом в местах с низкой соленостью биомасса моллюсков (геометрическое среднее) была в 5.3 раза ниже, чем на станциях с высокой соленостью.
Таблица 2.
Результаты тестов отношения правдоподобия для GLMM. Зависимая переменная — лог-траснформированная биомасса птеропод. Условия как в табл. 1, но для характеристики солености использована категориальная переменная (больше или меньше 33 psu). Коэффициенты представлены для итоговой модели
| Факторы | df | AIC | χ2 | p | Estimate | SE |
|---|---|---|---|---|---|---|
| Null model | 3 | 277.0 | ||||
| + Соленость | 1, 4 | 263.7 | 15.24 | 0.008 | –1.67 | 0.56 |
| + Температура | 1, 5 | 259.6 | 6.07 | 0.031 | 0.38 | 0.15 |
| 62 пробы, взятые за 5 лет | ||||||
График на рис. 5 аналогичен графику на рис. 4, но здесь соленость была качественной переменной. Предпочтение моллюсков к условиям с относительно высокой соленостью еще более заметно. Сходным очевидным образом проявляется влияние температуры и солености на доле биомассы L. helicina в общей биомассе зоопланктона (табл. 3). При этом влияние средней концентрации хлорофилла вновь оказывается незначимым (LRT, χ2(1) = 0.53, p = 0.47). Анализ модели показал, что одно из наблюдений оказывает аномально сильное влияние на значение коэффициентов регрессии (Cook’s D > 160), что позволяет считать это наблюдение выбросом [26]. Мы решили исключить эту пробу из выборки. Если не считать ее выбросом, то значимость коэффициентов регрессии качественно не меняется, но численные значения изменятся.
Рис. 4.
Зависимость биомассы L. helicina от температуры. Внизу – палитра различий в солености, согласно которой окрашены точки на графике.
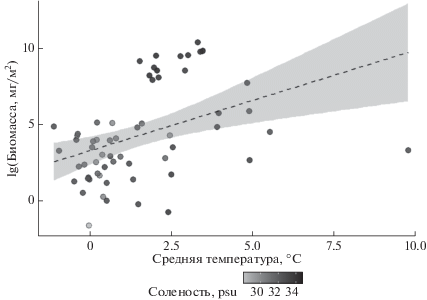
Таблица 3.
Результаты бета-регрессии, в которой зависимой переменной была доля биомассы птеропод от общей биомассы зоопланктона ([1, 10], собственные данные), ковариатами — соленость и температура, а год сбора проб – категориальной переменной. Остальные условия как в табл. 1
| Факторы | Коэффициент | SE | z | p |
|---|---|---|---|---|
| Год (2011) | 0.76 | 0.36 | 2.09 | 0.037 |
| Год (2014) | –3.07 | 0.43 | –7.13 | <0.0001 |
| Год (2015) | –2.70 | 0.37 | –7.41 | <0.0001 |
| Год (2016) | –3.26 | 0.54 | –6.09 | <0.0001 |
| + Соленость ковариата | 0.77 | 0.11 | 7.36 | <0.0001 |
| + Температура | 0.56 | 0.07 | 7.84 | <0.0001 |
| 61 проба, взятая за 5 лет | ||||
Из табл. 3 видно, что в исследованных диапазонах величин с увеличением как солености, так и температуры, доля моллюсков в общей биомассе зоопланктона увеличивается. Поскольку функция логистическая, то это значит, что с увеличением солености на одну единицу биомасса L. helicina по отношению к биомассе всего остального планктона увеличивается в exp (0.77) = 2.16 раза, а при увеличении температуры на один градус – в 1.75 раз. Межгодовые различия в доле лимацин в биомассе планктона в целом аналогичны межгодовым различиям в численности моллюсков. В 2007 и 2011 гг. доля лимацин от биомассы всего планктона была заметно выше, чем в 2014—2016 гг.
Анализ всей совокупности данных показал, что хлорофилл (ни его средняя концентрация в исследуемом слое, ни его максимальная концентрация) не оказывает значимого влияния на биомассу моллюсков. Однако, если рассматривать лишь те пробы, где биомасса L. helicina высока (выделенная группа станций с высокой соленостью), то в этих случаях она достоверно связана с максимальной концентрацией хлорофилла (табл. 4), и с увеличением максимальной концентрации хлорофилла растет и биомасса L. helicina.
Таблица 4.
Результаты тестов отношения правдоподобия для GLMM (зависимая переменная — лог-траснформированная биомасса птеропод). Учтены лишь станции с соленостью выше 33 psu, где биомасса моллюсков была высокой. Остальные условия как в табл. 1
| Факторы | df | AIC | χ2 | p-value | Estimate | SE |
|---|---|---|---|---|---|---|
| Null model | 3 | 120.5 | ||||
| + Соленость ковариата | 1, 4 | 115.4 | 6.93 | 0.009 | 1.20 | 0.25 |
| + Температура | 1, 5 | 110.8 | 6.78 | 0.01 | 2.05 | 0.63 |
| + Хлорофилл | 1, 6 | 104.4 | 8.35 | 0.004 | 0.94 | 0.26 |
| 25 проб, взятых за 5 лет | ||||||
ОБСУЖДЕНИЕ
Обобщение данных пяти рейсов (2007, 2011, 2014–2016 гг.) показало, что пелагические моллюски L. helicina распределены в морях Карском и Лаптевых крайне неравномерно: в районе континентального склона желоба Святой Анны постоянно наблюдалась высокая концентрация птеропод, в то время как на большей части акватории они были немногочисленны. Средняя биомасса птеропод здесь была выше на 2 порядка, чем на всей остальной исследованной акватории (8161 и 92 мг/м2 соответственно).
Максимальные значения численности лимацин, полученные нами в 2011 г. (562 614 или 11 252 инд/м3), превышают почти все опубликованные данные. Максимальная численность L. helicina, отмеченная в северной Пацифике, составляла 150 000 инд/м2 [44], L. retroversa в Норвежском море – 2000 инд/м3 [14]. Наиболее высокие значения для близкородственного вида Limacina helicina antarctica в Антарктике (41 000 инд/м3) были отмечены в западной части Южного океана [24]. Остальные исследователи приводят более низкие значения (2000–3000 инд/м3) численности этих видов [18, 29–31, 37]. При этом все авторы также указывают на большую неоднородность количественного распределения птеропод.
Наши результаты продемонстрировали, что в Карском море и море Лаптевых L. helicina были обильны лишь при температуре воды от 1.8 до 5°С и при высоких (>33 psu) значениях солености. Это согласуется с существующими представлениями об адаптации специфичного для арктических морей вида птеропод к жизни в узком диапазоне низких температур: от –0.4 до +4°С, изредка до +7°С [17, 33]. В недавней работе [32], где в области полярного фронта в Баренцевом море исследовалось влияние температуры, солености, глубины и концентрации хлорофилла на обилие двух видов лимацин, L. helicina и L. retroversa, было показано, что лишь два показателя достоверно влияли на численность моллюсков: температура воды, объяснявшая 70.5% вариабельности обилия, и концентрация хлорофилла –13.8%. Соленость в этой области изменялась незначительно (от 33.6 до 35.4 psu). Максимальная численность моллюсков, отмеченная, как пишут авторы, в зонах смешения вод с разными характеристиками, была относительно невысокой (13.8 инд/м3).
Опубликованных сведений о предпочтении лимацинами определенной солености мы не обнаружили. По нашим данным, в указанных выше диапазонах температуры и солености биомасса L. helicina возрастала при повышении их значений. Обнаруженное взаимодействие между этими факторами среды показывает, что эффект солености усиливается при возрастании температуры, а эффект температуры – при возрастании солености. Эти характеристики в районе исследований слабо коррелируют (R 2 = 0. 20) Таким образом, количественное распределение лимацин прежде всего зависит от сочетания значений солености и температуры в верхних слоях моря в районе исследований. Очевидно, в области континентального склона желоба Св. Анны сочетание этих параметров благоприятно для существования вида. При этом в желобе Св. Анны биомасса моллюсков была более чем в 7 раз выше, чем в желобе Воронина (187 и 26 мг/м2 соответственно). Значения солености в этих районах практически не различались, однако в желобе Воронина температура была в среднем на 3.5°С ниже (Mann-Whitney U test, p = 0.015), что, вероятно, играло решающую роль в наблюдаемых различиях.
Могут ли другие свойства среды, помимо солености и температуры, влиять на характер распределения лимацин? Среди наиболее важных факторов в литературе указываются гидродинамические процессы – формирование вихрей и конвергенций [5, 44] – и концентрация фитопланктона и величина первичной продукции [32, 34, 43]. Было показано, что большие (диаметром 100–200 км) антициклонические вихри, существующие у побережья Аляски в течение нескольких лет, способствуют формированию скоплений птеропод Clio pyramidata и Limacina helicina [44]. Рогачев [5] обнаружил плотные скопления L. helicina (более 2 г/м3) в заливе Академии (Шантарский архипелаг, Охотское море), и связал их формирование с локальными конвергенциями.
На севере Карского моря в области континентального склона желоба Святой Анны локализована хорошо выраженная фронтальная зона, разделяющая области с существенно различными условиями пелагической среды. Со склоновой фронтальной зоной ассоциировано возрастание биомассы фито- и мезопланктона, особенно хорошо выраженное в верхних слоях водной толщи [6, 10]. При этом биомасса лимацин в области склона желоба по данным двух рейсов (2007 и 2011 гг.) возрастала по отношению к прилежащим районам в большей степени, чем остального зоопланктона. Лимацины составляли здесь от 40 до 87% биомассы всего мезопланктонного сообщества, в то время как на шельфе – его незначительную часть [10]. Непропорциональное возрастание биомассы лимацин может указывать на особо благоприятное для них сочетание условий среды: солености, температуры, динамики в верхних слоях моря, доступной пищи.
На связь концентрации лимацин с обилием фитопланктона и величиной первичной продукции указывали ряд авторов [34, 43]. В этих работах отмечалось, что биомасса L. helicina существенно зависит от уровня первичной продукции и концентрации фитопланктона. Приводятся данные о значительном росте биомассы лимацин во время “цветения” фитопланктона [13], и резком снижении обилия популяции при уменьшении первичного продуцирования [42]. При рассмотрении всего массива собранных в пяти рейсах данных мы не обнаружили связи между численностью и биомассой лимацин, с одной стороны, и обилием фитопланктона с другой. Не было выявлено зависимости обилия L. helicina от концентрации хлорофилла и в работе [19]. При этом авторы полагали, что это объяснялось постоянно высокой обеспеченностью моллюсков пищей в исследуемой экосистеме Калифорнийского течения. Надо отметить, что в процитированных выше работах обеспеченность лимацин пищей не оценивалась, и не определялась величина их суточного рациона в исследованных условиях. Возрастание обилия птеропод с увеличением концентрации фитопланктона и первичной продукции может быть следствием сходной зависимости всех этих показателей от какого-нибудь третьего фактора (например, сезон, или гидродинамические условия).
В нашей предыдущей работе [4] была обнаружена высокая корреляция между потреблением пищи и весом птеропод, с одной стороны, и отсутствие зависимости между уровнем потребления и концентрацией пищи. Были предложены две вероятные причины отсутствия такой зависимости. Первая связана со способом питания с помощью слизистой ловчей сети, собирающей пищевые частицы из большого объема воды [28]. Такой способ может обеспечить высокое (близкое к максимальному) потребление пищи даже при относительно невысокой концентрации пищевых частиц. Второе обстоятельство методическое. Даже при дробном по вертикали отборе проб на хлорофилл и последующем интегрировании полученных данных на слой, из которого отбирали лимацин, полученные величины не обеспечивают адекватной оценки условий питания в природе. Можно предположить, что лимацины находят узкие слои с наиболее высокой концентрацией пищи (фитопланктон в Арктических морях формирует такие слои [7]), где и питаются с максимальной скоростью. В пользу этого предположения говорят результаты, полученные в настоящем исследовании. При отсутствии связи между биомассой лимацин и средней концентрацией хлорофилла в верхнем слое, выявлена зависимость между биомассой моллюсков и максимальной концентрацией хлорофилла (p = 0.004) на горизонтах скопления фитопланктона на станциях с высокой численностью птеропод в районе желоба Св. Анны.
Используя полученную ранее [4] зависимость содержания растительных пигментов в кишечнике лимацин (G, нг) от веса их тела (DW, мг сухого веса) lg G = 1.999 + 1.281 lg DW и время прохождения пищи через кишечник (8.7 ч), мы рассчитали величину суточного потребления хлорофилла одной особью среднего в нашем исследовании размера (0.4 мм) – 11 нг/сут. По этой предварительной оценке, популяция лимацин в районе их наибольших скоплений выедала от 15 до 25% биомассы фитопланктона (оценка по хлорофиллу). Наши оценки значительно выше, чем максимальные 5–6%, приведенные в работе [3], что, вероятно, связано с различными способами определения времени прохождения пищи через кишечник – 19.2 ч в [3] и 8.7 ч по нашим данным [4]. Оценки выедания фитопланктона популяцией Limacina retroversa во фронтальной полярной зоне Южного океана дали величины, превосходящие полученные нами: от 8.4 до 307% биомассы в сутки [20]. Последняя цифра, однако, является очевидным артефактом.
Неоднократно высказывалось мнение, что раковинные крылоногие моллюски будут одними из первых пелагических организмов, которые пострадают от климатических изменений [12, 19, 25]. В первую очередь, это связывалось с возможным повышением кислотности (“ацидификацией”) океана, что приведет к разрушению арагонитовой раковины лимацин. В последние десятилетия было отмечено небольшое локальное уменьшение биомассы L. helicina в районе острова Ванкувер [35], хотя на более крупном временном масштабе при анализе данных, собранных с 1950 г., четкого тренда не выявлено [39]. Не только “ацидификация”, но и повышение температуры воды для птеропод с узким диапазоном предпочитаемых температурных условий, каковой является L. helicina, может быть губительно. За последнее время в проливе Фрама отмечалось заметное увеличение численности относительно теплолюбивого вида L. retroversa и снижение холодолюбивого L. helicina, особенно после потепления 2007 г. [16]. В наших сборах 2014–2016 гг. биомасса и численность моллюсков была значительно ниже, чем в 2007 и 2011 гг. Возможно, это первые следствия климатических изменений, однако при столь непродолжительном периоде наблюдения нельзя уверенно утверждать, что эти различия связаны с долговременными изменениями, а не с каким-либо другим фактором, например, характерной для вида высокой межгодовой вариабельностью обилия [35]. Для подтверждения отмеченного тренда необходимы дальнейшие оценки в тех же районах, особенно в местах формирования регулярных скоплений лимацин, например, в районе континентального склона желоба Св. Анны.
Образование плотных скоплений лимацин в исследованных арктических морях обусловлено, по-видимому, сочетанием благоприятных для них факторов: высокой солености (≥33 psu), оптимального диапазона температуры (1–5°С), наличием концентрирующих планктонные организмы гидрофизических процессов, ассоциированных с фронтальными зонами. Наши результаты, основанные на всем массиве данных, полученных в различных по условиям пелагических биотопах, не подтвердили связи обилия птеропод ни со средней концентрацией хлорофилла в слое их обитания, ни с концентрацией хлорофилла в слое максимума. Так как наши предыдущие результаты [4] не выявили зависимости скорости питания лимацин от концентрации фитопланктона, можно предположить, что на станциях, где птероподы были обильны, связь их биомассы с максимальной концентрацией хлорофилла объясняется сходным концентрирующим влиянием процессов в области склоновой фронтальной зоны на зоо- и фитопланктон. Действительно, над континентальным склоном желоба Св. Анны отмечено увеличение биомассы фитопланктона [6] и зоопланктона [10], причем в последнем доминировала L. helicina [10]. Полученные результаты позволяют предположить, что роль птеропод в функционировании пелагических экосистем морей Сибирской Арктики существенно отличается от роли копепод, основного постоянного компонента таких экосистем, во многом благодаря существенной пространственной неравномерности количественного распределения моллюсков. Раковинные птероподы, представленные в этих морях одним видом Limacina helicina, крайне требовательны к условиям солености и температуры, а среди копепод многие массовые виды обитают при широких диапазонах и различных сочетаниях температуры и солености. Именно этим, вероятнее всего, определяется гораздо более неравномерное количественное распределение птеропод по акваториям морей по сравнения с копеподами. При этом более высокая скорость питания птеропод и ее слабая в отличие копепод зависимость от концентрации пищи [4] приводит к значительному выеданию фитопланктона в районах с плотными скоплениями моллюсков.
Источник финансирования. Полевые исследования выполнены по теме госзадания № 0149-2019-0008. Обработка проб и обобщение результатов поддержаны проектом РФФИ “Арктика” № 18-05-60 069, анализ полученных данных выполнен при поддержке РФФИ (проект № 19-05-00022), подготовка и написание статьи – проекта РФФИ № 19-04-00322.
Список литературы
Арашкевич Е.Г., Флинт М.В., Никишина А.Б. и др. Роль зоопланктона в трансформации органического вещества в Обском эстуарии, шельфовых и глубоководных районах Карского моря // Океанология. 2010. Т. 50. № 5. С. 823–836.
Виноградов М.Е., Шушкина Э.А. Функционирование планктонных сообществ эпипелагиали океана. М.: Наука, 1987. 240 с.
Дриц А.В., Арашкевич Е.Г., Никишина А.Б. и др. Роль массовых видов мезозоопланктона в выедании фитопланктона в северных районах Карского моря в осенний сезон // Океанология. 2015. Т. 55. № 4. С. 656–667.
Пастернак А.Ф., Дриц А.В., Флинт М.В. Питание, продукция яиц и дыхание крылоногих моллюсков Limacina в арктических морях // Океанология. 2017. Т. 57. № 1. С. 137–145.
Рогачев К.А. Формирование плотных скоплений пелагических моллюсков (Limacina helicina) в заливе Академии, Охотское море // Изв. ТИНРО. 2011. Т. 166. С. 200–207.
Суханова И.Н., Флинт М.В., Дружкова Е.И. и др. Фитопланктон северо-западной части Карского моря // Океанология. 2015. Т. 5. № 4. С. 605–619. https://doi.org/10.7868/S0030157415040140
Суханова И.Н., Флинт М.В., Сахарова Е.Г. и др. Фитоценозы Обского эстуария и Карского шельфа в поздневесенний сезон // Океанология. 2018. Т. 58. № 6. С. 882–898.
Флинт М.В. 54-й экспедиционный рейс научно-исследовательского судна “Академик Мстислав Келдыш” в Карское море // Океанология. 2010. Т. 50. № 5. С. 677–682.
Флинт М.В., Семенова Т.Н., Арашкевич Е.Г. и др. Структура зоопланктонных сообществ в области эстуарной фронтальной зоны реки Обь // Океанология. 2010. Т. 50. № 5. С. 809–822.
Флинт М.В., Поярков С.Г., Тимонин А.Г., Соловьев К.А. Структура мезопланктонного общества в области континентального склона желоба Святой Анны (Карское море) // Океанология. 2015. Т. 5. № 4. С. 643–655. https://doi.org/10.7868/S0030157415040061
Численко Л.Л. Номограммы для определения веса водных организмов по размерам и форме тела. Л.: Наука, 1968. 106 с.
Accornero A., Manno C., Esposito F., Gambi M.C. The vertical flux of particulate matter in the polynya of Terra Nova Bay. Part II. Biological components // Antarct. Sci. 2003. V. 15. P. 175–188.
Atkinson A., Shreeve R. S., Pakhomov E. A. et al. Zooplankton response to a phytoplankton bloom near South Georgia, Antarctica // Marine Ecology Progress Series. 1996. V. 144. P. 195–210.
Bathmann U.V., Noji T.T., von Bodungen B. Sedimentation of pteropods in the Norwegian Sea in autumn // Deep-Sea Res. 1991. A 38. № 10. P. 1341–1360.
Bauerfeind E., Nöthig E.M., Beszczynska A. et al. Particle sedimentation patterns in the eastern Fram Strait during 2000–2005: results from the Arctic long-term observatory HAUSGARTEN// Deep-Sea Res. I. 2009. V. 56. № 9. P. 1471–1487.
Bauerfeind E., Nöthig E.-M., Pauls B. et al. Variability in pteropod sedimentation and corresponding aragonite flux at the Arctic deep-sea long-term observatory HAUSGARTEN in the eastern Fram Strait from 2000 to 2009 // J. of Marine Systems. 2014. V. 132. P. 95–105.
Bé A.W.H., Gilmer R.W. A zoogeographic and taxonomic review of euthecosomatous Pteropoda // Oceanic micropalaeontology / Ed. Ali M. A., Londo: Academic Press, 1977. P. 773–808.
Bednaršek N., Tarling G.A., Fielding S., Baker D.C.E. Population dynamics and biogeochemical significance of Limacina helicina antarctica in the Scotia sea (Southern Ocean) // Deep-Sea Res. II. 2012. V. 59–60. P. 105–116.
Bednaršek N., Feely R.A., Tolimieri N. et al. Exposure history determines pteropod vulnerability to ocean acidification along the US West Coast // Scientific Reports. 2017. V. 7: 4526 https://doi.org/10.1038/s41598-017-03934-z
Bernard K.S. The role of the euthecosome pteropod, Limacina retroversa, in the polar frontal zone, southern ocean // Thesis submitted in fulfillment of the requirements for the degree of Doctor of Philosophy, Rhodes University, South Africa, 2006. P. 196.
Bernard K.S., Froneman P.W. The sub-Antarctic euthecosome pteropod, Limacina retroversa: Distribution patterns and trophic role // Deep-Sea Res. I. 2009. V. 56. P. 582–598. https://doi.org/10.1016/j.dsr.2008.11.007
Bolker B. Ecological models and data in R. Princeton, NJ: Princeton University Press, 2007. 507 p.
Busch K., Bauerfeind E., Nöthig E.-M. Pteropod sedimentation patterns in different water depths observed with moored sediment traps over a 4-year period at the LTER station HAUSGARTEN in eastern Fram Strait // Polar Biology. 2015. V. 38. № 6. P. 845–859. https://doi.org/10.1007/s00300-015-1644-9
Chen C. 1968. Zoogeography of thecosomatous pteropods in the West Antarctic Ocean // Nautilus. V. 81. P. 94–100.
Comeau S., Jeffree R., Teyssie J.-L. et al. Response of the Arctic pteropod Limacina helicina to projected future environmental conditions // PLoS ONE. 2010. V. 5. № 6. e11362. https://doi.org/10.1371/journal.pone.0011362
Cribari-Neto F., Zeileis A. Beta Regression in R // J. of Statistical Software. 2010. V. 34. № 2. P. 1–24. http://www.jstatsoft.org/v34/i02/.
Gannefors C., Marco B., Gerhard K. et al. The Arctic sea butterfly Limacina helicina: lipids and life strategy // Marine Biology. 2005. V. 147. P. 169–177.
Gilmer R.W., Harbison G.R. Diet of Limacina helicina (Gastropoda: Thecosomata) in Arctic waters in midsummer // Mar. Ecol. Prog. Ser. 1991. V. 77. P. 125–134.
Hopkins T.L. Midwater food web in McMurdo Sound, Ross Sea, Antarctica // Marine Biology. 1987. V. 96. P. 93–106.
Howard W.R., Roberts D., Moy A.D. et al. Distribution, abundance and seasonal flux of pteropods in the Sub-Antarctic Zone // Deep-Sea Res. II. 2011. V. 58. P. 2293–2300.
Hunt B.P.V., Pakhomov E.A., Hosie G.W. et al. Pteropods in Southern Ocean ecosystems // Progress in Oceanography. 2008. V. 78. P. 193–221.
Kacprzak P., Panasiuk A., Wawrzynek J., Weydmann A. Distribution and abundance of pteropods in the western Barents Sea // Oceanological and Hydrobiological Studies. 2017. V. 46. № 4. P. 393–404. https://doi.org/10.1515/ohs-2017-0039
Lischka S., Büdenbender J., Boxhammer T., Riebesell U. Impact of ocean acidification and elevated temperatures on early juveniles of the polar shelled pteropod Limacina helicina: mortality, shell degradation, and shell growth // Biogeosciences. 2011. V. 8. P. 919–932. https://doi.org/10.5194/bg-8-919-2011
Maas A.E., Elder L.E., Dierssen H.M., Seibel B.A. Metabolic response of Antarctic pteropods (Mollusca: Gastropoda) to food deprivation and regional productivity // Marine Ecology Progress Series. 2011. V. 441. P. 129–139.
Mackas D.L., Galbraith M.D. Pteropod time-series from the NE Pacific // ICES Journal of Marine Science. 2012. V. 69. P. 448–459.
Manno C., Tirelli V., Accornero A., Fonda Umani S. Importance of the contribution of Limacina helicina faecal pellets to the carbon pump in Terra Nova Bay (Antarctica) // J. Plankton Res. 2010. V. 34. P. 145–152.
Nishizawa Y., Sasaki H., Takahashi K. 2016. Interannual variability in shelled pteropods (Limacina spp.) in the Indian sector of the Southern Ocean during austral summer // Antarct. Rec. 2016. V. 60. P. 35–48.
Noji T.T., Bathmann U.V., von Bodungen B. et al. 1997. Clearance of picoplankton-sized particles and formation of rapidly sinking aggregates by the pteropod, Limacina retroversa // J. Plankton Res. 1997. V. 19. P. 863–875.
Ohman M.D., Lavaniegos B.E., Townsend A.W. 2009. Multidecadal variations in calcareous holozooplankton in the California Current System: thecosome pteropods, heteropods, and foraminifera // Geoph. Res. letters. 2009. V. 36: L18608.
Pakhomov E.A., Froneman P.W., Wassmann P. et al. Contribution of algal sinking and zooplankton grazing to downward flux in the Lazarev Sea (Southern Ocean) during the onset of phytoplankton bloom: a lagrangian study // Mar. Ecol. Prog. Ser. 2002. V. 233. P. 73–88.
R Core Team. R: A language and environment for statistical computing // R Foundation for Statistical Computing, Vienna, Austria. 2019. https://www.R-project.org/.
Seibel B.A., Dierssen H.M. Cascading trophic impacts of reduced biomass in the Ross Sea, Antarctica: Just the Tip of the Iceberg? // Biological Bulletin. 2003. V. 205. P. 93–97.
Seibel B.A., Maas A.E., Dierssen H.M. Energetic plasticity underlies a variable response to ocean acidification in the pteropod, Limacina helicina antarctica // PLoS 652 ONE. 2012. V. 7: e30464.
Tsurumi M., Mackas D.L., Whitney F.A. et al. Pteropods, eddies, carbon flux, and climate variability in the Alaska Gyre // Deep-Sea Res. II. 2005. V. 52. P. 1037–1053.
Wang K., Hunt B.P.V., Liang C. et al. Reassessment of the life cycle of the pteropod Limacina helicina from a high resolution interannual time series in the temperate North Pacific // ICES J. of Marine Science. 2017. V. 74. № 7. P. 1906–1920. https://doi.org/10.1093/icesjms/fsx014
Winter B. Linear models and linear mixed effects models in R with linguistic applications. 2013. arXiv: 1308.5499
Zeileis A., Hothorn T. Diagnostic checking in regression relationships // R News. 2002. V. 2. № 3. P. 7–10. URL https://CRAN.R-project.org/doc/Rnews/
Дополнительные материалы отсутствуют.