Океанология, 2021, T. 61, № 2, стр. 233-249
Донные сообщества бассейна Пауэлла
С. В. Галкин 1, *, К. В. Минин 1, А. А. Удалов 1, М. В. Чикина 1, Д. И. Фрей 1, Т. Н. Молодцова 1, М. И. Симаков 1, О. А. Головань 2, В. А. Сошнина 3, 4, Н. Ю. Неретин 5, В. А. Спиридонов 1
1 Институт океанологии им. П.П. Ширшова РАН
Москва, Россия
2 Национальный научный центр морской биологии ДВО РАН
Владивосток, Россия
3 Всероссийский научно-исследовательский институт рыбного хозяйства и океанографии
Москва, Россия
4 Кафедра ихтиологии, Биологический факультет МГУ им. М.В. Ломоносова
Москва, Россия
5 Беломорская биологическая станция им. Н.А. Перцова, Биологический факультет МГУ
им. М.В. Ломоносова
Москва, Россия
* E-mail: galkin@ocean.ru
Поступила в редакцию 15.06.2020
После доработки 30.06.2020
Принята к публикации 15.08.2020
Аннотация
В ходе 79-го рейса НИС “Академик Мстислав Келдыш” в бассейне Пауэлла и сопредельных районах было выполнено 12 траловых станций в диапазоне глубин 370–3771 м. При рассмотрении структуры донных сообществ на уровне макротаксонов наблюдалась высокая вариабельность. Различия в таксономической структуре определялись глубиной, скоростью придонных течений и долей твердой фракции грунта. Наиболее четко выделялось сообщество с преобладанием сестонофагов (в первую очередь, губок) на твердых грунтах склона Антарктического полуострова и хребта Филип, ассоциированное с наибольшими значениями скоростей придонных приливных течений (до 55.6 см/с). На ряде исследованных станций отмечены виды-индикаторы уязвимых морских экосистем – губки Demospongiae и глубоководные кораллы Stylasteridae (Hydrozoa) и Primnoidae (Octocorallia).
ВВЕДЕНИЕ
Донная фауна антарктической части Южного океана отличается значительным видовым богатством и высоким уровнем таксономического разнообразия и эндемизма большинства входящих в нее групп [6, 11, 33, 17, 20 ]. Бентосные сообщества Антарктики обладают рядом важных особенностей, в частности выраженной сезонностью происходящих в них процессов, особой ролью воздействия на донные биотопы льдов и айсбергов, вплоть до значительных глубин, доминированием эпифауны сестонофагов [4, 11, 32, 14, 10 ]. В последние годы в связи с наблюдающимся потеплением и уменьшением ледовитости, особенно сильно выраженным у западного побережья Антарктического полуострова, в литературе активно обсуждаются возможные изменения донных компонентов экосистем Антарктики [49, 42, 35 ].
Если фауне и зоогеографии отдельных таксонов Антарктики посвящено значительное количество исследований [6, 4, 11, 32, 33, 14, 10, 17, 20 ], представления о структуре донных сообществ антарктических вод в протяженном батиметрическом диапазоне их обитания (от литорали до абиссали и глубоководных желобов) даже на уровне состава макротаксонов и жизненных форм основываются на немногих относительно хорошо исследованных районах. К таким районам относятся прибрежные участки вблизи ряда антарктических станций [5, 27, 37, 11, 55, 14, 56, 36] и юго-восточная часть моря Уэдделла c сопредельным районом моря Лазарева, где в течение ряда лет проводились исследования по программе EASIZ [4, 60, 31, 11, 19, 43, 44 ]. В меньшей степени исследованы донные сообщества открытого шельфа и материкового склона западного побережья Антарктического полуострова, регулярно посещаемого научными экспедициями [34, 40].
Северо-западная часть моря Уэдделла, сопредельная районам Антарктического полуострова и моря Скотия, представляет значительный интерес с точки зрения исследований бентоса, поскольку этот район входит в наиболее затрагиваемую человеческой деятельностью, в частности рыболовством, область Антарктического полуострова и юго-западной части Атлантического сектора Южного океана. Основная часть исследований бентоса моря Уэдделла сконцентрирована в районе Антарктического полуострова [28, 29, 40], а также на шельфе и склоне западной и северной частей Южно-Оркнейского плато [18]. Только три станции со сборами бентоса, включая одну абиссальную, были выполнены в бассейне Пауэлла в ходе экспедиции ANDEEP III как часть глубоководного разреза через море Уэдделла в 2004 г. [17]. Таким образом, район бассейна Пауэлла и сопредельных подводных поднятий неравномерно и недостаточно (в особенности глубоководная и северная части) охвачен исследованиями макробентоса.
В ходе 79-го рейса НИС “Академик Мстислав Келдыш” в Антарктику в январе–феврале 2020 г. [3] проведены исследования макробентоса северо-западной части моря Уэдделла. Основной задачей исследования была оценка таксономического состава и соотношения трофических групп в донных сообществах, существующих в разных батиметрических зонах и океанографических режимах. Особый упор сделан на изучение глубоководных биотопов бассейна Пауэлла и проверку предположения о том, что поднятия склона Антарктического полуострова и хребта Филип представляют местообитания организмов-индикаторов уязвимых морских экосистем (УМЭ). Критериями для выделения УМЭ являются уникальность, функциональная значимость, хрупкость (или уязвимость) по отношению к антропогенному воздействию, структурная сложность и особенности жизненных циклов отдельных видов, осложняющие восстановление экосистемы [8]. В настоящее время ведется большая работа по выявлению УМЭ и их защите.
МАТЕРИАЛ И МЕТОДЫ
Район исследований
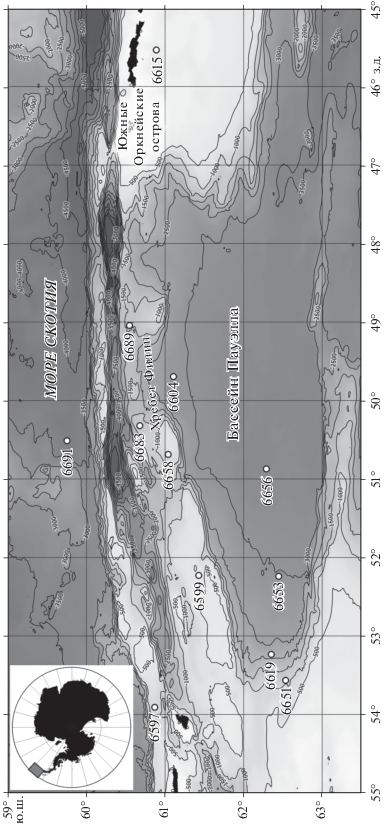
Район исследований (рис. 1) включает глубоководный бассейн Пауэлла. Этот бассейн, по своему происхождению являющийся самостоятельным бассейном океанского типа [24], ограничен с востока микроконтинентом Южно-Оркнейского плато, с севера – сложной системой поднятий хребта Филип с глубоководными каналами, с запада – материковым склоном и шельфом восточной части Антарктического полуострова, большую часть года находящимися подо льдом или в условиях краевой ледовой зоны [51]. Подводный порог с поднятиями до 1000 м и каналами отделяет абиссальную котловину бассейна Пауэлла от основной котловины моря Уэдделла.
Данные о факторах среды
Придонная температура и соленость. Вблизи каждой траловой станции были проведены вертикальные гидрологические зондирования с помощью CTD-зонда Sea-Bird Electronics SBE9 с измерениями температуры и солености в придонном слое воды. Для станций 6619, 6689 и 6691, на которых не проводили гидрологических зондирований, данные о придонной температуре и солености были взяты из World Ocean Database [16]. Данные брались для этого же сезона (январь–февраль), на такой же глубине (различие не больше 100 м) и на расстоянии не больше 20–30 миль от точек станций.
Измерение и моделирование скоростей придонных течений. Максимальные скорости придонных течений в точках работ определяли на основе прямых измерений и численной модели приливных течений. Прямые измерения проводили погружным акустическим доплеровским профилографом течений (LADCP, Lowered Acoustic Current Profiler) TRDI WorkHorse Monitor 300 kHz. Зондирования проводили одновременно с измерениями профилей температуры и солености. Зондирования проводились по всей толще океана от поверхности до дна, минимальное расстояние до дна обычно составляло 5 м. Обработка данных погружного измерителя течений проводилась по стандартному алгоритму [59], позволяющему получить горизонтальные скорости течений по всей толще океана. В качестве придонной скорости выбиралась скорость самого глубокого горизонта с вертикальным осреднением 8 м. Параллельно с прямыми измерениями нами были определены скорости приливных течений для шельфа, материкового склона и подводных поднятий района (рис. 2). Эта оценка проводилась по модели TPXO9 Орегонского университета, использующей данные динамической топографии, полученные с помощью спутниковой альтиметрии [30]. Для дальнейшего анализа максимальная скорость течений выбиралась на основе полученных натурных и расчетных данных. При этом если на станции проводились прямые измерения LADCP, то за максимальную скорость брались именно данные измерений, а в случае их отсутствия – данные моделирования. На двух станциях (6651 и 6653) модельные величины скоростей существенно превышали измеренные, при этом модель подтверждала низкие расчетные скорости на момент измерений. При дальнейшем анализе для этих двух станций также использовалась максимальная скорость прилива на основе моделирования (табл. 1).
Рис. 2.
Максимальные скорости приливных течений по данным модели TPXO9 и скорости придонных течений, измеренные судовым LADCP.

Таблица 1.
Факторы среды, использованные для анализа. Значения температуры (T), солености (S) и максимальных скоростей течений (Vmax) приведены для придонного слоя воды
| Станция | Средняя глубина (м) | Vmax (см/с) | T (°С) | S (psu) | Грунт |
|---|---|---|---|---|---|
| 6597 | 840 | 77.4 | 0.27 | 34.64 | Твердый |
| 6599 | 548 | 55.6 | –0.43 | 34.55 | Твердый |
| 6604 | 2797 | 6.8 | –0.53 | 34.63 | Рыхлый |
| 6615 | 373 | 21.4† | 0.00 | 34.59 | Рыхлый |
| 6619 | 2210 | 19.9† | –0.53* | 34.65* | Смешанный |
| 6651 | 1045 | 25.8† | –0.47 | 34.61 | Смешанный |
| 6653 | 2894 | 14.3† | –0.48 | 34.63 | Рыхлый |
| 6656 | 3293 | 16.3 | –0.71 | 34.61 | Рыхлый |
| 6658 | 757 | 38.3 | –0.08 | 34.60 | Твердый |
| 6683 | 1303 | 26.9 | –0.51 | 34.63 | Смешанный |
| 6689 | 1472 | 8.9† | –0.42* | 34.64* | Смешанный |
| 6691 | 3764 | 4.6† | 0.54* | 34.29* | Смешанный |
Тип грунта. Информация о составе грунтов для каждой станции была получена на основе визуального анализа грунта в траловых пробах. На нескольких станциях эти данные были дополнены видео- и фотонаблюдениями, сделанными БНПА “Видеомодуль” (ст. 6651, 6658 и 6689) и АНПА “ММТ-3000” (ст. 6599) [3]. После обобщения данных грунтам на каждой станции была присвоена одна из трех характеристик: твердый, смешанный или рыхлый. Для последующего анализа эти характеристики были переведены в числовой вид, отражающий ранжированную долю крупной фракции (1 для твердого, 0.5 для смешанного и 0 для рыхлого грунта).
Данные о факторах среды приведены в табл. 1.
Сбор и обработка проб донной фауны
В ходе 79-го рейса НИС “Академик Мстислав Келдыш” в бассейне Пауэлла, а также на шельфе и материковом склоне Антарктического полуострова, склоне подводных поднятий хребта Филип, и на шельфе Южных Оркнейских островов были выполнены 10 траловых станций в диапазоне глубин 375–3293 м. Помимо этого, были сделаны две дополнительные станции в сопредельных районах – в море Скотия к северу от о. Кларенс (ст. 6597, 836–843 м) и в бассейне Протектор (ст. 6691, 3771–3756 м) (табл. 2, рис. 1).
Таблица 2.
Станции донных тралений, выполненные в 79-м рейсе НИС “Академик Мстислав Келдыш”
| Станция | Касание | Отрыв | Длина трека, км | ||||||
|---|---|---|---|---|---|---|---|---|---|
| дата и время судовое (GMT-3) | широта, южная |
долгота, западная | глубина, м | дата и время судовое (GMT-3) | широта, южная |
долгота, западная | глубина, м | ||
| 6597 | 23.01.2020 19:13 | 60.8678 | 53.9087 | 836 | 23.01.2020 19:53 | 60.8657 | 53.9321 | 843 | 0.65 |
| 6599 | 24.01.2020 18:13 | 61.4281 | 52.2283 | 552 | 24.01.2020 19:40 | 61.4331 | 52.2252 | 544 | 0.63 |
| 6604* | 27.01.2020 5:07 | 61.1059 | 49.6952 | 2792 | 27.01.2020 07:46 | 61.1053 | 49.6589 | 2801 | 1.96 |
| 6615 | 30.01.2020 10:08 | 60.8879 | 45.5343 | 370 | 30.01.2020 11:10 | 60.8835 | 45.5231 | 375 | 0.80 |
| 6619 | 01.02.2020 17:44 | 62.3514 | 53.2351 | 2130 | 01.02.2020 20:47 | 62.3371 | 53.2171 | 2289 | 1.69 |
| 6651 | 15.02.2020 05:37 | 62.5343 | 53.5655 | 1030 | 15.02.2020 07:17 | 62.5410 | 53.5610 | 1060 | 1.13 |
| 6653* | 16.02. 2020 21:11 | 62.4463 | 52.2399 | 2889 | 17.02.2020 00:16 | 62.4511 | 52.2079 | 2898 | 1.80 |
| 6656* | 17.02. 2020 20:48 | 62.2883 | 50.8717 | 3292 | 18.02.2020 00:00 | 62.2965 | 50.8466 | 3293 | 1.83 |
| 6658 | 18.02.2020 20:42 | 61.0387 | 50.6875 | 740 | 18.02.2020 21:58 | 61.0385 | 50.7046 | 773 | 0.87 |
| 6683 | 21.02.2020 14:42 | 60.6781 | 50.3207 | 1306 | 21.02.2020 15:40 | 60.6694 | 50.3215 | 1299 | 0.93 |
| 6689 | 23.02.2020 13:57 | 60.5459 | 49.0441 | 1470 | 23.02.2020 15:15 | 60.5365 | 49.0472 | 1473 | 0.74 |
| 6691* | 24.02.2020 12:46 | 59.7509 | 50.5126 | 3771 | 24.02.2020 16:02 | 59.7369 | 50.5313 | 3756 | 1.85 |
Для сбора донной мега- и макрофауны использовали два трала Сигсби со стальной рамой шириной 2 или 2.5 м и высотой 35 и 50 см соответственно (табл. 2), с подборами из стального троса 4 мм. Трал был оснащен двойным мешком: наружный мешок сделан из двойной узловой капроновой дели из веревки 3.1 мм с ячеей 45 мм; внутренний – из безузловой дели с ячеей 4 мм. Трал утяжелялся двумя стальными штангами длиной 5 м с каплевидными грузами по 20 кг на конце. Забортные работы проводили при скорости 0.3–0.6 узла.
Полученную пробу промывали на системе стальных сит с ячеей 10 и 1 мм. Разборка проб велась по стандартной методике, в соответствии со списком из 72 макротаксонов, принятым в практике работы ИО РАН. После разборки представителей каждой группы подсчитывали и взвешивали (табл. 3). Первичную фиксацию проводили 96% этиловым спиртом и 6% нейтрализованным формалином.
Таблица 3.
Численность (N, экз.) и биомасса (В, г) таксонов макро- и мегабентоса в траловых пробах 79-го рейса НИС “Академик Мстислав Келдыш”
| Макротаксон | 6597 | 6599 | 6604 | 6615 | 6619 | 6651 | 6653 | 6656 | 6658 | 6683 | 6689 | 6691 | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| N | B | N | B | N | B | N | B | N | B | N | B | N | B | N | B | N | B | N | B | N | B | N | B | |
| Demospongiae | 3 | 2.80 | 151 | 35 330.20 | 3 | 0.50 | 6 | – | 6 | 2.00 | 3 | 0.01 | 10 | 15 400.00 | 1 | – | 2 | 15.75 | ||||||
| Hexactinellida | 2 | 620.00 | ||||||||||||||||||||||
| Hydrozoa | 7 | 8.70 | 142 | 12.80 | 2 | 0.01 | 1 | 0.01 | 13 | 1.70 | 6 | 0.10 | ||||||||||||
| Scyphozoa | 1 | – | ||||||||||||||||||||||
| Anthozoa (неопр.) | 2 | 3.91 | 3 | 4.33 | ||||||||||||||||||||
| Actiniaria | 29 | 4080.00 | 1 | 62.00 | 1 | 1.80 | 7 | 198.40 | 2 | 1.65 | 4 | 47.60 | 10 | 474.20 | 20 | 664.35 | ||||||||
| Ceriantharia | 2 | 0.87 | ||||||||||||||||||||||
| Scleractinia | 3 | 6.20 | 1 | – | 2 | 54.20 | 1 | 0.85 | 1 | 0.70 | ||||||||||||||
| Alcyonacea | 5 | 19.20 | 6 | 21.15 | 2 | 3.20 | 2 | 0.02 | 5 | 14.52 | 16 | 28.00 | 3 | 0.76 | 12 | 127.20 | ||||||||
| Pennatullacea | 1 | 1.20 | ||||||||||||||||||||||
| Turbellaria | 2 | 0.32 | ||||||||||||||||||||||
| Nemertea | 7 | – | 33 | 4.90 | 1 | 0.01 | 2 | 0.25 | 3 | 0.25 | ||||||||||||||
| Priapulida | 7 | 1.65 | 7 | 0.94 | 1 | 0.15 | ||||||||||||||||||
| Sipuncula | 1 | 0.40 | 1 | 2.20 | 2 | – | 1 | – | 1 | 0.10 | ||||||||||||||
| Echiura | 3 | 59.50 | 1 | 0.35 | ||||||||||||||||||||
| Polychaeta | 109 | 45.90 | 53 | 22.72 | 1038 | 81.75 | 10 | 1.68 | 55 | 23.60 | 59 | 18.98 | 70 | 15.61 | 163 | 629.95 | 100 | 31.95 | 63 | 32.10 | 56 | 92.58 | ||
| Solenogastres | 1 | 0.01 | ||||||||||||||||||||||
| Polyplacophora | 1 | 0.01 | ||||||||||||||||||||||
| Bivalvia | 1 | – | 84 | 19.20 | 395 | 18.80 | 26 | 3.15 | 2 | 0.20 | 2 | 0.20 | 1 | 0.20 | 12 | 2.18 | ||||||||
| Gastropoda | 15 | 160.61 | 5 | 0.40 | 13 | 8.70 | 1 | 0.35 | 13 | 0.75 | 50 | 4.90 | 8 | 1.92 | 17 | 31.35 | 35 | 9.39 | 5 | 0.90 | 101 | 31.17 | ||
| Scaphopoda | 198 | 14.32 | ||||||||||||||||||||||
| Cephalopoda | 1 | 110.00 | 1 | 5.50 | 1 | 41.65 | 1 | 0.60 | 1 | 1.32 | 2 | 2.10 | 2 | 65.00 | 2 | 149.25 | ||||||||
| Crustacea (неопр.) | 16 | – | 17 | 1.50 | ||||||||||||||||||||
| Ostracoda | 1 | 0.01 | ||||||||||||||||||||||
| Cirripedia | 1 | 0.10 | 2 | 1.60 | ||||||||||||||||||||
| Mysidacea | 33 | 3.00 | 27 | 7.87 | 31 | 11.00 | 167 | 13.73 | 2 | 2.02 | 2 | – | 4 | 1.80 | 165 | 15.84 | 1 | 1.80 | ||||||
| Cumacea | 2 | 0.01 | 3 | 0.08 | 1 | – | 13 | 0.90 | 1 | 0.05 | ||||||||||||||
| Tanaidacea | 4 | 0.22 | 4 | 0.01 | 2 | – | 2 | 0.01 | ||||||||||||||||
| Isopoda | 151 | 72.98 | 170 | 46.95 | 88 | 123.75 | 23 | 11.06 | 25 | 96.46 | 71 | 9.73 | 52 | 120.20 | 68 | 31.20 | 11 | 19.70 | 129 | 78.60 | 9 | 2.90 | 44 | 62.22 |
| Amphipoda | 497 | 58.03 | 310 | 120.70 | 511 | 324.05 | 35 | 5.31 | 57 | – | 114 | 8.10 | 46 | 20.19 | 4 | – | 126 | 20.50 | 335 | 23.20 | 102 | 12.50 | 14 | 0.70 |
| Decapoda | 33 | 25.36 | 69 | 800.00 | 14 | 74.20 | 26 | 172.70 | 1 | 17.50 | ||||||||||||||
| Pycnogonida | 483 | 41.40 | 4 | 2.85 | 19 | 1.10 | 1 | 0.01 | 5 | 0.00 | 319 | 33.80 | 110 | 14.50 | 1 | 0.01 | 28 | 32.30 | 165 | 38.50 | 64 | 9.90 | 9 | 2.22 |
| Ascothoracida | 3 | – | ||||||||||||||||||||||
| Entoprocta | 1 | – | ||||||||||||||||||||||
| Bryozoa | 34 | 3.60 | 9 | 0.50 | 1 | 5.60 | 30 | 19.50 | – | 0.07 | ||||||||||||||
| Brachiopoda | 2 | 0.11 | 1 | 0.15 | 1 | 0.42 | 6 | 2.70 | ||||||||||||||||
| Crinoidea | 25 | 46.35 | 36 | 250.00 | 8 | 1.45 | 2 | 0.49 | 8 | 12.50 | 2 | 3.58 | 1 | 0.40 | 60 | 155.70 | 1 | 0.30 | 1 | 1.10 | ||||
| Echinoidea | 8 | 117.65 | 14 | 152.83 | 21 | 51.20 | 6 | 32.12 | 18 | 94.20 | 33 | 239.80 | 6 | 91.00 | 10 | 115.96 | 9 | 87.50 | 61 | 571.17 | ||||
| Holothuroidea | 1 | 0.03 | 23 | 21.53 | 9 | 55.95 | 1 | 0.10 | 15 | 57.50 | 23 | 156.82 | 7 | 49.50 | 2 | 39.60 | 19 | 18.41 | 60 | 566.74 | 20 | 26.00 | 174 | 1509.37 |
| Asteroidea | 103 | 202.35 | 13 | 22.95 | 22 | 126.70 | 6 | 27.70 | 37 | 17.56 | 58 | 169.53 | 14 | 15.50 | 12 | 27.85 | 5 | 2.04 | 69 | 442.63 | ||||
| Ophiuroidea | 205 | 120.40 | 1008 | 991.10 | 210 | 180.00 | 30 | 16.50 | 178 | 125.40 | 17 | 7.90 | 120 | 139.11 | 191 | 54.00 | 90 | 40.10 | 646 | 747.03 | ||||
| Enteropneusta | 1 | 1.60 | ||||||||||||||||||||||
| Pterobranchia | 6 | 10.40 | ||||||||||||||||||||||
| Ascidiacea | 8 | 28.00 | 6 | 26.20 | 2 | 0.40 | 3 | 1.65 | 6 | 112.00 | 4 | 12.90 | 9 | 5.70 | 2 | 1.40 | 1 | 1.10 | ||||||
| Pisces | 1 | 50.00 | 21 | 2.50 | 3 | 0.01 | 2 | – | ||||||||||||||||
| Все таксоны | 1710 | 5188.47 | 2028 | 37 098.69 | 1018 | 729.78 | 2036 | 213.07 | 478 | 1835.95 | 926 | 479.81 | 619 | 1141.02 | 183 | 97.84 | 646 | 16 718.65 | 1286 | 1709.28 | 382 | 236.86 | 1261 | 4428.09 |
Методы статистической обработки материала. Статистическая обработка была произведена только для траловых уловов из основного района работ – бассейна Пауэлла, включая окружающие его подводные поднятия (10 станций), на уровне макротаксонов, выделенных при первичной обработке. Всего было выделено 45 таксонов (табл. 3). Поскольку использование данных по численности приводит к преувеличению роли мелких организмов, а данных по биомассе – к преувеличению роли крупных организмов, в качестве меры обилия использовали относительную интенсивность метаболизма (RR – respiration rate) [2, 13]:
Для анализа использовали процентные величины, так как объем тралов существенно различался от станции к станции. В качестве меры сходства проб использовали индекс Брэя-Кертиса, на основании полученных матриц сходства выполняли ординацию станций методом многомерного шкалирования (MDS) и кластеризацию станций (присоединение по среднему сходству). Значимые группы станций при кластеризации выявляли с помощью процедуры SIMPROF (определение значимых кластеров при отсутствии априорных групп) [21]. Для оценки роли абиотических факторов и их связи с таксономической структурой был использован метод канонического анализа соответствий (CCA – Canonical Correspondence Analysis) [50]. Предварительный анализ показал, что изменения придонной солености в районе исследования (34.55–34.65 psu) не значимы. Изменения температуры (0–0.71°С) и глубины сильно скоррелированы между собой (коэффициент корреляции Спирмена – 0.806). В этой связи параметры температура и соленость были исключены из анализа. Таким образом, в качестве действующих факторов мы использовали глубину, максимальную скорость придонных течений и характер грунта.
Статистический анализ был выполнен при помощи пакетов программ PRIMER V6 [21] и PAST V3 [45].
Рис. 3.
Таксономическая структура донной фауны на траловых станциях, выполненных в бассейне Пауэлла. Цифрами обозначены: 1 – Actiniaria; 2 – Amphipoda; 3 – Asteroidea; 4 – Decapoda; 5 – Demospongiae; 6 – Echinoidea; 7 – Holothuroidea; 8 – Isopoda; 9 – Ophiuroidea; 10 – Polychaeta; 11 – Mollusca; 12 – другие таксоны.

РЕЗУЛЬТАТЫ
Описание и результаты первичной обработки траловых проб
Общие данные о численности и биомассе таксонов макробентоса приведены в табл. 3 и на рис. 3. Данные по абиотическим факторам среды приведены в табл. 1.
Рис. 4.
(а) – Кластерный анализ, и (б) – ординация траловых станций методом многомерного шкалирования (на базе значений индекса сходства Брэя–Кертиса, рассчитанного по относительной интенсивности метаболизма RR). Пунктирной линией обозначены достоверные группировки станций (SIMPROF-test, p < 0,05). Цифрами обозначены глубина, м: 1 – <500; 2 – 500–1000; 3 – 1000–2000; 4 – 2000–3000; 5 – >3000; максимальные скорости течений, cм/c: 6 – <15; 7 – 15–30; 8 – >30; тип грунта: 9 – твердый; 10 – рыхлый; 11 – смешанный.

Станция 6597. Море Скотия, верхняя часть склона к северу от о. Кларенс (Южные Шетландские острова), глубина 836–843 м. Трал пришел деформированным. Грунт в трале представлен не был, предположительно крупные камни. Объем пробы около 10 л. Живой вес улова составил 5188.5 г, численность животных 1710 экз. По массе резко преобладают крупные Actiniaria (около 5 видов, при численности 29 экз. – более 4 кг или 78% улова). По численности доминируют Amphipoda (497 экз.) и Pycnogonida (483 экз.). К многочисленным группам относятся Ophiuroidea разных видов (205 экз.), Isopoda (151 экз.) и Polychaeta (109 экз). Хорошо представлены морские звезды сем. Asteriidae и Solasteridae. Довольно много бесстебельчатых Crinoidea. Заметную роль в сообществе играют гидрокораллы Stylasteridae (из-за методологических сложностей они не просчитывались и не взвешивались). Есть отдельные кустистые Octocorallia.
Станция 6599. Шельф Антарктического полуострова, глубина 544–552 м. Грунт: промытый щебень и галька разных размеров, камни размером до 1 м. Общий объем улова около 70 л, вес животных 37 098.7 г, численность 2028 экз. Основа улова – губки Demospongiae (35 330.2 г) (предварительно были выделены 18 морфотипов), Ophiuroidea разных видов (1008 экз.), гидроидные кораллы Stylasteridae, Crinoidea. Многочисленны Amphipoda.
Станция 6604. Ложе бассейна Пауэлла, глубина 2792–2801 м. Трал пришел непромытым, принес около 200 кг осадка. Грунт: алевро-пелитовый серый ил, присутствуют мелкие камни ледового разноса. Живой вес улова составил 729.8 г при численности 1018 экз. По численности и биомассе доминируют Amphipoda (511 экз.). Многочисленны и разнообразны Isopoda (88 экз., преобладают Serolidae) и мелкие Bivalvia (главным образом, Cuspidariidae) (84 экз.). В большом количестве встречены Komokioidea. Присутствуют Pycnogonida (19 экз.). В число руководящих групп по биомассе входят морские звезды сем. Porcellanasteridae (18 экз., 40.5 г) и Holothuroidea (9 экз., 55.95 г).
Станция 6615. Шельф Южных Оркнейских островов, глубина 370–375 м. Трал пришел непромытым, принес около 200 кг осадка. Грунт: жидкий пелитовый серый ил, присутствуют мелкие камни ледового разноса. Получено 2036 экз. животных общим весом 213.1 г. Довольно много прилова (Mysidacea, Euphausiidae). Ведущая группа макробентоса – различные Polychaeta: 81.8 г при численности 1038 экз., из которых наиболее массовые – крупные Sabellidae и Maldanidae. Многочисленны (395 экз. при весе 18.8 г) мелкие (до 1 см) Bivalvia нескольких видов. Очень много живых Scaphopoda (198 экз., 14.3 г). В значительных количествах обнаружены Nemertea (33 экз.).
Станция 6619. Склон Антарктического полуострова, глубина 2130–2289 м. Грунт: песок, галька и крупные валуны ледового разноса. Объем улова (за вычетом крупных валунов) составил около 10 л. Живой вес улова 1836 г, численность 478 экз. Крупные красные креветки Nematocarcinus lanceopes (56 экз.) резко доминируют в улове по биомассе (800 г). Представлены 2 крупные стеклянные губки Hexactinellida (620 г). Ophiuroidea (2–3 вида) доминируют по численности (210 экз.), внося заметный вклад в биомассу (180 г). К числу обычных форм относятся Amphipoda, Isopoda и Holothuroidea. Единичны – Echinoidea (6 экз.), Asteroidea (6 экз. трех видов). Обилие N. lanceopes сближает эту станцию с пробой со ст. 6651 (см. ниже).
Станция 6651. Западная часть бассейна Пауэлла, склон Антарктического полуострова, глубина 1030–1060 м. Трал пришел полностью промытым. Грунт: плотный промытый песок и гравий. Объем улова составил около 3 л. Представлено 926 экз. (479.8 г) животных. В целом фауна очень разнообразна. Хорошо представлены Ophiuroidea, бесстебельчатые Crinoidea, Holothuroidea, Polychaeta, крупные Nematocarcinidae. По биомассе преобладают Holothuroidea (156.8 г, 23 экз.), и Echinoidea (94.2 г, 18 экз.), а также креветки Nematocarcinus lanceopes (74.2 г). По численности лидируют Pycnogonida (319 экз., 33.8 г) и Amphipoda (114 экз.). При общем разнообразии фауны наиболее представленный тип – иглокожие.
Станция 6653. Западная часть бассейна Пауэлла, склон Антарктического полуострова, глубина 2889–2898 м. Трал пришел непромытым, объем улова около 100 л. Грунт: жидкий светло-серый пелитовый ил, крупные камни ледового разноса. Промыто и разобрано 3/4 пробы. Живой вес составил 1141 г, численность 619 экз. По численности доминируют Ophiuroidea и Pycnogonida (178 и 110 экз. соответственно). Довольно много звезд Porcellanasteridae двух видов (58 экз.), Polychaeta (59 экз.), Amphipoda (46 экз.) и Isopoda сем. Serolidae (52 экз.). Хорошо представлены Echinoidea, доминирующие по биомассе (239.8 г, 33 экз.).
Станция 6656. Центральная часть бассейна Пауэлла, глубина 3292–3293 м. Трал пришел непромытым, принес около 50 л ила и два больших камня. Грунт: жидкий желтоватый пелитовый ил, крупные камни ледового разноса. Несмотря на большую дистанцию траления, фауна очень бедная. Общий вес улова не превышает 100 г, численность – 183 экз. Крупных животных практически нет. В заметном количестве представлены лишь Polychaeta, Isopoda (сем. Munnopsidae) и Ophiuroidea (70, 68 и 17 экз. соответственно). Эти же таксоны лидируют и по биомассе. Представители других групп единичны (не более 4 экз.).
Станция 6658. Северная граница бассейна Пауэлла, подводное поднятие на хребте Филип, глубина 740–773 м. Траловая рама деформирована. Улов полностью промыт в ходе подъема, вес около 50 кг. Грунт: мелкий гравий и крупные камни. Живой вес 16 718.7 г, численность животных 646 экз. В пробе много губок Demospongiae (общий вес составил 15.4 кг). Губки были промыты на палубе, из части были полностью извлечены мелкие представители ассоциированной фауны. Среди них преобладали мелкие слизистые Polychaeta. Также представлены крупные Polychaeta сем. Polynoidae. Вместе Polychaeta составляют доминирующую по численности группу (163 экз.). По биомассе (630 г) эта группа занимает в пробе второе место по значимости (после Demospongiae). Из мелких форм в улове многочисленны Ophiuroidea (120 экз., 139.1 г). Много бесстебельчатых Crinoidea (более 60 экз., по биомассе они на 3 месте), мелких Amphipoda (126 экз.). Присутствовало более двух десятков крупных Pycnogonida, гидроидные кораллы (Stylasteridae), несколько мертвых Scleractinia. В целом, сообщество напоминает пробу со ст. 6599 (см. выше), где структурообразующей группой являются губки Demospongiae.
Станция 6683. Северная часть бассейна Пауэлла, подводное поднятие на хребте Филип, глубина 1299–1306 м. Трал пришел полностью промытым. Грунт: один большой камень, несколько мелких и около трех литров гравия. Живой вес улова 1709.3 г, численность 1286 экз. Фауна богатая. По численности доминируют мелкие и разнообразные Amphipoda (335 экз.), Ophiuroidea (191 экз.), Pycnogonida (165 экз.) и Isopoda Munnopsidae (около 100 экз.). Довольно много Polychaeta (в том числе крупные Maldanidae и симбионты кораллов) (более 100 экз.). В биомассу основной вклад вносят голотурии Peniagone sp. (566.7 г, 60 экз.), и довольно крупные Actiniaria 4–5 видов (474.2 г, 10 экз.). Присутствуют креветки Nematocarcinus lanceopes и Octocorallia сем. Primnoidae. В целом, проба напоминает ст. 6651, но в отличие от нее полностью отсутствуют Crinoidea.
Станция 6689. Подводная возвышенность на хребте Филип, глубина 1470–1473м. Трал пришел почти промытым, вес улова около 80 кг. Внутренний мешок был порван в кутовой части. Грунт: гравий, отдельные камни (размером до 30 см), заиленный песок (менее 30%). Животные пришли в сильно поврежденном состоянии. Живой вес улова составил 236.9 г, численность 382 экз. Основные группы по численности: Amphipoda (102 экз.), Ophiuroidea (90 экз.), Pycnogonida (64 экз.) и Polychaeta (63 экз.). По весу преобладают Echinoidea (в основном фрагментированные), Ophiuroidea, Polychaeta и Holothuroidea (87.5, 40.1, 32.1 и 26 г соответственно). В целом, проба похожа на ст. 6651, но практически отсутствуют Crinoidea.
Станция 6691. Южная часть моря Скотия, бассейн Протектор, глубина 3756–3771 м. Трал пришел частично промытым. Грунт: заиленный песок с большим количеством фораминифер, крупные камни ледового разноса (масса около 150 кг). На некоторых камнях есть эпифауна. Общий вес улова 4428.1 г, численность 1261 экз. По численности в пробе преобладают Ophiuroidea (646 экз.), Holothuroidea (174 экз.). Довольно много морских звезд сем. Porcellanasteridae (68 экз.), Echinoidea (61 экз.) и Polychaeta (56 экз.). В биомассу основной вклад вносят Holothuroidea (1509.4 г), Ophiuroidea (747 г), крупные Actiniaria (664.4 г), морские ежи сем. Cidaridae (571.2 г) и Asteroidea (442.6 г). Довольно много Isopoda семейств Serolidae и Munnopsidae. В улове присутствуют бичевидные Octocorallia.
Таксономическая структура сообществ и ее связь с факторами среды
Многомерный анализ сходства станций по таксономической структуре позволил выделить две группы станций (SIMPROF test < 0.05) (рис. 4). Первую из них составляют станции 6599 и 6658, на которых отмечено доминирование губок Demospongiae (85 и 66% соответственно) (рис. 3). Cтанции расположены на склоне Антарктического полуострова и вершине подводного поднятия в западной части хребта Филип (глубины 544–773 м), для них характерны самые высокие (55.6 и 38.3 см/с) скорости течений и наличие твердого субстрата.
Вторая группа станций (станции 6651, 6683 и 6689) характеризуется более выравненной таксономической структурой, без выраженного доминирования одного таксона и с примерно равным вкладом (5–20%) пяти основных групп – Holothuroidea, Echinoidea, Amphipoda, Decapoda и Polychaeta (рис. 4). Эти станции характеризуют склоновую часть подводных поднятий бассейна Пауэлла и Антарктического полуострова и расположены на смешанных грунтах в диапазоне глубин 1000–1500 м при средних скоростях течений (8.9–26.9 см/с).
Для остальных станций характерно доминирование разных таксонов (рис. 3). Мелководная станция 6615 (средняя глубина 373 м), расположенная на шельфе Южных Оркнейских островов на илистых грунтах, наиболее сильно отличается от остальных по таксономической структуре. Помимо доминирования инфауны – Polychaeta (50%) и Bivalvia (10%) – эта станция характеризуется полным отсутствием эпифауны (рис. 3).
Дополнительную информацию о связи наблюдаемой таксономической структуры сообществ с факторами среды можно получить, рассмотрев результаты канонического анализа соответствий (ССА) (рис. 5). Анализ ординации станций с факторами среды показал, что все учтенные нами факторы изменяются параллельно первой оси (CCA1). Первая ось объясняет 76.9% вариаций таксономической структуры сообществ (eigenvalue = 0.5605, p = 0.032), параллельно ей происходит уменьшение глубины (k = –0.725), увеличение скорости течения (k = 0.918) и увеличение доли крупной фракции грунта (k = 0.773). Самое правое положение станций 6599 и 6658 соответствует результатам, полученным при классификации (рис. 4), и связано с высокими скоростями течений и валунным грунтом. С таксономической точки зрения положение этих станций определяется присутствием в первую очередь Demospongiae, Hydrozoa, Bryozoa, Crinoidea. Основная (центральная) группа станций (6619, 6651, 6653, 6683, 6689) при средних значениях скоростей течений и на смешанных грунтах обуславливается присутствием разнообразной фауны, из которой наибольшее значение имеют Actiniaria, Ophiuroidea, Holothuroidea, Echinoidea. Станции 6604 и 6656, занимающие крайнее левое положение, характеризуются наибольшими глубинами, их своеобразие связано с присутствием Amphipoda и Isopoda.
Рис. 5.
Ординация траловых станций, выполненная методом канонического анализа соответствий (CCA – Canonical Correspondence Analysis), отражающая распределение станций и основных таксонов, а также их связь с абиотическими факторами: глубина (м), максимальная скорость течений (см/с) и тип грунта.

Вторая ось (CCA2) объясняет всего 22.9% вариаций таксономической структуры, причем связь ее с исследованными факторами слаба, за исключением доли крупной фракции грунта (k = –0.446), и влияние этой оси на изменения таксономической структуры недостоверны (eigenvalue = 0.167, p = 0.545). Фактически мы видим, что в указанном районе не вся изменчивость таксономической структуры связана с учтенными факторами. Особенно это касается станций 6615 и 6656, которые достаточно сильно выделяются из общего паттерна распределения.
Трофические группы макробентоса
Соотношение трофических групп (по показателю RR) в исследованных сообществах бассейна Пауэлла и окружающих его подводных поднятий неоднородно (рис. 6). Две станции (ст. 6599 и 6658) характеризуются безусловным доминированием сестонофагов (87.4 и 74.3% соответственно), представленных, в первую очередь, губками Demospongiae (рис. 3). В уловах с остальных станций доля сестонофагов была значительно ниже и варьировала в пределах 0.5–16.9%. Доля хищников и трупоядных животных была велика на станциях 6615, 6619, 6651 и 6683 и составляла от 38% на станции 6615 до 65.8% на станции 6619, где представители этой трофической группы однозначно доминировали (рис. 6). Детритофаги доминировали только на станции 6656, где их доля составила 64.2%. В сообществах, обнаруженных на остальных станциях, доля детритофагов не превышала 33%. Соотношение представителей трофических групп в уловах со станций 6604 и 6689 не удалось четко установить из-за высокой доли таксонов со смешанным или невыясненным типом питания (59.7 и 67.7% соответственно). С уверенностью можно только отметить, что среди этих таксонов практически отсутствуют группы, способные к сестонофагии.
Рис. 6.
Соотношение разных трофических групп макро- и мегабентоса в траловых уловах и максимальные скорости придонных течений на станциях, сделанных в бассейне Пауэлла и окружающих его подводных поднятиях. Номера станций приведены жирным шрифтом, скорости течений (в см/с) указаны в скобках. 1 – животные со смешанным или не определенным типом питания, 2 – хищники/трупоядные, 3 – детритофаги, 4 – сестонофаги.
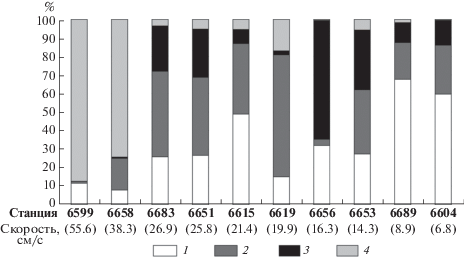
Среди всех факторов среды, рассмотренных в настоящей работе, влияние на соотношение трофических групп в макро- и мегабентосных сообществах удалось показать только для скоростей придонных течений и типа грунта. Обе станции, сделанные на твердых грунтах (ст. 6591 и 6658), отличаются от остальных преобладанием сестонофагов. Различий по соотношению разных трофических групп между станциями, сделанными на смешанных и рыхлых грунтах, выявить не удалось.
Станции с наиболее высокими максимальными значениями скоростей течений (ст. 6599, 55.6 см/с и ст. 6658, 38.3 см/с) характеризуются явным преобладанием сестонофагов (рис. 6). Оставшиеся восемь станций характеризуются значительно менее активным придонным гидродинамическим режимом и значительно меньшей долей сестонофагов в сообществах. Четыре станции с несколько более высокими скоростями придонных течений (максимальные значения в диапазоне 26.9–19.9 см/с) характеризовались большей долей хищников и трупоядных (38–65.8%). На оставшихся четырех станциях с наиболее слабыми течениями (максимальные значения до 16.3 см/с) хищники и трупоядные составляли не более 34.7%, а детритофаги до 64.2%. Существенность различий между этими двумя группами станций нуждается в проверке из-за высокой доли животных с невыясненным и смешанным типом питания на станциях 6615, 6689 и 6604.
ОБСУЖДЕНИЕ
Высокое таксономическое разнообразие и высокая степень эндемизма донной фауны Южного океана приводит к тому, что фаунистические данные, основанные на результатах траловых ловов и драгировок, анализируются исключительно на уровне крупных таксонов [48, 28, 40, 18 ]. Таким образом, полученные нами в 79-м рейсе НИС “Академик Мстислав Келдыш” предварительные данные по траловым сборам могут быть сопоставимы с предыдущими исследованиями и являются важным вкладом в изучение донных сообществ региона.
Эти данные свидетельствуют (рис. 4) о значительном разнообразии донных сообществ в исследованной части бассейна Пауэлла и на окружающих его поднятиях. Только половина из 10 траловых станций, включенных в анализ, образуют достоверные группы: группа станций с доминированием губок (ст. 6599 и 6658) и группа станций с преобладанием голотурий, морских ежей, амфипод, декапод и полихет (ст. 6651, 6683 и 6689). Оставшиеся пять станций значительно отличаются друг от друга по таксономическому составу и не образуют достоверных групп.
Некоторые выделенные нами группы донных сообществ в западной части района бассейна Пауэлла (рис. 4) обнаруживают сходство с определенными сообществами восточной части района, изученными экспедицией SO-AntEco в 2016 г. [19]. Это исследование основано на значительно большем числе траловых станций, но при этом более ограничено географически (край Южно-Оркнейского плато) и по глубинам (до 2000 м). Единственная выполненная в этом районе наша станция 6615 (на плато, к югу от Южных Оркнейских островов) резко отличается по составу макротаксонов от всех более глубоководных станций. По значительному преобладанию полихет это сообщество похоже на сообщество на северо-западном и северном Южно-Оркнейском шельфе на глубинах 500–750 м [18]. Сообщества с доминированием губок на вершинах подводных поднятий на северо-западной границе бассейна Пауэлла, существующие на твердых грунтах в условиях сильных придонных течений, похожи на сообщества с доминированием Demospongiae, широко представленные на кромке шельфа – в верхней части склона Южно-Оркнейского плато (500–1000 м, кроме западной части). Там среди донных субстратов также преобладают гравий, скальные выходы и валуны [18]. Сообщества верхней части склона (1000–1500 м) Антарктического полуострова и хребта Филип, существующие в условиях умеренных и слабых придонных течений на смешанных грунтах, характеризуются высоким таксономическим разнообразием, но по биомассе в них преобладают иглокожие, а значительную долю составляют креветки Nematocarcinus lanceopes. Похожие сообщества на преимущественно рыхлых грунтах с доминированием иглокожих и заметным присутствием крупных ракообразных (креветок, мизид, амфипод, изопод) отмечены на разных участках Южно-Оркнейского плато на глубинах 750–1000 м [18]. Более глубоководные сообщества нижней части склона и абиссальной котловины бассейна Пауэлла не схожи друг с другом и не находят аналогов среди охарактеризованных выше сообществ Южно-Оркнейского плато, которые описаны на меньших глубинах.
Значительное разнообразие донных сообществ уже было показано для Антарктического полуострова и смежных регионов, в том числе на уровне макротаксонов и в сравнительно небольших (десятки километров) пространственных масштабах [34, 40]. Одной из причин такого разнообразия, вероятно, является одновременное воздействие большого числа факторов, способных влиять на состав и структуру исследуемых сообществ: первичной продукции поверхностных вод, ледового режима, воздействия айсбергов, глубины, температуры, скорости придонных течений, типа рельефа и грунтов [31, 11, 38, 62, 29, 40 ]. Влияние различных сочетаний этих факторов исследовалось в ранее проведенных работах. Гутт и соавторы [40] выделяют глубину, температуру придонной воды и ледовое покрытие как факторы, лучше всего определяющие различия между сообществами в море Скотия, проливе Брансфилд и бассейне Пауэлла. Влияние особенностей рельефа и типа грунта на таксономический состав сообществ шельфа и склона Южных Оркнейских островов было показано Бразье и соавторами [18]. Роль субстрата в формировании гетерогенности сообществ была показана для донных сообществ о-вов Кинг Джордж (Ватерлоо) и Южных Оркнейских [54, 52, 18 ]. В число основных факторов, формирующих донные сообщества, также включают локальные скорости придонных течений, в свою очередь ответственных за формирование субстрата [28, 40].
Среди рассмотренных в нашей работе факторов среды глубина, скорость придонного течения и доля твердой фракции в грунте лучше всего объясняют различия в таксономической структуре сообществ (рис. 5). Вклад температуры и солености придонной воды оказался незначительным при рассмотрении сообществ на уровне макротаксонов. Вместе с тем, мы не исключаем вклад других, не исследованных нами, факторов.
Разнородность таксономической структуры траловых уловов также может объясняться высокой пространственной гетерогенностью местообитаний и, следовательно, наличием представителей нескольких локальных сообществ в одной пробе. Высокая степень мозаичности антарктических сообществ была показана и ранее [41]. Одним из факторов, обеспечивающих такую микромасштабную гетерогенность, является неоднородность грунтов [54, 52, 25, 41 ]. В пользу этого предположения могут свидетельствовать наблюдения камней и валунов с обильной эпифауной на фототрансектах, проводимых на мягких грунтах в районе о. Элефант (Мордвинова) [12]. В таких условиях траловые сборы не позволяют выделить выраженные ассоциации, и становится возможным проследить только влияние градиентов факторов, действующих в более крупном масштабе, таких как глубина и скорость течения (рис. 5).
Анализ полученных нами данных по соотношению трофических групп макробентоса и по абиотическим факторам среды позволяет предположить, что в исследованном районе твердые грунты и сильные придонные течения создают благоприятные условия для возникновения сообществ с доминированием сестонофагов, в первую очередь губок Demospongiae. При этом роль течений здесь, вероятно, является определяющей. В пользу этого свидетельствует наличие субстрата, подходящего для прикрепления сидячих сестонофагов, на станциях со смешанными грунтами. При этом придонные течения на этих станциях слабее, а доля сестонофагов не превышает 17% (рис. 6).
Среди факторов, влияющих на состав и структуру донных сообществ Антарктики, придонным течениям обычно уделяется меньше внимания [обзоры: 38, 39], а число работ, где использованы прямые измерения, невелико [15, 47]. Сильные придонные течения обеспечивают ресуспензию и горизонтальный перенос взвешенного органического вещества, тем самым обеспечивая пищей сестонофагов и уменьшая количество пищи, доступной детритофагам [11, 38, 39]. В своей работе Гутт и Старманс [43] связывают доминирующую роль сестонофагов (в первую очередь, губок) в сообществах шельфа и верхнего склона восточной части моря Уэдделла с влиянием краевого течения. Также в восточной части моря Уэдделла было проведено сравнение двух районов, отличающихся по силе приливных течений [47]. В районе с максимальными скоростями около 23 см/с было обнаружено сообщество с высоким таксономическим богатством и доминированием сестонофагов, в то время как в районе с более слабыми течениями (не выше 14 см/с) сообщество характеризовалось меньшим видовым разнообразием и большей долей детритофагов [39]. Течения, вероятно, могут влиять не только на преобладающие в сообществах трофические стратегии, но и на видовое богатство – по крайней мере, в рамках отдельных таксономических групп. Для шельфа о. Кинг Джордж (Ватерлоо) (Южные Шетландские острова) было показано, что сообщества, находящиеся под влиянием сильных приливных течений (до 250 см/с) характеризуются большим числом видов Amphipoda, чем сообщества бухты Максвелл с более спокойными водами [11, 53].
Одна из важнейших задач 79-го рейса НИС “Академик Мстислав Келдыш” состояла в документации индикаторов уязвимых морских экосистем (УМЭ) в исследованном районе. Ранее на части Южно-Оркнейского плато был создан первый в Антарктике охраняемый природный район [22, 58], а в море Скотия и в районе Антарктического полуострова выделен ряд участков, отвечающих критериям УМЭ ФАО [8, 23]. В ходе 79-го рейса НИС “Академик Мстислав Келдыш” нами отмечено значительное число видов-индикаторов УМЭ на шельфе и в верхней части склона подводных поднятий, окружающих бассейн Пауэлла. Эти районы находятся в зоне сильных приливных течений и характеризуются наличием обильной эпифауны. Наиболее ярко такие сообщества представлены в западной части исследованного района на глубинах менее 1000 м (станции 6597, 6599, 6658). Таксоны-индикаторы представлены, главным образом, губками Demospongiae и глубоководными кораллами Stylasteridae (Hydrozoa) и Primnoidae (Octocorallia).
ЗАКЛЮЧЕНИЕ
В ходе 79-го рейса НИС “Академик Мстислав Келдыш” в Атлантическом секторе Южного Океана была собрана репрезентативная коллекция донной фауны на глубинах 370–3771 м. Данные траловых уловов, проанализированные на уровне макротаксонов, показывают высокое разнообразие сообществ бассейна Пауэлла и окружающих его подводных поднятий. Изменение таксономической структуры сообществ в основном было связано с глубиной, скоростями придонных течений и типом грунта. Тем не менее, во всем исследуемом регионе наблюдалась высокая вариабельность сообществ. Наиболее четко выделялось сообщество с доминированием губок Demospongiae, приуроченное к склону Антарктического полуострова и вершине подводного поднятия в западной части хребта Филип, на которых были зарегистрированы высокие скорости течений. Выявление организмов-индикаторов УМЭ свидетельствует о необходимости дальнейшего детального исследования данного района. Для выявления более четкой картины распределения донных сообществ требуется более детальный таксономический анализ (определение, по крайней мере, ключевых таксонов до родового или видового уровня) и расширение спектра анализируемых параметров среды.
Благодарности. Авторы выражают признательность капитану и экипажу 79-го рейса НИС “Академик Мстислав Келдыш” за высокопрофессиональную работу. Благодарим И.О. Букина и А.М. Колтунова (ННЦМБ ДВО РАН) за участие в палубных работах, А.К. Залоту, А.Б. Басина, Н.В. Гордееву, С.Г. Кобылянского (ИО РАН), П.А. Киреева, А.Е. Власенко, Г.В. Малыкина (ННЦМБ ДВО РАН) за помощь при сборе и первичной обработке материала, А.А. Полухина (ИО РАН) за предоставление гидрохимических данных.
Источник финансирования. Работа выполнена в рамках тем государственного задания №№ 0128-2019-0008 (ИО РАН) и 0208-2019-0013 (ННЦМБ ДВО РАН).
Список литературы
Алимов А.Ф. Интенсивность обмена у водных пойкилотермных животных. Общие основы изучения водных экосистем. 1979. Л.: Наука. С. 5–20.
Кучерук Н.В., Савилова Т.А. Количественная и экологическая характеристика донной фауны шельфа и верхнего склона района Североперуанского апвеллинга. // Бюлл. МОИП, отд. биол. 1985. Т. 89. Вып. 4. С. 59–70.
Морозов Е.Г., Спиридонов В.А., Молодцова Т.Н., Фрей Д.И., Демидова Т.А., Флинт М.В. Исследования экосистемы Атлантического сектора Антарктики (79-й рейс научно-исследовательского судна “Академик Мстислав Келдыш”) // Океанология. 2020. Т. 60. № 4. С. 823–825.
Сиренко Б.И. Основные отличия макробентоса и донных сообществ Арктики и Антарктики на примере сравнения фаун морей Лаптевых и Уэдделла // Биол. моря. 2009. Т. 35. С. 393–400.
Сиренко Б.И., Гагаев С.Ю., Смирнов И.С. Сравнение мелководных донных сообществ морей Росса, Дейвиса, Космонавтов и Содружества по доминирующим видам антарктических беспозвоночных животных // Тр. БГУ. 2014. Т. 9. Ч. 2. С. 39–48.
Сиренко Б.И., Смирнов И.С., Неелов А.В. К вопросу о видовом богатстве и происхождении фауны антарктических морей // Чтения памяти академика Олега Григорьевича Кусакина. Сборник статей. Владивосток: Дальнаука. 2008. Вып. 1. С. 202–213.
Соколова М.Н. Питание и трофическая структура глубоководного макробентоса. М.: Наука, 1986. 208 с.
Спиридонов В.А., Винников А.В., Голенкевич А.А., Майсс А.А. “Уязвимые морские экосистемы” и близкие понятия в практике управления морским природопользованием: концепции, терминология и возможности приложения к сохранению морской среды и биологических ресурсов // Тр. ВНИРО. 2018. Т. 174. С. 143–173.
Турпаева Е.П. Питание и пищевые группировки морских донных беспозвоночных // Тр. ИО АН СССР. 1953. № 7. С. 259–299.
Aronson R.B., Thatje S., Clarke A., Peck L.S., Blake D.B., Wulga C.D., Siebels B.A. Climate Change and invasibility of the Antarctic benthos // Annu. Rev. Ecol. Evol. Syst. 2007. V. 38. P. 129–154.
Arntz W.E., Brey T., Gallardo V.A. Antarctic zoobenthos // Oceanogr. Mar. Biol. 1994. V. 32. P. 241–304.
Auscavitch S. R., Waller R. G. Biogeographical patterns among deep sea megabenthic communities across the Drake Passage // Antarct. Sci. 2017. V. 29. № 6. P. 531–543.
Azovsky A.I., Chertoprood E.S., Saburova M.A., Polikarpov I.G. Spatio-temporal variability of micro- and meiobenthic communities in a White Sea intertidal sandflat // Estuar. Coast. Shelf Sci. 2004. V. 60. P. 663–671.
Barnes D.K. Changing chain: past, present and future of the Scotia Arc’s and Antarctica’s shallow water benthic communities // Sci. Mar. 2005. V. 69. Suppl. 2. P. 65–89.
Barry J.P., Dayton P.K. Current patterns in McMurdo Sound, Antarctica and their relationship to local biotic communities // Polar Biol. 1988. № 8(5). P. 367–376.
Boyer T.P., Baranova O.K., Coleman C., Garcia H.E., Grodsky A., Locarnini R.A., Mishonov A.V., O’Brien T.D., Paver C.R., Reagan J.R., Seidov D., Smolyar I.V., Weathers K., Zweng M.M. World Ocean Database 2018. https://www.nodc.noaa.gov/OC5/WOD/pr_wod.html.
Brandt A., Brix S., Brökeland W., Choudhury M., Kaiser S., Malyutina M. Deep-sea isopod biodiversity, abundance, and endemism in the Atlantic sector of the Southern Ocean—Results from the ANDEEP I–III expeditions // Deep Sea Res., Pt. II. 2007. V. 54. № 16–17. P. 1760–1775. https://doi.org/10.1016/j.dsr2.2007.07.015
Brasier M.J., Grant S.M., Trathan P.N., Allcock L., Ashford O., Blagbrough H, Brandt A., Danis B., Downey R., Eléaume M.P., Enderlein P., Ghiglione C., Hogg O., Linse K., Mackenzie M., Moreau C., Robinson L.F., Rodriguez E., Spiridonov V., Tate A., Taylor M., Waller C., Wiklund H., Griffiths H.J. Benthic biodiversity in the South Orkney Islands Southern Shelf Marine Protected Area // Biodiversity. 2018. V. 19(1–2). P. 5–19. https://doi.org/10.1080/14888386.2018.1468821
Brey T., Gerdes D. High Antarctic macrobenthic community production // J. Exp. Mar. Biol. Ecol. 1998. V. 231. P. 191–200.
Clarke A. Antarctic marine benthic diversity: patterns and processes // J. Exp. Mar. Biol. Ecol. 2008. V. 366. P. 48–55. https://doi.org/10.1016/j.jembe.2008.07.008
Clarke K.R., Warwick R.M. Change in Marine Communities: An Approach to Statistical Analysis and Interpretation. 2nd ed. Plymouth. UK: PRIMER-E, 2001. 172 p.
CCAMLR (Commission for Conservation of Antarctic Marine Living Resources). Protection of the South Orkney Islands southern shelf. Conservation Measure 91-03. 2009. 2 p.
CCAMLR (Commission for Conservation of Antarctic Marine Living Resources). Vulnerable Marine Ecosystems. https://www.ccamlr.org/en/compliance/vulnerable-marine-ecosystems-vmes.
Coren F., Ceccone G., Lodolo E., Zanolla C., Zitelini N., Bonazzi C., Centonze J. Morphology, seismic structure and tectonic development of the Powell Basin, Antarctica // J. Geol. Soc. London. 1997. V. 154. P. 849–862.
Cummings V., Thrush S., Norkko A., Andrew N., Hewitt J., Funnell G., Schwarz A. M. Accounting for local scale variability in benthos: implications for future assessments of latitudinal trends in the coastal Ross Sea // Antarctic Science. 2006. V. 18(04). P. 633–644. https://doi.org/10.1017/S0954102006000666
Cutler E.B. The Sipuncula: their systematics, biology, and evolution. New York: Cornell University Press, 1994. 453 p.
Dayton P.K, Robilliard G.A., Paine R.T. Benthic fauna zonation as a result of anchor ice at McMurdo Sound, Antarctica / Holdgate M.V. (ed.) // Antarctic Ecology. London: Academic Press, 1970. V. 1. P. 244–255.
Dorschel B., Gutt J., Piepenburg D., Schröder M., Arndt J.E. The influence of the geomorphological and sedimentological settings on the distribution of epibenthic assemblages on a flat topped hill on the over-deepened shelf of the western Weddell Sea (Southern Ocean) // Biogeosciences. 2014. V. 11. P. 3797–3817. https://doi.org/10.5194/bg-11-3797-2014
Dorschel B., Gutt J., Huhn O., Bracher A., Huntemann M., Huneke W., Gebhardt C., Schröder, Herr H. Environmental information for a marine ecosystem research approach for the northern Antarctic Peninsula (RV Polarstern expedition PS81, ANT-XXIX/3) // Polar Biol. 2015. V. 39. P. 765–787. https://doi.org/10.1007/s00300-015-1861-2
Egbert G.D., Erofeeva S.Y. Efficient inverse modeling of barotropic ocean tides // J. Atmos. Ocean. Technol. 2002. V. 19(2). P. 183—204.
Gerdes D., Klages M., Arntz W.E., Herman R.L., Galéron J., Hain S. Quantitative investigations on macrobenthos communities of the southeastern Weddell Sea shelf based on multi box corer samples // Polar Biol. 1992. V. 12. P. 291–301.
Gili H-M., Coma R., Orejas C., López-González P.J., Zabala M. Are Antarctic suspension-feeding communities different from elsewhere in the world / Arntz W.E., Clarke A. (eds) // Ecological Studies of the Antarctic Sea Ice Zone. Results of the EASIZ Midterm Symposium. Berlin, Heidelberg: Springer Verlag, 2002. P. 104–116.
Gray J.S. Antarctic marine benthic biodiversity in a world-wide latitudinal context / Arntz W.E., Clarke A. (eds) // Ecological Studies of the Antarctic Sea Ice Zone. Results of the EASIZ Midterm Symposium. Berlin, Heidelberg: Springer Verlag, 2002. P. 1–9.
Griffiths H.J., Linse K., Barnes D.K. Distribution of macrobenthic taxa across the Scotia Arc, Southern Ocean // Antarct. Sci. 2008. V. 20. P. 213–226. https://doi.org/10.1017/S0954102008001168
Griffiths H.J., Meijers A.J.S., Bracegirdle T.J. More losers than winners in a century of future Southern Ocean seafloor warming // Nat. Clim. Change. 2017. https://doi.org/10.1038/NCLIMATE3377
Griffiths H.J., Waller C.L. The first comprehensive description of the biodiversity and biogeography of Antarctic and Sub-Antarctic intertidal communities // J. Biogeogr. 2016. V. 43. P. 1143–1155. https://doi.org/10.1111/jbi.12708
Gruzov E.N. Seasonal alterations in coastal communities in the Davis Sea / Llano G.A. (ed.) // Adaptations within Antarctic Ecosystems. Proc. of the Third SCAR symposium on Antarctic Biology. Washington, D.C.: Smithsonian Institution, 1977. P. 263–278.
Gutt J. Some “driving forces” structuring communities of the sublittoral Antarctic macrobenthos // Antarct. Sci. 2000. V. 12(3). P. 297–313.
Gutt J. Antarctic macro-zoobenthic communities: A review and an ecological classification // Antarct. Sci. 2007. V. 19(2). P. 165–182.
Gutt J., Alvaro M.C., Barco A., Böhmer A., Bracher A., David B., De Ridder C., Dorschel B., Eléaume M., Janussen D., Kersken D., López-González P.J., Martínez-Baraldés I., Schröder M., Segelken-Voigt A., Teixidó N. Macroepibenthic communities at the tip of the Antarctic Peninsula, an ecological survey at different spatial scales // Polar Biol. 2016. V. 39. P. 829–849. https://doi.org/10.1007/s00300-015-1797-6
Gutt J., Arndt J., Kraan C., Dorschel B., Schröder M., Bracher A., Piepenburg D., 2019. Benthic communities and their drivers: A spatial analysis off the Antarctic Peninsula // Limnol. Oceanogr. 2019. V. 64(6). P. 2341– 2357. https://doi.org/10.1002/lno.11187
Gutt J., Bertler N., Bracegirdle T.S., Buschmann A., Comiso J., Hosie G., Isla E., Schloss I.R., Smith C.R., Tournadre J., Xavier J.C. The Southern Ocean ecosystem under multiple climate change stresses – an integrated circumpolar assessment // Glob. Change Biol. 2015. V. 21. P. 1434–1453. https://doi.org/10.1111/gcb.12794
Gutt J., Starmans A. Structure and biodiversity of megabenthos in the Weddell and Lazarev Seas (Antarctica): ecological role of physical parameters and biological interactions // Polar Biol. 1998. V. 20. P. 229–247.
Gutt J., Starmans A. Quantification of iceberg impact and benthic recolonisation patterns in the Weddell Sea (Antarctica) / Arntz W.E., Clarke A. (eds.) // Ecological Studies of the Antarctic Sea Ice Zone. Results of the EASIZ Midterm Symposium. Berlin, Heidelberg: Springer Verlag, 2002. P. 210–214.
Hammer Ø. PAST: PAleontological STatistics software package, v3. 06. 2015.
Echinoderm Nutrion / Jangoux M., Lawrence J.M. (eds.). Rotterdam: A.A. Balkema, 1982. P. 1–654.
Lavaleye M., Thatje S., Duineveld G., Arntz W.E. Pelagic larvae and juveniles of benthic invertebrates in the near-bottom environment // Ber. Polarforsch. 2005. V. 503. P. 31–35.
Linse K., Brandt A., Bohn J.M., Danis B., De Broyer C., Ebbe B., Heterier V., Janussen D., Lo’pez Gonza’lez P.J., Schuller M., Schwabe E., Thomson M.R.A., 2007. Macro- and megabenthic assemblages in the bathyal and abyssal Weddell Sea (Southern Ocean) // Deep Sea Res., Pt. II. 2007. V. 54. P. 1848–1863. https://doi.org/10.1016/j.dsr2.2007.07.011
Massom R.A., Stammerjohn S.E. Antarctic sea ice change and variability – Physical and ecological implications // Polar Sci. 2010. V. 4. P. 149–186.
McCune B., Grace J.B., Urban D.L. Analysis of ecological communities. Gleneden Beach, OR: MjM software design, 2002. V. 28.
NASA (National Aeronautics and Space Agency). Earth observatory. World of Change. Antarctic Sea Ice. https://earthobservatory.nasa.gov/world-of-change/ sea-ice-antarctic.
Quartino M., Kloèser H., Schloss I., Wiencke C. Biomass and associations of benthic marine macroalgae from the inner Potter Cove (King George Island, Antarctica) related to depth and substrate // Polar B-iol. 2001. V. 24(5). P. 349–355. https://doi.org/10.1007/s003000000218
Rauschert M. 1991. Ergebnisse der faunistischen Arbeiten im Benthal von King George Island (Sildshetlandinseln, Antarktis) // Ber. Polarforsch. 1991. V. 76. P. 1–75.
Richardson, M.G. The Distribution of Antarctic Marine Macroalgae Related to Depth and Substrate // Brit. Antarct. Surv. B. 1979. V. 49. P. 1–13.
Saiz-Salinas J.I., Ramos A., Munilla T., Rauschert M. Changes in the biomass and dominant feeding mode of benthic assemblages with depth off Livingston Island (Antarctica) // Polar Biol. 1998. V. 19. P. 424–428.
Sisínski J., Paris K., Jażdżewski K., Konopacka A., Błażewicz-Paszkowycz M. Macrozoobenthos of two Antarctic glacial coves: a comparison with non-disturbed bottom areas // Polar Biol. 2012. V. 35. P. 355–367.
The Natural History of the Crustacea: Vol. 2. Lifestyles and Feeding Biology / Thiel M., Watling L. (eds.). Oxford, New York: Oxford University Press, 2015. 567 p.
Trathan P.N. Grant S.M. The South Orkney Islands Southern Shelf Marine Protected Area: towards the establishment of marine spatial protection within international waters in the Southern Ocean // Marine Protected Areas. Science, Policy and Management. Elsevier, 2020. P. 67–95. https://doi.org/10.1016/B978-0-08-102698-4.00004-6
Visbeck M. Deep velocity profiling using Lowered Acoustic Doppler Current Profiler: bottom track and inverse solution // J. Atmos. Ocean. Technol. 2002. V. 19(5). P. 794—807.
Voss J. Zoogeography and community analysis of macrobenthos of the Weddell Sea (Antarctica) // Ber. Polarforsch. 1988. V. 45. P. 1–145.
Wägele J.W. The feeding mechanism of Antarcturus and a redescription of A. spinacoronatus Schultz, 1978 (Crustacea: Isopoda: Valvifera) // Philos. Trans. R. Soc. 1987. V. B316. P. 429–458.
Waller R.G., Scanlon K.M., Robinson L.F. Cold-water coral distributions in the Drake Passage area from towed camera observations – initial interpretations // PLoS ONE. 2011. V. 6(1). P. e16153. https://doi.org/10.1371/journal.pone.0016153
Дополнительные материалы отсутствуют.