Океанология, 2022, T. 62, № 1, стр. 85-97
Мезопелагический микронектон и макропланктон и условия его обитания в северо-восточной Пацифике
А. С. Курносова 1, *, А. А. Сомов 1, А. Н. Канзепарова 1, М. А. Зуев 1, С. Ю. Орлова 2, 3, Д. С. Курносов 1, А. М. Орлов 2, 3, 4, 5, 6, 7
1 Тихоокеанский филиал ФГБНУ “ВНИРО” (ТИНРО)
Владивосток, Россия
2 Институт океанологии им. П.П. Ширшова РАН
г. Москва, Россия
3 Всероссийский научно-исследовательский институт рыбного хозяйства и океанографии
Москва, Россия
4 Институт проблем экологии и эволюции им. А.Н. Северцова РАН
Москва, Россия
5 Национальный исследовательский Томский государственный университет
Томск, Россия
6 Дагестанский государственный университет
Махачкала, Россия
7 Прикаспийский институт биологических ресурсов ДНЦ РАН
Махачкала, Россия
* E-mail: anna.vazhova@gmail.com
Поступила в редакцию 02.02.2021
После доработки 10.03.2021
Принята к публикации 08.04.2021
- EDN: FDRYLC
- DOI: 10.31857/S0030157422010075
Аннотация
Проанализированы различия вертикальной структуры вод и гидрохимических параметров на трех океанических станциях в северо-восточной части Тихого океана. Представлены данные по видовому составу мезопелагических рыб, кальмаров и желетелых организамов, совершающих суточные вертикальные миграции в эпипелагиаль. Проанализированы различия в их соотношении и размерном составе на разных станциях. Соотношение видов, размеры и общая биомасса микронектона и макропланктона претерпевали изменения в юго-западном направлении, что связано, прежде всего, с изменчивостью океанологических характеристик подповерхностного слоя.
ВВЕДЕНИЕ
В открытом океане вертикальные и горизонтальные градиенты температуры, солености, освещенности, давления и гидрохимических характеристик обуславливают своеобразие жизни на разных глубинах [14]. Одной из самых населенных и богатых в видовом отношении зон Мирового океана является мезопелагиаль; мезопелагические микронектон и макропланктон (рыбы, кальмары, желетелые и др.) распространены повсеместно на глубинах свыше 200 м от Шпицбергена и северной части Берингова моря до шельфовых ледников Антарктиды [10, 14]. Фауна мезопелагиали крайне богата в видовом отношении [2, 18, 20, 23]. Только в субарктической части Тихого океана насчитывается около 200 видов мезопелагических рыб [19], при этом светящихся анчоусов (сем. Myctophidae) в Тихом океане насчитывается более 50 видов [14].
Отличительной особенностью многих мезопелагических видов являются вертикальные суточные миграции из мезопелагиали в эпипелагиаль [9], что обеспечивает, таким образом, связь между мезо- и эпипелагиалью за счет переноса вещества и энергии [9, 17, 19, 25, 34, 36, 37, 39, 40].
По оценкам многих авторов, ресурсы мезопелагиали в Мировом океане (без учета кальмаров) огромны и могут достигать 1 млрд т, а в Тихом океане оцеиваются величиной, превышающей 300 млн т [7, 23, 24, 27]. С учетом последних акустических исследований эта цифра может быть еще выше, так как недоучет обилия траловым методом может достигать двух порядков [26]. В настоящее время ресурсы мезопелагиали рассматриваются как перспективные для промысла в качестве источника кормов для аквакультуры [32].
Несмотря на высокий интерес к мезопелагическим микронектону и макропланктону и большой объем проведенных исследований, виды этой группы до сих пор являются малоизученными. Особенности пространственного распределения, биологии, состояния запасов, видовой структуры и приуроченности к определенным водным массам фауны мезопелагиали остаются по большей части неясными [2, 20, 25, 35, 36]. Oсобенно это характерно для открытых океанических вод восточной части Тихого океана, где исследования проводятся крайне редко и нерегулярно.
Цель данного исследования – получение новых данных о составе, соотношении видов, размерах и биомассе мезопелагического микронектона и макропланктона в открытых водах северо-восточной Пацифики в связи с условиями их обитания.
МАТЕРИАЛЫ И МЕТОДЫ
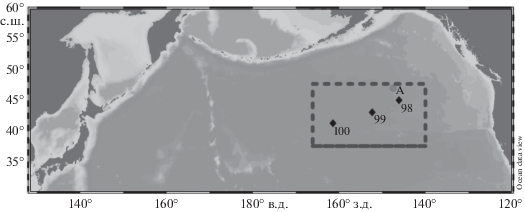
Настоящее сообщение основано на результатах исследований, проведенных в марте 2019 г. в открытых водах северо-восточной части Тихого океана (СВТО) на НИС “Профессор Кагановский” (рис. 1). Работы проводили во время перехода из п. Ванкувер (Канада) в район возвышенностей Императорского хребта [13].
Рис. 1.
Схема станций в открытых водах СВТО (цифры – номера комплексных станций, А – океанологическая станция для сравнения гидрологических параметров).
Сбор гидрологической информации осуществлялся с помощью гидрологического комплекса Sea Bird Electronics model 25 (SBE 25) до глубины 500 м с отбором проб на стандартных горизонтах для определения количества растворенного кислорода, силикатов, минеральных форм фосфора и азота. Гидрохимические измерения проводились по стандартным методикам, рекомендованным для исследований рыбохозяйственных водоемов и перспективных для промысла районов Мирового океана [12]. Для обработки данных использовалось стандартное программное обеспечение для SBE 25 и Ocean Data View V.4.7.1. Для построения геострофической карты в северо-восточной части Тихого океана в период исследований были использованы данные анализа спутниковой информации OSCAR (https://podaac.jpl.nasa.gov/dataset/OSCAR_L4_OC_third-deg) и программное обеспечение Surfer 11 (Golden Software, Inc.).
Также для анализа океанологической ситуации в районе исследований были использованы среднемесячные для марта 2019 г. данные анализа спутниковой информации по физическим параметрам с портала http://marine.copernicus.eu. Для сравнения вертикальной структуры вод использовали данные зондирования на станциях 99 и 100. Поскольку зондирование на станции 98 по техническим причинам не проводилось, вертикальное распределение температуры и солености на станции 98 получено с помощью данных анализа спутниковой информации по физическим параметрам воды (GLOBAL_ANALYSIS_FORECAST_PHY_001_024). Для того, чтобы воспользоваться модельными данными для вертикальной структуры на станции 98, было проведено сравнение инструментальных и модельных данных по температуре и солености для станций 99, 100 и А.
Данные ихтиологических исследований основаны на результатах часовых тралений, которые выполнялись разноглубинным тралом РТ 80/396 с мелкоячейной вставкой в кутце (10 мм) последовательно на трех горизонтах 60–90, 30–60 и 0–30 м по 20 мин в каждом горизонте (табл. 1). Каждая станция выполнялась в сумеречное время, когда мезопелагические рыбы и кальмары активно мигрируют в эпипелагиаль.
Таблица 1.
Характеристики станций и тралений в период проведения работ в открытых водах СВТО
| № трала | Дата | Время начало траления | UTC | Время окончания траления | Координаты траления | Скорость, узлы | Курс, градусы | Глубина, м | Поверхностная температура, °С | Вертикальное раскрытие трала, м | Горизонтальное раскрытие трала, м |
|---|---|---|---|---|---|---|---|---|---|---|---|
| 98 | 26.03 | 18:32 (+14) | 04:32 | 19:32 | 45°02.0′ с.ш. 143°18.6′ з.д. | 4.3 | 194 | 4500 | 9.2 | 32.7 | 45.2 |
| 99 | 28.03 | 18:37 (+13) | 05:37 | 19.37 | 43°10.0′ с.ш. 152°24.0′ з.д. |
3.9 | 258 | 5100 | 9.1 | 33.7 | 44.5 |
| 100 | 31.03 | 18:38 (+13) | 05:38 | 19:38 | 41°16.2′ с.ш. 161°20.0′ з.д. |
4.0 | 253 | 5500 | 8.7 | 33.7 | 43.0 |
Всего проанализировано 1700 экз. гидробионтов, в т.ч. выполнен биологический анализ 201 экз. и массовый промер 1499 экз. Для расчета относительной численности/биомассы гидробионтов использовали площадной метод [1], в котором учитываются горизонтальное раскрытие трала, средняя скорость и продолжительность траления, численность/масса объекта в улове, а также коэффициенты уловистости для каждого вида [3].
Для сравнения видового и численного состава кальмаров были использованы материалы базы данных “Морская биология” в соответствии со станциями, расположенными близ района исследования.
РЕЗУЛЬТАТЫ
Гидрологические и гидрохимические исследования
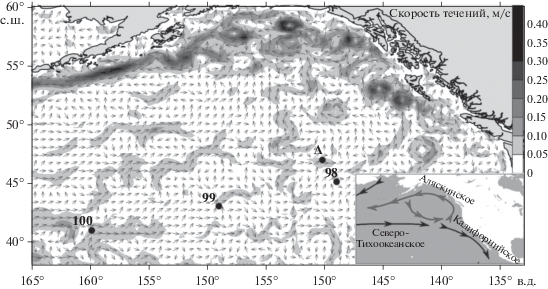
Динамика вод. Исследуемый район расположен в зоне замедляющегося при приближении к североамериканскому континенту Северо-Тихоокеанского (Субарктического) течения (рис. 2). Вследствие замедления в этой зоне можно наблюдать слабые циклонические и антициклонические круговороты. Карта течений (см. рис. 2) в северо-восточной части Тихого океана позволяет идентифицировать элементы поля геострофических течений (вихревые образования) в пределах съемки. Все исследованные станции расположены в областях с низкими скоростями течений. Наибольшие скорости течений (до 0.15 м/с) зафиксированы в районе ст. 100, наименьшие (0.05 м/с) – в зоне ст. 98. На схеме геострофической составляющей течений на поверхности исследуемого района можно отметить, что ст. 99 расположена на границе антициклонического круговорота со скоростями течений в пределах 0.1 м/с.
Рис. 2.
Схема течений в северо-восточной части Тихого океана на 29.03.2019 г., рассчитанная по модели OSCAR.
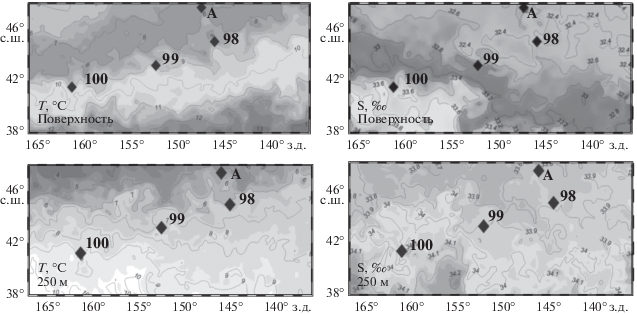
Пространственное распределение гидрологических параметров. Спутниковые данные распределения температуры и солености на поверхности, смоделированные до горизонта 250 м, демонстрируют широкий диапазон термохалинных параметров в исследованном районе (рис. 3). Так значения температуры от поверхности до 100 м варьировали в среднем от 7 до 12°С, значения солености – от 32.5 до 33.5‰, формируя довольно однородный верхний слой. На карте пространственного распределения поверхностной температуры видно, что исследованные станции 98, 99 и 100 были расположены примерно в одном поле температуры 8.7–9.2°С, но соленость в поверхностном слое варьировала от 32.5 до 33.2‰. На станции А, которая выбрана для сравнения как точка с субарктической структурой вод, значения температуры и солености на поверхности составляли 7.5°С и 32.5‰. В подповерхностном слое (250 м) четкие различия наблюдались по температуре (от 6.5 до 8.5°С), но по солености водные массы были практически однородными (33.9–34.1‰) (см. рис. 3).
Рис. 3.
Распределение термохалинных параметров на поверхности (вверху) исследованного района и на горизонте 250 м (внизу).
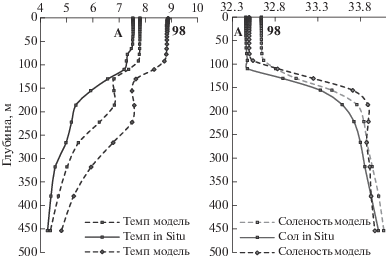
Вертикальное распределение гидрологических параметров. Для того, чтобы воспользоваться модельными данными для вертикальной структуры на станции 98, было проведено сравнение инструментальных и модельных данных по температуре и солености для станций 99, 100 и А (рис. 4). Коэффициент корреляции вертикального хода параметров составил 0.91–0.99 для температуры и 0.94–0.99 для солености. Модельные данные представлены в среднемесячном осреднении. Поэтому, несмотря на то, что величины немного различаются, вертикальная структура модельных термохалинных параметров для станций А и 98 оказалась весьма схожей наличием однородного перемешанного слоя до горизонта 100 м и подповерхностным увеличением солености ниже скачка плотности. Также схожими оказались модельные оценки и термохалинные значения in-situ для станций 99 и 100, что позволяет воспользоваться модельными данными для восполнения таковых на станции 98.
Рис. 4.
Сравнение вертикальных профилей температуры (слева) и солености (справа) для станций А и 98 (точками обозначены значения на горизонтах).
Вертикальные профили температуры на станциях А, 98 и 99 интерпретируются как типичная для этого района разновидность субарктической структуры, несмотря на то, что на поверхности моря значения температуры и солености на станции 99 были выше, чем на расположенной южнее станции 100 (рис. 5). Однако увеличение значений солености в подповерхностном слое на станциях 99 и 100 указывают на субтропическое происхождение вод. Поверхностная вода на станциях 99 и 100 имела довольно низкую температуру (характерную для субарктической), но все еще высокую соленость (характерную для субтропической).
Рис. 5.
Вертикальные профили температуры (слева) и солености (справа) на исследованных станциях по данным модельных оценок (вверху) и in situ (внизу).
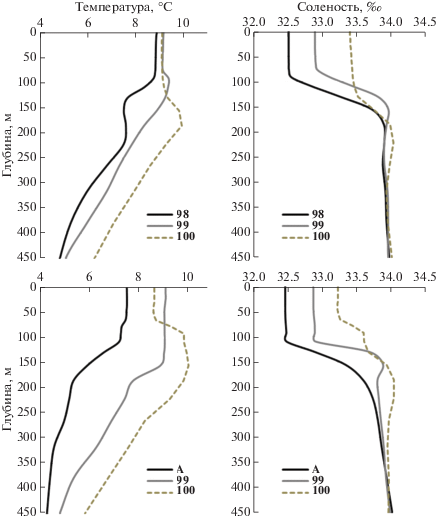
На станциях А и 99 преимущественно субарктическое происхождение водных масс подтверждают и измеренные гидрохимические параметры: высокое содержание растворенного кислорода (6.5–6.9 мл/л) в верхнем 100-метровом слое и характерное для субполярных вод высокое содержание минерального фосфора (0.6–1.5 мкМ/л) и азота (6.8–9.5 мкМ/л) (табл. 2).
Таблица 2.
Значения гидрохимических параметров на исследованных станциях (O2 – растворенный кислород, Si – растворенный кремний (силикаты), DIP – растворенный неорганический фосфор (фосфаты), DIN – растворенный неорганический азот (нитриты + нитраты))
| Глубина, м | O2 мл/л | O2 % | Si, мкМ/л | DIP, мкМ/л | DIN, мкМ/л | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| А | 99 | 100 | А | 99 | 100 | А | 99 | 100 | А | 99 | 100 | А | 99 | 100 | |
| 0 | 6.85 | 6.64 | 6.65 | 101.5 | 101.6 | 100.9 | 12.57 | 12.06 | 19.24 | 0.89 | 0.69 | 0.66 | 11.54 | 7.09 | 9.15 |
| 25 | 6.56 | 6.66 | 6.73 | 97.2 | 102.0 | 102.1 | 13.85 | 11.29 | 16.67 | 0.89 | 0.58 | 0.62 | 13.15 | 6.39 | 9.20 |
| 50 | 6.95 | 6.46 | 6.69 | 103.0 | 98.7 | 101.4 | 12.83 | 11.03 | 16.93 | 0.89 | 0.62 | 0.62 | 13.46 | 7.59 | 9.54 |
| 100 | 6.78 | 6.93 | 6.82 | 99.7 | 106.0 | 106.5 | 15.13 | 11.29 | 12.31 | 0.97 | 0.66 | 0.54 | 13.23 | 7.31 | 6.76 |
| 150 | 5.90 | 5.16 | 5.47 | 84.5 | 79.2 | 85.9 | 28.73 | 23.60 | 16.16 | 1.27 | 0.97 | 0.69 | 20.85 | 16.57 | 11.59 |
| 250 | 4.99 | 5.40 | 5.33 | 69.7 | 79.4 | 81.5 | 41.55 | 35.65 | 27.45 | 1.62 | 1.31 | 1.04 | 28.13 | 22.18 | 19.46 |
| 500 | 1.92 | 1.88 | 2.76 | 26.2 | 26.0 | 39.0 | 80.54 | 82.08 | 67.72 | 2.32 | 2.39 | 2.05 | 36.25 | 39.25 | 33.25 |
Согласно особенностям термохалинной вертикальной структуры на станции 100 выделяется подповерхностное увеличение концентрации растворенного кислорода (на 0.1–0.2 мл/л) вследствие распространения поверхностных субарктических вод к югу, накрывающих субтропические воды. Отмеченное уменьшение величин гидрохимических параметров ниже термоклина при движении в юго-западном направлении (от станции 98 к станции 100) также свидетельствует об изменении структуры вод в подповерхностном слое в исследованной фронтальной зоне.
Состав и соотношение видов в уловах. В уловах на трех рассматриваемых океанических станциях отмечено 14 видов рыб, 6 видов головоногих моллюсков (кальмары) и 3 вида желетелых (медузы и гребневик). Максимальная численность и биомасса всех гидробионтов отмечалась на центральной станции (99), за исключением Onychoteuthis borealijaponica и Corolla calceola (табл. 3). В уловах всех тралений как по численности, так и по биомассе преобладали кальмары, при этом их доля по численности была максимальна на крайней восточной станции, а по биомассе – на крайней западной. Рыбы в уловах составляли 16–45% по численности и 25–41% по биомассе. Доля медуз в уловах была мала и их численность и биомасса уменьшалась с востока на запад (рис. 6).
Таблица 3.
Видовой состав уловов и плотность распределения микронектона и макропланктона в верхней эпипелагиали открытых вод северо-восточной Пацифики 26–31 марта 2019 г. (относительная численность, экз./км2/относительная биомасса, кг/км2)
| Вид | № станции | ||
|---|---|---|---|
| 98 | 99 | 100 | |
| Diaphus theta | 2639/2.9 | 57 340/102.9 | 27 814/38.7 |
| Nannobrachium ritteri | 83/0.2 | 47 073/150.7 | 628/0.6 |
| Lestidium ringens | 69/0.1 | 29 884/15.5 | 16/0.2 |
| Nansenia candida | 1972/12.8 | 16 490/50.8 | 2606/7.8 |
| Notoscopelus japonicus | – | 6783/44.9 | 4175/24.0 |
| Stenobrachius leucopsarus | 1500/1.4 | 36713/73.5 | – |
| Symbolophorus californiensis | 28/0.1 | 560/1.4 | 22 069/48.6 |
| Tarletonbeania crenularis | 1722/4.3 | 15 307/48.9 | 1381/4.2 |
| Congriscus megastomus | 1667/75.3 | 2178/36.7 | 1570/36.4 |
| Abraliopsis felis | 37 042/114.9 | 209 794/662.0 | 105 585/453.8 |
| Boreoteuthis borealis | 7195/16.7 | 10 236/22.1 | 188/11.3 |
| Okutania anonycha | 3612/3.1 | 31 735/31.7 | 27 940/30.1 |
| Onychoteuthis borealijaponica | 83/2.2 | 31/0.8 | 157/6.2 |
| Atolla wyvilei | 28/0.3 | 62/0.1 | 31/0.3 |
| Corolla calceola | 5584/6.1 | 156/0.2 | 126/0.1 |
| Hormiphora cucumis | 306/2.2 | 124/0.4 | 157/1.3 |
| Итого | 63 531/242.8 | 431 597/1227.2 | 194 442/663.5 |
Рис. 6.
Соотношение основных групп организмов в уловах по численности (а) и биомассе (б) на различных станциях.
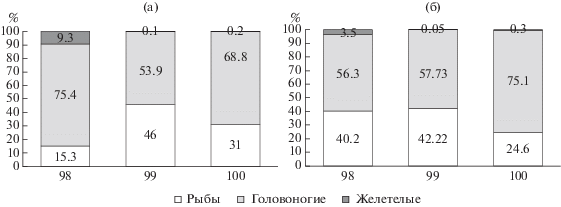
Среди рыб по численности в уловах преобладал Lestidium ringens, представленный преимущественно молодью, на долю которого пришлось 31.8% общего числа особей, а по биомассе – Nannobrachium ritteri (19.2%). По численности и биомассе среди кальмаров в уловах преобладал Abraliopsis felis. На него среди кальмаров пришлось 81.1% численной и 90.7% весовой доли, в общем улове – 48.6 и 57.1%, соответственно. Среди желетелых по численности и биомассе доминировала Corolla calceola – 89.2 и 58.9%.
При продвижении с востока на запад в уловах последовательно уменьшалась как по численности, так и по биомассе доля Nansenia candida, в то же время в этом же направлении возрастала доля трех видов – Diaphus theta, Notoscopelus japonicus и Stenobrachius leucopsarus. Nannobrachium ritteri по численности и биомассе отмечался массово на центральной станции (99). Symbolophorus californiensis практически отсутствовал на двух первых станциях (98 и 99) (рис. 7).
Рис. 7.
Долготные изменения доли рыб, кальмаров и желетелых в уловах по численности (а) и биомассе (б) на различных станциях.
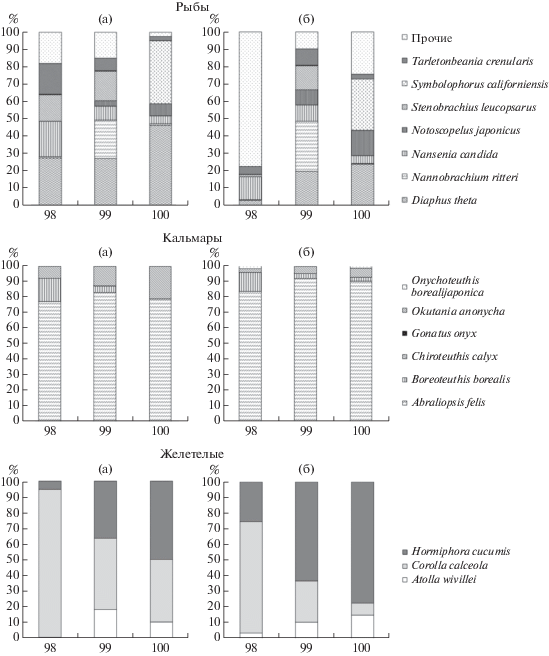
Среди кальмаров доля доминирующего вида – Abraliopsis felis существенно не изменялась во всех уловах как по численности (77–82%), так и по биомассе (83–92%). Доля других видов кальмаров при этом менялась значительно. Численная и массовая доля Boreoteuthis borealis в направлении с востока на запад последовательно уменьшалась, а Okutania anonycha, наоборот, увеличивалась (рис. 7).
В направлении с востока на запад численная и массовая доли медуз Corolla calceola уменьшались с 94.4 до 40% и 71.1 до 7.5%, соответственно, а гребневиков Hormiphora cucumis, наоборот, возрастали с 5.2 до 50% и 24.4 до 77.4% соответственно. Массовая доля медуз Atolla wivillei также возрастала с 3.5 до 15.1% (рис. 7).
Размерный состав. Наибольшая известная длина тела диафа-тета Diaphus theta около 9 см [2]. В наших уловах по относительной численности и биомассе – это второй вид, представленный особями длиной от 2.5 до 6.5 см (в среднем 5.1 см) (рис. 8). Основу уловов (76.2%) слагали рыбы длиной 4.5–5.5 см. Средняя длина рыб на восточной и западной станциях (4.6 и 5.0 см) была меньше, чем на центральной (5.8 см).
Рис. 8.
Размерный состав гидробионтов в уловах на различных станциях (N – число промеренных особей, M – средняя длина).
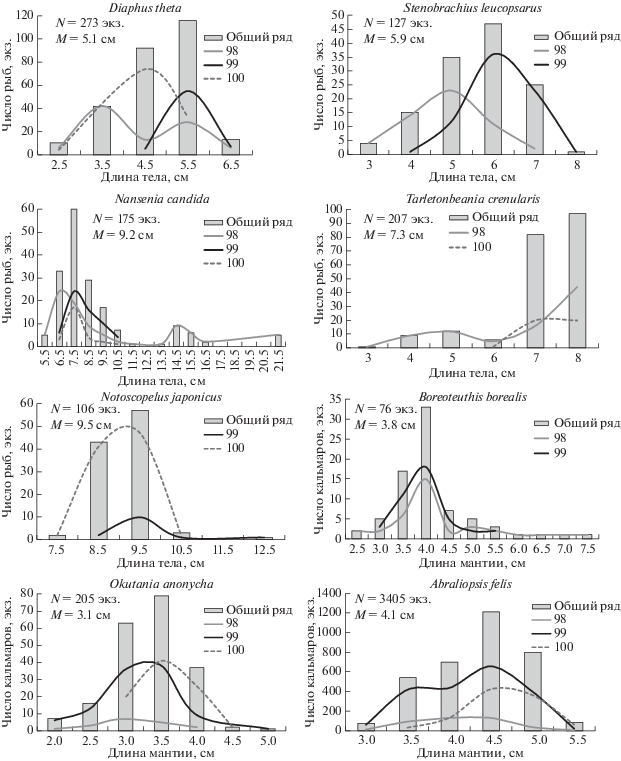
Наибольшая известная длина тела светлоплавникового стенобраха Stenobrachius leucopsarus около 9 см [2]. Данный вид в уловах по относительной численности и биомассе занимал третью позицию и был представлен особями длиной от 3 до 8 см при среднем значении 5.9 см и преобладании размерной группы 5–7 см, на которую пришлось 84.3% общей численности рыб (рис. 8). Средняя длина тела увеличивалась с востока на запад. На восточной станции (99) она составила 5.1 см, а на 98-й – 6.4 см.
Максимальная известная длина белой нансении Nansenia candida составляет 24 см [28]. Доля ее в уловах последовательно снижалась с востока на запад, была представлена особями длиной от 5.5 до 21.5 см с преобладанием (69.7%) размерной группы 6.5–8.5 см. Также была заметна доля (8.6%) более крупных особей длиной 14.5–15.5 см (рис. 8). Средняя длина тела N. candida уменьшалась с востока на запад. Так на восточной станции она равнялась 10.1 см, на центральной – 8.5 см и на западной – 8 см. При этом по длине и массе тела наблюдался ярко выраженный половой диморфизм – самки были гораздо длиннее и тяжелее самцов. Так, их средняя длина составляла, соответственно, 14.3 и 10.3 см, а масса тела – 24.4 и 8.4 г.
Западная тарлетонбиния Tarletonbeania crenularis достигает максимальной длины 8.4 см [21]. В наших уловах данный вид был представлен особями длиной от 3 до 8 см при среднем значении 7.3 см и преобладании (86.5%) размерной группы 7–8 см (рис. 8). Наименьшая средняя длина тела рыб отмечалась на восточной станции (6.9 см), а на центральной и западной была одинаковой (7.6 см). В уловах численно преобладали самки (76%), при этом половой диморфизм в размерах выражен не был – средняя длина самцов и самок составила 7.3 и 7.2 см, масса тела – 3.4 и 3.5 г, соответственно.
Наибольшая известная длина тела японского нотоскопела Notoscopelus japonicus около 15 см [2]. Данный вид в уловах был представлен особями длиной от 7.5 до 12.5 см при среднем значении 9.5 см и численном преобладании рыб размерной группы 8.5–9.5 см, на которую пришлось 94.3% общей численности рыб (рис. 8). Японский нотоскопел встрчался на двух станциях и его средняя длина уменьшалась с востока на запад. Так, на центральной станции она составила 10.1 см, а на западной – 9.4 см. При этом, при равной массе тела (в среднем 6.0 г) самки были несколько длиннее самцов (в среднем 9.4 и 9.0 см соответственно).
Северный кальмар Boreoteuthis borealis, являясь полиморфным видом, в северной части Тихого океана представлен двумя внутривидовыми группировками: мелкоразмерной и крупноразмерной [29]. Максимальная длина мантии (ДМ) зрелых кальмаров мелкоразмерной группировки достигает 17.9 см, крупноразмерной – 30.0 см у самок и 27.8 см у самцов [6]. Данный вид в наших уловах был представлен неполовозрелыми особями размерами от 2.4 до 7.2 см (рис. 8). На восточной и центральной станциях средняя ДМ северного кальмара практически не отличалась и составила 3.9 и 3.7 см, соответственно, в то время как на западной была заметно больше (5.2 см). Кроме того, на станции 100 выловлены три более крупные нагульные самки с длиной мантии 12.5, 14.7 и 14.9 см и один самец с ДМ 13.7 см.
Okutania anonycha отличается небольшими размерами, максимальная длина мантии до 15.0 см [30]. На всех станциях был представлен молодью с ДМ от 2.0 до 4.8 см (рис. 8). Прослеживалось увеличение средней длины мантии этого кальмара с востока на запад. Так на восточной станции средняя длина мантии составила 2.7 см, на центральной – 2.9 см, на западной – 3.3 см.
Максимальный размер мантии Abraliopsis felis до 5.7 см [16]. В уловах зарегистрированы особи с ДМ от 2.8 до 5.3 см (рис. 8), средняя величина которой увеличивалась с востока на запад. На восточной и центральной станциях она практически не отличалась (3.9 и 4.0 см соответственно), а на западной составила 4.4 см.
ОБСУЖДЕНИЕ
Выполненные станции находились на большом расстоянии друг от друга по разные стороны от Субарктического фронта, в динамической фронтальной зоне смешения субарктических и субтропической вод. Географически зона проведения работ относится к субарктическому фронту, который является границей между различными структурами водных масс [4]. В этой фронтальной зоне происходит смешение вод различной структуры, а следовательно перенос теплых поверхностных вод в субарктику и обратный перенос глубинных холодных субарктических вод [11].
Данные судового и спутникового зондирования в районе работ показывают, что станции были выполнены в высокоградиентной области субарктического фронта: на северной станции (98) водные массы имели выраженную субарктическую структуру, станция 99 располагалась в зоне смешения вод, а наиболее южная станция (100) – на южной периферии фронта с переходом в транзитный домен [22]. Основные отличия были характерны именно для подповерхностного слоя, что, как будет показано ниже, более существенно для состава и обилия микронектона и макропланктона, нежели характеристика приповерхностных вод.
Особенности вертикальной термохалинной структуры на станциях 99 и 100 могут быть следствием того, что поверхностные субарктические воды в этом районе были распространены далеко к югу, накрыв субтропические воды. Как было показано выше, поверхностная вода на станциях 99 и 100 имела довольно низкую температуру (характерную для субарктической), но все еще высокую соленость (характерную для субтропической). Это является следствием эффекта “двойной диффузии” [8], когда при горизонтальном турбулентном взаимодействии обмен температурой происходит быстрее, чем обмен соленостью из-за различия коэффициентов турбулентного обмена. В целом, анализ структуры вод на всех исследованных станциях свидетельствует о пересечении в момент выполнения работ динамической фронтальной зоны.
Как было показано на геострофической карте, в момент исследования во фронтальной зоне, где расположены все станции, скорости течений на поверхности варьировали от 0.05 до 0.15 м/с, однако стоит учитывать, что ниже 100-метрового слоя, где в основном обитают мезопелагические мигранты, течения не так ярко выражены [8]. Из этого можно предположить, что на распределение видов большее влияние оказывает вертикальная структура вод ниже 100 метров: субтропические воды на 99 и 100 станции и субарктические – на 98 станции. При этом, образованный в районе ст. 99 нестационарный антициклонический вихрь, может оказывать влияние на количественный состав микронектона, поскольку в вихревых системах концентрируются планктонные организмы, служащие объектами питания различным пелагическим рыбам [5, 31].
Таким образом, вероятно на видовой состав микронектона и макропланктона большее влияние оказывает вертикальная структура вод подповерхностного слоя. При этом на распределение биомассы и размеров частично оказывают влияние течения и вихри, поскольку в ночное время, когда проводились траления, эти виды поднимаются в верхний эпипелагический слой.
По результатам ихтиологических исследований можно сказать, что особенности вертикальной структуры вод в подповерхностном слое и вихревые образования на поверхности исследованного района оказали влияние на характерную долготную изменчивость в составе уловов. Так полученные данные по биомассе и соотношению видов показывают, что в составе уловов наблюдалась изменчивость, которая проявлялась как в соотношении биомассы/численности основных групп (рыбы, кальмары, желетелые) (см. табл. 3, рис. 6), так и внутри них. Наглядно подобные долготные изменения можно проследить на примере рыб, а наиболее ярко они были выражены в отношении желетелого макропланктона (см. рис. 7).
Несмотря на то, что по данным трех станций судить о достоверности влияния того или иного фактора среды на состав уловов микронектона и макропланктона сложно, на основании собственных и литературных данных мы можем предположить наличие связи между обилием и составом их сообществ и характером водных масс. Так сравнимые данные по мезопелагическим рыбам в Тихом океане были получены в 1989 г. в рейсе НПС “Посейдон” [7]. При анализе ресурсов мезопелагических рыб Северной Пацифики, ориентируясь на классификацию водных масс [22], были выделены ценотические комплексы. В этой классификации в рассматриваемом регионе выделено пять доменов. Наши станции, судя по всему, располагались между районом центрального субарктического домена и транзитного домена (в понимании [22]) или между северной и южной зонами тихоокеанского дрейфа (в понимании [7]). Основной характеристикой этой переходной зоны между субарктикой и транзитным доменами являются обширные вторжения холодной распресненной воды вдоль северной границы и теплой соленой вдоль южной границы [22]. Схожие явления мы наблюдали на нашем разрезе, особенно это было характерно для подповерхностного слоя, т.к. у поверхности температура на всех станциях была практически идентичной.
В отношении кальмаров, сравнимые данные также были получены в ходе уже упоминавшегося рейса НПС “Посейдон” в 1989 г., однако в литературе эти данные не были освещены. По материалам БД “Морская биология”, в отличие от наших данных, в 1989 г. в уловах повсеместно доминировала O. anonycha, концентрация которой на исследуемой нами акватории составляла от 22 до 480 кг/км2. В 2019 г. среди головоногих доминировал A. felis, концентрации которого были в пределах 114.9–662 кг/км2. При этом, как в 1989, так и в 2019 гг. максимальные концентрации кальмаров, как и мезопелагических рыб наблюдались в наиболее высокоградиентных зонах.
По данным Каредина [7], для указанных водных масс были выделены следующие доминирующие виды: Diaphus theta (53%), Stenobrachius leucopsarus (22%) и Nannobrachium ritteri (13%) в зоне северного тихоокеанского дрейфа и Ceratoscopelis warmingi (49%) и Diaphus perrspicillatus (21%), Stenobrachius leucopsarus (5%) в зоне южного тихоокеанского дрейфа. По нашим данным, видовой состав мезопелагических рыб несколько отличался: на трех станциях соотношение мезопелагических рыб следующее: Nannobrachium ritteri (22%), Diaphus theta (21%), Stenobrachius leucopsarus (16%), Notoscopelus japonicus (15%). Если сравнивать только данные тралений, выполненных в 1989 г. вблизи наших станций, то сходство видового состава значительно повышается. Тем не менее, отмечавшиеся среди доминантов в 2019 г. Tarletonbeania crenularis и Nansenia candida в 1989 г. занимали ничтожную долю. Стоит отметить, что по результатам исследований в зал. Аляска в феврале-марте 2019 г., по биомассе среди мезопелагических рыб также доминировала T. crenularis.
Концентрация мезопелагических рыб в 2019 г. на трех станциях в среднем составила 236 кг/км2 (21.8–488.6 кг/км2), в то время как в 1989 г. на близких к нашим станциям – 442 кг/км2. Однако следует учесть, что в 1989 г. на НПС “Посейдон” применяли экспериментальный трал РТ 93/500 с мелкоячеичной вставкой (10 мм) по всей длине тралового мешка [7], а не только в кутце, как в нашем случае, что могло отразиться на уловистости трала. Также в 1989 г. траления были выполнены в летний период, в то время как мы выполняли их в марте. Хотя в удаленных участках океана (в зоне субарктического фронта) сезонные изменения выражены не столь значительно [15], как в окраинных морях, это также могло отразиться на обилии мезопелагических рыб.
Поскольку среди многообразных факторов, влияющих на географическое распределение интерзональных видов в открытом океане большое значение имеет долготность и водные массы [33, 38], при анализе видовой структуры уловов мезопелагических рыб [19] проявилось четкое ее соответствие характерным водным массам. Однако в нашем исследовании траления пришлись на пограничную зону с крайне высокой изменчивостью океанологических характеристик. Несмотря на то, что станции были выполнены на относительно близком расстоянии друг от друга (400 миль в масштабах океана сравнительно небольшое расстояние), гидрологические и гидрохимические параметры в точках отбора различались весьма существенно, особенно в подповерхностном слое (глубже 100 м), что более существенно для макропланктонных и микронектонных организмов, нежели характеристики поверхностного слоя. Вероятно, это обусловило значительные вариации обилия, видового и размерного состава уловов, при том, что траления были выполнены по единой схеме и в одно и то же время. На основании полученных материалов мы полагаем, что, помимо случайной компоненты обилие и соотношение видов в уловах в значительной степени определялись структурой вод.
Список литературы
Аксютина З.М. Элементы математической оценки результатов наблюдений в биологических и рыбохозяйственных исследованиях. М.: Пищевая промышленность, 1968. 292 с.
Беккер В.Э. Миктофовые рыбы Мирового океана. М.: Наука, 1983. 248 с.
Волвенко И.В. Проблемы количественной оценки обилия рыб по данным траловых съемок // Изв. ТИНРО. 1998. Т. 124. С. 473–500.
Галеркин Л.И., Бараш М.Б., Сапожников В.В., Пастернак Ф.А. Тихий океан. М.: Мысль, 1982. 316 с.
Заворуев В.В., Заворуева Е.Н., Крум С.П. Распределение планктона в районах фронтальных зон водных экосистем: монография. Красноярск: Сиб. Федер. Ун-т, 2012. 292 с.
Зуев М.А. Катугин О.Н., Шевцов Г.А. и др. Распределение и дифференциация северного кальмара Boreoteuthis borealis (Sasaki, 1923) (Cephalopoda: Gonatidae) в Охотском море и северо-западной части Тихого океана // Тр. ВНИРО. 2007. Т. 147. С. 266–283.
Каредин Е.П. Ресурсы мезопелагических рыб северной части Тихого океана // Изв. ТИНРО. 1998. Т. 124. С. 391–415.
Малинин В.Н. Общая океанология. Ч. I. Физические процессы. СПб: Изд. РГМУ, 1998. 342 с.
Парин Н.В. Ихтиофауна океанской эпипелагиали. М.: Наука, 1968. 186 с.
Парин Н.В. Рыбы открытого океана. М.: Наука, 1988. 272 с.
Рожков В.А. Статистическая гидрометеорология: учебное пособие. СПб: Изд-во СПбГУ, 2015. 252 с.
Сапожников В.В., Агатова А.И., Аржанова Н.В. и др. Руководство по химическому анализу морских и пресных вод при экологическом мониторинге рыбохозяйственных водоемов и перспективных для промысла районов Мирового океана. М.: Изд-во ВНИРО, 2003.202 с.
Сомов А.А., Канзепарова А.Н., Важова А.С. и др. Некоторые предварительные результаты исследований на Императорском хребте в апреле 2019 г. // Тр. ВНИРО. 2019. Т. 175. С. 208–219.
Тихий океан. Биология Тихого океана. Кн. 3 Рыбы открытых вод. М.: Изд-во Наука, 1967. 276 с.
Федоров К.Н. Физическая природа и структура океанических фронтов. Л.: Гидрометеоиздат, 1983. 296 с.
Шевцов Г.А., Катугин О.Н., Зуев М.А. Распределение головоногих моллюсков в зоне субарктического фронта северо-западной части Тихого океана // Исслед. Вод. Биол. Ресур. Камчатки и Северо-зап. Части Тихого океана. 2013. Вып. 30. С. 64–81.
Angel M.V. Does mesopelagic biology affect vertical flux? // Productivity of the Oceans: Present and Past (Berger W.H., Smetacek V.S., Wefer G., eds.). New York: Wiley, 1989. P. 155–173.
Andersen V., Sardou J., Gasser B. Macroplankton and micronekton in the northeast tropical Atlantic: abundance, community composition and vertical distribution in relation to different trophic environments // Deep-Sea Res. I. 1997. V. 44. P. 193–222.
Beamish R.J., Leask K.D., Ivanov O.A. et al. The ecology, distribution, and abundance of midwater fishes of the Subarctic Pacific gyres // Prog. Oceanogr. 1999. V. 43. P. 399–442.
Brodeur R.D., Seki M.P., Pakhomov E.A., Suntsov A.V. Micronekton – what are they and why they important? // PICES Press. 2005. V. 13. P. 7–11.
Bystydzieńska Z.E., Phillips J.A., Linkowski T.B. Larval stage duration, age and growth of blue lanternfish Tarletonbeania crenularis (Jordan and Gilbert, 1880) derived from otolith microstructure // Environ. Biol. Fish. 2010. V. 89. P. 493–503.
Favorite F. Oceanography of the Subarctic Pacific region 1960-71 // Bull. Int. N. Pac. Comm. 1976. V. 33. P. 1–187.
Gjøsæter J., Kawaguchi K. A review of the world resources of mesopelagic fish // FAO Fish. Tech. Pap. № 193. 1980. P. 1–151.
Irigoien X., Klevjer T.A., Røstad A. et al. Large mesopelagic fishes biomass and trophic efficiency in the open ocean // Nat. Commun. 2014. V. 5. Art. 3271. https://doi.org/10.1038/ncomms4271
Kaartvedt S., Aksnes D.L., Aadnesen A. Winter distribution of macroplankton and micronecton in Masfjorden, western Norway // Mar. Ecol. Prog. Ser. 1988. V. 45. P. 45–55.
Kaartvedt S., Staby A., Aksnes D.L. Efficient trawl avoidance by mesopelagic fishes causes large underestimation of their biomass // Mar. Ecol. Prog. Ser. 2012. V. 456. P. 1–6.
Lam V.W.Y., Pauly D. Mapping the global biomass of mesopelagic fishes // Sea Around Us Project Newsletter. 2005. V. 30. P. 4.
Mecklenburg C.W., Mecklenburg T.A., Thorsteinson L.K. Fishes of Alaska. Bethesda, Maryland: Amer. Fish. Soc., 2002. 1037 p.
Nesis K.N., Nezlin N.P. Intraspecific groupings of gonatid squids // Rus. J. Aquat. Ecol. 1993. V. 2. № 2. P. 91–102.
Okutani T. Cuttlefish and Squids of the World in Color. Tokyo: Okumura Printing Co., 1995. 186 p.
Orlov A.M. Impact of eddies on spatial distributions of groundfishes along waters off the northern Kuril Islands, and southeastern Kamchatka (north Pacific Ocean) // Ind. J. Mar. Sci. 2003. V. 32. № 2. P. 95–113.
Orlov A.M., Rabazanov N.I. Past, present and future of deep-sea fisheries in the global oceans // Mod. App. Ocean. Petr. Sci. 2019. V. 3. Iss. 2. P. 255–257.
Proud R., Cox M.J., Brierley A.S. Biogeography of the global ocean’s mesopelagic zone // Current Biol. 2017. V. 27. P. 113–119.
Radchenko V.I. Mesopelagic fish community supplies “biological pump” // Raffles Bull. Zool. 2007. Suppl. 14. P. 265–271.
Robinson B.H. Deep pelagic biology // J. Exp. Mar. Biol. Ecol. 2004. V. 300. P. 253–272.
Sinclair E.H., Stabeno P.J. Mesopelagic nekton and associated physics of the southern Bering Sea // Deep-Sea Res. II. 2002. V. 49. P. 6127–6145.
Sugisaki H., Tsuda A. Nitrogen and carbon stable isotopic ecology in the ocean: the transportation of organic materials through the food web // Biogeochemical Processes and Ocean Flux in the Western Pacific (Sakai H., Nozaki Y., eds.). Tokyo: Terra Scientific Publishing Company. 1995. P. 307–317.
Van Noord J.E., Olson R.J., Redfern J.V. et al. Oceanographic influences on the diet of 3 surface-migrating myctophids in the eastern tropical Pacific Ocean // Fish. Bull. 2016. V. 114. № 3. P. 274–287.
Watanabe H., Moku M., Kawaguchi K. et al. Diel vertical migration of myctophid fishes (Family Myctophidae) in the transitional waters of the western North Pacific // Fish. Oceanogr. 1999. V. 8. № 2. P. 115–127.
Willis M.J., Pearcy W.G. Vertical distribution and migration of fishes of the lower mesopelagic zone of Oregon // Mar. Biol. 1982. V. 70. № 1. P. 87–98.
Дополнительные материалы отсутствуют.


