Океанология, 2022, T. 62, № 1, стр. 98-111
Гидрохимические исследования залива Академии (Охотское море)
П. Я. Тищенко 1, *, В. Б. Лобанов 1, П. П. Тищенко 1, П. Ю. Семкин 1, А. Ф. Сергеев 1, Е. В. Анисимова 1, Ю. А. Барабанщиков 1, В. В. Мельников 1, А. А. Рюмина 1, С. Г. Сагалаев 1, О. А. Уланова 1, М. Г. Швецова 1, Е. М. Шкирникова 1
1 Тихоокеанский океанологический институт им. В.И. Ильичева ДВО РАН
Владивосток, Россия
* E-mail: tpavel@poi.dvo.ru
Поступила в редакцию 20.04.2021
После доработки 24.06.2021
Принята к публикации 18.07.2021
- EDN: JQORWM
- DOI: 10.31857/S0030157422010166
Аннотация
Гидролого-гидрохимические характеристики поверхностных и придонных вод залива Академии получены в двух экспедициях ТОИ ДВО РАН, проводившихся 11–14 июля 2016 г. и 15–19 сентября 2020 г. Исследования 2016 года проводились во время летнего паводка, после таяния льдов в заливе. В этот период по отношению к атмосфере был обнаружен избыток концентрации растворенного кислорода придонных и поверхностных вод и дефицит по отношению к атмосферному углекислому газу, что указывают на доминирование продукционных процессов. Низкое содержание биогенных веществ и хлорофилла а в заливе и в эстуариях рек Сыран и Ульбан характеризует залив как олиготрофный бассейн. Осенью 2020 года в кутовой части Ульбанского залива содержание общего фосфора достигало 10–14 мкмоль/л, наблюдались высокие концентрации хлорофилла а, особенно в поверхностном слое (более 10 мкг/л), придонные воды испытывали дефицит кислорода и избыток углекислого газа. Эти данные характеризуют воды залива как высоко эвтрофированные. Сделано предположение, что различия в гидрохимических характеристиках, полученных летом 2016 и осенью 2020 гг. обусловлены эвтрофикацией залива Академии погибшим лососем, приходящим на нерест в конце июля–начале августа в реки, впадающие в залив.
ВВЕДЕНИЕ
Охотское море является одним из наиболее продуктивных водоемов Мирового океана [23]. Неоднородность физико-географических условий моря приводит к неравномерной продуктивности в разных его районах [18]. Одним из условий высокой продукции является поставка биогенных веществ из глубинных слоев моря в эвфотический слой. В работе [17] по географическому признаку были выделены пять гидродинамических систем, которые обеспечивают высокую продуктивность разных акваторий Охотского моря: Восточно-склоновая шельфовая система; Центрально-северо-восточная система; Северо-западная система; Восточно-сахалинская система; Юго-западная система. Каждую из систем авторы охарактеризовали с точки зрения причин и механизмов, обеспечивающих вертикальный транспорт биогенных веществ, а также с биологических позиций, т.е. указали основные виды гидробионтов, обеспечивающих высокую продуктивность и их промышленную значимость. Количественное распределение плотности зоопланктона в Охотском море [2] в общих чертах согласуется с выделенными ранее высокопродуктивными акваториями [17], за исключением одного района. Дополнительным высокопродуктивным районом, который ясно выделяется по распределению плотности мелкого зоопланктона, является акватория Шантарского архипелага [2]. Необходимо отметить, что общие контуры в распределениях мелкой фракции зоопланктона и частоты встреч гренландских китов [32] очень похожи друг на друга. Современные данные по миграции гренландских китов охотоморской популяции указывают на важную роль залива Академии в качестве места их нагула в летне-осенний сезон [10, 20, 21, 41]. Основной пищей гренландских китов является зоопланктон. В период нагула они ежедневно употребляют его в количестве 2–3% от общей массы животного, т.е. в среднем 1.5–2 тонны [33]. В свою очередь, биомасса зоопланктона формируется за счет фитопланктона.
В настоящее время полностью отсутствуют сведения о концентрации биогенных веществ и их источниках, которые необходимы для достижения требуемого уровня первичной продукции в заливе Академии. Именно этому пробелу посвящена данная работа, которая основана на результатах гидрохимических исследований, проведенных в заливе Академии в июле 2016 г. и в сентябре 2020 г.
ОБЪЕКТ И МЕТОДЫ ИССЛЕДОВАНИЯ
Акватория Шантарского архипелага расположена в северо-западной части Охотского моря и включает в себя четыре крупных залива, простирающихся с юго-запада на северо-восток: это заливы Николая, Академии и Тугурский и Удская губа (рис. 1). Залив Академии глубоко вдается в материк между мысом Врангеля (54°17′ с.ш., 138°40′ в.д) на востоке и мысом Сенека (54°19′ с.ш., 137°44′ в.д). На восточном побережье в залив Академии вдается залив Николая. Южная и западная части залива Академии называются соответственно заливами Ульбанский и Константина [9]. Глубины на входе в залив Академии не превышают 52 м, в средней части залива глубины 30–35 м, а по мере приближения к берегам они постепенно уменьшаются. Грунт в заливе Академии представляет собой илистый песок с галькой и ракушкой. Ульбанский залив, расположенный в южной части залива Академии, ограничен с востока полуостровом Тохареу, а с запада полуостровом Тугурский. Восточным входным мысом залива является мыс Тукургу, а западным мыс Укурунру. Глубины у входа в залив 30–35 м, в средней части залива 25 м, а у входа в его кутовую часть 12–14 м. Северный берег кутовой части Ульбанского залива оканчивается на востоке косой Бетти (53°39′ с.ш., 137°30′ в.д). В кутовую часть залива впадает несколько рек, наиболее крупные из них Сыран и Ульбан. Протяженности рек составляют 77 и 81 км, соответственно. Кета и горбуша являются основными видами лососевых рыб, которые заходят на нерест в эти реки, как правило со второй декады июля по первую декаду августа [5–8]. Приливы в заливе неправильные полусуточные, в кутовой части залива обычная высота приливов 3–6 м. Более 20 км нижнего течения рек Сыран и Ульбан находится под мощным влиянием приливов.
Рис. 1.
Акватория Шантарского архипелага: 1 – м. Врангеля, 2 – м. Сенеки, 3 – п-ов Тохареу, 4 – п-ов Тугурский, 5 – м. Тукургу, 6 – м. Укурунру, 7 – коса Бетти, 8 – о. Большой Шантар, 9 – о. Феклистова, 10 – о. Малый Шантар, 11 – о. Беличий.
Экспедиционные работы в заливе Академии выполняли на НИС “Профессор Гагаринский” в июле 2016 г. [14] и на НИС “Академик Опарин” в сентябре 2020 г. Работы в кутовой части Ульбанского залива и эстуариях рек Ульбан и Сыран проводили на резиновой лодке. Зондирование воды осуществляли зондом SBE 19plus V2, оснащенным датчиками температуры, давления, электропроводности, растворенного кислорода (DO), флюоресценции хлорофилла а, мутности, фотосинтетически-активной радиации (ФАР) в комплекте с батометрической системой SBE-55 с 6 батометрами, объемом 4 л каждый. Дополнительно в 2016 году изучали эстуарии рек Сыран (14 июля) и Ульбан (26 июля).
Воду для анализа отбирали на следующие гидрохимические параметры: соленость, DO, рН, общую щелочность (ТА), хлорофилл а, РОУ и гумусовое вещество, биогенные вещества (фосфаты, силикаты, нитраты, нитриты, ион аммония, общий азот, общий фосфор).
Значения рН измеряли потенциометрическим методом, используя ячейку безжидкостного соединения [15]. ТА анализировали прямым титрованием по методу Бруевича [12]. Элементы карбонатной системы (pHin situ, DIC – растворенный неорганический углерод, pCO2 – парциальное давление двуокиси углерода) были рассчитаны с учетом поправки на содержание органической щелочности [15].
Анализ биогенных веществ (нитраты, нитриты, аммонийный азот, анионы ортофосфорной кислоты, кремний) выполняли фотометрическим методом с помощью стандартной процедуры [29]. Определение общего фосфора и азота выполняли персульфатным сжиганием с ультрафиолетовым облучением на автоматическом анализаторе SKALAR SAN++, методические принципы и особенности изложены в работе [29].
DO в морской воде анализировали с помощью метода Винклера, модифицированного Карпентером [28]. В данном варианте метода применяли микробюретку Brinkman/Dosimate-665 (объемом 1 мл), которая позволяет измерять титрируемый раствор с точностью до 0.001 мл. Использовали кислородные склянки объемом около 125 мл. Ошибка измерения составляла ±0.05 мл/л. Для оценки состояния воды по отношению к атмосферному кислороду нами использовался параметр AOU – (apparent oxygen utilization, кажущееся поглощение кислорода), который определяется соотношением [39]:
(1)
${\text{AOU}} = {{{\text{[}}{{{\text{O}}}_{{\text{2}}}}{\text{]}}}^{{\text{o}}}} - {\text{[}}{{{\text{O}}}_{{\text{2}}}}{\text{],}}$Содержание хлорофилла а измеряли спектрофотометрическим методом в соответствии с ГОСТ 17.1.4.02.–90 [3]. Пробы воды фильтровали через мембранные фильтры Владипор МФАС-ОС-3 с диаметром пор 0.8 мкм. Затем фильтры высушивали и помещали в морозильную камеру. В береговой лаборатории хлорофилл растворяли в 5 мл 90% раствора ацетона и раствор помещали в холодильник. На следующий день на спектрофотометре РС 3600 производства Shimadzu проводили измерения [13].
РЕЗУЛЬТАТЫ
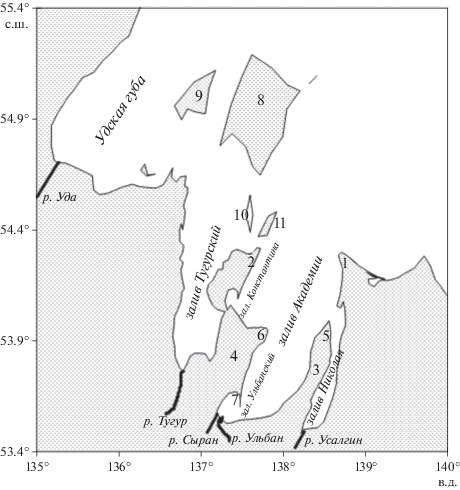
Сравнение гидролого-гидрохимических характеристик поверхностных и придонных вод залива Академии, полученных в периоды 11–14 июля 2016 г. и 15–19 сентября 2020 г., представлено на рис. 2–8. Из данных зондирования следует, что сравнительно высокая температура (около 12°С) поверхностных вод залива Академии характерна только для его южной части, находящейся под влиянием речного стока, что подтверждается низкой соленостью вод. Исследования 2016 года проводили в период летнего паводка и после таяния льдов в заливе. В этот период большая часть придонных вод залива имела температуру в диапазоне ±1°С. Для сентября 2020 г. характерны высокие температуры, как правило, в диапазоне 8–12°С и соленость от 27 епс (единица практической солености) в кутовой части залива до 32 епс в северной части залива. Во многом, благодаря низким температурам и низкой солености, содержание DO в поверхностных и придонных водах в июле 2016 года (400–450 мкмоль/кг) было в 1.5–2 раза выше в сравнении с результатами, полученными осенью 2020 г. (250–320 мкмоль/кг). Однако не только низкая температура и сравнительно низкая соленость были причинами высоких значений DO в 2016 г. Воды залива летом 2016 года содержали избыточную концентрацию кислорода по отношению к атмосфере, поскольку значения AOU для основной акватории залива были отрицательны (уравнение (1)) (рис. 2а, 2в). В то же время наблюдался дефицит углекислого газа, поскольку рассчитанные значения ${\text{pC}}{{{\text{O}}}_{{\text{2}}}}$ были меньше атмосферного парциального давления углекислого газа (${\text{pC}}{{{\text{O}}}_{{{\text{2atm}}}}} = {\text{400 мкатм}}$) (рис. 3а, в). Аналогичная ситуация характерна в отношении DO и парциального давления углекислого газа для поверхностных вод в осенний сезон 2020 г. Однако, для большей части придонных вод залива в сентябре 2020 г. характерен дефицит кислорода, поскольку AOU > 0 (рис. 2г), и избыток углекислого газа (${\text{pC}}{{{\text{O}}}_{{\text{2}}}} > {\text{400 мкатм}}$) (рис. 3г).
Рис. 2.
Распределение кажущегося потребления кислорода (AOU, мкмоль/кг) в заливе Академии в июле 2016 года (а, в) и в сентябре 2020 года (б, г). Слои поверхностный – а, б и придонный – в, г, соответственно. Белая изолиния соответствует равновесному состоянию кислорода на границе раздела “атмосфера–вода”.
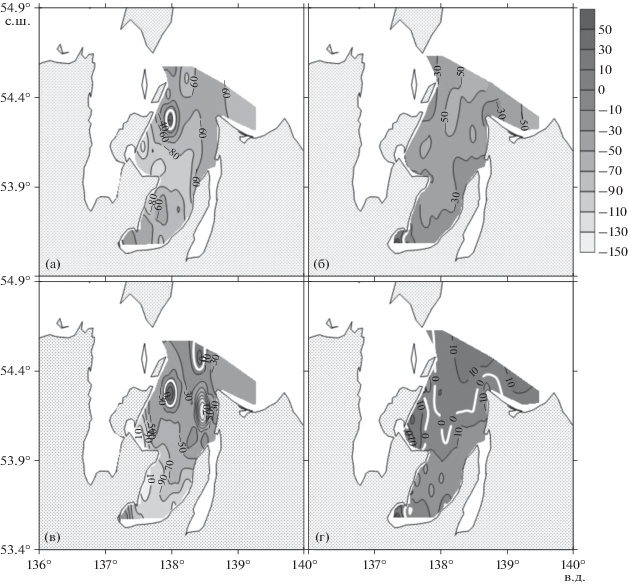
Рис. 3.
Распределение парциального давления углекислого газа (мкатм) в заливе Академии в июле 2016 года (а, в) и в сентябре 2020 года (б, г). Слои поверхностный – а, б и придонный – в, г, соответственно. Белая изолиния соответствует равновесному состоянию углекислого газа на границе раздела “атмосфера–вода”.
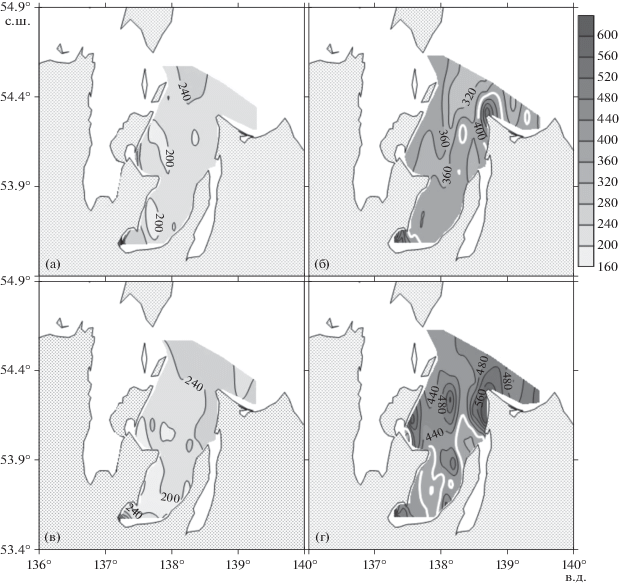
Рис. 4.
Распределение концентрации нитрат-ионов (мкмоль/л) в заливе Академии в июле 2016 года (а, в) и в сентябре 2020 года (б, г). Слои поверхностный – а, б и придонный – в, г, соответственно.
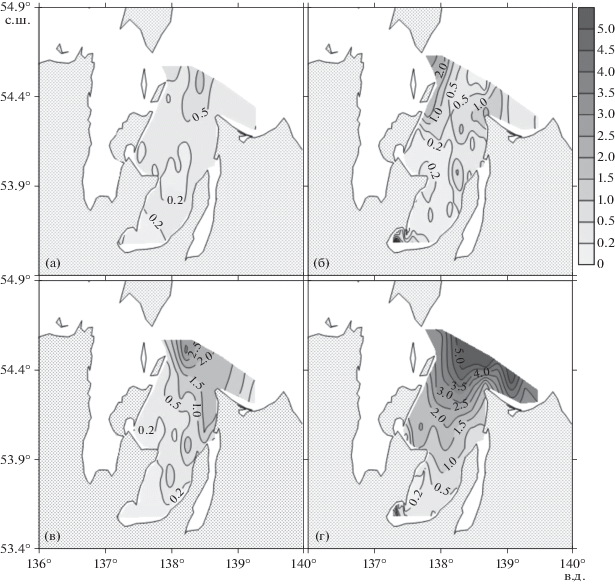
Рис. 5.
Распределение концентрации аммонийного азота (мкмоль/л) в заливе Академии в июле 2016 года (а, в) и в сентябре 2020 года (б, г). Слои поверхностный – а, б и придонный – в, г, соответственно.
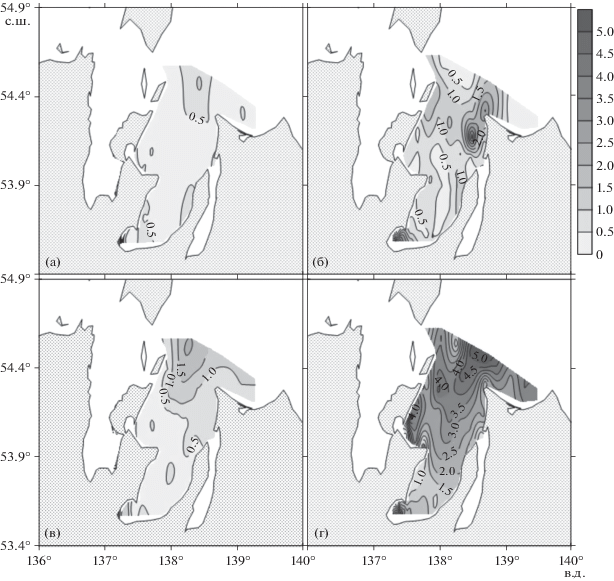
Рис. 6.
Распределение концентрации общего азота (мкмоль/л) в заливе Академии в июле 2016 года (а, в) и в сентябре 2020 года (б, г). Слои поверхностный – а, б и придонный – в, г, соответственно.
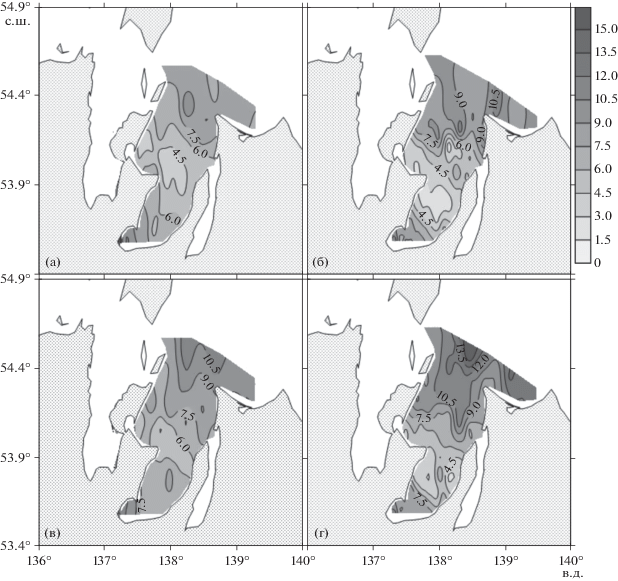
Рис. 7.
Распределение концентрации общего фосфора (мкмоль/л) в заливе Академии в июле 2016 года (а, в) и в сентябре 2020 года (б, г). Слои поверхностный – а, б и придонный – в, г, соответственно.
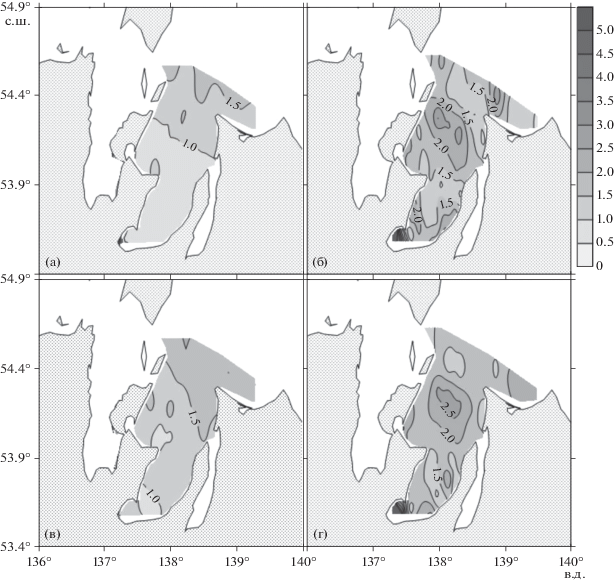
Рис. 8.
Распределение концентрации хлорофилла а (мг/м3) в заливе Академии в июле 2016 года (а, в) и в сентябре 2020 года (б, г). Слои поверхностный – а, б и придонный – в, г, соответственно.
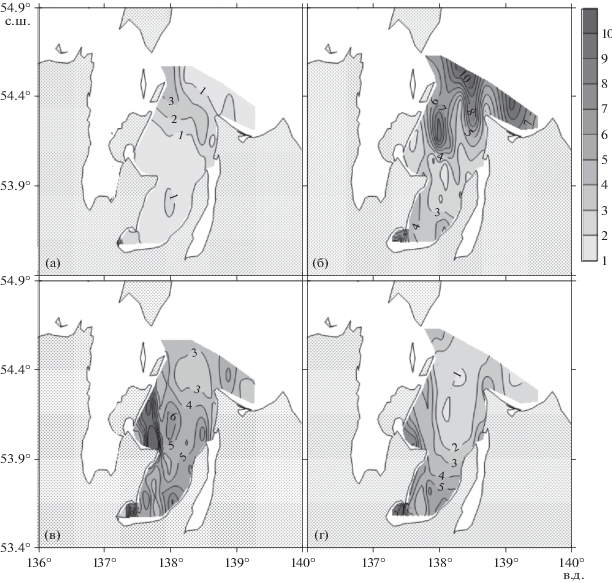
Низкие концентрации неорганических форм биогенных веществ (рис. 4а, 4в; 5а, 5в) в летний сезон 2016 г. (0.2–0.6 фосфора, 0.2–0.5 нитратов, 0.5–1.5 аммония, 1–2 кремния, мкмоль/л, соответственно) указывают на то, что на момент проведения исследований залива Академии они ограничивали величину первичной продукции органического вещества. Опубликованные в литературе средние значения констант Михаэлиса-Ментона для скоростей извлечения диатомеями неорганических форм азота, фосфора и кремния, равны 1.6, 1.2 и 3.9 мкмоль/л, соответственно [43].
Концентрации неорганических форм биогенных веществ в сентябре 2020 г. резко возросли в сравнении с летним сезоном 2016 г.: в два и более раз для нитратов (рис. 4), в три и более раз для аммония (рис. 5), в три и более раз для фосфора, в десять раз и более для кремния. Необходимо отметить, что резкое увеличение концентраций неорганических форм биогенных веществ в сентябре привело к увеличению более чем в пять раз содержания хлорофилла а в поверхностном слое залива (рис. 8).
Одна из предполагавшихся причин увеличения концентраций биогенных веществ в заливе Академии – вынос биогенных веществ реками, впадающими в залив. В 2016 году нами были исследованы эстуарии рек Сыран и Ульбан. В таблице 1 приведен диапазон изменений концентраций биогенных веществ в эстуарии рек. Из полученных результатов следует, что увеличение концентрации неорганических форм биогенных веществ в заливе осенью 2020 года не может быть результатом речного стока биогенных веществ. Во-первых, концентрации нитратов и ионов аммония в речных водах были весьма низкие. Во-вторых, роль речного стока в кутовой части Ульбанского залива была незначительной, поскольку минимальная соленость в кутовой части залива составляла 27 епс. Более того, для двух станций в поверхностном и придонном горизонтах кутовой части залива были обнаружены концентрации общего фосфора, равные соответственно 10.4 и 14.7 мкмоль/л. Подобных концентраций в реке не было обнаружено (табл. 1).
Таблица 1.
Диапазон изменений неорганических форм концентраций (мкмоль/л) биогенных веществ (${\text{[NH}}_{{\text{4}}}^{ + }]$, ${\text{[NO}}_{{\text{3}}}^{ - }]$, Nтот, P, Ртот, Si), хлорофилла a (мг/м3)
| Реки | ${\text{[NH}}_{{\text{4}}}^{ + }]$ | ${\text{[NO}}_{{\text{3}}}^{ - }]$ | Nтот | Р | Ртот | Si | Chl-a |
|---|---|---|---|---|---|---|---|
| Сыран | 0.13–7.05 | 0.02–0.51 | 9.66–17.12 | 0.20–3.56 | 0.82–5.56 | 0.3–128.4 | 1.1–4.4 |
| Ульбан | 0.78–5.90 | 0.0–0.92 | 5.85–25.01 | 0.50–3.16 | 1.14–3.83 | 2.9–165.9 | 0.9–5.3 |
ОБСУЖДЕНИЕ
Одновременное рассмотрение концентраций растворенного кислорода и углекислого газа по отношению к их содержанию в атмосфере с определенной долей уверенности позволяет установить доминирование продукционных и деструкционных процессов в среде [16]. Формально процесс продукции/деструкции органического вещества можно записать, используя соотношение Рэдфилда [40]:
(2)
$\begin{gathered} {\text{106}} \cdot {\text{C}}{{{\text{O}}}_{{\text{2}}}} + {\text{122}} \cdot {{{\text{H}}}_{{\text{2}}}}{\text{O}} + {\text{16}} \cdot {\text{HN}}{{{\text{O}}}_{{\text{3}}}} + {{{\text{H}}}_{{\text{3}}}}{\text{P}}{{{\text{O}}}_{{\text{4}}}} \Leftrightarrow \\ \Leftrightarrow {{{\text{(C}}{{{\text{H}}}_{{\text{2}}}}{\text{O)}}}_{{{\text{106}}}}}{{{\text{(N}}{{{\text{H}}}_{{\text{3}}}}{\text{)}}}_{{{\text{16}}}}}{{{\text{H}}}_{{\text{3}}}}{\text{P}}{{{\text{O}}}_{{\text{4}}}} + {\text{138}} \cdot {{{\text{O}}}_{{\text{2}}}}. \\ \end{gathered} $Полученные нами данные о концентрации биогенных веществ в заливе позволяют оценить статус эвтрофикации исследуемой акватории. В литературе существуют разные взгляды на содержательную часть термина “эвтрофикация” применительно к морским и прибрежным экосистемам [24, 35, 36]. В практическом отношении, при оценке статуса эвтрофности бассейна используется определение, данное Дж. Андерсеном с коллегами [24]: “…обогащение воды биогенными элементами, особенно азотом и/или фосфором, и органическим веществом, вызывающее ускоренный рост водорослей и высших растений, который создает неприемлемые отклонения в структуре, функционировании и стабильном существовании водных организмов, а также в качестве воды, по отношению к выбранным стандартным условиям”. Международными организациями (например, [30, 37, 38]) выбраны стандартные условия, при отклонении от которых среда считается эвтрофированной. Пороговые концентрации биогенных веществ и другие параметры в каждой из цитируемых работ международных организаций несколько отличаются друг от друга. Нами были выбраны критерии относительно концентрации биогенных веществ, принятые NOWPAP, которые использовались при оценке статуса эвтрофикации прибрежных вод к северу от о. Кюсю [37]. В качестве дополнительных параметров были включены концентрации хлорофилла а и глубина видимости диска Секки [26]. Величины этих параметров представлены в табл. 2. В том случае, если концентрации биогенных веществ и хлорофилла поверхностного слоя залива превышают значения, приведенные в первой строке таблицы (NOWPAP, L), то вода считается эвтрофированной по данному параметру. Ситуация рассматривается как чрезвычайная, которая приводит к нежелательным экологическим последствиям, если измеренные параметры превышают значения приведенные в строке 2 (NOWPAP, H) [37].
Таблица 2.
Минимальные (NOWPAP, L) и максимальные (NOWPAP, H) значения параметров (DIN = $ = {\text{[NH}}_{{\text{4}}}^{ + }{\text{]}} + {\text{[NO}}_{{\text{2}}}^{ - }{\text{]}} + {\text{[NO}}_{{\text{3}}}^{ - }{\text{]}}$ – dissolved inorganic nitrogen; DIP – dissolved inorganic phosphorus, Ntot, Ptot, Chl – хлорофилл a, N/P – мольные отношения DIN к DIP, глубина видимости диска Секки)*, используемые для оценки статуса эвтрофикации вод залива Академии в июле 2016 и сентябре 2020 г. на основе сравнения минимальных, максимальных и средних величин измеренных в поверхностных водах залива
| Параметр | DIN, мкM |
Ntot, мкМ |
DIP, мкM |
Ptot, мкМ |
DISi, мкM |
Chl, мкг/л |
N/P | Диск Секки, м |
|---|---|---|---|---|---|---|---|---|
| NOWPAP, L | 12 | 21 | 0.32 | 1.0 | 19.4 | 5 | 16 | <3 |
| NOWPAP, H | 40 | 71 | 0.94 | 2.9 | 25.8 | 20 | 16 | <1 |
| Июль, 2016 г. | ||||||||
| Минимум | 0.38 | 3.43 | 0.1 | 0.6 | 0.3 | 0.23 | 1.2 | 4.5 |
| Среднее | 0.72 | 6.37 | 0.25 | 1.0 | 1.15 | 3.22 | 1.05 | 7.0 |
| Максимум | 2.50 | 10.62 | 0.5 | 1.6 | 2.54 | 3.85 | 9.1 | 10.5 |
| Сентябрь, 2020 г. | ||||||||
| Минимум | 0.25 | 1.6 | 0.43 | 0.8 | 0.49 | 3.3 | 0.5 | 0.6 |
| Среднее | 1.8 | 6.8 | 0.73 | 2.1 | 11.1 | 5.0 | 2.3 | 4.7 |
| Максимум | 10.9 | 11.9 | 1.93 | 10.0 | 26.09 | 11.5 | 8.7 | 7.5 |
Измеренные параметры поверхностных вод залива Академии в июле 2016 года, как правило, ниже пороговых значений, используемых в оценке статуса эвтрофикации бассейна, исключением являются несколько станций, для которых максимальные значения концентраций DIP и Ptot, превышают нижний уровень показателей эвтрофности бассейна (табл. 2). В целом, на основе сравнения результатов гидрохимических исследований с пороговыми значениями, используемыми в оценке статуса эвтрофности бассейна, можно сделать вывод, что в июле 2016 г. залив Академии находился в благополучном состоянии, т.е. не был эвтрофирован. Для всей акватории Шантарского архипелага были получены невысокие концентрации хлорофилла а [11]. К подобному выводу пришли в работе [4] в отношении экосистемы Тугурского залива, изучая фотосинтез фитопланктона, бактериальную ассимиляцию СО2, общее количество бактерий и деструкцию органического вещества летом 1990 г. Автор охарактеризовал экосистему Тугурского залива как олиготрофно-мезотрофную. Концентрации неорганических форм биогенных веществ в сентябре 2020 возросли в несколько раз в сравнении с летним сезоном 2016 г. Необходимо отметить, что резкое увеличение концентраций неорганических форм биогенных веществ в сентябре 2020 г. привело к увеличению более чем в пять раз содержания хлорофилла а в поверхностном слое залива. Средние значения концентраций DIP, Ptot и хлорофилла а залива превосходят нижний пороговый предел статуса эвтрофности залива. Максимальные значения этих параметров (DIP = = 1.93 мкМ, Ptot = 10 мкМ, Chl = 11.5 мкмоль/кг) существенно превосходят максимально пороговые значения этих параметров (таблица 2). Иначе говоря, состояние залива Академии в сентябре 2020 года характеризуется как “высоко эвтрофированное”. Более того, средние глубины видимости диска Секки в 2020 г. оказались примерно в 1.5 меньше, чем были в июле 2016 г., что мы связываем с высоким содержанием фитопланктона. Следует отметить, что этот результат не обусловлен взмучиванием донных осадков, т.к. дно залива выстлано, как правило, крупной галькой и песком (в 2016 г. на каждой станции отбирались пробы на зообентос и фотографировался грунт). Исключением является кутовая часть Ульбанского залива, для которой характерен мягкий грунт. В этой части залива после шторма в 2020 г. зарегистрирована самая низкая глубина видимости диска Секки (0.6 м), что мы связываем с взмучиванием донных отложений во время шторма. Особенностью вод залива Академии являются низкие значения азот-фосфорных отношений (таблица 2). Вероятной причиной является денитрификация, которая широко обсуждается для прибрежных акваторий [47].
Наиболее важным вопросом является установление причин в обнаруженных различиях гидрохимического состояния вод залива Академии. Как уже отмечалось выше, реки Сыран и Ульбан, впадающие в кутовую часть Ульбанского залива, не могут быть причиной изменения в статусе эвтрофикации залива, поскольку эти реки не эвтрофированы (таблица 1). Более того, в бассейнах этих рек и на побережье залива Академии отсутствуют населенные пункты, которые могли бы служить источником биогенных веществ. Из-за высоких полусуточных приливов в акватории отсутствует промышленное рыболовство, которое могло бы стать причиной эвтрофикации залива.
Эпизодическим источником биогенных веществ может служить погибший после нереста лосось. Общий путь влияния погибшего лосося на пресноводные и прибрежные (эстуарные) экосистемы можно представить через пищевую цепь: тушка лосося–гетеротрофная деструкция–биогенные вещества–первичная продукция–второе звено–третье звено [44, 45]. Существуют прямые доказательства импульсного увеличения концентраций ионов аммония и неорганического фосфора в водотоках, в которые заходит на нерест лосось [19, 25, 27, 31, 34, 44]. Массовая миграция горбуши и ранней кеты в реки заливов Академии и Николая начинается в третьей декаде июля со стороны юго-востока, т.е. Сахалинского залива [8]. Таким образом, в июле 2016 года наблюдения проводились перед началом массового хода лосося, а точнее в начальный период его миграции к месту нереста. Этот вывод подтверждают наши наблюдения на лодке. 14 июля на пути к устью р. Сыран, после косы Бетти, лодка попала в стадо питавшихся рыбой белух в количестве 100–150 голов, и эхолот лодки регистрировал рыбу в большом количестве. Наблюдения за миграцией белухи подтверждают многочисленные скопления этих животных в кутовой части Ульбанского залива [1, 22]. При исследовании эстуария р. Ульбан, 26 июля мы встретили в устье реки двух рыбаков, которые сетью вдоль берега ловили кету и нерку, однако мертвой рыбы не видели.
Мы полагаем, что эвтрофикация залива через бактериальное разложение мертвого лосося [45] идет, но медленно и не является единственно возможным вариантом. Более эффективным является путь поедания лосося хищниками (белуха, косатка, лахтак) при его подходе к нересту. Такой вариант эвтрофикации вод прибрежных акваторий фекалиями млекопитающих хищников был доказан изотопными исследованиями [42]. По-видимому, этот вариант эвтрофикации реализуется и в заливе Академии. Наиболее существенные концентрации биогенных веществ в 2020 году наблюдаются на входе в залив Академии и в кутовой части Ульбанского залива (рис. 4–7). Именно здесь часто встречались косатки и лахтаки. По-видимому, фекалии этих млекопитающих создают потоки биогенных веществ и увеличивают скорость формирования первичной продукции, являющейся питательной основой для зоопланктона (копепод) [2], которые служат пищей гренландским китам. Однако эти предположения нуждаются в дополнительных исследованиях и проверке.
ВЫВОДЫ
Сравнение гидрохимических данных залива Академии, полученных в летний (2016 г.) и осенний (2020 г.) сезоны, указывает на то, что в осенний сезон воды залива подвержены эвтрофикации. Наиболее вероятным источником биогенных веществ в заливе, на берегах которого отсутствуют поселки и промышленное рыболовство, может быть пришедший на нерест лосось. Наиболее существенные концентрации биогенных веществ в 2020 г. наблюдаются на входе в залив и в его кутовой части. Сделано предположение, что эвтрофикация залива осуществляется фекалиями млекопитающих (лахтаки, белухи, косатки), которые питаются пришедшим на нерест лососем. Фекалии млекопитающих создают потоки биогенных веществ и увеличивают первичную продукцию, которая является питательной основой для зоопланктона, что объясняет причину ранее обнаруженного высокого содержания зоопланктона в данной акватории [2].
Благодарности: Авторы благодарят членов экипажей и научный состав НИС “Профессор Гагаринский” и НИС “Академик Опарин” за всестороннюю помощь в экспедиционных исследованиях.
Источник финансирования. Работа выполнена при финансовой поддержке гранта РФФИ, 21-55-53 015 и госбюджетных тем 121-21500052-9 и 121021700346-7.
Список литературы
Берзин А.А., Владимиров В.Л. Современное распределение и численность китообразных в Охотском море // Биология моря. 1989. № 2. С. 15–23.
Волков А.Ф. Интегральные схемы количественного распределения массовых видов зоопланктона дальневосточных морей и северо-западной части Тихого океана по среднемноголетним данным (1984–2006) // Изв. ТИНРО. 2008. Т. 154. С. 135–143.
ГОСТ 17.1.4.02.–90 Методика спектрофотометрического определения хлорофилла а. М.: ИПК Издательство стандартов, 1999 С. 790–804.
Дзюбан А.Н. Первичные продукционные процессы в воде Тугурского залива Охотского моря // Океанология. 2003. Т. 43. №. 3. С. 383–392.
Золотухин С.Ф. Предварительная оценка нерестового фонда кеты и горбуши Тугуро-Чумиканского района (Охотское море) // Чтения памяти Владимира Яковлевича Леванидова. 2005. Вып. 3. С. 622–628.
Иванков В.Н., Иванкова Е.В., Кульбачный С.Е. Внутривидовая экологическая и темпоральная дифференцация у тихоокеанских лососей. Эколого-темпоральные расы и темпоральные популяции кеты Oncorhynchus keta // Изв. ТИНРО. 2010. Т. 163. С. 91–105.
Канзепарова А.Н. Особенности биологии и современное состояние запасов горбуши (Oncorhynchus gorbuscha) северо-западного побережья Охотского моря // Дис. … канд. биол. наук: 03.02.06. Владивосток, 2018. 148 с.
Кульбачный С.Е. Экология и структура популяций кеты северо-западной части континентального побережья Охотского моря // Дис. … канд. биол. наук: 03.02.06. Владивосток, 2010. 148 с.
Лоция Охотского моря. Выпуск 2. Северная часть моря. Изд. УНГС ВМФ СССР. 1960. 200 с.
Мельников В.В., Федорец Ю.В. Распределение зоопланктона и полярного кита Balaena mysticetus Linnaeus, 1758 в заливе Академии Охотского моря // Биология моря. 2016. Т. 42. № 3. С. 189–194.
Мельников В.В., Федорец Ю.В., Семкин П.Ю. и др. Гидробиологические особенности заливов Шантарского района в связи с летним нагулом полярных китов охотской популяции // Океанология. 2020. Т. 60. № 2. С. 244 – 249.
Павлова Г.Ю., Тищенко П.Я., Волкова Т.И. и др. Интеркалибрация метода Бруевича для определения общей щелочности в морской воде // Океанология. 2008. Т.48. №3. С. 477–483.
Тищенко П.П., Тищенко П.Я., Еловская О.А. и др. Условия формирования первичной продукции фитопланктона в заливе Восток (Японское море) весной 2016 г. // Изв. ТИНРО. 2019. Т. 198. С. 164–185.
Тищенко П.Я., Лобанов В.Б., Шулькин В.М. и др. Комплексные исследования прибрежных акваторий Японского и Охотского морей, находящихся под влиянием речного стока (71-й рейс научно-исследовательского судна “Профессор Гагаринский”) // Океанология. 2018. Т. 58. № 2. С 340–342.
Тищенко П.Я., Тищенко П.П., Звалинский В.И. и др. Карбонатная система Амурского залива (Японское море) летом 2005 г. // Изв. ТИНРО. 2006. Т. 146. С. 235–255.
Тищенко П.Я. Павлова Г.Ю., Салюк А.Н., Бычков А.С. Карбонатная система и растворенный кислород Японского моря. Анализ биологического и температурного фактора // Океанология. 1998. Т. 38. № 5. С. 678–684.
Чернявский В.И., Жигалов И.А., Матвеев В.И. Океанологические основы формирования зон высокой биологической продуктивности // Гидрометеорология и гидрохимия морей. Т. 9. Охотское море., вып. 2. С.-Пб.:Гидрометеоиздат. 1993. С. 157–160.
Чернявский В.И., Бобров В.А., Афанасьев Н.Н. Основные продуктивные зоны Охотского моря // Изв. ТИНРО. 1981. Т. 105. С. 20–25.
Шестёркина Н.М., Таловская В.С. Особенности формирования химического состава водотоков бассейна Тугурского залива Охотского моря // География и природные ресурсы. 2010. № 2. С. 99–105.
Шпак О.В., Парамонов А.Ю. Гренландский кит Balaena mysticetus Linnaeus, 1758 в западной части Охотского моря (2009−2016 гг.): особенности распределения, поведение, угрозы // Биология моря. 2018. Т. 44. № 3. С. 179–186.
Шпак О.В., Парамонов А.Ю. Наблюдения за гренландскими китами (Balaena mysticetus) в Шантарском регионе Охотского моря; потенциальные угрозы для восстановления численности популяции // Морские млекопитающие Голарктики. 2015. Т. 2. С. 334–342.
Шпак О.В., Парамонов А.Ю. Наблюдения за белухами (Delphinapterus leucas), косатками (Orcinus orca), гладкими китами (Balaenidae) в Ульбанском заливе Охотского моря // Морские млекопитающие Голарктики. 2012. Т. 2. С. 395–400.
Шунтов В.П. Биологические ресурсы Охотского моря. М.: Агропромиздат. 1985. 224 с.
Andersen J.H., Schlüter L., Ærtebjerg G. Coastal eutrophication: recent developments in definitions and implications for monitoring strategies // J. Plankton Research. 2006. V. 28. P. 621–628.
Brickel D.C., Goering J.J. The influence of decomposing salmon on water chemistry // Report No. IWR-12. Alaska: University of Alaska. Institute of Water Resources, 1971. 26 p.
Bricker S.B., Ferreira J.G., Simas T. An integrated methodology for assessment of estuarine trophic status // Ecological Modelling. 2003. V. 169. P. 39–60.
Cak A.D., Chaloner D.T., Lamberti G.A. Effects of spawning salmon on dissolved nutrients and epilithon in coupled stream-estuary systems of southeastern Alaska // Aquat. Sci. 2008. V. 70. P. 169–178.
Carpenter J.H. The Chesapeake Bay Institute technique for the Winkler dissolved oxygen method // Limnol. Oceanogr. 1965. V. 10. P. 141–143.
Grasshoff K., Ehrhardt M., Kremling K. Methods of Seawater Analysis. Weinheim/Deerfield Beach, Florida: Verlag Chemie. 1983. 419 p.
HELCOM. Development of tools for assessment of eutrophication in the Baltic sea. Baltic Sea Environment Proceedings. 2006. No. 104. Helsinki Commission. 64 p.
Holtgrieve G.W., Schindler D.E. Marine-derived nutrients, bioturbation, and ecosystem metabolism: reconsidering the role of salmon in streams // Ecology. 2011. V. 92. No 2. P. 373–385.
Ivashchenko Yu., Clapham Ph. Bowhead whales Balaena mysticetus in the Okhotsk Sea // Mammal Rev. 2010. V. 40. No. 1. P. 65–89.
Lowry L.F., Sheffield G., Craighead J.G. Bowhead whale feeding in the Alaskan Beaufort Sea, based on stomach contents analyses // J. Cetacean Res. Manage. 2004. V. 6. No. 3. P. 215–223.
Moore J.W., Schindler D.E., Carter J.L. et al. Biotic control of stream fluxes: Spawning salmon drive nutrient and matter export // Ecology. 2007. V. 88. P. 1278–1791.
Nixon S.F. Eutrophication and the macroscope // Hydrobiologia. 2009. V. 629. P. 5–19.
Nixon S.F. Coastal marine eutrophication: a definition, social causes, and future concerns // Ophelia. 1995. V. 41. P. 199–219.
NOWPAP CEARAC. Application of the NOWPAP Common Procedure for Eutrophication Assessment in Selected Sea Areas in the NOWPAP Region, 2014. 95 p.
OSPAR Commission. OSPAR integrated report 2003 on the eutrophication status of the OSPAR maritime area based upon the first application of the comprehensive procedure. 2003. 59 p.
Pitkowicz R.M. On the apparent oxygen utilization and the preformed phosphate in the oceans // Limnol. Oceanogr., 1971. V. 16. P. 39–42.
Redfield A.C., Ketchum B.H, Richards F.A. The influence of organisms on the composition of seawater // The Sea. M.N.Hill. Ed. New York: Interscience. 1963. V. 2. P. 26–77.
Rogachev K.A., Carmack E.C., Foreman M.G.G. Bowhead whales feed on plankton concentrated by estuarine and tidal currents in Academy Bay, Sea of Okhotsk // Cont. Shelf Res., 2008. V. 28. P. 1811–1826.
Roman J., Nevins J., Altabet M. et al. Endangered Right Whales enhance primary productivity in the Bay of Fundy // PLoS ONE. 2016. V. 11. No. 6. e0156553. doi:. pone.0156553https://doi.org/10.1371/journal
Sarthou G., Timmermans K.R., Blain S., et al. Growth physiology and fate of diatoms in the ocean: a review // J. Sea Research. 2005. V. 53. P. 25–42.
Verspoor J.J., Braun D.C., Stubbs M.M., Reynolds J.D. Persistent ecological effects of a salmon-derived nutrient pulse on stream invertebrate communities // Ecosphere. 2011. V. 2. Article 18. P. 1–17.
Watkinson S. Life after death: The importance of salmon carcasses to British Columbia’s watersheds // Arctic. 2000. V. 53. No 1. P. 92–99.
Weiss R.F. The solubility of nitrogen, oxygen and argon in water and seawater // Deep-Sea Research. 1970. V. 17. P. 721–735.
Zehr J.P., Ward B.B. Nitrogen cycling in the ocean: new perspectives on processes and paradigms // Appl. Environm. Microbiology. 2002. V. 68. P. 1015–1024.
Дополнительные материалы отсутствуют.


