Океанология, 2022, T. 62, № 1, стр. 59-63
Влияние карбонатной щелочности на растворимость современных морских фосфоритов
А. В. Савенко 1, *, В. С. Савенко 2
1 Московский государственный университет им. М.В. Ломоносова,
геологический факультет
Москва, Россия
2 Московский государственный университет им. М.В. Ломоносова,
географический факультет
Москва, Россия
* E-mail: Alla_Savenko@rambler.ru
Поступила в редакцию 04.03.2021
После доработки 05.07.2021
Принята к публикации 17.08.2021
- EDN: JADTXI
- DOI: 10.31857/S0030157422010130
Аннотация
Экспериментально изучено взаимодействие современных (голоценовых) фосфоритовых конкреций с растворами, имитирующими поровые воды осадков высокопродуктивных районов океана с повышенной карбонатной щелочностью. Подтвержден ранее установленный факт увеличения концентрации растворенного фосфора с возрастанием карбонатной щелочности при постоянном значении pH. При карбонатной щелочности, соответствующей таковой в морской воде, происходит удаление фтора из раствора предположительно вследствие доминирования реакции карбонатизации апатита по схеме ${\text{C}}{{{\text{a}}}_{{{\text{10}}}}}{{{\text{(P}}{{{\text{O}}}_{{\text{4}}}}{\text{)}}}_{{\text{6}}}}{{{\text{F}}}_{{\text{2}}}} + x{\text{HCO}}_{{\text{3}}}^{ - } + x{{{\text{F}}}^{ - }} = {\text{C}}{{{\text{a}}}_{{{\text{10}}}}}{{{\text{(P}}{{{\text{O}}}_{{\text{4}}}}{\text{)}}}_{{{\text{6}}{\kern 1pt} - {\kern 1pt} x}}}{{{\text{(C}}{{{\text{O}}}_{{\text{3}}}}{\text{)}}}_{x}}{{{\text{F}}}_{{{\text{2}}{\kern 1pt} + {\kern 1pt} x}}} + x{\text{PO}}_{{\text{4}}}^{{{\text{3}} - }} + x{{{\text{H}}}^{ + }}.$ Рост карбонатной щелочности приводит к снижению удаления фтора, что, вероятно, связано с усилением карбонатизации апатита по другой схеме: ${\text{C}}{{{\text{a}}}_{{{\text{10}}}}}{{{\text{(P}}{{{\text{O}}}_{{\text{4}}}}{\text{)}}}_{{\text{6}}}}{{{\text{F}}}_{{\text{2}}}} + {\text{HCO}}_{{\text{3}}}^{ - } = {\text{C}}{{{\text{a}}}_{{{\text{10}}}}}{{{\text{(P}}{{{\text{O}}}_{{\text{4}}}}{\text{)}}}_{{\text{6}}}}{\text{С}}{{{\text{O}}}_{{\text{2}}}} + {\text{2}}{{{\text{F}}}^{ - }} + {{{\text{H}}}^{ + }}.$
Во всех существующих гипотезах генезиса морских фосфоритов наименее изучены физико-химические механизмы выделения апатитовых фаз и перераспределения рассеянного апатитового фосфора в донных отложениях, приводящие, в конечном счете, к формированию фосфоритовых рудных тел [1, 2]. Благодаря экспериментальным исследованиям [3–5, 16, 19–22], условия образования разных видов апатитов (гидроксил-, фтор- и фторкарбонат-апатита) в океане установлены достаточно надежно, однако сведения о механизмах перераспределения апатитового фосфора в донных отложениях весьма ограничены.
Ранее было экспериментально установлено, что в морской воде и растворах, имитирующих поровые воды осадков высокопродуктивных районов океана, для всех апатитовых фаз характерно увеличение равновесной концентрации растворенного фосфора с ростом карбонатной щелочности [4, 14, 15]. Увеличение карбонатной щелочности поровых растворов вниз от границы раздела вода–дно должно вызывать появление сонаправленного градиента концентрации растворенного фосфора и возникновение его восходящих потоков, которые обеспечивают переотложение апатита в верхних слоях донных отложений. Первоначально положительная корреляция концентрации фосфора и карбонатной щелочности объяснялась образованием прочных карбонатно-фосфатно-кальциевых комплексов [16, 18]. Впоследствии эта гипотеза не получила экспериментального подтверждения [14] и был предложен альтернативный механизм влияния карбонатной щелочности на равновесную с апатитами концентрацию фосфора, связанный с карбонатизацией апатитовых фаз и высвобождением части структурного фосфатного фосфора в результате изоморфного замещения ${\text{СO}}_{3}^{{2 - }}$ → ${\text{PO}}_{4}^{{3 - }}$ [13–15, 19].
Поскольку растворимость апатитов сильно зависит от содержания фтора, для понимания механизма диагенетической мобилизации фосфора большое значение имеет поведение фтора в процессе карбонатизации апатитовых фаз, происходящей при повышенных значениях карбонатной щелочности. В связи с этим нами выполнено экспериментальное изучение поведения фтора и фосфора при взаимодействии современных морских фосфоритов с карбонатсодержащими растворами – аналогами поровых вод осадков высокопродуктивных районов океана.
МАТЕРИАЛ И МЕТОДИКА ИССЛЕДОВАНИЙ
В экспериментах были использованы 2 образца морских голоценовых фосфоритов (рыхлая и плотная конкреции) с шельфа Юго-Западной Африки, любезно предоставленные Г.Н. Батуриным. Химический состав конкреций приведен в табл. 1.
При приготовлении растворов, имитирующих поровые воды осадков высокопродуктивных районов океана, учитывалось, что основным фактором метаморфизации их солевого состава является процесс сульфат-редукции, в ходе которого осуществляется окисление органического вещества сульфатами, а основное количество образующегося сероводорода связывается в сульфидах железа:
(1)
$\begin{gathered} {\text{9}}{{{\text{C}}}_{{{\text{орг}}}}} + {\text{4SO}}_{{\text{4}}}^{{{\text{2}} - }} + {\text{4FeOOH}} + {\text{3}}{{{\text{H}}}_{{\text{2}}}}{\text{O}} = \\ = {\text{9HCO}}_{{\text{3}}}^{ - } + {\text{4FeS}} + {{{\text{H}}}^{ + }}. \\ \end{gathered} $Таблица 2.
Изменение величин pH, карбонатной щелочности, концентрации кальция, фосфатного фосфора и фтора в растворах, имитирующих поровые воды осадков высокопродуктивных районов океана, при взаимодействии с фосфоритовыми конкрециями
| Модельный поровый раствор | pH | Alk ≈ ${\text{HCO}}_{{\text{3}}}^{ - }$, мМ | [Ca], мМ | [P-PO4], мкМ | [F], мг/л | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| исход. | конеч. | исход. | конеч. | ΔAlk | исход. | конеч. | Δ[Ca] | исход. | конеч. | Δ[P] | исход. | конеч. | Δ[F] | |
| Плотная конкреция | ||||||||||||||
| 0-PS | 7.44 | 7.44 | 2.25 | 2.70 | 0.45 | 8.63 | 8.40 | –0.23 | 0.10 | 6.98 | 6.88 | 1.31 | 0.72 | –0.59 |
| 1-PS | 7.44 | 7.45 | 6.92 | 6.45 | –0.47 | 8.40 | 8.13 | –0.27 | 0.10 | 9.55 | 9.45 | 1.30 | 0.81 | –0.49 |
| 2-PS | 7.45 | 7.43 | 13.60 | 12.35 | –1.25 | 8.15 | 7.80 | –0.35 | 0.10 | 10.9 | 10.8 | 1.30 | 0.91 | –0.39 |
| 3-PS | 7.48 | 7.46 | 20.53 | 18.30 | –2.23 | 7.98 | 7.55 | –0.43 | 0.10 | 11.8 | 11.7 | 1.31 | 1.01 | –0.30 |
| 4-PS | 7.49 | 7.45 | 27.12 | 24.33 | –2.79 | 7.88 | 7.39 | –0.49 | 0.10 | 12.8 | 12.7 | 1.29 | 1.09 | –0.20 |
| 5-PS | 7.50 | 7.46 | 33.85 | 30.85 | –3.00 | 7.83 | 7.28 | –0.55 | 0.10 | 13.7 | 13.6 | 1.29 | 1.17 | –0.12 |
| Рыхлая конкреция | ||||||||||||||
| 0-PS | 7.44 | 7.44 | 2.25 | 2.83 | 0.58 | 8.63 | 9.03 | 0.40 | 0.10 | 11.4 | 11.3 | 1.31 | 0.58 | –0.73 |
| 1-PS | 7.44 | 7.44 | 6.92 | 6.55 | –0.37 | 8.40 | 8.70 | 0.30 | 0.10 | 12.6 | 12.5 | 1.30 | 0.65 | –0.65 |
| 2-PS | 7.45 | 7.42 | 13.60 | 12.53 | –1.07 | 8.15 | 8.35 | 0.20 | 0.10 | 13.6 | 13.5 | 1.30 | 0.76 | –0.54 |
| 3-PS | 7.48 | 7.45 | 20.53 | 18.53 | –2.00 | 7.98 | 8.00 | 0.02 | 0.10 | 14.4 | 14.3 | 1.31 | 0.86 | –0.45 |
| 4-PS | 7.49 | 7.46 | 27.12 | 24.92 | –2.20 | 7.88 | 7.85 | –0.03 | 0.10 | 15.3 | 15.2 | 1.29 | 0.95 | –0.34 |
| 5-PS | 7.50 | 7.48 | 33.85 | 31.55 | –2.30 | 7.83 | 7.75 | –0.08 | 0.10 | 15.8 | 15.7 | 1.29 | 1.04 | –0.25 |
В пластиковые емкости объемом 330 мл вносили по 4 г растертых до пудры образцов фосфоритов, добавляли по 200 мл одного из модельных поровых растворов и небольшие аликвоты (0.03–0.5 мл) 1 М HCl, сразу после чего емкости герметично закрывали. Одновременно были поставлены холостые опыты с теми же растворами, но без фосфоритов.
В течение 3 недель плотно закрытые пробы ежедневно по 8–10 часов перемешивали на шейкере и еще 6 суток выдерживали без перемешивания, затем в отсутствие контакта с воздухом в них измеряли величину pH и отфильтровывали растворы через мембранный фильтр с размером пор 0.22 мкм. В фильтрате определяли содержание фторидов методом прямой потенциометрии, фосфатов колориметрическим методом с молибдатом аммония и аскорбиновой кислотой, а также кальция и карбонатной щелочности методом объемного титрования [11, 17]. Погрешность измерений составила ±0.005 ед. pH и ±3% для остальных компонентов.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
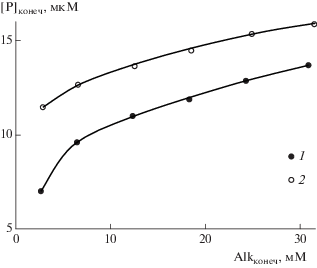
Результаты экспериментов (табл. 2) показали, что после взаимодействия с обоими образцами современных океанских фосфоритов концентрация растворенного фосфора увеличивается с возрастанием карбонатной щелочности (рис. 1). В опытах с плотной конкрецией концентрация фосфора в поровых растворах увеличивается от 6.98 мкМ при щелочности 2.70 мМ до 13.7 мкМ при щелочности 30.85 мМ. Рыхлая конкреция характеризуется более высокой растворимостью, но меньшим по абсолютной величине ростом концентрации растворенного фосфора: при щелочности 2.83 мМ концентрация фосфора составляет 11.4 мкМ, увеличиваясь до 15.8 мкМ при щелочности 31.55 мМ. Таким образом, результаты наших экспериментов подтверждают установленный в [4, 14, 15] факт увеличения концентрации фосфора с возрастанием карбонатной щелочности в поровых растворах, контактирующих с апатитовыми фазами.
Рис. 1.
Зависимость концентрации растворенного фосфора от величины карбонатной щелочности после взаимодействия с фосфоритовыми конкрециями. 1 – плотная конкреция, 2 – рыхлая конкреция.
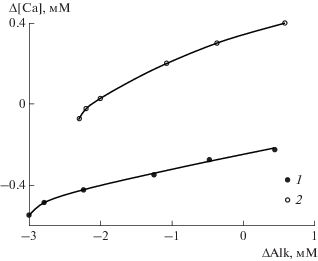
Конечная концентрация растворенного кальция с ростом карбонатной щелочности снижается (табл. 2), но эта зависимость не связана с осаждением карбоната кальция, поскольку изменение концентрации кальция и щелочности не соответствует стехиометрии реакции ${\text{C}}{{{\text{a}}}^{{{\text{2}} + }}} + {\text{HCO}}_{{\text{3}}}^{ - }$ = $ = {\text{CaC}}{{{\text{O}}}_{{\text{3}}}} + {{{\text{H}}}_{{\text{2}}}}{\text{O}}$ (рис. 2). Поскольку природные фосфориты, использованные в экспериментах, содержат примесь терригенного и биогенного осадочного материала, причины обратной зависимости между концентрацией кальция и карбонатной щелочностью однозначно установить трудно. Однако ясно, что указанная связь не обусловлена образованием карбоната кальция, с которым могли бы частично соосаждаться фосфаты и фториды.
Рис. 2.
Зависимость между изменением концентрации растворенного кальция и величины карбонатной щелочности при взаимодействии с фосфоритовыми конкрециями. 1 – плотная конкреция, 2 – рыхлая конкреция.
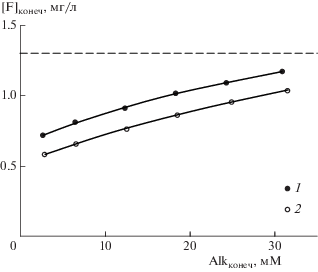
Фтор при взаимодействии с фосфоритовыми конкрециями удаляется из морской воды и модельных поровых растворов с той же исходной концентрацией фторидов (табл. 2), при этом степень его удаления снижается с возрастанием карбонатной щелочности (рис. 3).
Рис. 3.
Зависимость концентрации растворенного фтора от величины карбонатной щелочности после взаимодействия с фосфоритовыми конкрециями. 1 – плотная конкреция, 2 – рыхлая конкреция. Пунктиром отмечена концентрация фтора в нормальной морской воде (1.3 мг/л).
Согласно существующим представлениям [6–10], карбонатизация апатитов может идти несколькими путями, например, c замещением структурного фосфата ${\text{PO}}_{4}^{{3 - }}$ комплексом ${\text{C}}{{{\text{O}}}_{{\text{3}}}}{{{\text{F}}}^{{{\text{3}} - }}}$
(2)
$\begin{gathered} {\text{C}}{{{\text{a}}}_{{{\text{10}}}}}{{{\text{(P}}{{{\text{O}}}_{{\text{4}}}}{\text{)}}}_{{\text{6}}}}{{{\text{F}}}_{{\text{2}}}} + x{\text{HCO}}_{{\text{3}}}^{ - } + x{{{\text{F}}}^{ - }} = \\ = {\text{C}}{{{\text{a}}}_{{{\text{10}}}}}{{{\text{(P}}{{{\text{O}}}_{{\text{4}}}}{\text{)}}}_{{{\text{6}}{\kern 1pt} - {\kern 1pt} x}}}{{{\text{(C}}{{{\text{O}}}_{{\text{3}}}}{\text{)}}}_{x}}{{{\text{F}}}_{{{\text{2}}{\kern 1pt} + {\kern 1pt} x}}} + x{\text{PO}}_{{\text{4}}}^{{{\text{3}} - }} + x{{{\text{H}}}^{ + }} \\ \end{gathered} $(3)
$\begin{gathered} {\text{C}}{{{\text{a}}}_{{{\text{10}}}}}{{{\text{(P}}{{{\text{O}}}_{{\text{4}}}}{\text{)}}}_{{\text{6}}}}{{{\text{F}}}_{{\text{2}}}} + {\text{HCO}}_{{\text{3}}}^{ - } = \\ = {\text{C}}{{{\text{a}}}_{{{\text{10}}}}}{{{\text{(P}}{{{\text{O}}}_{{\text{4}}}}{\text{)}}}_{{\text{6}}}}{\text{С}}{{{\text{O}}}_{{\text{2}}}} + {\text{2}}{{{\text{F}}}^{ - }} + {{{\text{H}}}^{ + }}. \\ \end{gathered} $По-видимому, в области относительно небольших значений карбонатной щелочности преобладает реакция (2), приводя к снижению концентрации фтора в растворе, тогда как при высоких значениях карбонатной щелочности в большей степени развивается реакция (3), что сопровождается увеличением концентрации растворенного фтора. Таким образом, полученные экспериментальные данные могут быть объяснены одновременным протеканием двух разнонаправленных по отношению к фтору реакций карбонатизации апатита (2) и (3).
ВЫВОДЫ
1. При взаимодействии современных (голоценовых) морских фосфоритов с растворами, имитирующими поровые воды осадков высокопродуктивных районов океана, концентрация растворенного фосфора при постоянном значении pH возрастает пропорционально величине карбонатной щелочности.
2. Взаимодействие фосфоритов с фторсодержащими поровыми растворами приводит к удалению растворенного фтора, которое уменьшается с ростом карбонатной щелочности. Предполагается, что карбонатизация апатита протекает одновременно по двум схемам: ${\text{C}}{{{\text{a}}}_{{{\text{10}}}}}{{{\text{(P}}{{{\text{O}}}_{{\text{4}}}}{\text{)}}}_{{\text{6}}}}{{{\text{F}}}_{{\text{2}}}}$ + + $x{\text{HCO}}_{{\text{3}}}^{ - }$ + xF– = ${\text{C}}{{{\text{a}}}_{{{\text{10}}}}}{{{\text{(P}}{{{\text{O}}}_{{\text{4}}}}{\text{)}}}_{{{\text{6}}{\kern 1pt} - {\kern 1pt} x}}}{{{\text{(C}}{{{\text{O}}}_{{\text{3}}}}{\text{)}}}_{x}}{{{\text{F}}}_{{{\text{2}}{\kern 1pt} + {\kern 1pt} x}}}$ + + $x{\text{PO}}_{{\text{4}}}^{{{\text{3}} - }}$ + xH+ и ${\text{C}}{{{\text{a}}}_{{{\text{10}}}}}{{{\text{(P}}{{{\text{O}}}_{{\text{4}}}}{\text{)}}}_{{\text{6}}}}{{{\text{F}}}_{{\text{2}}}}$ + ${\text{HCO}}_{{\text{3}}}^{ - }$ = $ = {\text{C}}{{{\text{a}}}_{{{\text{10}}}}}{{{\text{(P}}{{{\text{O}}}_{{\text{4}}}}{\text{)}}}_{{\text{6}}}}{\text{С}}{{{\text{O}}}_{{\text{2}}}} + {\text{2}}{{{\text{F}}}^{ - }} + {{{\text{H}}}^{ + }}.$ Результатом первой реакции служит переход фтора из растворенного состояния в состав твердой фазы апатита, второй – наоборот, поступление структурного фтора твердой фазы в раствор. Интенсивность второй реакции при возрастании карбонатной щелочности, вероятно, усиливается, и при достижении значений >35 мМ происходит компенсация удаления фтора из раствора по первой схеме.
Список литературы
Батурин Г.Н. Фосфориты на дне океанов. М.: Наука, 1978. 231 с.
Батурин Г.Н. Фосфатонакопление в океане. М.: Наука, 2004. 464 с.
Батурин Г.Н., Савенко А.В. Проблема фосфатизации известняков в свете экспериментальных исследований // Океанология. 2002. Т. 42. № 2. С. 210–217.
Батурин Г.Н., Савенко В.С. Новые данные о растворимости природных фосфатов в морской воде // Докл. АН СССР. 1980. Т. 255. № 3. С. 726–728.
Батурин Г.Н., Савенко В.С. О растворимости фосфатов кальция в морской воде // Геохимия. 1985. № 4. С. 548–553.
Белов Н.В. Об изоморфных замещениях в группе апатита // Докл. АН СССР. 1939. Т. 22. № 2. С. 90–93.
Блисковский В.З. О курските и франколите // Литология и полезн. ископаемые. 1976. № 3. С. 75–84.
Борнеман-Старынкевич И., Белов Н.В. Об изоморфных замещениях в карбонат-апатите // Докл. АН СССР. 1940. Т. 26. № 8. С. 811–813.
Борнеман-Старынкевич И., Белов Н.В. О карбонат-апатитах // Докл. АН СССР. 1953. Т. 90. № 1. С. 89–92.
Кнубовец Р.Г. Некоторые кристаллохимические особенности реальной структуры фосфатов кальция // Исследование фосфатов кальция физическими методами. Новосибирск: Наука, 1979. С. 22–29.
Лурье Ю.Ю. Унифицированные методы анализа вод. М.: Химия, 1971. 375 с.
Немлихер Ю.Г., Батурин Г.Н., Калласте Т.Э., Мурдмаа И.О. Преобразование гидроксил-апатита костного фосфата со дна океана в ходе фоссилизации // Литология и полезн. ископаемые. 2004. № 5. С. 539–551.
Савенко А.В. Физико-химический механизм образования современных диагенетических фосфоритов в океане // Докл. Акад. наук. 2008. Т. 418. № 4. С. 526–529.
Савенко А.В. О физико-химическом механизме диагенетического формирования современных океанских фосфоритов // Геохимия. 2010. № 2. С. 208–215.
Савенко А.В. Физико-химический механизм перераспределения фосфора в осадках высокопродуктивных районов океана (по данным экспериментального моделирования) // Геохимия. 2014. № 5. С. 476–480.
Савенко В.С. О физико-химическом механизме образования морских фосфоритов // Докл. АН СССР. 1979. Т. 249. № 4. С. 972–976.
Савенко В.С. Введение в ионометрию природных вод. Л.: Гидрометеоиздат, 1986. 77 с.
Савенко В.С. Физико-химические аспекты формирования современных океанских фосфоритов // Геохимия. 1992. № 3. С. 377–388.
Савенко В.С., Савенко А.В. Физико-химический анализ процессов современного океанского фосфоритообразования. М.: ГЕОС, 2005. 142 с.
Atlas E.L., Pytcowicz R.M. Solubility behaviour of apatites in seawater // Limnol. and Oceanogr. 1977. V. 22. № 2. P. 290–300.
Jahnke R.A., Emerson S.R., Roe K.K., Burnett W.C. The present day formation of apatite in Mexican continental margin sediments // Geochim. Cosmochim. Acta. 1983. V. 47. № 2. P. 259–266.
Roberson C.E. Solubility implications of apatite in seawater // US Geol. Surv. Prof. Paper. 1966. V. 550-D. P. 178–185.
Дополнительные материалы отсутствуют.


