Океанология, 2022, T. 62, № 6, стр. 943-949
Состав и содержание микотоксинов в фукусовых водорослях Белого моря
Г. П. Кононенко 1, *, А. А. Буркин 1, А. А. Георгиев 2, М. Л. Георгиева 2, 3
1 Федеральный научный центр – Всероссийский научно-исследовательский институт
экспериментальной ветеринарии имени К.И. Скрябина и Я.Р. Коваленко
Москва, Россия
2 Московский государственный университет имени М.В. Ломоносова,
Биологический факультет
Москва, Россия
3 Научно-исследовательский институт по изысканию новых антибиотиков
имени Г.Ф. Гаузе
Москва, Россия
* E-mail: kononenkogp@mail.ru
Поступила в редакцию 18.02.2022
После доработки 26.04.2022
Принята к публикации 16.08.2022
- EDN: PRQZTV
- DOI: 10.31857/S0030157422050070
Аннотация
Методом иммуноферментного анализа выполнена сравнительная оценка содержания низкомолекулярных вторичных метаболитов микромицетов (микотоксинов) в талломах бурых водорослей Fucus vesiculosus, F. distichus и Ascophyllum nodosum, собранных в Кандалакшском заливе Белого моря. У всех исследованных фукоидов выявлен весь набор анализируемых микотоксинов, при этом содержание веществ сильно варьирует. Показано более высокое содержание микотоксинов для F. vesiculosus и F. distichus по сравнению с A. nodosum.
В Белом море важнейшую роль в донных сообществах играют бурые водоросли (отд. Ochrophyta, класс Phaeophyceae), среди них фукусовые водоросли (пор. Fucales) определяют облик донной растительности литорали и верхней сублиторали [4]. Известно пять видов беломорских фукоидов: Ascophyllum nodosum, Fucus distichus, F. serratus, F. vesiculosus и Pelvetia canaliculata [7, 14]. Характерной особенностью фукусовых водорослей является их способность к образованию экологических форм (экад), которые морфологически и анатомически существенно отличаются от типичных форм. В Кандалакшском заливе Белого моря в местообитаниях с рыхлыми грунтами (соленые марши, песчаная и илистая литораль, эстуарии) были обнаружены экады A. nodosum и F. vesiculosus. Одни из них представляют собой неприкрепленные, карликовые талломы, погруженные базальными концами в грунт (A. nodosum ecad muscoides и F. vesiculosus ecad muscoides), а другие – свободно лежащие на дне бентоплейстонные формы (A. nodosum ecad scorpioides и F. vesiculosus ecad vehovianus) [11, 12]. Помимо литоральных экад фукоидов в сублиторали произрастает F. vesiculosus f. giganteus [4]. Генетические исследования и наблюдения в природе продемонстрировали трансформацию экад одного вида друг в друга и генетическое единство экад этих видов макроводорослей [13].
Изучение грибов, связанных с водорослями-макрофитами, развивается со второй половины 20 века. Грибы образуют паразитические, сапротрофные, мутуалистические, патогенные или бессимптомные ассоциации со своими водорослевыми хозяевами; могут присутствовать во внутренних тканях как эндофиты или на поверхности как эпифиты [24, 29, 32]. Более 150 видов грибов из 80 родов известно в ассоциациях с макроводорослями [23], наиболее часто отмечают представителей аскомицетов из анаморфных родов (Acremonium, Penicillium, Cladosporium, Alternaria, Dendryphiella, Trichoderma, Phoma), которые встречаются и в других местообитаниях, но есть и специфические виды, выявленные только в ассоциациях с водорослями (Stigmidium ascophylli) [1, 2, 21, 28, 29, 32, 34, 36, 38]. Морские грибы считаются богатым источником уникальных вторичных метаболитов, охарактеризовано более 1000 новых соединений, из них 20% были получены из грибов, ассоциированных с макроводорослями [23, 30]. Эти метаболиты имеют большое структурное разнообразие (поликетиды, терпеноиды, пептиды, алкалоиды и др.) и значительный потенциал использования в различных биотехнологических направлениях [20, 27, 31, 33].
В то же время микромицеты могут продуцировать низкомолекулярные вторичные метаболиты, известные как токсины для теплокровных животных [17, 37]. Кроме многочисленных указаний на негативное действие этих соединений на живые системы, их считают инициаторами ответных реакций растения-хозяина на воздействие внешних факторов среды [18, 22]. Наиболее изучены микотоксины, продуцируемые грибами из родов Fusarium, Aspergillus, Penicillium, Alternaria и Cladosporium, которые встречаются в почве, на сельскохозяйственных растениях и продуктах питания [17, 19]. Грибы этих родов отмечают и в морских местообитаниях, в том числе в микобиоте фукусовых водорослей Белого моря [2, 8] и других морей [38]. Проведенный скриннинг-анализ талломов фукусовых макроводорослей выявил наличие в них широкого спектра микотоксинов [3, 9]. В данной работе приведена сравнительная оценка состава и содержания микотоксинов (16 веществ) в талломах видов F. vesiculosus, F. distichus, A. nodosum и их экологических форм.
МАТЕРИАЛЫ И МЕТОДЫ
Образцы талломов бурых водорослей отбирали в середине августа 2019 г. в Кандалакшском заливе Белого моря в типичных местообитаниях, характерных для данных макрофитов (рис. 1, табл. 1). Содержание микотоксинов было исследовано в трех видах и их экологических формах: F. vesiculosus (типичная форма, F. vesiculosus f. giganteus, F. vesiculosus ecad muscoides, F. vesiculosus ecad vehovianus); A. nodosum (типичная форма, A. nodosum ecad scorpioides, A. nodosum ecad muscoides); F. distichus (F. distichus f. edentatus, F. distichus f. latifrons). При наличии обрастаний, они тщательно удалялись с поверхности таллома. Образцы двух карликовых форм (F. vesiculosus ecad muscoides и A. nodosum ecad muscoides), а также образцы F. vesiculosus ecad vehovianus составляли из нескольких талломов, чтобы вес сухого образца был не менее 1 г.
Рис. 1.
Район исследования: 1 – о-в Кривой (66°30′ N, 33°08′ E), 2 – о-в Крестовый (66°31′ N 33°11′ E), 3 – п-ов Киндо (66°32′ N, 33°11′ E), 4 – о-в Молочница (66°30′ N 33°22′ E).
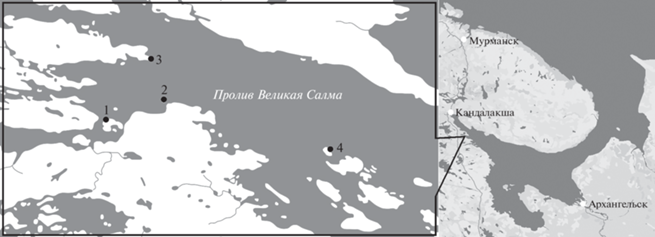
Таблица 1.
Характеристика образцов водорослей, отобранных в середине августа 2019 г. в проливе Великая Салма (Кандалакшский залив, Белое море)
| Таксон, зона сбора |
n | в том числе по местам сбора | |||
|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | ||
| Ascophyllum nodosum (L.) Le Jolis*, средняя/нижняя литораль | 10 | 7 | 3 | – | – |
| A. nodosum ecad scorpioides (Horn.) Hauck, литораль | 7 | 7 | – | – | – |
| A. nodosum ecad muscoides (Turner) Maximova et Mugue, верхняя литораль | 3 | 3 | – | – | – |
| Fucus distichus f. edentatus (De la Pylaie) Ju. Petrov, нижняя литораль/сублитораль | 13 | – | 3 | 10 | – |
| F. distichus f. latifrons (Foslie) Ju.Petrov, сублитораль/нижняя литораль | 7 | 7 | – | – | – |
| F. vesiculosus L., средняя/нижняя литораль | 10 | 7 | 3 | – | – |
| F. vesiculosus ecad vehovianus Maximova et Mugue, литораль | 4 | 4 | – | – | – |
| F. vesiculosus ecad muscoides (Cotton) Baker et Bohling, верхняя литораль | 1 | 1 | – | – | – |
| F. vesiculosus f. giganteus V. Vozh., сублитораль | 4 | – | – | – | 4 |
Примечание: n – число проб; прочерк означает, что образцы в данном месте не отбирали; места сбора: 1 – о-в Кривой (66°30′ N, 33°08′ E), 2 – о-в Крестовый (66°31′ N 33°11′ E), 3 – п-ов Киндо (66°32′ N, 33°11′ E), 4 – о-в Молочница (66°30′ N 33°22′ E). * Авторы видов даны согласно [7].
Непосредственно после сбора (в течение 1–2 ч) образцы высушивали в токе воздуха при температуре 60°С, транспортировали, сохраняя в суховоздушном состоянии, и затем измельчали в лабораторной мельнице. Для экстракции применяли смесь ацетонитрила и воды в объемном соотношении 84 : 16 при расходе 10 мл на 1 г навески. Экстракты после 10-кратного разбавления буферным раствором использовали для непрямого конкурентного иммуноферментного анализа (ИФА). Микотоксины – Т-2 токсин (Т-2), д-иацетоксисцирпенол (ДАС), дезоксиниваленол (ДОН), зеараленон (ЗЕН), фумонизины (ФУМ), альтернариол (АОЛ), охратоксин А (ОА), цитринин (ЦИТ), афлатоксин В1 (АВ1), стеригматоцистин (СТЕ), циклопиазоновую кислоту (ЦПК), микофеноловую кислоту (МФК), PR-токсин (PR), эмодин (ЭМО), роридин А (РОА) и эргоалкалоиды (ЭА) анализировали с помощью аттестованных коммерческих и исследовательских иммуноферментных тест-систем [6], данные обсчитывали в программе Microsoft Office Excel и представляли в виде минимального, максимального и среднего арифметического значений. Нижние пределы количественных измерений соответствовали 85% уровню связывания антител, наименьшие содержания в объекте, которые могли быть определены данным методом, составили 1 (АВ1, ЭА), 2 (Т-2, ОА, СТЕ), 5 (РОА), 10 (АОЛ, МФК, ЗЕН, ЭМО, ЦИТ, ЦПК), 40 (ДОН, ФУМ), 100 (ДАС, PR) нг/г.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
В талломах обследованных фукусовых водорослей присутствовали все анализируемые микотоксины (табл. 2). Если сравнивать метаболические профили (состав и количественное содержание микотоксинов) в разных фукоидах, то можно отметить некоторые особенности.
Таблица 2.
Встречаемость и содержание микотоксинов в талломах водорослей родов Fucus и Ascophyllum
| Мико- токсин | Содержание микотоксинов, мин.–макс., среднее (нг/г) | ||||||||
|---|---|---|---|---|---|---|---|---|---|
| F. vesiculosus n = 10 | F. vesiculosus ecad vehovianus n = 4 |
F. vesiculosus ecad muscoides n = 1 |
F. vesiculosus f. giganteus n = 4 |
F. distichus f. edentatus n = 13 |
F. distichus
f. latifrons n = 7 |
A. nodosum n = 10 |
A. nodosum f. scorpioides n = 7 |
A. nodosum
ecad muscoides n = 3 |
|
| Т-2 | 3–470 235 |
40–265 120 |
15 | 630–1120 845 |
10–400 83 |
16–120 49 |
24–150 45 |
3–20 14 |
4–12 7 |
| ДАС | 10 840–44 670 23 510 |
6030–8510 6980 |
6310 | 18 200–23 200 20 900 |
3980–31 700 16 400 |
8410–16 400 13 400 |
2510–12 400 5770 |
945–8510 5850 |
3350–5010 4110 |
| ДОН | 100–50 120 18 360 |
1740–7940 5050 |
515 | 48 100–141 200 79 800 |
230–10 000 3200 |
2000–33 900 12 400 |
725–6150 1600 |
100–1120 660 |
54–255 150 |
| ЗЕН | 250–2750 1230 |
515–1070 740 |
340 | 1550–5370 3850 |
330–3980 1060 |
525–5010 2110 |
125–1480 500 |
315–795 530 |
200–325 280 |
| ФУМ | 1230–11 220 5680 |
2660–9660 6360 |
3020 | 16 600–30 900 25 700 |
870–25 100 8360 |
3060–15 800 8790 |
685–4070 1390 |
2750–6240 4270 |
1590–2540 2040 |
| АОЛ | 1000–24 000 13 000 |
2290–8910 5010 |
1230 | 11 200–28 200 20 800 |
790–31 600 9060 |
500–6310 3410 |
260–1260 595 |
290–4840 1550 |
275–740 550 |
| ОА | 55–455 200 |
40–79 58 |
25 | 165–470 280 |
83–1000 290 |
250–680 485 |
31–200 74 |
48–125 91 |
25–38 32 |
| ЦИТ | 400–6310 3045 |
500–795 640 |
265 | 2820–5250 3650 |
680–7940 2890 |
1000–2340 1740 |
270–945 490 |
630–2040 1260 |
76–415 230 |
| АВ1 | 78–830 510 |
47–180 135 |
26 | 525–1510 945 |
58–500 225 |
100–315 210 |
25–94 38 |
23–85 54 |
8–25 16 |
| СТЕ | 225–4730 1840 |
310–470 380 |
200 | 4170–5010 4670 |
400–4470 1220 |
630–3020 1700 |
105–300 185 |
130–525 345 |
47–200 125 |
| ЦПК | 130–11 500 3770 |
195–760 440 |
100 | 3390–10 000 5540 |
100–3160 670 |
400–2600 1570 |
125–860 325 |
140–795 520 |
50–130 83 |
| PR | 760–28 200 17 000 |
13 200–25 100 17 900 |
7940 | 28 200–39 800 36 900 |
1260–26 600 9410 |
7590–16 600 12 100 |
100–350 160 |
2920–25 100 17 400 |
2290–8320 6070 |
| МФК | 795–19 300 5560 |
770–2240 1440 |
405 | 10 000–44 700 26 800 |
675–22 400 3950 |
3160–20 000 9760 |
3800–19 300 9030 |
405–1970 1430 |
130–510 280 |
| ЭМО | 25–5010 2000 |
160–245 190 |
135 | 3160–10 000 5220 |
48–1680 580 |
130–560 300 |
32–305 105 |
60–500 230 |
63–200 130 |
| PОA | 40–4170 1350 |
495–895 620 |
380 | 1410–7940 4140 |
68–1620 370 |
130–400 220 |
170–700 230 |
100–350 235 |
79–150 125 |
| ЭА | 345–31 600 12 300 |
795–3470 2760 |
290 | 10 000–30 900 21 900 |
200–10 000 2420 |
3160–14 000 9000 |
315–1260 440 |
100–1180 560 |
32–200 120 |
У F. vesiculosus, как и описано ранее [3, 9], уровни ДАС, ДОН, ФУМ, АОЛ, ЦПК, PR, МФК и ЭА достигали десятков тысяч нг/г, наименьшие значения были у Т-2, ОА и АВ1 (200–510 нг/г), а для остальных микотоксинов составляли несколько тысяч нг/г. Бентоплейстонная форма F. vesiculosus ecad vehovianus заметно уступала по содержанию большинства метаболитов типичной прикрепленной форме, сходными были лишь концентрации ФУМ и PR. У карликового фукуса F. vesiculosus ecad muscoides содержание всех микотоксинов было еще меньше – уровни Т-2, ОА и АВ1 соответствовали значениям 15–26 нг/г, для ДАС, АОЛ, ФУМ, PR составили 1230–7940 нг/г, а концентрации остальных веществ находились в диапазоне от 100 до 515 нг/г. Напротив, для сублиторальной формы F. vesiculosus f. giganteus выявлены максимальные показатели содержания микотоксинов, как по сравнению с другими экоформами F. vesiculosus, так и среди всех исследованных фукоидов. Возможно, такие высокие значения связаны с тем, что на талломах F. vesiculosus f. giganteus в природных условиях присутствует большое количество эпибионтов и это способствует развитию специфической микобиоты.
Для исследованных форм F. distichus метаболические профили были сходными между собой, кроме высокого содержания ДОН, МФК и ЭА в F. distichus f. latifrons и АОЛ в F. distichus f. edentatus.
У прикрепленной формы A. nodosum, как и ранее [3, 9], была выявлена меньшая, чем у F. vesiculosus интенсивность накопления микотоксинов – из всего перечня веществ сверхвысокие содержания имели только ДАС и PR (более 10 000 нг/г) и наименьшие – Т-2, ОА и АВ1 (38–74 нг/г). Метаболический профиль бентоплейстонной экоформы A. nodosum ecad scorpioides значительно отличался от профиля типичной прикрепленной формы A. nodosum – отмечено снижение количеств Т-2, ДОН и МФК, возрастание ФУМ, АОЛ, особенно резкое – ЦИТ и PR, при сходном содержании других метаболитов. У карликовой формы A. nodosum ecad muscoides, заметна общая тенденция к снижению содержания микотоксинов, особенно по Т-2, ДОН, а количества АОЛ и ЦИТ сходны с найденными у A. nodosum. Интересно, что внутри талломов у этой экады выявлено меньшее разнообразие грибов, чем у типичной формы, и представители родов Fusarium, Alternaria, Phoma, Aspergillus, Cladosporium отсутствовали [8]. В целом, направленность изменений в содержании микотоксинов была аналогична найденной для F. vesiculosus и F. vesiculosus ecad muscoides, но сравнение состава внутренней микобиоты у них не проводилось.
Для всех макрофитов были отмечены значительные различия в содержании трихотеценовых микотоксинов (Т-2, ДАС, ДОН), продуцируемых, в основном, грибами из рода Fusarium. Количества как ДАС, так и ДОН были на 1–2 порядка больше, чем Т-2. Максимальные средние значения ДАС (более 20 тыс. нг/г) отмечены для F. vesiculosus и F. vesiculosus f. giganteus, высокие значения характерны для обеих форм F. distichus, для остальных макрофитов содержание этого токсина варьировало около 5–10 тыс. нг/г. Максимальное количество ДОН выявлено у F. vesiculosus f. giganteus и составило 79800 нг/г, высокое содержание ДОН отмечено у F. vesiculosus (около 20 тыс. нг/г) и F. distichus f. latifrons (около 12 тыс. нг/г), для остальных макрофитов – в среднем от 150 до 5050 нг/г. По количеству Т-2 выделяется F. vesiculosus f. giganteus с максимальным показателем – 845 нг/г, при этом для других фукоидов оно было значительно ниже и варьировало в пределах 10–200 нг/г. Из других фузариотоксинов содержание ЗЕН было максимальным у F. vesiculosus f. giganteus (3850 нг/г), составляло более 1 тыс. нг/г у F. vesiculosus и обеих форм F. distichus, а количество ФУМ во всех образцах было более 2 тыс. нг/г.
В фукусовых водорослях также были выявлены токсины, свойственные грибам других таксонов. Так, максимальное содержание АОЛ было у F. vesiculosus f. giganteus (ср. 20 800 нг/г), а минимальные (около 600 нг/г) – у A. nodosum и A. nodosum ecad muscoides. Количества антрахинона ЭМО и макроциклического трихотецена РОА, по сравнению с другими микотоксинами были умеренными, составляя сотни или тыс. нг/г. Значительное содержание ЭА выявлено у F. vesiculosus, F. vesiculosus f. giganteus и F. distichus f. latifrons.
На данном этапе исследований невозможно делать выводы о том, какие именно виды грибов, ассоциированные с морскими макрофитами, ответственны за продукцию микотоксинов. Однако уже очевидно, что микобиота макрофитов довольно разнообразна и связана в единую систему как с организмом-хозяином и условиями его обитания, так и с другими эпибионтами, в первую очередь, посредством многочисленных вторичных метаболитов. Токсины, синтезируемые грибами, разнообразны по строению, и для многих из них известна возможность синтеза грибами разных видов. Современные методы способствуют обнаружению как новых микотоксинов, так и новых продуцентов известных ранее веществ [35].
Полученные результаты по содержанию микотоксинов в фукоидах, несомненно, важны и с практической точки зрения. Морские водоросли издавна служат объектом промысла и марикультуры, в ряде стран им традиционно отводится заметное место в рационе населения, они широко используются как биологически активные пищевые добавки, а также во многих других сферах человеческой деятельности ‒ в кормлении сельскохозяйственных животных, птицы и прудовой рыбы, как удобрения, для очистки сточных вод и прочих хозяйственных нужд [10, 15, 16, 25]. В России при изготовлении водорослевой муки и кормовой крупки, предназначенной для сельскохозяйственных животных, птиц и прудовой рыбы, предусмотрено использование фукусов, ламинарий, а также отходов экстракционной переработки анфельции, ламинарии, фукусов, фурцеллярии, филлофоры [5]. Документированные свидетельства отравлений фукоидами не известны. В доступной литературе единственная работа по микотоксинам макрофитов посвящена определению фузариотоксинов в 50 пробах келпов (в данном случае это были сухие макрофиты из супермаркета) из китайской провинции Шаньдун. В 43 пробах были детектированы моноацетаты ДОН в количествах от 15.3 до 162.5 мкг/кг, при этом другие анализированные фузариотоксины (ДОН, ниваленол, фузаренон Х, Т-2 токсин и ЗЕН) не обнаружены [26]. Дальнейшее изучение микотоксинов в водорослях-макрофитах как Белого моря, так и других морей, имеет важное прикладное значение.
Таким образом, впервые получены сравнительные данные о комплексе микотоксинов у трех видов бурых фукусовых водорослей и их экоформ. Выявлено наличие 16 различных микотоксинов, что говорит о присутствии разнообразных видов грибов, ассоциированных с макрофитами. Выявленное высокое содержание некоторых микотоксинов в талломах фукоидов указывает на необходимость повышенного внимания к их использованию.
Источники финансирования: Работа Георгиевой М.Л. (участие в анализе полученных результатов) выполнена при поддержке гранта Министерства науки и высшего образования РФ (проект № 075-15-2021-1396).
Список литературы
Бубнова Е.Н., Грум-Гржимайло О.А., Коновалова О.П., Марфенина О.Е. 50 лет микологических исследований на Беломорской биостанции им. Н.А. Перцова: основные направления, итоги, перспективы // Вестн. Моск. Ун-та. Сер. Биология. 2014. № 1. С. 29–46.
Бубнова Е.Н., Киреев Я.В. Сообщества грибов на талломах бурых водорослей рода Fucus в Кандалакшском заливе Белого моря // Микология и фитопатология. 2009. Т. 43. Вып. 5. С. 388–397.
Буркин А.А., Кононенко Г.П., Георгиев А.А., Георгиева М.Л. Токсичные метаболиты микромицетов в бурых водорослях семейств Fucaceae и Laminariaceae из Белого моря // Биология моря. 2021. Т. 47. № 1. С. 40–44.
Возжинская В.Б. Донные макрофиты Белого моря. М.: Наука, 1986. 191 с.
ГОСТ 22 455–77 Мука и крупка кормовая водорослевая. Технические условия. 1978. 4 с.
ГОСТ Р 52 471–2005 Корма. Иммуноферментный метод определения микотоксинов. 2006. 12 с.
Каталог биоты Беломорской биологической станции МГУ / Под ред. Чесунова А.В., Калякиной Н.М., Бубновой Е.Н. М.: Т-во научных изданий КМК, 2008. 384 с.
Коновалова О.П., Бубнова Е.Н. Грибы на бурых водорослях Ascophyllum nodosum и Pelvetia canaliculata в Кандалакшском заливе Белого моря // Микология и фитопатология. 2011. Т. 45. Вып. 3. С. 240–248.
Кононенко Г.П., Буркин А.А., Георгиев А.А., Георгиева М.Л. Микотоксины в макроводорослях из пролива Великая Салма Кандалакшского залива Белого моря // Биология моря. 2022. Т. 48. № 1. С. 53–61.
Коровкина Н.В., Богданович Н.И., Кутакова Н.А. Экстракты бурых водорослей для обогащения рациона питания природными минеральными веществами // Химия растительного сырья. 2008. № 4. С. 167–169.
Максимова О.В. Обзор исследований карликовых и бентоплейстонных фукусовых (Fucales, Phaeophyceae) // Ботанический журнал. 2007. Т. 92. № 6. С. 858–877.
Максимова О.В., Мюге Н.С. Новые для Белого моря формы фукоидов (Fucales, Phaeophyceae): морфология, экология, происхождение // Ботанический журнал. 2007. Т. 92. № 7. С. 965–986.
Максимова О.В., Симакова У.В., Неретина Т.В. Морфологическое разнообразие при генетическом единстве: Fucus vesiculosus и Ascophyllum nodosum (Белое море). В кн.: Водоросли: проблемы таксономии, экологии и использование в мониторинге. Материалы IV Всеросс. научной конф. с междунар. участием. СПб: Реноме, 2018. С. 287–291.
Михайлова Т.А., Максимова О.В., Бубнова Е.Н. Бурые водоросли. В кн.: Флора и фауна Белого моря: иллюстрированный атлас / Ред. А.Б. Цетлин, А.Э. Жадан, Н.Н. Марфенин. М.: Т-во научных изданий КМК, 2010. С. 397–413.
Муравьева Е.А. Комплексная технология получения экстрактивных БАВ из бурых водорослей Белого моря // Рыбпром. 2010. № 3. С. 54–57.
Al-Dulaimi O., Rateb M.E., Hursthouse A.S. et al. The Brown seaweeds of Scotland, their importance and applications // Environments. 2021. V. 8. № 6: 59. https://doi.org/10.3390/environments8060059
Alshannaq A., Yu J-H. Occurrence, toxicity, and analysis of major mycotoxins in food // International Journal of Environmental Research and Public Health. 2017. V. 14. № 6: 632. https://doi.org/10.3390/ijerph14060632
Arbona V., Manzi M., Ollas C., Gmez-Cadenas A. Metabolomics as a tool to investigate abiotic stress tolerance in plants // International Journal of Molecular Sciences. 2013. V. 14. №. 3. P. 4885–4911.
Didwania N., Joshi M. Mycotoxins: A critical review on occurrence and significance // International Journal of Pharmacy and Pharmaceutical Sciences. 2013. V. 5. I. 3. P. 1014–1019.
El-Bondkly E.A.M., El-Bondkly Al.A.M., El-Bondkly Ay.A.M. Marine endophytic fungal metabolites: A whole new world of pharmaceutical therapy exploration // Heliyon. 2021. V. 7. I. 3. e06362. https://doi.org/10.1016/j.heliyon.2021.e06362
Flewelling A.J., Johnson J.A., Gray C.A. Isolation and bioassay screening of fungal endophytes from North Atlantic marine macroalgae // Botanica Marina. 2013. V. 56. P. 287–297. https://doi.org/10.1515/bot-2012-0224
Hong J., Yang L., Zhang D., Shi J. Plant metabolomics: an indispensable system biology tool for plant science // International Journal of Molecular Sciences. 2016. V. 17. № 6: 767. https://doi.org/10.3390/ijms17060767
Ji N.Y., Wang B.G. Mycochemistry of marine algicolous fungi // Fungal diversity. 2016. V. 80. № 1. P. 301–342. https://doi.org/10.1007/s13225-016-0358-9
Kohlmeyer J., Kohlmeyer E. Marine Mycology, the higher fungi. New York: Acad. Press, 1979. 691 p.
Leandro A., Pereira L., Gonçalves A.M.M. Diverse applications of marine macroalgae // Marine Drugs. 2020. V. 18. № 1: 17. https://doi.org/10.3390/md18010017
Li Y., Sun M., Mao X., et al. Mycotoxins contaminant in kelp: a neglected dietary exposure pathway // Toxins. 2018. V. 10. № 11: 481. https://doi.org/10.3390/toxins10110481
Mohamed G.A., Ibrahim S.R.M. Untapped potential of marine-associated Cladosporium species: an overview on secondary metabolites, biotechnological relevance, and biological activities // Mar. Drugs. 2021. V. 19. № 11: 645. https://doi.org/10.3390/md19110645
Ogaki M.B., de Paula M.T., Ruas D. et al. Marine fungi associated with Antarctic macroalgae // The ecological role of microorganisms in the Antarctic environment. Springer Polar Sciences / Ed. Castro-Sowinski S. Springer, 2019. P. 239–255. https://doi.org/10.1007/978-3-030-02786-5_11
Raghukumar S. Fungi in coastal and oceanic marine ecosystems. Marine Fungi. Springer, 2017. 378 p.
Rateb M.E., Ebel R. Secondary metabolites of fungi from marine habitats // Natural Product Reports. 2011. V. 28. P. 290–344. https://doi.org/10.1039/c0np00061b
Singh R.P., Kumaru P., Reddy C.R.K. Antimicrobial compounds from seaweeds-associated bacteria and fungi // Appl. Microbiol. Biotechnol. 2015. V. 99. P. 1571–1586. https://doi.org/10.1007/s00253-014-6334-y
Suryanarayanan T., Venkatachalam A., Thirunavukkarasu N. et al. Internal mycobiota of marine macroalgae from the Tamilnadu coast: distribution, diversity and biotechnological potential // Botanica Marina. 2010. V. 53. I. 5. P. 457–468. https://doi.org/10.1515/bot.2010.045
Teixeira T.R., Santos G.S.d., Armstrong L. et al. Antitumor potential of seaweed derived-endophytic fungi // Antibiotics. 2019. V. 8. № 4: 205. https://doi.org/10.3390/antibiotics8040205
Tourneroche A., Lami R., Burgaud G. et al. The bacterial and fungal microbiota of Saccharina latissima (Laminariales, Phaeophyceae) // Front. Mar. Sci. 2020. V. 7: 587566. https://doi.org/10.3389/fmars.2020.587566
Van den Brand A.D., Bulder A.S. An overview of mycotoxins relevant for the food and feed supply chain: using a novel literature screening method. The Netherlands: RIVM, 2020. 48 p.
Xu H., Deckert R.J., Garbary D.J. Ascophyllum and its symbionts. X. Ultrastructure of the interaction between A. nodosum (Phaeophyceae) and Mycophycias ascophylli (Ascomycetes) // Botany. 2008. V. 86. P. 185–193.
Zaki M.M., El-Midany S.A., Shaheen H.M., Rizzi L. Mycotoxins in animals: occurrence, effects, prevention and management // Journal of Toxicology and Environmental Health Science. 2012. V. 4. № 1. P. 13–28. https://doi.org/10.5897/JTEHS11.072
Zuccaro A., Schoch C.L., Spatafora J.W., Kohlmeyer J., Draeger S., Mitchell J.I. Detection and identification of fungi intimately associated with the brown seaweed Fucus serratus // Appl. Environ. Microbiol. 2008. V. 74. P. 931–941.
Дополнительные материалы отсутствуют.


