Океанология, 2022, T. 62, № 6, стр. 933-942
Размерная структура половoзрелых крабов-стригунов Chionoecetes opilio (O. Fabricius, 1788) (Decapoda, Oregoniidae) в Карском море
А. К. Залота *
Институт океанологии им. П.П. Ширшова РАН
Москва, Россия
* E-mail: azalota@gmail.com
Поступила в редакцию 11.01.2022
После доработки 03.02.2022
Принята к публикации 25.02.2022
- EDN: RVCBPC
- DOI: 10.31857/S0030157422060132
Аннотация
Проанализирована размерная структура и половозрелость самцов популяции вселившегося в Карское море краба-стригуна опилио (Chionoecetes opilio). Наблюдения в южных заливах архипелага Новая Земля и в Новоземельской впадине показали, что основная масса самцов краба достигает половозрелости при ширине карапакса (ШК) выше 60 мм. Все пойманные самцы с ШК более 67 мм прошли терминальную линьку. Только два самца в уловах из Новоземельской впадины достигли установленного промыслового размера по ширине карапакса (ШК) в 100 мм. Наиболее многочисленная размерная группа взрослых самцов в заливах имела ШК 60 мм, а в Новоземельской впадине 80–90 мм. Полученные данные позволяют утверждать, что вылов в Карском море крабов с ШК 80–90 мм не приведет к изъятию неполовозрелых особей и не снизит репродуктивный потенциал местной популяции сверх предусмотреного в рамах устойчивого рыболовства.
ВВЕДЕНИЕ
Естественный ареал краба-стригуна опилио (Chionoecetes opilio) охватывает северную часть Тихого океана от Берингова пролива до вод Британской Колумбии и северной части Японского моря, Чукотское море с отдельными находками в восточной части Восточно-Сибирского моря и западной части моря Бофорта, а также Северо-Западную Атлантику от крайнего северо-западного побережья США до Девисова пролива [11, 48].
В Баренцевом море краб-стригун был обнаружен в 1996 г. [6]. Развитие инвазии краба-стригуна в Баренцевом море произошло быстро, и в настоящее время вид обитает практически по всему центральному, восточному, северо-восточному шельфу бассейна. С 2016 г. начался его полноценный промысел [3, 6]. В 2012 г. опилио был обнаружен в юго-западной части Карского моря [5]. В 2014 г. молодь крабов-стригунов встречалась по всей акватории западной части моря и в заливах восточного побережья Новой Земли [53]. В настоящий момент это активно распространяющийся интродуцент, и в юго-западной части Карского моря присутствуют все размерные группы вида [53–55].
В 2022 г. предполагается начало промысла краба-стригуна в Карском море, с установленным промысловом размером ширины карапакса 100 мм. В настоящее время существуют оценки возможности эксплуатации популяции краба в Карском море на основе сравнения “плотности скоплений промыслового краба в Карском море в 2019 г. с оценками плотности краба на промысловых участках открытой части Баренцева моря в период открытия его промысла (2013–2016 гг.)” [2]. Однако такие прямые сравнения далеко не небесспорны, так как океанографические и продукционные условия в Карском море сильно отличаются от Баренцева моря.
Западная часть Карского моря находится под сильным влиянием водообмена с Баренцевым морем, а его центральная и южная части – под воздействием стока крупных сибирских рек [8, 41, 56–58]. Карское море покрыто льдом большую часть года, в нем присутствуют обширные массивы припая и регулярные полыньи [8, 28]. Начиная с середины 2000-х годов, в Карском море отмечается общая для Арктики тенденция замедления образования морского льда осенью и более раннего его разрушения весной – в начале лета [1]. Это совпало с началом вселения в бассейн C. opilio из Баренцева моря [53]. По сравнению с Баренцевым морем, Карское море имеет гораздо более низкую первичную продуктивность [9, 23, 24, 51] и биомассу бентоса [4, 18, 25, 35, 50]. До вселения краба-стригуна в бентосном сообществе Карского моря почти полностью отсутствовали крупноразмерные активные хищники. По предварительным оценкам автора, основанным на данных полученных в рамках многолетней программы “Экосистемы морей Сибирской Арктики”, вселение в бассейн хищного краба опилио привело к деградации бентосных сообществ, что остро ставит вопрос о достаточности кормовой базы для поддержания промысловой популяции краба-стригуна в Карском море. Однако данная работа поднимает другой, не менее важный вопрос для успешного промысла краба-стригуна в Карском море – возможность достижения видом промысловых размеров.
В районах, где ведется промысел краба-стригуна опилио, добываются только самцы с установленным минимальным размером ширины карапакса. В Беринговом море он составляет 78 мм [38], в Канаде и Японии – 90 мм и более [26, 52]. В Баренцевом море установлен промысловый размер в 100 мм [30], и эти правила предварительно экстраполированы на Карское море. Однако в Карском бассейне таких размеров достигают далеко не все самцы, прошедшие терминальную линьку, что влияет на рентабельность промысла. В то же время вылов самцов меньших размеров может приводить к изъятию особей до достижения ими репродуктивного возраста и снизить репродуктивный потенциал популяции. Таким образом, данные о размерной структуре популяции и размерах, при которых самцы краба-стригуна достигают половозрелости в районах вылова, имеет не только экономическое значение, но и важно для ведения рационального природопользования. В связи с предстоящим началом промысла краба-стригуна опилио в Карском море данный вопрос стоит особо остро.
В настоящей работе анализируется размерная структура крупных самцов крабов-стригунов в Карском море и размеры, при которых они достигают репродуктивного возраста.
МЕТОДЫ
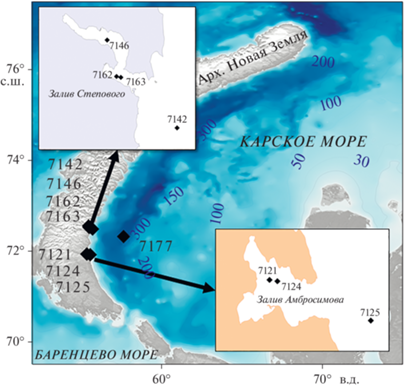
Материал был получен в заливах Абросимова и Степового (восточное побережье Южного острова Новой Земли) и в Новоземельской впадине (рис. 1) в ходе 85 рейса НИС “Академик Мстислав Келдыш” в сентябре 2021 г.
Для качественной оценки макро- и мегабентоса использовано устройство отбора бентосных проб (УОБ) в форме усеченного конуса с диаметром нижнего и верхнего оснований, соответственно, 1.5 и 0.7 м и высотой 0.6 м (ячея размером 50–80 мм). У всех собранных крабов был определен пол и при помощи штангенциркуля измерены основные морфометрические параметры: ширина карапакса (ШК), высота и толщина карапакса, ширина абдомена у самок, высота правой клешни у самцов. Половозрелые самки зафиксированы в 6% растворе формалина для последующего полного биологического анализа, в том числе для анализа гонад. В местах постановки УОБ была измерена температура придонного слоя воды при помощи океанографического зонда SBE 19plusV2 и CTD-зонда YSI CastAway.
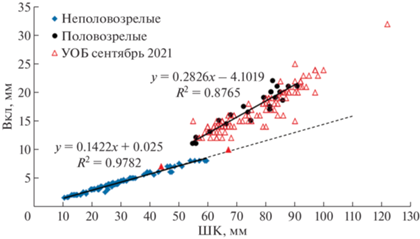
Для выявления отличия между половозрелыми и неполовозрелыми самцами были использованы морфометрические параметры. У крабов-стригунов опилио половозрелость наступает после терминальной линьки, и в этот момент меняется пропорциональное соотношения размера клешней (высота – ВКл) к ширине карапакса (ШК) (рис. 2) [19, 20, 44]. Проследить эти различия в Карском море позволили данные, полученные с 2016 по 2021 гг. в ходе предыдущих рейсов, в рамках многолетней программы “Экосистемы морей Сибирской Арктики” [53–55]. Орудием лова в этих экспедициях служил трал Сигсби со стальной рамой (2.0 × 0.35 м), с двойным сетным мешком, диаметр внешней ячеи которого был 45, а внутренней – 4 мм.
Рис. 2.
Схема основных размерных показателей, используемых для оценки полового созревания самцов крабов-стригунов опилио. ШК – ширина карапакса, ВКл – высота правой клешни.

При обработке материала 85-го рейса НИС “Академик Мстислав Келдыш” для оценки размерной структуры всех пойманных самцов и отдельно самцов со станций 7162 и 7177, где они были в количестве, достаточном для статистического анализа, использовался анализ разделения смешанного распределения на нормально распределенные группы, выполненный с использованием пакета программного обеспечения PAST [29]. Для выявления наиболее пригодной модели были использованы показатели критерия Акаике [13] и параметр логарифмического правдоподобия (log likelihood). Расчеты были выполнены с 50-кратной повторностью для выявления наиболее стабильного результата. Размерная структура популяции на станциях с низким количеством особей была определенны эмпирическим способом по подобию предыдущих наблюдений с разбиением на группы с разницей ШК в 10 мм [53–55].
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Температура (табл. 1) и соленость придонного слоя воды в исследованных районах Карского моря находятся в пределах известных уровней толерантности краба-стригуна от –1.8 до 7.2°С и примерно 34 PSU [7, 10, 34, 43], хотя в соседнем Баренцевом море распределение вида ограничено изотермой 2°C, максимально предпочитаемой крабами температурой [12, 33]. В заливе Абросимова в устройство отбора бентосных проб не попалось ни одного краба (табл. 1). Залив Абросимова очень мелководный (около 20 м) и температура придонного слоя воды в нем в сентябре 2021 г. была около +6°С. Такая температура слишком высока для холодолюбивых крабов-стригунов [21, 39, 46] и, скорее всего, все крупные особи покинули залив в поиске больших глубин, где придонный слой не вовлечен в процессы перемешивания и в нем сохраняется низкая температура. При этом в качественные пробы, взятые в заливе дночерпателем “Ван Вин” (площадь раскрытия 0.1 м2), попадались мелкие крабы с шириной карапакса около 10 мм. Особи такого размера не способны передвигаться на большие расстояния и могут выдерживать некомфортную температуру, закапываясь в грунт. На выходе из залива Абросимова (ст. 7125, рис. 1) на глубине около 50 м при придонной температуре +0.27°С были отловлены 4 самца крабов. Три из них были крупные нативные для Карского моря крабы Hyas araneus (ШК 68–78 мм) и один краб-стригун (ШК 74 мм).
Таблица 1.
Район, где выполнена станция, количество установленных устройств отбора бентосных проб (Кол УОБ), продолжительности работы устройств (Дни), глубины установки, температура придонного слоя воды (Темп °С) и количество пойманных крабов-стригунов (Chionoecetes opilio) и нативных крабов (Hyas araneus)
| Станция | Район | Кол. УОБ | Дни | Глубина м | Темп °С | C. opilio | H. araneus |
|---|---|---|---|---|---|---|---|
| 7121 | з. Абросимова, центр | 2 | 1 | 15 | 6 | 0 | 0 |
| 7124 | з. Абросимова, центр | 2 | 6 | 15 | 6 | 0 | 0 |
| 7125 | У входа в з. Абросимова, снаружи | 3 | 5 | 49 | 0.27 | 1 | 3 |
| 7142 | У входа в з. Степового, снаружи | 3 | 5 | 54 | от 1.75 до 6 | 2 | 1 |
| 7146 | з. Степового, яма в кутовой части |
2 | 4 | 52 | –0.1 | 11 | 0 |
| 7162 | з. Степового, яма у выхода | 3 | 1 | 53 | –0.35 | 44 | 1 |
| 7163 | з. Степового, у выхода | 2 | 1 | 32.5 | 4.9 | 15 | 1 |
| 7177 | Новоземельская впадина | 3 | 5 | 350 | –1.8 | 45 | 0 |
Залив Степового более глубокий, с ямами в центральной части до 50 м. В трех точках – в ямах, в куту и у выхода из залива – было собрано большое количество крабов. В кутовой части залива (ст. 7146) при температуре придонной воды –0.1°С (табл. 1) было поймано 11 самцов крабов стригунов. ШК у девяти особей превышала 80 мм и достигала 92.5 мм, у двух была меньше – 61 и 75 мм. В яме ближе к выходу из залива (ст. 7162, температура –0.35°С) было поймано 44 самца краба-стригуна, у которых ШК варьировала от 55 до 97 мм (в среднем 67 мм), и 1 нативный краб Hyas araneus. В соседнем районе (ст. 7163) на глубине 32.5 м, при температуре +4.9°С, что выше максимально предпочитаемой крабами температуры +2°С, было поймано всего 15 особей меньших размеров с ШК от 40 до 86 мм (в среднем 60 мм). Из них было две самки с ШК 40 и 44 мм, более крупная из которых носила икру на плеоподах. В районе, примыкающем к заливу Степового (ст. 7142), на глубине около 60 м при установке устройства отбора проб температура была +1.75°С, а при его снятии возросла до +6°С. Здесь было поймано всего 3 краба, один из которых был нативный Hyas araneus. ШК крабов-стригунов составила 73 и 80 мм.
В Новоземельской впадине на глубине свыше 350 м температура воды была комфортной для крабов-стригунов (–1.8°С). В этом районе было поймано самое большое количество крабов и самые крупные особи (только самцы). Средняя ШК составляла 85 мм и варьировала от 63 до 122 мм. Два самца по ширине карапакса превышали установленный промысловый размер в 100 мм.
В ходе предыдущих экспедиций в Карское море (2016–2021 гг.) с использованием трала Сигсби, был собран материал, позволяющий проследить морфометрические отличия между половозрелыми (круги) и неполовозрелыми (ромбы) самцами (рис. 3). Почти все пойманные в 2021 г. самцы с ШК более 60 мм имели соотношение размеров ШК/Вкл половозрелых особей. На рис. 3 они формируют тренд, обозначенный треугольниками, который близок к линии тренда, построенного на основе ранее полученных данных. Исключение составляют всего две особи с ШК 44 и 67 мм, обозначенные на рисунке закрашенными треугольниками.
Рис. 3.
Соотношение ширины карапакса (ШК мм) и высоты правой клешни (ВКл мм) у самцов крабов стригунов Chionoecetes opilio, собранных в траловых сборах в Карском море с 2016 по 2021. Ромбы – неполовозрелые самцы, круги – половозрелые самцы, треугольники – самцы, собранные в устройство отбора бентосных проб (УОБ) в рейсе НИС АМК 85. Линии тренда построены на основе данных, полученных до 2021 г.
Распределение размерных групп у пойманных самцов крабов (рис. 4а, 4б; табл. 2) соответствовало стадиям роста, ранее обнаруженным нами в Карском море [53–55] и литературным данным [3, 14]. В целом, наиболее многочисленная стадия роста (X) имела ШК около 60 мм. Крабы больших размеров могли соответствовать как Х, так и более высокой стадии роста, так как большинство пойманных крабов с ШК более 60 мм прошли терминальную линьку, и их дальнейший рост невозможен [20]. Вероятнее всего, крабы-стригуны в Карском море достигают половозрелости на X стадии роста, так же, как и встреченные нами самцы больших размеров. Мы наблюдали лишь редкие исключения – был пойман один неполовозрелый самец с ШК 67 мм, который пройдет терминальную линьку на XI стадии роста.
Рис. 4.
Размерный состав самцов Chionoecetes opilio, пойманных в устройство отбора бентосных проб (УОБ) в рейсе НИС АМК 85 в 2021 г. Количество особей и распределение по размерным группам приведены в табл. 2. (а) – Самцы со всех станций; (б) – ст. 7162, яма с глубиной >50 м у выхода из залива Степового; (в) – ст. 7177, Новоземельская впадина.
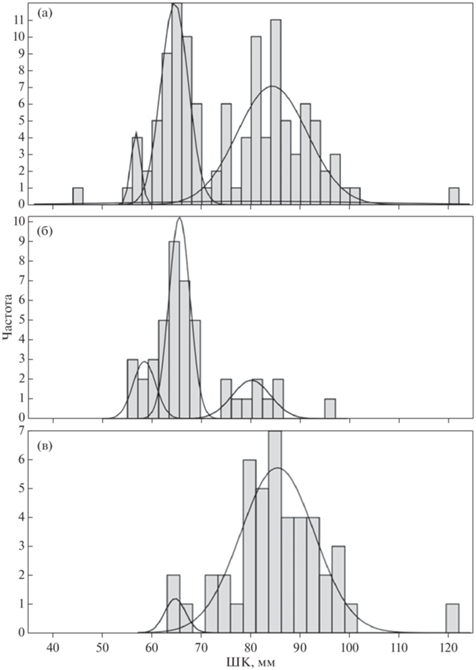
Таблица 2.
Состав размерных групп самцов Chionoecetes opilio, пойманных в устройство отбора бентосных проб в рейсе НИС АМК 85 в 2021 г. n – количество собранных особей; Мин–макс ШК (мм) – минимальная и максимальная ширина карапакса обнаруженных самцов; римские цифры – стадии роста (соответствуют ранее полученным данным [53–55])
| Станции | n | Мин–макс ШК (мм) | Стадии роста и средняя ширина карапакса ± ± стандартное отклонение (мм) | |||||||
|---|---|---|---|---|---|---|---|---|---|---|
| VII | IX | Х | >Х | |||||||
| все самцы | 116 | 44–122 | 44 | 56.7 (±1) |
64.5 (±2.8) |
84.3 (±7.3) |
122 | |||
| 7125 | У входа в з. Абросимова, снаружи |
1 | 74 | |||||||
| 7142 | У входа в з. Степового, снаружи |
2 | 73–80 | 73 | 80 | |||||
| 7146 | з. Степового, яма в кутовой части |
11 | 61–92.5 | 61 | 83.5 (±4) |
90.8 (±1.4) |
||||
| 7162 | з. Степового, яма у выхода |
44 | 55–97 | 58.2 (±2.2) |
65.4 (±2.2) |
80 (±3.9) |
97 | |||
| 7163 | з. Степового, у выхода |
13 | 44–86 | 44 | 58 (±1.7) |
64.5 (±1.9) |
86 | |||
| 7177 | Новоземельская впадина | 45 | 63–122 | 64.6 (±2.1) |
85.3 (±7.4) |
122 | ||||
Примечание. Размерные группы для всех пойманных самцов на станциях 7162 и 7177 были выявлены при анализе разделения смешанного распределения на нормально распределенные группы, Akaike IC и Log lk.hood для анализа всех самцов 646 и –316.6, соответственно; соответствующие значения на ст. 7162 – 207.1 и –96.38; на ст. 7177 – 195 и –90.39.
На большинстве станций в заливах половозрелые самцы редко превышают по ШК 60–70 мм. Только в яме в кутовой части залива Степового (ст. 7146) подавляющее большинство крабов имели размеры карапакса 80–90 мм, и была встречена лишь одна особь с ШК 61 мм (табл. 2). Размерная структура крабов в Новоземельской впадине (ст. 7177) отличалась от таковой в заливах. Во впадине ШК у наиболее многочисленной размерной группы половозрелых самцов превышала 80 мм (рис. 4в, табл. 2). Также, в этом районе была поймана особь с максимальной ШК 122 мм.
Таким образом, можно сделать вывод, что большинство пойманных нами самцов достигают половозрелости (проходят терминальную линьку) с шириной карапакса гораздо меньше установленного разрешенного размера для добычи в Баренцевом море (ШК >100 мм). Пойманные нами в предыдущих рейсах рекордно маленькие самки с икрой на плеоподах (от 25 мм [53, 54]) также подтверждают тенденцию к уменьшению размеров половозрелых крабов-стригунов в Карском море. Причины такой тугорослости могут быть разными, но наиболее вероятны, на наш взгляд, две. Это низкая температура придонных вод (достигающая –1.8°С), которая не препятствует половому созреванию, но тормозит соматический рост крабов, и крайне ограниченная кормовая база. Можно предположить, что уменьшение размеров половозрелых особей — это часть адаптивной стратегии вселенца, приводящей к ускорению роста популяции и оккупации всех возможных экологических ниш в инвазионном ареале, что известно для других видов [16, 32, 36].
В природе хорошо прослеживается правило Бергмана (или правило Джеймса как расширенная межвидовая версия [15]) об увеличении размера особей с увеличением географической широты или высоты обитания. Данное правило особенно хорошо выражено в наземных экосистемах, и чаще всего связано с температурыми условиями и продолжительностью сезонов. Однако в морских условиях встречается и обратная связь размера организмов с широтой. Как прямая, так обратная связь особенно хорошо показана для ракообразных, в том числе и декапод [31, 42, 47, 49]. В морских, особенно придонных, биотопах температура менее вариабельна (не опускается менее –1.9°C), и сезонность не столь ощутима. Доступность питания для организмов также не сильно различается между сезонами, особенно для таких крупных хищников, как краб-стригун, который может питаться крупными долгоживущими организмами. Таким образом, рост крабов-стригунов может происходить вне зависимости от сезонов. Это подтверждают наблюдения, сделанные в восточной Канаде, где самки проходят терминальную линьку и спаривание в зимние месяцы, когда температура воды достигает максимально отрицательных значений [37]. Ряд работ показал, что размеры самок крабов-стригунов имеют положительную корреляцию с температурой, а не с продолжительностью сезонов [17, 39, 40, 45, 59]. Это так же подтверждается наблюдениями, согласно которым размеры крабов после терминальной линьки меняются с глубиной и, соответственно, температурой на одних и тех же широтах [27, 37]. Большинство работ основаны на анализе самок крабов, так как их размерная структура не подвержена изменениям под воздействием промысла, который изымает крупных самцов в большей части ареала их обитания. Схожие тренды наблюдались и для самцов [21, 22]. Динамика размерной структуры крабов-стригунов, прежде всего самцов, в Карском море на данный момент представляет особый интерес, так как популяция до настоящего времени не подвергалась воздействию промысла. В ближайшее время будет возможно наблюдать изменения в размерной структуре вида в реальном времени в связи с началом его промыслового изъятия.
ЗАКЛЮЧЕНИЕ
Вселенцы крабы-стригуны (Chionoecetes opilio) распространились на большую часть юго-западной акватории Карского моря, достигли высокой плотности и половозрелости [53–55]. Повсеместно встречаются самки с икрой на плеоподах и самцы, прошедшие терминальную линьку. Большинство самцов с шириной карапакса более 60 мм достигают в бассейне половозрелого возраста. При этом в условиях Карского моря половозрелые самцы крайне редко достигают ширины карапакса, превышающей 100 мм. Этот параметр у большинства самцов после терминальной линьки составляет 60–90 мм. Полученные нами материалы позволяют констатировать, что вылов крабов с ШК 80–90 мм в Карском море не приведет к изъятию неполовозрелых особей и не снизит репродуктивный потенциал местной популяции сверх того, что предусмотрено в рамах устойчивого использования биоресурсов.
Благодарности. Автор выражает глубокую признательность капитану Ю.Н. Горбачу и команде судна за обеспечение забортных работ; А.А. Недоспасову, за оперативное предоставление данных по гидрофизике; а также В.Л. Сёмину, А.В. Мишину, А.В. Булохову и А.В. Бондарю за помощь в палубных работах. Особая благодарность научному руководству 85-го рейса НИС “Академик Мстислав Келдыш” в сентябре 2021 г. за поддержку в проведении исследований.
Источники финансирования. Исследования проведены в рамках Государственного задания ИО РАН № 0128-2021-0007.
Список литературы
Ашик И.М., Карклин В.П. Кириллов С.В. и др. Воздействие изменения климата на морские природные системы // Второй оценочный доклад об изменениях климата и их последствиях на территории Российской Федерации / Федеральная служба по гидрометеорологии и мониторингу окружающей среды (Росгидромет), 2014. С. 588–615. http://voeikovmgo.ru/index.php?option=com_content&view= article&id=649&Itemid=24&lang=ru [последнее посещение 01.12.2018].
Баканев С.В., Павлов В. А. Перспективы промысла краба-стригуна Chionoecetes opilio в Карском море // Вопросы рыболовства. 2020. Т. 21. № 4. С. 478–487.
Баканев С.В., Жак Ю.Е., Павлов В.А. Пространственное распределение краба-стригуна опилио в Баренцевом море // Краб-стригун опилио Chionoecetes opilio в Баренцевом и Карском морях / Ред. Соколов К.М. и др. Мурманск: ПИНРО, 2016. С. 74–84.
Зенкевич Л.А. Биология морей СССР. М: Изд-во АН СССР, 1963. 740 с.
Зимина О.Л. Находка краба-стригуна в Карском море // Биол. моря. Т. 40. 2014. С. 497–499.
Кузьмин С.А., Ахтарин С.М., Менис Д.Т. Первые находки Chionocoetes opilio (Decapoda, Majidae) в Баренцевом море // Зоол. журн. 1998. Т. 77. № 4. С. 489–491.
Первеева Е.Р. Распределение, условия обитания и динамика численности краба-стригуна Chionoecetes opilio у восточного Сахалина // Рыбохозяйственные исследования в Сахалинско-Курильском раойне и сопредельных акваториях: Сб. науч. тр. СахНИРО. Южно-Сахалинск: Сах. обл. книж. изд-во, 1999. Т. 2. С. 100–106.
Полухин А.А., Загретдинова Д.Р. Океанографическая характеристика Карского моря // Карское море. Экологический атлас / Ред. Исаченко А.И. Москва: ООО “Арктический Научный Центр”, 2016. С. 53–76.
Романкевич Е.А., Ветров А.А. Цикл углерода в арктических морях России. Москва: Наука, 2001. 302 с.
Слизкин А.Г. Распределение крабов-стригунов рода Chionoecetes и условия их обитания в северной части Тихого океана // Изв. ТИНРО. 1982. Т. 106. С. 26–33.
Соколов К.М., Павлов В.А. Пространственное распределение краба-стригуна опилио // Краб-стригун опилио Chionoecetes opilio в Баренцевом и Карском морях / Ред. К.М. Соколов и др. Мурманск: ПИНРО, 2016. С. 9–17.
Agnalt A.-L., Pavlov V., Jørstad K.E. et al. The snow crab, Chionoecetes opilio (Decapoda, Majoidea, Oregoniidae) in the Barents Sea // Springer Series in Invasion Ecology. 2011. V. 6. P. 283–300.
Akaike H. A new look at the statistical model identification // IEEE Transactions on Automatic Control. 1974. V. 19. P. 716–723.
Alunno-Bruscia M., Sainte-Marie B. Abdomen allometry, ovary development, and growth of female snow crab, Chionoecetes opilio (Brachyura, Majidae), in the northwestern Gulf of St. Lawrence // Can. J. Fish. Aquat. Sci. 1998. V. 55. № 2. P. 459–477.
Blackburn T.M., Gaston K.J., Loder N. Geographic gradients in body size: a clarification of Bergmann’s rule // Diversity and Distribution. 1999 V. 5. P. 165–174.
Bøhn T., Terje Sandlund O., Amundsen P.-A., Primicerio R. Rapidly changing life history during invasion // Oikos. 2004. V. 106. № 1. P. 138–150. https://doi.org/10.1111/j.0030-1299.2004.13022.x
Burmeister A., Sainte-Marie B. Pattern and causes of a temperature-dependent gradient of size at terminal moult in snow crab (Chionoecetes opilio) along West Greenland // Polar Biology. 2010. V. 33. № 6. P. 775–788. https://doi.org/10.1007/s00300-009-0755-6
Chava A.I., Udalov A.A., Vedenin A.A. et al. Benthic Fauna of Tsivolki Bay (Novaya Zemlya Archipelago, Kara Sea) // Oceanology. 2017. V. 57. № 1. P.160–170.
Claxton W.T., Govind C.K., Elner R.W. Chela function, morphometric maturity, and the mating embrace in male snow crab, Chionoecetes opilio // Can. J. Fish. Aquat. Sci. 1994. V. 51. № 5. P. 1110–1118. https://doi.org/10.1139/f94-110
Conan G.Y., Comeau M. Functional maturity and terminal molt of male snow crab, Chionoecetes opilio. Can. J. Fish. Aquat. Sci. 1986. V. 43. № 9. P. 1710–1719. https://doi.org/10.1139/f86-214
Dawe E.G., Colbourne E.B. Distribution and demography of snow crab (Chionoecetes opilio) males on the Newfoundland and Labrador shelf // Crabs in cold water regions: biology, management, and economics. / Eds. Paul A.J., Dawe E.G., Elner R., Jamieson G.S. et al. University of Alaska Sea Grant, AK-SG-02-01, Fairbanks, AK, 2002. P. 577−594. http://seagrant. uaf.edu/bookstore/pubs/AK-SG-02-01.html.
Dawe E.G., Mullowney D.R., Moriyasu M., Wade E. Effects of temperature on size-at-terminal molt and molting frequency in snow crab Chionoecetes opilio from two Canadian Atlantic ecosystems // Marine Ecology Progress Series. 2012. V. 469. P. 279–296. https://doi.org/10.3354/meps09793
Demidov A.B., Mosharov S.A. Vertical distribution of primary production and chlorophyll a in the Kara Sea // Oceanology. 2015. V. 55. P. 521–534.
Demidov A.B., Mosharov S.A., Makkaveev P.N. Evaluation of environmental factors infuence on Kara Sea primary production in autumn // Oceanology. 2015. V. 55. P. 535–546.
Denisenko N.V., Rachor E., Denisenko S.G. Benthic fauna of the southern Kara Sea // Siberian river run off in the Kara Sea. / Eds. Stein R., Fahl K., Fütterer D.K. et al. Elsevier Science. 2003. P. 2013–236.
DFO. Assessment of snow crab (Chionoecetes opilio) in the southern Gulf of St. Lawrence (Areas 12, 12E, 12F and 19) to 2020 and advice for the 2021 fishery // DFO Canadian Science Advisory Secretariat Science Advisory Report 2021/021. 2021. 20 p. www.dfo-mpo.gc.ca/csas-sccs/ [последнее посещение 10.01.2022].
Ernst B., Orensanz L.J.M., Armstrong D. Spatial dynamics of females snow crab (Chionoecetes opilio) in the eastern Bering Sea // Can. J. Fish. Aquat. Sci. 2005. V. 62. P. 250–268.
Gavrilo V.V., Popov A.V. Sea ice biotopes and biodiversity hotspots of the Kara and the north-eastern Barents Sea // Atlas of the Marine and Coastal Biodiversity of the Russian Arctic / Eds. Gavrilo V.A, Nikolaeva M.V., Krasnova N.G. Moscow: WWF Russia. 2011. P. 34–35.
Hammer Ø. PAST: Paleontological STudies Version 3.0: Reference Manuel. Natural History Museum. Olso. 2013. http://folk.uio.no/ohammer/past/past3manual.pdf [последнее посещение 01.10.2015].
Herrmann B., Grimaldo E., Brčić J., Cerbule K. Modeling the effect of mesh size and opening angle on size selection and capture pattern in a snow crab (Chionoecetes opilio) pot fishery // Ocean & Coastal Management. 2021. V. 201. 105495. https://doi.org/10.1016/j.ocecoaman.2020.105495
Hines A.H. Geographic variation in size at maturity in brachyuran crabs // Bull. Mar. Sci. 1989. V. 45. P. 356–368.
Jaspers C., Marty L., Kiørboe T. Selection for life-history traits to maximize population growth in an invasive marine species // Global Change Biology. 2018. V. 24. № 3. P. 1164–1174. https://doi.org/10.1111/gcb.13955
Jørgensen L.L., Spiridonov V. Effect from the king- and snow crab on Barents Sea benthos // Results and conclusions from the Norwegian-Russian Workshop in Tromsø 2010. Fisken og Havet. Institute of Marine Research, Bergen, Norway, 2013. № 8. 41 p.
Kon T. Fisheries biology of the Japanese tanner crab. V. Effect of salinity on survival and growth of the larvae reared in the laboratory // Bull. Jpn. Soc. Scient. Fish. 1973. V. 39. P. 945–950.
Kulakov M.Yu., Pogrebov V.B., Timofeyev S.F. et al. Ecosystem of the Barents and Kara Seas, coastal segment (22,P) // IThe Sea, Volume 14 / Eds. Robinson A.R., Brink K.H. The President and Fellows of Harvard College. 2004. P. 1135–1172.
Kurita Y., Onikura N. Phenotypic shift of an alien piscivorous chub following translocation from a large lake to small irrigation ditches // Ecological Research. 2016. V. 31. № 5. P. 731–738. https://doi.org/10.1007/s11284-016-1380-9
Lovrich G.A., Sainte-Marie B., Smith B.D. Depth distribution and seasonal movements of Chionoecetes opilio (Brachyura: Majidae) in Baie Sainte-Marguerite, Gulf of Saint Lawrence // Can. J. Zool. 1995. V. 73. P. 1712–1726.
NPFMC. Fishery Management Plan For Bering Sea / Aleutian Islands King and Tanner Crabs. North Pacific Fishery Management Council. Anchorage, Alaska, USA. 2021. 2014 p. (https://www.npfmc.org/fishery-management-plan-team/bsai-crab-plan-team/) [последнее посещение 10.01.2022].
Orensanz J.M., Ernst B., Armstrong D. Variation of female size and stage at maturity in snow crab (Chionoecetes opilio) (Brachyura: Majidae) from the Eastern Bering Sea // J. Crust. Biol. 2007. V. 27. P. 576–591.
Otto R.S. Assessment of the eastern Bering Sea snow crab, Chionoecetes opilio, stock under the terminal molting hypothesis // Proceedings of the North pacific / Eds. Jamieson G.S., Campbell A. Symposium on Invertebrate Stock Assessment and Management. Can. Spec. Publ. Fish. Aquat. Sci. 1998. V. 125. P. 109–124.
Pavlov V.K., Pfirman S.L. Hydrographic structure and variability of the Kara Sea: implications for pollutant distribution // Deep Sea Res. II. 1995. V. 42. P. 1369–1390.
Poulin R., Hamilton W.T. Ecological determinants of body size and clutch size in amphipods: a comparative approach // Funct. Ecol. 1995. V. 9. P. 364–370.
Powles H. W. Distribution and biology of the spider crab Chionoecetes opilio in the Magdalen shallows, Gulf of St. Lawrence // Fish. Res. Board Can. MS Rep., 1968. V. 997. P. 106.
Sainte-Marie B., Hazel F. Moulting and mating of snow crabs, Chionoecetes opilio (O. Fabricius), in shallow waters of the Northwestern Gulf of Saint Lawrence // Can. J. Fish. Aquat. Sci. 1992. V. 49. № 7. P. 1282–1293. https://doi.org/10.1139/f92-144
Sainte-Marie B, Gilbert D. Possible effects of change in CIL temperature and thickness on population dynamics of snow crab, Chionoecetes opilio, in the Gulf of Saint Lawrence // Can. Stock Assess Secret. Res. Doc. 1998. V. 98. № 38. P. 19.
Sainte-Marie B., Gosselin T., Sévigny J.M., Urbani N. The snow crab mating system: opportunity for natural and unnatural selection in a changing environment // Bull. Mar. Sci. 2008. V. 83. P. 131−161.
Steele D.H. Latitudinal variations in body size and species diversity in marine decapod crustaceans of the continental shelf // Arch. Hydrobiol. 1988. V. 73. P. 235– 246.
Squires H.J., Dawe E.G. Stomach content of snow crab from the Northeast Newfoundland Shelf // J. Northwest Atl. Fish. Sci. 2003. V. 32. P. 27–38.
Timofeev S.F. Bergmann’s principle and deep-water gigantism in marine crustaceans // Biol. Bull. 2001. V. 28. P. 646–650.
Udalov A.A., Vedenin A.A., Simakov M.I. Benthic Fauna of Blagopoluchiya Bay (Novaya Zemlya Archipelago, Kara Sea) // Oceanology. 2016. V. 56. № 5. P. 720–730.
Vinogradov M.E., Vedernikov V.I., Romankevich E.A., Vetrov A.A. Components of the carbon cycle in the Russian Arctic seas: primary production and flux of Corg from the photic layer // Oceanology. 2000. V. 40. P. 204–215.
Yamasaki A. Legal minimum size and fishing period of soft-shelled male snow crab Chionoecetes opilio in order to realize the reasonable sex ratio in the Western Sea of Japan // Nippon Suisan Gakkaishi (Japanese Edition). (2000). V. 66. P. 221–227. https://doi.org/10.2331/suisan.66.221
Zalota A.K., Spiridonov V.A., Vedenin A.A. Development of snow crab Chionoecetes opilio (Crustacea: Decapoda: Oregonidae) invasion in the Kara Sea // Polar Biology. 2018. V. 41. № 10. P. 1983–1994. https://doi.org/10.1007/s00300-018-2337-y
Zalota A.K., Zimina O.L., Spiridonov V.A. Combining data from different sampling methods to study the development of an alien crab Chionoecetes opilio invasion in the remote and pristine Arctic Kara Sea // PeerJ. 2019. 7:e7952. https://doi.org/10.7717/peerj.7952
Zalota A.K., Spiridonov V.A., Galkin S., Pronin A.A. Population structure of alien snow crabs (Chionoecetes opilio) in the Kara Sea (trawl and video sampling) // Oceanology. 2020. V. 60. №. 1. P. 83–88.
Zatsepin A.V., Morozov E.V., Paka V.T. et al. Circulation in the southwestern part of the Kara Sea in September 2007 // Oceanology. 2010. V. 50. P. 643–656.
Zatsepin A.G., Zavialov P.O., Kremenetskiy V.V. et al. The upper desalinated layer water propagation and transformation in the Kara Sea // Oceanology, 2010. V. 50. P. 657–667.
Zatsepin A.G., Poyarkov S.G., Kremenetskiy V.V. et al. Hydrophisical features of deep water troughs in the Kara Sea // Oceanology. 2015. V. 55. P. 472–484.
Zheng J., Kruse G.H., Ackley D.R. Spatial distribution and recruitment patterns of snow crabs in the Eastern Bering Sea // Spatial processes and management of marine populations / Eds. Kruse G.H., Bez N., Booth A. et al. University of Alaska Sea Grant, AK-SG-02-01. 2001. P. 233–255.
Дополнительные материалы отсутствуют.