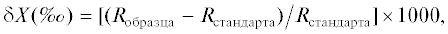Океанология, 2022, T. 62, № 6, стр. 924-932
Трофический статус макробентоса на континентальном склоне охотского моря по изотопному составу углерода и азота
К. М. Горбатенко 1, *, С. И. Кияшко 2
1 Тихоокеанский филиал ФГБНУ “ВНИРО” (“ТИНРО”)
Владивосток, Россия
2 Национальный научный центр морской биологии им. А.В. Жирмунского ДВО РАН
Владивосток, Россия
* E-mail: gorbatenko@tinro.ru
Поступила в редакцию 19.12.2020
После доработки 05.07.2021
Принята к публикации 30.09.2021
- EDN: HEFTUW
- DOI: 10.31857/S0030157422060041
Аннотация
Определены соотношения стабильных изотопов углерода (13C/12C) и азота (15N/14N) в мягких тканях у 41 массового вида макробентоса континентального склона Охотского моря. Значения δ13С у исследованных видов и групп бентосных беспозвоночных сильно варьируют, отражая разнообразие состава их рационов. Диапазон значений δ15N (от 6.8 до 18.3‰) соответствует четырем трофическим уровням: от второго (для двустворчатых моллюсков-детритофагов) до пятого (для некоторых хищных видов гастропод, полихет и морских звезд).
ВВЕДЕНИЕ
Изучение функционирования морских сообществ, эксплуатируемых рыболовством, требует определения потоков вещества и энергии, которые ими используются и проходят по их пищевым цепям. Поэтому в основу выделения элементов пелагического или донного населения наиболее удобно положить способы питания животных и определение их положения в трофической иерархии пищевых цепей. Традиционно такого рода информацию получают, исследуя содержимое желудков животных, например, такие исследования проводили ранее в Охотском море для установления типа питания доминирующих видов макробентоса [13]. Однако анализ содержимого желудков у глубоководных беспозвоночных сталкивается со сложностью в определении пищевых компонентов в рационе, так как зачастую пища очень сильно измельчена и не поддается определению.
Помимо анализа содержимого желудков, возможность существенно уточнить трофические связи животных дает изотопный анализ углерода (13C/12C) [см. обзор 17] и азота (15N/14N) [23, 30] в их тканях. Изотопный состав углерода органического вещества претерпевает слабые изменения по мере его прохождения по пищевой цепи от растений к растительноядным животным и далее к хищникам, что позволяет использовать величины δ13С в качестве маркера источников пищи [17]. Изотопы азота подвергаются более значительному фракционированию в ходе метаболических процессов, что приводит к закономерному обогащению тканей консументов тяжелым изотопом 15N на каждом последующем трофическом уровне [27]. Это дает возможность определять по изотопному составу азота трофический статус исследуемых организмов в экосистеме [30].
Цель настоящей работы заключалась в определении трофических позиций доминирующих видов макробентоса континентального склона Охотского моря, на основе сравнительного анализа изотопного состава углерода и азота. Ранее подобные исследования были проведены на западнокамчатском шельфе [4].
МАТЕРИАЛ И МЕТОДЫ
В основу работы положены сборы макробентоса из донных траловых съемок, выполненных в ходе экспедиций ТИНРО-центра в восточной части Охотского моря на материковом склоне в интервале глубин 340–965 м (рис. 1). Донные биотопы в районе исследования довольно однородны, в осадках в основном преобладают алевритовые и пелитовые илы с отдельными вкраплениями крупнообломочных осадков, формирующиеся в результате оползней и ледового разноса, а в донной фауне преобладают различные детритоеды [7].
Рис. 1.
Расположение точек отбора проб донных беспозвоночных на континентальном склоне Охотского моря в 2010–2013 гг., выполненного для изучения изотопного состава углерода и азота.
Для изотопного анализа из траловых уловов были взяты пробы 41 вида крупных бентосных и придонных беспозвоночных, большинство из которых было представлено, учитывая однородность биотопов, только одним экземпляром. Пробы всех исследованных видов были собраны в осенний период 2013 г. Кроме того, для четырех массовых промысловых видов (гастропода Buccinum pemphigus; креветки Argis ochotensis и Pandalopsis longirostris; краб Chionoecetes angulatus) ранее были взяты пробы в летне-осенний сезон 2010 и 2012 гг. (табл. 1). Всего было исследовано 62 пробы, каждая из которых представляла отдельный экземпляр животного. Для анализа у большинства беспозвоночных брали мышечные ткани: у моллюсков – ногу и мантию; у голотурий, полихет и актиний – кожно-мускульный мешок; у крабов и крабоидов – мышцы бедра; у креветок – мышцы абдомена. Исключение составили морские звезды и морские ежи, у которых для анализа брали гонады. Все образцы тканей, за исключением стенки тела голотурий, не содержали остатков карбонатного скелета.
Таблица 1.
Изотопный состав углерода и азота доминирующих видов макробентоса на континентальном склоне Охотского моря
| Группа | Компонент | Индекс | Тип питания | Год | n | δ13C ± SD (‰) | δ15N ± SD (‰) | ТУ |
|---|---|---|---|---|---|---|---|---|
| Actiniaria | Liponema brevicorne | 1 | П | 1 | –18.0 | 15.4 | 4.5 | |
| Actiniaria fam. gen. sp. | 2 | П | 1 | –18.1 | 11.0 | 3.2 | ||
| Polychaeta | Ampharete acutifrons | 3 | Д | 1 | –20.9 | 11.8 | 3.5 | |
| Aphrodita australis | 4 | П | 1 | –14.2 | 17.5 | 5.1 | ||
| Eunoe nodosa | 5 | П | 1 | –15.8 | 14.5 | 4.3 | ||
| Nereis sp. | 6 | П | 1 | –17.9 | 14.3 | 4.2 | ||
| Polychaeta fam. gen. sp. | 7 | Д | 1 | –17.4 | 12.7 | 3.7 | ||
| Sipuncula | Golfingia margaritacea | 8 | Д | 1 | –15.3 | 13.0 | 3.8 | |
| Aplacophora | Neomenia sp. | 9 | П | 1 | –18.3 | 15.3 | 4.5 | |
| Bivalvia | Megayoldia thraciaeformis | 10 | Д | 1 | –16.0 | 6.8 | 2.0 | |
| Parvamussium alaskense | 11 | С | 1 | –17.3 | 13.8 | 4.1 | ||
| Gastropoda | Cryptonatica sp. | 12 | П | 1 | –15.0 | 10.5 | 3.1 | |
| Buccinum pemphigus | 13 | П/П | 2010 | 3 | –15.9 ± 0.5 | 16.0 ± 0.2 | 4.7 | |
| 2013 | 2 | –16.1 ± 0.4 | 16.0 ± 1.0 | 4.7 | ||||
| Clinopegma chikaoi | 14 | П/П | 1 | –15.4 | 15.9 | 4.7 | ||
| Ancistrolepis grammatus | 15 | П/П | 2 | –15.4 ± 0.7 | 16.6 ± 0.1 | 4.9 | ||
| Neancistrolepis glabra | 16 | П/П | 1 | –18.8 | 16.2 | 4.8 | ||
| Neptunea convexa | 17 | П/П | 2 | –16.6 ± 1.2 | 17.4 ± 0.5 | 5.1 | ||
| Neptunea laticostata | 18 | П/П | 3 | –14.7 ± 0.1 | 16.3 ± 1.0 | 4.8 | ||
| Neptunea pribiloffensis | 19 | П/П | 1 | –15.2 | 16.8 | 4.9 | ||
| Cirripedia | Chirona evermanni | 20 | С | 1 | –18.4 | 14.1 | 4.1 | |
| Caridea | Argis ochotensis | 21 | П | 2010 | 3 | –14.5 ± 0.3 | 14.9 ± 0.3 | 4.4 |
| 2013 | 1 | –14.2 | 14.4 | 4.2 | ||||
| Pandalopsis longirostris | 22 | П | 2010 | 3 | –17.5 ± 0.1 | 14.9 ± 0.3 | 4.4 | |
| 2013 | 1 | –17.1 | 15.1 | 4.4 | ||||
| Pandalopsis ochotensis | 23 | П | 1 | –17.0 | 14.7 | 4.3 | ||
| Pandalus borealis | 24 | П | 3 | –17.0 ± 0.6 | 14.2 ± 0.9 | 4.2 | ||
| Pasiphaea pacifica | 25 | П | 1 | –18.2 | 14.1 | 4.1 | ||
| Sclerocrangon derjugini | 26 | П | 1 | –15.3 | 15.8 | 4.6 | ||
| Brachyura | Chionoecetes angulatus | 27 | П | 2010 | 3 | –16.3 ± 0.6 | 15.2 ± 0.3 | 4.5 |
| 2012 | 2 | –15.9 ± 0.3 | 15.1 ± 0.6 | 4.4 | ||||
| 2013 | 1 | –16.3 | 14.8 | 4.4 | ||||
| Chionoecetes opilio | 28 | П | 1 | –14.3 | 14.0 | 4.1 | ||
| Anomura | Lithodes aequispinus | 29 | П | 1 | –14.3 | 14.0 | 4.1 | |
| Lithodes couesi | 30 | П | 1 | –16.4 | 15.4 | 4.5 | ||
| Paralomis multispina | 31 | П | 1 | –16.3 | 15.2 | 4.5 | ||
| Paralomis verrilli | 32 | П | 1 | –16.2 | 15.8 | 4.6 | ||
| Echinoidea | Brisaster townsendi | 33 | Д | 1 | –16.4 | 11.4 | 3.4 | |
| Asteroidea | Ceramaster patagonicus | 34 | П | 1 | –16.0 | 15.0 | 4.4 | |
| Ctenodiscus crispatus | 35 | Д | 1 | –15.0 | 11.4 | 3.3 | ||
| Diplopteraster multipes | 36 | П | 1 | –13.3 | 17.2 | 5.1 | ||
| Hippasteria phrygiana | 37 | П | 1 | –14.9 | 14.7 | 4.3 | ||
| Myxoderma sacculatum | 38 | П | 1 | –12.9 | 13.4 | 3.9 | ||
| Asteroidea fam. gen. sp. | 39 | П | 1 | –15.4 | 15.5 | 4.6 | ||
| Holothuroidea | Molpadia roretzii | 40 | Д | 1 | –15.8 | 18.3 | 5.4 | |
| Synallactes nozawai | 41 | Д | 1 | –14.8 | 14.0 | 4.1 |
Образцы ополаскивали дистиллированной водой для удаления солей, сушили в сушильном шкафу в течение 24 ч при температуре 60°С и хранили на борту судна при температуре –18°С. После доставки в лабораторию пробы перетирали с помощью корундовой ступки и обезжиривали смесью хлороформа и этанола, чтобы исключить влияние липидов, по-разному накапливающихся в различных тканях (в частности, гонадах иглокожих) и существенно обедненных изотопом 13C [32]. Для образцов голотурий и морских звезд, содержавших известковые спикулы, проводили повторный анализ изотопного состава углерода после полного удаления минерального карбоната путем обработки проб 1 N раствором HCl.
Изотопный анализ проб выполнен в Лаборатории стабильных изотопов Дальневосточного геологического института ДВО РАН с использованием элементного анализатора FlashEA-1112, соединенного через интерфейс ConFlo IV с изотопным масс-спектрометром MAT-253 (Thermoquest). Содержание изотопов 13С и 15N в образцах выражено в промилле относительно соответствующего международного стандарта (VPDB в случае величин δ13С и атмосферного азота в случае величин δ15N) :
где X является 13C или 15N, а R является 13C/12C или 15N/14N, соответственно.Для калибровки измеренных величин в международные шкалы использованы стандарты CH-6, NBS-22, N-1 и N-2 (Международное агентство по атомной энергии, Вена). Точность определения величин δ13С и δ15N составила ±0.1‰.
Трофический уровень консументов (ТУк), занимаемый тем или иным видом в пищевой сети, определяли по изотопному составу азота [30]:
Группировку видов по типам питания проводили по литературным данным о составе пищи глубоководных видов [1–3, 5, 6, 8, 9, 14, 19], а при отсутствии таковых – по известным способам питания у родственных видов [7, 10–13, 16, 18].
РЕЗУЛЬТАТЫ
Изотопный состав углерода и азота в образцах 41 вида донных беспозвоночных, из 9 таксономических групп, приведен в табл. 1. Разброс значений δ13С всех образцов составил 8‰ (от –20.9 до –12.9‰), а значения δ15N варьировали от 6.8 до 18.3‰, составляя диапазон в 11.5‰. Образцы одних и тех же видов, собранные в различные годы и в разных районах исследованной акватории (рис. 1): гастроподы Buccinum pemphigus, креветки Argis ochotensis и Pandalopsis longirostris, и краб Chionoecetes angulatus показали незначительные внутривидовые вариации как значений δ13С, так и значений δ15N, не превышающих 0.5‰ (табл. 1). Внутри таксономических групп исследованных беспозвоночных вариации изотопных показателей были гораздо бóльшими. Так двустворчатый моллюск Megayoldia thraciaeformis показал самое низкое значение δ15N (6.8‰) среди всех беспозвоночных, а другая двустворка, Parvamussium alaskense, показала, напротив, очень высокое значение δ15N (13.8‰) при сходном изотопном составе углерода.
Показатель δ15N у восьми исследованных видов плотоядных гастропод изменялся в пределах от 10.5 до 17.4‰ (табл. 1). Самое низкое значение δ15N среди гастропод было у натициды Cryptonatica sp. (10.5‰). Остальные гастроподы принадлежали к сем. Buccinidae и характеризовались гораздо более высокими значениями δ15N (от 15.9 до 17.4‰) и очень сходными значениями δ13С (от –16.6 до –14.7‰), за исключением Neancistrolepis glabra, которая показала самое низкое значение δ13С (–18.8‰) среди гастропод.
Наибольшие межвидовые вариации изотопного состава среди беспозвоночных отмечены у полихет. Среди них Ampharete acutifrons показала наиболее низкие значения δ13С и δ15N (–20.9 и 11.8‰, соответственно), а хищная полихета Aphrodita australis – самые высокие (–14.2 и 17.5‰, соответственно) (табл. 1) .
Креветки, крабы и крабоиды имели сравнительно узкий диапазон значений δ15N от 14.1 до 15.8‰, которые были существенно ниже таковых у плотоядных гастропод-букцинид, и имели относительно большой разброс значений δ13С от ‒18.2 до –14.2‰ (табл. 1). Донные шримсы Sclerocrangon derjugini и Argis ochotensis, а также равношипый краб Lithodes aequispina и краб-стригун Chionoecetes opilio показали наиболее высокие значения δ13С. Придонная креветка Pasiphaea pacifica оказалась среди наиболее обедненных изотопом 13С беспозвоночных, таких как актинии, усоногие раки Chirona evermanni и борозчатобрюхий моллюск Neomenia sp. (табл. 1).
Диапазон вариаций δ15N шести видов морских звезд (от 11.4 до 17.2‰) сопоставим с таковым полихет. Самое низкое значение δ15N показала морская звезда Ctenodiscus crispatus, которая была близка по изотопному составу к морскому ежу Brisaster townsendi. Самое высокий показатель δ15N среди морских звезд был у Diplopteraster multipes (табл. 1). По показателям δ13С (от –16.0 до –12.9‰) все морские звезды были среди наиболее обогащенных изотопом 13С беспозвоночных, несмотря на полное удаление скелетного карбоната при повторных анализах (см. Материал и Методы). Голотурии имели сходный изотопный состав углерода, но один из них, Molpadia roretzii, был максимально обогащен изотопом 15N среди всех исследованных нами беспозвоночных.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Основным исходным источником органического углерода для батиального сообщества Охотского моря (рис. 3), как и для других не-хемотрофных глубоководных сообществ, являются первичные продуценты эпипелагиали [10, 31]. Однако, углерод большинства донных беспозвоночных материкового склона существенно обогащен изотопом 13С (рис. 2) по сравнению с пищевой сетью зоопланктона эпипелагиали Охотского моря [20]. Сходное обогащение изотопом 13С батиальной фауны по сравнению с зоопланктоном ранее было показано и для других глубоководных сообществ [15, 28, 29, 34]. Основными причинами обогащения глубоководной донной макрофауны изотопом 13С считают потребление микроорганизмов, мейофауны и переработанного органического вещества [22, 26]. В Охотском море, в котором акватория над материковым склоном значительную часть года покрыта льдом, дополнительной причиной высоких значений δ13С глубоководной фауны может быть существенный вклад оседающих после таяния льдов ледовых водорослей, которые обычно сильнее обогащены 13С по сравнению с фитопланктоном [23].
Рис. 2.
Соотношения стабильных изотопов углерода и азота донных беспозвоночных на континентальном склоне Охотского моря. Цифровые обозначения соответствуют индексам компонентов (см. табл. 1). Штриховкой выделена область изотопных значений, характерных для различных видов эпипелагического зоопланктона глубоководной части Охотского моря [по данным 21].

Рис. 3.
Блок-схема пищевых связей основных трофических групп макробентоса на континентальном склоне Охотского моря. Пунктирными стрелками показаны потоки органического вещества, создаваемого мертвыми организмами.
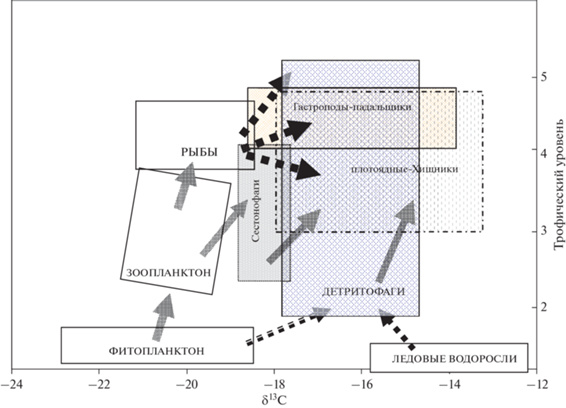
Сестонофаги в исследованном нами сообществе (двустворчатый моллюск Parvamussium alaskense и усоногий рак Chirona evermanni) были среди наименее обогащенных 13С видов и по значениям δ13С близки к зоопланктону. По значениям δ15N эти сестонофаги близки к наиболее хищным организмам зоопланктона (рис. 2) и плотоядной мезопелагической креветке Pasiphaea pacifica (табл. 1), что свидетельствует об их высоком трофическом статусе. Очевидно, существенную часть пищи P. alaskense и Ch. evermanni составляли мелкие планктонные ракообразные, что подтверждает плотоядный характер питания некоторых глубоководных сестонофагов – двустворок-пектинид и усоногих раков [10].
Детритофаги показали максимальный разброс полученных значений ТУк (от 2 до 5.4) и величин δ13С и δ15N в исследуемом сообществе (рис. 2, 3). Очевидно, это обусловлено питанием различных видов глубоководных детритофагов как поступающим из эпипелагиали свежим детритом (оседающими микроводорослями, фекальными пелетами, мертвыми останками мелких организмов зоопланктона), так и органическим веществом донных осадков, обогащенным тяжелыми изотопами углерода и азота в результате многократной переработки донными микробиальными сообществами. Так, глубоководные селективные детритофаги Megayoldia питаются свежим органическим материалом оседающих микроводорослей (преимущественно диатомей) [24] и могут рассматриваться как характерные представители второго трофического уровня. В нашем исследовании двустворка Megayoldia thraciaeformis показала самое низкое значение δ15N (6.8‰) среди всех донных беспозвоночных, соответствующее трофическому статусу растительноядного зоопланктона [20] и была принята нами за основание данной пищевой цепи материкового склона) (ТУк = 2.0). Большинство остальных видов детритофагов (полихеты, сипункулиды, морской еж Brisaster townsendi, морская звезда Ctenodiscus crispatus) располагались между 3 и 4 трофическими уровнями (рис. 2). Вероятно, организмы донной мейофауны и/или фрагменты зоопланктона играли значительную роль в питании этих детритофагов, существенно повышая их трофический статус. Исключение составляли детритофаги-голотурии: Synallactes nozawai и, особенно, Molpadia roretzii, которые показали обогащение изотопом 15N даже по сравнению со многими хищными организмами (рис. 2). Значения δ15N этих видов соответствуют ТУк 4.1 и 5.4, соответственно (табл. 1) и, очевидно, не отражают их реальное положение в трофической иерархии сообщества. Аномальный изотопный состав азота у глубоководных голотурий может быть результатом ассимиляции этими детритофагами микроорганизмов и детрита, обогащенного изотопом 15N в ходе его глубокой переработки в толще донных осадков [22, 25]. Подобные несоответствия степени обогащения изотопом 15N типу питания были отмечены и ранее для некоторых глубоководных беспозвоночных [20, 31], что заставляет относиться к оценкам трофического уровня глубоководных организмов по значениям δ15N с большой долей осторожности. Кроме того, так как глубоководные голотурии по изотопному составу азота близки к гастроподам-падальщикам, вероятно локальное присутствие в их питании мелкодисперсной фракции останков рыб, разлагающихся в донном осадке, что также приводит к возрастанию величин δ15N в тканях этих организмов.
Среди плотоядных самые низкие значения δ15N показали хищная гастропода Cryptonatica sp. (10.5‰) и актиния неопределенного вида. Изотопный состав азота криптонатики точно соответствует ее специализированному питанию двустворчатыми моллюсками [12], в данном случае мегайолдиями, а актинии – питанию мирным зоопланктоном и положению консументов второго порядка в трофической иерархии (ТУк 3.1–3.2). Большинство остальных плотоядных видов заняли разное положение между 4-м и 5-м трофическими уровнями (рис. 2). Хищная полихета Aphrodita australis и морская звезда Diplopteraster multipes показали самые высокие значения δ13С и δ15N, соответствующие вершине пищевой цепи, состоящей из донных беспозвоночных (ТУк = 5.1)
Букциниды, группа хищных гастропод-падальщиков, показывают более высокие значения (ТУк от 4.7 до 5.1), по сравнению с другой массовой группой плотоядных – крупными крабами и крабоидами (ТУк 4.1–4.5), соответствующие их месту как высших консументов-падальщиков в донной пищевой сети, потребляющих останки рыб, опускающиеся на дно из пелагиали (рис. 3).
Одна из гастропод-букцинид, Neancistrolepis glabra, показала по сравнению с другими плотоядными самые низкие значения δ13С, соответствующие пелагической пищевой сети (рис. 2). Вероятно, что эта гастропода являлась падальщиком, питающимися преимущественно останками зоопланктона и пелагических рыб, как и сходные с ней по изотопному составу бороздчатобрюхий моллюск Neomenia sp. и актиния L. brevicornis.
Креветки, крабы и крабоиды показали сравнительно узкий диапазон значений δ15N – от 14.0 до 15.8‰, соответствующий сходному трофическому статусу (табл. 1). Однако, относительно большой размах значений δ13С (от –18.2 до –15.3‰), установленных для этой группы животных, указывает на разнообразие источников их питания. Мезопелагическая креветка Pasiphaea pacifica и придонные креветки (Pandalopsis. longirostris, P.ochotensis и Pandalus borealis) обеднены изотопом 13С (от –18.2 до –17‰) по сравнению с донными шримсами и крабами и очевидно в большей степени были связаны с пелагической пищевой цепью. Шримсы Sclerocrangon derjugini и Argis ochotensis, а также равношипый краб Lithodes aequispina и краб-стригун Chionoecetes opilio показали наиболее высокие значения δ13С, соответствующие питанию бентосными беспозвоночными из пищевой цепи, основанной на детрите (рис. 2).
ЗАКЛЮЧЕНИЕ
Величины δ15N и δ13С у животных исследованных видов и групп бентосных беспозвоночных на континентальном склоне Охотского моря сильно варьируют, тем самым показывая разнообразие состава рационов. Диапазон значений межвидовых вариаций δ15N составил около 11.5‰, что формально соответствует четырем трофическим уровням. Размах вариаций значений δ13С бентоса материкового склона составил 5.6‰, однако в целом, углерод донного сообщества беспозвоночных существенно обогащен изотопом 13С по сравнению с пищевой сетью зоопланктона эпипелагиали Охотского моря. Среди исследованных плотоядных видов бентоса можно выделить две группы: виды с наиболее низкими значениями δ13С, свидетельствующими о питании преимущественно животными пелагического происхождения, и виды с высокими значениями δ13С, свидетельствующими о питании преимущественно донными животными.
Следует отметить, что определенную сложность при изучении глубоководных сообществ может представлять установление трофического статуса глубоководных гидробионтов по значениям δ15N, так как в пищевых сетях глубоководных сообществ в эвтрофных районах моря могут интегрироваться как сезонные потоки оседающих после “цветения” диатомей, так и органическое вещество, многократно переработанное в микробиальных пищевых цепях [21, 28]. Кроме того, существенный вклад может вносить “дождь трупов"(зоопланктона, рыб) поступающий с разных трофических уровней очень продуктивной экосистемы эпипелагиали [33].
Список литературы
Буруковский Р.Н. Питание и пищевые взаимоотношения креветок. Калиниград: ФГОУ ВПО “КГТУ”, 2009. 409 с.
Голиков А.Н. Брюхоногие моллюски рода Neptunea Bolten. М.-Л.: Изд-во АН СССР, 1963. 183 с.
Голиков А.Н. Моллюски Buccininae Мирового океана. Л.: Наука, 1980. 466 с.
Горбатенко К.М., Кияшко С.И., Лаженцев А.Е. и др. Трофические отношения и бенто-пелагические связи на западнокамчатском шельфе Охотского моря по данным анализа содержимого желудков и стабильных изотопов δ13С и δ15N. // Изв. ТИНРО. 2013. Т. 175. С. 3–25.
Надточий В.А.,Чучукало В.И., Кобликов В.Н. Характеристика питания камчатского и равношипого крабов на юге западнокамчатского шельфа в летний период // Изв. ТИНРО. 1998. Т. 124. С. 651–657.
Надточий В.А., Чучукало В.И., Кобликов В.Н. Питание краба-стригуна Chionoecetes opilio в Анадырском заливе Берингова моря в осенний период // Изв. ТИНРО. 2001. Т. 128. С. 432–436.
Савилов А.И. Экологическая характеристика донных сообществ беспозвоночных Охотского моря // Тр. Ин-та океанологии АН СССР. 1961. Т. 46. С. 3–85.
Соколова М.Н. Питание некоторых видов дальневосточных Crangonidae // Тр. Ин-та океанологии АН СССР. 1957. Т. 23. С. 269–285.
Соколова М.Н. Питание глубоководных донных беспозвоночных детритоедов // Тр. Ин-та океанол. АН СССР. 1958. Т. 27. С. 123–153.
Соколова М.Н. Питание и трофическая структура глубоководного макробентоса. М.: Наука, 1986. 207 с.
Турпаева Е.П. Питание и пищевые группировки морских донных беспозвоночных // Тр. Ин-та океанол. АН СССР. 1953. Т. 7. С. 259-299.
Цихон-Луканина Е.А. Трофология водных моллюсков. М.: Наука, 1987. 175 с.
Чучукало В.И. Питание и пищевые отношения нектона и нектобентоса в дальневосточных морях. Владивосток: ТИНРО-центр, 2006. 484 с.
Carey A.G. Jr. Food sources of sublittoral, bathyal and abyssal asteroids in the northeast Pacific Ocean // Ophelia. 1972. V. 10. P. 35–47.
Fanelli, E., Papiol, V., Cartes, J.E. et al. Food web structure of the epibenthic and infaunal invertebrates on the Catalan slope (NW Mediterranean): evidence from δ13C and δ15N analysis // Deep-Sea Research I. 2011. V. 58. P. 98–109.
Fauchald K., Jumars P.A. The diet of worms: a study of polychaete fiding guilds // Oceanogr. Mar. Biol. Ann. Rev. 1979. V. 17. P. 193–284.
Fry B., Sherr E. B. 13C measurements as indicators of carbon flow in marine and freshwater ecosystems // Contrib. Mar. Sci. 1984. V. 27. P. 13–47.
Gale K.S.P., Hamel J.-F., Mercier A. Trophic ecology of deep-sea Asteroidea (Echinodermata) from eastern Canada // Deep-Sea Research I. 2013. V. 80. P. 25–36.
Gontikaki E., Mayor D.J., Narayanaswamy B.E., Witte U. Feeding strategies of deep-sea sub-Arctic macrofauna of the Faroe-Shetland Channel: combining natural stable isotopes and inrichment techniques // Deep-Sea Research I. 2011. V. 58. P. 160–172.
Gorbatenko K.M., Lazhentsev A.E., Kiyashko S.I. Seasonal dynamics of the trophic status of zooplankton in the Sea of Okhotsk (based on data from stable carbon- and nitrogen-isotope analysis) // Russian Journal of Marine Biology. 2014. V. 40. P. 519–531.
Iken K., Brey T., Wand U. et al. Food web structure of the benthic community at the Porcupine Abyssal Plain (NE Atlantic): a stable isotope analysis // Progress in Oceanography. 2001. V. 50. P. 383–405.
Iken K., Bluhm B.A., Gradinger R. Food web structure in the high Arctic Canada Basin: evidence from δ13C and δ15N analysis // Polar Biology. 2005. V. 28. P. 238–249.
Jennings S., van der Molen J. Trophic levelof marine consumers from nitrogen stable isotope analysis: estimation and uncertainty // ICES Journal of Marine Science. 2015. V 72. P. 2289−2300.
Kharlamenko V.I., Brandt A., Kiyashko S.I., Würzberg L. Trophic relationship of benthic invertebrate fauna from the continental slope of the Sea of Japan // Deep-Sea Research II. 2013. V. 86–87. P. 34–42.
Kharlamenko V.I., Stepanov V.G., Borisovets E.E. et al. The fatty-acid composition and nutrition of deep-sea holothurians from the Sea of Okhotsk // Russian Journal of Marine Biology. 2015. V. 41. P. 448–455.
Mincks S.L., Smith C.R., Jeffreys R.M., Sumida P.Y.G. Trophic structure on the West Antarctic Peninsula shelf: detritivory and benthic inertia revealed by δ13C and δ15N analysis // Deep-Sea Research II. 2008. V. 55. P. 2502–2514.
Minagawa M., Wada E. Stepwise enrichment of 15N along food chains: further evidence and the relation between δ15N and animal age. // Geochimica Cosmochimica Acta. 1984. V. 48. P. 1135–1140.
Papiol V., Cartes J.E., Fanelli E., Rumolo P. Food web structure and seasonality of slope megafauna in the NW Mediterranean elucidated by stable isotopes: relationship with available food sources // Journal of Sea Research. 2013. V. 77. P. 53–69.
Polunin N.V.C., Morales-Nin B., Pawsey W.E. et al. Feeding relationships in Mediterranean bathyal assemblages elucidated by stable nitrogen and carbon isotope data // Marine Ecology Progress Series. 2001. V. 220. P. 13–23.
Post D.M. Using stable isotopes to estimate trophic position: models, methods, and assumption // Ecology. 2002. V. 83. P. 703–718.
Reid W.D.K., Wigham B.D., McGill R.A.R., Polunin N.V.C. Elucidating trophic pathways in benthic deep-sea assemblages of the Mid-Atlantic Ridge north and south of the Charlie-Gibbs Fracture Zone // Mar. Ecol. Progr. Ser. 2012. V. 463. P. 89–103.
Sato M., Sasaki H., Fukuchi M. Stable isotopic compositions of overwintering copepods in the arctic and subarctic waters and implications to the feeding history // J. Mar. Systems. 2002. V. 38. P. 165–174.
Sokolova M.N. Trophic structure of abyssal macrobenthos // Adv. Mar. BIiol. 1997. V. 32. P. 427–525.
Søreide J.E., Michael L. Carroll M.L., Haakon Hop W.G. A. Jr. et al. Sympagic-pelagic-benthic coupling in Arctic and Atlantic waters around Svalbard revealed by stable isotopic and fatty acid tracers // Marine Biology Research. 2013. V. 9. P. 831–850.
Дополнительные материалы отсутствуют.