Океанология, 2022, T. 62, № 6, стр. 911-923
Пространственное распределение фитопланктона прибрежных вод острова Русский (залив Петра Великого, Японское море)
О. Г. Шевченко 1, *, К. О. Тевс 2
1 Национальный научный центр морской биологии им. А.В. Жирмунского ДВО РАН
Владивосток, Россия
2 Дальневосточный федеральный университет
Владивосток, Россия
* E-mail: 713553@mail.ru
Поступила в редакцию 17.03.2022
После доработки 11.04.2022
Принята к публикации 28.04.2022
- EDN: ZTUDDC
- DOI: 10.31857/S0030157422060119
Аннотация
Исследованы видовой состав, количественные характеристики и пространственное распределение фитопланктона прибрежных вод вокруг острова Русский. Отмечено 144 таксона микроводорослей, относящихся к 5 классам; их численность варьировала в переделах 3.6 × 104–4.7 × 106 кл./л, биомасса – 0.2 г/м3 – 18.3 г/м3. Впервые в сентябре 2018 г. зарегистрировано “цветение” воды, обусловленное массовым развитием комплекса видов рода Cyclotella – Cyclotella sp., С. atomus var. gracilis и С. choctawhatcheeana. Анализ сходства видового состава и численности микроводорослей показал, что в летний период на акватории Амурского и Уссурийского заливов был схожий состав доминирующих видов, в планктоне преобладали широко распространенные Skeletonema dohrnii, Pseudo-nitzschia delicatissima, Prorocentrum triestinum, вызывающие “цветения” воды в умеренных широтах Мирового океана. Осенью состав доминирующих видов был характерен для каждого из заливов: в 2018 г. в Уссурийском – комплекс видов рода Cyclotella, в Амурском – комплекс видов рода Thalassiosira; в 2019 г. в Уссурийском – Skeletonema dohrnii, в Амурском – Thalassiosira nordenskioeldii и Teleaulax amphioxeia. Выдвинуто предположение, что распространение видов из одного залива на акваторию другого осуществлялось через пролив Старка и находилось в зависимости от направления преобладающих ветров.
ВВЕДЕНИЕ
В условиях интенсивного антропогенного воздействия и глобального изменения климата изучение биологического разнообразия и структурно-функциональной организации водной биоты остается актуальным направлением современных гидробиологических и экологических исследований [8]. Значительное влияние на пространственное распределение микроводорослей оказывают поверхностные течения [16]. В зал. Петра Великого (Японское море) главенствующую роль в формировании течений осуществляют субмезомасштабные динамические явления в верхнем квазиоднородном слое [10]. Обладая высокой кинетической энергией, они обуславливают обмен теплом, солью и любыми трассерами, в том числе растворенными газами, загрязняющими веществами и биогенными элементами, которые в свою очередь оказывают влияние на развитие фитопланктона [26]. Водные растительные сообщества активно используют для оценки качества среды, а также в качестве показателей состояния экосистем водоемов. Фитопланктон является интегральным показателем совокупного действия факторов среды на биоту и первым реагирует на различные виды воздействия путем изменения видового состава и структурно-функциональных характеристик [1, 53].
Среди островов зал. Петра Великого крупнейшим является о-в Русский. С запада остров граничит с Амурским заливом, исследованию фитопланктона которого посвящено более 40 публикаций. Среди них есть работы по изучению сообщества в целом [5, 14, 22–25, 43], отдельных родов микроводорослей [21, 32, 34, 36, 40, 41], проблем эвтрофирования и “цветения” воды [27, 31, 35]. Результаты многолетних исследований флоры микроводорослей акватории обобщены в работе Орловой Т.Ю. с соавторами [20]. Восточное побережье о-ва Русский омывает Уссурийский залив – наиболее крупный на акватории зал. Петра Великого. Исследования фитопланктона залива фрагментарны: показано пространственно-временнóе изменение весенне-осеннего фитоцена [28], изучены качественный и количественный состав фитопланктона в б. Сухопутная [5].
Настоящая статья является продолжением многолетних исследований фитопланктона прибрежных вод о-ва Русский [64, 66]. Сборы материала вокруг острова были выполнены в период начала активной эксплуатации побережья – функционирование Дальневосточного федерального университета, “Приморского океанариума” – филиала ННЦМБ ДВО РАН, марикультурных хозяйств, мостов, автомобильных дорог.
Цель данной работы – определить видовой состав и количественные характеристики фитопланктона, оценить пространственное распределение микроводорослей в Амурском и Уссурийском заливах.
МАТЕРИАЛ И МЕТОДИКА
Материал. В основу работы легли планктонные сборы, выполненные 21 сентября 2018, 17 сентября 2019, 16 июня и 14 июля 2020 гг. на 15 станциях, расположенных в прибрежной зоне о-ва Русский (рис. 1). Пробы фитопланктона отбирали с катера 5-литровым батометром Нискина с горизонта 0.5 м. Всего было собрано и обработано 60 проб. Температуру и соленость поверхностного слоя воды измеряли с помощью многопараметрического зонда HORIBA U-52G.
Рис. 1.
(а) Карта-схема расположения станций в прибрежных вода о-ва Русский. Черными стрелками указаны направления постоянных течений [17]. (б) Схема ветровых течений при различных ветрах: весенне-летний период – юго-восточные ветра, осенне-зимний период – северо-западные ветра, по Храпченкову Ф.Ф. с соавторами [39].
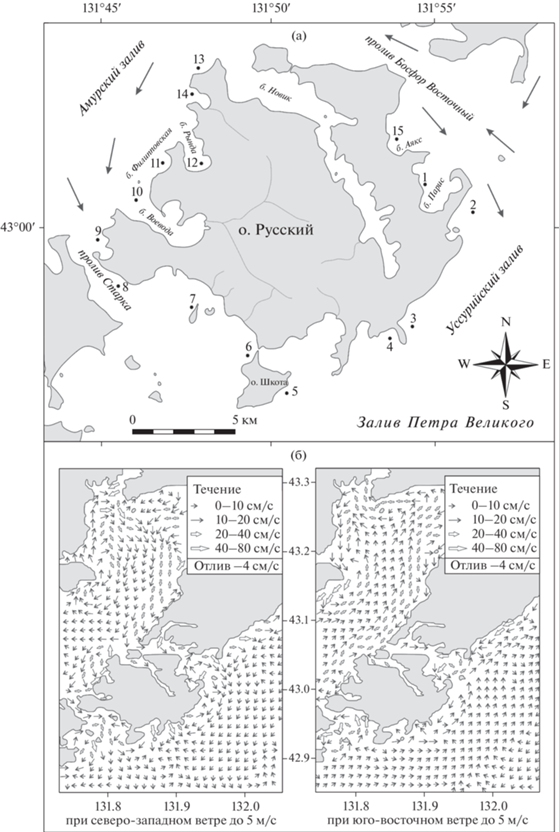
Характеристика района исследования. Залив Петра Великого располагается в северо-западной части Японского моря (42°17ʹ–42°40ʹ с.ш., 130°41ʹ– 133°02ʹ в.д.) и является наиболее крупным. Залив разделен п-вом Муравьева-Амурского и группой островов, расположенных к юго-западу от него, на два крупнейших залива второго порядка: Амурский и Уссурийский. Максимальные глубины Амурского залива не превышают 50 м [9], Уссурийского залива – 60–70 м [17]. Исследуемый нами о-в Русский расположен к северо-западу от п-ова Муравьева-Амурского. В берега острова вдается несколько бухт, наибольшая из которых б. Новик. Эта бухта делит остров на северо-восточную и юго-западную части [17].
Гидрологический режим вод зал. Петра Великого формируется под воздействием системы течений, климатических условий, материкового стока, сгонно-нагонных и приливно-отливных явлений, водообмена с водами Японского моря, рельефа дна и очертания берегов [6, 7]. Климат в районе исследования, как и на всей северо-западной части Японского моря, муссонный [44]. Ежегодно в период с июля по ноябрь на Японское море выходят тропические циклоны, зарождающиеся в районе Филлипинских островов. Если циклон не выходит на акваторию Японского моря, он все же влияет на погоду в этом регионе: идут сильные дожди и ветер усиливается до штормового. Во всех случаях выхода циклонов на акваторию Японского моря наблюдаются сильные и штормовые ветра [4, 17]. На о-в Русский оказывают влияние воды смежных заливов Амурского и Уссурийского, соединенных проливами: на северо-западе – Босфор Восточный, на юго-востоке – Старка (рис. 1). В формировании течений в Уссурийском и Амурском заливах участвуют речной сток, морские течения и ветровые явления [45]. Посредством циклонического круговорота осуществляется водообмен между северной и южной частями заливов. Большое влияние на циркуляцию вод оказывает водообмен через проливы. В прол. Босфор Восточный действуют постоянные поверхностные течения, идущие из Амурского залива в Уссурийский вдоль северного берега пролива, и из Уссурийского залива в Амурский вдоль южного берега [39], в проливе Старка течения направлены на север [17]. Однако, вихревая структура течений в зал. Петра Великого неустойчива и может меняться в течении от 1 до 10 сут [10], меняя как скорость, так и структуру в верхнем квазиоднородном слое.
Ветровая обстановка в сентябре 2018 г. характеризовалась преобладанием северо-западных ветров (1–12 м/с), в сентябре 2019 г. – юго-восточных (2–6 м/с). В июне–июле 2020 г. ветровая обстановка не имела стабильности [3]. Гидрохимические параметры поверхностного слоя воды в районе исследования изменялись в переделах: соленость – от 24.6 до 34.6‰, температура – 14.8–21.1°C.
Состав и количественные характеристики фитопланктона. Для исследования микроводорослей материал фиксировали раствором Утермеля до бледно-желтого цвета. Концентрирование проб объемом 1 литр производили методом осаждения [75]. Численность клеток микроводорослей подсчитывали в счетной камере типа Нажотта объемом 0.05 мл [38]. С учетом минимальной репрезентативной выборки было просчитано не менее 3 тыс. экземпляров для всего фитопланктона независимо от исходной численности клеток в каждой пробе. При таком подсчете обеспечивается 80% точность определения числа клеток в пробе [13, 38]. Биомассу микроводорослей оценивали объемным методом, используя оригинальные и литературные данные измерений объема клеток каждого вида [61, 71]. Доминирующими считали виды, численность которых составляла не менее 20% от общей численности всех видов в сообществе [15]. “Цветение” воды рассматривали как массовое развитие водорослей, численность клеток которых превышала 106 кл./л [54]. Из-за сложности видовой идентификации под световым микроскопом мелкоклеточных центрических диатомей (диаметр клетки менее 10 мкм), для комплекса видов схожего размера определяли общую численность. К группе “мелкие жгутиковые водоросли” относили неидентифицированные пигментированные клетки, чаще флагелляты, размером менее 10 мкм.
Видовую идентификацию фитопланктона проводили с помощью светового микроскопа (СМ) Olympus BX 41 с использованием объективов ×10, ×20 и ×40. Тонкую структуру панцирей доминирующих видов изучали с помощью сканирующего электронного микроскопа (СЭМ) Carl Zeiss, Sigma 300 и трансмиссионного электронного микроскопа (ТЭМ) Carl Zeiss, Libra 120. Подготовку препаратов для электронной микроскопии проводили по стандартным методикам [57, 74]. Для СЭМ пробу обезвоживали в этиловом спирте при разных разведениях (25, 50, 75, 96%), очищенные створки на нуклеопоровом фильтре помещали на предметный столик и высушивали на воздухе. В вакуумном посту AUTO 306 на поверхность образцов было нанесено электропроводящее покрытие из углерода. Для ТЭМ на образец воздействовали концентрированной серной кислотой при высокой температуре, затем пробу многократно центрифугировали с дистиллированной водой. Каплю отмытой пробы наносили на бленды, покрытые формваром и высушивали на воздухе.
При проведении экологического анализа использовали классификацию фитопланктона, предложенную И.А. Киселевым [12]. Фитогеографический анализ производили по типам ареалов на основе различий в широтно-зональном распространении видов микроводорослей [29, 30].
Статистический анализ. В качестве исходных данных для статистического исследования применены данные численности фитопланктона. Для определения сходства сообществ использовался коэффициент Брэя-Кертиса (один из вариантов индекса Чекановского-Съеренсена для определения количественных данных), который позволяет брать во внимание относительное обилие таксонов [47]. В программе Past проведен кластерный анализ методом невзвешенного парного среднего (UPGMA), в качестве меры сходства использован индекс сходства Брэя-Кертиса.
РЕЗУЛЬТАТЫ
В прибрежных водах о-ва Русский обнаружено 144 таксона микроводорослей, относящихся к 5 классам: Bacillariophyceae (89 видов и внутривидовых таксонов), Dinophyceae (49), Chrysophyceae (3), Cryptophyceae (2) и Euglenophyceae (1). В определении видового богатства ведущая роль принадлежала диатомовым водорослям – 61.8% общего списка видов. Динофлагелляты составляли 34.0%, другие систематические группы менее 3% каждая. Среди Bacillariophyceae наибольшее видовое разнообразие отмечено среди рода Chaetoceros (31.5% общего числа всех диатомей), среди динофлагеллят – Protoperidinium (36.7% от всех динофлагеллят). Число видов фитопланктона в пробе изменялось от 18 (ст. 4, 2020 г.) до 60 (ст. 7, 2019 г.) видов и внутривидовых таксонов в пробе.
Экологическая характеристика установлена для 107 видов (74.3% от общего количества видов). Разнообразие экологических групп микроводорослей обусловлено сложностью гидрологического режима исследуемого района. В биотопическом отношении основу флористического списка представляли неритические виды (65.4% от общего видового состава), вторую позицию занимали панталассные виды (12.1%), бентические и океанические – 10.3% и 8.4% соответственно, пресноводные – 3.8%. Географический статус установлен для 87 видов и внутривидовых таксонов микроводорослей (60.4% от общего числа видов). Анализ соотношения географических элементов флоры выявил преобладание космополитов (48.3% от числа видов с известной характеристикой). Тропическо-бореальные составляли 18.4%, тропическо-аркто-бореальные и аркто-бореальные – 11.5% и 9.2% соответственно. Также фитопланктон включал 6 (6.9%) тропических и 5 (5.7%) бентических видов.
Анализ количественных данных показал, что в прибрежных водах о-ва Русский численность фитопланктона изменялась на 2 порядка от 3.6 × × 104 кл./л до 4.7 × 106 кл./л, а биомасса варьировала от 0.2 г/м3 до 18.3 г/м3 (рис. 2, табл. 1). Количественные характеристики микроводорослей между годами имели значительные различия; основу биомассы фитопланктона на всей акватории исследования преимущественно формировал крупноклеточный вид Coscinodiscus oculus-iridis (0.4–11.1 г/м3).
Рис. 2.
Динамика численности и биомассы фитопланктона (черные столбики), температуры и солености поверхностного слоя воды (ломаная кривая) в районе исследования в сентябре 2018 и 2019 гг., в июне и июле 2020 г.
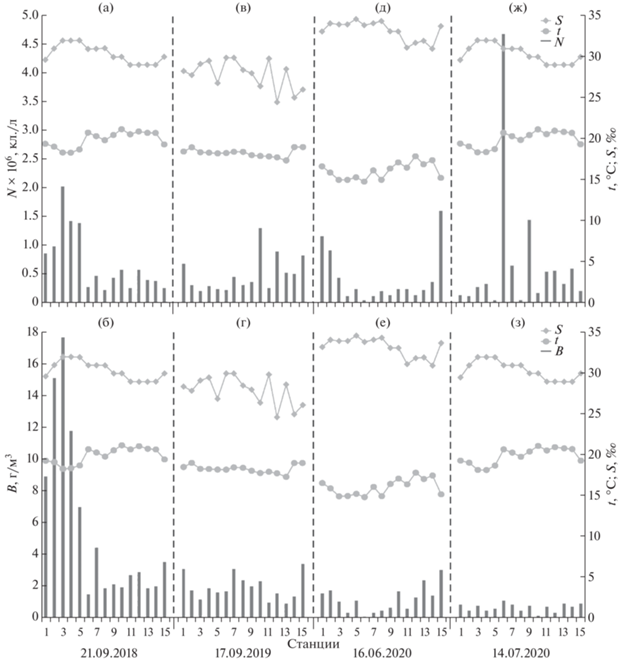
Таблица 1.
Количественные параметры фитопланктона в прибрежных водах о-ва Русский в период исследования. Через косую черту указаны: численность микроводорослей (тыс. кл./л)/биомасса (г/м3)
| Станция, № | Дата сбора материала | |||
|---|---|---|---|---|
| 21.09.2018 | 17.09.2019 | 16.06.2020 | 14.07.2020 | |
| Пролив Босфор Восточный | ||||
| 1 | 862.7/8.9 | 671.1/3.1 | 1164.5/1.6 | 120.0/0.9 |
| 15 | 250.9/3.6 | 810.5/3.4 | 1593.3/3.0 | 204.6/1.0 |
| Уссурийский залив | ||||
| 2 | 973.5/15.1 | 303.7/1.8 | 899.7/1.8 | 112.0/0.5 |
| 3 | 2026.7/17.7 | 203.2/1.2 | 419.8/1.1 | 271.2/0.8 |
| 4 | 1423.8/11.8 | 290.1/1.9 | 101.5/0.3 | 325.7/0.5 |
| 5 | 1392.6/7.0 | 235.3/1.6 | 234.1/1.2 | 36.6/0.7 |
| 6 | 270.9/1.5 | 221.3/1.7 | 38.1/0.1 | 4686.9/1.2 |
| 7 | 460.8/4.4 | 454.2/3.1 | 114.7/0.4 | 643.4/0.9 |
| Пролив Старка | ||||
| 8 | 221.1/1.9 | 302.4/2.4 | 190.1/0.5 | 39.7/0.5 |
| 9 | 420.0/2.2 | 354.2/2.0 | 132.6/0.7 | 1439.6/0.8 |
| Амурский залив | ||||
| 10 | 563.1/1.9 | 1289.5/2.3 | 224.2/1.7 | 169.5/0.2 |
| 11 | 256.2/2.7 | 246.1/1.0 | 225.9/0.6 | 536.6/0.8 |
| 12 | 571.8/2.9 | 880.5/1.6 | 132.4/1.4 | 544.9/0.4 |
| 13 | 388.2/1.9 | 515.0/0.9 | 216.6/2.4 | 321.1/1.0 |
| 14 | 367.4/2.0 | 490.8/1.4 | 364.0/1.4 | 590.5/0.8 |
В сентябре 2018 г. численность фитопланктона изменялась от 2.2 × 105 кл./л до 2.0 × 106 кл./л, биомасса – от 1.5 г/м3 до 17.7 г/м3 (рис. 2а, 2б). Наиболее высокие значения численности и биомассы микроводорослей наблюдали в прол. Босфор Восточный и Уссурийском заливе. “Цветение” воды регистрировали на станциях 3–5, вызванное массовым развитием комплекса видов рода Cyclotella – Cyclotella sp., С. atomus var. gracilis и С. choctawhatcheeana (численность варьировала от 1.2 × 106 до 1.9 × 106 кл./л). В сентябре 2019 г. количественные характеристики микроводорослей были ниже, численность изменялась в переделах от 2.03 × 105 кл./л до 1.3 × 106 кл./л, биомасса – 0.9–3.4 г/м3 (рис. 2 в, 2г). Массовое развитие фитопланктона наблюдали в северо-западной части о-ва Русский в б. Воевода (ст. 10) в районе марикультурного хозяйства. “Цветение” воды было обусловлено диатомеей Thalassiosira nordenskioeldii (5.3 × 105 кл./л) и эвригалинной криптофитовой водорослью Teleaulax amphioxeia (6.6 × 105 кл./л). Наибольшие значения биомассы, сформированные C. oculus-iridis и T. nordenskioeldii, регистрировали на станциях 1, 7 и 15. В июне 2020 г. численность микроводорослей изменялась от 3.8 × 104 до 1.6 × 106 кл./л, биомасса – от 0.1 г/м3 до 3.0 г/м3 (рис. 2 д, 2е). Высокие значения численности и биомассы наблюдали в прол. Босфор Восточный (ст. 1, 15); основу сообщества формировали Skeletonema dohrnii (7.7 × 105 кл./л) и комплекс видов рода Thalassiosira: T. tenera и Thalassiosira sp. (6.3 × × 105 кл./л). В июле 2020 г. численность микроводорослей изменялась от 3.6 × 104 до 4.7 × 106 кл./л, биомасса – от 0.2 до 1.2 г/м3 (рис. 2ж, 2з). Максимальные значения численности фитопланктона за весь период исследования наблюдали в Уссурийском заливе (ст. 6), “цветение” воды было вызвано массовым развитием “мелких жгутиковых водорослей” (4.6 × 106 кл./л).
На протяжении периода исследования в планктоне установлено 28 доминирующих видов фитопланктона; по численности доминировали 17 видов микроводорослей, по биомассе – 20 видов (табл. 2). Степень доминирования видов составляла 23.6–98.3% от общей численности и 23.1–81.3% от общей биомассы фитопланктона.
Таблица 2.
Максимальные доли доминирующих видов фитопланктона в прибрежных водах о-ва Русский в период исследования. Через косую черту указаны: доля численности вида (%) от суммарной численности фитопланктона/доля биомассы вида (%) от общей биомассы микроводорослей
| Вид | Дата сбора материала | |||
|---|---|---|---|---|
| 21.09.2018 | 17.09.2019 | 16.06.2020 | 14.07.2020 | |
| Пролив Босфор Восточный | ||||
| Coscinodiscus oculus-iridis (Ehrenberg) Ehrenberg | –/56.8 | –/– | –/– | –/64.7 |
| Skeletonema dohrnii Sarno et Kooistra | –/– | –/– | 77.0/32.3 | 29.1/– |
| Thalassiosira sp., T. tenera Proshkina-Lavrenko | –/– | –/– | 39.5/38.6 | –/– |
| Thalassiosira sp., Minidiscus comicus Takano | 93.0/47.2 | –/– | –/– | –/– |
| Prorocentrum micans Ehrenberg | –/– | –/– | –/– | –/30.4 |
| Prorocentrum triestinum Schiller | –/– | –/– | –/– | 42.5/– |
| Protoperidinium thulesense (Balech) Balech | –/– | –/– | –/32.0 | –/– |
| Уссурийский залив | ||||
| Dictyocha fibula Ehrenberg | –/28.7 | –/– | –/– | –/– |
| Coscinodiscus oculus-iridis (Ehrenberg) Ehrenberg | –/81.3 | –/27.1 | –/– | –/66.2 |
| Chaetoceros constrictus Gran | –/– | –/– | 27.4/32.6 | –/– |
| Cyclotella sp., С. atomus var. gracilis Genkal et Kiss, С. сhoctawhatcheeana Prasad | 92.8/49.4 | –/– | –/– | –/– |
| Pseudo-nitzschia delicatissima (Cleve) Heiden | –/– | 23.9/– | 58.1/– | –/– |
| Pseudo-nitzschia pungens (Grunow ex Cleve) Hasle | –/– | –/– | –/38.8 | –/– |
| Rhizosolenia setigera Brightwell | –/– | –/20.7 | –/– | –/– |
| Skeletonema dohrnii Sarno et Kooistra | –/– | 33.5/– | 52.3/– | 71.4/24.9 |
| Diplopsalis lenticula Bergh | –/– | –/– | –/30.8 | –/– |
| Prorocentrum micans Ehrenberg | –/– | –/– | –/– | –/27.0 |
| Prorocentrum triestinum Schiller | –/– | –/– | –/– | 29.1/– |
| Small flagellata | –/– | –/– | –/– | 98.3/– |
| Амурский залив | ||||
| Coscinodiscus oculus-iridis (Ehrenberg) Ehrenberg | –/20.9 | –/– | –/34.7 | –/65.7 |
| Chaetoceros affinis Lauder | –/– | –/– | 22.3/22.4 | –/– |
| Pseudo-nitzschia delicatissima (Cleve) Heiden | –/– | –/– | 37.9/– | –/– |
| Rhizosolenia setigera Brightwell | –/– | –/– | –/28.7 | –/– |
| Skeletonema dohrnii Sarno et Kooistra | –/– | –/– | 46.0/– | –/– |
| Thalassiosira sp., T. tenera Proshkina-Lavrenko | 89.7/47.6 | –/– | –/– | –/– |
| Thalassiosira sp., T. gravida Cleve | 65.2/28.9 | –/– | –/– | –/– |
| Thalassiosira nordenskioeldii Cleve | –/– | 61.1/72.4 | –/– | –/– |
| Alexandrium tamarense (Lebour) Balech | –/– | –/– | –/40.7 | –/– |
| Diplopsalis lenticula Bergh | –/– | –/– | –/56.2 | –/– |
| Protoperidinium marielebouriae (Paulsen) Balech | –/– | –/– | –/29.3 | –/– |
| Teleaulax amphioxeia (Conrad) Hill | –/– | 66.6/– | –/– | –/– |
| Small flagellata | –/– | –/– | –/– | 85.0/– |
| Пролив Старка | ||||
| Coscinodiscus oculus-iridis (Ehrenberg) Ehrenberg | –/– | –/27.2 | –/– | –/51.4 |
| Chaetoceros contortus Schütt | –/– | –/– | 44.1/43.0 | –/– |
| Pseudo-nitzschia delicatissima (Cleve) Heiden | –/– | –/– | 50.6/– | –/– |
| Prorocentrum triestinum Schiller | –/– | –/– | –/– | 57.5/– |
| Protoperidinium conicoides (Paulsen) Balech | –/– | –/– | –/25.8 | –/– |
| Protoperidinium depressum (Bailey) Balech | –/– | –/– | –/– | –/25.1 |
| Teleaulax amphioxeia (Conrad) Hill | –/– | 35.6/– | –/– | –/– |
| Small flagellata | –/– | –/– | –/– | 98.3/– |
В сентябре 2018 и 2019 гг. динофлагелляты не играли существенной роли в фитопланктоне, в сообществе преобладали Bacillariophyceae, достигая до 99.2% от общей численности и 96.1% от общей биомассы микроводорослей. В 2018 г. в прибрежных водах о-ва Русский практически на всех станциях доминировали виды рода Thalassiosira, достигая 93% от общего обилия клеток и 47.6% от общей биомассы фитопланктона, а в юго-восточной части острова в планктоне преобладал комплекс видов рода Cyclotella (92.8 и 47.2% от суммарной численности и биомассы микроводорослей, соответственно). Только на станциях в южной части острова существенный вклад в биомассу вносил Chrysophyceae – Dictyocha fibula (20.7–28.7%). В 2019 г. в южной части острова по численности доминировали S. dohrnii (39.1% от общей численности фитопланктона) и Pseudo-nitzschia delicatissima (23.9%), на северо-западе – Cryptophyceae Teleaulax amphioxeia (66.6%), в северной части о-ва Русский отмечали массовое развитие T. nordenskioeldii (61.1 и 72.4% от общей численности и биомассы фитопланктона, соответственно) (табл. 2).
Летом 2020 г. значительный вклад в биомассу сообщества вносили представители Dinophyceae, их доля варьировала от 25.1 до 56.2%. По численности преобладали диатомовые рода Chaetoceros (23.6–44.1%), P. delicatissima (58.1%), Thalassiosira sp., T. tenera (39.5%), S. dohrnii (77.0%). В июле массовое развитие S. dohrnii было характерно для прибрежных вод о-ва Русский в целом. Массовое развитие динофлагелляты Prorocentrum triestinum (61.4%) и “мелких жгутиковых водорослей” (98.3%) регистрировали в северо-западной и юго-западной частях прибрежной зоны о-ва Русский.
Для анализа сходства/различия флоры отдельных частей района исследования были построены дендрограммы, по видовому составу станции объединились в два кластера. Уровень сходства кластеров на всем протяжении исследования составлял от 18% в июле 2020 г. до 40% в сентябре 2018 г. (рис. 3). Так в 2018 г. в группу I при уровне сходства около 40%, вошли станции, расположенные в западной, юго-западной части побережья о-ва Русский, отличительной особенностью было массовое развитие комплекса видов рода Thalassiosira. Во II кластер объединились станции, на которых доминировали виды рода Cyclotella. В 2019 г. станции объединились на уровне 22%. Первый кластер был сформирован станциями, расположенными в Амурском заливе, доминировали в планктоне T. nordenskioeldii и Teleaulax amphioxeia. В группу II вошли станции Уссурийского залива, в этом районе отмечали массовое развитие S. dohrnii (рис. 3).
Рис. 3.
Дендрограмма сходства видового состава и количественных характеристик фитопланктона в прибрежных водах о-ва Русский в период исследования. I, II – группы станций.
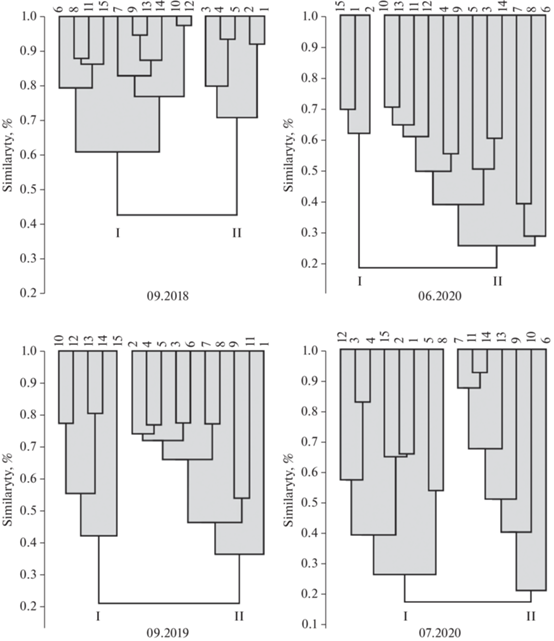
В 2020 г. также выделялись два кластера по результатам анализа сходства таксономического состава микроводорослей. Уровень сходства составлял 19% в июне и 18% в июле. Массовое развитие S. dohrnii наблюдали в июне на всей исследуемой акватории, в июле только в Уссурийском заливе и прол. Босфор Восточный. В июне отличительной особенностью I кластера, объединившего станции в прол. Босфор Восточный, было доминирование комплекса видов рода Thalassiosira, на остальных станциях преобладали P. delicatissima, виды рода Chaetoceros. В июле на станциях в Уссурийском заливе и прол. Босфор Восточный (кластер I) значительного развития в сообществе достигал P. triestinum. В остальных частях района исследования (кластер II) доминировали мелкие жгутиковые водоросли.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Видовое разнообразие фитопланктона в районе исследования сопоставимо с результатами, представленными в литературе: б. Парис – 177 видов фитопланктона [64], прибрежные воды о-ва Русский – 254 вида [65], Уссурийский залив – 119 [5]. Распределение видов по типам ареалов показало преобладание микроводорослей с широким распределением: космополитов, тропическо-бореальных и тропическо-аркто-бореальных, что в целом характерно для фитопланктона прибрежных вод зал. Петра Великого [5, 20]. Большинство отмеченных в данном исследовании доминирующих видов широко распространены и преобладают в планктоне умеренных широт Мирового океана [49, 69, 73].
Механизм смены доминирующих видов в рамках одного сезона пока полностью не известен [68]. Исследования последних десятилетий показали, что “цветение” воды, вызванное массовым развитием микроводорослей в морской прибрежной зоне, может быть обусловлено многочисленными факторами среды: апвеллингом, речным стоком, вертикальным и горизонтальным перемешиванием, стратификацией, сезонными изменениями температуры, солнечной радиацией и др. [48, 50, 52, 56, 62, 67, 76]. Показана зависимость между обилием биогенных веществ и количественным развитием фитопланктона [11, 58], в некоторых исследованиях установлено отсутствие связи между наличием биогенов и “цветением” воды [51]. Проведенные ранее исследования в локальных районах прибрежной зоны о-ва Русский показали отсутствие стойкой взаимосвязи между количественными характеристиками фитопланктона и основными биогенными веществами [42, 64]. Схожие сведения для зал. Петра Великого в целом представлены в работе Лучина В.А. и Тихомировой Е.А. [18], которые свидетельствуют о том, что содержание фосфатов и силикатов не лимитируют уровень первичной продукции.
Впервые в районе исследования зарегистрировано “цветение” воды, обусловленное массовым развитием комплекса видов рода Cyclotella – Cyclotella sp., С. atomus var. gracilis и С. choctawhatcheeana в сентябре 2018 г. По экологической характеристике представители этого рода относятся к пресноводным или солоноватоводным, однако, в районе исследования развитие видов наблюдали при солености 29.6–32.0‰ (рис. 2а, 2б). Доминирование комплекса видов рода Cyclotella отмечали только в Уссурийском заливе, в Амурском заливе в этот период в планктоне преобладал комплекс видов рода Thalassiosira. Также доминирование Thalassiosira spp. отмечали на станциях, расположенных в юго-западной части острова, в Уссурийском заливе (рис. 3). Пространственное распределение доминирующих видов в прибрежных водах о-ва Русский в сентябре 2018 г. согласовалось с данной схемой ветровых течений при северо-западных ветрах; воды Амурского залива через прол. Старка доходили до п-ова Шкота (рис. 1). В сентябре 2019 г. Skeletonema dohrnii доминировал в планктоне восточного побережья, омываемого Уссурийским заливом; T. nordenskioeldii и Teleaulax amphioxeia в массе развивались на станциях в Амурском заливе. Влияние вод Уссурийского залива через прол. Старка отмечали в Амурском заливе, S. dohrnii доминировал на станции 9. При преобладании юго-восточного ветра, воды Уссурийского залива заходят в Амурский залив, пространственное распределение доминирующих видов фитопланктона в сентябре 2019 г. так же подтверждало схему ветровых течений вокруг о-ва Русский (рис. 1).
В 2020 г. в июне–июле в период сбора материала в районе исследования не отмечали ветров стабильного направления [3]. Картина распределения доминирующих видов фитопланктона в прибрежных водах о-ва Русский отличалась от ситуации, характерной для сентября. В начале лета практически на всех станциях отмечали массовое развитие S. dohrnii. В июне Pseudo-nitzschia delicatissima входил в число доминант на значительном числе станций в Амурском и в Уссурийском заливах. В июле на большей части района исследования доминировал Prorocentrum triestinum, а на отдельных станциях преобладали мелкие жгутиковые водоросли. Эти виды – S. dohrnii, P. delicatissima, P. triestinum регулярно вызывают “цветения” воды в зал. Петра Великого [20, 33, 37, 70] и широко распространены в умеренных водах Мирового океана [46, 60, 72, 77].
Пространственное распределение фитопланктона также зависит и от особенностей биологии видов, вызывающих “цветения” воды. Одним из факторов, обуславливающих вспышку развития и широкое распространение на большой площади и, в результате доминирование вида по всей акватории, может служить наличие покоящихся стадий, которые у диатомовых отмечены для видов родов Skeletonema и Pseudo-nitzschia [19, 55]. Покоящиеся стадии могут служить посевным материалом, который обеспечивает бурный рост при попадании из бентоса в толщу воды в период конвективного перемешивания воды [59, 63]. Для получения фундаментальных знаний по биологии отдельных видов, понимания механизмов взаимодействия компонентов в сообществе необходимо проведение мониторинговых наблюдений для накопления сведений о видовом составе и динамике количественных параметров фитопланктона на определенной акватории [66].
Согласно публикации Алексанина А.И. с соавторами [2], в зал. Петра Великого есть месяцы, когда состав доминирующих видов сходен для всей акватории залива и есть периоды, когда он зависит от места сбора материала. Полученные нами данные показали, что в июне–июле состав доминирующих видов фитопланктона в прибрежных водах о-ва Русский схож в Амурском и Уссурийском заливах. А в сентябре в каждом из заливов устанавливается собственный состав доминант и, вероятно, через прол. Старка в зависимости от преобладающих ветров происходит трансфер видов.
Источники финансирования. Работа выполнена в Центре коллективного пользования “Приморский океанариум” ННЦМБ ДВО РАН, в рамках темы государственного задания “Динамика морских экосистем, адаптации морских организмов и сообществ к изменениям среды обитания”, № 121082600038-3.
Список литературы
Абакумов В.А. Контроль качества вод по гидробиологическим показателям в системе Гидрометеорологической службы СССР // Научные основы контроля качества поверхностных вод по гидробиологическим показателям. – Л.: Гидрометеоиздат, 1984. С. 93–100.
Алексанин А.И., Ким В., Орлова Т.Ю. и др. Фитопланктон залива Петра Великого и задача его дистанционного зондирования // Океанология. 2012. Т. 52. № 2. С. 239–250.
Архив погоды г. Владивосток [Электронный ресурс]: сайт. Владивосток, 2022. URL: https://rp5.ru/ Архив_погоды_во_Владивостоке.
Атлас волнения и ветра Японского моря. Изд. Приморского УГМС. Владивосток, 1968. 153 с.
Бегун А.А. Фитопланктон бухты Золотой Рог и Уссурийского залива (Японское море) в условиях антропогенного загрязнения // Изв. ТИНРО. 2004. Т. 138. С. 320–344.
Бирюлин Г.М., Бирюлина М.Г., Микулич Л.В. и др. Летние модификации вод залива Петра Великого // Тр. ДВНИГМИ. 1970. Вып. 30. С. 286–299.
Винокурова Т.Т. О сезонной и краткопериодной изменчивости гидрологических характеристик в заливе Петра Великого // Изв. ТИНРО. 1977. Т. 101. С. 7–12.
Воденеева Е.Л., Охапкин А.Г., Генкал С.И. и др. Состав, структура и распределение фитопланктона высокоминерализованного Карстового озера // Биол. внутр. вод. 2020. №6. С. 573–582.
Григорьев Р.В., Зуенко Ю.И. Среднемноголетнее распределение температуры и солености в Амурском заливе Японского моря // Изв. ТИНРО. 2005. Т. 143. С. 179–188.
Дубина В.А., Файман П.А., Пономарев В.И. Вихревая структура течений в заливе Петра Великого // Изв. Тинро. 2013. Т. 173. С. 247–258.
Егоров В.Н., Поповичев В.Н., Гулин С.Б. и др. Влияние первичной продукции фитопланктона на оборот биогенных элементов в прибрежной акватории г. Севастополя (Черное море) // Биол. моря. 2018. Т. 44. №3. С. 207–214.
Киселев И.А. Планктон морей и континентальных водоемов. Л.: Наука, 1969. Т. 1. 657 с.
Кольцова Т.И., Конопля Л.А., Максимов В.И. и др. К вопросу о представительности выборок при анализе фитопланктонных проб // Гидробиол. журнал. 1971. Т. 7. № 3. С. 109–117.
Коновалова Г.В. Сезонная характеристика фитопланктона в Амурском заливе Японского моря // Океанология. 1972. Т. 12. № 1. С. 123–128.
Коновалова Г.В. Структура планктонного фитоценоза залива Восток Японского моря // Биол. моря. 1984. №1. С. 13–23.
Лепская Е.В., Коломейцев В.В., Тепнин О.Б. и др. Сравнительная характеристика фитопланктона эпипелагиали тихоокеанских вод Камчатки // Исследования водных биологических ресурсов Камчатки и северо-западной части Тихого океана. 2011. Вып. 22. С. 5–22.
Лоция северо-западного берега Японского моря. От реки Туманная до мыса Белкина. Санкт-Петербург: Изд. ГУНИО, 1996. 360 с.
Лучин В.А., Тихомирова Е.А. Типовые распределения океанографических параметров в заливе Петра Великого (Японское море) // Изв. ТИНРО. 2012. Т. 169. С. 134–146.
Орлова Т.Ю., Морозова Т.В. Покоящиеся стадии микроводорослей в поверхностных осадках залива Петра Великого Японского моря // Биол. моря. 2009. Т. 35. №4. С. 256–265.
Орлова Т.Ю., Стоник И.В., Шевченко О.Г. Флора микроводорослей планктона Амурского залива Японского моря // Биол. моря. 2009. Т. 35. № 1. С. 48–61.
Орлова Т.Ю., Шевченко О.Г. Первая находка Pseudo-nitzschia americana (Bacillariophyta) в морях России // Биол. моря. 2002. Т. 28. № 5. С. 372–375.
Паутова Л.А. Видовой состав фитопланктона пролива Старка (залив Петра Великого) // Гидробиологические исследования заливов и бухт Приморья. Владивосток: ДВНЦ АН СССР, 1984. С. 99–103.
Паутова Л.А. Структура планктонного фитоценоза в районе промышленной плантации приморского гребешка (бухта Алексеева, Японское море) // Биология морского планктона. Владивосток: ДВО АН СССР, 1990. С. 46–52.
Паутова Л.А., Коновалова Г.В. Летне-осенний фитопланктон пролива Старка Японского моря // Биол. моря. 1982. № 5. С. 20–28.
Паутова Л.А., Силкин В.А. Зимний фитопланктон северо-западной части Японского моря. Некоторые закономерности формирования структуры фитоцена в прибрежном мелководье // Океанология. 2000. Т. 40. № 4. С. 553–561.
Пономарев В.И., Файман П.А., Дубина В.А. и др. Синоптические вихри над материковым склоном Японской котловины и шельфом Приморья // Изв. ТИНРО. 2011. Т. 167. С. 160–175.
Селина М.С. Фитопланктон в районе мидиевого хозяйства в заливе Восток Японского моря // Биол. моря. 1992. № 5–6. С. 15–24.
Селина М.С. Фитопланктон залива Восток Японского моря: Дисс. … канд. биол. наук. Владивосток: Дальнаука, 1998. 25 с.
Семина Г.И. Фитопланктон // Биология Тихого океана: планктон. М.: Наука, 1967. С. 27–85.
Семина Г.И. Фитопланктон Тихого океана. М.: Наука, 1974. 239 с.
Симакова Н.К., Орлова Т.Ю., Селина М.С. “Красный прилив”, вызванный жгутиковой водорослью Chattonella sp. (Raphidophyceae) в Амурском заливе Японского моря // Биол. моря. 1990. № 5. С. 77–78.
Стоник И.В. Потенциально токсичная динофитовая водоросль Prorocentrum minimum в Амурском заливе Японского моря // Биол. моря. 1994. Т. 20. № 6. С. 419–425.
Стоник И.В., Орлова Т.Ю. Видовой состав и количественное распределение диатомовых водорослей рода Pseudo-nitzschia H. Peragallo, 1900 в российских водах Японского и Охотского морей // Биол. моря. 2013. Т. 39. № 4. С. 246–253.
Стоник И.В., Орлова Т.Ю. Летне-осенний фитопланктон в Амурском заливе Японского моря // Биол. моря. 1998. Т. 24. № 4. С. 205–211.
Стоник И.В., Орлова Т.Ю. Новые данные о морфологии и распространении Cerataulina dentata (Bacillariophyta) // Бот. жур. 1998. Т. 83. № 4. С. 64–69.
Стоник И.В., Орлова Т.Ю., Пропп Л.Н. и др. Осеннее “цветение” диатомовых водорослей рода Pseudo-nitzschia H. Peragallo, 1900 в Амурском заливе Японского моря // Биол. моря. 2012. Т. 38. № 3. С. 197–202.
Стоник И.В., Селина М.С. Фитопланктон как показатель трофности вод залива Петра Великого, Японского моря // Биол. моря. 1995. Т.21. № 6. С. 403–406.
Федоров В.Д. О методах изучения фитопланктона и его активности. М.: МГУ, 1979. 167 с.
Храпченков Ф.Ф., Дулова Н.М., Горин И.И. и др. Долговременные измерения течений и температуры воды в заливе Петра Великого в 2004–2007 гг. // Современное состояние и тенденции изменения природной среды залива Петра Великого Японского моря. / ред. В.А. Акуличев. М.: ГЕОС, 2008. С. 9–56.
Шевченко О.Г., Орлова Т.Ю. Морфология и экология диатомовой водоросли Chaetoceros contortus, вызывающей “цветение” в заливе Петра Великого Японского моря // Биол. моря. 2010. Т. 36. № 4. С. 251–258.
Шевченко О.Г., Орлова Т.Ю., Масленников С.И. Сезонная динамика диатомовых водорослей рода Chaetoceros Ehrenberg в Амурском заливе Японского моря // Биол. моря. 2004. Т. 30. № 1. С. 30–38.
Шевченко О.Г., Тевс К.О., Шулькин В.М. Комплексный мониторинг фитопланктона в мелководной бухте залива Петра Великого (Японское море): динамика хлорофилла “а” и биогенных элементов // Изв. ТИНРО. 2020. Т. 200. Вып. 1. С. 141–154.
Шулькин В.М., Орлова Т.Ю., Шевченко О.Г. и др. Влияние речного стока и продукции фитопланктона на сезонную изменчивость химического состава прибрежных вод Амурского залива Японского моря // Биол. моря. 2013. Т. 39. № 3. С. 202–212.
Юрасов Г.И., Ванин Н.С., Рудых Н.И. Особенности гидрологического режима зал. Петра Великого в осенне-зимний период. // Изв. ТИНРО. 2007. Т. 148. С. 211–220.
Юрасов Г.И., Яричин В.Г. Течения Японского моря. Владивосток: ДВО АН СССР, 1991. 176 с.
Borkman D., Smayda T. Multidecadal (1959–1997) changes in Skeletonema abundance and seasonal bloom patterns in Narragansett Bay, Rhode Island, USA // J. Sea Res. 2009. V. 61. P. 84–94.
Bray R.J., Curtis J.T. An ordination of the upland forest communities of southern Wisconsin // Ecol. Monogr. 1957. V. 27. № 4. P. 325–349.
Brown C.A., Ozretich R.J. Coupling between the coastal ocean and Yaquina Bay, Oregon: importance of oceanic inputs relative to other nitrogen sources // Estuar. Coasts. 2009. V. 32. P. 219–237.
Canesi K.L., Rynearson T.A. Temporal variation of Skeletonema community composition from a long-term time series in Narragansett Bay identified using high-throughput DNA sequencing // Mar. Ecol. Prog. Ser. 2016. V. 556. P. 1–16.
Carstensen J., Frohn L.M., Hasager C.B. et al. Summer algal blooms in a coastal ecosystem: the role of atmospheric deposition versus entrainment fluxes // Estuar. Coast. Shelf Sci. 2005. V. 62. P. 595–608.
Carstensen J., Klais R., Cloern J.E. Phytoplankton blooms in estuarine and coastal waters: Seasonal patterns and key species // Estuar. Coast. Shelf Sci. 2015. V. 162. P. 98–109.
Cloern J.E. Phytoplankton bloom dynamics in coastal ecosystems: a review with some general lessons from sustained investigation of San Francisco Bay, California // Rev. Geophys. 1996. V. 34. P. 127–168.
Cloern J.E., Jassby A.D. Patterns and scales of phytoplankton variability in estuarine-coastal ecosystems // Estuar. Coast. 2010. Vol. 33. P. 230–241.
Colijn F. Changes in plankton communities: when, where and why / F. Colijn // ISES Mar. Sci. Symp. 1992. V. 195. P. 193–212.
Gu H., Zhang X., Sun J. et al. Diversity and seasonal occurrence of Skeletonema (Bacillariophyta) species in Xiamen Harbour and Surrounding Seas, China // Cryptogam., Algol. 2012. V. 33. №3. P. 245–263.
Hall N.S., Paerl H.W., Peierls B.L. et al. Effects of climatic variability on phytoplankton community structure and bloom development in the eutrophic, microtidal, New River Estuary, North Carolina, USA // Estuar. Coast. Shelf Sci. 2013. V. 13. P. 1837–1849.
Hasle G.R., Fryxell G.A. Diatoms: cleaning and mounting for light and electron microscopy // Trans. Amer. Microsc. Soc. 1970. V. 89. №4. P. 469–474.
Hodgkiss I.J., Songhui Lu. The effects of nutrients and their ratios on phytoplankton abundance in Junk Bay, Hong Kong // Hydrobiologia. 2004. V. 512. P. 215–229.
Itakura S., Imai I., Itoh K. “Seed bank” of coastal planktonic diatoms in bottom sediments of Hiroshima Bay, Seto Inland Sea, Japan // Mar. Biol. 1997. V. 128. P. 497–508.
Lelong, A., Hégaret, H., Soudant, P. et al. Pseudo-nitzschia (Bacillariophyceae) species, domoic acid and amnesic shellfish poisoning: revisiting previous paradigms // Phycologia. 2012. V. 51. P. 168−216.
Olenina I., Hajdu S., Edler L., et al. Biovolumes and size-classes of phytoplankton in the Baltic Sea // HELCOM Balt. Sea Environ. Proc. 2006. V. 106. 144 p.
Peierls B.L., Hall N.S., Paerl H.W. Non-monotonic responses of phytoplankton biomass accumulation to hydrologic variability: a comparison of two coastal plain North Carolina estuaries // Estuar. Coasts. 2012. P. 1–17.
Round F.E., Crawford R.M., Mann D.G. The diatoms. Biology and morphology of the Genera. Cambridge University Press, Cambridge. 1990. 747 pp.
Shevchenco O.G., Ponomareva A.A., Shulkin V.M. Phytoplankton and hydrochemical parameters near net pens with beluga whales in a shallow Bay of the Northwestern Sea of Japan // Thalassas: Int. J. Mar. Sci. 2018. V. 34. №1. P. 139–151.
Shevchenko O.G., Ponomareva A.A., Shulgina M.A. et al. Phytoplankton in the coastal waters of Russky Island, Peter the Great Bay, Sea of Japan // Bot. Pac. 2019. V. 8. №1. P. 133–141.
Shevchenko O.G., Tevs K.O., Shulkin V.M. et al. Monitoring of Phytoplankton and Hydrochemical Parameters of Coastal Waters of Russky Island (Peter the Great Bay, Sea of Japan) // Russian J. Mar. Biol. 2022. V. 48. № 1. P. 39–47.
Shikata I., Nagasoe S., Matsubara T. et al. Factors influencing the initiation of blooms of the raphidophyte Heterosigma akashiwo and the diatom Skeletonema costatum in a port in Japan // Limnol. Oceanogr. 2008. V. 53. P. 2503–2518.
Silkin V.A., Pautova L.A., Giordano M. et al. Drivers of phytoplankton blooms in the northeastern Black Sea // Mar. Pollut. Bull. 2019. V. 138. P. 274–284.
Škaloud P., Řezáčová M., Ellegaard M. Spatial distribution of phytoplankton in spring 2004 along a transect in the eastern part of the North Sea // J. Oceanogr. 2006. V. 62. P. 717–729.
Stonik I.V., Orlova T.Yu., Chikalovets I.V. et al. Pseudo-nitzschia species (Bacillariophyceae) and the domoic acid concentration in Pseudo-nitzschia cultures and bivalves from the northwestern Sea of Japan, Russia // Nova Hedwigia. 2019. V. 108. № 1. P. 73–93.
Sun J., Liu D. Geometric models for calculating cell biovolume and surface area for phytoplankton // J. Plankton Res. 2003. V. 25. № 11. P. 1331–1346.
Trainer V.L., Bates S.S., Lundholm N., et al. Pseudo-nitzschia physiological ecology, phylogeny, toxicity, monitoring and impacts on ecosystem health // Harmful Algae. 2012. V. 14. P. 271−300.
Trigueros J.M., Orive E. Seasonal variations of diatoms and dinoflagellates in a shallow, temperate estuary, with emphasis on neritic assemblages // Hydrobiologia. 2001. V. 444. P. 119–133.
Truby E.W. Preparation of cingle-celled marine dinoflagellates for electron microscopy // Microsc. Res. Tech. 1997. V. 36. P. 337–340.
Utermöhl H. Zur Vervollkommnung der quntitativen Phytoplankton. Methodik. Internat. Verein // Limnol. Mitteilungen. 1958. V. 9. P. 1–38.
Yin K. Influence of monsoons and oceanographic processes on red tides in Hong Kong waters // Mar. Ecol. Prog. Ser. 2003. V. 262. P. 27–41.
Yoo K., Lee J-B. Taxonomical studies of Dinoflagellates in Masan Bay: 1. Genus Prorocentrum Ehrenberg // Oceanological Soc. Korea. 1986. V. 21. № 1. P. 46–55.
Дополнительные материалы отсутствуют.


