Океанология, 2022, T. 62, № 6, стр. 898-910
Первичная и бактериальная продукция в юго-восточной части Балтийского моря в летний и осенний периоды
С. А. Мошаров 1, 3, *, И. В. Мошарова 1, 3, О. А. Дмитриева 1, 3, А. С. Семенова 2, 3, Е. С. Бубнова 1, 3
1 Институт океанологии им. П.П. Ширшова Российской академии наук
Москва, Россия
2 Атлантический филиал Всероссийского научно-исследовательского института
рыбного хозяйства и океанографии
Калининград, Россия
3 Балтийский федеральный университет им. Иммануила Канта
Калининград, Россия
* E-mail: sampost@list.ru
Поступила в редакцию 24.02.2022
После доработки 15.04.2022
Принята к публикации 16.08.2022
- EDN: BACEZW
- DOI: 10.31857/S0030157422060090
Аннотация
В работе рассматривается потенциальная (флуоресцентным методом) и реализованная (радиоуглеродным методом) первичная продукция фитопланктона и продукция гетеротрофных бактерий в эвфотической зоне мористой части Гданьского залива Балтийского моря в летний и осенний периоды. Максимальная квантовая эффективность фотосистемы II фитопланктона (Fv/Fm) значительно варьировала по глубине в июне (0.33–0.59), но была равномерно очень высокой в октябре (0.68–0.71), что указывает на потенциально более активное состояние ранне-осеннего фитопланктона. Интегральная первичная продукция в октябре была почти в два раза выше, чем в июне (633 и 375 мг С/м2 в сут, соответственно), тогда как бактериальная продукция – в полтора раза ниже (239 и 371 мг С/м2 в сут, соответственно). В верхнем 10-м слое водной толщи автотрофная продукция (фитопланктон) лишь ненамного превышала гетеротрофную (бактериальную) продукцию в июне (63% от общей продукции) и доминировала в октябре (92% от общей продукции).
ВВЕДЕНИЕ
Балтийское море – одно из наиболее изучаемых в мире, однако информация о вертикальном распределении продукционных процессов фитопланктона и бактериопланктона в российском секторе юго-восточной части моря практически отсутствует. В основном исследования продукционных параметров фито- и бактериопланктона в Балтийском море проводились в наиболее продуктивный период весеннего “цветения”. Сезонная динамика продукционных процессов большей частью рассматривалась в прибрежных районах моря [3–5, 11, 25, 44].
Пастбищная трофическая цепь, основанная на фитопланктоне, во многих случаях более эффективна, чем ее ответвление, основанное на бактериях – “микробная петля” [14, 16]. Качество бактерий как пищевого ресурса более низкое, чем фитопланктона. Биомасса бактерий обычно лишена важных липидов и жирных кислот, которые жизненно необходимы для питающихся ими животных [26], и имеют относительно низкое отношение углерод : азот : фосфор (C : N : P = 50 : 10 : 1) [11]. С другой стороны, биомасса фитопланктона соответствуют отношению Редфилда (106 : 16 : 1) и в пищевом отношении более эффективна. Таким образом, доминирование продукции гетеротрофных бактерий может приводить к более низкой эффективности пищевой сети и более низкой продукции высших трофических уровней [14, 15]. Следовательно, факторы окружающей среды, которые поворачивают основание пищевой сети от фитопланктонного к бактериальному доминированию, оказывают влияние на всю трофическую структуру и продуктивность планктонного сообщества [11].
Развитие фитопланктона в Балтийском море носит ярко выраженный сезонный характер. Биомасса фитопланктона имеет три отчетливых пика: весенний (основной), летний и осенний [2, 9]. В период весеннего “цветения” доминируют диатомовые и динофитовые водоросли. В период летнего максимума развитие фитопланктона определяют в основном солоноватоводные синезеленые водоросли (Nodularia spumigena, Aphanizomenon sp. и другие), способные ассимилировать атмосферный азот [19]. Осенью, при условии выравнивания температуры по вертикали и началу перемешивания вод, происходит вынос биогенных элементов из глубинного слоя в эвфотический, что обуславливает второй максимум развития диатомовых водорослей [18]. Затем биомасса и продуктивность фитопланктона постепенно сокращается до зимнего минимума в связи с низким уровнем солнечной радиации [43].
Район, где были выполнены настоящие исследования, расположен в морской зоне российского сектора юго-восточной части Балтийского моря. Этот район находится достаточно далеко от береговой линии, однако испытывает заметное влияние выноса вод реки Вислы, а также Вислинского залива – одной из самых крупных и высокопродуктивных лагун Балтийского моря [1]. С другой стороны, район исследований находится в районе Гданьской впадины в зоне крупной “метановой аномалии”, содержание метана в донных осадках в этом районе почти в 10 раз превышает фоновые показатели [42]. Кроме того, акватория находится под влиянием затоков в Балтийское море трансформированных вод из Северного моря [13]. Эти затоки привносят не только более холодные, соленые и насыщенные кислородом воды, но и свою специфическую флору и фауну. В итоге в этом районе происходит смешение солоноватоводной флоры и фауны из Вислинского залива, флоры и фауны непосредственного района исследования, а также попадающих с трансформированными североморскими водами видов. Именно в силу специфических условий этого района и была выбрана морская площадка Калининградского карбонового полигона для разработки и испытаний технологий контроля углеродного баланса.
Целью данной работы было исследование параметров первичной продуктивности фитопланктона и бактериальной продукции в эвфотическом слое и их соотношения в летний и осенний периоды, как части углеродного баланса в пелагиали Балтийского моря.
МАТЕРИАЛЫ И МЕТОДЫ
Гидрофизические параметры. Исследования проводились в юго-восточной части Балтийского моря (рис. 1). Пробы были отобраны 30 июня и 1 октября 2021 года. Профили температуры и солености были получены с помощью гидрофизического зонда Sea&Sun CTD90M. Пробы воды для определения биомассы и доминирующих видов фитопланктона, общей численности, биомассы и продукции бактерий, первичной продукции и активной флуоресценции хлорофилла “а” (хл “а”), концентрации хл “а” отбирали с горизонтов 0, 5, 10, 15, 20 и 25 м с помощью батометра Нискина, помещали в темный термоизолированный контейнер и транспортировали в береговую лабораторию для последующего анализа.
Величина фотосинтетически активной радиации (ФАР, 400–700 нм) на поверхности моря была измерена с помощью квантового датчика LI-190R (Li-Cor, США), подводная освещенность на разных горизонтах – с помощью подводного датчика LI-193. Одновременность измерений обоими датчиками обеспечивалась подключением к интегрирующему блоку LI-1400 DataLogger, и позволяла точно определять долю ФАР, достигающей конкретных горизонтов. Эуфотическая зона определялась как водный слой, ограниченный глубиной проникновения 1% от поверхностной ФАР.
Определение продукционных параметров фитопланктона. Определение скорости первичной продукции (ПП) проводили экспериментально радиоуглеродным методом [39]. Во флаконы c пробами воды объемом 50 мл был добавлен раствор NaH14СO3. Экспонирование флаконов осуществляли по методу имитации световых и температурных условий в оригинальном лабораторном инкубаторе с регулируемой светодиодной подсветкой [8]. Поддержание температуры инкубации, соответствующей температуре в точке отбора проб, осуществляли с помощью лабораторного охладителя HAILEA-100 и помпы для прокачки воды EHEIM. Уровень освещенности для каждого флакона, также соответствующей освещенности в точке отбора проб, задавался регулируемой величиной постоянного тока, протекающего через светодиод [8].
Условия освещенности в инкубаторе устанавливались для каждого измерения следующим образом. Учитывая параболическую зависимость интенсивности освещения от времени суток и величину максимальной (полуденной) интенсивности ФАР, измеренной при пробоотборе, был рассчитан средний за светлое время суток уровень ФАР. Для 30 июня и 1 октября эти значения составляли 800 и 100 мкмоль фотонов/м2 в сек, соответственно. Эти значения устанавливались в инкубаторе для поверхностных проб. Для задания освещенности проб с других горизонтов использовались значения доли ФАР, достигавшей соответствующих горизонтов, рассчитанных при зондировании водной толщи с помощью комплекса Li-COR.
После инкубации в течение 3 ч пробы отфильтровывали через мембранные фильтры “Владипор” (0.45 мкм). Радиоактивность исходного раствора и фильтров определяли с помощью жидкостного сцинтилляционного счетчика Triathler (Hidex, Финляндия). Ассимиляционное число (удельная первичная продукция, АЧ, мг С/мг хл в ч) было рассчитано путем нормирования ПП на отдельных горизонтах по соответствующей концентрации хл “а”.
Концентрацию хл “а” в воде измеряли методом флуоресценции ацетонового экстракта [22]. Пробы воды (500 мл) отфильтровывали через стекловолоконные фильтры Whatman GF/F под вакуумом не более 0.2 атм. Для экстракции хл “а” фильтры помещали в пробирки с ацетоном (90%) и выдерживали в темноте при температуре +4°С в течение 24 ч. Затем флуоресценцию экстракта измеряли с помощью флуориметра МЕГА-25 до и после подкисления 1н HCl (коррекция на феофитин). Флуориметр был предварительно откалиброван с использованием стандарта хлорофилла (Sigma). Концентрация хл “а” и феофитина была рассчитана согласно [21].
Активная флуоресценция хл “а” была измерена с помощью ультрачувствительного РАМ-флуориметра WATER-PAM (Walz, Германия). Измерение соотношения интенсивности флуоресценции хл “а” при насыщающем фотосинтез возбуждающем свете (максимальный выход флуоресценции, Fm) и при слабой вспышке возбуждающего света (минимальный выход флуоресценции, Fо) для фитопланктона, выдержанного в темноте, позволяет определить максимальную квантовую эффективность фотосистемы II (Fv/Fm) [23]:
Максимальные значения Fv/Fm для фитопланктона при оптимальных условиях роста составляют 0.65–0.70 и существенно варьируют для разных таксонов [41]. Соотношение Fv/Fm отражает максимальную (потенциальную) фотохимическую эффективность фотосистемы II и показывает долю абсорбированной световой энергии, направленной на фотосинтез посредством реакционных центров фотосистемы II.
Для оценки текущего состояния фитопланктона и его адаптации к свету использовался метод “быстрых световых кривых”, в соответствии с которым измеряется эффективный квантовый выход фотосистемы II (ФPSII) как функция освещенности [18]:
Умножая число квантов, абсорбированных фитопланктоном, на величину ФPSII, получаем значение относительной скорости электронного транспорта (rETR) в фотосистеме II при определенном уровне естественного освещения:
где Е – это уровень естественного освещения образца в камере РАМ-флуориметра (мкмоль фотонов/м2 в сек), а коэффициент 0.5 учитывает распределение фотонов между фотосистемами I и II [38].Для определения rETR пробы воды экспонировали при 8-ми уровнях интенсивности света в диапазоне от 0 до 1500 мкмоль фотонов/м2 в сек, в том числе при интенсивности света, соответствующей природной в точке отбора и примененной в инкубаторе при радиоуглеродных измерениях. График зависимости rETR от уровня освещенности (“световая кривая”) использовался для определения уровня оптимальной освещенности для фитопланктона с конкретного горизонта отбора проб, отражающей уровень световой адаптации фитопланктона.
Концентрация хл “а” в пробах, в которых измерялась активная флуоресценция, варьировала от 0.385 до 10.735 мкг/л. Отсутствие самозатенения при измерениях в этих пробах проверялось разбавлением образца 1 : 1 и оценкой линейности зависимости “флуоресценция–концентрация”.
Концентрирование проб фитопланктона проводили седиментационным методом [7]. Камеральную обработку проб выполняли в камере “Учинская” объемом 0.01 мл по стандартным методикам с использованием микроскопа Leica DM2500 [7].
Определение микробиологических параметров. Для определения численности (ЧБ) и биомассы бактериопланктона (ББ) пробы морской воды сразу после их отбора фиксировали 38% формальдегидом (предварительно профильтрованным через фильтр с диаметром пор 0.2 мкм (Nucleopor)) до конечной концентрации в пробе 1% и хранили максимум в течение суток в темноте при температуре 4°С. Численность и размеры бактериальных клеток определяли методом эпифлуоресцентной микроскопии с использованием флуоресцентного красителя 3,6-bis(dimethylamino)acridine (акридиновый оранжевый) и черных ядерных фильтров с диаметром пор 0.2 мкм (Osmonics, USA) [35, 36]. Препараты для микроскопирования изготовляли с применением низко флуоресцирующего иммерсионного масла (Olimpus, Япония). Бактерий учитывали с помощью микроскопа МикМед-3 ЛЮМ LED, соединенного с цифровой камерой Touptek Photonics FMA 050 (China) и персональным компьютером. Изображение преобразовывали в цифровую форму с помощью программного обеспечения “ToupView” и использовали для последующего подсчета и измерения бактериальных клеток. На каждом препарате считали не менее 200 и измеряли не менее 50 клеток бактерий. Сырую биомассу бактерий вычисляли путем умножения их численности на средний объем клеток. Содержание углерода в бактериальных клетках (С, фг С/кл) рассчитывали с использованием аллометрического уравнения, наиболее подходящего для клеток, окрашенных акридиновым оранжевым: С = 120V0.72 [32, 36].
Скорость роста и продукцию бактериапланктона (ПБ) определяли в «живых» пробах морской воды методом “разбавления” по изменению их численности в изолированных пробах воды, инкубируемых в течение 24-48 ч в климатическом инкубаторе при температуре in situ. Для устранения бактериотрофных организмов пробы морской воды разбавляли 1 : 10 морской водой, взятой из места отбора пробы и профильтрованной через мембранный фильтр с диаметром пор 0.20 мкм [17]. Эксперименты проводили в трехкратной повторности. Удельную скорость роста численности бактерий (μ, ч–1) вычисляли по формуле: µ = (ln Nt – ln No)/t, где No и Nt – численности бактерий в начале и в конце инкубации, t – время инкубации, часы в разбавленных пробах воды. Продукцию бактериопланктона (Pв, мг С/м3 сут или кл/мл сут) рассчитывали, как произведение удельной скорости роста и биомассы (или численности) бактерий в неразбавленной морской воде. Деструкцию органического вещества рассчитывал, принимая, что отношение продукции бактерий к их рациону составляет 0.27 [28].
Интегрированные по глубине значения были рассчитаны по методу трапеции. Средневзвешенные значения параметров для водной толщи рассчитывали путем интегрирования значений по глубине и делением на значение глубины.
РЕЗУЛЬТАТЫ
Глубина эвфотического слоя в районе исследований и 30 июня, и 1 октября составила 20 м. При этом летом верхний перемешанный слой с температурой 21°С был ограничен термоклином на глубине 10 м. Ниже 20 м температура воды была 8°С. В начале октября термоклин был на глубине 60 м при температуре верхнего слоя воды 15°С. Соленость во обоих случаях рассматриваемом верхнем 25-м слое варьировала незначительно от 7.2 до 7.4 psu.
В июне в верхнем 25-м слое по биомассе доминировали динофитовые (43% от суммарной биомассы), синезеленые (31%) и криптофитовые (16%) водоросли, при этом основная часть суммарной биомассы была сосредоточена в верхнем 10-м слое. В октябре в фитопланктоне доминировали диатомовые водоросли (86% от суммарной биомассы).
Основная часть первичной продукции была сосредоточена в верхнем 10 м слое. В июне она варьировала от 16.55 до 20.36 мкг С/л в сут с ярко выраженным максимумом на глубине 5 м (табл. 1). На этой же глубине формировался максимум концентрации хл “а” (10.7 мкл/л). Основная масса хл “а” в этот период была сосредоточена в слое 0–10 м, т.е. в верхнем прогретом слое, ограниченном термоклином. В октябре максимум первичной продукции находился в поверхностном слое (147.24 мкг С/л в сут) и в семь раз превышал значение для июня, при том что на глубинах 5 и 10 м значения для двух периодов были близкими (табл. 1). Концентрация хл “а” в октябре была высокой во всем 25-м верхнем нестратифицированном слое (4.67–7.43 мкг/л), с максимумом у поверхности. Ассимиляционное число в июне было максимальным (0.58 мкг С/л в сут) на глубине 10 м, а в октябре – в поверхностном слое (1.65 мкг С/л в сут). При этом в октябре его величина достаточно быстро снижалась с глубиной.
Таблица 1.
Первичная продукция (ПП, мкг С/л в день), концентрация хл “а” (Хл, мкг/л), ассимиляционное число (АЧ, мкг С/мкг хл “а” в час), максимальная квантовая эффективность (Fv/Fm), относительная скорость электронного транспорта в фотосистеме II (rETR), оптимальная освещенность (Ek, мкмоль фотонов/м2 в сек), максимальная rETR при оптимальной освещенности (rETRmax) на разных горизонтах в июне и октябре
| Горизонт, м | ПП | Хл | АЧ | Fv/Fm | rETR | Ek | rETRmax |
|---|---|---|---|---|---|---|---|
| 30 июня | |||||||
| 0 | 20.36 | 4.66 | 0.36 | 0.327 | 26.7 | 710 | 26.7 |
| 5 | 47.32 | 10.74 | 0.37 | 0.393 | 10.0 | 480 | 36.9 |
| 10 | 16.55 | 2.38 | 0.58 | 0.585 | 7.0 | 710 | 81.2 |
| 15 | 1.04 | 0.89 | 0.10 | 0.525 | 3.0 | 710 | 50.9 |
| 25 | 0.39 | 0.471 | 710 | 33.4 | |||
| 1 октября | |||||||
| 0 | 147.24 | 7.430 | 1.65 | 0.704 | 70.4 | 710 | 83 |
| 5 | 38.10 | 6.876 | 0.46 | 0.675 | 13.2 | 710 | 81 |
| 10 | 11.23 | 4.942 | 0.19 | 0.682 | 3.0 | 800 | 81 |
| 15 | 3.64 | 4.885 | 0.06 | 0.711 | 1.1 | 710 | 81 |
| 20 | 5.542 | 0.695 | 800 | 69 | |||
| 25 | 4.670 | 0.677 | 710 | 60 | |||
Квантовый выход фотосистемы II фитопланктона (Fv/Fm) в июне значительно варьировал в пределах верхнего слоя (0.393–0.585) с максимумом на глубине 10 м и минимальными значениями в слое 0–5 м. В противоположность этому, в октябре этот параметр имел высокие значения (0.675–0.711) во всем верхнем слое с небольшим максимумами на поверхности и в зоне термоклина на 15 м. Значения rETR в пределах эвфотического слоя варьировали от 3.0 до 26.7 отн. ед. в июне и от 1.1 до 70.4 отн. ед. в октябре. Максимальные значения различались почти в три раза, но в обоих случаях были определены в поверхностном слое (табл. 1).
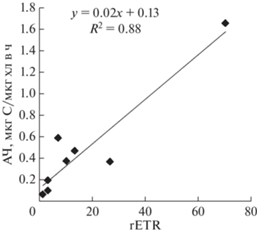
Анализ соотношения между значениями rETR и АЧ в эвфотическом слое при одинаковых уровнях освещенности, полученными в июне и октябре, показал сильную положительную корреляцию (r = 0.93, n = 8, P = 0.05) (рис. 2). Линейная корреляция между rETR и валовой фиксацией углерода и/или продукцией О2 была установлена в различных регионах [24, 27, 40]. Это позволяет нам использовать графики зависимости rETR от уровня освещенности (“быстрые световые кривые”) для определения уровня оптимальной освещенности для ПП фитопланктона на конкретном горизонте отбора проб, отражающей уровень световой адаптации фитопланктона.
Рис. 2.
Соотношение между ассимиляционным числом (АЧ) и относительной скоростью электронного транспорта (rETR) в эвфотическом слое.
Определенные с помощью “быстрых световых кривых” значения оптимальной освещенности Ek (при которой в экспериментальных условиях в измерительной камере РАМ-флуориметра достигался максимальный уровень rETR для конкретной пробы, rETRmax) были на одном уровне (710 мкмоль фотонов/м2 в с) и в летний, и в осенний периоды (табл. 1) в верхнем 25-м слое. Отметим при этом, что в июне оптимальная освещенность для поверхностного фитопланктона (710 мкмоль фотонов/м2 в с) была ниже средней для светового периода солнечной радиации (800 мкмоль фотонов/м2 в с). Это обстоятельство могло быть причиной более низкой величины ПП на поверхности по сравнению с ее значением на глубине 5 м (см. табл. 1). В целом и в июне и в октябре фитопланктон в эвфотическом слое был адаптирован к высокому уровню освещенности. Однако максимально возможная фотосинтетическая активность (rETRmax) в июне существенно различалась для разных горизонтов (от 26.7 до 81.2 отн. ед.) с минимумом на поверхности и максимумом на глубине 10 м (на нижней границе верхнего прогретого слоя). В октябре вертикальный профиль rETRmax характеризовался равномерно высокими значениями (80.5–82.9 отн. ед.) в пределах слоя 0–15 м и снижением в слое 20–25 м.
Значения ЧБ в июне и в октябре в пределах 25-м слоя варьировали от 970 до 2250 тыс. кл/мл (табл. 2), при этом средние значения для этого слоя в оба периоды были близки. Максимальные величины в обоих случаях были определены на глубине 5 м, но в октябре их значения были в 1.5 раза ниже, чем в июне (1490 и 2250 тыс. кл/мл). Осредненные для пробы воды значения объема клеток варьировали от 0.02 до 0.24 мкм3, составляя в среднем 0.21 мкм3. В июле преобладали мелкие кокковые формы, средний объем 0.02 мкм3, в то время как в августе в общем составе бактериопланктона увеличилась доля палочковидных форм и вибрионов (средний объем клетки 0.18 мкм3).
Таблица 2.
Численность (ЧБ, тыс. кл/мл) и биомасса бактерий (ББ, мг С/м3), бактериальная продукция (ПБ, мг С/м3 в сут) и деструкция (ДБ, мг С/м3 в сут), удельная продукция бактерий (P/B, сут–1), доля бактериальной продукции в общей продукции (первичная + бактериальная) (ПБ/(ПБ + ПП), %) и соотношение величин бактериальной деструкции и первичной продукции (ДБ/ПП)
| Горизонт, м | ЧБ | ББ | ПБ | ДБ | P/B | ПБ/(ПБ + ПП) | ДБ/ПП |
|---|---|---|---|---|---|---|---|
| 30 июня | |||||||
| 0 | 1460 | 24.0 | 12.8 | 47.4 | 0.533 | 39% | 2.33 |
| 5 | 2250 | 34.2 | 25.3 | 93.7 | 0.740 | 35% | 1.98 |
| 10 | 1450 | 23.3 | 14.8 | 54.8 | 0.635 | 47% | 3.31 |
| 15 | 1040 | 14.1 | 18.5 | 68.5 | 1.312 | 95% | 66.0 |
| 25 | 970 | 23.0 | 18.7 | 69.3 | 0.813 | ||
| 1 октября | |||||||
| 0 | 1210 | 21.5 | 1.03 | 3.8 | 0.048 | 0.7% | 0.03 |
| 5 | 1490 | 28.9 | 4.86 | 18.0 | 0.168 | 11% | 0.47 |
| 10 | 1440 | 28.1 | 8.77 | 32.5 | 0.312 | 44% | 2.89 |
| 15 | 1190 | 34.5 | 24.9 | 92.2 | 0.722 | 87% | 25.33 |
| 20 | 1270 | 37.0 | 17.8 | 65.9 | 0.481 | ||
| 25 | 990 | 37.4 | |||||
Распределения ББ по глубине в пределах 25-м слоя в июне и октябре существенно различались, что, по-видимому, было связано с толщиной верхнего перемешанного слоя. Вертикальный профиль биомассы бактерий в июне характеризовался ярко выраженным максимумом (34.2 мг С/м3) и более низкими величинами в слое ниже термоклина. В октябре, когда термоклин был на глубине 60 м, это распределение по глубине было более выравненным, а общий уровень величин превышал аналогичные значения в июне. При этом наиболее высокие значения (34.5–37.0 в слое мг С/м3) наблюдались в слое 15–25 м. Исходя из отношения биомассы к численности, можно сказать, что в октябре клетки бактерий были в среднем крупнее в 1.4 раза, чем в июне.
ПБ также значительно различалась летом и осенью. В июне значения этого параметра варьировали по глубине от 14.8 до 25.3 мг С/м3 в сут (в среднем 16.3 ± 4.1 мг С/м3 в сут) с максимумом на глубине 5 м (табл. 2). В октябре наблюдалась совершенно другая картина. В поверхностном слое ПБ была очень низкая (1.03 мг С/м3 в сут) и увеличивалась с глубиной до максимального значения (24.9 мг С/м3 в сут) на глубине 15 м. В среднем в этот период в слое 0–25 м ПБ составляла 12.0 ± 9.7 мг С/м3 в сут, и была в 1.4 раза ниже, чем в июне.
Удельная ПБ (P/B-коэффициент) варьировала по глубине от 0.53 до 1.31 сут–1 (в среднем 0.84 ± ± 0.34 сут–1) в июне и от 0.05 до 0.72 сут–1 (в среднем 0.36 ± 0.25 сут–1). Максимальные значения в оба периода наблюдались на глубине 15 м (1.31 и 0.72 сут–1, соответственно).
Интегральные для эвфотического слоя значения биомассы и продуктивности фито- и бактериопланктона представлены в табл. 3. Интегральная ПП, содержание хл “а”, суммарная удельная продукция фитопланктона (АЧ), суммарная величина электронного транспорта в фотосистеме II (rETR), а также ББ в октябре были выше, чем в июне. Интегральная ПБ в эвфотическом слое в октябре была 1.5 раза ниже, чем в июне.
Таблица 3.
Интегральные величины параметров продуктивности фито- и бактериопланктона в эвфотическом слое: интегральная первичная продукция (ППинт, мг С/м2 в сут), суммарное содержание хл “а” (Хлинт, мг/м2), интегральная удельная первичная продукция (АЧинт, мг С/мг хл “а” в час), интегральная численность бактерий (ЧБинт, млн кл/см2), интегральная биомасса бактерий (ББинт, мг С/м2), интегральная бактериальная продукция (ПБинт, мг С/м2 в сут), интегральная потребность бактерий в углероде (деструкция) (ДБинт, мг С/м2 в сут), доля интегральной бактериальной продукции в общей (первичная + бактериальная) продукции (ПБ/(ПБ + ПП), %) и соотношение интегральных величин бактериальной деструкции и первичной продукции (ДБ/ПП, отн. ед.) в летний и осенний периоды
| Дата | 30 июня | 01 октября |
|---|---|---|
| ППинт | 375.8 | 633.0 |
| Хлинт | 82.7 | 113.8 |
| АЧинт | 6.1 | 7.7 |
| ЧБинт | 29.8 | 26.8 |
| ББинт | 475.5 | 603.8 |
| ПБинт | 371.8 | 239.7 |
| ДБинт | 1375.9 | 887.9 |
| ПБ/(ПБ + ПП) | 50% | 27% |
| ДБ/ПП | 3.67 | 1.40 |
ОБСУЖДЕНИЕ
Величина интегральной ПП, измеренная в наших исследованиях, была сопоставима с величинами, полученными в южной части открытой Балтики (381–617 мг С/м2 в сут) [34], но ниже, чем в прибрежных зонах Гданьского бассейна – 538–1214 мг С/м2 в сут в северо-восточной части бассейна [6, 25] и 580–1860 мг С/м2 в сут в юго-западной прибрежной зоне [44]. Значения rETR сравнимы c таковыми для фитопланктона Северного моря и Южной Атлантики (2–40 отн. ед.) [37].
Потенциальная фотосинтетическая активность фитопланктона, определяемая по максимальной квантовой эффективности фотосистемы II (Fv/Fm), в июне в пределах верхнего 25-м слоя значительно варьировала по глубине, достигая относительного максимума (0.585) на 10 м. Аналогично и потенциальная способность фотосистемы II фитопланктона к трансформации световой энергии в химическую (максимально возможная скорость электронного транспорта в фотосистеме II при оптимальном освещении, rETRmax) была наиболее высокой на этой же глубине. В обоих случаях минимальные значения потенциальной активности были отмечены на поверхности. Высокая потенциальная активность фотосинтетического аппарата на глубине 10 м реализуется в высокой скорости биосинтеза органического вещества, что выражалось в максимальной для вертикального профиля величине АЧ. Однако максимальная величина ПП в июне была на глубине 5 м, что было обусловлено высоким содержанием хл “а” на этой глубине.
Совершенно другое распределение этих продукционных показателей фитопланктона по глубине в эвфотическом слое было в октябре того же года. Величины относительной переменной флуоресценции (Fv/Fm) в этот период на всех горизонтах находились на уровне 0.67–0.71, характеризуя очень высокую квантовую эффективность фотосистемы II фитопланктона, т. е. высокую потенциальную активность первичных (световых) процессов фотосинтеза в верхнем 25-м слое. Это подтверждается и высокой во всем этом слое максимально возможной скоростью электронного транспорта в фотосистеме II (rETRmax) при условии оптимального освещения.
Высокий потенциал фотосинтеза реализуется в этот период в максимальной степени только на поверхности, где значение АЧ было почти в четыре раза больше, чем на глубине 5 м. Величина rETR (скорость электронного транспорта в фотосистеме II при уровне освещения, соответствующем природному в точке отбора проб), так же была максимальной в поверхностном слое, существенно отличаясь от величин на других горизонтах. В целом, величина rETR, отражающая скорость конвертации солнечной энергии в химически связанную энергию в клетках, которая обеспечивает процессы биосинтеза органического вещества фитопланктоном, и в октябре, и в июле закономерно уменьшалась с глубиной вслед за уменьшением количества доступного света. Однако интенсивность такого уменьшения различалась в разные периоды. При равномерном распределении хл “а” в октябре в верхнем слое высокая активность фитопланктона в поверхностном слое выражалась в значениях высокой ПП.
Отношение величин rETR и АЧ, измеренных при одинаковых интенсивностях света для каждой подпробы, позволяет нам сравнивать фотосинтетическую эффективность фитопланктона на разных глубинах эвфотического слоя и в разные периоды года независимо от текущих световых условий.
Как уже указывалось выше, между продуктивными параметрами – rETR и АЧ – была установлена тесная взаимосвязь (см. рис. 2). Это позволяет рассматривать их как величины, отражающие интенсивность двух основных стадий фотосинтеза – темновой и световой стадий, соответственно. При этом в ряде работ показано, что отклонения от прямой зависимости наблюдаются при определенных условиях, таких как высокие и низкие световые условия, сильная вариабельность температуры или биогенный стресс [20, 31]. В некоторых работах взаимоотношение между rETR и фиксацией углерода демонстрирует видоспецифичность [40].
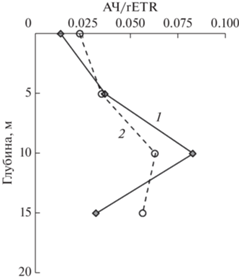
Фотосинтетическая эффективность (АЧ/rETR), рассчитанная для каждой пробы, варьировала от 0.014 до 0.083 в июне и от 0.024 до 0.063 в октябре, в среднем составляя 0.048 и 0.046, соответственно. Очевидно, что при всех различиях показателей потенциальной и реализованной продукции фитопланктона, фотосинтетическая эффективность, отражающая количество синтезированного органического вещества на единицу уловленной и запасенной световой энергии, в оба периода была на одном уровне (рис. 3), хотя масштаб различий на разных горизонтах в июне был существенно выше. При этом максимальные для профиля величины были установлены на одной и той же глубине 10 м. Результаты наших исследований в Карском море продемонстрировали аналогичные пределы вариаций фотосинтетической эффективности – от 0.014 до 0.071, хотя это арктический регион [30].
Рис. 3.
Вертикальное распределение значений фотосинтетической эффективности (АЧ/rETR) фитопланктона в июне (1) и октябре (2).
Полученные нами величины лежат приблизительно в том же диапазоне значений, что и установленные для фитопланктона и микрофитобентоса в эстуариях [12], где значения эффективности rETR для фиксации углерода (ЕЕ) варьировали между 0.04 и 0.16. Цитируемые авторы также пересчитали опубликованные данные для культур и получили значения ЕЕ в пределах от 0.007 до 0.02 для различных видов морского фитопланктона.
По нашим оценкам значения ЧБ и ББ хорошо сопоставимы со значениями, полученными ранее для польской части Гданьского залива (ЧБ варьировала от 1.2 до 3.8 × 106 кл/мл, ББ от 30 до 70 мгС/м3) [44], и сравнимы со значениями, полученными в октябре 2007 г. в российской части Гданьского залива (средние ЧБ – 1.08 млн кл/мл и ББ – 22 мг С/м3) [6]. В тоже время, определенная нами в июле численность и биомасса бактериопланктона оказались ниже значений, полученных в июле 2009 г. – средняя ЧБ для слоя 0–20 м составила 5.13 млн кл/мл, ББ – 65 мг С/м3 [6]. По-видимому, это связано с тем, что наши исследования проводились в более мористых водах, чем прибрежная акватория Куршской косы и Самбийского полуострова, где была выполнена цитируемая работа [6].
Значения ПБ согласуются с результатами, полученными ранее для Гданьского залива [44], и выше значений, полученными в открытой части Балтийского моря (от 0.90 до 2.43 мг С/м3 сут) [34].
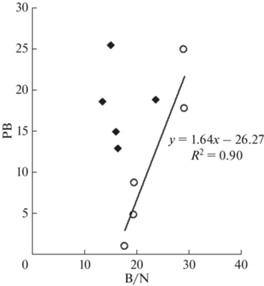
Удельная продукция бактерий (отношение продукции к биомассе) и в июне, и в октябре была максимальной на глубине 15 м (т.е. ниже, чем максимум удельной продукции фитопланктона), при этом в июне 2021 г. она была в 1.8 раза выше. Среднее значение удельной продукции бактерий для июня также было выше (в 2.3 раза), чем для октября. Одной из причин могло быть увеличение размеров бактериальных клеток (величина B/N) и, соответственно, уменьшение отношения поверхности клеток к их объему в октябре, что может определять интенсивность обменных процессов [29]. Для этого периода была установлена прямая корреляция между ПБ и размерным индексом B/N (рис. 4). В июле такая связь отсутствовала.
Рис. 4.
Соотношение бактериальной продукции (PB) и индекса размера бактериальных клеток (B/N) в июне (значок ромба)) и октябре (значок кружка).
В отличие от ПП фитопланктона, интегральные значения бактериальной продукции в октябре были ниже, чем в июне. Вертикальное распределение ПБ значительно различалось. В июне максимальные значения и ПП, и ПБ были определены на 5 м. В октябре при экспоненциальном снижении ПП с глубиной значения ПБ, наоборот, возрастали от минимальных на поверхности до максимума в слое 15–20 м. Таким образом, бактериальная продукция в верхнем слое 0–10 м в июне была на высоком уровне (в среднем 17.63 ± ± 6.71 мгС/м2 в сут), а октябре – значительно ниже (в среднем 4.88 ± 3.87 мгС/м2 в сут). При этом в слое 15–20 м значения этого параметра были на высоком уровне в оба периода (в среднем 18.6 ± ± 0.14 и 21.35 ± 5.02 мгС/м2 в сут, соответственно). Возможно, это связано с понижением температуры воды и с увеличением глубины верхнего перемешанного слоя в октябре. Последнее обстоятельство может обуславливать степень доступности растворенного органического углерода – одного из главных источников углерода для бактериопланктона. Чистая ПП включает образование биомассы и растворенные продукты фотосинтеза, которые выделяются клетками фитопланктона. Эти продукты являются количественно важным и легко усваиваемым источником лабильного и полулабильного органического вещества для гетеротрофного морского бактериопланктона [34]. При увеличении глубины верхнего перемешанного слоя содержание органического углерода (и взвешенного, и растворенного) в поверхностном слое, по-видимому, становится меньше и, в связи с этим, бактериальная продукция может снижаться.
Общая интегральная продукция фито- и бактериопланктона в эвфотическом слое в октябре была выше, чем в июне, но незначительно (табл. 3). Доля ПП в общей продукции в июне в слое 0–10 м составляла 53–65% и снижалась до 95% на нижней границе эвфотического слоя, где ПП лимитировалось минимальным светом (рис. 5). В октябре противоположно направленные изменения с глубиной продукционных показателей фито- и бактериопланктона определяли постепенное увеличение доли БП в слое 0–10 м, где создавалась основная масса ПП, от 1% на поверхности до 44% на глубине 10 м и затем до 87% на нижней границе эвфотической зоны.
Рис. 5.
Вертикальное распределение доли бактериальной продукции в общей продукции в июне (1) и октябре (2).
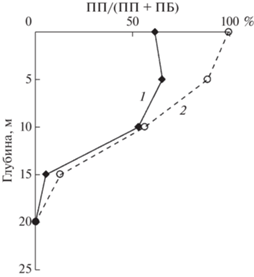
В верхнем 10-м слое, где формировалась основная часть ПП (88 и 93% от интегральной ПП в июне и октябре, соответственно), баланс между автотрофной (фитопланктон) и гетеротрофной (бактерии) продукцией значительно различается для летнего и осеннего периодов (табл. 4). В июне в этом слое автотрофная продукция (63% от общей продукции) лишь ненамного превышала гетеротрофную, тогда как в октябре наблюдалось доминирование автотрофной продукции (92% от общей продукции) (рис. 5). В слое 15–25 м, где уровень освещенности снижался до нуля, доминирование гетеротрофной продукции естественным образом возрастала до 100% в оба периода.
Таблица 4.
Первичная продукция и бактериальная деструкция (мгС/м2 в сут) в верхнем 10-м слое
| Параметры | 30 июня | 1 октября |
|---|---|---|
| ПП инт (0–10 м) | 329 | 587 |
| ПБ инт (0–10 м) | 195 | 49 |
| ПП + ПБ | 524 | 635 |
| ПП/(ПП + ПБ) | 63% | 92% |
Бактериальная потребность в органическом углероде (бактериальная деструкция), рассчитанная из бактериальной продукции, в верхнем слое 0–10 м варьировала от 47.4 до 93.7 мг С/м3 в сут в июне и от 3.8 до 32.5 мг С/м3 в сут в октябре. Отношение бактериальной потребности в углероде к первичной продукции в этом слое составляло 2.54 и 1.13 в июне и октябре, соответственно. Следует отметить, что бактерии утилизируют только небольшую часть запаса автохтонного растворенного органического вещества, присутствующего в морской экосистеме (в основном моносахариды и аминокислоты), которые выделяются фитопланктоном [33]. Наиболее важным источником пищи для бактерии в Гданьском заливе является аллохтонное вещество, поступающее с речным стоком [10].
ЗАКЛЮЧЕНИЕ
Установлена тесная связь между параметрами первичной продукции – rETR и AЧ – отражающие интенсивность световой и темновой стадий фотосинтеза. Фотосинтетическая эффективность, характеризующая степень использования абсорбированной световой энергии в процессе синтеза органического вещества, выраженная в виде отношения АЧ/rETR, была максимальной на глубине 10 м и в июне, и в октябре 2021 г. При различной степени вариабельности этого параметра по глубине в пределах эвфотического слоя в июне и октябре (0.014–0.083 и 0.24–0.063, соответственно), средние значения для слоя были очень близки (0.48 и 0.46, соответственно). По-видимому, фитопланктонное сообщество данного местообитания сохраняет постоянный уровень фотоадаптации в летне-осенний период, а максимальная фотосинтетическая эффективность привязана к слою с низкой освещенностью (2% от поверхностной ФАР).
Интегральная ПП в октябре была выше, чем в июне (633 и 376 мг С/м2 в сут, соответственно), тогда как интегральная бактериальная продукция была ниже в эти же даты (240 и 372 мг С/м2 в сут, соответственно). Очевидно, что сезонная продукционная активность фито- и бактериопланктона в летне-осенний период развивается в противофазе, что скорее всего связано со сложным характером трофических и конкурентных взаимоотношений.
В верхнем наиболее продуктивном 10-м слое водной толщи автотрофная продукция (фитопланктон) ненамного превышала гетеротрофную (бактериальную) продукцию в июне и доминировала в октябре. Следовательно, в летне-осенний период эффективность пищевой цепи оставалась высокой и способствовала высокой продукции высших трофических уровней.
Источники финансирования.Работа выполнена в рамках пилотного проекта по созданию полигонов для разработки и испытаний технологий контроля углеродного баланса (Приказ Минобрнауки России от 5 февраля 2021 г. № 74), а также в рамках госзадания ИО РАН (тема № FMWE-2021-0016).
Список литературы
Александров С.В. Первичная продукция планктона в лагунах Балтийского моря (Вислинский и Куршский заливы). Калининград: АтлантНИРО, 2010. 227 с.
Калвека Б.Я. Особенности развития фитопланктона в Рижском заливе 1987–1980 гг. // Рыбохозяйственные исследования в бассейне Балтийского моря. 1983. Вып. 18. С. 3–9.
Кудрявцева Е.А., Александров С.В. Гидролого-гидрохимические основы первичной продуктивности и районирование российского сектора Гданьского бассейна Балтийского моря // Океанология. 2019. Т. 59. № 1. С. 56–71.
Кудрявцева Е.А., Александров С.В., Дмитриева О.А. Сезонная изменчивость первичной продукции и состава фитопланктона в береговой зоне российского сектора Гданьского бассейна Балтийского моря // Океанологические исследования. 2018. Т. 46. № 3. С. 99–115.
Кудрявцева Е.А., Буканова Т.В., Александров С.В. Моделирование первичной продукции в юго-восточной части Балтийского моря // Известия КГТУ. 2022. № 64. С. 11–22.
Кудрявцева Е.А., Саввичев А.С., Александров С.В. и др. Бактериопланктон Гданьского бассейна Балтийского моря // Микробиология. 2012. Т. 81. № 3. С. 377–388.
Методические рекомендации по сбору и обработке материалов при гидробиологических исследованиях на пресноводных водоемах. Фитопланктон и его продукция. Л.: 1981.
Мошаров С.А., Гонтарев С.В., Корсак М.Н. Новый фитоинкубатор с регулировкой температуры и освещенности для определения первичной продукции // Безопасность в техносфере. 2015. № 4. С. 3–9.
Alasaarela E. Phytoplankton and environmental conditions in central and coastal areas of the Bothnian Bay // Ann. Bot. Fennica. 1979. V. 16. № 3. P. 241–274.
Ameryk A., Podgorska B., Witek Z. The dependence between bacterial production and environmental conditions in the Gulf of Gdańsk // Oceanologia. 2005. V. 47. № 1. P. 27–45.
Andersson A., Brugel S., Paczkowska J. et al. Influence of allochthonous dissolved organic matter on pelagic basal production in a northerly estuary // Estuarine, Coastal and Shelf Science. 2018. V. 204. P. 225–235.
Barranguet C., Kromkamp J. Estimating primary production rates from photosynthetic electron transport in estuarine microphytobenthos // Mar. Ecol. Prog. Ser. 2000. V. 204. P. 39–52.
Bergen B., Naumann M., Herlemann D.P. et al. Impact of a major inflow event on the composition and distribution of bacterioplankton communities in the Baltic Sea // Frontiers in Marine Science. 2018. V. 5. UNSP 383.
Berglund J., Muren U., Båmstedt U. et al. Efficiency of a phytoplankton and a bacterial-based food web in a pelagic marine system // Limnol. Oceanogr. 2007. V. 52. P. 121–131.
Dahlgren K., Eriksson-Wiklund A.-K., Andersson A. The influence of autotrophy, heterotrophy and temperature on pelagic food web efficiency in a brackish water system // Aquat. Ecol. 2011. V. 45. P. 307–323.
Degerman R., Lefebure R., Bystreom P. et al. Food web interactions determine energy transfer efficiency and top consumer responses to inputs of dissolved organic carbon // Hydrobiologia. 2018. V. 805. P. 131–146.
Ducklow H.W., Hill S.M. The growth of heterotrophic bacteria in the surface waters of warm core rings // Limnol. Oceanogr. 1985. V. 30. № 2. P. 239–259. https://doi.org/10.4319/lo.1985.30.2.0239
Genty B., Briantais J.-M., Baker N.R. The relationship between the quantum yield of photosynthetic electron transport and quenching of chlorophyll fluorescence // Biochim. Biophys. Acta. 1989. V. 990. P. 87–92.
Hallfors G.A., Niemi A. Biological oceanography / The Baltic Sea (Voipio, A., ed.), Amsterdam. Elsevier Oceanogr. Ser. № 30. 1981. P. 219–238.
Hancke K., Hancke T.B., Olsen L.M. et al. Temperature effects on microalgal photosynthesis-light responses measured by O2 production, pulseamplitude- modulated fluorescence, and C assimilation // J. Phycol. 2008. V. 44. P. 501–514.
Holm-Hansen O., Riemann B. Chlorophyll a determination: improvements in methodology // Oikos. 1978. V. 30. P. 438–447.
JGOFS (Joint Global Ocean Flux Study Protocols), 1994. Protocols for the Joint Global Ocean Flux Study Protocols (JGOFS) Core Measurements. UNESCO, Paris, pp. 119–122.
Kolber Z., Falkovski P.G. Use of active fluorescence to estimate phytoplankton photosynthesis in situ // Limnol. Oceanogr. 1993. V. 38. № 8. P. 1646–1665.
Kromkamp J.C., Dijkman N.A., Peene J. et al. Estimating phytoplankton primary production in Lake IJsselmeer (The Netherlands) using variable fluorescence (PAM-FRRF) and C uptake techniques // Eur. J. Phycol. 2008. V. 43. P. 327–344.
Kudryavtseva E., Aleksandrov S., Bukanova T. et al. Relationship between seasonal variations of primary production, abiotic factors and phytoplankton composition in the coastal zone of the south-eastern part of the Baltic Sea // Regional studies in marine sciences. 2019. V. 32. 100862.
Larsson U., Hagstreom Å. Fractionated phytoplankton primary production, exudate release and bacterial production in a Baltic eutrophication gradient // Mar. Biol. 1982. V. 67, № 1. P. 57–70.
Lawrenz E., Silsbe G., Capuzzo E. et al. Predicting the electron requirement for carbon fixation in seas and oceans // PLoS One. 2013. V. 8. № 3.
Meon B., Amon R.M.W. Heterotrophic bacterial activity and fluxes of dissolved free amino and glucose in the Arctic rivers Ob, Yenisei and the adjacent Kara Sea // Aquatic Microbial Ecology. 2004. V. 37.P. 121–135.
Microbial Ecology of the Oceans, Second Edition, Edited by David L. Kirchman, John Wiley & Sons. 2008. 569 p.
Mosharov S.A., Sergeeva V.M., Kremenetskiy V.V. et al. Assessment of phytoplankton photosynthetic efficiency based on measurement of fluorescence parameters and radiocarbon uptake in the Kara Sea // Estuarine, Coastal and Shelf Science. 2019. V. 218. P. 59–69.
Napoleon C., Raimbault V., Claquin P. Influence of nutrient stress on the relationships between PAM measurements and carbon incorporation in four phytoplankton species // PLoS One. 2013. V. 8. № 6. e66423.
Norland S. The relationship between biomass and volume of bacteria. In: Kemp, P. F., Cole, J.J., Sherr, B.F., Sherr, E.B. (Eds.), Handbook of Methods in Aquatic Microbial Ecology. Lewis Publ, Boca Raton, 1993. P. 303–308.
Norman B., Zweifel U.L., Hopkinson C.S. et al. Production and utilization of dissolved organic carbon during an experimental diatom bloom // Limnol. Oceanogr. 1995. V. 40. P. 898–907.
Piontek J., Endres S., Le Moigne F.A.C. et al. Relevance of nutrient-limited phytoplankton production and its bacterial remineralization for carbon and oxygen fluxes in the Baltic Sea // Frontiers in Marine Science. 2019. V. 6. Article 581.
Porter K.G., Feig Y.S. The use DAPI for identifying and counting of aquatic microflora // Limnol. Oceanogr. 1980. V. 25. № 5. P. 943−948.
Posch T., Loferer-Krӧßbacher M., Gao G. et al. Precision of bacterioplankton biomass determination: a comparison of two fluorescent dyes, and of allometric and linear volume-to carbon conversion factors // Aquat. Microb. Ecol. 2001. V. 25. P. 55–63.
Röttgers R. Comparison of different variable chlorophyll a fluorescence techniques to determine photosynthetic parameters of natural phytoplankton // Deep-Sea Res. Part I. 2007. V. 54. P. 437–451.
Schreiber U. Pulse amplitude (PAM) fluorometry and saturation pulse method: an overview. In: Papageorgiou, G., Govindjee, G. (Eds.), Chlorophyll a Fluorescence: a Signature of Photosynthesis. Advances in Photosynthesis and Respiration Series. Kluwer Academic Publishers, Dordrecht. 2004. P. 270–319.
Steemann-Nielsen E. The use of radio-active carbon (C14) for measuring organic production in the sea // Journal du Conseil/Conseil Permanent International pour l’Exploration de la Mer. 1952. V. 18. P. 117–140.
Suggett D.J., MacIntyre H.L., Kana T.M. et al. Comparing electron transport with gas exchange: parameterising exchange rates between alternative photosynthetic currencies for eukaryotic phytoplankton // Aquat. Microb. Ecol. 2009. V. 56. P. 147–162.
Suggett D.J., Moore C.M., Hickman A.E. et al. Interpretation of fast repetition rate (FRR) fluorescence: signatures of phytoplankton community structure versus physiological state // Mar. Ecol. Prog. Ser. 2009. V. 376. P. 1–19.
Ulyanova M., Sivkov V., Kanapatskij T. et al. Methane fluxes in the southeastern Baltic Sea // Geo-Marine Lett. 2012. V. 32 (5–6). P. 535–544.
Wasmund N., Andrushaitis A., Łysiak-Pastuszak E. et al. Trophic Status of the South-Eastern Baltic Sea: A Comparison of Coastal and Open Areas // Estuarine. Coastal and Shelf Science. 2001. № 53. P. 849–864.
Witek Z., Ochocki S., Maciejowska M. et al. Phytoplankton primary production and its utilization by the pelagic community in the coastal zone of the Gulf of Gdańsk (southern Baltic) // Mar. Ecol. Prog. Ser. 1997. V. 148. P. 169–186.
Дополнительные материалы отсутствуют.