Океанология, 2022, T. 62, № 6, стр. 887-897
Сезонная динамика вертикальных потоков фитопланктона, тинтиннид и стрекательных клеток кишечнополостных в Карском море
И. Н. Суханова 1, М. В. Флинт 1, *
1 Институт океанологии им. П.П. Ширшова РАН
Москва, Россия
* E-mail: m_flint@ocean.ru
Поступила в редакцию 27.01.2022
После доработки 12.05.2022
Принята к публикации 13.07.2022
- EDN: ECFLMK
- DOI: 10.31857/S0030157422060120
Аннотация
Исследование проведено по материалам месячных сборов седиментационной ловушки, экспонированной на внешнем шельфе Карского моря с сентября 2018 г. по июль 2019 г. Впервые получены оценки вертикальных потоков фитопланктона и его доминирующих компонентов, тинтиннид и стрекательных клеток кишечнополостных. Максимальный вертикальный поток фитопланктона, в котором доминировали крупные центрические диатомеи, наблюдался в мае и был связан с формированием обширной полыньи в сезонном ледовом покрове. Численность фитопланктона в максимуме достигла 6.5 × 106 кл. м–2 сут–1, сырая биомасса – 17.7 мг м–2 сут–1, биомасса в углероде – 1.17 мгС м–2 сут–1. Вертикальный поток ВОУ был невысоким (4.1 мгС м–2 сут–1) при этом вклад фитопланктона в ВОУ был максимальным за весь период наблюдений – 28.5%. Высокие численность и биомасса фитопланктона при доминировании видов приледового цветения зарегистрированы в июньской пробе в период схода сезонного льда. Минимальные величины обилия водорослей в седиментационных пробах отмечены с января по апрель. За исключением мая вклад фитопланктона в ВОУ не превышал 3%. Численность тинтиннид была максимальной в сентябре–ноябре, стрекательных клеток кишечнополостных – с сентября по декабрь и в мае. В осенние месяцы вклад тинтиннид в ВОУ был соизмерим с вкладом фитопланктона.
ВВЕДЕНИЕ
Изучение фитопланктона Карского моря, особенно интенсивно проводившееся в последние 15 лет, позволило выделить фитоценозы, приуроченные к биотопам с разными гидрофизическими и гидрохимическими условиями, получить количественные оценки численности и биомассы водорослей, проанализировать влияние пресноводного стока на структурные особенности фитопланктона, выявить особенности сезонной изменчивости [6–11, 16]. Все перечисленные исследования были сделаны в период, когда море свободно ото льда. Работы, посвященные анализу изменений фитопланктона в Карском море в масштабах годового цикла, не проводились. В настоящей работе использованы материалы, собранные седиментационными ловушками на внешнем шельфе Карского моря на протяжении десятимесячного эксперимента. Они позволяют впервые непрерывно проследить перестройку качественной структуры и некоторых количественных показателей фитопланктона на протяжении столь длинного периода, охватывающего разные этапы сезонной сукцессии, и оценить роль водорослей и некоторых других компонентов микропланктона в седиментационных процессах.
МАТЕРИАЛ И МЕТОДЫ ИССЛЕДОВАНИЙ
Материал был собран с помощью 12-стаканной конической седиментационной ловушки “Лотос-3” производства ОКБ ОТ РАН, установленной на заякоренной буйковой станции и позволяющей получить непрерывный ряд проб осаждающегося вещества. Ловушка была установлена на внешнем шельфе в северо-западной части Карского моря в точке с координатами N 76°23′872″ с.ш., 71°22′198″ в.д (рис. 1) на глубине 110 м в 60 м от дна, что позволяло исключить влияние придонного нефелоидного слоя на собираемое осадочное вещество. Эксперимент был начат 8 сентября 2018 г. в 72-ом рейсе “Академик Мстислав Келдыш” и закончен 12 июля 2019 г. в 76-ом рейсе этого судна. Время экспозиции каждого сборного стакана составляло 30 сут, которые включали большую часть каждого календарного месяца и начало следующего. В тексте мы относили материал к тому месяцу, когда была получена большая часть материала.
Стаканы пробосборника объемом 260 мл были предварительно заполнены 1% раствором HgCl2 в фильтрованной через стекловолокнистые фильтры морской водой с соленостью до 40. Пробу осадочного вещества, содержащуюся в каждом стакане, фильтровали через сито с размером ячеи 1 мм, после чего отбирали 30 мл для исследования компонентов ловушечного материала, в частности, фитопланктона.
Помимо фитопланктона, в осадочном веществе нами был проведен учет раковинных инфузорий тинтиннид и стрекательных клеток кишечнополостных. Счет клеток и видовые определения всех компонентов проводили в камере Ножотта объемом 0.08 мл и в камере Наумана объемом 0.86 мл. Содержимое углерода рассчитывали с учетом линейных размеров клеток с использованием аллометрических зависимостей (21).
Океанографическая характеристика района исследования подробно обсуждается в работе [3]. Отметим, что формирование сезонного ледового покрова в районе работ началось в конце ноября 2018 г., освобождение ото льда происходило во второй половине июня 2019 г. Условия на горизонте нахождения ловушки были стабильными – при начале и окончании эксперимента соленость на глубине 110 м составляла 34.2 и 34.6, температура – 0.5° и –0.8°, соответственно.
РЕЗУЛЬТАТЫ
Основным компонентом фитопланктона в ловушечных пробах были диатомовые водоросли. Доминирование диатомей характерно для всех районов Карского моря практически в течение большей части года. В осенний сезон в верхнем фотическом слое высокой численности могут достигать мелкоразмерные виды Dinophyсеае, виды морских Flagеllates классов Chrysophyceae, Prasinophyceae и др. В наблюдениях при постановки седиментационной ловушки значительное число видов перечисленных классов были представлены в батометрических пробах фитопланктона. Хорошая сохранность Bacillariophyceae в ловушечных пробах определяется кремневым наружным скелетом, при этом степень сохранности клеток связана с различной толщиной кремневого слоя. Сравнение состава диатомей в планктоне верхнего фотосинтетического слоя во время постановки эксперимента и видов встретившихся в ловушке убеждает в том, что наилучшей сохранностью отличаются виды относящиеся к порядку Biddulphiales подпорядку Coscinodisсineae в частности роды Coscinodiscus, Thalassiosira, Porosira, Cyclotella, Melosira, Paralia и др. Более тонкий и ломкий панцирь у родов Skeletonema, Leptocylindrus и др., а также у ряда колониальных пеннатных форм, таких, как род Fragilariopsis, некоторых видов родов Navicula, Pauliella и др., наряду с распадом колоний, приводит к тому, что значительная часть клеток оказывается включенной в комки детрита. Это крайне затрудняет или делает невозможным их определение. Например, в поверхностном слое при постановке ловушки наиболее многочисленным видом была колониальная Skeletonema costatum (64% численности диатомей). В ловушечных пробах вид был встречен лишь в виде отдельных малочисленных клеток. Перечисленные особенности разных планктонных водорослей определяют то, что полученные нами оценки вклада фитопланктона в поток взвешенного органического углерода заведомо занижены.
Число клеток диатомей в пробах ловушки, как правило, превышало 90% общей численности фитопланктона в осадочном веществе. По биомассе во всех пробах диатомеи составляли > 95% общей биомассы водорослей. Максимальная численность и биомасса наблюдалась в майской пробе (табл. 1, рис. 2а), где на долю диатомей приходилось более 99% численности и биомассы (рис. 3). Преобладали центрические диатомовые (92.2% численности и 95.6% биомассы, табл. 1, рис. 3). В численности 68.7% составляли споры Chaetoceros socialis (4.4 × 106 кл. м–2 сут–1). Высокой численностью характеризовались Thalassiosira hyalina, Paralia sulcatа и споры Chaetoceros furcellatus 9.0 × 105, 3.2 × 105 и 2.4 × 105 кл. м–2 сут–1, соответственно (табл. 1). В биомассе доминировали виды рода Thalassiosira (средний объем клетки ~15 000 мкм3), которые составляли 76.2% (13.5 мгС м–2 сут–1) общей сырой биомассы фитопланктона и 76.0% биомассы водорослей в углероде (0.9 мгС м–2 сут–1, таб. 1. рис. 4). Наибольший вклад вносила T. hyalinа, меньший – T. gravida и T. nordenskioeldii.
Таблица 1.
Численность (N × 103 кл. м–2 cут–1), сырая биомасса (В, мкг м–2 сут–1), биомасса в углероде (ВС, мкг м–2 сут–1)
| Класс, роды, виды | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| месяц | IX | X | XI | XII | I | II | III | IV | V | VI | |
| Bacillario phyceae |
N | 160.7 | 223.7 | 118.9 | 131.9 | 704.9 | 32.4 | 38.8 | 145.0 | 6397.7 | 2262.6 |
| B | 901.1 | 2254.1 | 858.1 | 412.0 | 167.0 | 180.4 | 98.2 | 603.1 | 17 707.1 | 2306.1 | |
| BС | 60.2 | 150.6 | 57.1 | 27.5 | 11.3 | 12.0 | 6.6 | 38.3 | 1170.9 | 153.1 | |
| Centricae | |||||||||||
| Thalassiosira (массовый вид T. eccentricа) | N | 45.6 | 141.1 | 27.0 | 18.2 | 6.0 | |||||
| B | 703.0 | 2176.0 | 486.0 | 350.0 | 84.9 | ||||||
| BС | 46.9 | 145.1 | 32.3 | 23.3 | 5.7 | ||||||
| Thalassiosira (массовый вид T. hyalina) | N | 5.1 | 3.4 | 2.9 | 900.8 | 17.1 | |||||
| B | 81.6 | 55.0 | 46.2 | 13 512.0 | 308.2 | ||||||
| BС | 5.4 | 3.7 | 3.1 | 890.8 | 20.5 | ||||||
| Porosira glacialis | N | 0.13 | 7.35 | 5.0 | 0.3 | ||||||
| B | 11.2 | 460.0 | 427.6 | 22.1 | |||||||
| BС | 0.74 | 28.8 | 28.5 | 1.5 | |||||||
| Рaralia sulcata | N | 3.0 | 1.1 | 1.3 | 0.2 | 3.9 | 315.8 | 0.17 | |||
| B | 18.9 | 6.5 | 8.66 | 1.26 | 24.3 | 2014.6 | 1.3 | ||||
| BС | 1.3 | 0.43 | 0.6 | 0.08 | 1.6 | 134.3 | 0.08 | ||||
| Detonula confervacea | N | 3.5 | 19.8 | 59.3 | |||||||
| B | 1.2 | 13.95 | 41.6 | ||||||||
| BС | 0.08 | 0.95 | 2.77 | ||||||||
| Coscinodiscus spp. | N | 0.22 | 0.21 | 0.06 | |||||||
| B | 282.5 | 49.7 | 159.4 | ||||||||
| BС | 18.8 | 3.3 | 10.0 | ||||||||
| Chaetoceros socialis (споры) | N | 7.9 | 3.9 | 38.3 | 91.3 | 694.0 | 8.4 | 5.2 | 104.0 | 4435.0 | 274.4 |
| B | 0.8 | 0.39 | 2.6 | 8.2 | 69.4 | 0.84 | 0.52 | 10.5 | 443.5 | 27.7 | |
| BС | 0.06 | 0.03 | 0.17 | 0.55 | 4.67 | 0.06 | 0.04 | 0.7 | 29.5 | 1.9 | |
| Chaetoceros furcellatus (споры) | N | 5.2 | 244.4 | 2.0 | |||||||
| B | 10.9 | 491.0 | 4.1 | ||||||||
| BС | 0.73 | 32.7 | 0.3 | ||||||||
| Остальные
идентифицированные
Сentricae: Melosira arctica, M. moniliformis Aulacoseira spp., Rhizosolenia hebetata f. semispina, Thalassiothrix sp., Chaetoceros decipiens, С. debilis |
N | 8.0 | 3.2 | 6.1 | 0.6 | 1.4 | 2.7 | ||||
| B | 70.8 | 0.8 | 35.2 | 3.83 | 8.2 | 15.8 | |||||
| BС | 4.7 | 0.05 | 2.3 | 0.25 | 0.55 | 0.99 | |||||
| Неидентифицированные Centricae |
N | 9.9 | 25.9 | 22.4 | 9.1 | 1.7 | 6.7 | 1.4 | 2.4 | 30.8 | 5.9 |
| B | 12.1 | 32.4 | 30.3 | 11.8 | 2.2 | 8.8 | 1.9 | 3.3 | 46.2 | 4.8 | |
| BС | 0.8 | 2.3 | 2.0 | 0.8 | 0.14 | 0.6 | 0.12 | 0.2 | 3.08 | 0.3 | |
| Все Centricae (суммарно) |
N | 83.1 | 174.1 | 87.9 | 124.7 | 703.4 | 23.1 | 10.3 | 120.5 | 5951.7 | 362.0 |
| B | 817.7 | 2209.6 | 801.4 | 405.2 | 166.8 | 157.8 | 69.9 | 544.3 | 16 948.8 | 585.0 | |
| BС | 54.6 | 147.5 | 53.3 | 27.0 | 11.2 | 10.5 | 4.7 | 34.4 | 1119.8 | 38.3 | |
| Pennatae | |||||||||||
| Nitzschia frigida | N | 0.75 | 0.6 | 9.2 | 15.4 | ||||||
| B | 0.68 | 0.54 | 8.4 | 13.9 | |||||||
| BС | 0.04 | 0.04 | 0.6 | 1.0 | |||||||
| Fragjilaria oceanica | N | 8.4 | 1.46 | 191.3 | 1644.5 | ||||||
| B | 5.46 | 0.95 | 124.3 | 1068.0 | |||||||
| BС | 0.36 | 0.06 | 8.3 | 71.2 | |||||||
| Fragjilaria cylindrus и F. striatula | N | 1.5 | 26.0 | 12.2 | |||||||
| B | 1.0 | 44.1 | 19.6 | ||||||||
| BС | 0.07 | 3.4 | 1.26 | ||||||||
| Pleurosigma normanii | N | 3.0 | 2.0 | 0.8 | 1.58 | 8.0 | 20.3 | ||||
| B | 9.5 | 8.5 | 15.1 | 20.7 | 202.0 | 398.0 | |||||
| BС | 0.64 | 0.57 | 1.0 | 1.38 | 13.45 | 26.5 | |||||
| Gyrosigma macrum и G. tenuirostrum | N | 3.0 | 2.6 | ||||||||
| B | 107.1 | 16.2 | |||||||||
| BС | 7.15 | 1.1 | |||||||||
| Navicula spp. | N | 11.9 | 0.6 | 1.7 | 6.5 | 12.0 | 51.8 | 23.7 | |||
| B | 7.12 | 1.45 | 9.7 | 4.9 | 24.3 | 74.3 | 59.0 | ||||
| BС | 0.48 | 0.17 | 0.63 | 0.32 | 1.6 | 5.06 | 4.0 | ||||
| Navicula vanhoeffenii |
N | 6.5 | 43.0 | ||||||||
| B | 3.9 | 30.1 | |||||||||
| BС | 0.26 | 2.03 | |||||||||
| Thalassionema nitzschioides | N | 0.3 | 0.17 | 3.0 | 11.4 | ||||||
| B | 0.2 | 0.13 | 2.4 | 8.6 | |||||||
| BС | 0.02 | + | 0.16 | 0.57 | |||||||
| Diploneis spp. | N | 3.0 | 1.0 | 7.0 | 3.1 | 3.8 | |||||
| B | 3.9 | 1.2 | 13.4 | 19.1 | 26.4 | ||||||
| BС | 0.26 | 0.08 | 0.9 | 1.27 | 1.72 | ||||||
| Cocconeis spp. | N | 15.8 | 16.4 | 1.3 | |||||||
| B | 32.2 | 33.2 | 2.6 | ||||||||
| BС | 2.14 | 2.2 | 0.17 | ||||||||
| Pseudonitzschia spp. | N | 6.4 | 15.2 | 2.3 | |||||||
| B | 2.1 | 3.7 | 1.84 | ||||||||
| BС | 0.16 | 0.25 | 0.12 | ||||||||
| Идентифицированные Pennatae: Pauliella taeniata, Synedropsis hyperborea Amphora spp. Licmophora sp Hantschia spp. Eunotia spp. Caloneis spp. Phaeodactylum tricornutum |
N | 7.5 | 2.4 | 3.3 | 6.3 | 10.4 | |||||
| B | 7.1 | 2.75 | 3.7 | 7.1 | 11.0 | ||||||
| BС | 0.47 | 0.18 | 0.27 | 0.4 | 0.76 | ||||||
| Неидентифицированные Pennatae | N | 19.8 | 42.0 | 31.0 | 6.4 | 0.9 | 7.6 | 2.7 | 3.9 | 119.1 | 108.0 |
| B | 14.8 | 29.5 | 21.8 | 7.7 | 0.6 | 12.9 | 0.9 | 0.4 | 130.6 | 65.2 | |
| BС | 1.0 | 2.0 | 1.6 | 0.5 | 0.04 | 0.86 | 0.06 | 0.03 | 8.7 | 4.2 | |
| Bce Pennatae (суммарно) |
N | 77.6 | 49.6 | 31.0 | 7.2 | 1.5 | 9.3 | 28.5 | 24.5 | 446.0 | 1900.6 |
| B | 83.4 | 44.5 | 21.8 | 8.4 | 1.14 | 22.6 | 28.3 | 58.8 | 758.3 | 1721.1 | |
| BС | 5.6 | 3.1 | 1.6 | 0.54 | 0.08 | 1.49 | 1.9 | 3.9 | 51.1 | 114.5 | |
| Все Dinophyceae |
N | 37.6 | 7.8 | 4.8 | 18.4 | 9.4 | 16.6 | 59.5 | 5.6 | ||
| B | 32.3 | 14.6 | 37.4 | 11.9 | 4.7 | 9.0 | 29.7 | 2.5 | |||
| BС | 3.3 | 1.06 | 3.64 | 0.8 | 0.58 | 0.6 | 1.43 | 0.15 | |||
| Dinophyceae споры | N | 37.6 | 7.8 | 4.5 | 18.2 | 9.4 | 16.6 | 58.7 | 5.6 | ||
| B | 32.3 | 14.6 | 3.6 | 11.3 | 4.7 | 9.0 | 29.35 | 2.5 | |||
| BС | 3.3 | 1.06 | 0.24 | 0.74 | 0.58 | 0.6 | 1.4 | 0.15 | |||
| Cеratium arcticum | N | 0.26 | |||||||||
| B | 33.8 | ||||||||||
| BС | 3.4 | ||||||||||
| Gonyaulax scrippsae (cпоры) | N | 0.15 | |||||||||
| B | 0.61 | ||||||||||
| BС | 0.06 | ||||||||||
| Actiniscus pentasterias | N | 0.76 | |||||||||
| B | 0.38 | ||||||||||
| BС | 0.03 | ||||||||||
| Dictyochophyceae | |||||||||||
| Dictyocha speculum | N | 0.22 | |||||||||
| B | 0.88 | ||||||||||
| BС | 0.09 | ||||||||||
| Весь фитопланктон | N | 198.3 | 231.5 | 123.7 | 150.3 | 704.9 | 32.4 | 48.2 | 161.6 | 6457.2 | 2268.4 |
| B | 933.4 | 2268.7 | 860.6 | 425.5 | 168.0 | 180.4 | 102.9 | 612.1 | 17 736.5 | 2308.6 | |
| BС | 63.5 | 151.7 | 58.5 | 28.3 | 11.3 | 12.0 | 7.2 | 38.9 | 1172.3 | 153.0 | |
| Стрекательные клетки кишечнополостных (все) | N | 53.7 | 111.0 | 60.1 | 172.8 | 10.6 | 40.2 | 9.5 | 2.0 | 111.1 | |
| B | 97.9 | 198.4 | 109.3 | 198.3 | 15.0 | 40.1 | 9.0 | 1.3 | 161.9 | ||
| BС | 10.9 | 21.9 | 12.1 | 21.9 | 1.7 | 4.4 | 1.1 | 0.5 | 17.9 | ||
| Тип 1 | N | 18.3 | 36.5 | 20.0 | 12.5 | 2.2 | 1.5 | 0.8 | 19.8 | ||
| B | 73.2 | 146.0 | 80.0 | 50.0 | 8.8 | 6.0 | 3.2 | 79.2 | |||
| BС | 8.1 | 16.2 | 8.8 | 5.5 | 1.0 | 0.7 | 0.4 | 8.8 | |||
| Тип 2 | N | 20.2 | 43.6 | 25.0 | 150.0 | 5.3 | 33.7 | 4.5 | 0.9 | 83.1 | |
| B | 19.4 | 41.8 | 24.0 | 144.7 | 5.1 | 32.4 | 4.3 | 0.9 | 79.8 | ||
| BС | 2.2 | 4.6 | 2.7 | 16.0 | 0.6 | 3.5 | 0.5 | 0.1 | 8.8 | ||
| Тип 3 | N | 15.2 | 30.9 | 15.1 | 10.3 | 3.1 | 5.0 | 4.2 | 1.1 | 8.2 | |
| B | 5.3 | 10.6 | 5.3 | 3.6 | 1.1 | 1.7 | 1.5 | 0.4 | 2.9 | ||
| BС | 0.6 | 1.1 | 0.6 | 0.4 | 0.1 | 0.2 | 0.2 | 0.4 | 0.3 | ||
Рис. 2.
Помесячные изменения численности фитопланктона (а), стрекательных клеток кишечнополостных (б) и раковинных инфузорий тинтиннид (в) в седиментационном потоке; кл. м–2 сут–1.
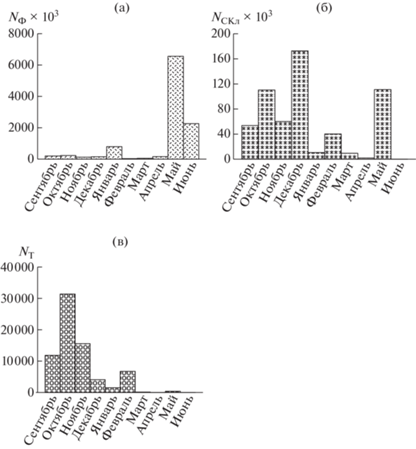
Рис. 3.
Помесячные изменения группового состава фитопланктона в пробах седиментационной ловушки, % об общей численности. 1 – Centricae, 2 – Pennatae, 3 – Dinoflagellatae.
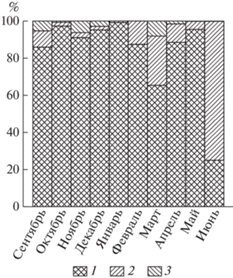
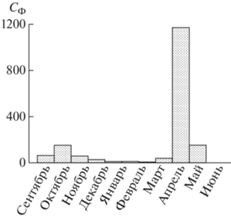
Рис. 4.
Помесячные изменения вертикального потока органического углерода, заключенного в оседающих клетках фитопланктона.
В июньской пробе осадочного вещества видовой состав водорослей был совершенно иным. Основу численности и биомассы фитопланктона формировали пеннатные диатомеи, составлявшие 83.8% общей численности и 74.6% общей биомассы (табл. 1, рис. 3). Доминировал Fragilariорsis oceanica, численность которого по сравнению с майской пробой увеличилась почти на порядок и составляла 1.6 × 106 кл. м–2 сут–1 (72.5% общей численности и 42.3% общей биомассы фитопланктона). Одновременно, более чем на два порядка, сократилась численность видов рода Thalassiosira, вклад этой группы в биомассу фитопланктона не превышал 13.3%. Трехкратное сокращение общей численности фитопланктона, изменение видового состава и господство мелкоклеточных видов диатомей (средний объем F. oceanica ~700 мкм3) определили восьмикратное сокращение биомассы фитопланктона в осадочном материале.
Относительно высокая биомасса водорослей в осадочном веществе (860–2255 мкг м–2 сут–1, 58.5–151.7 мкг м–2 сут–1) наблюдалась в осенний период с сентября по ноябрь (табл. 1, рис. 4). Основу биомассы составляла Thalassiosira eccentrica. Меньший вклад давали T. tenera, T. gravida, T. pacifica (табл. 1).
Во второй половине января–первой декаде февраля наблюдалось существенное увеличение числа спор Chaetoceros socialis, (до 6.9 × × 105 кл. м–2 сут–1), что не вызвало заметного увеличения биомассы фитопланктона (табл. 1).
Самая низкая биомасса водорослей в осадочном веществе (98–180 мкг м–2 сут–1) зарегистрирована в пробах, собранных с января по март (табл. 1).
В осенних (сентябрь–декабрь) и в майской пробах было встречено большое количество стрекательных клеток кишечнополостных (табл. 1, рис. 2б). Обнаружено три типа стрекательных клеток (рис. 5), различающихся по строению и размерам, все они принадлежали сифонофорам [15, 18, 20]. Наиболее многочисленными были нематоцисты второго типа (рис. 5б) со средним объемом клеток 950–1000 мкм3. Их максимальная численность в декабрьской пробе достигала 1.5 × × 105 кл. м–2 сут–1 (табл. 1). Второй пик численности стрекательных клеток того же типа (8.3 × × 104 кл. м–2 сут–1) наблюдался в майской пробе. Численность более крупных стрекательных клеток (тип 1, средний объем клетки ~4000 мкм3, табл. 1, рис. 5в) достигала максимума 3.6 × × 104 кл. м–2 сут–1 в октябрьской пробе; увеличение численности этой группы до 2.0 × 104 кл. м–2 сут–1 отмечено также в мае. Количество нематоцист третьего типа со средним объемом клеток ~350 мкм3 (рис. 5а) в осадочном материале демонстрировало аналогичную динамику с максимумом 3.1 × × 104 кл. м–2 сут–1 в октябре (табл. 1).
Рис. 5.
Три типа стрекательных клеток сифонофор. (а) – мелкоразмерные, длина ~16 мкм, ширина ~7 мкм; (б) – среднеразмерные длина 25–30 мкм, ширина 5–8 мкм; (в) – крупные, длина 40–45 мкм, ширина 16–18 мкм.
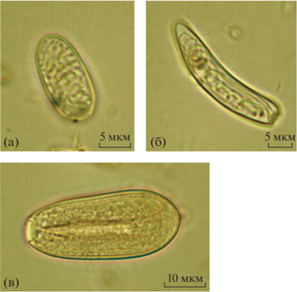
Во всех ловушечных пробах были встречены тинтинниды. Максимальная численность раковинных инфузорий наблюдалась в осенних пробах с сентября по ноябрь, с максимумом 3.1 × × 104 кл. м–2 сут–1 (табл. 2, рис. 2в). Из семи встретившихся видов наиболее многочисленным был Аcanthostomella norvegica; часто встречались Ptychocylis obtusa и Parafavella denticulata.
Таблица 2.
Численность (N, кл. м–2 сут–1), сырая биомасса (В, мкг м–2 сут–1) и биомасса в углероде (ВС, мкг м–2 сут–1) раковинных инфузорий (тинтиннид) в пробах седиментационной ловуки
| Вид/месяцы | IX | X | XI | XII | I | II | III | IV | V | VI | |
|---|---|---|---|---|---|---|---|---|---|---|---|
| Acanthostomella norvegica | N | 6918 | 22 160 | 15 563 | 3782 | 1361 | 6120 | 68 | 78 | ||
| B | 93.1 | 299.2 | 210.1 | 51.0 | 18.4 | 82.6 | 0.9 | 1.1 | |||
| BС | 6.7 | 21.4 | 15.0 | 3.7 | 1.3 | 5.9 | 0.07 | 0.08 | |||
| Parafavella denticulata |
N | 1482 | 916 | 151 | 151 | ||||||
| B | 92.5 | 57.3 | 9.7 | 9.7 | |||||||
| BС | 7.7 | 4.8 | 0.9 | 0.9 | |||||||
| Parafavella obtusa |
N | 1482 | |||||||||
| B | 160.0 | ||||||||||
| BС | 13.3 | ||||||||||
| Ptychocylis obtusa |
N | 1977 | 8310 | 151 | 153 | ||||||
| B | 148.3 | 623.2 | 11.3 | 11.5 | |||||||
| BС | 12.3 | 51.9 | 0.9 | 1.0 | |||||||
| Salpingella acuminata |
N | 610 | |||||||||
| B | 15.3 | ||||||||||
| BС | 1.3 | ||||||||||
| Tintinnopsis parvula | N | 78 | |||||||||
| B | 1.0 | ||||||||||
| BС | 0.08 | ||||||||||
| Tintinnopsis fibriata | N | 68 | 78 | ||||||||
| B | 9.5 | 10.9 | |||||||||
| BС | 0.9 | 1.0 | |||||||||
| Tintinnida (суммарно) |
N | 11 859 | 31 386 | 15 563 | 4084 | 1512 | 6730 | 136 | 387 | ||
| B | 494.2 | 979.7 | 210.1 | 72.0 | 28.1 | 97.9 | 10.4 | 24.5 | |||
| BС | 40.2 | 78.1 | 15.0 | 5.5 | 2.2 | 7.2 | 1.0 | 2.2 |
ОБСУЖДЕНИЕ
В Карском море до настоящего времени не проводилось исследований, оценивающих вертикальные потоки водорослей, на основе годичных сборов седиментационными ловушками. В ряде работ приводятся данные, полученные при короткой экспозиции ловушек в течение от 2 до 26 суток и проведенных только в поздне-летний (август) и ранне-осенний (сентябрь) сезоны [5]. Имеются данные годовых сборов седиментационных ловушек, полученные на шести станциях в северной части моря Лаптевых и в Северном Ледовитом океане [19]. Было показано, что весеннее массовое развитие водорослей (июнь) начинается с ледовой флоры, и толчком к этому служит освобождение поверхности сезонного льда от снежного покрова и улучшение подледных световых условий. В этих исследованиях основными видами весеннего сезона были Nitzschia frigida и Melosira arctica, ассоциированные со льдом. Следующий этап сезонной сукцессии, включающий развитие пелагических видов Chaetoceros spp. и Thalassiosira spp., начинался в июле. В работе [4], основанной на данных годовой седиментационной ловушки на буйковой станции LOMO-2 (81°04′ c.ш., 138°55′ в.д.) в море Лаптевых, в составе водорослей перечислены почти исключительно виды приледового цветения. Из представителей истинно пелагической флоры авторы отмечают присутствие в незначительном количестве несколько видов Chaetoceros. Максимальная численность водорослей в этих наблюдениях была отмечена в июле и августе (14.4–15.8 × 106 кл. м–2 сут–1).
Полученный нами материал, охватил период с сентября 2018 г. до середины июля 2019 г. Два не представленных в эксперименте летних безледных месяца по нашим и литературным данным [10, 11, 13, 14] характеризуются активной вегетацией водорослей и высокими показателями численности и биомассы фитопланктона. Отсутствие данных для этого периода не дает возможности полностью реконструировать годовой цикл вклада фитопланктона в вертикальный поток взвешенного органического вещества. Однако полученные материалы позволяют сделать помесячные расчеты величин вертикального потока органического углерода, связанного с осаждением фитопланктона и восполнить часть пробелов в понимании годового цикла фитоценоза в Карском море.
Анализ ловушечных проб показал, что максимальные численность и биомасса фитопланктона в осадочном веществе наблюдались в мае (рис. 2, табл. 1). На этот же месяц приходился и максимальный вклад водорослей в вертикальный поток ВОУ, который составляет 28.5% (рис. 4). В пробах в этот период доминировали центрические диатомеи. В численности главным компонентом были споры Chaetoceros socialis, в биомассе – крупноклеточные Thalassiosira hyalinа, T. gravida, T. tenera и T. nordenskioeldii (табл. 1). Для массового развития перечисленных видов требуется высокое содержание биогенных элементов в эвфотическом слое, которое в Карском море в сочетании с открытой водой наблюдается только в короткий период разрушения сезонного ледяного покрова. Мы полагаем, что высокие численность и биомасса фитопланктона в ловушечных пробах в мае были связаны с формированием в районе наблюдений полыньи, открывшейся в конце февраля и просуществовавшей, по крайней мере, до начала мая (рис. 6). Благоприятные световые условия в полынье в весеннее время не только на поверхности, но на глубинах пикногалоклина (~18 м), где концентрации нитратов и фосфатов в Карском море, как правило, возрастают в разы по сравнению с поверхностным слоем, что стимулирует интенсивный рост фитопланктона. В нашем эксперименте это определяло высокую численность, биомассу и доминирование видов весеннего комплекса диатомей родов Chaetoceros и Thalassiosira в пробах осадочного вещества.
Рис. 6.
Ледяной покров Карского моря 10 апреля (а) и 10 мая (б) 2019 г. (данные SIOWS: Arctic portal – Oceanographic investigations of the Arctic ocean (rshu.ru)); $ \oplus $ – место постановки седиментационной ловушки.
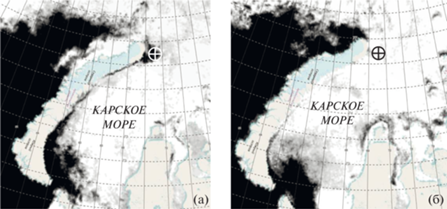
Доминирование в июньской пробе приледовых видов пеннатных диатомовых водорослей Fragilariopsis oceanica, Nitzschia frigida, Navicula vanhoeffenii и др., было связано с периодом масштабного таяния сезонного льда, сформировавшегося на месте полыньи в мае (рис. 6). Сход сезонного льда в Карском море в 2019 г. по данным спутниковых микроволновых радиометров АМSR-E и АМSR2 (SIOWS: Arctic portal (rshu.ru)) прошелся на конец июня. Массовым видом оседающих водорослей в это время был Fragilariopsis oceanica, который известен как компонент приледного “цветения”. Изменения видовой структуры фитопланктона в июньской ловушечной пробе по сравнению с майской, значимые различия в размерах клеток доминирующих видов определили существенную разницу в биомассе (почти в 8 раз) и в численности (в 3 раза) фитопланктона (табл. 1). На этом фоне вклад фитопланктона в ВОУ снизился с 28.5% в мае до 1.7% июне. Во все остальные месяцы, охваченные экспериментом, эта величина не превышала 3.0%, в сентябре и с февраля по май она составляла десятые доли процента.
Вклад углерода, заключенного в клетках тинтиннид, в вертикальный поток был максимальным в осенне-зимний период (табл. 2). Его доля во взвешенном органическом углероде составляла от 0.3 до 1.0% и была соизмерима с вкладом фитопланктона. В весенние месяцы при активной вегетации фитопланктона вклад этой группы не превышал 0.05%.
В майской пробе были встречены клетки пресноводной диатомеи Аulacoseira ambigua. На нахождение пресноводных планктонных водорослей в пробах ловушек, установленных в желобе Святой Анны (79°23.44′ c.ш., 69°58.38′ в.д.) указывает В. Шевченко с соавторами [12], связывая это с возможным их включением в лед, формирующийся в условиях сильного влияния речного стока, и дальнейшим переносом этого льда в район исследования. В работе [1] в весеннем фитопланктоне в северной части Восточно-Баренцевоморской впадины (77°59.94′ c.ш. 61°06.86′ в.д.) были обнаружены три пресноводных вида: Аulacoseira ambigua, A. subarctica и Stephanodiscus rotula. Мы не исключаем возможности проникновения Аulacoseira ambigua в район наших работ с плюмом опресненной речным стоком воды в период интенсивного весеннего половодья.
Полученные нами результаты и приведенные литературные данные дают основание считать, что наблюдаемая нами инверсия в ходе сезонной сукцессии фитоцена, вероятнее всего, была связана с образованием полыньи на внешнем шельфе Карского моря. Достаточное количество света на глубине галоклина в весеннее время и доступность биогенных элементов в эвфотическом слое после осенне-зимней конвекции, формировали благоприятные условия для развития крупноклеточных пелагических видов фитопланктона.
Благодарности. Авторы признательны Ф.В. Сапожникову за фотографии стрекательных клеток сифонофор и анонимному рецензенту за замечания к рукописи.
Источники финансирования. Работа выполнена в рамках государственных заданий № FMWE-2021-0007 (обработка полевого материала) и FMWE-2022-0003 (подготовка статьи); экспедиционные исследования проведены при целевой финансовой поддержке Министерства науки и высшего образования РФ.
Список литературы
Агафонова Е.А., Новигатский А.Н., Кравчишина М.Д., Клювиткин А.А. Состав сообществ диатомовых водорослей в осадочном веществе восточной части Баренцева моря // Материалы ХХIV международной научной конференции (школы) по морской геологии. 2021. Т. 2.
Богоров В.Г. Биологические сезоны полярного моря // Докл. АН СССР. 1938. Т. 19. № 8. С. 639–642.
Дриц А.В., Кравчишина М. Д., Суханова И.Н. и др. Сезонная изменчивость потока осадочного вещества на шельфе северной части Карского моря // Морская биология. 2021. Т.
Зернова В.В., Нютик Е.М., Шевченко В.П. Вертикальные потоки микроводорослей в северной части моря Лаптевых (по данным годичной постановки седиментационной ловушки) // Океанология. 2000. Т.40. № 6. С. 850–858.
Лисицын А.П., Шевченко В.П., Виноградов М.Е. и др. Потоки осадочного вещества в Карском море и в эстуариях Оби и Енисея // Океанология. 1994. Т. 34. № 5. С. 748–759.
Макаревич П.Р. Планктонные альгоценозы эстуарных экосистем. М.: Наука, 2007. 223 с.
Макаревич П.Р., Ларионов В.В., Дружков Н.В., Дружкова Е.И. Роль обского фитопланктона в формировании продуктивности Обь – Енисейского мелководья // Экология. 2003. № 2. С. 96–100.
Суханова И.Н., Флинт М.В., Мошаров С.А., Сергеева В.М. Структура сообществ фитопланктона и первичная продукция в Обском эстуарии и на прилежащем Карском шельфе // Океанология. 2010. Т. 50. № 5. С. 785–800.
Суханова И.Н., Флинт М.В., Сергеева В.М. и др. Структура сообществ фитопланктона Енисейского эстуария и прилежащего Карского шельфа // Океанология. 2015. Т. 55. № 6. С. 935–950.
Суханова И.Н., Флинт М.В., Сахарова Е.Г. и др. Фитоценозы Обского эстуария и Карского шельфа в поздневесенний сезон // Океанология. 2018. Т. 58. № 6. С. 882–898.
Суханова И.Н., Флинт М.В., Сахарова Е.Г. и др. Структура фитоценозов Енисейского эстуария и прилежащего Карского шельфа в поздневесенний период // Океанология. 2020. Т. 60. № 6. С. 858–875.
Шевченко В.П., Иванов Г.И., Буровкин А.А. и др. Потоки осадочного вещества в желобе Святой Анны и в восточной части Баренцева моря // Докл. АН. 1998. Т. 359. № 3. С. 401–404.
Ширшов П.П. Сезонные явления в жизни фитопланктона полярных морей в связи с ледовым режимом // Тр. Арктического ин-та. 1937. Т. 82. С. 47–111.
Ширшов П.П. Планктон арктических вод // Избранные труды. М.: Наука. 1982. 256 с.
Bentlage B. Description of the chirodropid box jellyfish Chiropsella rudloei sp. nov. (Cnidaria: Cubozoa) from Madagascar // Marine Biodiversity Records. 2013. V. 6. P. 1–7.
Druzhkov N.V., Makarevich P.R. Comparison of the Phytoplankton Assemblages of the South–Eastern Barents Sea and South-Western Kara Sea: Phytogeographical Status of the Regions // Botanica Marina. 1999. V. 42. P. 103–115.
Gaye-Haake B., Unger D., Nothig E.-M. et al. Particle fluxes from short-term sediment trap deployments in late summer in the southern Kara // Siberian River Run-off in the Kara Sea: Characterization, Quantification, Variability and Environmental Significance. Eds. Stein R. Amsterdam: Elsevier. 2003. P. 309–328.
Kass-Simon G., Scappaticci A.A. The behavioral and developmental physiology of nematocysts // Can. J. Zool. 2002. V.80. P. 1772–1794.
Lalande C., Nothig E., Fortier L. Algal Export in the Arctic Ocean in Times of Global Warming // Geophysical Research Letters. https://doi.org/10.1029/2019GL083167
Mapstone G.M. Global Diversity and Review of Siphonophorae (Cnidaria: Hydrozoa) // PLOS ONE. 2014. V. 9. № 2. E87737.
Menden-Deuer S., Lessard E.J. Carbon to volume relationships for dinoflagellates, diatoms, and other protest plankton // Limnol. Oceanogr. 2000. V. 45. P. 569–579.
Дополнительные материалы отсутствуют.