Онтогенез, 2019, T. 50, № 4, стр. 253-269
Структурно-функциональные особенности клеток антиподального комплекса зародышевого мешка пшеницы на стадии дифференцировки
Т. В. Доронина a, *, И. А. Чабан b, Е. М. Лазарева a, b
a Московский государственный университет им. М.В. Ломоносова, биологический факультет
119992 Москва, Ленинские горы, Россия
b Всероссийский научно-исследовательский институт сельскохозяйственной биотехнологии РАСХН
127550 Москва, ул. Тимирязевская, 42, Россия
* E-mail: matveevatatiana.94@yandex.ru
Поступила в редакцию 11.01.2019
После доработки 20.03.2019
Принята к публикации 29.03.2019
Аннотация
Проведено детальное изучение особенностей структуры клеток многоуровневого антиподального комплекса зародышевого мешка пшеницы Triticum aestivum L. на различных стадиях дифференцировки комплекса после двойного оплодотворения. Выявлена гетерогенность ядер клеток индивидуальных антиподальных комплексов по плоидности, возникающая в результате асинхронности раундов эндоредупликации ДНК. Определена плоидность ядер базального, среднего и апикального ярусов комплексов на ранней, средней и поздней стадиях дифференцировки. На ранней стадии дифференцировки, плоидность ядер базального яруса антиподального комплекса, примыкающего к халазальной области нуцеллуса зародышевого мешка, достигает 13 С, ядер клеток апикального яруса комплекса, контактирующих с синцитием эндосперма, 63 С, а ядер среднего яруса, расположенных между базальным и апикальным ярусами, 30 С. На средней стадии дифференцировки, плоидность ядер базального яруса возрастает до 17 C, ядер клеток апикального яруса – до 95 С, а ядер среднего яруса – до 45 С. На стадии поздней дифференцировки, плоидность ядер базального яруса увеличивается до 24 С, апикального яруса – до 215 С, среднего яруса – до 63 С. Выявлена гетерогенность формы, размеров и структуры хроматина, обособление индивидуальных политенных хромосом, формирование инвагинаций ядерной оболочки и варьирование числа ядрышек в ходе дифференцировки антиподального комплекса. Принципиально новыми являются данные о распределении и структуре органелл цитоплазмы антиподальных клеток – эндоплазматического ретикулума, диктиосом, митохондрий и микротрубочек на разных этапах дифференцировки антиподальных комплексов. Выявлено увеличение количества органелл цитоплазмы. В ходе дифференцировки протяженные цистерны гранулярного ретикулума сменяются концентрическими кольцами, появляются митохондрии и пластиды протяженной и чашевидной формы, перестраивается сеть микротрубочек. Особенности структуры клеток антиподального комплекса могут отражать изменение функций клеток комплекса в течение дифференцировки. На ранней стадии все клетки комплекса выполняют осморегулирующую функцию, на средней стадии дифференцировки происходит специализация клеток разных ярусов комплекса. Уровень плоидности ядер клеток с политенными хромосомами отражает их функциональную значимость в формировании эндосперма на нуклеарной стадии развития, и, впоследствии, полноценного зерна.
ВВЕДЕНИЕ
Во многих тканях животных и растений образуются полиплоидные клетки и только в редких случаях в ядрах формируются политенные хромосомы для обеспечения высокой синтетической активности клеток, выполняющих специализированные функции. Подробно изучена структура политенных хромосом клеток двукрылых. У таких политенных хромосом выявляется соматическая конъюгация между гомологичными хромосомами и находящимися в одном функциональном состоянии гомологичными участками хроматид (Жимулев, 1994; Zhimulev, 1996).
Полиплоидные ядра с гигантскими политенными хромосомами другого типа наблюдали в децидуальных клетках и клетках трофобласта млекопитающих, расположенных между плацентой плода и материнским организмом (Зыбина, 1986), и в антиподальных клетках женского гаметофита злаков, расположенных в непосредственной близости к проводящей системе семяпочки и занимающих пограничное положение между формирующимся в результате двойного оплодотворения эндоспермом и областью плаценто-халазы (Поддубная-Арнольди, 1976; Батыгина, 1994). Сходство структуры гигантских хромосом клеток растений и животных предполагает схожесть их функций. Эти клетки принадлежат тканям, выполняющим трофическую и барьерную функции между материнским организмом и тканями, сформированными после оплодотворения. Общей для клеток с такими политенными хромосомами является также секреторная функция (Зыбина, 1986; Чабан и др., 2011).
Клетки антиподального комплекса зародышевого мешка злаков характеризуются длительным периодом функционирования (относительно периода развития семени) по сравнению с другими видами растений (Поддубная-Арнольди, 1976). Кроме того, именно у злаков в ядрах антиподальных клеток формируются гигантские политенные хромосомы. Поэтому антиподальные клетки зародышевого мешка злаков являются уникальным объектом для решения фундаментальных задач клеточной биологии и удобной моделью для изучения структуры ядер и стадий реформирования политенных хромосом в ходе онтогенеза.
Ранее в работе Чабан с соавторами были подробно описаны этапы формирования антиподального комплекса до оплодотворения и впервые показано, что в ходе пролиферации три инициальные клетки этого комплекса претерпевают неодинаковое количество асинхронных делений. На ранних стадиях пролиферации антиподального комплекса митозы встречаются в базальных и апикальных клетках, тогда как на более поздних стадиях делятся клетки только апикальной зоны. Сформированный комплекс состоит из трех ярусов клеток – базального яруса, примыкающего к халазальной зоне нуцеллуса, апикального яруса, граничащего с центральной клеткой, а впоследствии с эндоспермом, и среднего яруса, расположенного между базальным и апикальным ярусами. В этот период развития антиподальные ядра не отличаются по размерам и содержанию ДНК от ядер, примыкающих к ним клеток нуцеллуса. После завершения пролиферации до двойного оплодотворения инициируется процесс эндополиплоидизации геномов антиподальных клеток, который сопровождается тотальной перестройкой хроматина, в результате в ядрах формируются гигантские хромосомы (Чабан и др., 2011).
Важнейший этапом развития женского гаметофита культурных злаков является формирование в нем ткани эндосперма, нормальное развитие которого обуславливает полноценное формирование зерна этих растений. Ключевую роль в этом процессе играют клетки антиподального комплекса зародышевого мешка. Показано, что при нарушениях развития комплексов антиподальных клеток ячменно-ржаных и пшенично-ржаных амфидиплоидов зерно не формируется или формируется невыполненное зерно (Brink, Cooper, 1944; Ригин, Орлова, 1974). Описанная ранее секреция компонентов ядра и ядрышка в цитоплазму антиподальных клеток и, позднее, в эндосперм, позволяет предположить, что одной из основных функций антиподальных клеток является синтез веществ, необходимых для формирующегося эндосперма на нуклеарной стадии (Чабан и др., 2011). Уникальные структурные особенности антиподальных клеток обусловлены их функциями на различных этапах дифференцировки комплекса, когда происходят все ключевые процессы в их ядрах и цитоплазме.
Изучение тонкой структуры хроматина ядер и органелл цитоплазмы антиподальных клеток в ходе дифференцировки комплекса имеет фундаментальное значение для понимания процессов соматической полиплоидии клеток растений.
Существующие на данный момент исследования, посвященные антиподальным клеткам зародышевого мешка злаков (Kuwada, 1910; Terada, 1928; Morrison, 1954; Hoshikawa, 1960; Diboll, Larson, 1966; Diboll, 1968; Kaltsikes, 1973; Kaltsikes et al., 1975; Петрова и др., 1985; You, Jensen, 1985; Engell, 1994; Maeda, Miyake, 1996, 1997; Лазарева, Ченцов, 2004; An, You, 2004; Чабан, 2008; Чабан и др., 2011; Chetoor, Evans, 2015) фрагментарны, и не дают четкого представления о структуре этих клеток на разных этапах их дифференцировки.
Целью данной работы является изучение структурно-функциональных особенностей клеток антиподального комплекса на стадии дифференцировки после двойного оплодотворения зародышевого мешка пшеницы.
МАТЕРИАЛЫ И МЕТОДЫ
Объектом исследования являлись клетки антиподального комплекса (n = 21) зародышевого мешка гексаплоидной пшеницы (Triticum aestivum L.) сорта Московская 39 (2n = 42). Семязачатки на разных стадиях развития извлекали из колосьев пшеницы.
Для проведения иммуноцитохимического окрашивания семязачатки фиксировали в течение двух часов в 4% параформальдегиде (Sigma, США) на PBS (pH = 7.2). Для выявления ДНК и аргентофильных белков ядрышка семязачатки фиксировали в смеси этанола и ледяной уксусной кислоты в соотношении 3 : 1. Для изучения ультраструктуры клеток семязачатки фиксировали в 2.5% растворе глутарового альдегида на 0.1 М фосфатном буфере Зоренсена (pH = 7.3) с добавлением сахарозы (0.015 г/мл).
После фиксации зародышевые мешки, содержащие эндосперм, зародыш и антиподальные клетки выделяли из тканей семяпочки при помощи препаровальных игл под бинокулярной лупой по методу Петровой (Петрова, 1970). Общий вид семязачатков и выделенных зародышевых мешков представлен на рис. 1а, 1б.
Рис. 1.
Общий вид семяпочек, зародышевого мешка и комплексов антиподальных клеток пшеницы Triticum aestivum L. на стадии дифференцировки. а – выделенные из колоса индивидуальные семяпочки, масштабная линейка 3 мм; б – зародышевый мешок с антиподальным комплексом на стадии ранней дифференцировки, масштабная линейка 250 мкм; ак – антиподальный комплекс; в, г – комплексы антиподальных клеток на стадии ранней (в) и поздней (г) дифференцировки, * – цитоплазматические вакуоли антиподальных клеток, масштабная линейка 70 мкм; ак – антиподальный комплекс.

Морфологию ядер антиподальных клеток изучали после окрашивания гематоксилином Каррачи (Merck, Германия), окрашивание ДНК проводили по методу Фёльгена реактивом Шиффа (Sigma, США) и флуорохромом DAPI (4,6-diamidino-2-phenylindole) (Sigma, США). Для выявления РНП-продуктов в ядрах антипод, проводили регрессивное контрастирование РНК по методу Бернара (Monneron, Bernhard, 1969). Аргентофильные белки ядрышка выявляли после Ag-Nor окрашивания (Лазарева, Ченцов, 2004).
Для изучения морфологии и оценки содержания ДНК ядра клеток окрашивали флуорохромом DAPI (4,6-diamidino-2-phenylindole) содержащимся в заключительной среде Vectashield with DAPI (Vector Laboratories, США). Количество ДНК ядер антиподальных клеток оценивали на снимках ядер комплексов (объектив PlanApo×20) (рис. 2а, 2б, 2в) в программе ImageJ. После вычитания фона (“Tresholding”), программой были идентифицированы индивидуальные ядра антиподального комплекса (“Analyse particles”) и определены показатели интенсивности свечения в расчете на площадь каждого ядра (“Integrated Optical Density”). В качестве репера на тех же снимках измеряли значения интенсивности свечения ядер триплоидных клеток эндосперма.
Рис. 2.
Полиплоидные ядра клеток антиподальных комплексов зародышевых мешков пшеницы на разных стадиях дифференцировки и триплоидные ядра эндосперма. а – ранняя; б – средняя; в – поздняя стадии дифференцировки, ант – антиподальные клетки, э – эндосперм. Масштабная линейка – 50 мкм.

Рис. 3.
Основные структурные домены ядер антиподальных клеток на стадии дифференцировки комплекса. а – хромосомы (реактив Шиффа, метод Фельгена); б – хромосомы и ядрышки ядра (гематоксилин Каррачи); в – ядрышки и мини-ядрышки (Ag-NOR окрашивание); г – ядрышки и мини-ядрышки (антитела против фибрилларина, клон 38F3), хромосомы (DAPI); д, е – ядра антиподальных комплексов на ранней и средней стадии дифференцировки. як – ядрышко, хс – хромосомы, * – конденсированные области политенных хромосом, стрелки – мини-ядрышки. Масштабная линейка – 30 мкм.

Для непрямого иммуноцитохимического выявления фибрилларина ядрышек использовали мышиные моноклональные антитела (1 : 50) к фибрилларину клон 38F3 (Abcam, США) и овечьи антитела против Ig мыши, конъюгированные с флуорохромом Alexa 488 (Sigma, США) в разведении 1 : 400.
Таблица 1.
Содержание ДНК в ядрах клеток ярусов антиподального комплекса на разных стадиях дифференцировки
| Стадии дифференцировки | Ярусы комплекса | ||
|---|---|---|---|
| базальный | средний | апикальный | |
| Ранняя | 5–13 С | 9–30 С | 19–63 С |
| Средняя | 5–17 С | 11–45 С | 32–95 С |
| Поздняя | 6–24 С | 15–63 С | 38–215 С |
Для непрямого иммуноцитохимического выявления микротрубочек использовали мышиные моноклональные антитела против α-тубулина клон DM1α (Sigma, США) (в разведении 1 : 100) и козлиные антитела против Ig мыши, конъюгированные с флуорохромом Alexa 488 (Sigma, США) (в разведении 1 : 1000).
Для непрямого иммуноцитохимического выявления ЭПР, аппарата Гольджи и митохондрий в качестве первых антител использовали мышиные моноклональные антитела (в разведении 2 : 100) против KDEL (Abcam, Великобритания), мышиные моноклональные антитела (в разведении 2 : : 100) против 58K белка аппарата Гольджи (Sigma Aldrich, США), кроличьи поликлональные антитела (в разведении 1 : 100) против цитохрома с (Agrisera, Швеция). В качестве вторых антител использовали ослиные антитела против Ig мыши, конъюгированные с флуорохромом Alexa 488 (Sigma, США) в разведении 1 : 1000 и ослиные антитела против Ig кролика, конъюгированные с флуорохромом Alexa 488 (Abcam, Великобритания).
Окрашенные препараты заключали в Mowiol (Hoechst, Германия). Препараты изучали с помощью светового микроскопа Leica (с объективами N Plan ×40 и ×100/1.25, oil), оснащeнного цифровой камерой DFC 295 и программным обеспечением Leica Аpplication Suite Version 3.4.0; инвертированного флуоресцентного микроскопа Axiovert 200M (“Carl Zeiss Inc.”) (с объективами PlanApo ×20 и ×63/1.4, oil), оснащенного черно-белой цифровой камерой Carl Zeiss AxioCam и программным обеспечением AxioVision 3.1.
Трехмерная реконструкция локализации гранулярного ретикулума и диктиосом аппарата Гольджи антиподальных клеток проводилась с использованием изображений, полученных с помощью конфокального микроскопа Nicon Yokogawa со стандартным набором фильтров и объективами PlanApo ×20, ×60 и ×100 (шаг сканирования – 0.5 мкм, 25 изображений в Z-стэке).
Для изучения ультраструктуры антиподальных клеток фиксированные зародышевые мешки заключали в эпон 812 (Sigma, США) по стандартной методике. Ультратонкие срезы получали с помощью микротома LKB III (Швеция) окрашивали по методу Рейнольдса (Reynolds, 1963). Ультратонкие срезы изучали с помощью трансмиссионного электронного микроскопа JEM-1011 (JEOL, Япония) c цифровой фотокамерой GATAN ES500W.
Обработка изображений производилась в программах ImageJ, Photoshop CS6.
РЕЗУЛЬТАТЫ
Исследование процесса дифференцировки клеток антиподального комплекса зародышевого мешка T. aestivum после двойного оплодотворения показало, что на данном этапе развития эти клетки неравномерно увеличиваются в размерах за счет многочисленных раундов эндоредупликации. При этом анализ структуры антиподальных комплексов пятидесяти зародышевых мешков (1000 клеток) показал, что на стадии дифференцировки базальный ярус антиподального комплекса сформирован 5–6 клетками, апикальный ярус – 8–10, средний – 10–12 клетками.
На ранней стадии дифференцировки все клетки антиподального комплекса имеют овальную форму, округлые ядра сходного размера и цитоплазму с одной или двумя-крупными вакуолями (рис. 1в). Однако, позднее они начинают различаться по морфологии, что проявляется в значительном увеличении размеров ядер отдельных клеток и появлении в них отдельных политенных хромосом (рис. 1г).
Ядра антиподальных клеток
Количество ДНК ядер антипод (1000 клеток) комплексов, находящихся на различных стадиях дифференцировки, определяли на тотальных препаратах пятидесяти зародышевых мешков, окрашенных DAPI, в программе ImageJ. Содержание ДНК в ядрах клеток ярусов антиподального комплекса на разных стадиях дифференцировки приведено в табл. 1.
Полученные данные показали, что в пределах одного антиподального комплекса на всех стадиях дифференцировки ядра клеток отличаются по содержанию ДНК. При этом клетки разных ярусов каждого комплекса заметно отличаются по размеру и плоидности ядер. Плоидность ядер клеток, примыкающих к эндосперму, значительно выше, чем в ядрах клеток других ярусов. При этом в базальном ярусе, примыкающем к халазе, локализуются клетки самой низкой плоидности.
Все ядра антиподальных клеток на ранней стадии дифференцировки комплекса имеют округлую форму, в них не выявляются отдельные политенные хромосомы (рис. 2а). Антиподальные клетки базального яруса с небольшими округлыми ядрами с фибриллярным хроматином сохраняют свою морфологию до конца средней стадии дифференцировки. Ядра клеток среднего и апикального ярусов заметно увеличиваются в размерах и в них выявляются гигантские политенные хромосомы (рис. 2б). На поздней стадии дифференцировки политенные хромосомы наблюдаются в ядрах клеток всех ярусов и ядра приобретают удлиненно-овальную форму (рис. 2в).
С помощью окрашивания компонентов ядра гематоксилином Каррачи (рис. 3 б), Ag-Nor окрашивания аргентофильных белков ядрышка (рис. 3 в) и иммуноцитохимического выявления мажорного белка плотного фибриллярного компонента ядрышка фибрилларина (рис. 3 г) показано, что ядра на всех стадиях дифференцировки содержат от одного до четырех гигантских ядрышек и несколько зон локализации мини-ядрышек.
Схематическое изображение структуры ядер антиподальных клеток на разных стадиях их дифференцировки представлено нами на рис. 4.
Рис. 4.
Ядра антиподальных клеток на разных стадиях дифференцировки комплекса. Гематоксилин Каррачи. a – фибриллярные эндополиплоидные ядра ярусов комплекса на ранней стадии дифференцировки. б, в – обособленные индивидуальные политенные хромосомы ядер среднего и апикального яруса на средней и поздней стадии дифференцировки. Масштабная линейка – 30 мкм.
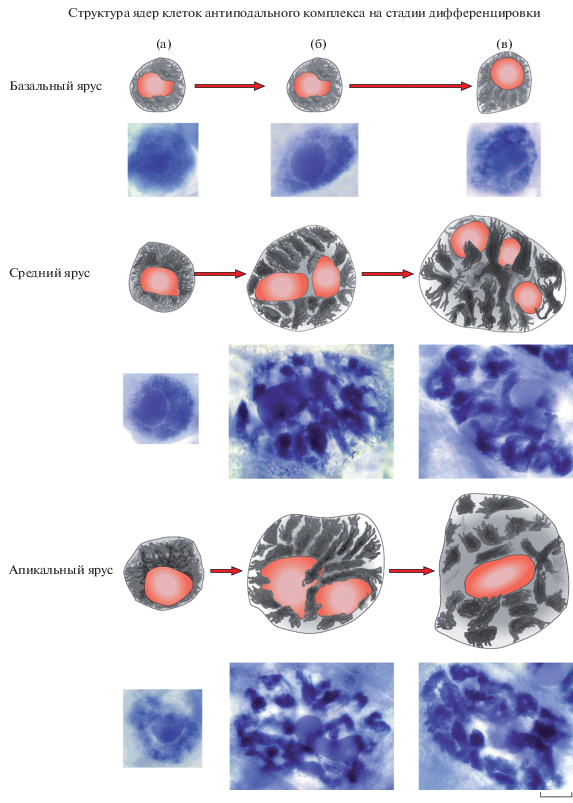
Изучение ультраструктуры антиподальных клеток показало, что на средней и поздней стадиях дифференцировки ядерная мембрана пронизана поровыми комплексами и образует многочисленные инвагинации (рис. 5а, 5б).
Рис. 5.
Ультраструктура ядер антиподальных клеток зародышевого мешка пшеницы на стадии дифференцировки. а – политенные хромосомы (хс), гигантское ядрышко (як) с многочисленными гетерогенными фибриллярными центрами (фц) и вакуолями (в), мини-ядрышко (мяк) в ядре антиподальной клетки на ранней стадии дифференцировки. Масштабная линейка 10 мкм. б – инвагинации ядерной оболочки ядра на ранней средней стадии дифференцировки. Масштабная линейка – 5 мкм.

Политенные хромосомы на ранней стадии дифференцировки сформированы меньшим числом хроматид в отличие от хромосом в ядрах на средней и поздней стадии дифференцировки. В ядрах выявляются гигантские ядрышки с многочисленными гетерогенными фибриллярными центрами, погруженными в обширный плотный фибриллярный компонент, окруженный многочисленными гранулами (рис. 5а).
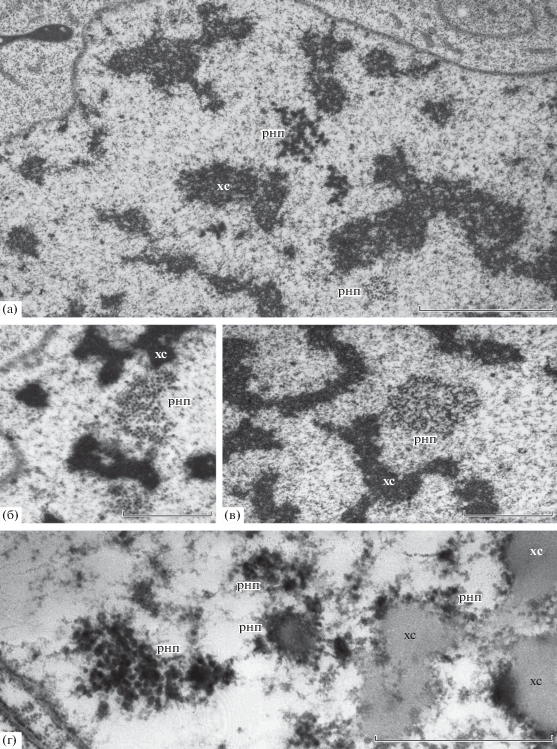
В области политенных хромосом выявляются полиморфные структуры (рис. 6а–6в), содержащие РНК и РНП, ассоциированные с поверхностью политенных хромосом (рис. 6г), идентифицированные по методу Бернара.
Рис. 6.
Полиморфизм структур, содержащих РНК и РНП в ядрах клеток антиподальных комплексов на стадии дифференцировки. а–в – структуры, ассоциированные с поверхностью хромосом (стрелки) в ядрах антиподальных клеток. г – РНК и РНП ядра антиподальной клетки (метод Бернарда). хс – хромосомы, рнп – рибонуклеопротеиды. Масштабная линейка: а, – 3 мкм; б–г – 1 мкм.
Цитоплазма антиподальных клеток
Использование иммуноцитохимического окрашивания цитоплазмы антиподальных клеток, находящихся на стадии дифференцировки, позволило выявить особенности локализации ее гранулярного ретикулума, диктиосом, митохондрий и микротрубочек.
Для локализации основных органелл, участвующих в выполнении секреторной функции, была проведена трехмерная реконструкция структуры антиподальных клеток после иммуноцитохимического выявления гранулярного ретикулума (рис. 7б) и диктиосом (рис. 7г). Гранулярный ретикулум и диктиосомы на ранней стадии дифференцировки располагаются по всему объему цитоплазмы антипод. В клетках базального яруса такая картина наблюдается в течение всей стадии дифференцировки. В клетках среднего и апикального ярусов комплекса на средней и поздней стадиях дифференцировки диктиосомы располагаются по периферии клетки и вблизи инвагинаций ядерной оболочки (рис. 7). Многочисленные митохондрии располагаются по всему объему цитоплазмы клеток антиподального комплекса (рис. 8а, 8б).
Рис. 7.
Локализация эндоплазматического ретикулума и диктиосом в цитоплазме клеток антиподальных комплексов зародышевых мешков пшеницы. Иммуноцитохимическое окрашивание гранулярного ретикулума (КDEL) и диктиосом (58K). а – гранулярный ретикулум на оптическом срезе; б – распределение гранулярного ретикулума в объеме клетки (Z-проекция 25 срезов); в – диктиосомы на оптическом срезе, г – распределение диктиосом в объеме клетки (Z-проекция 25 срезов). Масштабная линейка – 30 мкм.

Рис. 8.
Локализация митохондрий и микротрубочек на стадии дифференцировки клеток антиподального комплекса. а, б – митохондрии (антитела к цитохрому с) на ранней и поздней стадиях дифференцировки. г, е – пучки микротрубочек (антитела к тубулину, клон DM1α) в цитоплазме антиподальных клеток на ранней и средней стадиях дифференцировки. в, д – ядра антиподальных клеток. Масштабная линейка: а, б – 30 мкм; в–е – 20 мкм.

На ранней стадии дифференцировки в цитоплазме антиподальных клеток выявляется тонкая сеть из многочисленных пучков коротких микротрубочек (рис. 8г). На поздней стадии дифференцировки выявляются плотные протяженные пучки микротрубочек (рис. 8е).
При изучении ультраструктуры цитоплазмы антиподальных клеток на стадии дифференцировки четко визуализуются многочисленные органеллы.
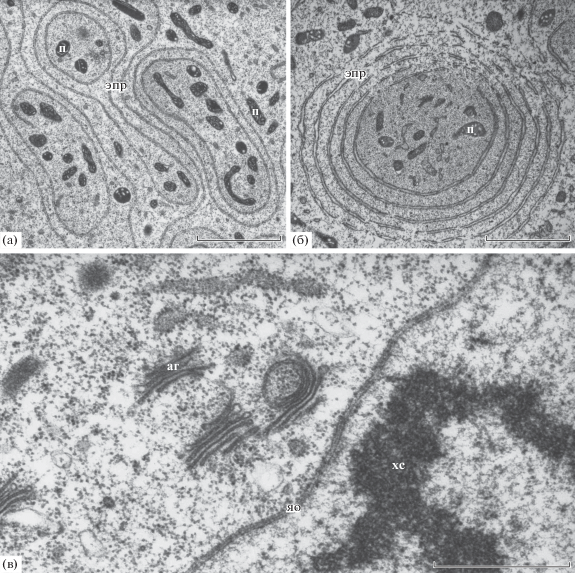
Гранулярный ретикулум на ранней стадии имеет вид протяженных цистерн. На поздней стадии дифференцировки гранулярный ретикулум представлен концентрическими замкнутыми цистернами, внутри которых могут находиться митохондрии и пластиды (рис. 9а). Число таких концентрических цистерн, расположенных одна внутри другой, может достигать десяти на поздней стадии дифференцировки (рис. 9б). Выявляются стопки диктиосом аппарата Гольджи из 4–10 цистерн (рис. 9в).
Рис. 9.
Ультраструктура эндоплазматического ретикулума и диктиосом на стадии дифференцировки клеток антиподального комплекса. а, б – многослойные концентрические цистерны гранулярного ретикулума (эпр) на средней и поздней стадии дифференцировки. Отдельные диктиосомы аппарата Гольджи (аг). Пластиды (п) и митохондрии (м). Хромосома (хс), ядерная оболочка (яо). Масштабная линейка – 3 мкм.
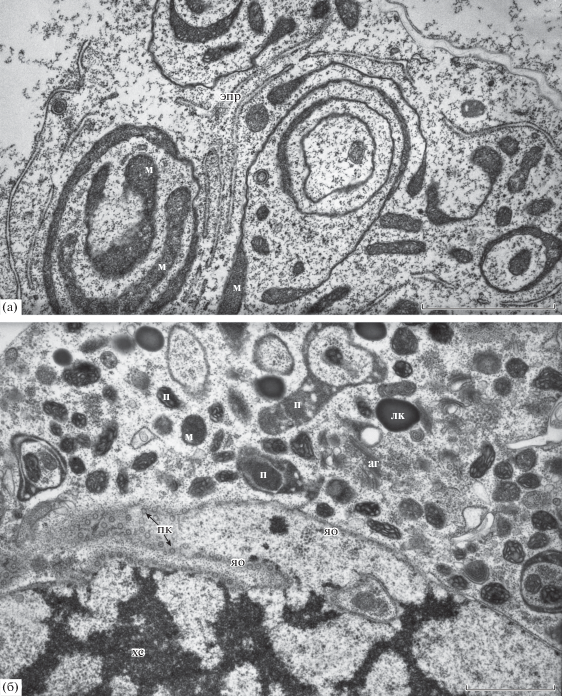
Митохондрии клеток многочисленны, их трудно отличить от пластид (рис. 9а, 10б). Однако матрикс митохондрий светлее, чем у пластид. Многие митохондрии на поздней стадии дифференцировки имеют форму чаши (рис. 10а). Форма пластид разнообразна и варьирует от овальной до чашевидной (рис. 10б). В цитоплазме антиподальных клеток на всех стадиях дифференцировки выявляются многочисленные рибосомы. На поздней стадии дифференцировки в цитоплазме присутствуют многочисленные крупные липидные капли (рис. 10б).
Рис. 10.
Ультраструктура митохондрий и пластид клеток антиподального комплекса на стадии дифференцировки. а – чашевидные митохондрии (м), цистерны гранулярного ретикулума (эпр). б – диктиосомы аппарата Гольджи (аг), пластиды (п), липидные капли (л), поровые комплексы (пк) антиподальной клетки. Ядерная оболочка (яо) и область теломеры политенной хромосомы (хс) ядра антиподальной клетки. Масштабная линейка: а – 6 мкм; б – 3 мкм.
ОБСУЖДЕНИЕ
В ряде ранних цитологических работ была дана краткая характеристика ультраструктуры антипод разных злаков – Zea mays L. (Diboll, Larson, 1966; Diboll, 1968), Oryza sativa L. (Maeda et al., 1996, 1997), Hordeum vulgare L. (Engell, 1994) и Triticum aestivum L. (Morrison, 1954; Hoshikawa, 1960; You, Jensen, 1985). Было показано, что у злаков ядра антипод в ходе онтогенеза увеличиваются в размерах. В ядрах содержатся одно или несколько крупных ядрышек с вакуолями. Ядерная оболочка формирует многочисленные инвагинации (Morrison, 1954; Hoshikawa, 1960; Diboll, Larson, 1966; Diboll, 1968; You, Jensen, 1985; Engell, 1994; Maeda et al., 1996, 1997).
В работе Чабан с соавторами было показано, что размеры ядер антиподальных клеток пшеницы на стадии дифференцировки после оплодотворения отличаются: наибольшего размера достигают ядра клеток апикального яруса антиподальных комплексов. В составе гигантских хромосом выявляются отдельные фибриллярные структуры – хромонемы, размеры ядрышек увеличиваются, клетки удлиняются (Чабан и др., 2011).
В нашей работе мы изучали клетки антиподальных комплексов на разных стадиях дифференцировки после оплодотворения и показали, что в ядрах антиподальных клеток пшеницы Triticum aestivum L. отдельные гигантские политенные хромосомы выявляются на средней и поздней стадии дифференцировки (рис. 2б, 2в, 3 а, 3б, 3е). Центральные области политенных хромосом конденсированы, в области теломер хроматиды хромосом не конъюгированы, разобщены и контактируют с ядерной оболочкой (рис. 3 а, 3б, 3е). В каждом ядре на стадии дифференцировки выявляются одно–три крупных ядрышка (рис. 3 б, 3в, 3г). Ядерная оболочка с многочисленными порами образует инвагинации (рис. 5 и 10б).
Петрова с соавторами исследовали структуру ядер антипод в зародышевом мешке Hordeum vulgare L. и наблюдали аналогичные картины (Петрова и др., 1985).
Антиподальные комплексы клеток Triticum aestivum L. с ядрами разной морфологии описаны ранее в работе Лазаревой и Ченцова. На ранней стадии онтогенеза в ядрах антипод кроме крупных ядрышек они выявляли мини-ядрышки с помощью Ag-Nor окрашивания и иммуноцитохимического выявления фибрилларина (Лазарева, Ченцов, 2004). Наши данные подтверждают полученные ими факты (рис. 3 в).
Беннет с соавторами измеряли количество ДНК в ядрах антипод разных зародышевых мешков Triticum aestivum L., фиксированных через определенные временные отрезки после цветения, и выявили среди антиподальных ядер каждого комплекса ядра с низким и высоким содержанием ДНК (Bennett et al., 1973). В нашей работе мы впервые связали содержание ДНК ядер антиподальных клеток Triticum aestivum L. с их морфологией и топологией, показав, что они отличаются по плоидности, структуре ядер и расположению в антиподальном комплексе. В каждом комплексе клетки с ядрами, содержащими от 5 до 24 С располагались в базальном ярусе и почти не меняли морфологию ядер. Антиподы со средним (от 30 до 63 С) и высоким (от 63 до 215 С) содержанием ДНК располагались в среднем и апикальном ярусах комплекса и структура их ядер значительно изменялась в ходе дифференцировки, ядра клеток увеличивались в размере, в них выявлялись отдельные политенные хромосомы. Клетки апикального яруса комплекса всегда были плотно ассоциированы с клетками эндосперма, и их ядра проходили наибольшее число раундов эндоредупликации генома (до 215 С).
Во всех ядрах антиподальных клеток на стадии дифференцировки мы обнаружили структуры, связанные с различными участками хромосом (рис. 6а–6в), и с помощью регрессивного контрастирования РНК по методу Бернара выявили в них и на поверхности хромосом РНК и РНП.
С помощью трехмерной реконструкции изображений клеток после иммуноцитохимического окрашивания, мы показали, что локализация гранулярного ретикулума и диктиосом, участвующих в секреторной активности клеток, меняется на разных стадиях дифференцировки антиподального комплекса. На ранних этапах они равномерно располагаются по объему цитоплазмы, позднее большая часть органелл выявляется вблизи плазматической мембраны и в инвагинациях ядерной оболочки.
Сходную ультраструктуру органелл цитоплазмы антиподальных клеток злаков наблюдали у Zea mays L. (Diboll, Larson, 1966; Diboll, 1968), Oryza sativa L. (Maeda, Miyake, 1996, 1997) и Hordeum vulgare L. (Engell, 1994). Мы обнаружили, что диктиосомы антиподальных клеток Triticum aestivum L. состоят из 4–10 цистерн. У ячменя, риса, кукурузы диктиосомы имеют сходную структуру (3–6 цистерн). Гранулярный ретикулум в виде протяженных цистерн и концентрических колец выявляли в антиподальных клетках Triticum aestivum L. (You, Jensen, 1985), Hordeum vulgare L. (Engell, 1994), Oryza sativa L. (Maeda, Miyake, 1996, 1997) и Zea mays L. (Diboll, Larson, 1966). В антиподальных клетках Hordeum vulgare L. гладкий ретикулум имел вид концентрических колец, а гранулярный – протяженных цистерн (Engell, 1994). У антиподальных клеток Triticum aestivum L. мы этого не обнаружили. И гранулярный, и гладкий ретикулум имели форму как концентрических колец, так и протяженных цистерн. Мы показали, что цистерны гранулярного ретикулума антиподальных клеток Triticum aestivum L. чаще имеют вид концентрических колец, и на поздних этапах дифференцировки увеличивается количество концентрических цистерн, вставленных друг в друга. Такая структура ретикулума наблюдается в зародышевых мешках Triticum aestivum L., в синцитиальном эндосперме которых выявляются волна митозов. В цитоплазме антиподальных клеток других злаков эта закономерность не была обнаружена.
В антиподальных клетках пшеницы выявлялись многочисленные полиморфные пластиды, схожие по морфологии с митохондриями. Подобную структуру пластид наблюдали у антиподальных клеток Triticum aestivum L. (You, Jensen, 1984) и Hordeum vulgare L. (Engell, 1994). На разнообразие структуры митохондрий антиподальных клеток обращали внимание у Triticum aestivum L. (You, Jensen, 1985), Hordeum vulgare L. (Engell, 1994), Oryza sativa L. (Maeda, Miyake, 1996, 1997) и Zea mays L. (Diboll, Larson, 1966). В изученных нами антиподальных клетках пшеницы также встречались полиморфные митохондрии. Мы обнаружили, что на поздних стадиях дифференцировки комплекса в цитоплазме антиподальных клеток появляются чашевидные митохондрии и многочисленные липидные капли. Присутствие липидных капель показано ранее в цитоплазме антипод Zea mays L. (Diboll, Larson, 1966). Пластиды синтезируют аминокислоты, жирные кислоты, нуклеотиды, митохондрии участвуют в синтезе аминокислот и производных нуклеотидов, увеличение размера и изменение структуры этих органелл может свидетельствовать о возрастании их функциональной нагрузки в процессе дифференцировки комплекса.
Необходимо отметить, что все клетки антиподальных комплексов имеют крупные вакуоли, чаще обращенные в сторону эндосперма.
Полученные данные позволяют предположить, что клетки базального и апикального ярусов не только отличаются по структуре, но и выполняют различные функции на этапах дифференцировки. На стадии ранней дифференцировки все антиподы выполняют осморегулирующую функцию, что подтверждается присутствием в клетках крупных вакуолей по обеим сторонам от ядра. На средней и поздней стадии развития в клетках выявляются обособленные гигантские политенные хромосомы, что свидетельствует о высокой метаболической активности этих клеток. Вероятно, клетки среднего и апикального яруса с наибольшей степенью политенизации осуществляют транскрипцию разнообразных РНК, кодирующих белки, которые обеспечивают развитие и защиту формирующегося синцития эндосперма.
Список литературы
Батыгина Т.Б. Хлебное зерно. Л.: Наука, 1987. 103 с.
Зыбина Е.В. Цитология трофобласта. Л.: Изд. Наука, 1986. 121 с.
Жимулев И.Ф. Хромосомы. Структура и функции. Новосибирск. Изд. СО РАН, 2009. 258 с.
Лазарева Е.М., Ченцов Ю.С. Особенности локализации фибрилларина, белка с мол. массой 53 кДа и Ag-Nor белков в гигантских ядрах антипод пшеницы // Цитология. 2004. Т. 46. С. 125–135.
Петрова Т.Ф., Соловьянова О.Б., Ченцов Ю.С. Ультраструктура гигантских политенных хромосом в антиподах ячменя // Цитология. 1985. Т. 17. С. 499–503.
Поддубная-Арнольди В.А. Цитоэмбриология покрытосеменных растений. Основы и перспективы. М.: Наука, 1976. 507 с.
Ригин Б.В., Орлова И.Н. Пшенично-ржаные амфидиплоиды. Л.: Колос, 1974. 206 с.
Чабан И.А., Лазарева Е.М., Кононенко Н.В., Поляков В.Ю. Развитие антиподального комплекса зародышевого мешка пшеницы // Онтогенез. 2011. Т. 42. С. 101–115.
An L.-H., You R. Studies on nuclear degeneration during programmed cell death of synergid and antipodal cells in Triticum aestivum // Sex Plant Reproduction. 2004. V. 17. P. 195–201.
Brink R.A., Cooper D.C. The antipodals in relation to abnormal endosperm behaviour in Hordeum jubatum × Secale cereale hybrid // Genetics. 1944. V. 29. P. 391–406.
Diboll A.G., Larson D.A. An electron microscopic study of the mature megagametophyte in Zea mays // American Journal of Botany. 1966. V. 53. P. 391–402.
Diboll A.G. Fine structural development of the megagametophyte of Zea mays following fertilization // American Journal of Botany. 1968. V. 55. P. 797–806.
Engell K. Embryology of barley. IV. Ultrastructure of the antipodal cells of Hordeum vulgare L. cv. Bomi before and after fertilization of the egg cell // Sex Plant Reproduction. 1994. V. 7. P. 333–346.
Jensen G.H. Studies on the morphology of wheat // Washington 110 University Agricultural Experimet Station Bulleten. 1918. V. 150. P. 3–30.
Kaltsikes P.J. Early seed development in hexaploid triticale // Canadian Journal of Botany. 1973. V. 51. P. 2291–2300.
Maeda E., Miyake H. Ultrastructure of antipodal cells of rise (Orysa sativa) after anthesis, as related to nutrient transport in embryo sac // Japanese J. Crop Science. 1996. V. 65. P. 340–351.
Maeda E., Miyake H. Ultrastructure of antipodal cells of rise (Orysa sativa) before anthesis with special reference to concentric configuration of endoplasmic reticula // Japanese J. Crop Science. 1997. V. 66. P. 488–496.
Monneron A., Bernhard W. Fine structural organization of the interphase nucleus in some mammalian cells // J. Ultrastructure Research. 1969. V. 27. P. 266–288.
Morrison J.W. Fertilization and postfertilization development in wheat // Canadian Journal of Botany. 1954. V. 33. P. 168–176.
Reynolds E.S. The use of lead citrate at high pH as an electron-opaque stain in electron microscopy // The J. Cell Biology. 1963. V. 17(1). P. 208.
Terada S. Embryological studies of Oryza sativa L. // Journal of College of Agriculture Hokkaido. 1928. V. 9. P. 245–260.
You R., Jensen W. Ultrastructural observations of the mature megagametophyte and the fertilization in wheat (Triticum aestivum) // Canadian J. Botany. 1985. V. 63. P. 163–178.
Zhang W.C., Yan W.M., Lou C.H. The structural changes during the degeneration process of antipodal complex and its function to endosperm formation in wheat caryopsis // Acta Biologica Cracoviensia. Series Botanica. 1988. V. 30. P. 457–462.
Zhimulev I.F. Morphology and structure of polytene chromosomes // Advances in Genetics. 1996. V. 34. P. 1–359.
Дополнительные материалы отсутствуют.


