Онтогенез, 2019, T. 50, № 4, стр. 237-246
Динамика содержания липидов и жирных кислот на ранних стадиях онтогенеза горбуши Oncorhynchus gorbuscha (Walbaum, 1792) в естественных условиях (река Индера, Кольский п-ов)
С. А. Мурзина a, *, З. А. Нефедова a, С. Н. Пеккоева a, А. Е. Веселов a, Д. А. Ефремов a, Т. Р. Руоколайнен a, Н. Н. Немова a
a Институт биологии – обособленное подразделение Федерального государственного бюджетного учреждения науки Федерального исследовательского центра “Карельский научный центр Российской академии наук”
185910 Петрозаводск, ул. Пушкинская, 11, Россия
* E-mail: murzina.svetlana@gmail.com
Поступила в редакцию 21.12.2018
После доработки 20.03.2019
Принята к публикации 27.03.2019
Аннотация
Проведено сравнительное исследование липидного и жирнокислотного статуса на ранних стадиях онтогенеза горбуши – в преднерестовой икре, на стадии пигментации глаз и у выклюнувшихся предличинок с учетом экологических условий естественной среды обитания р. Индера (Кольский полуостров). Показано, что высокая пластичность горбуши обусловлена включением и сочетанием сложных биохимических механизмов на ранних стадиях развития, обеспечивающих как чувствительность вида, так и устойчивость, за счет которой формируется высокий потенциал вида в условиях высоких широт. Метаболически зрелая икра горбуши характеризуется высоким уровнем общих липидов с большим запасом структурных и энергетических компонентов, которые обеспечивают оптимальное развитие зародыша. На стадии пигментации глаз, протекающей осенью, активизируются метаболические процессы, что отражается на изменении спектра отдельных классов липидов, жирных кислот и показателей их соотношений. У предличинок, выклев которых проходил зимой при температурах ниже нуля, снижено количество фосфолипидов и триацилглицеринов, а также 16:1ω-7, 18:3ω-3 и 20:5ω-3, повышен уровень холестерина и эфиров холестерина, а также показатель 20:4ω-6/18:2ω-6 жирных кислот, сохраняется высокое содержание доминирующих 18:1ω-9 и 22:6ω-3 жирных кислот. Разнонаправленность изменений уровня липидов и жирных кислот на стадии пигментации глаз (наиболее чувствительном этапе эмбрионального развития) и у предличинок горбуши после выклева обусловлена специфическими процессами интенсификации метаболизма развивающегося организма.
ВВЕДЕНИЕ
Биохимические исследования липидного и жирнокислотного статуса горбуши, Oncorhynchus gorbusha (Walbaum, 1792), на ранних стадиях онтогенеза интересны с точки зрения поиска возможных индикаторов оценки потенциальных возможностей для их дальнейшего развития (особенно для личинок), формирования потомства. Горбуша – многочисленный и наиболее пластичный вид дальневосточных лососей. Она относится к проходным рыбам и имеет самый короткий жизненный цикл среди представителей семейства Salmonidae (становится половозрелой за 22–23 месяца после нереста) (Зубченко и др., 2004). В северных широтах нерестовый ход горбуши в р. Индера начинается с середины июля, икрометание проходит осенью, эмбриогенез протекает в условиях зимы при низких температурах и подо льдом. Развитие эмбрионов горбуши проходит в реках с галечным грунтом, в нерестовых гнездах. До вылупления личинок должно пройти около 500 градусодней. Вылупление молоди рыбы происходит с конца января по начало марта, в зависимости от климатических условий. Далее личинки находятся в грунте, питаются за счет содержимого желточного мешка, который полностью рассасывается к апрелю (у личинок в реках Кольского полуострова), и они остаются без питания до мая. С распалением льда и повышением температуры воды до 5°С и выше, в реке начинается массовая покатная миграция мальков на нагул в море (Зубченко и др., 2004).
Одним из основных биохимических критериев зрелости икры и готовности ее к оплодотворению является содержание липидов в желтке яиц, а определенный их уровень и соотношение отдельных липидных классов, в том числе их жирных кислот, являются показателями жизнеспособности эмбрионов и личинок (Крыжановский, 1960; Сидоров, 1983; Tocher, 2003). Жирные кислоты – одни из компонентов липидных молекул, участвуют в энергетических процессах клетки, в регуляции биохимических реакций и физиологических процессов, в том числе, связанных с возрастными аспектами. В ходе вителлогенеза в ооците совместно с липидами запасаются и желточные белки (Wiegand, 1996).
Каждый этап онтогенеза характеризуется определенными морфологическими и физиологическими изменениями, поддерживаемыми биохимическими реакциями и процессами, которые идут с разной интенсивностью. К стадии пигментации глаз (при полной пигментации меланином сосудистой оболочки глаз) образуется сердце и печень, начинает функционировать печеночно-желточная система кровообращения и компоненты желтка начинают использоваться более активно (Wiegand, 1996; Рыжков, Крупень, 2004). Ранее было установлено, что уменьшение массы желтка к стадии пигментации глаз эмбрионов лосося (от этапа дробления) составляет 24.0% (Нефедова, 1989). Стадия пигментации глаз является одним из чувствительных (критических) этапов эмбриогенеза, повышается метаболическая активность с существенными морфофизиологическими и биохимическими преобразованиями (Павлов, 1984; Новиков, 2000; Мурзина и др., 2012; Немова и др., 2015). Потенциальная возможность для выживания выклюнувшихся личинок зависит от стартового уровня липидов в преднерестовой икре и скорости их траты в процессе эмбрионального развития.
Настоящая работа представляет собой сравнительное исследование липидного и жирнокислотного статуса на ранних стадиях онтогенеза горбуши – в преднерестовой икре, на стадии пигментации глаз и у выклюнувшихся предличинок с учетом экологических условий естественной среды обитания, в которых протекает их развитие в р. Индера (Кольский полуостров).
МАТЕРИАЛЫ И МЕТОДЫ
Индивидуальные пробы преднерестовой икры горбуши были взяты в первую декаду августа, за неделю до нереста. Массовая нерестовая миграция горбуши в р. Индера происходит в начале августа. Средняя температура воды в это время колеблется от 16 до 12°С.
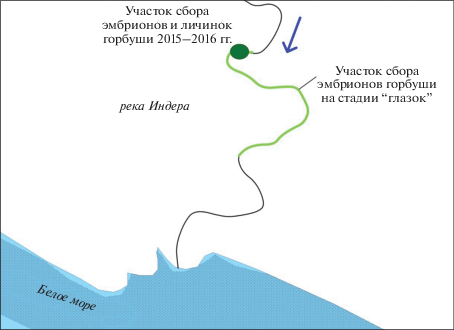
Сбор эмбрионов горбуши на стадии пигментация глаз проводили 5 октября в реке Индера, в 1.0–1.8 км от устья (рис. 1), при температуре воды 1.5°С. Развитие эмбрионов проходило подо льдом в естественных гнездах реки (рис. 2). Из одного гнезда, которое располагалось в центре русла реки, были собраны более 200 эмбрионов горбуши. Глубина на участке составляла 0.4–0.5 м, поверхностная скорость течения – 0.9–1.0 м/с. Гнездо сложено из крупной и средней гальки, гравия и песка, без обрастания растительностью. Период эмбрионального развития продолжался с конца августа до конца января. Предличинки начинают вылупляться в конце января и до начала марта, в зависимости от температурных условий. Сбор предличинок осуществляли в марте из двух нерестовых гнезд, которые располагались на расстоянии 10 метров друг от друга. Температура воды была –0.5°С. Глубина залегания как эмбрионов, так и предличинок горбуши от поверхности бугра не превышала 10–15 см. Личинки имели прозрачное тело с выраженной головой, туловищем, хвостовым отделом и овально–вытянутый желточный мешок, размером в 2/3 от длины тела. Желточный мешок и область сочленения его с телом имели ярко-оранжевый цвет.
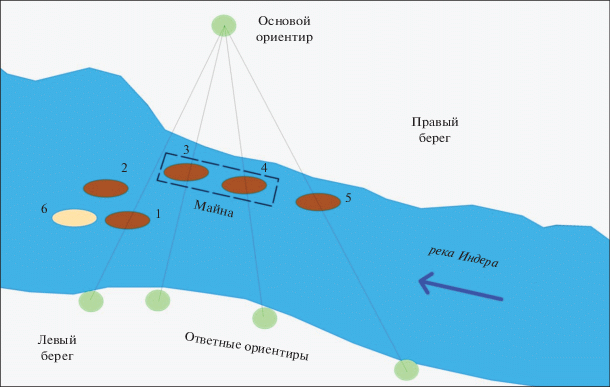
Рис. 2.
Схема расположения естественных гнезд горбуши. 1, 2, 3, 4, 5 – гнезда, отмеченные для сбора икры в зимний период; 6 – гнездо из которого взята проба на стадии глазок, в октябре 2015 г. Пунктиром обозначена майна во льду, взятие пробы в марте 2016 г.
Липидный статус зрелой икры, эмбрионов на стадии пигментации глаз и выклюнувшихся предличинок оценивали по содержанию общих липидов (ОЛ), в том числе фосфолипидов (ФЛ) – фосфатидилинозитола (ФИ), фосфатидилсерина (ФС), фосфатидилэтаноламина (ФЭА), фосфатидилхолина (ФХ), лизофосфатидилхолина (ЛФХ) и сфингомиелина (СФМ), триацилглицеринов (ТАГ), холестерина (ХС), эфиров холестерина (ЭХС) и жирных кислот (ЖК) общих липидов: насыщенных (НЖК), мононенасыщенных (МНЖК) и полиненасыщенных жирных кислот (ПНЖК).
Пробы преднерестовой икры, эмбрионов и предличинок горбуши (по 300 мг в 10–30 повторностях) гомогенезировали в небольшом количестве этилового спирта (96%), затем фиксировали смесью хлороформ : метанол (2 : 1) и хранили при температуре 4°С до анализа. Липиды экстрагировали и очищали по методу Фолча (Folch et al., 1957), концентрировали до сухого состояния с помощью роторно-вакуумной установки, затем фракционировали на пластинках “Silufol” (Kavalier, Чехия) в системе растворителей петролейный эфир : серный эфир : уксусная кислота (90 : 10 : 1, по объему). Количественное определение суммарных фосфолипидов, триацилглицеринов, эфиров холестерина проводили гидроксаматным методом (Walsh et al., 1965; Сидоров и др., 1972), холестерина (ХС) – методом Ф. Энгельбрехта (Engelbrecht et al., 1974) и выражали в процентах сухой массы. Фосфолипиды разделяли на классы: ФИ, ФС, ФЭА, ФХ, ЛФХ и СФМ методом высокоэффективной жидкостной хроматографии (Arduini, 1996) на стальной колонке Nucleosil 100-7 (“Элсико”, Москва). Подвижная фаза: ацетонитрил : : гексан : метанол : ортофосфорная кислота (918 : : 30 : 30 : 17.5). Детектирование проводили по степени поглощения света при 206 нм. Для идентификации использовали стандартные ФЛ (“Sigma Aldrich”, США). Соотношение между фосфолипидными компонентами оценивали по значениям площадей пиков на хроматограмме. Затем проводили метанолиз ЖК общих липидов (Цыганов и др., 1976). Метиловые эфиры жирных кислот разделяли и идентифицировали методом газожидкостной хроматографии с применением хроматографа “Хроматэк-Кристалл 5000.2” (ЗАО “ХРОМАТЭК”, Россия). В качестве внутреннего стандарта использовали бегеновую кислоту (22 : 0) (“Sigma Aldrich”, США), обработку хроматограмм проводили с помощью компьютерной программы “Хроматэк Аналитик” (ЗАО “ХРОМАТЭК”, Россия).
Результаты проведенных экспериментов были обработаны с применением общепринятых методов вариационной статистики с использованием компьютерных программ Excel и Stadia.
Исследования выполнены на научном оборудовании Центра коллективного пользования Федерального исследовательского центра “Карельский научный центр Российской академии наук”.
РЕЗУЛЬТАТЫ
Результаты исследования липидного и жирнокислотного статуса преднерестовой икры горбуши и в период ее эмбрионального развития – на стадии пигментации глаз и у выклюнувшихся предличинок из двух гнезд представлены в табл. 1 и 2.
Таблица 1.
Содержание липидных компонентов (% сухой массы) у горбуши разных стадий развития из р. Индеры
| Показатель | Зрелая икра (перед нерестом) | Икра на стадии пигментации глаз | Предличинки горбуши из нерестовых гнезд | |
|---|---|---|---|---|
| Дата сбора проб | Август, 2015 | Октябрь, 2015 | Март, 2016 | |
| Нерестовые гнезда | ||||
| 1 | 2 | |||
| Число проб | 30 | 12 | 7 | 7 |
| ОЛ | 21.01 ± 0.28 | 28.2 ± 1.12^ | 22.31 ± 0.39^^ | 20.13 ± 0.34* |
| ФЛ | 10.85 ± 0.30 | 9.57 ± 0.47^ | 6.24 ± 0.83^^ | 7.71 ± 0.44 |
| ФИ | 0.06 ± 0.01 | 0.06 ± 0.01 | 0.09 ± 0.02 | 0.13 ± 0.02 |
| ФС | 0.01 ± 0 | 0.04 ± 0.003^ | 0.13 ± 0.03^^ | 0.14 ± 0.02 |
| ФЭА | 0.96 ± 0.03 | 1.06 ± 0.07 | 1.32 ± 0.19 | 1.76 ± 0.07 |
| ФХ | 9.58 ± 0.29 | 8.01 ± 0.40^ | 4.43 ± 0.60^^ | 5.33 ± 0.32 |
| ЛФХ | 0.16 ± 0.02 | 0.31 ± 0.07^ | 0.17 ± 0.02 | 0.25 ± 0.03* |
| СФМ | 0.07 ± 0.01 | 0.06 ± 0.01 | 0.08 ± 0.02 | 0.08 ± 0.02 |
| ТАГ | 8.57 ± 0.32 | 17.49 ± 0.80^ | 13.25 ± 1.27^^ | 10.61 ± 0.43 |
| ЭХС | 0.34 ± 0.05 | 0.17 ± 0.03^ | 0.65 ± 0.28^^ | 0.27 ± 0.15 |
| ХС | 1.25 ± 0.17 | 0.97 ± 0.20 | 2.18 ± 0.22^^ | 1.54 ± 0.15* |
| ХС/ФЛ | 0.12 ± 0.02 | 0.11 ± 0.02 | 0.39 ± 0.06^^ | 0.21 ± 0.03* |
| ТАГ/ФЛ | 0.82 ± 0.04 | 1.85 ± 0.08^ | 2.69 ± 0.72 | 1.42 ± 0.11 |
Примечание. Значения представлены в виде: M ± m; ОЛ – общие липиды, ФЛ – фосфолипиды, ФИ – фосфатидилиназитол, ФС – фосфатидилсерин, ФЭА – фосфатидилэтаноламин, ФХ – фосфатидилхолин, ЛФХ – лизофосфатидилхолин, СФМ – сфингомиелин, ТАГ – триацилглицерины, ЭХС – эфиры холестерина, ХС – холестерин; ^ – различия достоверны от икры перед нерестом (p ≤ 0.05; ANOVA); ^^ – различия достоверны от икры на стадии пигментации глаз (p ≤ 0.05; ANOVA); * – различия достоверны у личинок из гнезда 1 и 2 (p ≤ 0.05; ANOVA).
Таблица 2.
Содержание жирнокислотных компонентов (% суммы ЖК) в зрелой икре горбуши и в процессе раннего развития р. Индера
| Показатель | Зрелая икра (перед нерестом) | Икра на стадии пигментации глаз | Предличинки горбуши из нерестовых гнезд | |
|---|---|---|---|---|
| Дата сбора проб | Август, 2015 | Октябрь, 2015 | Март, 2016 | |
| Нерестовые гнезда | ||||
| 1 | 2 | |||
| Число проб | 30 | 15 | 7 | 7 |
| 14:0 | 2.29 ± 0.06 | 1.95 ± 0.02^ | 2.19 ± 0.07^^ | 1.87 ± 0.03* |
| 16:0 | 10.73 ± 0.13 | 9.64 ± 0.06^ | 10.84 ± 0.22^^ | 12.01 ± 0.18* |
| 18:0 | 4.47 ± 0.10 | 4.16 ± 0.03^ | 4.01 ± 0.08^^ | 4.41 ± 0.10* |
| Сумма НЖК | 18.82 ± 0.23 | 16.93 ± 0.09^ | 18.49 ± 0.21^^ | 19.59 ± 0.33* |
| 16:1ω-9 | 0.73 ± 0.02 | 0.64 ± 0.004^ | 0.78 ± 0.01^^ | 0.81 ± 0.01 |
| 16:1ω-7 | 7.33 ± 0.18 | 6.52 ± 0.02^ | 6.11 ± 0.03^^ | 6.26 ± 0.07 |
| 18:1ω-9 | 23.19 ± 0.53 | 21.08 ± 0.08^ | 21.60 ± 0.10^^ | 21.35 ± 0.16 |
| 18:1ω-7 | 4.67 ± 0.10 | 4.10 ± 0.01^ | 4.15 ± 0.07 | 3.81 ± 0.04* |
| 20:1ω-9 | 1.86 ± 0.11 | 1.34 ± 0.04^ | 1.99 ± 0.08^^ | 1.52 ± 0.02* |
| Сумма МНЖК | 39.24 ± 0.72 | 35.04 ± 0.09^ | 36.15 ± 0.19^^ | 35.10 ± 0.26* |
| 18:2ω-6 | 1.63 ± 0.03 | 1.57 ± 0.01 | 1.68 ± 0.04^^ | 1.47 ± 0.01* |
| 20:4ω-6 | 0.87 ± 0.02 | 0.88 ± 0.004 | 0.99 ± 0.01^^ | 1.01 ± 0.02 |
| Сумма ω-6 ПНЖК | 3.37 ± 0.05 | 3.34 ± 0.02 | 3.55 ± 0.05^^ | 3.32 ± 0.03* |
| 18:3ω-3 | 0.99 ± 0.03 | 1.34 ± 0.02^ | 1.00 ± 0.01^^ | 1.12 ± 0.01* |
| 18:4ω-3 | 0.89 ± 0.05 | 1.15 ± 0.01^ | 0.88 ± 0.03^^ | 1.11 ± 0.01* |
| 20:4ω-3 | 2.14 ± 0.06 | 3.03 ± 0.03^ | 2.07 ± 0.09^^ | 2.73 ± 0.04* |
| 20:5ω-3 | 14.93 ± 0.46 | 16.63 ± 0.07^ | 14.98 ± 0.24^^ | 13.82 ± 0.15* |
| 22:5ω-3 | 4.60 ± 0.09 | 5.07 ± 0.03^ | 5.27 ± 0.14 | 4.48 ± 0.04* |
| 22:6ω-3 | 13.68 ± 0.38 | 16.12 ± 0.05^ | 16.25 ± 0.28 | 17.46 ± 0.37 |
| Сумма ω-3 ПНЖК | 37.80 ± 0.89 | 43.92 ± 0.16^ | 41.01 ± 0.12^^ | 41.30 ± 0.52 |
| Сумма ПНЖК | 41.91 ± 0.90 | 47.99 ± 0.17^ | 45.30 ± 0.13^^ | 45.27 ± 0.55 |
| ω-3/ω-6 | 11.28 ± 0.29 | 13.16 ± 0.08^ | 11.55 ± 0.18^^ | 12.44 ± 0.08* |
| ω-6/ω-3 | 0.09 ± 0 | 0.08 ± 0.001^ | 0.09 ± 0.001 | 0.08 ± 0.001* |
| 16:0/18:1ω-9 | 0.47 ± 0.01 | 0.46 ± 0.002 | 0.50 ± 0.01^^ | 0.56 ± 0.01* |
| 18:3ω-3/18:2ω-6 | 0.61 ± 0.02 | 0.85 ± 0.02^ | 0.60 ± 0.02^^ | 0.76 ± 0.005* |
| НЖК/ПНЖК | 0.46 ± 0.02 | 0.35 ± 0^ | 0.41 ± 0.005^^ | 0.43 ± 0.01 |
| 20:4ω-6/18:2ω-6 | 0.54 ± 0.01 | 0.56 ± 0 | 1.24 ± 0.1^^ | 1.86 ± 0.02* |
| 22:6ω-3/ 18:3ω-3 | 13.98 ± 0.45 | 12.11 ± 0.22^ | 16.30 ± 0.13^^ | 15.63 ± 0.36 |
Примечание. Значения представлены в виде: M ± m; НЖК – насыщенные жирные кислоты, МНЖК – мононенасыщенные жирные кислоты, ПНЖК – полиненасыщенные жирные кислоты. В пробах также содержалось <1% ЖК: 15:0, 17:0, 24:0, 14:1ω-9, 14:1ω-7, 14:1ω-5, 16:1ω-5, 20:1ω-7, 14:2ω-9, 16:2ω-9, 18:2ω-9, 14:2ω-7, 16:2ω-7, 18:2ω-7, 18:3ω-6, 20:2ω-6, 20:3ω-6, 22:3ω-6, 22:4ω-6, 22:5ω-6, 14:2ω-5, 18:2ω-4, 18:3ω-4, 18:4ω-4, 16:2ω-3, 16:3ω-3, 16:4ω-3, 18:2ω-3, 20:3ω-3, 22:4ω-3); ^ – различия достоверны от икры перед нерестом; ^^ – различия достоверны от стадии пигментации глаз; * – различия достоверны у личинок из гнезда 1 и 2 (p ≤ 0.05; ANOVA).
В зрелой икре перед нерестом установлено высокое содержание ОЛ (21.0% сухой массы) за счет доминирования структурных ФЛ (10.8% сухой массы), а также запасных ТАГ (8.6% сухой массы). Показатель соотношения запасных и структурных липидов ТАГ/ФЛ составил 0.82. Доля ХС была 1.25%, а его запасной формы – ЭХС – в 3.7 раза меньше (0.34% сухой массы). Коэффициент соотношения структурных липидов ХС/ФЛ составил 0.12. В фосфолипидном спектре ОЛ доминировал ФХ (9.58% сухой массы), а доля других ФЛ (ФЭА, ЛФХ, ФИ, ФС и СФМ) не превышала 1.0% сухой массы.
Сравнивая липидный спектр у эмбрионов на стадии пигментации глаз с таковым у преднерестовой икры горбуши, установили, что содержание ОЛ увеличилось в 1.3 раза (за период август– начало октябрь), в основном за счет энергетических ТАГ (в 2 раза), а содержание ФЛ снизилось за счет ФХ, незначительно, но достоверно. Доля минорного ЛФХ – метаболического производного ФХ, увеличилась в 2 раза. В результате таких изменений коэффициент ТАГ/ФЛ повысился в 2.25 раза. Уровень структурного ХС у эмбрионов на стадии пигментации глаз по сравнению с таковым в преднерестовой икре достоверно не изменился, но в 2.0 раза снизилась доля его запасной формы – ЭХС.
В спектре ЖК общих липидов преднерестовой икры и эмбрионов на стадии пигментации глаз отмечено высокое содержание суммарных ПНЖК (41.9 и 48.0% суммы ЖК соответственно) с преобладанием ПНЖК семейства ω-3 (37.8 и 43.92% суммы ЖК соответственно) за счет физиологически активных эйкозапентаеновой, 20:5ω-3, и докозагексаеновой, 22:6ω-3 ЖК, причем в относительно высоких и почти равных долях. К стадии пигментации глаз повысилась доля ПНЖК семейства ω-3 (в 1.16 раза). В преднерестовой икре и эмбрионах на стадии пигментации глаз показаны низкие и равные доли ПНЖК семейства ω-6 (3.37 и 3.34% суммы ЖК соответственно), в том числе метаболически значимых – эссенциальной линолевой 18:2ω-6 и ее производного арахидоновой 20:4ω-6 ЖК. Установлено, что коэффициенты соотношений 18:3ω-3/18:2ω-6 и ω-3ПНЖК/ω-6ПНЖК, характеризующие направление метаболизма ПНЖК ω-3 и ω-6 семейств в преднерестовой икре и у эмбрионов горбуши составляли 0.61 и 11.4; 0.85 и 13.15 соответственно.
Второе место после ПНЖК по содержанию занимают МНЖК (39.2 и 35.0% суммы ЖК соответственно), основная доля которых приходится на олеиновую 18:1ω-9 ЖК, а 16:1ω-7 и 18:1ω-7 ЖК выявлены в меньших количествах. К стадии пигментации глаз в исследуемых эмбрионах снизилась доля всех МНЖК. Следует отметить, что содержание 18:1ω-9 ЖК наиболее высокое (23.19 и 21.1% суммы ЖК соответственно), среди всех установленных нами жирных кислот как в преднерестовой икре, так и зародышах горбуши на стадии пигментации глаз.
Сравнили липидный и жирнокислотный спектр развивающихся эмбрионов на стадии пигментации глаз с таковым у предличинок горбуши из двух нерестовых гнезд р. Индера. У предличинок по сравнению с эмбрионами на стадии пигментации глаз наблюдалось снижение содержания ОЛ за счет структурных ФЛ (в том числе ФХ и ЛФХ), запасных ТАГ, повышение уровня минорных ФЛ – ФС, ФИ и ФЭА, а также структурного ХС и его запасной формы ЭХС, повышение доли НЖК, МНЖК (за счет 18:1ω-9 ЖК) и ПНЖК семейства ω-6, снижение доли ПНЖК семейства ω-3 (за счет 20:5ω-3 и 22:5ω-3 ЖК). Следует отметить, что содержание физиологически значимой докозагексаеновой 22:6ω-3 ЖК у предличинок горбуши не изменилось. Все различия были достоверны.
Исследование предличинок из двух гнезд (расположенных на расстоянии 10 метров друг от друга) показало небольшое, но достоверное различие между ними по уровню ОЛ, в том числе ХС и ЛФХ, показателю ХС/ФЛ. Обнаруженные вариации запасных ТАГ, ЭХС, отдельных ФЛ классов (за исключением ЛФХ) и показателя ТАГ/ФЛ были недостоверны. Также следует отметить, что предличинки из разных гнезд незначительно, но достоверно различались долей почти всех связанных жирных кислот и значимыми показателями их соотношений (ПНЖК ω-3/ω-6, 16:0/18:1ω-9 и 20:4ω-6/18:2ω-6).
ОБСУЖДЕНИЕ
На ранних стадиях онтогенеза разная направленность изменений уровня липидов и ЖК может быть обусловлена специфическими процессами интенсификации метаболизма развивающегося организма, особенно на стадии пигментации глаз – наиболее чувствительном этапе эмбрионального развития. Повышение у зародышей горбуши содержания ОЛ, в основном за счет запасных ТАГ (в 2 раза), а также показателя ТАГ/ФЛ по сравнению с таковым в преднерестовой икре, может быть связано со снижением концентрации белков, которые могут использоваться при эндогенном питании зародыша рыб. Этому соответствует и увеличение активности протеолитических ферментов (катепсина Д) в период эмбриогенеза у лосося, как было показано ранее (Немова и др., 2017). В исследованиях, проведенных на вьюне, было показано, что на ранних стадиях эмбриогенеза при низком поглощении кислорода в качестве источника энергии используется гликолиз (Мильман и др., 1977; Озернюк, 1985).
Снижение температуры среды обитания к периоду пигментации глаз эмбрионов (от 10°С в августе, перед нерестом икры и до 0.5°С к началу октября, на стадии пигментации глаз), способствовало увеличению степени ненасыщенности липидов за счет повышения уровня ПНЖК ω-3 семейства (в том числе 20:5ω-3, 22:5ω-3 и 22:6ω-3 ЖК) кислот и снижения коэффициента ХС/ФЛ, что влияет на уровень метаболической активности мембранных ферментов и тем самым активизирует метаболизм липидов и ЖК (Hochachka, Somero, 2002; Tocher, 2003). Такие изменения были показаны нами ранее при изучении развития атлантического лосося (Мурзина и др., 2012; Немова и др., 2015). Уровень запасных ТАГ определяется потребностями самого организма в сохранении (или запасании) энергетических резервов, которые необходимы в наиболее критические периоды эмбрионального развития, каким является стадия пигментации глаз. Накопление и сохранение значительного количества липидов (особенно энергетических) в яйцах и эмбрионах горбуши, как и других видов лососевых рыб, связано не только с длительностью инкубационного периода зародышей (до 7 месяцев как у атлантического лосося и до 5 месяцев у горбуши), но и экологическими условиями: личинки выклевываются ранней весной при низкой температуре и ограниченных кормовых возможностях. Накопление определенного уровня запасных энергетических липидов в преднерестовой икре и повышение их у эмбрионов на стадии пигментации глаз можно рассматривать как адаптивную стратегию, обеспечивающую дальнейшее оптимальное развитие эмбриона и повышение степени выживаемости личинок при эндогенном питании. При этом уровень структурного ХС у эмбрионов по сравнению с таковым у преднерестовой икры достоверно не изменился, но снизилась в 2 раза доля его запасной формы – ЭХС, которые являются для организма запасной формой не только холестерина, но и жирных кислот (последние входят в структуру молекулы ЭХС).
Установленное в исследовании снижение ФХ и повышение уровня метаболически связанного с ним ЛФХ на стадии пигментации глаз у горбуши, возможно, обусловлено активацией гормоночувствительной цитозольной фосфолипазы А2 под влиянием ростовых факторов (Проказова и др., 1998). Оптимальное накопление ЛФХ у эмбрионов, которое повышает проницаемость биомембран для ионов и молекул (Осадчая и др., 2004), а также снижение у них коэффициента ХС/ФЛ способствуют уменьшению микровязкости биомембран и увеличивает функциональную активность рецепторов и мембраносвязанных ферментов (Нетюхайло, Тарасенко, 2001). Такие изменения показателей соотношений между ЛФХ и ФХ, ХС и ФЛ были отмечены нами и при развитии атлантического лосося на этапе пигментации глаз (Немова и др., 2015).
В липидах икры до оплодотворения и на стадии пигментации глаз высокое содержание олеиновой 18:1ω-9, эйкозапентаеновой 20:5ω-3 и докозагексаеновой 22:6ω-3 ЖК подтверждает их важную функциональную роль в организме. Из литературы известно о корреляции содержания 22:6ω-3 кислоты в липидах гонад производителей и выживаемостью развивающейся икры и личинок рыб, в том числе и горбуши (Юнева и др., 1990; Tocher, 2003). Причем 22:6ω-3 ЖК является жизненно необходимой для функции мозга и глаз (Puskas et al., 2004; Arts, Kohler, 2009).
В процессе эмбрионального развития содержание отдельных ЖК подвержено определенным постадийным вариациям, связанным с изменением (ростом) морфологических структур яйцеклеток (Нефедова, 1989; Мурзина и др., 2012; Dantagnan et al., 2007). Установленное снижение уровня МНЖК (в основном за счет 18:1ω-9 и 16:1ω-7 ЖК) указывает на их использование эмбрионом в качестве энергетического источника при снижении температуры среды (Tocher, 2003; Conceicao, Tandler, 2018). В икре перед нерестом и на этапе пигментации глаз одинаково низкий уровень арахидоновой 20:4ω-6 ЖК по сравнению с ее метаболическим предшественником линолевой 18:2ω-6 ЖК свидетельствует о низкой активности линолеил-СоА-десатуразы, которая играет ключевую роль в превращении ее в 20:4ω-6 ЖК – источник внутриклеточных эндогормонов (Bell et al., 2002). Отмеченные изменения – использование МНЖК и сохранение ПНЖК ω-3 семейства, а также снижение коэффициента ХС/ФЛ и повышение ЛФХ могут быть одним из факторов регуляции оптимального уровня микровязкости липидной компоненты в зависимости от физиологической потребности эмбриона.
Дополнительные исследования липидных и ЖК спектров у двух групп предличинок горбуши, развивающихся в разных, близко расположенных гнездах (не более 10 метров друг от друга), при одинаковых внешних условиях среды позволили установить (небольшие, но достоверные) различия по уровню ОЛ, в том числе отдельных классов липидов и ЖК и показателей их соотношений. Так, пониженный уровень ХС, показателя ХС/ФЛ и повышенный ЛФХ у предличинок в одном из гнезд (№ 2) предполагает у них снижение вязкости биомембран и повышение уровня метаболической активности, о чем свидетельствует повышение показателей соотношений ЖК – 16:0/18:1ω-9, 20:4ω-6/18:2ω-6 и 18:3ω-3/18:2ω-6. При этом первый из показателей характеризует интенсивность липидного обмена, второй – повышение биоконверсии линолевой 18:2ω-6 ЖК в арахидоновую 20:4ω-6 ЖК – источник внутриклеточных гормонов, и третий – соотношение эссенциальных ЖК, которое оказывает влияние на оптимизацию метаболических процессов в развивающемся организме в соответствии с его потребностями (Архипов, 1980; Sargent et al., 1995; Сергеева, Варфоломеева, 2006). Выявленные различия у предличинок горбуши из разных, но близко расположенных гнезд указывают на формирование у них разнокачественности по липидному статусу, которые могут повлиять на дальнейший рост, развитие и дифференциацию молоди.
Сравнительное исследование липидного статуса преднерестовой икры горбуши, эмбрионов на стадии пигментации глаз и выклюнувшихся предличинок показало снижение уровня ФЛ, в том числе ФХ и повышение минорных фосфолипидов (ФИ, ФС, ФЭА), а также ХС и показателя соотношения ХС/ФЛ, особенно у предличинок. Накопление ФИ и ФС – минорных ФЛ индуцирует активность мембранных ферментов, например комплекса Na+,K+-ATФазы, связанного с осморегуляцией, что имеет значение при смене среды обитания (Болдырев и др., 2006; Bystriansky, Ballantyne, 2007) и может свидетельствовать о начале их подготовки к миграции в морскую среду. Выклюнувшиеся предличинки находятся в грунте (до мая) и питаются за счет содержимого желточного мешка. У предличинок произошло снижение не только ФЛ, но и запасных ТАГ, а также 16:1ω-7, 18:3ω-3 и 20:5ω-3 кислот, при этом, повысилось содержание ХС, ЭХС и показателя ХС/ФЛ (причем в нерестовом гнезде № 1 больше, чем в гнезде № 2), что может быть одним из факторов регуляции оптимального уровня микровязкости липидной компоненты в зависимости от их физиологической потребности в определенный момент развития.
Индекс интенсивности биоконверсии 20:4ω-6/18:2ω-6 и уровень арахидоновой 20:4ω-6 ЖК, как источника физиологически активных эндогормонов, был выше у выклюнувшихся предличинок. На выявленные изменения липидных и ЖК характеристик у предличинок горбуши повлияло повышение у них интенсивности обмена липидов (показатель 16:0/18:1ω-9 ЖК), причем в гнезде № 2 в большей степени. У выклюнувшихся предличинок удерживается высокое содержание доминирующих олеиновой 18:1ω-9 и докозагексаеновой 22:6ω-3 ЖК, которые будут им необходимы при дальнейшем росте и развитии в результате их физиологической значимости и повышенной потребности в них.
Таким образом, к началу нереста в яйцах горбуши накапливается большой запас структурных и энергетических липидов, которые обеспечивают оптимальное развитие зародыша. На стадии пигментации глаз активизируются метаболические процессы, что отражается на изменении спектра отдельных классов липидов, ЖК и показателей их соотношений: увеличивается содержание ТАГ, ЛФХ и ФС, ПНЖК ω-3 семейства, показатель ТАГ/ФЛ; снижается – ФХ, показатель ХС/ФЛ, все МНЖК и НЖК; остаются без изменения ПНЖК ω-6 семейства. У предличинок повышается интенсивность обмена липидов, в результате чего происходит снижение ФЛ, запасных ТАГ, а также 16:1ω-7, 18:3ω-3 и 20:5ω-3 ЖК, но повышается уровень ХС, ЭХС, показатели ХС/ФЛ и 20:4ω-6/18:2ω-6 кислот. При этом у предличинок сохраняется высокое содержание доминирующих олеиновой 18:1ω-9 и докозагексаеновой 22:6ω-3 ЖК, функционально значимых как энергетической единицы и пластического резерва при дальнейшем развитии личинок горбуши.
Разная направленность изменений уровня липидов и ЖК обусловлена специфическими процессами интенсификации метаболизма развивающегося организма на стадии пигментации глаз. У предличинок горбуши из двух близко расположенных гнезд установлены количественные и качественные различия отдельных липидных и ЖК показателей и их соотношений, что позволяет рассматривать их как пример эколого-биохимических адаптаций, связанных с особенностями развития и формированием ответной реакции организма на действие факторов среды, что определяет дальнейшую стратегию развития молоди, формирование ее фенотипической разнокачественности.
Исследование выполнено при финансовой поддержке Российского научного фонда, проект № 14-24-00102.
Список литературы
Архипов А.В. Изменение обмена липидов у кур в онтогенезе // Сельскохозяйственная биология. 1980. Т. 15. № 5. С. 756–761.
Болдырев А.А., Кяйвяряйнен Е.И., Илюха В.А. Биомембранология: учебное пособие. Петрозаводск: Изд-во Кар НЦ РАН, 2006. 226 с.
Зубченко А.В., Веселов А.Е., Калюжин С.М. Горбуша (Oncorhynchus gorbusha): проблемы акклиматизации на Европейском Севере России. Петрозаводск: Фолиум, 2004. 82 с.
Крыжановский С.Г. О значении жировых отложений в яйцах рыб // Зоол. журн. 1960. Т. 39. С. 111–123.
Мильман Л.С., Юровицкий Ю.Г., Ермолаева Л.П. Контроль углеводного обмена на различных стадиях оогенеза // Современные проблемы оогенеза. М.: Наука, 1977. С. 249–264.
Мурзина С.А., Нефедова З.А., Рипатти П.О., Немова Н.Н. Динамика жирнокислотного состава липидов в процессе эмбрионального развития атлантического лосося Salmo salar L. // Онтогенез. 2012. Т. 43. № 2. С. 154–160.
Немова Н.Н., Нефедова З.А., Мурзина С.А., Веселов А.Е., Рипатти П.О. Сравнительная характеристика липидного и жирнокислотного статуса икры атлантического лосося на стадии пигментации глаз в естественных и искусственных условиях // Изв. РАН. Сер. Биол. 2015. № 6. С. 581–588.
Немова Н.Н., Кяйвяряйнен Е.И., Крупнова М.Ю. Динамика активности внутриклеточных цистеинзависимых протеиназ и некоторых пептидаз в эмбриогенезе лосося Salmo salar L. // Онтогенез. 2017. Т. 48. № 4. С. 308–314.
Нетюхайло Л.Г., Тарасенко Л.М. Особенности липидного состава плазматических мембран тканей легких при остром эмоционально-болевом стрессе у крыс // Укр. биохим. ж. 2001. Т. 73. № 1. С. 115–117.
Нефедова З.А. Липидный статус лосося на ранних этапах онтогенеза: Автореф. диc. … канд. биол. наук. Харьков, 1989. 16 с.
Новиков Г.Г. Рост и энергетика развития костистых рыб в раннем онтогенезе. М.: Эдиториал УРСС, 2000. 296 с.
Озернюк Н.Д. Энергетический обмен в раннем онтогенезе рыб. М.: Наука, 1985. 173 с.
Осадчая Л.М., Галкина О.В., Ещенко Н.Д. Влияние коразола на активность Na+, K+-АТФазы и интенсивность ПОЛ в нейронах и нейроглии // Биохимич. и молек.-биол. основы физиологич. функций. С.-Петер. ун-т. 2004. Вып. 37. С. 220–226.
Павлов Д.А. Влияние температуры на ранний онтогенез семги Salmo salar (Salmonidae). 1. Изменчивость морфологических признаков и продолжительности развития семги при разной температуре // Вопр. ихтиол. 1984. Т. 24. № 5. С. 794–802.
Проказова Н.В., Звездина Н.Д., Коротаева А.А. Влияние лизофосфатидилхолина на передачу трансмембранного сигнала внутрь клетки // Биохимия. 1998. Т. 63. Вып. 1. С. 38–46.
Рыжков Л.П., Крупень И.М. Пресноводный лосось Онежского озера. Петрозаводск: ПетрГУ, 2004. 152 с.
Сергеева М.Г., Варфоломеева А.Т. Каскад арахидоновой кислоты. М.: Народное образование, 2006. 256 с.
Сидоров В.С. Экологическая биохимия рыб. Липиды. Л.: Наука, 1983. 240 с.
Сидоров В.С., Лизенко Е.И., Болгова О.М., Нефедова З.А. Липиды рыб. 1. Методы анализа. Тканевая специфичность ряпушки Coregonus albula L. // Лососевые (Salmonidae) Карелии. Петрозаводск: Карел. Фил. АН СССР, 1972. Вып. 1. С. 152–163.
Цыганов Э.П. Метод прямого метилирования липидов после ТСХ без элюирования с силикагелем // Лаб. дело. 1971. № 8. С. 490–493.
Юнева T.B., Шульман Г.Е., Чебанов H.A., Щепкина А.М., Виленская Н.И., Маркевич Н.Б. Связь содержания докозагексаеновой кислоты в теле производителей с выживаемостью икры и предличинок горбуши // Биол. науки. 1990. № 10. С. 85–89.
Arduini A., Peschechera A., Dottori S. et al. High performance liquid chromatography of long-chain acylcarnitine and phospholipids in fatty acid turnover studies // J. Lipid Res. 1996. V. 37. № 2. P. 684–689.
Arts M.T., Kohler C.C. Health and conditions in fish: the influence of lipids on membrane competency and immune response // Lipids in Aquatic Ecosystems / Eds. Arts M.T., Brett M.T., Kainz M.J. Dordrecht; Heidelberg; London, New York: Springer, 2009. P. 237–257.
Bell J.G., Henderson R.J., Tocher D.R., McGhee F., Dick J.R., Porter A., Smullen R.P., Sargent J.R. Substituting fishoil with crude palm oil in the diet of Atlantic salmon (Salmo salar) affects muscle fatty acid composition andhepatic fatty acid metabolism // J. Nutr. 2002. № 132. P. 222–230.
Bystriansky J.S., Ballantyne J.S. Gill Na+-K+-ATPase activity correlates with basolateral membrane lipid composition in seawater but not freshwater-acclimated Arctic charr (Salvelinus alpines) // Am. J. Physiol. Regul. Integr. Comp. Physiol. 2007. V. 292. № 2. P. R1043–R1051.
Conceicao L. Success Factors for Fish Larval Production. Oxford: John Wiley & Sons, 2018. 512 p.
Dantagnan H., Borquez A.S., Valdebenito I.N., Salgado I.A., Serrano E.A., Izquierdo M.S. Lipid and fatty acid composition during embryo and larval development of puye Galaxias maculatus Jenyns, 1842, obtained from estuarine, freshwater and cultured populations // J. Fish Biol. 2007. № 70. P. 770–781.
Engelbrecht F.M., Mari F., Anderson J.T. Cholesterol determination in serum. A rapid direction method // S.A. Med. J. 1974. V. 48. № 7. P. 250–356.
Folch J., Lees M., Sloan-Syanley G.H. A simple method for the isolation and purification of total lipids from animal tissue (for brain, liver and muscle) // J. Biol. Chem. 1957. V. 226. P. 497–509.
Hochachka P.W., Somero G.N. Biochemical Adaptation: Mechanism and Process in Physiological Evolution. Oxford University Press: Oxford, NY, USA. 2002. 480 p.
Puskas L.G., Bereczki E., Santha M., Vigh L., Spener F., Ferdinanddy P., Onochy A., Kitajka K. Cholesterol and cholesterol plus DHA diet-induced gene expression and fatty acid changes in mouse eye and brain // Biochimie. 2004. V. 86. № 11. P. 817–824.
Sargent J.R. Origins and functions of egg lipids: Nutritional implications // Broodstock Management and Egg and Larval Quality / Eds. Bromage N.R., Roberts R.J. Oxford: Blackwell Science, 1995. P. 353–372.
Tocher D.R. Metabolism and functions of lipids and fatty acids in teleost fish // Rew. Fish. Sci. 2003. V. 11. № 2. P. 107–184.
Walch D.E., Banasik O.J., Gilles K.A. Thin-layer chromatographic separation and colorimetric analysis of barley or malt lipid classes and their fatty acids // Chromatography. 1965. V. 17. № 2. P. 78–85.
Wiegand M.D. Composition, accumulation and utilization of yolk lipids in teleost fish // Rev. Fish Biol. Fish. 1996. № 6. P. 259–286.
Дополнительные материалы отсутствуют.