Онтогенез, 2020, T. 51, № 6, стр. 450-459
Взаимосвязь голоплоидного содержания ДНК с жизненной формой и продолжительностью жизненного цикла растений
Н. Ф. Лунькова a, Н. В. Жуковская a, В. Б. Иванов a, *
a Федеральное государственное бюджетное учреждение науки Институт физиологии растений им. К.А. Тимирязева Российской академии наук
127276 Москва, Ботаническая улица, 35, Россия
* E-mail: ivanov_vb@mail.ru
Поступила в редакцию 18.06.2020
После доработки 30.06.2020
Принята к публикации 04.07.2020
Аннотация
Величина генома является одним из важных эндогенных факторов, определяющих особенности роста и развития растений. Голоплоидное содержание ДНК (C-value) у растений варьирует в очень широких пределах. В статье анализируется новая база данных по голоплоидному содержанию ДНК у разных видов покрытосеменных, опубликованная в интернете Ботаническим садом Кью (Лондон, Англия), где собраны данные для 10 770 видов покрытосеменных растений (6633 видов двудольных и 4006 видов однодольных), что превышает предыдущие выпуски этой базы. Показаны четкие различия по голоплоидному содержанию ДНК между разными жизненными формами и проанализированы корреляции между C-value и скоростями прохождения жизненного цикла и другими процессами. Данные корреляции не являются однозначными и зависят от сложного сочетания разных факторов, таких как происхождение, климатические условия и др.
ВВЕДЕНИЕ
Термин “голоплоидное содержание ДНК” (от греческого holos – полный) обозначает содержание ядерной ДНК в нереплицированном гаплоидном наборе хромосом. Такое же значение имеют термины C-value (или 1C), при этом символ “С” образован от слова constant – постоянный, что подчеркивает постоянство содержания ядерной ДНК в разных тканях организма. Кроме 1С возможно использование и других префиксов – 2С, 3С и т.д. Так, 2С обозначает содержание ДНК в нередуцированном нереплицированном наборе хромосом (2n). Однако термины “голоплоидный размер генома” или “голоплоидное содержание ДНК” соответствуют термину “C-value” (или 1C) (Bennett, Smith, 1976; Greilhuber et al., 2005; Шереметьев и др., 2011).
Голоплоидное содержание ДНК у покрытосеменных растений варьирует в очень широких пределах: от 0.065 пг у Genlisea aurea (Fleischmann et al., 2014) до 152.23 пг у Paris japonica (Pellicer et al., 2010). Еще больший разброс данных по голоплоидному содержанию ДНК обнаруживается в целом у эукариот: от 0.009 пг у Saccharomyces cerevisiae до 700 пг у Amoeba dubia (Leitch et al., 1998; Gregory, 2005). Несмотря на такой огромный разброс значений C-value, не прослеживается в целом четкой корреляции между фенотипической сложностью организма, его таксономическим положением и C-value. Это явление получило название C-value paradox (Thomas, 1971; Gregory, 2001). Значения C-value могут значительно отличаться у растений не только из разных семейств, но и в пределах одного семейства и даже рода. Так, например, два подрода Genlisea отличаются друг от друга по значениям C-value в 20 раз (Fleischmann et al., 2014). Тем не менее, некоторые исследования подтверждают наличие корреляции между C‑value и различными морфологическими и физиологическими признаками (Greilhuber, Leitch, 2012). Показана взаимосвязь между значением C‑value и размером меристематических и закончивших рост клеток в листьях (Beaulieu et al., 2008) и корнях (Simova, Herben, 2012; Жуковская и др., 2016), скоростью роста корней проростков (Gruner et al., 2010), размером и массой семян (Beaulieu et al., 2007), размером пыльцевых зерен (Beaulieu et al., 2008), длительностью митотического цикла в корнях (Van’t Hof, Sparrow 1963; Van’t Hof, 1967; Evans, Rees, 1971; Evans et al., 1972; Olszewska et al., 1990; Иванов, 1987, 2011; Francis et. al., 2008), продолжительностью жизненного цикла (Bennett, 1972; Bennett, Smith, 1976; Иванов, 1978; Ivanov, 2010; Bennett and Leitch, 2011; Fleischmann et al., 2014), жизненной формой и распространением по климатическим зонам (Ohri, 2005; Шереметьев и др., 2011).
МАТЕРИАЛЫ И МЕТОДЫ
В базе данных “Plant DNA C-values Database” of Kew Royal Botanical Gardens (Leitch et al., 2019) собрана информация о значении C-value и продолжительности жизненного цикла 10 770 видов покрытосеменных растений (6633 видов двудольных и 4006 видов однодольных), что превышает предыдущие выпуски этой базы. В данной статье был проведен анализ значений C-value у следующих жизненных форм растений: деревья, лианы, кустарники, полукустарники, пальмы, травы. Среди трав отдельно изучали однодольные и двудольные, а по длительности жизненного цикла выделяли следующие группы: эфемеры, однолетние и многолетние. Отдельно анализировали двулетние травы, а также такие травы, у которых длительность жизненного цикла меняется в зависимости от условий, и они могут быть одно- или двулетними, одно- или многолетними, дву- или многолетними. Среди однодольных трав выделяли для анализа лилиоиды. Также отдельно рассматривали группу растений паразитов.
Данные обработаны в программах MS Excel 2007 и SigmaPlot 13.0 и представлены как средние значения и их стандартные ошибки.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
В табл. 1 приведены средние, минимальные и максимальные значения C-value у однодольных и двудольных растений разных жизненных форм для данного числа видов. Оказалось, что наименьшее среднее значение C-value у деревьев (1.16 пг). У лиан и кустарников оно несколько выше. У полукустарников и двудольных трав средние значения C-value примерно в 2.5 раза, а у однодольных трав почти в 8.5 раз выше, чем у деревьев. У пальм среднее значение C-value ниже, чем у травянистых однодольных. Наиболее высокие значения C-value обнаружены у группы растений паразитов. То, что среднее значение C-value у деревьев меньше, чем у трав, было показано ранее, но на гораздо меньшем числе видов (Ohri, 2005; Шереметьев и др., 2011; Гамалей, 2014; Иванов, 2014). Интересно отметить, что такая же закономерность выявляется даже в пределах одного семейства, что было показано на примере семейства Fabaceae (Ohri, 2005), а также на целом ряде других семейств (Гамалей, Шереметьев, 2012; Шереметьев, Чеботарева, 2018), в которых были сопоставлены значения C-value древесных и травянистых форм. Шереметьев и Чеботарева (2018) также отмечали наибольший размер генома у трав в сравнении с кустарниками и деревьями. Эти авторы проанализировали индекс травянистости у неформальных групп филогенетической системы APG III (таксономическая система классификации цветковых растений), а также показали корреляцию между возрастом вершинных неформальных групп и размером их геномов. На основании полученных результатов было выдвинуто предположение, что может существовать связь между систематическим положением растений и размером геномов, однако на данном этапе накопленных знаний такой корреляции не выявляется. В то же время подчеркивается, что связь между размером генома прослеживается в большей степени не с систематическим положением группы, а составом ее жизненных форм. Также показано, что размер геномов увеличивается по мере увеличения вклада трав в таксономическое разнообразие. В этой работе развито представление, что увеличение C-value в ходе эволюции связано с изменением спектра жизненных форм – возникновением и дальнейшей экспансией трав, у которых размер генома значительно больше, чем у деревьев. Увеличение размера генома имело адаптогенное значение и позволило значительно повысить функциональную активность важнейших процессов, что было показано на разных примерах. Травы получили возможность более широкого расселения и большей приспособляемости к внешним условиям. Таким образом, увеличение размера генома было необходимо для формирования биологического разнообразия, связанного с распространением трав в условиях меняющегося климата Земли. В нашу задачу не входил более детальный анализ этих проблем. Можно, однако, отметить, что корреляции между размерами генома и экологией в современное время не столь однозначны. Например, лилиоиды с очень большими геномами могут иметь узкие ареалы, а некоторые виды из других семейств, например, крестоцветных, с малыми геномами успешно растут в разнообразных условиях.
Таблица 1.
Среднее, минимальное, максимальное значение C-value и число видов у однодольных и двудольных растений разных жизненных форм
| Группы растений | C-value среднее, пг | C-value min, пг | C-value max, пг | Число видов |
|---|---|---|---|---|
| Двудольные | ||||
| Деревья | 1.16 ± 0.06 | 0.19 | 35.11 | 1035 |
| Лианы | 1.84 ± 0.24 | 0.21 | 15.8 | 126 |
| Кустарники | 1.68 ± 0.07 | 0.19 | 18.32 | 872 |
| Полукустарники | 3.1 ± 0.79 | 0.24 | 15.0 | 25 |
| Травы | 2.82 ± 0.05 | 0.07 | 44.6 | 4436 |
| Паразиты | 14.23 ± 2.11 | 0.58 | 102.9 | 71 |
| Однодольные | ||||
| Пальмы | 3.49 ± 0.30 | 0.76 | 30 | 119 |
| Травы | 9.77 ± 0.2 | 0.2 | 152.2 | 3872 |
В нашей работе показано, что у трав по мере увеличения длительности жизненного цикла в ряду эфемеры – однолетние – многолетние возрастает голоплоидное содержание ДНК (табл. 2). При этом стоит отметить, что C-value у однодольных трав выше, чем у двудольных. Особенно резко отличается группа лилиоидов, у которых среднее значение C-value в 3.5 раза выше, чем у остальных однодольных многолетних трав. Однако двулетние травы, а также виды трав, которые могут иметь разную продолжительность жизненного цикла (одно- и двулетние, одно- и многолетние, дву- и многолетние) имеют средние значения C-value даже ниже, чем у однолетних (табл. 2 и 3). Эта закономерность показана на небольшом числе видов как у двудольных, так и у однодольных трав и свидетельствует о непростом характере зависимости длительности жизненного цикла от голоплоидного содержания ДНК. Увеличение длительности жизненного цикла с возрастанием C-value, показанное в данной работе в ряду эфемеры – однолетние – многолетние травы, а также продемонстрированное в работах (Bennett, 1972, Иванов, 1978, 2014), согласуется с теорией о том, что голоплоидное содержание ДНК коррелирует с минимальной продолжительностью жизненного цикла (Bennett, 1972). Однако, представление о том, что увеличение длительности жизненного цикла коррелирует с увеличением голоплоидного содержания ДНК расходится с данными по значению C-value и продолжительности жизненного цикла у деревьев и кустарников в сравнении с травами. Есть предположение, что более низкое голоплоидное содержание ДНК наряду с более длительным жизненным циклом у деревьев и кустарников по сравнению с травами может быть связано с более ранним происхождением деревьев, когда климат на Земле был более теплый и влажный. Происхождение трав в период с менее благоприятными климатическими условиями сопровождалось увеличением голоплоидного содержания ДНК (Шереметьев и др., 2011; Гамалей, Шереметьев, 2012; Гамалей, 2014). Это представление согласуется с тем, что у растений, произрастающих в условиях более теплого климата, значения C-value ниже, чем у растений из более северных регионов (Bennett, 1976; Grime et al., 1985). Результаты анализа значений C-value у видов орхидей из умеренного климата и более южных тропических видов (табл. 4) также подтверждают эту теорию. У более северных видов орхидей среднее значение C-value немногим более, чем в 2 раза выше, чем у южных видов. Однако у деревьев такая закономерность не прослеживается (табл. 5). У видов деревьев умеренного климата среднее значение C-value почти на 20% ниже, чем у южных. Этот факт требует дальнейшего исследования, хотя отчасти полученные данные могут быть связаны с маленьким числом изученных видов деревьев умеренного климата.
Таблица 2.
Среднее, минимальное, максимальное значение C-value и число видов у однодольных и двудольных трав с разной продолжительностью жизненного цикла, исключая двулетние виды и виды, у которых длительность жизненного цикла может меняться
| Группы трав | C-value среднее, пг |
C-value min, пг | C-value max, пг | Число видов |
|---|---|---|---|---|
| Двудольные | ||||
| Эфемеры | 1.05 ± 0.20 | 0.16 | 2.3 | 15 |
| Однолетние травы | 2.27 ± 0.08 | 0.12 | 27.4 | 944 |
| Многолетние травы | 3.15 ± 0.07 | 0.07 | 44.6 | 3039 |
| Однодольные | ||||
| Эфемеры | 4.72 ± 1.78 | 1.2 | 11.3 | 5 |
| Однолетние травы | 5.57 ± 0.29 | 0.28 | 26 | 283 |
| Многолетние травы без лилиоидов | 5.65 ± 0.14 | 0.2 | 49.9 | 2400 |
| Лилиоиды | 20.15 ± 0.52 | 0.35 | 152.2 | 1110 |
Таблица 3.
Среднее, минимальное, максимальное значение C-value и число видов у однодольных и двудольных трав с продолжительностью жизненного цикла два года и с меняющейся продолжительностью жизненного цикла
| Группы трав | C-value среднее, пг | C-value min, пг | C-value max, пг | Число видов |
|---|---|---|---|---|
| Двудольные травы | ||||
| Одно- и двулетние | 2.22 ± 0.27 | 0.21 | 10.6 | 61 |
| Двулетние | 1.76 ± 0.18 | 0.2 | 8.98 | 100 |
| Одно- и многолетние | 1.53 ± 0.13 | 0.17 | 7.32 | 103 |
| Дву- и многолетние | 2.14 ± 0.43 | 0.35 | 8.66 | 27 |
| Однодольные травы | ||||
| Одно- и двулетние | 1.88 ± 0.62 | 0.5 | 4.3 | 6 |
| Двулетние | 1.56 ± 1.16 | 0.4 | 2.72 | 2 |
| Одно- и многолетние | 5.12 ± 0.94 | 0.93 | 16.1 | 19 |
| Дву- и многолетние | 0.69 ± 0.08 | 0.46 | 0.8 | 4 |
Таблица 4.
Среднее, минимальное, максимальное значение C-value и число видов у орхидей из умеренного и тропического климата
| C-value, пг | Орхидеи | |
|---|---|---|
| умеренного климата | тропического климата | |
| Среднее | 13.21 ± 2.63 | 5.87 ± 0.39 |
| Минимум | 2.89 | 0.38 |
| Максимум | 37.4 | 44.84 |
| Число видов | 15 | 410 |
Таблица 5.
Среднее, минимальное, максимальное значение C-value и число видов у деревьев из умеренного и тропического климата
| C-value, пг | Деревья | |
|---|---|---|
| умеренного климата | тропического климата | |
| Среднее | 0.94 ± 0.11 | 1.17 ± 0.06 |
| Минимум | 0.33 | 0.19 |
| Максимум | 3.4 | 35.11 |
| Число видов | 41 | 994 |
Интересно, что у промежуточных между деревьями и травами форм растений – кустарников и древесных лиан средние значения C-value занимают промежуточное положение между средними значениями C-value у деревьев и трав. У полукустарников, которые по форме скорее ближе к травам, средние значения C-value немного выше, чем у однолетних и ниже, чем у многолетних двудольных трав, а у пальм, которые являются крупными формами однодольных, средние значения C-value ниже, чем у малых травянистых форм однодольных (табл. 1). У паразитов, у которых идет упрощение ряда функций, средние значения C‑value (14.23 пг) гораздо выше, чем у всех остальных изученных групп растений, кроме лилиоидов.
На рис. 1 и 2 представлены гистограммы распределения числа видов разных жизненных форм растений в зависимости от значений C-value отдельно для однодольных и двудольных. Для трав данная зависимость рассматривалась отдельно для однолетних и многолетних видов, а у однодольных выделяли еще группу лилиоидов.
Рис. 1.
Распределение числа видов у разных жизненных форм двудольных в зависимости от значений C-value: деревья (а), лианы (б), кустарники (в), полукустарники (г), паразиты (д), однолетние (е) и многолетние (ж) травы.
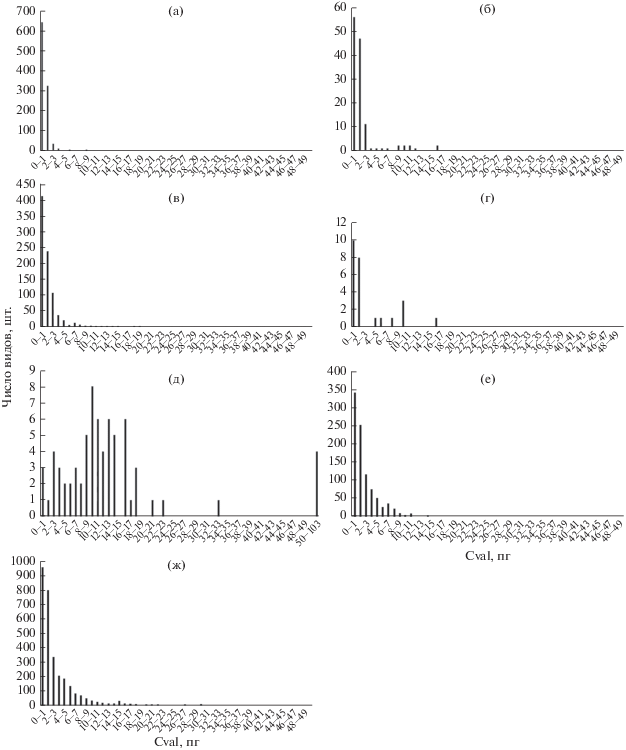
Рис. 2.
Распределение числа видов однодольных в зависимости от значений C-value: однолетние (а) и многолетние травы без лилиоидов (б), пальмы (в), лилиоиды (г). (Примечание – на рис. 2г в последнем столбике сгруппировано число видов со значением C-value от 50 до 153 пг.)
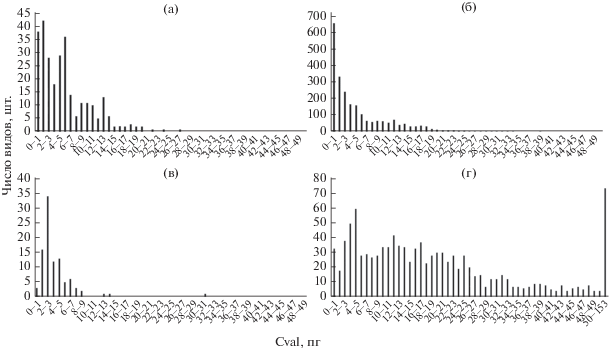
Число видов деревьев, имеющих значение C‑value менее 2 пг, составляет 93.6% от всех изученных деревьев (рис. 1а). Далее в ряду деревья – лианы – кустарники – полукустарники – травы можно проследить увеличение доли видов с возрастанием значений C-value по мере продвижения по данному ряду жизненных форм по сравнению с деревьями (рис. 1а–1г, 1е, 1ж). При этом у всех двудольных, кроме паразитов, наибольшее число видов обладает значением C-value меньше 1 пг. Среди изученных однодольных наибольшее число видов со значением C-value меньше 1 пг наблюдается только в группе многолетних трав без учета лилиоидов (рис. 2б). У однодольных однолетних трав наибольшее число видов имеет значение C-value 1–2 пг (рис. 2а), у пальм 2–3 пг (рис. 2в), у лилиоидов 4–5 пг (рис. 2г). Пределы значений C-value, выше которых уже нет однолетних видов трав для однодольных 26 пг и для двудольных 27.4 пг (табл. 2) совпадают с обозначенными в работе (Ivanov, 2010). Общая тенденция у всех групп растений, кроме паразитов, в том, что наибольшее число видов обладает меньшим значением C-value. Стоит отметить, что у лилиоидов, которые не являются отдельной жизненной формой растений, а лишь частью группы однодольных многолетних трав распределение числа видов примерно одинаковое до 25 пг, в отличие от других групп растений.
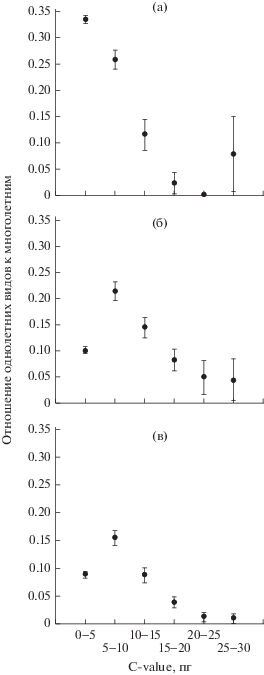
При изучении отношения числа однолетних трав к числу многолетних в зависимости от значений C-value показано, что у двудольных наибольшая доля однолетних видов сосредоточена при C‑value до 5 пг (рис. 3а), при этом отношение числа однолетних трав к числу многолетних составляет 0.34. При дальнейшем увеличении значений C-value доля однолетних падает. У однодольных доля однолетних видов максимальна при значениях C-value 5–10 пг (рис. 3б, 3в), а отношение числа однолетних трав к числу многолетних без учета лилиоидов составляет 0.21 и с учетом лилиоидов 0.15. Таким образом, у однодольных доля однолетних видов сначала увеличивается, а затем падает по мере увеличения значений C-value. Такой характер распределения доли однолетних видов у двудольных и однодольных представляет большой интерес и свидетельствует о том, что минимальная продолжительность жизненного цикла не всегда связана с меньшим содержанием C‑value. Сложность зависимости минимальной продолжительности жизненного цикла от голоплоидного содержания ДНК подтверждается также данными, опубликованными в работе (Иванов, 2014) о том, что у многолетников, зацветающих в 1 и 2 год жизни средние значения C-value ниже, чем у многолетников, зацветающих позже 2 лет. Это показано как для двудольных, так и для однодольных видов.
Рис. 3.
Отношение числа однолетних видов к многолетним у двудольных (a) и однодольных без лилиоидов (б) и с лилиоидами (в).
В данной статье более подробно были проанализированы два семейства из двудольных (Asteraceae и Fabaceae) и одно семейство из однодольных (Poaceae). В каждом из этих семейств отобрали такие рода, в которых есть и однолетние и многолетние виды, и посчитали среднее значение C‑value отдельно у однолетних и многолетних видов в каждом роду. При сопоставлении между собой средних значений C-value у однолетних и многолетних видов по каждому роду оказалось, что в большинстве случаев у многолетних видов среднее значение C-value больше, чем у однолетних, но все же для некоторых родов эта закономерность не соблюдалась (табл. 6–8). Это также является свидетельством того, что взаимосвязь между голоплоидным содержанием ДНК и многолетностью непростая.
Таблица 6.
Среднее значение C-value и число однолетних и многолетних видов в отдельных родах семейства Asteraceae
| Род | Однолетние виды | Многолетние виды | ||
|---|---|---|---|---|
| C-value среднее, пг | число видов | C-value среднее, пг | число видов | |
| Agoseris | 1.1 | 1 | 2.9 | 3 |
| Ambrosia | 1.55 | 2 | 2.78 | 3 |
| Anacyclus | 5.80 | 3 | 6.20 | 1 |
| Andryala | 1.59 | 1 | 1.89 | 4 |
| Anthemis | 5.21 | 6 | 6.60 | 3 |
| Artemisia | 3.62 | 4 | 5.46 | 99 |
| Aster | 3.00 | 1 | 3.49 | 10 |
| Bellis | 1.44 | 1 | 1.81 | 2 |
| Calendula | 1.83 | 3 | 1.40 | 3 |
| Carduus | 4.30 | 1 | 1.83 | 3 |
| Centaurea | 0.96 | 4 | 1.46 | 59 |
| Chamaemelum | 4.50 | 2 | 5.3 | 1 |
| Chrysanthemum | 8.49 | 4 | 6.74 | 16 |
| Coreopsis | 1.60 | 1 | 2.59 | 3 |
| Cosmos | 2.25 | 2 | 7.34 | 1 |
| Crepis | 2.83 | 15 | 4.55 | 31 |
| Cyanus | 0.74 | 1 | 1.61 | 13 |
| Echinops | 1.59 | 2 | 4.12 | 35 |
| Guizotia | 2.73 | 3 | 3.37 | 3 |
| Haplopappus | 1.53 | 3 | 2.10 | 2 |
| Helianthus | 4.94 | 13 | 6.39 | 10 |
| Hypochaeris | 1.60 | 4 | 2.11 | 9 |
| Inula | 0.91 | 1 | 1.57 | 8 |
| Krigia | 1.50 | 1 | 2.67 | 1 |
| Lactuca | 2.22 | 3 | 3.02 | 10 |
| Leontodon | 0.40 | 1 | 1.26 | 7 |
| Leucanthemum | 7.50 | 2 | 12.30 | 13 |
| Melampodium | 1.67 | 17 | 3.38 | 4 |
| Microseris | 1.53 | 4 | 3.85 | 6 |
| Reichardia | 1.5 | 1 | 2.04 | 8 |
| Senecio | 3.77 | 20 | 6.52 | 61 |
| Sonchus | 1.15 | 2 | 1.59 | 12 |
| Tolpis | 2.9 | 1 | 1.41 | 6 |
Таблица 7.
Среднее значение C-value и число однолетних и многолетних видов в отдельных родах семейства Fabaceae
| Род | Однолетние виды | Многолетние виды | ||
|---|---|---|---|---|
| C-value среднее, пг | число видов | C-value среднее, пг | число видов | |
| Arachis | 2.52 | 6 | 3.30 | 9 |
| Astragalus | 0.58 | 2 | 1.79 | 24 |
| Cicer | 1.2 | 7 | 1.36 | 1 |
| Crotalaria | 1.15 | 4 | 1.13 | 3 |
| Lathyrus | 6.87 | 33 | 8.76 | 33 |
| Lotus | 0.64 | 12 | 0.73 | 28 |
| Lupinus | 0.71 | 25 | 0.86 | 20 |
| Medicago | 0.61 | 9 | 1.28 | 7 |
| Phaseolus | 0.96 | 5 | 0.70 | 24 |
| Rhynchosia | 1.20 | 1 | 1.28 | 2 |
| Tephrosia | 1 | 3 | 2.55 | 2 |
| Trifolium | 1.11 | 8 | 1.92 | 6 |
| Vicia | 5.65 | 59 | 5.81 | 24 |
| Vigna | 0.62 | 9 | 0.78 | 6 |
Таблица 8.
Среднее значение C-value и число однолетних и многолетних видов в отдельных родах семейства Poaceae
| Род | Однолетние виды | Многолетние виды | ||
|---|---|---|---|---|
| C-value среднее, пг | число видов | C-value среднее, пг | число видов | |
| Agrostis | 2.19 | 2 | 4.73 | 17 |
| Alopecurus | 5.80 | 1 | 11.47 | 3 |
| Anthoxanthum | 6.49 | 2 | 7.48 | 5 |
| Avena | 7.65 | 31 | 10.89 | 1 |
| Brachypodium | 0.41 | 3 | 0.60 | 8 |
| Briza | 4.93 | 3 | 6.84 | 5 |
| Bromus | 7.76 | 29 | 8.47 | 32 |
| Cenchrus | 4.08 | 2 | 1.63 | 2 |
| Dasypyrum | 5.07 | 1 | 10.50 | 1 |
| Digitaria | 1.24 | 8 | 0.62 | 1 |
| Eleusine | 1.50 | 6 | 2.22 | 5 |
| Eragrostis | 0.72 | 2 | 1.15 | 1 |
| Hordeum | 8.16 | 19 | 7.59 | 31 |
| Lachnagrostis | 6.74 | 1 | 10.78 | 8 |
| Lolium | 2.66 | 5 | 4.10 | 4 |
| Milium | 4.00 | 2 | 3.90 | 1 |
| Oryza | 0.59 | 3 | 0.80 | 7 |
| Panicum | 1.36 | 6 | 1.93 | 3 |
| Pennisetum | 2.52 | 6 | 2.18 | 10 |
| Phalaris | 2.97 | 6 | 4.16 | 7 |
| Poa | 2.05 | 2 | 3.75 | 39 |
| Secale | 8.07 | 3 | 7.80 | 2 |
| Setaria | 1.30 | 5 | 1.70 | 6 |
| Sorghum | 2.64 | 25 | 3.11 | 7 |
| Vulpia | 2.30 | 1 | 4.23 | 4 |
| Zea | 3.65 | 2 | 3.95 | 2 |
Уже давно обсуждается то, что с увеличением C-value наблюдается замедление развития (Иванов, 1978). В нашей работе показано, что у лилиоидов, обладающих признаками замедления развития (медленным прорастанием, поздним зацветанием, длительным мейозом) (Иванов, 2014), наибольшее среднее значение C-value (20.15 пг) не только из всех однодольных трав, но вообще из всех изученных групп покрытосеменных растений (табл. 1 и 2). Кроме того, к группе лилиоидов относится растение Paris japonica Franchet, имеющее самое большое значение C-value (152.23 пг) из всех изученных на данный момент растений (Pellicer et al., 2010). Характерной особенностью распределения числа лилиоидов в зависимости от значений C-value является то, что нет резкого пика числа видов с минимальным значением C-value, а само распределение более плавное, чем у остальных многолетних однодольных. У лилиоидов часто большие размеры меристем. Это обеспечивает им возможность быстрого роста весной, так как скорость роста зависит от числа клеток и продолжительности цикла. Однако то, что у лилиоидов нет однолетних видов даже при низких значениях C-value так же свидетельствует о том, что связь между голоплоидным содержанием ДНК и многолетностью не прямая.
ЗАКЛЮЧЕНИЕ
На основании анализа последнего выпуска базы данных ботанического сада Кью в нашей работе показаны особенности распределения числа видов однодольных и двудольных растений разных жизненных форм, а также однолетних и многолетних трав в зависимости от значений C-value. С незначительными отличиями они во многом сходятся с показанными ранее на значительно меньшем числе видов в работах (Ivanov, 2010; Шереметьев и др., 2011; Шереметьев, Чеботарева 2018). Из приведенных результатов ясно, что сравнение средних значений C-value и длительности жизненного цикла недостаточно, чтобы решить вопрос о связи между C-value и жизненной формой растения. Можно предположить, что увеличение C-value приводит к замедлению развития, что четко прослеживается у лилиоидов, среди которых нет однолетних видов, однако изучение отдельных родов у семейств Asteraceae, Fabaceae и Poaceae показало, что для некоторых родов среднее значение C-value у однолетних видов было больше, чем у многолетних. Таким образом, механизм этой зависимости далеко неясен и требует дальнейшего изучения.
Список литературы
Гамалей Ю.В. Растительные формы палеогена и неогена // Труды IX Международной конференции по экологической морфологии растений, посвященной памяти Ивана Григорьевича и Татьяны Ивановны Серебряковых. 2014. С. 129–132.
Гамалей Ю.В., Шереметьев С.Н. Направления эволюции генома наземных и вторично-водных трав // Цитология. 2012. Т. 54. № 6. С. 449–458.
Жуковская Н.В., Быстрова Е.И., Иванов В.Б. Зависимость размеров меристематических и закончивших рост клеток от содержания ДНК в расчете на гаплоидное число хромосом // Онтогенез. 2016. Т. 47. № 6. С. 346–356.
Иванов В.Б. Содержание ДНК в ядре и скорость развития растений // Онтогенез. 1978. Т. 9. С. 39–53.
Иванов В.Б. Клеточные механизмы роста растений. М.: Наука, 2011. 104 с.
Иванов В.Б. Корреляция между содержанием ДНК в геноме и жизненной формой растений // Труды IX Международной конференции по экологической морфологии растений, посвященной памяти Ивана Григорьевича и Татьяны Ивановны Серебряковых. 2014. С. 203–206.
Шереметьев С.Н., Гамалей Ю.В., Слемнев Н.Н. Направления эволюции генома покрытосеменных // Цитология. 2011. Т. 53. С. 295–312.
Шереметьев С.Н., Чеботарева К.Е. Современная и мел-кайнозойская диверсификация покрытосеменных // Журн. общей биологии. 2018. Т. 79. № 1. С. 28–54.
Beaulieu J.M., Moles A.T., Leitch I.J., Bennett M.D., Dickie J.B., Knight C.A. Correlated evolution of genome size and seed mass // New Phytol. 2007. V. 173. P. 422–437.
Beaulieu J.M., Leitch I.J., Patel S. et al. Genome size is a strong predictor of cell size and stomatal density in angiosperms // New Phytol. 2008. V. 179. P. 975–986.
Bennett M. Nuclear DNA content and minimum generation time // Proc. RL. Soc. Lond. B. 1972. V. 181. P. 109–135.
Bennett M.D., Leitch I.J. Nuclear DNA amounts in angiosperms: targets, trends and tomorrow // Annals Bot. 2011. V. 107. P. 467–590.
Bennett M.D., Smith J.B. Nuclear DNA amounts in angiosperms // Philosophical Transactions of the Royal Society of London Series B: Biological Sciences. 1976. V. 274. P. 227–274.
Evans G.M., Rees H. Mitotic cycles in Dicotyledons and Monocotyledons // Nature. 1971. V. 233. P. 350–351.
Evans G.M., Rees H., Snell C.L. et al. The relationship between nuclear DNA amount and time duration of the mitotic cycle // Chromosome Today. 1972. V. 3. P. 24–31.
Fleischmann A., Michael T.P., Rivadavia F. et al. Evolution of genome size and chromosome number in the carnivorous plant genus Genlisea (Lentibulariaceae), with a new estimate of the minimum genome size in angiosperms // Annals Bot. 2014. V. 114. P. 1651–1663.
Francis D., Davies M.S., Barlow P.W. A strong nucleotypic effect on the cell cycle regardless of ploidy level // Annals Bot. 2008. V. 101. P. 747–757.
Gregory T.R. Coincidence, coevolution, or causation? DNA content, cell size, and the C-value enigma // Biol. Rev. 2001. V. 76. P. 65–101.
Gregory T.R. The C-value enigma in plants and animals: a review of parallels and an appeal for partnership // Annals Bot. 2005. V. 95. P. 133–146.
Greilhuber J., Doležel J., Lysák M.A. et al. The origin, evolution and proposed stabilization of the terms ‘Genome Size’ and ‘C-Value’ to describe nuclear DNA contents // Annals Bot. 2005. V. 95. P. 255–260.
Greilhuber J., Leitch I.J. Plant Genome Diversity. Vol. 2: Physical Structure, Behaviour and Evolution of Plant Genomes. Springer, 2012. 352 p.
Grime J.P., Shacklock M.L., Band S.R. Nuclear DNA contents, shoot phenology and species co-existence in a limestone grassland community // New Phytol. 1985. V. 100. № 3. P. 435–445.
Gruner A., Howerter N., Smith T. et al. Genome size is a strong predictor of root meristem growth rate // J. Botany. 2010. P. 1–4.
Ivanov V.B. Ambiguous dependence of minimal plant generation time on nuclear DNA content // Nat. Preced. 2010. https://doi.org/10.1038/npre.2010.4943.1
Leitch I.J., Chase M.W., Bennett M.D. Phylogenetic analysis of DNA C-values provides evidence for a small ancestral genome size in flowering plants // Annals Bot. 1998. V. 82. P. 85–94.
Leitch I.J, Johnston E., Pellicer J. et al. Plant DNA C-values Database (Release 7.1). 2019. https://cvalues.science.kew.org/.
Ohri O. Climate and Growth Form. The consequences for Genome Size in Plants // Plant Biol. 2005. V. 7. P. 449–458.
Olszewska M.J., Bilecka A., Kuran H. et al. Dry mass and protein increase during interphase as a possible factor regulating the cell cycle duration // Caryologia. 1990. V. 43. P. 43–55.
Pellicer J., Fay M.F., Leitch I.J. The largest eukaryotic genome of them all? // Botanical Journal of the Linnean Society. 2010. V. 164. P. 10–15.
Simova I., Herben T. Geometrical constraints in the scaling relationships between genome size, cell size and cell cycle length in herbaceous plants // Proc. R. Soc. B. 2012. V. 279. P. 867–875.
Thomas C.A. The genetic organization of chromosomes // Ann. Rev. Genet. 1971. P. 237–256.
Van’t Hof J. Studies on the relationships between cell population and growth kinetics of root meristem // Exp. Cell Res. 1967. V. 46. P. 335–347.
Van’t Hof J., Sparrow A.H. A relationship between DNA content, nuclear volume, and minimum mitotic cycle time // PNAS. Proc. Natl. Acad. Sci. USA. 1963. V. 49. P. 897–902.
Дополнительные материалы отсутствуют.


