Онтогенез, 2020, T. 51, № 6, стр. 440-449
Раннее появление признаков старения в ретинальном пигментном эпителии у молодых крыс альбиносов
Ю. П. Новикова a, *, Э. Н. Григорян a, **
a Институт биологии развития им. Н.К. Кольцова РАН
119334 Москва, ул. Вавилова, 26, Россия
* E-mail: info@idbras.ru
** E-mail: leonore@mail.ru
Поступила в редакцию 23.03.2020
После доработки 26.04.2020
Принята к публикации 30.04.2020
Аннотация
Ретинальный пигментный эпителий (РПЭ), чьи основные функции заключаются в прямом участии в световосприятии и обеспечении трофики и функционирования сетчатки глаза, традиционно является предметом многочисленных исследований. Значительная их часть носит биомедицинский характер и направлена на выявление причин старения и дегенерации РПЭ, в свою очередь, ассоциированных с рядом серьезных, приводящих к потере зрения, заболеваний сетчатки. Часто объектом таких исследований служат грызуны, в частности, крыса альбинос (Вистар). Наша работа направлена на выявление признаков старения в РПЭ у молодых (от 2 нед. до 2 мес.) крыс альбиносов. С помощью методов флуоресцентного анализа и окрашивания по методу Шморля, в уже раннем возрасте крыс альбиносов в изолированном слое РПЭ выявлено накопление “пигмента старения” липофусцина, а также высокое содержание полиплоидных двуядерных клеток по отношению к одноядерным клеткам. Параллельно обнаружено наличие липофусцина в подстилающей РПЭ, изолированной сосудистой оболочке (хороиде) сетчатки. Обсуждается взаимосвязь между выявленным в работе ранним появлением признаков старения в РПЭ крыс альбиносов и отсутствием в клетках этой ткани пигмента меланина. Полученные данные рекомендуется учитывать при проведении экспериментальных офтальмологических исследований на этом животном модельном объекте.
ВВЕДЕНИЕ
Ретинальный пигментный эпителий (РПЭ) является монослоем поляризованных и высокоспециализированных пигментированных клеток. РПЭ расположен между нейральной сетчаткой и ее васкулярным слоем, именуемым хороидом, снабжающим сетчатку всеми необходимыми для ее нормальной трофики веществами и кислородом. РПЭ, помимо переноса веществ по базально-апикальному градиенту клеток, выполняет ряд важных функций, необходимых для поддержания гомеостаза и нормального функционирования сетчатки. Хорошо известно, что основной функцией РПЭ является фагоцитоз слущивающихся наружных сегментов фоторецепторов сетчатки, а затем их переваривание с помощью лизосом (Strauss, 2005). Это позволяет фоторецепторам синтезировать новые отростки для световосприятия, обеспечивает жизнеспособность клеток и метаболизм ретиноидов (Young et al., 1971; Mazzoni et al., 2014). Однако осуществить полное переваривание фоторецепторных наружных отростков с помощью лизосомальных ферментов и их полную деградацию клеткам РПЭ не удается, что в результате постепенно и неуклонно с возрастом приводит к аккумуляции липофусцина (ЛФ) (Katz, 1989; Gu et al., 2012). Наружные сегменты фоторецепторных клеток богаты полиненасыщенными жирными кислотами, подверженными воздействию свободных радикалов, в больших количествах находящихся в клетках функционирующей в условиях постоянного облучения светом сетчатки глаза. Полиненасыщенные жирные кислоты в результате переокисления, катализируемого в лизосомах ионами металлов, трансформируются во флуорофоры – обладающие аутофлуоресценцией компоненты ЛФ (Gutteridge et al., 1982; Smith et al., 2016). Предполагается также, что ЛФ в РПЭ представляет собой гетерогенный материал, в состав которого входят также жиры и белки, а флуоресцирующие компоненты различны и основной среди них идентифицирован как дериват витамина А (Kennedy et al., 1995).
В то же время известно, что клетки РПЭ взрослых животных in vivo, если и обладают пролиферативной активностью, то только на очень низком уровне, на периферии слоя (Al-Hussaini et al., 2008; Григорян, 2014). По этой причине весь аккумулируемый ЛФ остается в цитоплазме, и количество его в клетках РПЭ не только не снижается, но, напротив, возрастает. Этот процесс поддается экспериментальному воссозданию при культивировании РПЭ in vitro в условиях оксидативного стресса (Sundelin et al., 2001). Последствиями накопления ЛФ являются дегенерация клеток РПЭ и нарушение функции фоторецепторных отростков. С дегенерацией и дисфункцией РПЭ связаны многие заболевания сетчатки глаза человека. К их числу относится и макулярная дистрофия сетчатки (age-related macular degeneration, AMD), часто приводящая к слепоте (Sparrow et al., 2010).
К связанным с возрастом процессам в РПЭ имеет отношение и возрастание относительного числа многоядерных клеток на фоне снижения общей численности клеток в популяции. Наличие в слое РПЭ одноядерных и полиплоидных, в основном двуядерных клеток является обычным явлением для грызунов (Al-Hussaini et al., 2008). У старых мышей, например, доля многоядерных клеток РПЭ может достигать 80%, и подавляющее их число составляют двуядерные клетки (Chen et al., 2016). Данные Чен и соавторов свидетельствуют также о том, что клетки, становясь двуядерными, значительно увеличиваются в размерах, хотя и сохраняют при этом свою фагоцитарную активность в отношении слущивающихся дисков наружных сегментов фоторецепторов сетчатки. Предполагается, что важную роль в обретении слоем РПЭ многоядерных клеток играет возрастающая, связанная с ростом глаза фагоцитарная нагрузка, нарушающая цитокинез клеток, а многоядерность клеток является неким защитным механизмом для сохранения слоя РПЭ и его основной функции (Chen et al., 2016).
Известно, что развитие дегенеративных процессов в РПЭ часто сопровождается потерей клетками пигмента – меланиновых гранул (см. обзор Rozanowska, 2011). Меланин является полимером высокого молекулярного веса, синтезируется и накапливается в РПЭ в процессе развития и роста глаза. Меланин образуется в результате окисления молекул предшественников – тирозина и дигидроксифенилаланина (ДОФА) и содержится в гранулах, заполняющих цитоплазму клеток РПЭ (Rozanowska, 2011). Важной функцией меланина, находящегося в высокой концентрации в апикальной цитоплазме и апикальных отростках клеток РПЭ, является защита фоторецепторов от избыточного света. Предполагается, что фотозащитная роль меланина в клетках РПЭ обусловлена его способностью связывать редокс-активные ионы металлов (Sarna, 1992). В количественной конкуренции с меланином находится ЛФ – чем больше меланина в клетках РПЭ, тем меньше гранул ЛФ и наоборот (Sundelin et al., 2001).
Альбинизм характеризуется разрушением меланосом, где пигмент синтезируется и откладывается, и/или нарушением процесса синтеза меланина (см. обзор Grønskov et al., 2007; Summers, 2009). Однако РПЭ и нейральная сетчатка грызунов альбиносов используются in vivo (Новикова и др., 2013; Nadal-Nicolás et al., 2014; Iwai et al., 2016) и in vitro (Cortese et al., 2005; Grigoryan et al., 2012) в качестве модели для изучения развития сетчатки глаза и зависимых от возраста процессов, способных вести к дегенерации сетчатки. Для проведения такого рода исследований нужны дополнительные характеристики РПЭ грызунов альбиносов, в частности в отношении наличия и накопления ЛФ, а также развития многоядерности клеток в слое РПЭ, как еще одного зависимого от возраста процесса. В данной работе мы использовали препараты слоя (whole amount) РПЭ крыс альбиносов для изучения этих признаков в возрастном диапазоне от двух недель до двух месяцев после рождения.
МАТЕРИАЛЫ И МЕТОДЫ
Объект исследования
Работа была проведена на РПЭ молодых крыс альбиносов Wistar в возрасте 2 нед., 1 мес. и 2 мес. после рождения. Выбор возраста крыс обусловлен нашим предварительным наблюдением, свидетельствующим о том, что уже спустя 1 мес. после рождения отдельные клетки РПЭ этих животных могут содержать заметное число гранул, обладающих аутофлуоресценцией. В условиях вивария все крысы находились при световом режиме 12 ч свет/темнота и свободном доступе к еде и воде.
Выделение ретинального пигментного эпителия
После анестезии глаза крыс альбиносов в возрасте 2 нед., 1 мес. и 2 мес. были энуклеированы. Для исследования слоя РПЭ использовали (с модификациями) метод его выделения whole amount с применением диссоциирующих сред (Wang et al., 1993).
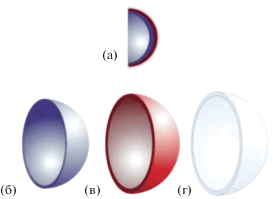
Сразу после выделения глаза помещали в охлажденную среду DMEM и переносили в условия бокса. В среде DMEM глаза освобождали от мышц и соединительной ткани, дважды отмывали в холодном растворе Хенкса без кальция (HBSS, Gibco), содержащем ЭДТА (Хеликон) в концентрации 10 ммол/л, pH 7.4. Далее с помощью бинокуляра глаза разделяли на передний и задний секторы, микрохирургически, делая разрез постериальнее за пределами лимба (рис. 1). Нейральная сетчатка при этом оставалась в составе задней стенки глаза. Затем задние секторы глазных чаш были вновь отмыты три раза в холодном растворе Хенкса с ЭДТА.
Рис. 1.
Схема выделения тканей задней стенки глаза крысы. (а) – задняя стенка глаза, (б) – изоляция нейральной сетчатки, (в) ретинального пигментного эпителия, (г) – остается сосудистая и склеральная оболочки. Подробное описание способа выделения тканей приведено в статье.
Затем задние секторы глаз крыс были инкубированы при 37°С в течение 10–12 мин в растворе Хенкса с ЭДТА, куда были добавлены гиалуронидаза IV типа (220 ед./мл, Merck) и коллагеназа 1 типа (65 ед./мл, производитель ПанЭко). Потом глазные чаши вновь переносили в холодный раствор Хенкса с ЭДТА, где проводили выделение нейральной сетчатки, РПЭ при этом оставался неповрежденным в составе заднего сектора глаза. Задние секторы глаз вновь инкубировали в растворе указанных выше диссоциирующих сред в течение 8 мин при 37°С и переносили в холодный раствор Хенкса с ЭДТА, в котором дважды отмывали от ферментов коллагеназы и гиалуронидазы.
После инкубации в растворе Хенкса с ЭДТА при комнатной температуре (30 мин) для достижения полной отслойки слоя РПЭ от подлежащих тканей, его аккуратно отделяли тонкими стеклянными палочками с запаянным концом (0.3–0.5 мм) по краю, двигаясь в сторону центра глаза, к области выхода зрительного нерва. После отделения РПЭ его забирали пипеткой и осторожно переносили на предметные стекла, которые помещали в широкую чашку Петри в пары формалина для мягкой фиксации ткани РПЭ. Параллельно у крыс двухмесячного возраста удавалось выделить фрагменты подстилающей РПЭ сосудистой оболочки, которые были фиксированы тем же способом.
Фиксированные препараты РПЭ крыс альбиносов разного возраста использовали для дальнейшей гистологической обработки с окрашиванием гематоксилин – эозином, окраски по методу Шморля, а также (минуя гистологическую обработку) для анализа аутофлуоресценции гранул ЛФ на тотальных препаратах РПЭ с помощью флуоресцентного микроскопа. Для окрашивания по методу Шморля применяли дополнительно поперечные парафиновые срезы (7 мкм) задней стенки глаз крыс разного возраста, фиксированной в 4%-ом формалине.
Окрашивание по методу Шморля
После депарафинирования срезы, взятые из экваториальных и центральных областей задней стенки глаза, а также фиксированные фрагменты пластов РПЭ крыс разного возраста трижды промывали в дистиллированной воде. Затем их помещали в свежеприготовленную среду для окрашивания, содержащую 1%-ый хлорид железа (30 мл), гексацианоферрат калия (4 мл) и дистиллированную воду (6 мл). Контроль интенсивности окрашивания проводили с помощью микроскопа в интервале от 5 до 10 мин реакции с красителем. После этого препараты тщательно промывали в проточной воде, обезвоживали, помещали в ксилол, затем заключали в канадский бальзам под покровные стекла.
Анализ флуоресценции липофусциновых гранул
ЛФ – аутофлуоресцирующий пигмент гликолипопротеиновой природы. Для анализа флуоресценции препараты РПЭ через сутки после фиксации тщательно отмывали и заключали в глицерин с добавлением DABCO (Sigma, США) – протектора флуоресценции. Наличие гранул ЛФ проводили методом регистрации их флуоресценции с помощью флуоресцентного микроскопа AxioVev + 200M (Carl Zeiss Jena, Germany). Изображения получали в коротковолновом диапазоне света (488 нм) аргонного лазера (барьерный фильтр 570 нм) и при тождественных других параметрах работы микроскопа. Полученные изображения регистрировали с помощью цифровой камеры и компьютера, оснащенного программой AxioVision LE Rel.4.3.
Количественный анализ содержания ЛФ гранул в РПЭ крыс альбиносов через 2 нед., 1 мес. и 2 мес. после рождения проводили с помощью визуального подсчета числа клеток, содержащих обилие ярко флуоресцирующих гранул относительно общего числа клеток, на 20 полях визуального обзора размером 16 × 104 px на изображениях пластов РПЭ, полученных при 1000-кратных увеличениях микроскопа (Об. 100×, Ок. 10×). Клетки с гранулами слабого свечения на грани идентификации или с незначительным их числом не учитывали. Этим намеренно понижали уровень содержания ЛФ в РПЭ, ставя перед собой задачу – не допустить значительной погрешности подсчетов и дать сравнительную характеристику клеток РПЭ крыс разного возраста по параметру относительного числа флуоресцирующих клеток в слое. Подсчеты проводили на черно-белых изображениях препаратов РПЭ, полученных от обоих глаз 2-х крыс для каждого срока. Cтатистическую обработку данных проводили с помощью программы Excel. Был расчитаны средние значения показателя для каждого возраста, среднеквадратичное отклонение и проведен дисперсионный анализ выборок.
Определение соотношения одноядерных и двуядерных клеток в слое РПЭ
Для этой цели использовали фиксированные парами формалина и окрашенные гематоксилин-эозином препараты РПЭ глаз крыс в возрасте 2 нед., 1 мес. и 2 мес. В подсчетах учитывали только экваториальную область слоя по всей его окружности, периферия и центральная (вокруг головки зрительного нерва) области РПЭ оставались за пределами количественного анализа. Это связано с приведенными в литературе данными, согласно которым у трехмесячных крыс альбиносов Wistar на периферии многие клетки РПЭ часто имеют атипичную морфологию и нечеткие границы (Adams et al., 2010). По нашим наблюдениям в центральной области вблизи головки зрительного нерва морфология и распределение клеток РПЭ были нерегулярными, что также существенно осложняло количественные исследования. По этой причине центральная область была оставлена за пределами наших подсчетов. Подобные изменения отсутствовали в выбранной нами экваториальной области, намного более значительной по размерам области слоя РПЭ (примерное соотношение в мм от крайней периферии к центру: 0.5/1.5/0.5).
Для проведения подсчета клеток гистологические препараты РПЭ исследовали с помощью микроскопа Olympus AH-3, оснащенного цифровой камерой. Для каждого препарата делали серию снимков экваториальной зоны РПЭ. На каждом из полученных изображений брались прямоугольные площадки, на которых проводили подсчет сначала двуядерных, потом одноядерных клеток при помощи программы Image J. После этого определяли отношения числа одноядерных клеток к двуядерным. Затем проводили статистическую обработку данных с помощью программы Excel. Был сделан расчет средних значений показателей для каждого возраста, среднеквадратичных отклонений и дисперсионный анализ выборок для определения достоверности отличий в выборках.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
РПЭ нормального глаза взрослой крысы альбиноса 2-х месячного возраста представляет собой однорядный слой шестигранных клеток, плотно прилежащих друг к другу (рис. 2а). Клетки РПЭ являются одноядерными или двуядерными, а их соотношение зависит от возраста животного (Chen et al., 2016). Большинство клеток РПЭ крыс в возрасте месяц и более имеет два равных по размерам ядра, содержащих обычно 1–2 ядрышка (рис. 3а). Помимо двуядерных клеток, в небольшом относительном числе присутствуют одноядерные клетки, размер ядер которых часто больше, чем у двуядерных клеток (рис. 3б, 3в, 3г). В популяции двуядерных и одноядерных клеток встречались и необычно крупные, имеющие примерно в полтора раза больший диаметр одноядерные клетки. Важно отметить, что цитоплазма клеток РПЭ у крыс альбиносов не содержит меланиновых гранул и имеет равномерное гомогенное светлое окрашивание при использовании гематоксилин-эозина. При сравнении с пигментированным РПЭ мышей C57Bl, взятым нами в качестве дополнительного образца, это отличие очевидно (рис. 4а, 4б). Известно, что основной отличительной чертой РПЭ альбиносов в развитии является не только отсутствие пигмента, но и компонентов его синтеза, участвующих также в регуляции клеточных циклов в сетчатке. Так, например, низкий уровень дегидроксифенилаланина (ДОФА) – предшественника синтеза меланина может оказывать влияние на процесс выхода клеток из цикла, что, в свою очередь, может приводить как к избыточной пролиферации, так и клеточной гибели (Ilia, Jeffery, 1999). С этим явлением некоторые авторы (Adams et al., 2010) связывают частые случаи нарушений цитокинеза и других аномалий в популяции клеток РПЭ, в особенности его периферического отдела, поздно дифференцирующегося в развитии и обладающего хоть и очень низкой, но большей относительно экваториального и центрального отделов слоя, пролиферативной активностью (Al-Hussaini et al., 2008).
Рис. 2.
Поперечный срез задней стенки глаза крысы альбиноса в возрасте 2 мес. (а) – нормальное строение, окраска гематоксилин-эозин (б) – окраска по методу Шморля. Стрелками указана область прилежащих друг к другу окончаний фоторецепторных отростков, ретинального пигментного эпителия и сосудистой оболочки.
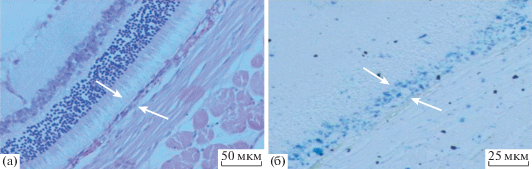
Рис. 3.
Выделенный слой ретинального пигментного эпителия крысы альбиноса в возрасте 2 мес. (а) – общий вид; (б, в, г) – фрагменты при высоких разрешениях микроскопа. Тонкие стрелки – одноядерные клетки; толстые стрелки – клетки, имеющие крупные овальные ядра.
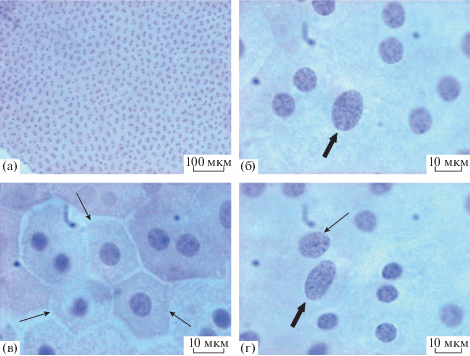
Эта особенность – отсутствие гранул меланина (или, возможно, крайне низкое их число), имеющая место в использованной модели, позволяет достаточно точно определить включения ЛФ в цитоплазме клеток, накапливаемые в процессе фагоцитирования. При исследовании полей РПЭ, относящихся к разным зонам экваториальной области слоя, нами не выявлено существенных клеточных морфологических отличий. Фигуры митотических делений ядер в РПЭ в образцах, полученных от 4-х глаз 2-х животных на каждый срок, не обнаружены.
На срезах задней стенки нормального глаза крыс альбиносов РПЭ расположен между нейральной сетчаткой и сосудистой оболочкой. Он образует однорядный, непигментированный, эпителий, состоящий из двуядерных и одноядерных клеток, плотно прилежащих друг к другу латеральными поверхностями. С базальной стороны слой выстилает мембрана Бруха и сосудистая (хороидальная) оболочка (рис. 2а). Эти три слоя в норме плотно расположены относительно друг друга и вместе представляют собой самостоятельный комплекс. Сосудистая оболочка у крыс имеет развитую неоднородную структуру – сосудистую сеть, состоящую из кровеносных сосудов разного калибра. Клеточными элементами сосудистой оболочки являются также клетки эндотелия сосудов и отростчатые, не содержащие пигмента “меланофоры”, фибробласты, тучные клетки, резидентные макрофаги (рис. 5а). За сосудистой оболочкой следует плотная, склеральная соединительнотканная оболочка, обеспечивающая механическое напряжение и сохранение топологии РПЭ и сосудистой оболочки.
Рис. 5.
Сосудистая оболочка глаза крысы альбиноса в возрасте 1 мес. (а) – общий вид, окраска – гематоксилин-эозин; (б) – окрашивание по методу Шморля.

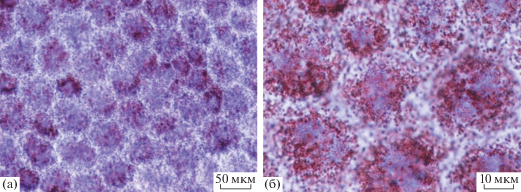
ЛФ гранулы являются обладающими аутофлуоресценцией, электронноплотными, гетерогенными, полимерными субстанциями, накапливаемыми внутри лизосомального вакуолярного аппарата (во вторичных лизосомах) клеток. Накопление происходит в течение всей жизни в линейной от возраста зависимости и является показателем (биомаркером) старения (Katz, 1989). Проведенное с помощью флуоресцентного микроскопа выявление ЛФ и последующий количественный анализ относительного числа клеток, обладающих значительными количествами ЛФ, как по числу гранул, так и их флуоресценции, позволил судить о накоплении ЛФ в клетках РПЭ крыс альбиносов на отрезке времени от 2 нед. до 2 мес. после рождения. Эти результаты представлены на рис. 6 и 7. Следует отметить, что, по всей вероятности, в популяции крыс одного и того же возраста существуют отличия в числе интенсивно флуоресцирующих клеток в РПЭ, что с большой вероятностью связано с индивидуальными особенностями животных. При этом все же можно выявить определенные закономерности. Первая – это то, что уже в 2 неделям постанатального развития у крыс альбиносов в экваториальной зоне РПЭ выявляются ЛФ-содержащие клетки, относительное содержание которых, однако, не превышает 10%. Флуоресенция ЛФ при этом чаще всего носит диффузный характер. Клетки с флуоресцирующей цитоплазмой могут быть обнаружены как в группах, так и отдельных клетках.
Рис. 6.
Аутофлуоресценция в клетках ретинального пигментного эпителия крыс альбиносов в возрасте: (а) – 2 нед., (б) – 1 мес., (в) – 2 мес. после рождения.
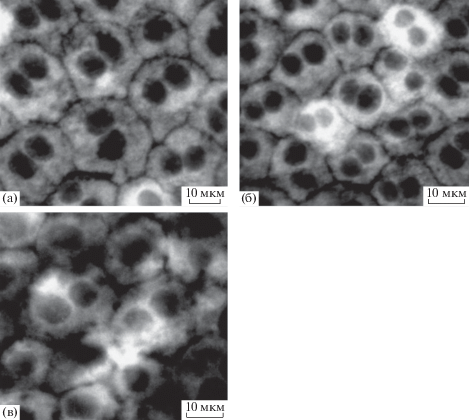
Рис. 7.
Увеличение числа клеток, обладающих высокой ЛФ флуоресценцией в ретинальном пигментном эпителии крыс альбиносов в раннем развитии. По оси ординат среднее относительное число клеток с высоким уровнем флуоресценции к числу всех клеток на анализируемом поле изображения слоя РПЭ.
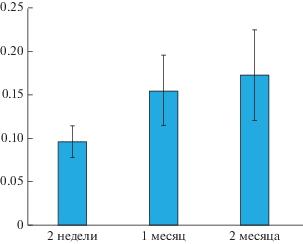
Позже уже к 1 мес. развития число таких клеток значительно увеличивается и 2 месяцам достигает уже 17–20% (рис. 7). Межгрупповой анализ выявил достоверные отличия между средними значениями показателя при сравнении возрастов 2 нед. и 1 мес. (p < 0.01). По мере возрастания относительного числа ЛФ – содержащих клеток, увеличивается и разброс этого показателя в образцах. Таким образом, очевидно, что накопление ЛФ в РПЭ глаза крыс альбиносов с возрастом является для этих животных естественным процессом, имеющим место вскоре после рождения и происходящим достаточно быстро в коротком интервале времени от 2 нед. до 2 мес. В чем же причина столь быстрого появления данного признака старения? Существуют работы, прямо указывающие на обратную связь наличия меланина (меланосом) с накоплением ЛФ в клетках РПЭ. В работе (Sundelin et al., 2001) исследовали РПЭ кролика и быка в условиях оксидативного стресса in vitro, вызванного добавлением к клеткам РПЭ препарата наружных сегментов фоторецепторных клеток. Авторы сравнивали РПЭ нормальных кроликов и альбиносов, а также клетки РПЭ быка, богатые и обедненные меланиновыми гранулами. Было показано, что клетки РПЭ кроликов альбиносов и РПЭ быка с низким содержанием меланина аккумулировали значительно большие количества ЛФ по сравнению с содержанием ЛФ в клетках РПЭ нормальных кроликов, а также клетках РПЭ быка, богатых меланином. Работа, по мнению авторов (Sundelin et al., 2001), свидетельствовала о том, что меланин является эффективным антиоксидантом, что, в свою очередь, вероятно, обусловлено связью меланина с процессом переноса металлов. Предполагается также, что отсутствие меланинового пигмента в РПЭ может также обусловливать нарушение межклеточной коммуникации, осуществляемой через контакты не только на латеральных поверхностях клеток РПЭ, но и с нейральной сетчаткой по мере ее развития, что приводит к нарушению клеточной интеграции (Iwai et al., 2016). Это может проявляться в изменении формы клеток, а также в изменениях процесса фосфорилирования белков клеточных контактов и их сборки.
Полученные препараты РПЭ крыс альбиносов, окрашенные по методу Шморля для выявления ЛФ, дали возможность провести дополнительный анализ РПЭ у развивающейся крысы альбиноса. Проведение количественного анализа при таком подходе ограничено в связи с особенностями любой гистологической окраски, интенсивность которой зависит от многих факторов. Тем не менее, метод позволил обнаружить окрашенные (темноголубые) включения как на поперечных срезах задней стенки глаза крыс (рис. 2б), так и на препаратах РПЭ whole amount (рис. 8а, 8б, 8в, 8г). На поперечных срезах окрашенные включения локализовались в клетках РПЭ на границе с фоторецепторами сетчатки, а также в сосудистой оболочке (рис. 2б). Такая локализация окрашивания была очевиднее у крыс в возрасте 2 мес., чем у крыс более раннего возраста. На ранних сроках развития (2 нед. и 1 мес.) (не показано) концентрация была незначительной, часто на грани фонового включения красителя. В целом эти результаты соответствовали данным, полученным при оценке накопления ЛФ с помощью флуоресцентного микроскопа, свидетельствующим в целом о наличии ЛФ на всех сроках наблюдения, и с максимумом 20% у двухмесячных крыс альбиносов.
Рис. 8.
Присутствие ЛФ гранул в изолированном ретинальном пигментном эпителии. (а) – окраска гематоксилин-эозином, 1 мес., (б) – окраска по методу Шморля, 1 мес., (в) – окраска гематоксилин-эозином, 2 мес., (г) – окраска по методу Шморля, 2 мес.
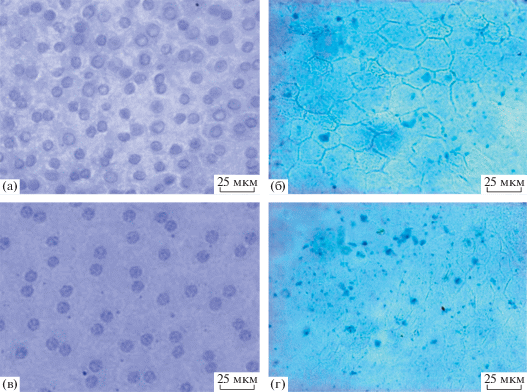
Интересно, что в задней стенке глаза двухмесячных крыс, помимо РПЭ, специфическое окрашивание присутствовало также в сосудистой оболочке (рис. 5б). Наличие ЛФ в сосудистой оболочке отмечалось и на более ранних сроках на окрашенных по методу Шморля парафиновых срезах. Недавно было описано накопление с возрастом ЛФ как результат переокисления липидов в сосудах сетчатки глаза человека (Nag et al., 2019).
Таким образом, выявленное в работе раннее накопление ЛФ в клетках РПЭ и сосудистой оболочке может являться свидетельством наличия одного из признаков старения РПЭ у крыс альбиносов уже в раннем постнатальном возрасте. Накопление ЛФ было показано также для ткани слезных желез стареющих (в возрасте от 2 до 24 мес.) крыс. Авторы (Batista et al., 2011) показали, что накопление ЛФ происходит на фоне падения экспрессии различных антиоксидантных маркеров, что свидетельствует об угнетении с возрастом антиоксидантной защиты, в свою очередь приводящей, в частности, к накоплению ЛФ и других признаков старения.
Определение соотношения, в котором находятся одноядерные и двуядерные клетки в экваториальной области слоя РПЭ крыс разного возраста дало результаты, представленные на рис. 9. Из данных гистограммы следует, что через две недели постнатального развития крыс альбиносов в экваториальной зоне РПЭ присутствует еще значительное число одноядерных клеток, однако, уже к первому месяцу постнатального развития крыс их содержание значительно снижается, и позже эта тенденция сохраняется. Межгрупповой анализ выявил достоверные отличия между финальными средними значениями соотношения одно- и двуядерных клеток при сравнении возрастов крыс 2 нед. и 1 мес. (p < 0.005).
Рис. 9.
Изменение соотношения одноядерных и двуядерных клеток в ретинальном пигментном эпителии крыс альбиносов в раннем возрасте. По оси ординат – отношение числа одноядерных клеток к числу двуядерных клеток на анализируемом поле изображения слоя РПЭ.
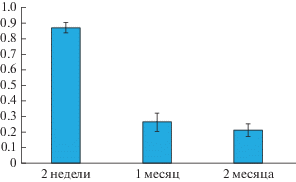
Из данных литературы известно, что РПЭ пигментированных грызунов накапливает двуядерные клетки уже на третьей постнатальной неделе (Bodenstein, Sidman, 1987). Согласно нашим данным крысы альбиносы уже через две недели постнатального развития имеют значительное число таких клеток в РПЭ, что в свою очередь может быть обусловлено одним из факторов альбинизма – недостаточным уровнем ДОФА. Последнее, в свою очередь, ответственно за выход клеток из цикла и, вероятно, цитокинез (Adams et al., 2010).
Интересен вопрос связи накопления ЛФ клетками РПЭ и развития в нем многоядерности. Согласно нашим наблюдениям накопление ЛФ происходит как в двуядерных, так и одноядерных клетках, но поскольку число одноядерных клеток на всех сроках наблюдения невелико, то определенно ответить на вопрос о связи скорости накопления ЛФ и нарушения цитокинеза, приводящего к многоядерности, пока нельзя. Однако при сравнении количественных результатов, представленных на рис. 7 и 9, можно выявить положительную корреляцию между исследуемыми нами этими двумя событиями.
Данные работы, полученные на РПЭ крыс альбиносов раннего возраста, косвенно подтверждают и дополняют сведения о роли меланина в клетках РПЭ как необходимого участника поддержания гомеостаза, защиты от избыточного света, развития и старения сетчатки глаза. Выявленное нами появление таких признаков как наличие и аккумуляция ЛФ, а также наличие высокого относительного числа двуядерных клеток в РПЭ у крыс альбиносов в раннем постнатальном развитии связаны, безусловно, с отсутствием меланина. Оба процесса свидетельствуют также о раннем старении РПЭ у крыс альбиносов, что должно учитываться при проведении офтальмологических медико-биологических исследований на этом животном модельном объекте.
ВЫВОДЫ
РПЭ глаза крысы альбиноса уже на ранних стадиях постнатального развития приобретает признаки старения. Это выражается в накоплении клетками липофусциновых гранул, а также в увеличении относительного содержания двуядерных полиплоидных клеток в слое. В первые две недели постнатального развития эти признаки выражены незначительно, однако уже к месяцу становятся очевидны. Причиной феномена раннего старения РПЭ у крыс альбиносов предполагается отсутствие меланина, предохраняющего от переокисления, и компонетов синтеза меланина – регуляторов цитокинеза. Данные дополняют сведения о состоянии РПЭ крыс альбиносов, используемых в экспериментах in vivo и in vitro в качестве животной модели при изучении старения и патологии сетчатки глаза.
Список литературы
Григорян Э.Н. Факторы компетенции клеток ретинального пигментного эпителия для репрограммирования в нейрональном направлении при регенерации сетчатки у тритона // Известия РАН. Серия биологическая. 2014. № 1. С. 5–16.
Новикова Ю.П., Ганчарова О.С., Эйхлер О.В. и др. Профилактическое и лечебное действие SkQ1-содержащих глазных капель визомитин при фотоиндуцируемых повреждениях сетчатки глаза // Биохимия (Москва). 2014. Т. 79. С. 1355–1366.
Adams T., Shahabi G., Hoh-Kam J., Jeffery G. Held under arrest: Many mature albino RPE cells display polyploidal features consistent with abnormal cell cycle retention // Exp. Eye Res. 2010. V. 90. № 2. P. 368–337.
Al-Hussaini H., Vugler A., Semo M., Jeffery G. Mature mammalian retinal pigment epithelium cells proliferate in vivo // Mol. Vision. 2008. V. 14. P. 1784–1791.
Batista T.M., Tomiyoshi L.M., Dias A.C. et al. Age-dependent changes in rat lacrimal gland anti-oxidant and vesicular related protein expression profiles // Mol. Vision. 2012. V. 18. P. 194–202.
Bodenstein L., Sideman R. Growth and development of the mouse retinal pigment epithelium. Cell and tissue morphometrics and topography of mitotic activity // Develop. Biol. 1987. V. 121. P. 192–204.
Chen M., Rajapakse D., Fraczek M. et al. Retinal pigment epithelial cell multinucleation in the aging eye – a mechanism to repair damage and maintain homoeostasis // Aging Cell. 2016. V. 15. P. 436–445.
Cortese K., Giordano F., Surace E.M. et al. The ocular albinism type 1 (OA1) gene controls melanosome maturation and size // Invest. Ophthalmol. Vis. Sci. 2005. V. 46. № 12. P. 4358–4364.
Grigoryan E.N., Novikova Y.P., Gancharova O.S. New antioxidant SkQ1 is an effective protector of rat eye retinal pigment epithelium and choroid under conditions of long-term organotypic cultivation // Adv. Aging Res. 2012. V. 1. P. 31–37.
Grønskov K., Ek J., Brondum-Nielsen K. Oculocutaneous albinism // Orphanet. J. Rare Dis. 2007. V. 2. P. 43–53.
Gu X., Neric N.J., Crabb J.S., Crabb J.W. et al. Age-related changes in the retinal pigment epithelium (RPE) // PLoS One. 2012. 7. № 6. e38673.
Gutteridge J.M.C. Fluorescent products of phospholipid peroxidation: formation and inhibition in model systems // Ceroid Lipofuscinosis (Batten’s Disease) / Eds. Armstrong D., Koppang N., Rider J.A. Amsterdam. Elsevier Biomedical Press. 1982. P. 351–364.
Ilia M., Jeffery G. Retinal mitosis is regulated by dopa, a melanin precursor that may influence the time at which cells exit the cell cycle: analysis of patterns of cell production in pigmented and albino retinae // J. Comp. Neurol. 1999. V. 405. P. 394–405.
Iwai L., Ramos A., Schaler A. et al. Retinal pigment epithelial integrity is compromised in the developing albino mouse retina // J. Comp. Neurol. 2016. V. 524. № 18. P. 3696–3716.
Katz M.L. Incomplete proteolysis may contribute to lipofuscin accumulation in the retinal pigment epithelium // Adv. Exp. Med. Biol. 1989. V. 266. P. 109–116.
Kennedy C.J., Rakoczy P.E., Constable I.J. Lipofuscin of the retinal pigment epithelium: a review // Eye (Lond.). 1995. V. 9. Pt. 6. P. 763–771.
Mazzoni F., Safa H., Finnemann S.C. Understanding photoreceptor outer segment phagocytosis: use and utility of RPE cells in culture // Exp. Eye Res. 2014. V. 126. P. 51–60.
Nadal-Nicolás F.M., Salinas-Navarro M., Jiménez-López M. et al. Displaced retinal ganglion cells in albino and pigmented rats // Front. Neuroanat. 2014. V. 8. P. 99–105.
Nag T.C., Maurya M., Sankar Roy T. Age-related changes of the human retinal vessels: Possible involvement of lipid peroxidation // Annals of Anatomy – Anatomischer Anzeiger. 2019. V. 226. P. 35–47.
Rozanowska M. Properties and functions of ocular melanins and melanosomes // Melanins and Melanogenesis: Biosynthesis, Biogenesis, Physiological and Pathological Functions / Eds. Borovansky J., Riley P.A. Wiley-Blackwell. Weinheim. Germany, 2011. P. 187–224.
Sarna T. Properties and function of ocular melanin—a photophysical view // J. Photochem. Photobiol. Biol. B. 1992. V. 12. P. 215–258.
Smith R.T., Farsiu S., Allingham M. Understanding RPE Lipofuscin // Invest. Ophthalmol. Vis. Sci. 2016. V. 57. № 15. P. 6766–6772.
Sparrow J.R., Hicks D., Hamel C.P. The retinal pigment epithelium in health and disease // Curr. Mol. Med. 2010. V. 10. № 9. P. 802–823.
Strauss O. The retinal pigment epithelium in visual function // Physiol. Rev. 2005. V. 85. № 3. P. 845–881.
Summers C.G. Albinism: Classification, clinical characteristics, and recent findings // Optom. Vis. Sci. 2009. V. 86. P. 659–662.
Sundelin S.P., Nilsson S.E.G., Brunk U.T. Lipofuscin formation in cultured retinal pigment epithelial cells is related to the melanin content // Free Radical Biology & Medicine. 2001. V. 30. № 1. P. 74–81.
Wang N., Koutz CA., Anderson RE. A method for the isolation of retinal pigment epithelial cells from adult rats // Invest. Ophthalmol. Vis. Sci. 1993. V. 34. № 1. P. 101–107.
Young R.W. The renewal of rod and cone outer segments in the rhesus monkey // J. Cell Biol. 1971. V. 49. P. 303–309.
Дополнительные материалы отсутствуют.