Онтогенез, 2021, T. 52, № 1, стр. 27-45
Соматические клетки цисты как микроокружение для поддержания и дифференцировки герминальных клеток в сперматогенезе Drosophila
С. С. Базылев a, В. Е. Адашев a, А. С. Шацких a, Л. В. Оленина a, А. А. Котов a, *
a Федеральное государственное бюджетное учреждение Институт молекулярной генетики Национального исследовательского центра “Курчатовский институт”
123182 Москва, площадь академика И.В. Курчатова, 2, Россия
* E-mail: kotov_alexei@mail.ru
Поступила в редакцию 29.05.2020
После доработки 02.07.2020
Принята к публикации 10.07.2020
Аннотация
Функции соматических клеток у многоклеточных организмов существенны для поддержания герминальных стволовых клеток и образования гамет, и, в конечном итоге, для выживаемости видов. В семенниках Drosophila две популяции соматических клеток выполняют функции микроокружения герминальных клеток. Группа терминально-дифференцированных клеток на апикальном конце семенника, хаб, непосредственно контактирует с герминальными стволовыми клетками, регулируя их самообновление и пролиферацию с помощью секреции сигнальных молекул. Другая популяция соматических клеток семенников, соматические клетки цисты, играет важную роль как в поддержании герминальных стволовых клеток, так и в процессах направленной дифференцировки их потомков, модулируя внешние сигналы и создавая микроокружение дифференцирующихся герминальных клеток в течение всего сперматогенеза. Обзор посвящен анализу современных данных о молекулярно-клеточных механизмах и белковых комплексах, необходимых в соматических клетках цисты для неавтономной регуляции развития герминальных клеток.
ВВЕДЕНИЕ
У всех животных герминальные стволовые клетки (ГСК) функционируют в уникальном процессе самообновления и производства потомков, вступающих в клеточную дифференцировку, критически важном для образования гамет и передачи генетической информации следующим поколениям. Самообновляющие деления ГСК и дифференцировка их потомства поддерживаются сигналами, исходящими из ниш, – структур, формируемых соматическими клетками гонад. Динамический процесс сперматогенеза требует точных переключений между отдельными стадиями: от самообновления ГСК к митотически амплифицирующимся сперматогониям и созреванию сперматоцитов, до образования гаплоидных сперматид и морфогенетического процесса их индивидуализации, ведущего к образованию зрелой спермы (Spradling et al., 2011; Greenspan et al., 2015). Специализированные соматические клетки сопровождают герминальные клетки семенников в течение всего процесса сперматогенеза и контролируют переключение стадий развития герминальных клеток. Концепция ниши стволовых клеток была впервые предложена в 1978 г. при обсуждении механизмов поддержания гематопоэтических клеток млекопитающих (Schofield, 1978). Соматические клетки, выполняющие функции ниши, были впервые идентифицированы при исследовании гаметогенеза у модельного объекта Drosophila melanogaster (Hardy et al., 1979; Wieschaus, Szabad, 1979; Xie, Spradling, 2000). Под нишей понимаются клетки и клеточные структуры, формирующие микросреду, в которой размещены стволовые клетки, получающие из ниши регуляторные сигналы и питательные компоненты. Данные, полученные к настоящему времени, ясно демонстрируют консервативные функции соматической ниши в регуляции процессов поддержания и самообновления стволовых клеток у многоклеточных эукариот (Morrison, Spradling 2008; Spradling et al., 2011; de Cuevas, Matunis, 2011; Oatley, Brinster, 2012). Соматические клетки также играют существенную роль в процессах направленной дифференцировки потомков стволовых клеток, модулируя внешние сигналы и создавая микроокружение дифференцирующихся клеток. При этом в настоящее время молекулярные и клеточные механизмы поддержания и функционирования самих соматических клеток в гонадах, а также их взаимодействия с герминальными клетками на разных этапах гаметогенеза, изучены недостаточно.
Сперматогенез млекопитающих, изучаемый главным образом на мышиной модели, происходит в семенных канальцах семенников. Основные этапы сперматогенеза у животных консервативны от дрозофилы до человека. Семенники дрозофилы и млекопитающих, при значительных морфологических различиях имеют высокое функциональное сходство. Соматические клетки цисты дрозофилы рассматриваются как функциональные аналоги клеток Сертоли у млекопитающих (Spradling et al., 2011; Greenspan et al., 2015; Kotov et al., 2017). Большие неделящиеся клетки Сертоли присоединены к базальной мембране семенных канальцев, простираясь внутрь их просвета и выполняя функции ниши герминальных клеток на всех стадиях дифференцировки (Griswold, 1998; Nel-Themaat et al., 2011; Oatley, Brinster, 2012; Jiang et al., 2014). Герминальные клетки, как у млекопитающих, так и у дрозофилы, упорядочены вдоль условной пространственно-временной оси, где наиболее ранние герминальные клетки расположены возле базальной мембраны, тогда как клетки на более зрелых стадиях дифференцировки расположены близко к просвету семенного канальца у млекопитающих или семенному пузырьку у Drosophila. Тесное взаимодействие между соматическими и герминальными клетками является консервативным для сперматогенеза у различных животных (Valli et al., 2014; Greenspan et al., 2015).
Выяснение того, как множество сигналов интегрируются для регуляции поддержания и дифференцировки герминальных клеток, является актуальным в изучении молекулярных механизмов сперматогенеза, и семенники Drosophila являются ценной модельной системой для таких исследований. Значительная доказательная база указывает на то, что соматическое микроокружение критически важно для самообновления ГСК, дифференцировки их потомков, предотвращения канцерогенеза герминальных клеток и их преждевременной потери, а также для поддержания их клеточной идентичности (Tran et al., 2000; Kiger et al., 2000; Lim, Fuller, 2012; Yu et al., 2016; Fairchild et al., 2017; Kotov et al., 2020). В этом обзоре мы суммируем современные представления о молекулярных механизмах, обеспечивающих функционирование соматических клеток цисты семенников в регулировании процесса сперматогенеза.
КРАТКИЙ ОБЗОР СПЕРМАТОГЕНЕЗА У ДРОЗОФИЛЫ
Семенники D. melanogaster морфологически представляют собой понятную и просто интерпретируемую систему для изучения процессов поддержания герминальных клеток и их дифференцировки в зрелые гаметы (рис. 1а). В семенниках Drosophila 9–12 герминальных стволовых клеток (ГСК) плотно контактируют с нишевой структурой, называемой хабом, и состоящей из 12–15 терминально-дифференцированных соматических клеток, прикрепленной к базальной мембране на апикальном слепом конце семенника (рис. 1а). Соматические стволовые клетки цисты (ССКЦ) располагаются на второй линии от хаба за ГСК и в норме контактируют с клетками хаба c помощью длинных цитоплазматических выростов, расположенных в просветах между ГСК. Две ССКЦ окружают каждую ГСК, полностью изолируя друг от друга индивидуальные ГСК (Hardy et al., 1979). Две популяции стволовых клеток, ГСК и ССКЦ, вследствие ассиметричного митоза производят себе подобные стволовые клетки и дочерние клетки, вступающие в дифференцировку (Gönczy, DiNardo, 1996). Являясь источником соматических клеток цисты, ССКЦ также составляют важную часть ниши для ГСК (Kawase et al., 2004; Zoller, Schulz, 2012; Greenspan et al., 2015). Непосредственные потомки ГСК, вступающие в дальнейшую дифференцировку, гониабласты, окружаются двумя соматическими клетками цисты (СКЦ), которые ко-дифференцируются вместе с ними. Таким образом, формируется основная функциональная единица сперматогенеза – циста. Две соматические клетки цисты образуют прочные окклюзионные и адгезионные соединения друг с другом, формируя барьер проницаемости для посторонних сигналов (Fairchild et al., 2015). Каждый гониабласт внутри развивающейся цисты претерпевает 4 цикла митотических делений с неполным цитокинезом, превращаясь в синцитий из 16 сперматогониев, взаимосвязанных между собой через круглые мембранные каналы. СКЦ в процессе сперматогенеза не делятся, но увеличиваются в размерах, уплощаются и вытягиваются вокруг герминальных клеток, создавая барьер проницаемости для внешнего окружения, а также являясь акцептором и источником молекулярных сигналов. 16 герминальных клеток внутри цисты, ограничиваемой двумя СКЦ, становятся сперматоцитами, значительно увеличиваются в размерах и вступают в мейоз, с образованием 64 гаплоидных сперматид. Сперматиды в процессе индивидуализации превращаются в зрелые гаметы, двигаются к базальному концу семенника и запасаются в семенном пузырьке (Fuller, 1998; Spradling et al., 2011; Dubey et al., 2019) (рис. 1а). СКЦ продолжают ко-дифференцироваться с герминальными клетками в течение всего сперматогенеза и, в конечном итоге, поглощаются эпителиальными клетками на базальном конце семенника после индивидуализации сперматид (Fuller, 1998; Dubey et al., 2016).
Рис. 1.
(а) Общая схема сперматогенеза у Drosophila melanogaster. На апикальном конце семенника (вверху) находится соматическая нишевая структура – хаб. Хаб поддерживает две соседние популяции стволовых клеток, ГСК и ССКЦ, посредством межклеточной передачи сигналов. ГСК делится с самообновлением и производством гониабласта, который обволакивается двумя клетками цисты и дополнительно подвергается четырем митотическим делениям с неполным цитокинезом, после чего циста из 16 герминальных клеток переключается на программу первичных сперматоцитов. Сперматоциты растут и созревают внутри цисты, а затем входят в мейоз, образуя 64 гаплоидных круглых сперматид, также взаимосвязанных внутри цисты. Наконец, удлиненные сперматиды подвергаются индивидуализации и перемещаются к базальному концу семенника. Зрелые индивидуальные сперматозоиды попадают в семенной пузырек. (б) Сигнальные пути, регулирующие сперматогенез в области ниши (вверху) и вне ее (внизу). В пятиугольниках представлены секретируемые лиганды сигнальных путей. Только некоторые из множества сигнальных путей, действующих в семенниках, указаны на схеме.
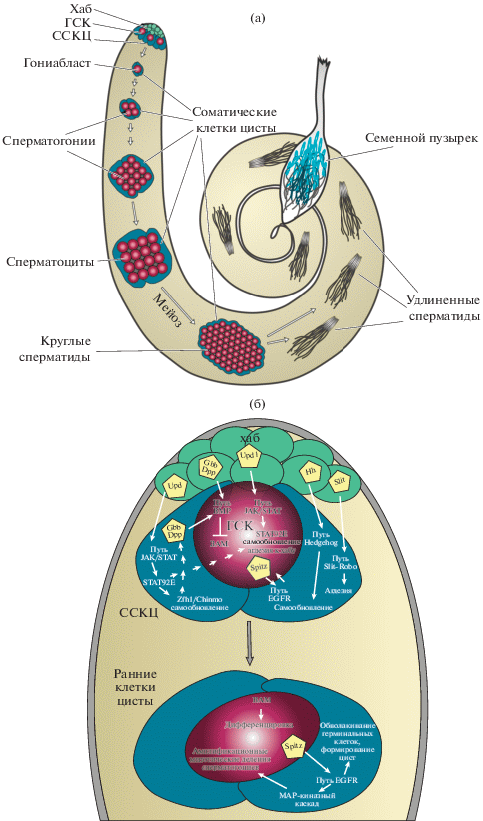
Соматические клетки семенников происходят из соматических клеток-предшественников гонад, специфицирующихся из клеток дорсолатеральной мезодермы. Эмбриональные семенники формируются в период среднего и позднего эмбриогенеза путем ассоциации примордиальных герминальных клеток, мигрирующих внутрь эмбриона с его заднего конца через кишечный эпителий, и нескольких кластеров соматических клеток: передних, задних и специфических мужских соматических клеток-предшественников (Santos, Lehmann, 2004; Jemc, 2011; Whitworth et al., 2012). Последние экспрессируют маркерные белки Eyes absent (Eya), Six4, Doublesex и SOX100B; эти клетки выживают только у самцов и впоследствии формируют терминальный эпителий семенников. Хаб формируется на поздней стадии эмбриогенеза из кластера передних соматических клеток-предшественников (Hardy et al., 1979), экспрессирующих молекулярный маркер Escargot (Boyle, DiNardo, 1995; Voog et al., 2014). Подмножество этих клеток плотно ассоциировано между собой, они терминально-дифференцированы и экспрессируют на высоком уровне молекулы клеточной адгезии, такие как DE-кадгерин, DN-кадгерин и Fasciclin III. Хаб секретирует лиганды множества сигнальных путей, включая JAK/STAT, BMP, Hedgehog и других (рис. 1б). Те примордиальные герминальные клетки, которые оказалась в непосредственном контакте с хабом, принимают эти сигналы и становятся стволовыми, тогда как остальные герминальные клетки, не получающие сигналов от хаба на достаточном уровне, подвергаются дифференцировке (Sheng et al., 2009; Whitworth et al., 2012). ССКЦ происходят из того же пула соматических клеток-предшественников, что и клетки хаба. Каким же образом формируется нужное количество соматических клеток семенника обоих этих типов? По-видимому, транскрипционный фактор Bowl, экспрессируемый в клетках хаба, существенен для этого процесса, поскольку в случае мутаций bowl хаб содержит меньшее количество клеток, а репрессия Lines, ингибитора Bowl, напротив, увеличивает численность клеток хаба (DiNardo et al., 2011). Образование хаба индуцируется с помощью сигнального пути Notch, который необходим и достаточен для этого и регулирует число клеток хаба, частично действуя через активацию фактора Bowl (Kitadate, Kobayashi, 2010; DiNardo et al., 2011; Okegbe, DiNardo, 2011). Остается невыясненным, как специфицируются ССКЦ. Эктопическая активация Bowl с помощью нокдауна lines в ССКЦ, приводит к транс-дифференцировке их в клетки хаба, что указывает на общее происхождение клеток хаба и ССКЦ (Voog et al., 2008; DiNardo et al., 2011). ССКЦ экспрессируют транскрипционный фактор Zfh1, регулируемый сигнальным каскадом JAK/STAT, и используемый в настоящее время как специфический маркер для этих клеток (Leatherman, Dinardo, 2008; Issigonis et al., 2009; Flaherty et al., 2010). Уровень экспрессии Zfh1 падает в дифференцирующихся потомках ССКЦ, покидающих область ниши возле хаба. ССКЦ также экспрессируют на высоком уровне транскрипционный фактор Traffic jam (Tj), но период его экспрессии в процессе сперматогенеза шире, он экспрессируется также в СКЦ, окружающих гониабласты и сперматогонии (Li et al., 2003), и рассматривается в литературе как маркер совокупной популяции ранних СКЦ. В качестве маркера зрелых СКЦ, окружающих сперматоциты, часто используется транскрипционный активатор Eya (Fabrizio et al., 2003).
РЕГУЛЯЦИЯ САМООБНОВЛЕНИЯ ГСК С ПОМОЩЬЮ РЯДА СИГНАЛЬНЫХ КАСКАДОВ
Локальный сигнальный путь JAK/STAT в регулировании адгезии ГСК к хабу, поддержании их идентичности и конкуренции с ССКЦ. Соматические клетки хаба являются источником сигналов короткой дистанции, регулирующих поддержание обеих популяций стволовых клеток, герминальных и соматических. Сигнальный путь JAK/STAT (Janus kinase-Signal transducer and activator of transcription) способствует самообновлению как ГСК, так и ССКЦ (рис. 1б). Клетки хаба секретируют цитокин Unpaired1 (Upd1), активирующий путь JAK/STAT в примыкающих к нему стволовых клетках обоих типов, ГСК и ССКЦ (Kiger et al., 2001; Tulina, Matunis, 2001). Upd1, связываясь с рецептором Domeless (Dome), активирует единственную у Drosophila киназу JAK, Hopscotch (Hop), которая, в свою очередь, рекрутирует и фосфорилирует единственный гомолог транскрипционного фактора STAT у Drosophila – STAT92E по остатку тирозина 711, способствуя его димеризации и активации. Ранние данные позволяли предположить, что STAT92E необходим как внутриклеточный фактор для поддержания ГСК и ССКЦ, поскольку в stat92E-мутантных семенниках или при использовании нулевых клонов stat92E, как ГСК, так и ССКЦ, быстро терялись из ниши, вступая в дифференцировку (Kiger et al., 2001; Tulina, Matunis, 2001). Однако позднее было показано, что сигнальный путь JAK/STAT по-разному требуется для поддержания этих двух клеточных популяций. Активация эндогенного STAT92E в ГСК оказалась недостаточной для их самообновления. Но эктопическая активация STAT92E в ССКЦ способна поддерживать самообновление обеих популяций стволовых клеток, ГСК и ССКЦ, независимо от хаба (Leatherman, DiNardo, 2008, 2010). ГСК с нарушенной экспрессией STAT92E вытесняются с позиции возле хаба, проигрывая конкуренцию с ССКЦ, благодаря дефектам адгезионных контактов между хабом и ГСК (Issigonis et al., 2009; Leatherman, DiNardo, 2010). В этих условиях ССКЦ кластеризуются вокруг хаба, но ГСК, контактирующие с ССКЦ, продолжают самообновляющие деления. Вместе эти данные свидетельствуют о том, что активация пути JAK/STAT в ССКЦ достаточна для индукции самообновления как в ГСК, так и в ССКЦ.
Несмотря на то, что JAK/STAT не требуется внутриклеточно для самообновления ГСК, этот путь необходим для DE-кадгерин-опосредуемой адгезии ГСК к клеткам хаба (Leatherman, DiNardo, 2008, 2010). STAT92E способен связываться с промотором гена chickadee и активировать его транскрипцию в ГСК и ССКЦ (Shields et al., 2014). Этот ген, кодирующий профилин у Drosophila, необходим для локализации DE-кадгерина в составе комплексов адгезии на клеточной поверхности и, таким образом, для поддержания ГСК в нише. В семенниках с отсутствием экспрессии STAT92E нарушается внутриклеточный траффик кадгерин-катениновых комплексов к клеточной мембране ГСК и, таким образом, DE-кадгерин отсутствует в зоне контакта с хабом и ГСК теряются из ниши вступлением в дифференцировку. Эктопическое увеличение экспрессии DE-кадгерина умеренно супрессирует потерю ГСК (Leatherman, DiNardo, 2008). Тем не менее, автономные сигналы JAK/STAT сами по себе не достаточны для самообновления ГСК.
Предполагаемые мишени транскрипционной регуляции, осуществляемой фактором STAT92E, по-видимому, различны в ГСК и ССКЦ. Две транскрипционные мишени пути JAK/STAT – zinc finger homeodomain 1 (zfh1) и chronologically inappropriate morphogenesis (chinmo) экспрессируются в ССКЦ и необходимы для их самообновления и поддержания идентичности (Leatherman, DiNardo, 2008; Flaherty et al., 2009, 2010). Хотя оба этих фактора требуются внутриклеточно в ССКЦ, они не взаимодействуют друг с другом, предположительно участвуя в независимых процессах (Flaherty et al., 2010). Мутантные по zfh1 или chinmo ССКЦ неспособны к поддержанию самообновления, мутантные клоны теряются, вступая в дифференцировку. Гиперэкспрессия любого из этих факторов вызывает экспансию обеих популяций стволовых клеток, как и в случае гиперактивации STAT92E (Leatherman, DiNardo, 2008; Flaherty et al., 2010). Chinmo также экспрессируется в ГСК, но не требуется для их самообновления, тогда как мутантные по chinmo клоны ССКЦ быстро теряются через преждевременную дифференцировку (Flaherty et al., 2010).
Suppressor of Cytokine Signaling at 36E (Socs36E) является прямой мишенью пути JAK/STAT в ССКЦ и его репрессором, формируя классическую петлю негативной обратной связи (Arbouzova, Zeidler, 2006). Socs36E (ортолог SOCS5 млекопитающих) контролирует конкуренцию двух популяций стволовых клеток за место в нише, модулируя уровень клеточной адгезии ССКЦ (Issigonis et al., 2009). Socs36E ослабляет активацию сигнального каскада JAK/STAT в ССКЦ, приводя к сбалансированному соотношению ГСК и ССКЦ возле хаба (Issigonis et al., 2009; Singh et al., 2010; Amoyel et al., 2016a). Тогда как обе популяции стволовых клеток используют DE-кадгерин для адгезии к хабу, ССКЦ также используют для этого гетеродимерные интегриновые комплексы. Socs36E негативно регулирует уровень интегринов в этих клетках. В семенниках мутантов Socs36E это приводит к сверхпредставленности ССКЦ, окружающих хаб, и конкурентному вытеснению ГСК из ниши. Клоны ССКЦ, в которых отсутствует экспрессия Socs36E, способны вытеснять как ГСК, так и ССКЦ дикого типа, за счет повышенного уровня экспрессии интегринов на их клеточной поверхности (Singh et al., 2010). Socs36E ингибирует MAP-киназный (Mitogen-Activated Protein) каскад в ССКЦ, активируемый сигнальным путем EGFR, тогда как эктопическое усиление активности MAP-киназного каскада в клонах ССКЦ вызывает вытеснение ССКЦ дикого типа и ГСК из ниши за счет конкуренции (Amoyel et al., 2016a). Таким образом, Socs36E специфически модулирует уровень сигналов JAK/STAT и EGFR в ССКЦ для поддержания корректного соотношения двух популяций стволовых клеток, поскольку две дочерние соматические клетки цисты нужны для поддержания и окружения одного дифференцирующегося гониабласта при формировании цисты.
Существенные функции сигнального пути BMP в поддержании ГСК в семенниках. Локальные сигналы пути Bone Morphogenetic Protein (BMP) необходимы для регулирования самообновления и поддержания ГСК в семенниках (Schulz et al., 2002; Shivdasani, Ingham, 2003; Kawase et al., 2004). Цитокино-подобные лиганды BMP-пути Decapentaplegic (Dpp) и Glass Bottom Boat (Gbb), секретируемые клетками хаба и ССКЦ в область адгерентных контактов с ГСК, связываются с рецепторами первого типа Thickveins (Tkv) and Saxophone (Sax) и рецептором второго типа Punt на поверхности ГСК (Kawase et al., 2004). Секреция сигнальных молекул Dpp и Gbb приводит к активации сигнального каскада в ГСК, вследствие чего в них подавляется транскрипция основного фактора дифференцировки Bag-of-marbles (BAM) (Kawase et al., 2004; Michel et al., 2011) (рис. 1б). Дочерние герминальные клетки, которые не контактируют с хабом и ССКЦ, не получают сигналов BMP в достаточной дозе и начинают экспрессировать BAM, что дает им возможность вступить на путь дифференцировки (McKearin, Spradling, 1990; Kawase et al., 2004). Показано, что недавно идентифицированные нанотрубки – проникающие в хаб структуры, создаваемые ГСК, – играют специфическую роль в проведении сигналов BMP из клеток хаба, что, предположительно, обеспечивает высокий пороговый уровень секреции лигандов BMP в ГСК, необходимый для их самообновления (Inaba et al., 2015). В яичниках Drosophila повышенная экспрессия Dpp в соматических клетках гермария, окружающих ГСК, приводит к опухолеподобному накоплению ГСК-подобных клеток, не экспрессирующих BAM и не вступающих в дифференцировку (Xie, Spradling, 1998). В ГСК семенников эктопически повышенный уровень Dpp или Gbb не приводит к предотвращению дифференцировки гониабластов или к формированию опухолеподобных кластеров ГСК. Но в случае повышенной экспрессии Dpp, но не Gbb, митотические деления сперматогониев часто не останавливаются на четырех, как в норме, а продолжаются, приводя к формированию цист, содержащих более чем 16 сперматогониев (Kawase et al., 2004). Тем не менее, анализ семенников самцов с мутациями по gbb или по dpp показал, что только экспрессия Gbb существенна для поддержания ГСК, и Dpp экспрессируется на более низком уровне, чем Gbb (Kawase et al., 2004). Однако недавние исследования показали, что эктопическая экспрессия Dpp в ССКЦ может способствовать усилению конкуренции между популяциями стволовых клеток за позиции возле хаба с последующей потерей ГСК (Lu et al., 2019). По-видимому, уровни экспрессии Dpp и Gbb в семенниках тщательно регулируются, обеспечивая правильный баланс стволовых клеток обеих популяций.
СИГНАЛЬНЫЕ ПУТИ, ВОВЛЕЧЕННЫЕ В ПОДДЕРЖАНИЕ СОМАТИЧЕСКИХ СТВОЛОВЫХ КЛЕТОК ЦИСТЫ
Сигнальный путь Hedgehog. Сигнальный путь Hedgehog активируется в ССКЦ с помощью секреции из хаба одноимeнного лиганда Hedgehog (Hh) (рис. 1б). В отсутствие сигнала рецептор Patched (Ptc) на поверхности ССКЦ подавляет активацию другого трансмембранного белка Smoothened (Smo). В этом случае белковый комплекс, состоящий из протеинкиназы A (PKA) и фактора Costal2, осуществляет протеолитическое разрезание 155 кДа транскрипционного фактора Cubitus interruptus (Ci) до укороченной формы 75 кДа, которая, в отличие от полноразмерной, подавляет транскрипцию генов-мишеней пути Hedgehog. Взаимодействие лиганда Hh с рецептором Ptc приводит к предотвращению расщепления Ci и к активации транскрипции генов-мишеней. Транскрипция неустановленных генов, активируемых в этом сигнальном каскаде необходима только для самообновления ССКЦ, но не ГСК (Michel et al., 2012; Amoyel et al., 2013; Zhang et al., 2013). ССКЦ, дефицитные по экспрессии smo, теряются из ниши, но не в результате конкуренции, а вследствие нарушения самообновления (Amoyel et al., 2013). Сигнальный путь Hedgehog действует в ССКЦ клеточно-автономно и независимо от пути JAK/STAT и необходим для спецификации определенного числа ССКЦ в нише семенника, поскольку эктопическая гипер-экспрессия лиганда Hh вызывает значительное увеличение численности Zfh1-положительных соматических клеток на апикальном конце. Но активность пути Hedgehog не существенна для формирования ниши для ГСК: в stat92E-мутантных семенниках ССКЦ с эктопически активированным путем Hedgehog не способны к поддержанию ГСК (Amoyel et al., 2013). Этот путь, по-видимому, действует параллельно JAK/STAT для обеспечения самообновления ССКЦ, хотя некоторые нижерасположенные мишени обоих путей могут перекрываться (Amoyel et al., 2013, Zhang et al., 2013).
Сигнальный путь Hippo. Hippo играет важную роль в регуляции пролиферации различных типов стволовых клеток у дрозофилы, таких как нервные стволовые клетки, стволовые клетки кишечника и фолликулярные стволовые клетки яичников (Mo et al., 2014; Hsu et al., 2017). Основными компонентами пути Hippo являются киназы Hippo (Hpo) и Warts (Wts), а также ко-активатор транскрипции Yorkie (Yki), активность которого регулируется фосфорилированием, что обусловливает его стабильность и субклеточную локализацию. Фосфорилированный Yki локализуется в цитозоле и быстро деградирует, что показано при использовании имагинальных дисков крыла дрозофилы и клеточной культуры S2 (Oh, Irvine, 2008; Ren et al., 2010). Нефосфорилированный Yki импортируется в ядро и взаимодействует с факторами транскрипции, такими как Scalloped (Sd), активируя транскрипцию генов-мишеней, таких как циклин E, Myc, diap1, expanded и bantam, способствуя клеточному росту, пролиферации и поддержанию стволовых клеток, что изучено, прежде всего, на клетках глазных имагинальных дисков и имагинальных дисков крыла (Wu et al., 2008). В семенниках hpo-мутантные клоны ССКЦ гиперпролиферируют и вытесняют ГСК из ниши, что сравнимо фенотипически с конкурентным поведением мутантных клонов ptc, в которых постоянно активирован путь Hedgehog (Amoyel et al., 2014). Показано, что Yki требуется автономно для самообновления ССКЦ, но не ГСК (Sun et al., 2008; Amoyel et al., 2014). Клональная эктопическая экспрессия активированной формы Yki в ССКЦ приводит к вытеснению как ГСК, так и ССКЦ дикого типа, из ниши (Amoyel et al., 2014). Изучение взаимодействия сигнальных путей Hippo и Hedgehog с помощью создания клонов ССКЦ, мутантных по ptc и yki одновременно, показало, что такие клоны не способны к гиперпролиферации и колонизации ниши. Таким образом, путь Hippo проявляет эпистатические эффекты по отношению к сигнальному пути Hedgehog, маскируя фенотипические проявления последнего (Amoyel et al., 2014). Предполагается, что оба пути, Hedgehog и Hippo, необходимы параллельно для поддержания и пролиферации ССКЦ с помощью независимого или аддитивного контроля экспрессии генов клеточного цикла, но это требует дальнейшего подтверждения.
Сигнальный путь Slit-Robo. Показано, что сигнальный путь Slit-Roundabout (Slit-Robo) модулирует адгезию в ССКЦ через регуляцию DE-кадгерина (Stine, Matunis, 2014). Хаб секретирует лиганд Slit и снижение уровня его рецептора Roundabout 2 в ССКЦ приводит к потере их из ниши (рис. 1б). В противоположность этому, потеря нижерасположенного в каскаде эффектора пути Slit-Robo тирозин-киназы Abelson обеспечивает ССКЦ конкурентное преимущество. Тирозин-киназа Abelson в норме функционирует в пути дестабилизации β-катенина, позволяя проводить обновление адгезионных контактов, обеспечиваемых кадгерин-катениновыми комплексами адгезии (Stine, Matunis, 2014). Экспрессия Roundabout 2 в ССКЦ также регулируется сигнальным путем JAK/STAT, что указывает на координацию сигналов из ниши для регуляции адгезии.
ДИФФЕРЕНЦИРОВКА ГЕРМИНАЛЬНЫХ КЛЕТОК ПОД КОНТРОЛЕМ СИГНАЛОВ ИЗ СОМАТИЧЕСКИХ КЛЕТОК ЦИСТЫ
Сигнальный путь EGFR. Как в яичниках, так и в семенниках дифференцировка герминальных клеток зависит от сигнального пути рецептора эпидермального фактора роста (EGFR) (Brand, Perrimon, 1994; Kiger et al., 2000; Schulz et al., 2002) (рис. 1б). В семенниках Drosophila основной лиганд этого пути Spitz активируется в ранних герминальных клетках протеазой Stet и секретируется из них, активируя рецепторы EGFR на соматических клетках цисты (Schulz et al., 2002; Sarkar et al., 2007; Parrot et al., 2012). Как во многих других типах клеток, взаимодействие лиганда с рецептором EGFR запускает в соматических клетках цисты линейный киназный каскад Ras-Raf-MAP (Shilo, 2014). Каскад заканчивается фосфорилированием фактора ERK и транслокацией его в ядро, где он активирует транскрипцию неизвестных мишеней (Tran et al., 2000; Chen et al., 2013; Hudson et al., 2013). Предполагается, что вследствие активации MAP- киназного каскада, герминальные клетки на разных стадиях развития от ГСК до сперматогониев получают от соматических клеток цисты специфические обратные сигналы, часть из которых существенна для самообновляющего деления ГСК, другая часть для ограничения синхронных амплификационных делений сперматогониев и переключения на программу роста сперматоцитов (Kiger et al., 2000; Hudson et al., 2013). Однако поиск таких обратных сигналов чрезвычайно трудная задача, нерешeнная в настоящее время. Гиперактивация сигналинга EGFR приводит к инициации терминальной дифференцировки сперматогониев до завершения всех четырех раундов митотических делений (Hudson et al., 2013). В случае мутаций компонентов сигнального пути EGFR, таких как spitz, stet, raf или egfr, ранние герминальные клетки не формируют 2–16-клеточные цисты, а образуют крупные гиперпролиферирующие кластеры мелких герминальных клеток, задержанных на ранних этапах дифференцировки, тогда как СКЦ не окружают их, а сегрегируют в группы мелких клеток округлой формы и теряются впоследствии (Kiger et al., 2000; Schulz et al., 2002; Sarkar et al., 2007; Parrott et al., 2012; Hudson et al., 2013). Нарушение окружения сперматогониев соматическими клетками цисты у таких мутантов предположительно приводит к потере последующих сигналов пути EGFR, необходимых как для дифференцировки герминальных клеток, так и для выживания СКЦ (Kiger et al., 2000). Вторая ветвь пути EGFR, действующая в ССКЦ, связана с фактором обмена гуанина Vav и малыми ГТФазами Rac1 и Rho1. Подавление экспрессии Vav или Rac1 существенно усиливает мутантный фенотип spitz, в том числе дефекты окружения герминальных клеток соматическими клетками цисты, тогда как редукция Rho1 производит противоположный эффект (Sarkar et al., 2007). Активация пути EGFR герминальными клетками вызывает противоположные активности Rac1 и Rho1 в СКЦ, по-видимому, вследствие реорганизации актинового цитоскелета, в норме приводящей к росту и вытягиванию соматических клеток цисты вокруг герминальных клеток и образованию ламеллоподия-подобных выростов в области контактов, предположительно концентрирующих на своей поверхности комплексы клеточной адгезии (Sarkar et al., 2007; Zoller, Schulz, 2012). В семенниках млекопитающих гомолог EGFR локализуется на поверхности соматических клеток Сертоли и перемещение дифференцирующихся герминальных клеток в направлении просвета семенных канальцев требует постоянной реорганизации их контактов с клетками Сертоли (Amlani, Vogl, 1988; Suarez-Quian, Niklinski, 1990; Kopera et al., 2010). Поскольку соматические клетки цисты у Drosophila являются функциональными аналогами клеток Сертоли у млекопитающих (Spradling et al., 2011), ряд функций пути EGFR имеет консервативный характер в сперматогенезе как у Drosophila, так и у млекопитающих.
Однако в настоящее время не идентифицированы молекулярные взаимодействия, обеспечивающие формирование цисты за счет роста и окружения соматическими клетками герминальных. Также неизвестен характер сигналов, посылаемых соматическими клетками цисты на различных этапах дифференцировки герминальных клеток. К настоящему времени выявлены только некоторые факторы, принадлежащие пути EGFR и функционирующие в семенниках, такие как Spitz, Stet, EGFR, Raf, ERK, Rac1, Rho1, Vav. Таким образом, молекулярные механизмы, запускающие аномальную пролиферацию ранних герминальных клеток в семенниках при нарушении пути EGFR, остаются неизвестными. В большинстве тканей эукариотических организмов непосредственные потомки стволовых клеток подвергаются амплификационным делениям для увеличения числа предшественников терминально-дифференцированных клеток. Такая пролиферация должна подвергаться строгой регуляции для предотвращения онкогенеза и выявление механизмов, ее ограничивающих, является важным приоритетом для биологии стволовых клеток и изучения формирования опухолей в развивающихся тканях.
Экдизоновый сигнальный путь и его антагонизм пути EGFR. Стероидный гормон экдизон выполняет хорошо охарактеризованные функции в контроле процессов развития, обмена веществ и размножения (Ables, Drummond-Barbosa, 2017). Экдизон связывается с гетеродимерным рецептором, состоящим из рецептора экдизона (EcR) и белка Ultraspiracle (Usp), что приводит к последующей активации многих его транскрипционных мишеней, включая такие транскрипционные факторы как E74, E75, Broad, E78 и Ftz-f1. Экдизоновый путь генетически взаимодействует с BMP в семенниках, усиливая ответ ГСК на сигналы BMP (Ables, Drummond-Barbosa, 2010). Мутации EcR, E75 или ftz-f1 в ССКЦ приводят к потере ГСК в семенниках, которая предотвращается при кормлении самцов экдизоном (Li et al., 2014). У самцов с мутацией EcR наблюдается высокий уровень гибели дифференцирующихся герминальных клеток в семенниках, но эктопическая экспрессия EcR в СКЦ неавтономно приводит к спасению герминальных клеток (Li et al., 2014). Однако в другом исследовании показано, что нокдауны Usp, EcR или E75 в ССКЦ не нарушают раннее развитие герминальных клеток в семенниках и их обволакивание соматическими клетками цисты (Morris, Spradling, 2012). Еще одно исследование свидетельствует, что нормальная активность экдизонового пути не существенна или избыточна в семенниках дикого типа для сперматогенеза, но гиперэкспрессия EcR в СКЦ неавтономно приводит к массовой гибели дифференцирующихся герминальных клеток (Qian et al., 2014). В этом же исследовании показано, что в случае семенников spitz-мутантов, редуцированный экдизоновый сигналинг в СКЦ приводит к “спасению” дефектов взаимодействия соматических и герминальных клеток при формировании цист, таким образом, антагонизируя пути EGFR. Необходимы дальнейшие исследования, чтобы выяснить молекулярные аспекты функционирования экдизонового каскада в семенниках и его баланса и антагонизма с сигнальным путем EGFR.
Только некоторые пути, вносящие существенный вклад в самообновление и поддержание ГСК, идентифицированы к настоящему времени. Диетические особенности, инсулиновая сигнальная система (путь PI3K/Tor), путь Wnt, путь Notch, путь трансляционной репрессии Nanos/Pumilio и эпигенетические факторы также влияют на поддержание и регуляцию ГСК и ССКЦ (Forbes, Lehmann, 1998; Wang, Lin, 2004; Park et al., 2007; Matunis et al., 2012; Amoyel et al., 2016b; Ng et al., 2019). Взаимодействие и параллельное функционирование множества сигнальных путей, таких как JAK/STAT, BMP, EGFR, Hedgehog, Hippo, Slit-Roundabout и других регулирует конкуренцию стволовых клеток семенников (Amoyel et al., 2013, 2014, 2016a; Stine, Matunis, 2014; Singh et al., 2016; Lu et al., 2019). ССКЦ интегрируют различные сигналы, контролирующие совокупность сигнальных путей, направленных на поддержание стволовых клеток в нише семенников и дифференцировку их потомков, но соответствующие интегральные механизмы далеко не полностью выяснены (рис. 1б). Выяснение того, как множество сигналов интегрируются для поддержания стволовых клеток, является одной из основных проблем в изучении стволовых клеток; и исследования Drosophila как модельного организма обеспечивают все большее понимание этих механизмов.
ИДЕНТИФИКАЦИЯ ФАКТОРОВ, ЭКСПРЕССИЯ КОТОРЫХ В СОМАТИЧЕСКИХ КЛЕТКАХ ЦИСТЫ НЕАВТОНОМНО ПРЕДОТВРАЩАЕТ НАРУШЕНИЯ ДИФФЕРЕНЦИРОВКИ РАННИХ ГЕРМИНАЛЬНЫХ КЛЕТОК
Классические генетические скрининги, проводимые на дрозофиле в XX веке и направленные на поиск и идентификацию генов, существенных для сперматогенеза, сталкивались с трудностями, если мутации приводили к летальному фенотипу, поскольку многие гены, необходимые для производства гонад, также вовлечены и в другие процессы в организме. Использование системы UAS-GAL4 в настоящее время позволяет исследователям проводить скрининговые исследования с помощью РНКi-индуцированных нокдаунов выбранных генов в строго определенном типе клеток за счет использования драйверных конструкций, активных в специфических клетках мухи (Dietzl et al., 2007; Gleason et al., 2018; Vorontsova et al., 2019). Это позволяет с одной стороны обойти проблему летальности на любой стадии развития, и с другой стороны выявить фенотипические проявления, обусловленные нарушением экспрессии изучаемого гена прицельно, в определенных клетках или тканях. Ряд таких скрининговых исследований, направленных на выявление генов, экспрессия которых существенна в соматических клетках цисты, был проведeн к настоящему времени с использованием коллекций трансгенных мух, несущих РНКi-конструкции к последовательностям 2338 белок-кодирующих генов (Liu et al., 2016; Yu et al., 2016; Fairchild et al., 2017). В результате этих трех исследований выявлено 319 генов, РНКi-опосредованные нокдауны которых в соматических клетках цисты приводят к стерильности самцов, а также с помощью иммунофлуоресцентной микроскопии проанализированы фенотипические нарушения в семенниках этих самцов на разных стадиях сперматогенеза. Основные типы фенотипических нарушений в таких семенниках выражаются в неавтономных дефектах поддержания герминальных клеток (существенная потеря их количества) или в нарушении их дифференцировки. Согласно результатам этих скринингов, выявлена обширная категория генов, РНКi-опосредованные нокдауны которых в ранних соматических клетках цисты при использовании драйверных линий tj-GAL4 или c587-GAL4 приводят к формированию недоразвитых или рудиментарных семенников, как правило, содержащих обширные кластеры недифференцированных герминальных клеток. В таких семенниках СКЦ часто не поддерживаются или расположены отдельно от герминальных клеток. Вследствие этого, основные функциональные единицы сперматогенеза – цисты – не формируются, герминальные клетки не вступают в дифференцировку, но, как правило, поддерживаются в течение длительного времени и пролиферируют независимо друг от друга. Как было показано ранее, даже полное удаление из семенников соматических клеток цисты путем индукции в них апоптоза не приводит к потере ранних герминальных клеток (Lim, Fuller, 2012), но полностью останавливает дифференцировку последних. Образование герминальных опухолей в линиях мух, несущих конструкции tj-Gal4>UAS-RNAi или с587-Gal4>UAS-RNAi, обеспечивающих нокдауны тестируемых генов в ранних СКЦ, может быть обусловлено как преждевременной потерей этих клеток, так и нарушением их взаимодействия с герминальными клетками вследствие недостаточной экспрессии комплексов клеточной адгезии или нарушения их сборки и траффика к клеточной мембране. Обнаруженные в скринингах гены, нокдауны которых в соматических клетках цисты приводят к подобным фенотипам, вовлечены в такие клеточные процессы как внутриклеточный мембранный транспорт, адгезию и поддержание клеточной поляризации; формирование внутриклеточной цитоскелетарной системы; процессинг мРНК; убиквитин-зависимый протеолиз и стабилизацию белков; ядерный импорт и экспорт; функционирование ядрышка; функционирование митохондрий; транскрипцию и ремоделирование хроматина; трансляцию; а также другие процессы (табл. 1). Ниже мы рассмотрим некоторые примеры таких генов и белковых комплексов, в которых функционируют их продукты.
Таблица 1.
Функциональная классификация генов, экспрессия которых в ранних соматических клетках цисты существенна для дифференцировки ранних герминальных клеток семенника
| Функциональная классификация | Гены | Ссылки |
|---|---|---|
| Внутриклеточный мембранный транспорт | Bet3, exo84, Rab1, Rab11, Rph, sar1, sec23, sec5, Slh, Syx18, β'Cop, βCop, γCop, ζCOP, CG2023, CG32113 | Liu et al., 2016
Yu et al., 2016 Fairchild et al., 2017 |
| Адгезия и клеточная полярность, цитоскелет | ama, pk, Act88F, chic, form3, pbl, Rho1, tum, nudC, shi, unc-104 | Liu et al., 2016
Yu et al., 2016 Fairchild et al., 2017 |
| Убиквитинирование/стабильность белков | Cct5, Hsc70-4, hyd, Prosα7, Pros26, Pros26.4, Prosβ5, Rpn1, Rpn3, Rpn5, Rpn9, Rpn11, Rpn6, Rpn7, Rpn8, Rpt2, skpA, T-cp1, Uba1, Uba2, Nedd8, CSN7,Tbp-1 | Liu et al., 2016
Yu et al., 2016 Fairchild et al., 2017 Kotov et al., 2020 |
| Ядерный импорт и экспорт | Cas, emb, Fs(2)Ket, msk, Ntf-2, RanGAP | Liu et al., 2016
Yu et al., 2016 Fairchild et al., 2017 Kotov et al., 2020 |
| Ядрышко | bys, l(2)05287, Rs1, CG11920, CG13096 | Yu et al., 2016 Fairchild et al., 2017 |
| Регуляция мРНК | Bx42, cbp20, cbp80, crn, hfp, hrg, l(1)10Bb, Not1, pAbp, Prp19, Prp3, SmB, SmD3, SmE, snRNP-U1-C, CG10418, Sf3b5, Sf3b1, Phf5a, tut | Yu et al., 2016
Fairchild et al., 2017 Kotov et al., 2020 |
| Функционирование митохондрий | ATPsynCF6, ATPsynO, ATPsynβ, Letm1, CG8728 | Liu et al., 2016 Fairchild et al., 2017 |
| Tранскрипция | e(y)1, lab, Spt5, Stat92E, MBD-R2, Ctr9, M1BP | Liu et al., 2016
Yu et al., 2016 Fairchild et al., 2017 |
| Ремоделирование хроматина | Atac2, aurB, BRWD3, сaf1-55, Hat1, Mi-2, mxc, Nipped-A, Ssrp, Su(var)2-10, Su(var)2-HP2, Su(var)3-9, E(bx), iswi, Nurf38 | Badenhorst et al., 2005
Cherry, Matunis, 2010 Liu et al., 2016 Lv et al., 2016Yu et al., 2016 Fairchild et al., 2017 Kotov et al., 2020 |
| Клеточное деление/цитокинез | Cdk1, Cenp-C, CycK, glu, SMC2, SMC3, Spc105R, Cdc37, east | Liu et al., 2016
Yu et al., 2016 Fairchild et al., 2017 |
| Трансляция | eIF-2γ, eIF4A3, eIF5, belle, eIF-1A | Yu et al., 2016
Fairchild et al., 2017 Kotov et al., 2020 |
| Другое | SERCA, Vha26, AsnRS, LeuRS, Akt1, alph, Ance, Strip, Tor, CG10483, INPP5E, l(2)37Cc, Pp2A-29B, Sps1, CG11180, Nfs1, CG7839 | Amoyel et al., 2016b
Liu et al., 2016
Yu et al., 2016 Fairchild et al., 2017 La Marca et al., 2019 |
Комплекс ремоделирования хроматина NURF. Комплексы ремоделирования хроматина участвуют в поддержании самообновления как ГСК, так и ССКЦ, катализируя ряд модификаций хроматина, таких как посттрансляционные модификации гистоновых хвостов, метилирование ДНК, транслокацию и изменение конформации нуклеосом для активации транскрипции (Narlikar et al., 2013). Эти комплексы содержат в своем составе АТФазы, принадлежащие к суперсемейству ДНК-хеликаз. Комплекс Nucleosome-Remodeling Factor (NURF), состоящий из белков NURF301 (E(bx)), Caf1-55 (NURF55), NURF38 и ISWI, АТФ-зависимо регулирует процессы самообновления в обеих популяциях стволовых клеток семенников, герминальных и соматических (Cherry and Matunis, 2010). Этот комплекс действует как позитивный регулятор JAK/STAT-пути в ССКЦ. Мозаичный клональный анализ позволил выяснить, что ССКЦ-клоны, мутантные по nurf301, nurf38 или iswi, не поддерживаются в семенниках и теряются из ниши, вступая в дифференцировку. В ССКЦ-клонах, мутантных по nurf301, обнаруживается пониженный уровень экспрессии STAT92E, и эктопическая экспрессия STAT92E спасает их потерю. Это указывает на то, что данный комплекс действует как позитивный регулятор пути JAK/STAT в ССКЦ и транскрипция stat92E может опосредованно регулироваться NURF (Cherry, Matunis, 2010). В семенниках мутантов, у которых отсутствует экспрессия полноразмерного NURF301, часто возникает остановка мейоза и детектируется нарушение экспрессии ряда генов, необходимых для дифференцировки сперматид (Kwon et al., 2009). Нужно отметить, что Caf1-55 входит в состав нескольких комплексов ремоделирования хроматина, таких как CAF-1 (Chromatin Assembly Factor 1), а также NURF, NuRD (Nucleosome Remodeling and Deacetylase) и PRC2 (Polycomb Repressive Complex 2). Нокдаун caf1-55 в ССКЦ приводит к нарушению формирования цист, разобщению герминальных и соматических клеток на ранних стадиях сперматогенеза и гиперпролиферации ГСК-подобных клеток (Fairchild et al., 2017, Kotov et al., 2020). Таким, образом, Caf1-55 также функционирует в соматических клетках цисты в составе других хроматиновых комплексов, отличных от NURF. Но, поскольку NuRD и другие комплексы не являются необходимыми для поддержания стволовых клеток в семенниках, регуляция ССКЦ и ГСК в нише на уровне хроматина зависит, главным образом, от функционирования NURF (Cherry, Matunis, 2010), а участие Caf1-55 в других комплексах ремоделирования хроматина существенно для программы дифференцировки.
Генетическое взаимодействие было обнаружено между генами комплекса NURF iswi и nurf301 и генами экдизонового каскада usp и E74 (Ables, Drummond-Barbosa, 2010). Мутации в usp и E74 приводят к снижению уровня ISWI. Мутации и нарушение экспрессии iswi приводят к подавлению сигнального пути BMP и преждевременной экспрессия фактора дифференцировки BAM в ГСК (Ables, Drummond-Barbosa, 2010). В соответствии с уменьшением уровня ISWI в нулевых клонах usp и E74 соматических клеток цисты в них наблюдается редуцированный уровень активации BMP. Показано также, что комплекс NURF экдизон-зависимо физически взаимодействует с EcR и экспрессия генов-мишеней экдизонового пути нарушается у мутантов nurf301, подтверждая то, что NURF является ко-активатором EcR (Badenhorst et al., 2005).
РНК-хеликаза Belle как существенный трансляционный регулятор. Недавно мы показали, что РНКi-нокдаун гена belle, кодирующего РНК-хеликазу Belle подсемейства DDX3, в ранних соматических клетках цисты приводит к гиперплазии ГСК-подобных ранних герминальных клеток, аресту их дифференцировки и сегрегации Tj-положительных соматических клеток цисты от герминальных. С помощью CLIP-seq анализа мы определили более 300 генов, транскрипты которых взаимодействуют с Belle в семенниках (Kotov et al., 2020). Belle преимущественно взаимодействует со зрелыми мРНК и функционирует как трансляционный регулятор, и, в соответствии с опубликованными данными, может как активировать, так и подавлять трансляцию транскриптов-мишеней (Ihry et al., 2012; Götze et al., 2017; Liao et al., 2019; Kotov et al., 2020). Среди идентифицированных транскриптов мы обнаружили подмножество из 17 генов, ранее определенных в скрининговых ислледованиях (Liu et al., 2016; Yu et al., 2016; Fairchild et al., 2017), нокдауны которых в ССКЦ приводят к подобному фенотипу. Среди них были обнаружены транскрипты генов Rpn7, Fs(2)Ket, Not1, caf1-55 и др. (Kotov et al., 2020). Not1 является ключевым компонентом комплекса деаденилирования CCR4-Not, вовлечeнного в трансляционную регуляцию мРНК во множестве процессов развития (Temme et al., 2014; Götze et al., 2017). Caf1-55, как упоминалось выше, является компонентом нескольких комплексов ремоделирования хроматина, существенным для поддержания и пролиферации ГСК в семенниках и яичниках (Wen et al., 2012; Angulo et al., 2019). Rpn7 является компонентом протеасомы, а β-импортин Fs(2)Ket вовлечeн в ядерный импорт и экспорт (Yu et al., 2016; Lippai et al., 2000). Нокдауны этих генов в соматических клетках цисты с различной пенетрантностью вызывают формирование опухолеподобных кластеров ГСК-подобных герминальных клеток в семенниках (Liu et al., 2016; Yu et al., 2016; Fairchild et al., 2017; Kotov et al., 2020). Мы полагаем, что нарушение трансляции этих и других мРНК-мишеней в случае нокдауна belle в ССКЦ обеспечивает интегральный вклад в наблюдаемые дефекты сперматогенеза. Эктопическая экспрессия β-интегрина на фоне нокдауна belle в ССКЦ приводит к восстановлению ранних стадий сперматогенеза в 80% случаев, что свидетельствует в пользу гипотезы о нарушении взаимодействия соматических клеток цисты с герминальными благодаря автономным дефектам клеточной адгезиии (Kotov et al., 2020).
Убиквитин-зависимый протеолиз. Как показано в скрининговых исследованиях, нокдауны целого ряда генов в ранних соматических клетках цисты, таких как Rpn1, Rpn7, Rpn11, Rpn12, Rpn8, Rpn9, Rpn3, Rpn5, Tbp-1, Prosα7, Prosβ1, Prosβ5, Pros26 и Pros26.4, кодирующих компоненты протеасомного комплекса 26S, приводят к дефектам поддержания самих ССКЦ и к гиперпролиферации ГСК-подобных герминальных клеток (Liu et al., 2016; Yu et al., 2016; Fairchild et al., 2017) (табл. 1). Все субстраты протеасомного комплекса 26S должны иметь узнаваемый сигнал и неструктурированную инициирующую область (Bard et al., 2018). Преобладающим сигналом является поли-убиквитиновая цепь, которая формируется ковалентным присоединением убиквитина посредством изопептидной связи с остатком лизина белкового субстрата и последующих присоединений молекул убиквитина к лизинам в убиквитиновой цепи. Полиубиквитинированные белки рекрутируются в протеасому путем взаимодействия с одним из трех убиквитиновых рецепторов комплекса, одним из которых является Rpn1. Среди найденных в скринингах существенных генов также обнаружен Rpn11, кодирующий наиболее важную деубиквитиназу комплекса 26S (Bard et al., 2018). В скринингах также определены гены Uba1 и Uba2 (Fairchild et al., 2017), кодирующие убиквитин-активирующие ферменты, вовлечeнные в убиквитинирование белков (табл. 1). Все эти находки свидетельствует о необходимости протеасомной активности и убиквитин-опосредуемого протеолиза в ССКЦ для их выживания и функционирования (Yu et al., 2016; Fairchild et al., 2017). Потеря ССКЦ и их потомков вследствие дефектов системы внутриклеточного протеолиза белков в соответствии с более ранним исследованием (Lim, Fuller, 2012) неавтономно приводит к нарушению дифференцировки герминальных клеток и их опухолеподобной пролиферации.
ДЕФЕКТЫ ДИФФЕРЕНЦИРОВОЧНОЙ ПРОГРАММЫ СПЕРМАТОГОНИЕВ ПРИ НАРУШЕНИИ ЭКСПРЕССИИ БЕЛКОВЫХ ФАКТОРОВ В СОМАТИЧЕСКИХ КЛЕТКАХ ЦИСТЫ
Выявлена ещe одна категория генов, нокдауны которых в СКЦ не приводят к нарушению их поддержания, но неавтономно вызывают дефекты развития сперматогониев, что выражается в нарушении контроля численности митозов и часто приводит к гиперпролиферации сперматогониев из-за повышенной частоты их синхронных делений. В этом случае переключение на программу роста и развития сперматоцитов не происходит, и семенники постепенно наполняются большими кластерами ранних герминальных и соматических клеток. Анализ кандидатных генов, чей нокдаун неавтономно приводит к нарушениям развития на стадии сперматогониев, выявил обогащение генами, связанными с процессом эндоцитоза, такими как Rab5, Chc, Vps16A, Sec15, и AP-1-2β (Fairchild et al., 2017), а также генами компонентов гистон-ацетилтрансферазного комплекса Tip60 HAT и другими (Liu et al., 2016; Yu et al., 2016; Fairchild et al., 2017) (табл. 2).
Таблица 2.
Функциональная классификация генов, экспрессия которых в соматических клетках цисты существенна для морфогенеза сперматогониев и сперматоцитов
| Функциональная классификация | Гены | Ссылки |
|---|---|---|
| Эндоцитоз | AP-1-2β, Chc, Rab5, sec15, Vps16A, AP-2μ, Syx1A, Syx7 | Fairchild et al., 2017 Tang et al., 2017 |
| Адгезия, клеточная полярность, цитоскелет | cora, dlg1, l(2)gl, Lac, Nrx-IV, scrib, Cdc42, ssh, aPKC, baz, par-1, par-6, pck, sinu | Yu et al., 2016
Fairchild et al., 2017 Dubey P. et al., 2019 Papagiannouli et al., 2019 Brantley, Fuller, 2019 |
| Убиквитинирование/стабильность белков | alien, CSN1b, CSN3 | Fairchild et al., 2017 |
| Ядерный импорт и экспорт | Kap-α3 | Fairchild et al., 2017 |
| Регуляция мРНК | Atx2, IntS8, LSm7, pix, Pop2, Cnot7, snRNP-U1-70K, U2af50, CG6066 | Yu et al., 2016 Fairchild et al., 2017 |
| Функционирование митохондрий | ATPsynB, ATPsynγ, Mtch, Tom40 | Fairchild et al., 2017 |
| Ремоделирование хроматина | Tip60, Domino, Reptin, Ing3, BAP55, E(Pc) | Liu et al., 2016 Yu et al., 2016Fairchild et al., 2017 Feng et al., 2017 |
| Другое | Atpα, cngl, MED19, MED4, chico, SA, CG5589, CG9609, CkIIβ, CkIα, mts | Liu et al., 2016 Fairchild et al., 2017 |
Малая ГТФаза Rab5. Нокдаун гена Rab5, кодирующего малую ГТФазу, вовлечeнную в эндосомальный мембранный транспорт от поверхности клетки, приводит к эктопической аккумуляции, как соматических клеток цисты, так и ранних герминальных клеток в семенниках. Эти герминальные клетки имеют тонкие, многократно разветвляющиеся фузомы, соединяющие эти клетки в синцитиальные структуры. Найдено, что эктопические соматические клетки цисты экспрессируют специфический маркер ССКЦ транскрипционный фактор Zfh1, что позволяет предположить, что нокдаун Rab5 вызывает нарушение функционирования внутриклеточных сигнальных каскадов в этих клетках. В семенниках дикого типа экспрессия Zfh1 в СКЦ, отошедших от хаба, подавляется, позволяя таким клеткам дифференцироваться самим и контролировать дифференцировку герминальных клеток. Нокдаун Rab5, предположительно, может подавлять способность соматических клеток цисты обрабатывать сигналы, исходящие из хаба, и в этом случае в гониабластах и сперматогониях путь BMP остается активным, что останавливает их дифференцировку (Tang et al., 2017). Известно, что сигнальные пути JAK/STAT и Hedgehog независимо поддерживают экспрессию Zfh1 в ССКЦ (Leatherman, DiNardo 2008; Michel et al., 2012). Таким образом, Rab5 в ранних СКЦ модулирует работу нескольких сигнальных путей, таких как JAK/STAT и Hedgehog, возможно также влияя на уровень экспрессии лигандов сигнального пути BMP.
Гистонацетилтрансферазный комплекс Tip60 HAT. Enhancer of Polycomb (E(Pc)) – консервативный представитель генов группы Polycomb, который распространен от дрожжей до млекопитающих и является существенным для регуляции структуры хроматина у разных видов, функционируя в составе гистонацетилтрансферазного комплекса Tip60 HAT, ацетилирующего гистоны H4 и H2A (Kusch et al., 2004; Clapier, Cairns, 2009). По данным скрининговых исследований экспрессия E(Pc) и еще шести компонентов комплекса, Tip60, Domino, Reptin, Ing3, Nipped-A и BAP55 в соматических клетках цисты является существенной для сперматогенеза дрозофилы (Liu et al., 2016; Yu et al., 2016; Fairchild et al., 2017) (табл. 2). Нокдаун E(Pc) в ранних СКЦ приводит к опухолеподобному накоплению ранних герминальных клеток, соответствующих, в большинстве случаев, сперматогониальной стадии дифференцировки, и накоплению избытка ССКЦ-подобных соматических клеток, экспрессирующих одновременно как ранние маркеры Zfh1 и Yan, так и маркер поздних соматических клеток цисты Eya (Feng et al., 2017; Fairchild et al., 2017). Таким образом, E(Pc) способствует дифференцировке соматических клеток цисты с помощью репрессии ССКЦ-специфических транскрипционных факторов Zfh1 и Yan, а нокдаун E(Pc) останавливает дифференцировку как соматических, так и герминальных клеток. E(Pc) в СКЦ действует в составе комплекса Tip60 HAT, содержащего Tip60 как каталитический компонент, и регулирует уровень ацетилирования гистона H4 в генах-мишенях. С помощью ChIP-seq экспериментов были выявлены многочисленные гены-мишени E(Pc) в СКЦ. Три основных категории мишеней представлены генами, кодирующими компоненты сигнальных путей; генами, ответственными за чекпойнт-контроль повреждения ДНК; и генами, кодирующими гистон-модифицирующие ферменты (Feng et al., 2017). В частности обогащены гены сигнальных путей EGFR, JAK/STAT, Wnt и Notch, что подтверждает важную роль E(Pc) и Tip60 в координации взаимодействия между соматическими и герминальными клетками семенников в процессе дифференцировки. ChIP-seq анализ позволил идентифицировать значительное обогащение E(Pc) на геномных локусах, содержащих гены пути JAK/STAT, domeless, hopscotch, stat92E и zfh1. Эксперименты с применением репортeрных конструкций показывают, что E(Pc) подавляет активность сигнального пути JAK/STAT в потомках ССКЦ (Feng et al., 2017). Возможной мишенью E(Pc) является ген yan, функционирующий как антагонист пути EGFR (Lai, Rubin, 1992). Потенциально E(Pc) может рассматриваться как ключевой регулятор взаимодействия между соматическими и герминальными клетками в семенниках дрозофилы, обеспечивающий тонкую настройку деятельности различных сигнальных путей.
ПОДАВЛЕНИЕ АКТИВАЦИИ СИГНАЛЬНОГО ПУТИ JNK КОМПЛЕКСОМ АПИКАЛЬНОЙ ПОЛЯРНОСТИ PAR НЕОБХОДИМО ДЛЯ ВЫЖИВАНИЯ СПЕРМАТОЦИТОВ
Белковый комплекс апикальной полярности Par, состоящий из таких компонентов как Bazooka (Baz), Par-6 и aPKC, высоко консервативен от нематод до человека (Baum and Georgiou, 2011). Функции комплекса Par необходимы в СКЦ для подавления активации сигнального пути Jun-киназы (JNK) (Timmons et al., 2016). РНКi-опосредованные нокдауны компонентов комплекса Par, aPKC, par-6 или baz, в соматических клетках цисты не вызывают потери самих этих клеток, но неавтономно приводят к прогрессирующей потере ранних сперматоцитов (Fairchild et al., 2017; Brantley, Fuller, 2019) (табл. 2). При этом дифференцирующиеся герминальные клетки в таких семенниках успешно проходят через митотическую программу сперматогониев. Неавтономная гибель сперматоцитов внутри цист зависит от экспрессии в соматических клетках цисты эндосомальной малой ГТФазы Rab35. Гибель сперматоцитов вследствие нокдауна компонентов комплекса Par, по-видимому, не связана с разрушением барьера проницаемости цисты, созданного контактами между двумя СКЦ. Согласно предложенным моделям (Brantley, Fuller, 2019), нарушение функции комплекса Par в соматических клетках цисты приводит к гибели сперматоцитов благодаря активации пути JNK, который может осуществлять секрецию про-апоптотических сигналов в сперматоциты через эндосомальный транспорт с помощью Rab35. Альтернативно, Rab35 может также функционировать параллельно с сигнальным путем JNK с потерей функции комплекса Par, вызывая фагоцитоз погибших сперматоцитов соматическими клетками цисты.
ЭКСПРЕССИЯ КОМПОНЕНТОВ МИКРОТРУБОЧЕК И КОМПЛЕКСОВ ДИНЕИНА И ДИНАКТИНА В СОМАТИЧЕСКИХ КЛЕТКАХ ЦИСТЫ НЕОБХОДИМА НА ПОЗДНИХ СТАДИЯХ ДИФФЕРЕНЦИРОВКИ СПЕРМАТИД
После образования гаплоидных сперматид вследствие мейоза, начинается морфогенетический процесс превращения их в зрелую сперму. Одновременно с удлинением сперматид СКЦ также претерпевают ряд изменений, становясь структурно различными. Соматическая клетка цисты, оказавшаяся в хвостовой части элонгирующей цисты, значительно увеличивается в размерах, чтобы приспособиться к удлиненным хвостам сперматид, тогда как головная соматическая клетка в передней части растет в меньшей степени (Zoller, Shulz, 2012; Dubey et al., 2016). По мере созревания сперматид, головная соматическая клетка формирует вокруг головок удлиненных сперматид шапочкообразную структуру, обогащенную молекулами актина, комплексами клеточной адгезии и комплексом Arp2/3 (табл. 3). Любые мутации или нокдауны, приводящие к нарушению формирования шапочки, приводят к остановке развития на этой стадии (Desay et al., 2009; Dubey et al., 2016; Fairchild et al., 2017). Ещe одна категория генов, нокдауны которых неавтономно вызывают дефекты развития сперматид, представлена генами, ассоциированными с функциями клеточного транспорта, зависимого от микротрубочек (табл. 3). Среди них гены компонентов комплексов динеина и динактина, Dhc64C, Dlic и DCTN1-p150 (Glued), а также субъединиц микротрубочек, такие как αTub84B, αTub85E, βTub60D и βTub97EF. Несмотря на корректное прохождение митотической и мейотической стадий сперматогенеза, нокдауны этих генов в СКЦ приводят к уменьшению численности удлиненных сперматид в семенниках и нарушению процесса их индивидуализации, в результате чего индивидуальные сперматозоиды не попадают в семенной пузырeк (Fairchild et al., 2017). Тогда как специфический нокдаун динактина 1 (Glued) в СКЦ не нарушает исходную инкапсуляцию герминальных клеток в цисте, он нарушает упорядоченность β-тубулин-содержащих микротрубочек в СКЦ и целостность цист на стадии морфогенеза сперматид (Fairchild et al., 2017).
Таблица 3.
Функциональная классификация генов, экспрессия которых в соматических клетках цисты существенна для процесса формирования и индивидуализации сперматид
| Функциональная классификация | Гены | Ссылки |
|---|---|---|
| Эндоцитоз | Arf102F, Crag, dor, endoB, Rab7, Rbcn-3A, Rep, sec71, Snap29, Syx5, Vps25 | Yu et al., 2016 Fairchild et al., 2017 |
| Адгезия и клеточная полярность | DE-cadherin | Fairchild et al., 2017 |
| Актиновый цитоскелет | Act5C, AnxB10, Arp1, Arp2, Arp3, Arpc1, Arpc2, Arpc5, DCTN2-p50, RacGAP84C, zip | Desai et al., 2009 Dubey et al., 2016 Fairchild et al., 2017 |
| Тубулиновый цитоскелет | Dhc64C, Dlic, DCTN5-p25, DCTN1-p150, msps, sw, αTub84B, αTub85E, βTub60D, βTub97EF | Yu et al., 2016 Fairchild et al., 2017 |
| Регуляция мРНК | me31B, CG2021 | Yu et al., 2016 Fairchild et al., 2017 |
| Функционирование митохондрий | blw, COX5A, cype, mRpS10, ND-23, ND-42, ND-51, ND-75, ND-B18 | Fairchild et al., 2017 |
| Убиквитинирование/стабильность белков | Hsf, Hsp83, l(2)tid | Fairchild et al., 2017 |
| Другое | ZnT49B, da, yki, bun, msn, Pten, pyr, Hlc, PI4KIIIα, schlank, sktl, TER94 | Yu et al., 2016 Fairchild et al., 2017 |
ЗАКЛЮЧЕНИЕ И ПЕРСПЕКТИВЫ
Поддержание и дифференцировка герминальных клеток базируются на клеточно-автономных и неавтономных механизмах. Правильная регуляция пролиферации, адгезии и селекции герминальных клеток для их предназначения осуществляется при помощи сигналов из соматического микроокружения. Секретируемые лиганды и питательные вещества, поступающие из соматических клеток, регулируют сохранение идентичности и самообновление ГСК, контролируют их пролиферацию и дифференцировку потомков на протяжении всего сперматогенеза. Сложная сеть взаимодействий между сигнальными путями с элементами обратной связи, функционирующая для производства гамет, идентифицирована лишь частично к настоящему времени. Результаты недавних исследований, включающие генетические скрининги, полногеномные и транскриптомные исследования, обеспечивают новые данные для улучшенного понимания неавтономной регуляции поддержания и дифференцировки герминальных стволовых клеток, осуществляемой соматическими клетками цисты. Выявлены существенные комплексы, ответственные за ремоделирование хроматина и регуляцию транскрипции на различных стадиях дифференцировки, протеасомные комплексы, компоненты машины эндоцитоза и факторы регуляции трансляции множества транскриптов, необходимых для нормального сперматогенеза. Исследования, осуществленные при использовании Drosophila как модельного организма, способствуют лучшему пониманию неавтономных функций соматических клеток семенников в поддержании сперматогенеза на всех его стадиях. Мы предполагаем актуальность и полезность этих исследований для изучения широкого круга эукариотических организмов, в том числе и человека. Дальнейшее изучение механизмов, обеспечивающих непрерывное производство гамет с постоянной скоростью в течение репродуктивного возраста, важно для понимания возникновения таких патологий, как бесплодие, онкологические заболевания, а также возрастные нарушения.
Список литературы
Ables E.T., Drummond-Barbosa D. The steroid hormone ecdysone functions with intrinsic chromatin remodeling factors to control female germline stem cells in Droso-phila // Cell Stem Cell. 2010. V. 7. № 5. P. 581–592.
Ables E.T., Drummond-Barbosa D. Steroid hormones and the physiological regulation of tissue-resident stem cells: Lessons from the Drosophila ovary // Curr. Stem Cell Rep. 2017. V. 3. № 1. P. 9–18.
Amlani S., Vogl A.W. Changes in the distribution of microtubules and intermediate filaments in mammalian Sertoli cells during spermatogenesis // Anat. Rec. 1988. V. 220. № 2. P. 143–160.
Amoyel M. et al. Socs36E controls niche competition by repressing MAPK signaling in the Drosophila testis // PLoS Genet. 2016a. V. 12. № 1. P. e1005815.
Amoyel M. et al. Somatic stem cell differentiation is regulated by PI3K/Tor signaling in response to local cues // Development. 2016b. V. 143. № 21. P. 3914–3925.
Amoyel M. et al. Hedgehog is required for CySC self-renewal but does not contribute to the GSC niche in the Drosophila testis // Development. 2013. V. 140. № 1. P. 56–65.
Amoyel M., Simons B.D., Bach E.A. Neutral competition of stem cells is skewed by proliferative changes downstream of Hh and Hpo // EMBO J. 2014. V. 33. № 20. P. 2295–2313.
Angulo B. et al. DREF genetically counteracts Mi-2 and Caf1 to regulate adult stem cell maintenance // PLoS Genet. 2019. V. 15 № 6. P. e1008187.
Arbouzova N.I., Zeidler M.P. JAK/STAT signalling in Drosophila: insights into conserved regulatory and cellular functions // Development. 2006. V. 133. № 14. P. 2605–2516.
Badenhorst P. et al. The Drosophila nucleosome remodeling factor NURF is required for Ecdysteroid signaling and metamorphosis // Genes Dev. 2005. V. 19. № 21. P. 2540–2545.
Bard J.A.M. et al. Structure and function of the 26S proteasome // Annu. Rev. Biochem. 2018. V. 87. P. 697–724.
Baum B., Georgiou M. Dynamics of adherens junctions in epithelial establishment, maintenance, and remodeling // J. Cell Biol. 2011. V. 192. P. 907–917.
Brand A.H., Perrimon N. Raf acts downstream of the EGF receptor to determine dorsoventral polarity during Drosophila oogenesis // Genes Dev. 1994. V. 8. № 5. P. 629–639.
Brantley S.E., Fuller M.T. Somatic support cells regulate germ cell survival through the Baz/aPKC/Par6 complex // Development. 2019. V. 146. № 8. P. dev169342.
Boyle M., DiNardo S. Specification, migration and assembly of the somatic cells of the Drosophila gonad // Development. 1995. V. 121. P. 1815–1825.
Chen D., McKearin D. Dpp signaling silences bam transcription directly to establish asymmetric divisions of germline stem cells // Curr. Biol. 2003. V. 13. P. 1786–1791.
Chen H., Chen X., Zheng Y. The nuclear lamina regulates germline stem cell niche organization via modulation of EGFR signaling // Cell Stem Cell. 2013. V. 13. № 1. P. 73–86.
Cherry C.M., Matunis E.L. Epigenetic regulation of stem cell maintenance in the Drosophila testis via the nucleosome-remodeling factor NURF // Cell Stem Cell. 2010. V. 6. № 6. P. 557–567.
Clapier C.R., Cairns B.R. The biology of chromatin remodeling complexes // A. Rev. Biochem. 2009. V. 78. P. 273–304.
Dietzl G. et al. A genome-wide transgenic RNAi library for conditional gene inactivation in Drosophila // Nature. 2007. V. 448. P. 151–156.
DiNardo S. et al. lines and bowl affect the specification of cyst stem cells and niche cells in the Drosophila testis // Development. 2011. V. 138. P. 1687–1696.
De Cuevas M., Matunis E.L. The stem cell niche: lessons from the Drosophila testis // Development. 2011. V. 138. № 14. P. 2861–2869.
Desai B.S., Shirolikar S., Ray K. F-actin-based extensions of the head cyst cell adhere to the maturing spermatids to maintain them in a tight bundle and prevent their premature release in Drosophila testis // BMC Biol. 2009. V. 7. P. 19.
Dubey P. et al. Atypical septate junctions maintain the somatic enclosure around maturing spermatids and prevent premature sperm release in Drosophila testis // Biol. Open. 2019. V. 8. № 2. P. pii: bio036939.
Dubey P. et al. Localized, reactive F-actin dynamics prevents abnormal somatic cell penetration by mature spermatids // Dev. Cell. 2016. V. 38. № 5. P. 507–521.
Fabrizio J.J., Boyle M., DiNardo S. A somatic role for eyes absent (eya) and sine oculis (so) in Drosophila spermatocyte development // Dev. Biol. 2003. V. 258. № 1. P. 117–128.
Fairchild M.J., Islam F., Tanentzapf G. Identification of genetic networks that act in the somatic cells of the testis to mediate the developmental program of spermatogenesis // PLoS Genet. 2017. V. 13. № 9. P. e1007026.
Fairchild M.J., Smendziuk C.M., Tanentzapf G. A somatic permeability barrier around the germline is essential for Drosophila spermatogenesis // Development. 2015. V. 142. P. 268–281.
Feng L., Shi Z., Chen X. Enhancer of polycomb coordinates multiple signaling pathways to promote both cyst and germline stem cell differentiation in the Drosophila adult testis // PLoS Genet. 2017. V. 13. № 2. P. e1006571.
Flaherty M.S. et al. chinmo is a functional effector of the JAK/STAT pathway that regulates eye development, tumor formation, and stem cell self-renewal in Drosophila // Dev. Cell. 2010. V. 18. № 4. P. 556–568.
Flaherty M.S. et al. Genome-wide expression profiling in the Drosophila eye reveals unexpected repression of notch signaling by the JAK/STAT pathway // Dev. Dyn. 2009. V. 238. № 9. P. 2235–2253.
Forbes A., Lehmann R. Nanos and Pumilio have critical roles in the development and function of Drosophila germline stem cells // Development. 1998. V. 125. № 4. P. 679–690.
Fuller M.T. Genetic control of cell proliferation and differentiation in Drosophila spermatogenesis // Semin. Cell Dev. Biol. 1998. V. 9. № 4. P. 433–444.
Gleason R.J. et al. Protecting and diversifying the germline // Genetics. 2018. V. 208. № 2. P. 435–471.
Greenbaum M. et al. Germ cell intercellular bridges // Cold Spring Harb. Perspect. Biol. 2011. V. 3. № 8. P. a005850.
Greenspan L.J., de Cuevas M., Matunis E. Genetics of gonadal stem cell renewal // Annu. Rev. Cell. Dev. Biol. 2015. V. 31. P. 291–315.
Griswold M.D. The central role of Sertoli cells in spermatogenesis // Semin. Cell. Dev. Biol. 1998. V. 9. P. 411–416.
Gönczy P., DiNardo S. The germ line regulates somatic cyst cell proliferation and fate during Drosophila spermatogenesis // Development. 1996. V. 122. № 8. P. 2437–2447.
Götze M. et al. Translational repression of the Drosophila nanos mRNA involves the RNA helicase Belle and RNA coating by Me31B and Trailer hitch // RNA. 2017. V. 23. № 10. P. 1552–1568.
Hardy R. et al. The germinal proliferation center in the testis of Drosophila melanogaster // J. Ultrastructure Res. 1979. V. 69. P. 180–190.
Hasan S., Hétié P., Matunis E.L. Niche signaling promotes stem cell survival in the Drosophila testis via the JAK-STAT target DIAP1 // Dev. Biol. 2015. V. 404. № 1. P. 27–39.
Hsu T.H. et al. The Hippo pathway acts downstream of the Hedgehog signaling to regulate follicle stem cell maintenance in the Drosophila ovary // Sci. Rep. 2017. V. 7. № 1. P. 4480.
Hudson A.G. et al. A temporal signature of epidermal growth factor signaling regulates the differentiation of germline cells in testes of Drosophila melanogaster // PLoS One. 2013. V. 8. № 8. P. e70678.
Ihry R.J., Sapiro A.L., Bashirullah A. Translational control by the DEAD Box RNA helicase belle regulates ecdysone-triggered transcriptional cascades // PLoS Genet. 2012. V. 8. P. e1003085.
Inaba M., Buszczak M., Yamashita Y.M. Nanotubes mediate niche-stem-cell signalling in the Drosophila testis // Nature. 2015. V. 523. № 7560. P. 329–332.
Issigonis M. et al. JAK-STAT signal inhibition regulates competition in the Drosophila testis stem cell niche // Science. 2009. V. 326. № 5949. P. 153–156.
Jiang X.H. et al. Blood-testis barrier and spermatogenesis: lessons from genetically–modified mice // Asian J. Androl. 2014. V. 16. № 4. P. 572–580.
Jemc J.C. Somatic gonadal cells: the supporting cast for the germline // Genesis. 2011. V. 49. № 10. P. 753–775.
Kawase E. et al. Gbb/Bmp signaling is essential for maintaining germline stem cells and for repressing bam transcription in the Drosophila testis // Development. 2004. V. 131. № 6. P. 1365–1375.
Kiger A.A. et al. Stem cell self–renewal specified by JAK-STAT activation in response to a support cell cue // Science. 2001. V. 294. № 5551. P. 2542–2545.
Kiger A.A., White-Cooper H., Fuller M.T. Somatic support cells restrict germline stem cell self–renewal and promote differentiation // Nature. 2000. V. 407. № 6805. P. 750–754.
Kitadate Y., Kobayashi S. Notch and Egfr signaling act antagonistically to regulate germline stem cell niche formation in Drosophila male embryonic gonads // Proc. Natl. Acad. Sci. U. S. A. 2010. V. 107. P. 14241–14246.
Kopera I.A. et al. Sertoli-germ cell junctions in the testis: a review of recent data // Philos. Trans. R. Soc. Lond. B. Biol. Sci. 2010. V. 365. № 1546. P. 1593–1605.
Kotov A.A. et al. Progress in understanding the molecular functions of DDX3Y (DBY) in male germ cell development and maintenance // Biosci. Trends. 2017. V. 11. № 1. P. 46–53.
Kotov A.A. et al. The Drosophila RNA helicase belle (DDX3) non-autonomously suppresses germline tumorigenesis via regulation of a specific mRNA set // Cells. 2020. V. 9. P. 550.
Kusch et al. Acetylation by Tip60 is required for selective histone variant exchange at DNA lesions // Science. 2004. V. 306. P. 2084–2087.
Kwon S.Y. et al. Alternative splicing of NURF301 generates distinct NURF chromatin remodeling complexes with altered modified histone binding specificities // PLoS Genet. 2009. V. 5. № 7. P. e1000574.
Lai Z.C., Rubin G.M. Negative control of photoreceptor development in Drosophila by the productof the yan gene, an ETS domain protein // Cell. 1992. V. 70. P. 609–620.
La Marca J.E. et al. Strip and Cka negatively regulate JNK signalling during Drosophila spermatogenesis // Development. 2019. V. 146. № 13. P. dev174292.
Leatherman J.L., Dinardo S. Germline self-renewal requires cyst stem cells and stat regulates niche adhesion in Drosophila testes // Nat. Cell. Biol. 2010. V. 12. № 8. P. 806–811.
Leatherman J.L., Dinardo S. Zfh-1 controls somatic stem cell self-renewal in the Drosophila testis and nonautonomously influences germline stem cell self-renewal // Cell Stem Cell. 2008. V. 3. № 1. P. 44–54.
Liao S.E. et al. DEAD-box RNA helicase Belle posttranscriptionally promotes gene expression in an ATPase activity-dependent manner // RNA. 2019. V. 25. P. 825–839.
Lim J.G., Fuller M.T. Somatic cell lineage is required for differentiation and not maintenance of germline stem cells in Drosophila testes // Proc. Natl. Acad. Sci. USA. 2012. V. 109. № 45. P. 18477–18481.
Li M.A. et al. The large Maf factor Traffic Jam controls gonad morphogenesis in Drosophila // Nat. Cell. Biol. 2003. V. 5. № 11. P. 994–1000.
Li Y. et al. Steroid signaling promotes stem cell maintenance in the Drosophila testis // Dev. Biol. 2014. V. 394. № 1. P. 129–141.
Lippai M. et al. The Ketel gene encodes a Drosophila homologue of importin-beta // Genetics. 2000. V. 156. P. 1889–1900.
Liu Y. et al. Whole-animal genome-wide RNAi screen identifies networks regulating male germline stem cells in Drosophila // Nat. Commun. 2016. V. 7. P. 12149.
Lu Y., Yao Y., Li Z. Ectopic Dpp signaling promotes stem cell competition through EGFR signaling in the Drosophila testis // Sci. Rep. 2019. V. 9. № 1. P. 6118.
Lv X. et al. SUMO regulates somatic cyst stem cell maintenance and directly targets the Hedgehog pathway in adult Drosophila testis // Development. 2016. V. 143. № 10. P. 1655–1662.
Ma Q., Wawersik M., Matunis E.L. The Jak-STAT target Chinmo prevents sex transformation of adult stem cells in the Drosophila testis niche // Dev. Cell. 2014. V. 31. № 4. P. 474–486.
Matunis E.L., Stine R.R., de Cuevas M. Recent advances in Drosophila male germline stem cell biology // Spermatogenesis. 2012. V. 2. P. 137–144.
McKearin D.M., Spradling A.C. bag-of-marbles: a Drosophila gene required to initiate both male and female gametogenesis // Genes Dev. 1990. V. 4. № 12B. P. 2242–2251.
Michel M. et al. Hh signalling is essential for somatic stem cell maintenance in the Drosophila testis niche // Development. 2012. V. 139. № 15. P. 2663–2669.
Michel M. et al. Local BMP receptor activation at adherens junctions in the Drosophila germline stem cell niche // Nat. Commun. 2011. V. 2. P. 415.
Morrison S.J., Spradling A.C. Stem cells and niches: mechanisms that promote stem cell maintenance throughout life // Cell. 2008. V. 132. P. 598–611.
Morris L.X., Spradling A.C. Steroid signaling within Drosophila ovarian epithelial cells sex-specifically modulates early germ cell development and meiotic entry // PLoS One. 2012. V. 7. № 10. P. e46109.
Mo J.S., Park H.W., Guan K.L. The Hippo signaling pathway in stem cell biology and cancer // EMBO Rep. 2014. V. 15. P. 642–656.
Nel-Themaat L. et al. Sertoli cell behaviors in developing testis cords and postnatal seminiferous tubules of the mouse // Biol. Reprod. 2011. V. 84. P. 342–350.
Ng C.L., Qian Y., Schulz C. Notch and Delta are required for survival of the germline stem cell lineage in testes of Drosophila melanogaster // PLoS One. 2019. V. 14. № 9. P. e0222471.
Narlikar G.J., Sundaramoorthy R., Owen-Hughes T. Mechanisms and functions of ATP-dependent chromatin-remodeling enzymes // Cell. 2013. V. 154. P. 490–503.
Oatley J.M., Brinster R.L. The germline stem cell niche unit in mammalian testes // Physiol. Rev. 2012. V. 92. P. 577–595.
Ohlstein B., McKearin D. Ectopic expression of the Drosophila Bam protein eliminates oogenic germline stem cells // Development. 1997. V. 124. № 18. P. 3651–3662.
Oh H., Irvine K.D. In vivo regulation of Yorkie phosphorylation and localization // Development. 2008. V. 135. P. 1081–1088.
Okegbe T.C., DiNardo S. The endoderm specifies the mesodermal niche for the germline in Drosophila via Delta-Notch signaling // Development. 2011. V. 138. P. 1259–1267.
Papagiannouli F., Berry C.W., Fuller M.T. The Dlg module and clathrin-mediated endocytosis regulate EGFR signaling and cyst cell-germline coordination in the Drosophila testis // Stem Cell Reports. 2019. V. 12. № 5. P. 1024–1040.
Parisi M. et al. Paucity of genes on the Drosophila X chromosome showing male-biased expression // Science. 2003. V. 299. P. 697–700.
Park J.K. et al. The miRNA pathway intrinsically controls self-renewal of Drosophila germline stem cells // Curr. Biol. 2007. V. 17. № 6. P. 533–538.
Parrott B.B. et al. Control of germline stem cell division frequency–a novel, developmentally regulated role for epidermal growth factor signaling // PLoS One. 2012. V. 7. № 5. P. e36460.
Phillips B.T., Gassei K., Orwig K.E. Spermatogonial stem cell regulation and spermatogenesis // Philos. Trans. R. Soc. Lond. B. Biol. Sci. 2010. V. 365. P. 1663–1678.
Qian Y. et al. Ecdysone signaling opposes epidermal growth factor signaling in regulating cyst differentiation in the male gonad of Drosophila melanogaster // Dev. Biol. 2014. V. 394. № 2. P. 217–227.
Ren F., Zhang L., Jiang J. Hippo signaling regulates Yorkie nuclear localization and activity through 14-3-3 dependent and independent mechanisms // Dev. Biol. 2010. V. 337. P. 303–312.
Santos A.C., Lehmann R. Germ cell specification and migration in Drosophila and beyond // Curr. Biol. 2004. V. 14. № 14. P. R578–R589.
Sarkar A. et al. Antagonistic roles of Rac and Rho in organizing the germ cell microenvironment // Curr. Biol. 2007. V. 17. № 14. P. 1253–1258.
Schulz C. et al. Signaling from germ cells mediated by the rhomboid homolog stet organizes encapsulation by somatic support cells // Development. 2002. V. 129. № 19. P. 4523–4534.
Sheng X.R. et al., Jak-STAT regulation of male germline stem cell establishment during Drosophila embryogenesis // Dev. Biol. 2009. V. 334. P. 335–344.
Shields A.R. et al. The actin-binding protein profilin is required for germline stem cell maintenance and germ cell enclosure by somatic cyst cells // Development. 2014. V. 141. № 1. P. 73–82.
Shilo B.Z. The regulation and functions of MAPK pathways in Drosophila // Methods. 2014. V. 68. № 1. P. 151–159.
Schofield R. The relationship between the spleen colony-forming cell and the haemopoietic stem cell // Blood Bells. 1978. V. 4. P. 7–25.
Shivdasani A.A., Ingham P.W. Regulation of stem cell maintenance and transit amplifying cell proliferation by TGF-β signaling in Drosophila spermatogenesis // Curr. Biol. 2003. V. 13. P. 2065–2072.
Singh S.R. et al. The novel tumour suppressor Madm regulates stem cell competition in the Drosophila testis // Nat. Commun. 2016. V. 7. P. 10473.
Singh S.R. et al. Competitiveness for the niche and mutual dependence of the germline and somatic stem cells in the Drosophila testis are regulated by the JAK/STAT signaling // J. Cell Physiol. 2010. V. 223. № 2. P. 500–510.
Spradling A. et al. Germline stem cells // Cold Spring Harb. Perspect. Biol. 2011. V. 3. P. a002642.
Stine R.R., Matunis E.L. JAK-STAT signaling in stem cells // Adv. Exp. Med. Biol. 2013. V. 786. P. 247–267.
Stine R.R. et al. Coordinate regulation of stem cell competition by Slit-Robo and JAK-STAT signaling in the Drosophila testis // PLoS Genet. 2014. V. 10. № 11. P. e1004713.
Suárez-Quian C.A., Niklinski W. Immunocytochemical localization of the epidermal growth factor receptor in mouse testis // Biol. Reprod. 1990. V. 43. № 6. P. 1087–1097.
Sun S., Zhao S., Wang Z. Genes of Hippo signaling network act unconventionally in the control of germline proliferation in Drosophila // Dev. Dyn. 2008. V. 237. P. 270–275.
Tang Y. et al. Germline proliferation is regulated by somatic endocytic genes via JNK and BMP signaling in Drosophila // Genetics. 2017. V. 206. № 1. P. 189–197.
Temme C., Simonelig M., Wahle E. Deadenylation of mRNA by the CCR4-NOT complex in Drosophila: molecular and developmental aspects // Front. Genet. 2014. V. 5. P. 143.
Timmons A.K. et al. Phagocytosis genes nonautonomously promote developmental cell death in the Drosophila ovary // Proc. Natl. Acad. Sci. U.S.A. 2016. V. 113. P. 1246–1255.
Tran J., Brenner T.J., DiNardo S. Somatic control over the germline stem cell lineage during Drosophila spermatogenesis // Nature. 2000. V. 407. P. 754–757.
Tulina N., Matunis E. Control of stem cell self-renewal in Drosophila spermatogenesis by JAK-STAT signaling // Science. 2001. V. 294. № 5551. P. 2546–2549.
Valli H. et al. Germline stem cells: Toward the regeneration of spermatogenesis // Fertil. Steril. 2014. V. 101. P. 3–13.
Voog J., D’Alterio C., Jones D.L. Multipotent somatic stem cells contribute to the stem cell niche in the Drosophila testis // Nature. 2008. V. 454. P. 1132–1136.
Voog J. et al. Escargot restricts niche cell to stem cell conversion in the Drosophila testis // Cell Rep. 2014. V. 7. № 3. P. 722–734.
Vorontsova Y.E. et al. Drosophila as a model system used for searching the genes, signaling pathways, and mechanisms controlling cytoskeleton formation // Russ. J. Dev. Biol. 2019. V. 50. P. 1–8.
Wang Z., Lin H. The division of Drosophila germline stem cells and their precursors requires a specific cyclin // Curr. Biol. 2005. V. 15. P. 328–333.
Wieschaus E., Szabad J. The development and function of the female germ line in Drosophila melanogaster: a cell lineage study // Dev. Biol. 1979. V. 68. P. 29–46.
Wen P., Quan Z., Xi R. The biological function of the WD40 repeat-containing protein p55/Caf1 in Drosophila // Dev. Dyn. 2012. V. 241. P. 455–464.
Whitworth C., Jimenez E., Van Doren M. Development of sexual dimorphism in the Drosophila testis // Spermatogenesis. 2012. V. 2. № 3. P. 129–136.
Wu S. et al. The TEAD/TEF family protein Scalloped mediates transcriptional output of the Hippo growth-regulatory pathway // Dev. Cell. 2008. V. 14. P. 388–398.
Xie T., Spradling A.C. decapentaplegic is essential for the maintenance and division of germline stem cells in the Drosophila ovary // Cell. 1998. V. 94. № 2. P. 251–260.
Xie T., Spradling A.C. A niche maintaining germ line stem cells in the Drosophila ovary // Science. 2000. V. 290. P. 328–330.
Xu T., Rubin G.M. Analysis of genetic mosaics in developing and adult Drosophila tissues // Development. 1993. V. 117. P. 1223–1237.
Yu J. et al. Protein synthesis and degradation are essential to regulate germline stem cell homeostasis in Drosophila testes // Development. 2016. V. 143. № 16. P. 2930–2945.
Zhang Z. et al. Dual roles of Hh signaling in the regulation of somatic stem cell self-renewal and germline stem cell maintenance in Drosophila testis // Cell Res. 2013. V. 23. № 4. P. 573–576.
Zoller R., Schulz C. The Drosophila cyst stem cell lineage: Partners behind the scenes? // Spermatogenesis. 2012. V. 2. № 3. P. 145–157.
Дополнительные материалы отсутствуют.


