Онтогенез, 2021, T. 52, № 1, стр. 46-55
Сравнительный анализ паттернов экспрессии генов семейства Noggin на ранних стадиях развития головных структур европейской речной миноги Lampetra fluviatilis
Г. В. Ермакова a, А. В. Кучерявый b, А. Г. Зарайский a, А. В. Байрамов a, *
a Федеральное государственное учреждение науки Институт биоорганической химии им. акад. М.М. Шемякина
и Ю.А. Овчинникова РАН
117997 Москва, ул. Миклухо-Маклая, 16/10, Россия
b Федеральное государственное учреждение науки Институт проблем экологии и эволюции им. А.М. Северцова РАН
119071 Москва, Ленинский проспект, 33, Россия
* E-mail: andrbayr@gmail.com
Поступила в редакцию 21.07.2020
После доработки 27.08.2020
Принята к публикации 04.09.2020
Аннотация
В контексте изучения механизмов раннего развития нервной системы позвоночных, бесчелюстные (круглоротые) являются уникальной группой животных. Поскольку ветви бесчелюстных и челюстноротых разделились на самых ранних этапах эволюции позвоночных, у генов миног, как представителей бесчелюстных, с большой вероятностью, могли сохраниться древние экспрессионные паттерны, характерные для предков позвоночных. Предыдущие исследования генов семейства Noggin челюстноротых показали, что все три гена Noggin позвоночных (Noggin1, Noggin2 and Noggin4) отличаются по паттерну экспрессии и функциональным свойствам. Было показано участие генов Noggin в широком спектре онтогенетических процессов, в том числе раннем развитии переднеголовных структур и отделов головного мозга позвоночных. В этой статье мы анализируем паттерны экспрессии четырех генов Noggin в головных структурах личинок европейской речной миноги Lampetra fluviatilis на ранних стадиях развития. Проведенный анализ обнаруживает много общих черт в паттернах экспрессии генов Noggin миног с их гомологами у челюстноротых. Ген NogginB, демонстрируя высокий уровень экспрессии в конечном отделе мозга (теленцефалоне), может примененяться в качестве специфического маркера этого уникального отдела мозга позвоночных, впервые появляющегося в эволюции именно у бесчелюстных.
ВВЕДЕНИЕ
Миноги, как представители бесчелюстных, являются очень привлекательной моделью для исследований эволюционных аспектов биологии развития в силу того, что разделение ветвей бесчелюстных и челюстноротых произошло на самых ранних стадиях эволюции позвоночных. На основании этого, можно предположить, что гены миног могли сохранить типы паттернов экспрессии, характерные для предковых позвоночных. Исследуя особенности экспрессии ранних регуляторных генов миног, как представителей круглоротых и их пространственную связь с развитием какого-либо морфологического признака, характерного для всех позвоночных, можно попытаться оценить, был ли этот ген изначально связан с появлением определенного признака в эволюции у предков современных позвоночных, или же экспрессия этого гена характерна только для челюстноротых. Такой подход может позволить выявить гены, участвовавшие в формировании признаков и структур у предковых позвоночных, а также выявить механизмы, обеспечившие появление того или иного признака в эволюции позвоночных.
Одним из важнейших эволюционных достижений позвоночных стало появление конечного мозга (теленцефалона), обеспечивающего высшие формы нервной деятельности у животных и человека. Вопрос наличия гомологов конечного мозга у ближайших родственников позвоночных – представителей бесчерепных и оболочников обсуждается, однако доминирующей на сегодняшний день является точка зрения, согласно которой, у современных бесчерепных (и, вполне возможно, у предковых форм хордовых) в качестве переднего отдела ЦНС выступает гомолог промежуточного отдела мозга позвоночных, а конечный отдел мозга появляется в эволюции позже, только у позвоночных (Albuixech-Crespo et al., 2017). В то же время, есть свидетельства, что после метаморфоза в мозговом пузыре взрослого ланцетника был обнаружен домен, близкий по своей геноархитектуре нейроэпителию развивающихся коры и подкорковой области позвоночных (Benito Gutierrez et al., 2018). Что касается оболочников, то в сенсорном пузыре личинки асцидии была обнаружена экспрессия гена Hroth – единственного гомолога гена Otx позвоночных. Характер экспрессии обнаруженного гена HrPax2/5/8 отличался от гомологичных ему генов Pax2, Pax5 и Pax8 позвоночных. Были также обнаружены три Hox гена, гомологичные генам Hoxb1, Hox3, Hox5 (Wada et al., 1998).
Полученные данные показывают, что сегментация нервной системы на основные отделы – передний (прозенцефалон + средний мозг), средний (продолговатый мозг) и задний (спинной мозг) отделы наблюдаются у всех хордовых что, по всей видимости, является отражением появления такой дифференцировки еще до эволюционного разделения бесчерепных, оболочников и позвоночных. Однозначных свидетельств наличия у беспозвоночных хордовых гомологов конечного мозга пока не выявлено, что позволяет считать этот отдел мозга уникальной структурой позвоночных.
В связи с этим, большое внимание исследователей привлекает строение головного мозга миног, и особенно конечного мозга, который морфологически впервые в эволюции появляется именно у этой группы животных.
На макроуровне, в плане сегментации на основные отделы, головной мозг миног имеет много общих черт с мозгом костистых рыб, за исключением ряда особенностей, таких как хорошо развитый эпифиз, расположенный сзади назального отверстия, и очень слабо развитый мозжечок (Sugahara et al., 2017). При исследовании геноархитектуры конечного мозга миног, в его дорсальной части была обнаружена экспрессия генов Pax6 (Murakami et al., 2001) и Emx (Tank et al., 2009), а в вентральной – генов Dlx (Miojin et al., 2001; Murakami et al., 2001; Neidert et al., 2002). Обнаружение зон экспрессии Pax6 и Dlx и стало на ранних этапах исследований основным свидетельcтвом наличия у миног структур, гомологичных конечному мозгу челюстноротых.
Поиск консервативных для позвоночных переднеголовных генов у миног, в сочетании с исследованиями на миксинах, привели к тому, что в последние годы у миног был обнаружен ряд новых для них генов, что внесло коррективы в сложившуюся ранее картину геноархитектуры передних отделов мозга. Были найдены два ортолога гена Nkx2.1 – гены Nkx2.1/2.4B и Nkx2.1/2.4C, экспрессия которых наблюдается в вентральной зоне подкорковой области конечного мозга (Sugahara et al., 2016). Также у миног были обнаружены три ортолога гена Pax6. Все они экспрессируются в формирующихся глазных структурах и мозге, что соответствует экспрессии гена Pax6 у челюстноротых, у которых этот ген является ключевым регулятором развития глаз и ЦНС (Osumi et al., 2008; Klimova and Kozmik, 2014). При этом паттерн экспрессии генов Pax6 миног в других структурах различается. Экспрессия Pax6a обнаруживается в печени, указывая на то, что у предков позвоночных ген Pax6, по всей видимости, участвовал в формировании этого органа (Ravi et al., 2019).
Экспрессия раннего регулятора развития мозга – гена Otx у миног, начинается на самых ранних этапах онтогенеза, в районе спинной губы бластопора, а у личинки наблюдается в области переднего и среднего отделов мозга, до границы между средним и задним мозгом (Tomsa and Langeland, 1999; Suda et al., 2009).
Ингибитором экспрессии гена Otx у позвоночных и одним из ключевых регулятоорв ранней дифференцировки переднего мозга позвоночных являются гомеобоксные гены класса Anf/Hesx1 (далее Anf), обнаруженные в том числе у миног (Bayramov et al., 2016, Байрамов и др., 2017). Проведенные функциональные исследования гена Lanf (Lamprey Anf) показали, что этот ген миног по своим свойствам сходен с генами Anf челюстноротых, обладает ингибиторной активностью, подавляя экспрессию гена Otx и усиливая экспрессию ключевого регулятора развития конечного мозга – гена FoxG1. Это указывает на то, что появление генов класса Anf было существенным, если не ключевым, фактором в возникновении у позвоночных структур конечного мозга (Bayramov et al., 2016).
Белок, кодируемый геном FoxG1, относится к семейству Forkhead-связывающих транскрипционных факторов и играет ключевую роль в индукции и пространственной организации развития конечного мозга у позвоночных. Экспрессия FoxG1 в переднем отделе мозга достаточно консервативна у разных групп позвоночных и, поэтому этот ген часто применяется в качестве маркера данного отдела мозга (Kumamoto and Hanashima, 2017). У всех исследованных позвоночных FoxG1 (ранее также известный как BF-1), является одним из первых транскрипционных факторов, экспрессирующихся в передней части нервной пластинки – области будущего конечного мозга и в дальнейшем его экспрессия сохраняется до зрелых стадий (Danesin and Houart, 2012). Было показано, что ген FoxG1 имеет важное значение для многих аспектов развития конечного мозга и выживания нейронов в коре головного мозга у взрослых организмов. Блокирование трансляции FoxG1 у рыб и мышей приводит к редукции вентральной области конечного мозга, что отражается в вентральной экспансии маркеров дорсальной части конечного мозга (Martynoga et al., 2005; Danesin et al., 2009). У человека мутации гена FOXG1 приводят к нарушениям развития, таким как синдром Ретта, эпилепсия, постнатальная микроцефалия, тяжелая умственная отсталость, нарушения речи, дискинезия и гипогенез мозолистого тела (Kortum et al., 2011; Danesin, Houart, 2012).
Пространственный паттерн экспрессии FoxG1 у миног в целом соответствует паттернам экспрессии FoxG1 у других позвоночных, в том числе у шпорцевой лягушки (Ermakova et al., 2019). В тоже время имеется и ряд отличий. Так, экспрессия FoxG1 у миноги впервые в развитии детектируется в формирующихся ушных плакодах и вентаральной части теленцефалона. При этом у миноги FoxG1 совсем не экспрессируется в дорсальной части теленцефалона, тогда как у других позвоночных экспрессия этого гена в теленцефалоне носит градиентный характер, с возрастаниеми интенсивности от дорсальной части к вентральной (Danesin and Houart, 2012). Также у миноги в отличие от других позвоночных экспреcсия FoxG1 не обнаруживается в формирующихся глазных структурах, что может объясняться особенностью развития этих структур у миног. В отличие от челюстноротых у миног наблюдается двухступенчатое развитие глаза и зрительного нерва. На эмбриональной стадии глаз покрыт толстой непрозрачной кожей, хрусталик незрелый что, возможно, указывает на примитивное состояние зрительной системы позвоночных (Melendez-Ferro et al., 2002; Suzuki et al., 2015). В этот период образуется небольшое количество волокон зрительного нерва. Позже в онтогенезе формируются новые оптические волокна, и после метаморфоза у взрослых миног развиваются полноценные глазные камеры.
Важными регуляторами раннего развития структур переднего мозга позвоночных являются гены семейства Noggin. Noggin стал первым известным фактором, в норме секретирующимся в области Шпеманновского организатора, для которого была показана способность вызывать формирование дополнительных осей тела в случаях его экспериментальной эктопической экспрессии на вентральной стороне зародыша амфибий (Dale, Slack, 1987; Smith, Harland, 1992; Lamb et al., 1993; Smith et al., 1993; Slack, Tannahill, 1993). Впоследствии были описаны два гомолога гена Noggin – Noggin2 и Noggin4 (Fletcher et al., 2004; Eroshkin et al., 2006). Долгое время считалось, что основной (по сути – единственной описанной) функцией Noggin1 в развитии позвоночных является подавление сигнального каскада BMP (bone morphogenetic proteins) – группы ростовых факторов из суперсемейства TGF-beta. Модуляция активности BMP каскада является необходимым условием для формирования нервной ткани и дифференцировки дорсальной мезодермы (Xanthos et al., 2002; Moreau and Leclerc, 2004). При исследовании гена Noggin2 было показано, что он обладает способностью подавлять не только BMP, но также и Nodal/Activin и Wnt/beta-cathenin сигнальные каскады, играющих ключевые роли в клеточной дифференцировке и развитии головных структур позвоночных. Оверэкспрессия мРНК Noggin2 в зародышах X. laevis приводит к формированию дополнительного комплекса осевых структур в которых наблюдается экспрессия переднеголовных генов (Bayramov et al., 2011).
В настоящей работе мы описываем особенности пространственной экспрессии генов семейства Noggin на ранних стадиях развития головных структур у личинок европейской речной миноги L. fluviatilis. У миног было обнаружено четыре гена семейства Noggin – NogginA, NogginB, NogginC и NogginD. Проведенный нами ранее анализ аминокислотных последовательностей выявил гомологию этих белков Noggin миног с тремя белками семейства Noggin (Noggin1, Noggin2, Noggin4) челюстноротых.
Анализ паттернов экспрессии генов Noggin миног с одной стороны обнаружил существенные различия в экспрессии четырех генов между собой, а с другой стороны – выявил ряд общих черт с экспрессией ортологов этих генов у челюстноротых.
Интенсивная экспрессия гена NogginB в конечном отделе мозга делает возможным использование этого гена в качестве специфического маркера этого отдела головного мозга миног. Исследование механизмов развития теленцефалона у миног вызывает большой интерес, поскольку как раз у них этот отдел переднего появляется впервые в эволюции.
МАТЕРИАЛЫ И МЕТОДЫ
Животные
Взрослые половозрелые особи L. fluviatilis были выловлены в Ленинградской области. Зародыши получались путем искусственного оплодотворения в лабораторных условиях. Икра половозрелых самок сдаивалась в контейнер и активировалась в растворе 0.1× MMR (температура 12°C) в течение 3 мин при постоянном помешивании. После активации в раствор добавлялась сперма половозрелого самца, икра инкубировалась 10 мин при постоянном помешивании. После оплодотворения икра дважды промывалась раствором 0.1× MMR. Инкубация осуществлялась в чашках Петри (9 см) на 12°C. Стадии определялись согласно Tahara (Tahara, 1988). Для гибридизации in situ зародыши фиксировались в растворе MEMFA.
Гибридизация in situ
Фрагменты генов NogginA, NogginB, NogginC и NogginD для гибридизации in situ были получены методом ОТ-ПЦР с использованием следующих пар праймеров:
Lf_NgA_full_Frw1: ATTGGATCCGGTGCCCGCGGCTCCATGAA;
Lf_NgA_full_Frw2: ATTGAATTCGCCACCATGAACTGTGGTCGTGTGGA;
Lf_NgA_full_Rev1: AATCTCGAGTACAGGGCTGGTCTCAG;
Lf_NgA_full_Rev2: AATCTCGAGTCAGCAGGCGCAGCGGCA;
Lf_NgB_full_Frw1: ATTGGATCCCGCGCCGAGACCATCAT;
Lf_NgB_full_Frw2: ATTGAATTCGCCACCATGCCGGGGTCCCTGCG;
Lf_NgB_full_Rev1: AATCTCGAGCCCTCGTCGTCTCAGCAG;
Lf_NgB_full_Rev2: AATCTCGAGTCAGCAGGAGCACCTGCACTCG;
Lf_NgC_full_Frw1: ATTGGATCCCGTATGCCGAACAAATGGAG;
Lf_NgC_full_Frw2: ATTGAATTCGCCACCATGGAGCAGTCGCAGTGTT;
Lf_NgC_full_Rev1: AATCTCGAGCGGATGTCCCCCCATCAGC;
Lf_NgC_full_Rev2: AATCTCGAGTCAGCACGAGCATTTG;
Lf_NgD_full_Frw1: ATTGAATTCACTTCGACGCAGCCATGGA;
Lf_NgD_full_Frw2: ATTGAATTCGCCACCATGGATGTGAAGAGC;
Lf_NgD_full_Rev1: AATCTCGAGTTTGCTGCGGGGAGATTCA;
Lf_NgD_full_Rev2: AATCTCGAGTCACTCCCATCCGTGTCC.
В первом раунде ПЦР (30 циклов) применялись праймеры Frw1 и Rev1. После этого полученный ПЦР продукт очищался и использовался в качестве матрицы в следующем раунде ПЦР (20 циклов) с праймерами Frw2 и Rev2.
Для ПЦР использовался набор фирмы Evrogen с полимеразой Encyclo. Полученные кДНК фрагменты было и клонированы в вектор pAL2-T (Evrogen) и отсеквенированы.
Гибридизация in situ была проведена на целых зародышах согласно протоколу, описанному в Sugahara et al., 2015. Оболочку зародышей удаляли микропинцетами до фиксации. Фиксацию проводили в растворе параформальдегида (MEMFA) в течение ночи на 4°C. Предгибридизационный и гибридизационный буфер содержали: 50% формамид, 5× SSC, 100 мкг/мл гепарин, 100 мкг/мл tRNA, 5 мМ EGTA, 1% chaps, 2% Tween20. После предгибридизации (1 ч 70°C), зародышы инкубировались ночь на 70°C в гибридизационном буфере содержащем 5 мкг/мл Dig-меченой РНК пробы, промывались (дважды в гибридизационном буфере, дважды в двухкратном растворе SSC на 70°C, дважды в 0.2-кратном растворе SSC при комнатной температуре, а также в растворе MAB) и инкубировались в блокирующем буфере (MAB + 2% блокирующего реагента (Roch) + 20% телячьей сыворотки (Sigma)) 2 ч при комнатной температуре. Затем эмбрионы инкубировались с антиDig-Fab фрагментом, конъюгированным с алкалиновой фосфатазой (фирмы Roche, разведение 1 : 1500 в блокирующем буфере) в течение ночи на 4°C.
Затем эмбрионы были 8 раз промыты в буфере MABT (MAB + 0.1% Triton X100) и помещены в алкалинфосфатазный буфер на 20 мин при комнатной температуре. Краситель BM purple (Roch) был использован для проявки.
30 мкм срезы гибридизованных эмбрионов выполнялись на вибратоме Microm HM 650 (зародыши помещались в 4% агарозные блоки).
Фотографирование производилось на стереомикорскопе Leica M205.
Анализ паттернов экспрессии на каждой стадии проводился не менее чем на 10 зародышах. В статье приведены паттерны, вопроизводившиеся не менее чем в 90% случаев.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Пространственные паттерны экспрессии генов Noggin были проанализированы методом гибридизации in situ на целых зародышах речной миноги L. fluviatilis и срезах. В этих экспериментах мы анализировали экспрессию генов Noggin речной миноги на серии стадий, начиная со стадии 11 (стадия поздней бластулы по Tahara, 1988) и до стадии предличинки (стадия 29). В качестве зондов применялись dig-меченые антисмысловые полноразмерные мРНК генов Noggin. В качестве контроля использовали dig-меченые полноразмерные смысловые мРНК генов Noggin. Проведенный анализ дал следующие результаты.
Ни у одного из четырех проанализированных генов Noggin речной миноги не было обнаружено экспрессии на стадиях бластулы и гаструлы методом гибридизации in situ.
Экспрессия гена NogginA впервые обнаруживается в хордомезодерме начиная со на стадии ранней нейрулы (ст. 17). В дорзальной области зачатка будущего головного экспрессия впервые наблюдается на стадии поздней нейрулы (ст. 20).
На стадии головного выроста (ст. 22) отчетливо видна экспрессия в области промежуточного, среднего и заднего мозга.
На стадиях 23–24 в головном мозге экспрессия обнаруживается на границе конечного и промежуточного отделов – в области zona limitans intrathalamica (ZLI) и на границе промежуточного и среднего мозга и в заднем мозге по границам некоторых ромбомеров. Во всех этих районах экспрессия обнаруживается в клетках дорсальной и вентральной частей нервной трубки. На стадии 27 появляется экспрессия в формирующихся глазах. Кроме головных структур, экспрессия гена NogginA выявляется в сомитах и хорде.
Экспрессия гена NogginB впервые появляется на стадии ранней нейрулы в головном отделе нервной трубки. Предположительно, это могут быть клетки нервного гребня или клетки презумптивного головного мозга. В ходе нейруляции экспрессия NogginB усиливается в области всего презумптивного переднего и заднего мозга и в отдельных дорсальных клетках нервной трубки – в премиграторных клетках нервного гребня. К завершению нейруляции паттерн меняется – экспрессия в области переднего мозга усиливается, а экспрессия в дорсальной части заднего мозга ослабевает.
На стадии головного выроста (ст. 21) NogginB экспрессируется в области презумптивного переднего мозга и в дальнейшем, на стадиях 22–29 высокий уровень экспрессии сохраняется в дорсальной и вентральной части переднего мозга и в небольшой области вентрального гипоталамуса.
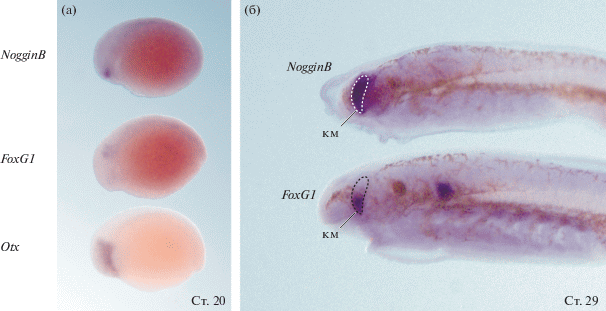
Обобщая, можно сказать, что NogginB экспрессируется в эволюционно молодых структурах – клетках нервного гребня и переднего мозга, которые появились впервые у позвоночных животных. Сравнение паттерна экспрессии гена NogginB с паттерном другого регуляторно гена переднего мозга, гена FoxG1, показывает, что в отличие от FoxG1, который экспрессируется в вентральной области теленцефалона, NogginB экспрессируется на высоком уровне во всем теленцефалоне, частично распространяясь на на вентральную область промежуточноого отдела мозга (рис. 1г).
Рис. 1.
Паттерны экспрессии генов NogginA, NogginB, NogginC, NogginD и FoxG1 в раннем развитии европейской речной миноги, показаные методом гибридизации in situ. (а) На стадии головного выроста (ст. 22–23 по Tahara, 1988) ген NogginA экспрессируется в головных структурах и мезодермальных производных. (б) На стадии предличинки (ст. 27 по Tahara, 1988) ген NogginA экспрессируется в ZLI, на границе промежуточного и среднего мозга и в заднем мозге по границам некоторых ромбомеров. (в, г) Ген NogginB экспрессируется в области конечного мозга. (д) Ген NogginС экспрессируется в головных структурах и мезодермальных производных. (е) На стадии предличинки наблюдается экспрессия NogginC в области конечного мозга. (ж, з) Паттерн экспрессии гена NogginD носит диффузный характер. (и, к) На стадии головного выроста экспрессия гена FoxG1 наблюдается в ушной плакоде, а экспрессия в области вентрального конечного мозга начинается позже. гсзм – граница среднего и заднего мозга, км – конечный мозг, zli – zona limitans intrathalamica.
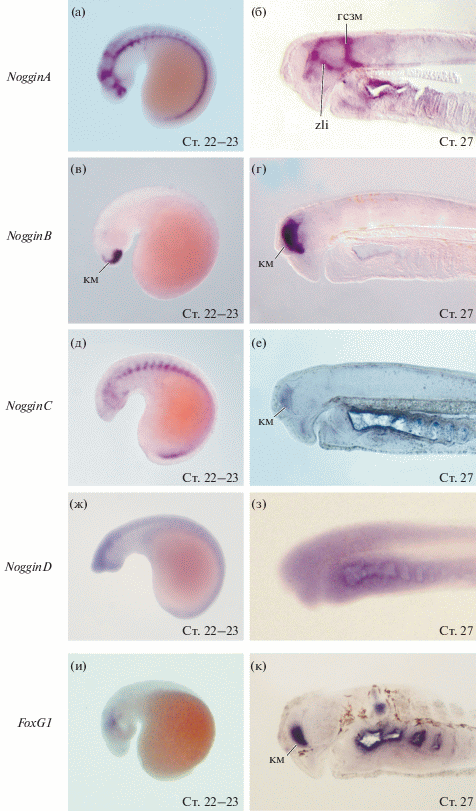
Экспрессия NogginC наблюдается на стадии поздней нейрулы (ст. 20) в области ушных плакод и в клетках нервного гребня. На более поздних стадиях окрашивается нервная трубка и мезодерма сомитов и верхней и нижней губы.
На стадии 24–25 появляется экспрессия NogginC в вентральной области конечного мозга и эпифизе. Также наблюдается слабое окрашивание в промежуточном отделе мозга в области ZLI и на границе среднего и заднего мозга. Экспрессия наблюдается также в конечном отделе мозга и здесь она более выражена в вентральной его части. Выявляется окраска в формирующихся ушах, но эндолимфатический проток не окрашивается.
Можно отметить, что, по своему характеру, паттерн экспрессии NogginС частично совмещает паттерны экспрессии генов NogginA (экспрессия в клетках нервного гребня, ZLI, на границе среднего и заднего мозга и в мезодерма) и NogginB (экспрессия в конечном мозге и клетках нервного гребня).
Экспрессия NogginD, как и у других генов Noggin речной миноги, обнаруживается начиная со стадии ранней нейрулы (ст. 17), однако имеет диффузный характер, равномерно окрашивая нервную пластинку. На следующих стадиях развития, вплоть до предличиночной стадии (ст. 29) мы наблюдали лишь слабое диффузное окрашивание во всей нервной системе. Такой паттерн очень похож на паттерн экспрессии гена Noggin4 у челюстноротых.
Предыдущие исследования генов семейства Noggin челюстноротых показали, что все три гена Noggin позвоночных (Noggin1, Noggin2 и Noggin4) отличаются по паттерну экспрессии и функциональным свойствам. Было показано, что белки Noggin1 и Noggin2 обладают способостью ингибировать активность трех сигнальных каскадов BMP, Nodal/Activin, Wnt, что само по себе является важным условием формирования переднеголовных структур (Watanabe et al., 2005). Это подтверждается способностью мРНК Noggin1 и Noggin2 индуцировать формирование дополнительных осей тела, содержащих переднеголовные структуры при эктопической экспрессии в экспериментах с зародышами шпорцевой лягушки (Eroshkin et al., 2006, 2016; Bayramov et al., 2011).
Исследуя экспрессию гена Noggin у шпорцевой лягушки, Smith и Harland показали, что мРНК этого гена сначала локализуется в области дорсальной губы бластопора, т.е. в области Шпеманновского организатора, а затем в хорде (Smith, Harland, 1992).
Ген Noggin2 начинает экспрессироваться у шпорцевой лягушки на стадии нейрулы в области переднего нервного валика, а на более поздних стадиях обнаруживается в дорсальной области формирующегося переднего мозга, и, на более низком уровне – в районе заднего мозга, спинных участках сомитов и в формирующемся сердце (Eroshkin et al., 2006).
Ген Noggin4, не обладая способностью выступать в качестве антагониста BMP сигнального каскада, обнаружил способность специфически связывать фактор Wnt8 и ингибировать канонический Wnt/бета-катенин – сигнальный каскад (Eroshkin et al., 2016). Было показано, что экспрессия гена Noggin4 у разных представителей позвоночных консервативна и в значительной степени комплементарна области экспрессии гена Noggin1. Так, у шпорцевой лягушки экспрессия Noggin4 впервые обнаруживается на стадии гаструлы в эпидермальном слое анимального полушария и носит диффузный характер (Eroshkin et al., 2006). На стадии нейрулы экспрессия гена Noggin4 наблюдается в передней части нервной пластинки и области будущего нервного гребня. На более поздних стадиях ген Noggin4 экспрессируется в головном эпидермисе, нервной трубке, включая передний мозг, слуховых пузырьках, присоске и производных нервного гребня, включая жаберные дуги (Eroshkin et al., 2006). Экспресcия гена Noggin4 у куриного эмбриона начинается на стадии гаструлы (стадия 4+ (Chapman et al., 2002)) сначала в презумптивной, а затем и в дефинитивной нейроэктодерме, носит диффузный характер и проявляет тенденцию к широкому распространению на производные эктодермы и, частично, на некоторые структуры мезодермальной природы (сомиты) по мере развития зародыша (Borodulin et al., 2012).
На основе представленного анализа паттернов экспресcии генов семейства Noggin, можно заключить, что среди генов Noggin миног обнаруживаются гомологи всех трех ранее описанных генов Noggin позвоночных.
Гены NogginA по характеру экспрессии имеет много общих черт с геном Noggin1 челюстноротых.
Ген NogginB, экспрессирующийся в конечном и промежуточном отделах мозга очень похож на по своему паттерну на ген Noggin2 челюстноротых.
Паттерн экспрессии NogginС, в свою очередь, частично совмещает паттерны экспрессии генов NogginA и NogginB.
Экспрессия NogginD, подобно Noggin4, имеет диффузный характер и наблюдается начиная со стадии нейрулы в нервной пластинке, а позже – всей нервной системе.
В целом, можно отметить, что все четыре гена Noggin миног обладают уникальными особенностями паттерна экспрессии в головных структурах. В то же время, сравнивая их экспрессию с экспрессией генов Noggin шпорцевой лягушки (Eroshkin et al., 2006) можно отметить, что паттерны экспрессии генов Noggin у миног имеют много общих черт, с паттернами экспрессии их гомологов у других позвоночных.
Если сопоставить экспрессию гена NogginB с экспрессией другого переднеголовного гена миног – FoxG1, можно отметить, что экспрессия NogginB в области конечного мозга обнаруживается раньше, уже на стадии поздней нейрулы (ст. 20) и стадии раннего головного выроста (ст. 21), в то время как экспрессия FoxG1 на аналогичных стадиях наблюдается только в ушной и тройничной плакодах (рис. 2). Экспрессия FoxG1 в конечном мозге начинается на стадии 23–24 (Ermakova et al., 2019). На более поздних стадиях, вплоть до стадии предличинки, NogginB экспрессируется во всем конечном мозге, в то время как FoxG1, только в его вентральной части (рис. 2б). С технической точки зрения существенно, что NogginB экспрессируется в конечном мозге с высокой интенсивностью и специфичностью (практически нет фонового окрашивания в других областях зародыша). Это позволяет рассматривать NogginB в качестве перспективного маркерного гена при дальнейших исследованиях развития переднеголовных структур у миног.
ЗАКЛЮЧЕНИЕ
В этой статье мы описываем особенности экспрессии четырех генов семейства Noggin на ранних стадиях развития переднеголовных структур у миног – одних из самых древних ныне живущих позвоночных.
Сравнивая наблюдаемую экспрессию генов Noggin речной миноги с экспрессией генов Noggin шпорцевой лягушки можно отметить, что паттерны экспрессии генов Noggin у миног и челюстноротых имеют много общих черт. Экспрессия трех генов Noggin миног обнаруживается в структурах и организационных центрах головного мозга на ранних этапах его формирования. Ген NogginB, демонстрируя высокий уровень экспрессии в конечном отделе мозга (теленцефалоне) начиная со стадии ранней нейрулы и до личиночной стадии, может примененяться в качестве специфического маркера этого уникального отдела мозга позвоночных, впервые появляющегося в эволюции именно у миног.
Список литературы
Байрамов А.В., Ермакова Г.В., Ерошкин Ф.М. и др. Гомеобоксный ген семейства Anf, обнаруженный у тихоокеанской миноги Lethenteron camtschaticum, подтверждает гипотезу о важности появления генов Anf для возникновения конечного мозга в эволюции позвоночных // Онтогенез. 2017. Т. 48. № 4. С. 241–251.
Albuixech-Crespo B., Herrera-Úbeda C., Marfany G. et al., Origin and evolution of the chordate central nervous system: insights from amphioxus genoarchitecture // Int. J. Dev. Biol. 2017. V. 61. P. 655–664.
Bayramov A.V., Ermakova G.V., Eroshkin F.M. et al. The presence of the Anf/Hesx1 homeobox in lampreys indicates that it may play important role in telencephalon emergence // Sci. Rep. 2016. V. 6. P. 39849.
Bayramov A.V., Eroshkin F.M., Martynova N.Y. et al. Novel functions of Noggin proteins: inhibition of Activin/ Nodal and Wnt signaling // Development. 2011. V. 138. P. 5345–5356.
Benito Gutierrez E., Stemmer M., Rohr S.D. et al. Patterning of a elencephalon-like region in the adult brain of amphioxus // bioRxiv. 2018. V. 307629.
Borodulin A.V., Eroshkin F.M., Bayramov A.V. et al. Noggin4 expression during chick embryonic development // The International J. Developmental Biology. 2013. V. 56. P. 403–406.
Chapman S.C., Schubert F.R., Schoenwolf G.C. et al. Analysis of spatial and temporal gene expression patterns in blastula and gastrula stage chick embryos // Dev. Biol. 2002. V. 1. 245(1). P. 187–199.
Dale L., Slack J.M.W. Regional specification within the mesoderm of early embryos of Xenopus laevis // Development. 1987. V. 100. P. 279–295.
Danesin C., Houart C. A Fox stops the Wnt: implications for forebrain development and diseases // Curr. Opin. Genet. Dev. 2012. V. 22. № 4. P. 323–330.
Danesin C., Peres J.N., Johansson M. et al. Integration of telencephalic Wnt and hedgehog signaling center activities by Foxg1 // Dev. Cell. 2009. V. 16. № 4. P. 576–587.
Ermakova G.V., Kucheryavyy A.V., Zaraisky A.G., Bayra-mov A.V. The expression of FoxG1 in the early development of the European river lamprey Lampetra fluviatilis demonstrates significant heterochrony with that in other vertebrates // Gene Expr. Patterns. 2019. Sep 28; 34:119073. https://doi.org/10.1016/j.gep.2019.119073
Eroshkin F.M., Ermakova G.V., Bayramov A.V. et al. Multiple noggins in vertebrate genome: cloning and expression of noggin2 and noggin4 in Xenopus laevis // Gene Expr Patterns. 2006. V. 6. P. 180–186.
Eroshkin F.M., Nesterenko A.M., Borodulin A.V. et al. Noggin4 is a long-range inhibitor of Wnt8 signalling that regulates head development in Xenopus laevis // Sci. Rep. 2016. V. 6. P. 23049.
Fletcher R.B., Watson A.L., Harland R.M. Expression of Xenopus tropicalis noggin1 and noggin2 in early development: two noggin genes in a tetrapod // Gene Expr. Patterns. 2004. V. 5. P. 225–230.
Klimova L., Kozmik Z. Stage-dependent requirement of neuroretinal Pax6 for lens and retina development // Development. 2014. V. 141. P. 1292–1302.
Kortüm F., Das S., Flindt M. et al. The core FOXG1 syndrome phenotype consists of postnatal microcephaly, severe mental retardation, absent language, dyskinesia, and corpus callosum hypogenesis // J. Med. Genet. 2011. V. 8. № 6. P. 396–406.
Kumamoto T., Hanashima C. Evolutionary conservation and conversion of Foxg1 function in brain development // Dev. Growth Differ. 2017. V. 59. № 4. P. 258–269.
Lamb T.M., Knecht A.K., Smith W.C. et al. Neural induction by secreted polypeptide noggin // Science. 1993. V. 262. P. 713–718.
Martynoga B., Morrison H., Price D.J. et al. Foxg1 is required for specification of ventral telencephalon and region-specific regulation of dorsal telencephalic precursor proliferation and apoptosis // Dev. Biol. 2005. V. 283(1). P. 113–127.
Meléndez-Ferro M., Villar-Cheda B., Abalo X.M. et al. Early development of the retina and pineal complex in the sea lamprey: comparative immunocytochemical study // J. Comp. Neurol. 2002. V. 442. № 3. P. 250–265.
Moreau M., Leclerc C. The choice between epidermal and neural fate: a matter of calcium // Int. J. Dev. Biol. 2004. V. 48(2–3). P. 75–84.
Murakami Y., Ogasawara M., Sugahara F. et al. Identification and expression of the lamprey Pax6 gene: evolutionary origin of the segmented brain of vertebrates // Development. 2001. V. 128(18). P. 3521–3531.
Myojin M., Ueki T., Sugahara F. et al. Isolation of Dlx and Emx gene cognates in an agnathan species, Lampetra japonica, and their expression patterns during embryonic and larval development: conserved and diversified regulatory patterns of homeobox genes in vertebrate head evolution // J. Exp. Zool. 2001. V. 15; 291(1). P. 68–84.
Neidert A.H., Virupannavar V., Hooker G.W. et al. Lamprey Dlx genes and early vertebrate evolution // Proc. Natl. Acad. Sci. USA. 2001. V. 13; 98(4). P. 1665–1670.
Osumi N., Shinohara H., Numayama-Tsuruta K. et al. Concise review: Pax6 transcription factor contributes to both embryonic and adult neurogenesis as a multifunctional regulator // Stem Cells. 2008. V. 26. P. 1663–1672.
Ravi V., Bhatia S., Shingate P. et al. Lampreys, the jawless vertebrates, contain three Pax6 genes with distinct expression in eye, brain and pancreas // Sci. Rep. 2019. V. 9(1). P. 19559.
Slack J.M., Tannahill D. Noggin the dorsalizer // Nature. 1993. V. 361. P. 498–499.
Smith W.C., Knecht A.K., Wu M. et al. Secreted noggin protein mimics the Spemann organizer in dorsalizing Xenopus mesoderm // Nature. 1993. V. 361. P. 547–549.
Smith W.C., Harland R.M. Expression cloning of noggin, a new dorsalizing factor localized to the Spemann orginizer in Xenopus embryos // Cell. 1992. V. 70. P. 829–840.
Suda Y., Kurokawa D., Takeuchi M. et al. Evolution of Otx paralogue usages in early patterning of the vertebrate head // Dev. Biol. 2009. V. 1; 325(1). P. 282–295.
Sugahara F., Murakami Y., Kuratani S. Gene Expression Analysis of Lamprey Embryo. N.Y.: Springer, 2015.
Sugahara F., Pascual-Anaya J., Oisi Y. et al. Evidence from cyclostomes for complex regionalization of the ancestral vertebrate brain // Nature. 2016. V. 531. P. 97–100.
Sugahara F., Murakami Y., Pascual-Anaya J. et al. Reconstructing the ancestral vertebrate brain // Dev. Growth Differ. 2017. V. 59(4). P. 163–174.
Suzuki D.G., Murakami Y., Escriva H. et al. A comparative examination of neural circuit and brain patterning between the lamprey and amphioxus reveals the evolutionary origin of the vertebrate visual center // J. Comp. Neurol. 2015. V. 523. № 2. P. 251–261.
Tahara Y. Normal stages of development in the lamprey, Lampetra reissneri (Dybowski) // Zoological Science. 1988. V. 5. P. 109–118.
Tank E.M., Dekker R.G., Beauchamp K. et al. Patterns and consequences of vertebrate Emx gene duplications // Evol. Dev. 2009. V. 11(4). P. 343–353.
Tomsa J.M., Langeland J.A. Otx expression during lamprey embryogenesis provides insights into the evolution of the vertebrate head and jaw // Dev. Biol. 1999. V. 1; 207(1). P. 26–37.
Wada H., Saiga H., Satoh N. et al. Tripartite organization of the ancestral chordate brain and the antiquity of the placodes: Insights from ascidian Pax-2/5/8, Hox, and Otx genes // Development. 1998. V. 125. P. 1113–1122.
Watanabe K., Kamiya D., Nishiyama A. et al. 2005. Direct differentiation of telencephalic precursors from embryonic stem cells // Nature Neuroscience. V. 8. P. 288–296.
Xanthos J.B., Kofron M., Tao Q. et al. The roles of three signaling pathways in the formation and function of the Spemann Organizer // Development. 2002. V. 129(17). P. 4027–4043.
Дополнительные материалы отсутствуют.