Онтогенез, 2021, T. 52, № 2, стр. 129-136
Влияние фотопериода на липидный профиль сеголеток (0+) атлантического лосося Salmo salar L. при заводских условиях выращивания
Н. Н. Немова a, *, З. А. Нефедова a, С. А. Мурзина a, С. Н. Пеккоева a, В. П. Воронин a, Т. Р. Руоколайнен a
a Институт биологии – обособленное подразделение Федерального государственного бюджетного учреждения науки Федерального исследовательского центра “Карельский научный центр Российской академии наук”
185910 Петрозаводск, ул. Пушкинская, 11, Россия
* E-mail: nnnemova@gmail.com
Поступила в редакцию 25.06.2020
После доработки 04.10.2020
Принята к публикации 10.10.2020
Аннотация
Получены новые данные о влиянии дополнительного освещения на липидный профиль сеголеток 0+ атлантического лосося в процессе роста и развития при искусственном выращивании в заводских условиях. Изучено влияние разных световых режимов: заводское освещение (контроль), экспериментальные режимы – 16 ч освещения и 8 ч затемнения (16:8), постоянное освещение (24:0). У сеголеток, развитие которых проходило в условиях экспериментальных режимов фотопериода, обнаружены специфические модификации липидного профиля, главным образом – в содержании структурных липидов (фосфолипидов), а также индексов соотношений структурных и запасных липидов: холестерин/фосфолипиды (ХЛ/ФЛ) и триацилглицерины/фосфолипиды (ТАГ/ФЛ). Эти изменения в большей степени проявились у молоди лосося, выращиваемой при круглосуточном освещении (24:0).
ВВЕДЕНИЕ
Свет, как абиотический фактор, воздействует на разные аспекты жизнедеятельности рыб. Для каждого вида рыб характерен определенный оптимальный диапазон освещенности, при котором улучшается физиологическое состояние организма, происходит накопление массы. Поэтому при искусственном выращивании молоди лососевых и других видов рыб нередко используются регулируемые световые режимы, которые влияют на рост и развитие молоди (Villarreal et al., 1988; Mäkinen, Ruohonen, 1992; Boeuf, Le Bail, 1999; Taylor et al., 2006; Björnsson et al., 2011). В исследованиях на молоди рыб (форель, белый толстолобик, карп, щука), подращиваемой при переменном световом режиме (искусственном и естественном освещении), показано отличие более высокой скорости роста и максимальной выживаемости (Власов и др., 2013). Например, у карповых рыб при круглосуточном освещении возрастает эффективность конвертирования пищи (Ручин, 2012), в мышцах осетра при переменных режимах (12-часовой смене освещенности) повышается содержание липидов и белков на фоне снижения их оводненности (Ручин, 2007). Показано, что увеличение светового режима с 8 до 16 ч стимулирует рост и развитие молоди лососевых рыб, повышается эффективность потребления корма и его конвертация (Clarke, 1981; Бретт, 1983). Предшествующие условия жизни молоди лосося (сеголеток 0+), связанные с изменением температуры и продолжительностью светового периода, могут в дальнейшем повлиять на сроки смолтификации двухлеток лосося (1+) (Metcalfe, Thorpe, 1990), что важно при их заводском выращивании, поскольку в этом возрасте происходит выпуск молоди в природную среду для поддержания численности природной популяции атлантического лосося.
Известно, что липиды в значительной степени обеспечивают адаптационные способности организма в ответ на специфические условия искусственной среды, включая фотопериод, температуру, аэрацию среды и др. (Murzina et al., 2009; Nemova et al., 2020) и тем самым могут считаться индикаторами роста и развития жизнеспособной молоди лосося. В настоящей работе оценили влияние разных световых режимов (заводское освещение – контроль, экспериментальные режимы – пролонгированное освещение – 16 ч света и 8 ч затемнения, постоянное освещение – 24 ч) на липидный профиль и рост сеголеток 0+ атлантического лосося в условиях искусственного выращивания.
МАТЕРИАЛЫ И МЕТОДЫ
В июле сеголетки (0+) атлантического лосося были перенесены из инкубационного центра в выростные бассейны Выгского рыбоводного завода (Республика Карелия) при достижении соответствующей массы (0.96–1.00 г). После недельной адаптации, в начале августа, был поставлен эксперимент по влиянию разных режимов фотопериода (контроль–заводские условия, режимы 16:8 и 24:0) на липидный профиль сеголеток лосося. В дальнейшем пробы молоди лосося отбирали для биохимического анализа липидов дважды – в сентябре и октябре. Молодь лосося содержалась в бассейнах размером 2 × 2 м. Для каждого из исследуемых экспериментальных режимов освещения, а также для заводского режима (контроль) были определены по два бассейна. Из каждого бассейна с соответствующим режимом освещения забирали равное количество рыб, для формирования смешанной выборки (n = 20). Тем самым, исследовали три группы рыб: контрольная – заводское освещение, экспериментальные – 16:8 (16 ч света и 8 ч затемнения) и круглосуточное/постоянное освещение, 24:0. Описание режимов освещения было ранее представлено в работе Н.Н. Немовой с соавторами (Nemova et al., 2020), в которой обсуждались данные по жирным кислотам и массе у молоди лосося в эксперименте с фотопериодом. Схема эксперимента дана на рис. 1.
Рис. 1.
Схема эксперимента по оценке влияния различных режимов фотопериода на липидный профиль сеголеток атлантического лосося, выращиваемых в условиях Выгского рыбзавода.
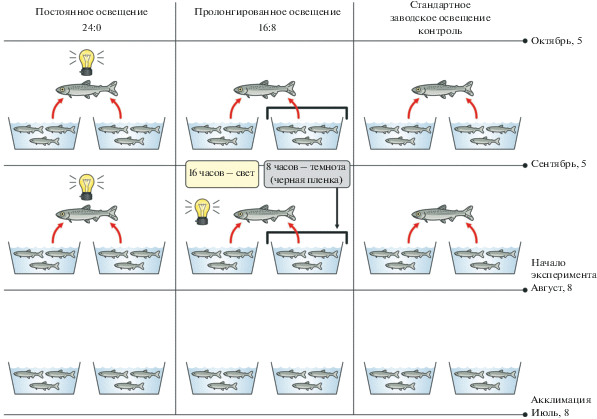
Экспериментальные бассейны были оборудованы двумя светодиодными светильниками (Aquael leddy smart led sunny, 6 W, 6500 K), а для создания затемнения бассейны накрывали черной, непропускающей свет пленкой. Переключение режимов происходило автоматически с помощью розеток-таймеров (Feron TM-50). Все остальные условия содержания для всех бассейнов были одинаковыми: плотность посадки, режим кормления и корм (согласно потребностям возрастной группы), профилактические меры и уход за бассейнами. Для молоди лосося, выращиваемой в условиях завода, использовали коммерческий корм марки BioMar Inicio plus G (Biomar, Danmark) (стартовый корм для сеголеток 0+).
Количество сеголеток, содержащихся в бассейнах составило: 7541 шт. (контроль), 7361 шт. (режим 16:8) и 7400 (режим 24:0). Вода в бассейны поступала с Маткожненского водохранилища (р. Нижний Выг). Температурный режим был естественный. Значения температуры за период исследования составили в августе 18.2–13.8°C, сентябре 13.8–9.8°C, октябре 9.8–2.4°С. Эксперимент проводился до конца октября. Пробы рыб (тушки рыб) на липидный анализ брали в конце каждого месяца.
Взвешивание рыб проводили каждый месяц (по 3–5 раз в месяц) на заводе. Чипирование сеголеток не проводилось вследствие их маленьких размеров, поэтому данные по массе рыб получали по результатам повторных взвешиваний по 70–100 особей вместе. Средняя масса молоди лосося 0+ в начале исследования в разных бассейнах составляла: 0.96 ± 0.07 (контроль), 1.00 ± 0.04 (режим 16:8), 0.96 ± 0.03 (режим 24:0). За весь период эксперимента было собрано 465 проб сеголеток. Кроме того, следует отметить, что “отход” в бассейнах с экспериментальным освещением был ниже по сравнению с контрольным (139 шт., 1.84%) и составил 45 особей (0.61% – режим 16:8), 72 (0.97% – режим 24:0).
Экстракцию липидов из отобранных образцов (тушка) молоди лосося проводили по методу Фолча (Folch et al., 1957) и Кейтс (Кейтс, 1975). Затем липиды концентрировали с помощью роторно-вакуумной установки Heidolph Hei-Vap (Heidolph, Германия). Выделенные суммарные липиды и обезжиренный остаток (включающий белки, углеводы, нуклеиновые кислоты, аминокислоты и микроэлементы) сушили до постоянной массы.
Качественное и количественное определение отдельных липидных классов осуществляли при помощи метода высокоэффективной тонкослойной хроматографии (ВЭТСХ). Фракционирование общих липидов проводили на пластинках на стеклянной основе – HPTLC Silicagel 60 F254 Premium Purity (Merck, Германия). Нанесение экстракта липидов осуществлялось при помощи полуавтоматического аппликатора Linomat 5 (CAMAG, Швейцария) микрошприцом на 100 мкл штриховым методом. В качестве элюента, а также раствора для насыщения хроматографической камеры ADC2 (CAMAG, Швейцария), использовалась система растворителей гексан–диэтиловый эфир–уксусная кислота (32 : 8 : 0.8 по объему) (Olsen, Henderson, 1989). Насыщение хроматографической камеры проводили в течение 20 мин с одновременным контролем влажности (10 мин), после чего проводилось насыщение пластины (20 минут). Дистанция подвижной фазы составляла 80 мм (Rf конечная = 80 мм), сушка пластины осуществлялась в течение 5 мин. Проявление липидных пятен проводили в растворе медного купороса (CuSO4) с ортофосфорной кислотой (H3PO4) и нагреванием пластины до 160°С в течение 15 мин (Hellwig, 2008). Качественное и количественное определение липидных компонентов было выполнено в камере денситометра TLC Scanner 4 (CAMAG, Швейцария) на дейтериевой лампе при длине волны 350 нм в режиме адсорбции (Hellwig, 2008). Идентификация липидных классов проводилась по референтным стандартам соответствующих компонентов (Sigma-Aldrich, США) с учетом соответствия значений Rf. В составе общих липидов анализировали: общие фосфолипиды (ФЛ), триацилглицерины (ТАГ), диацилглицерины (ДАГ), холестерин (ХС), эфиры холестерина (ЭХС), свободные жирные кислоты (СЖК).
Состав индивидуальных фосфолипидов – фосфатидилхолина (ФХ), фосфатидилэтаноламина (ФЭА), фосфатидилсерина (ФС), фосфатидилинозитола (ФИ), сфингомиелина (СФМ), лизофосфатидилхолина (ЛФХ) анализировали методом высокоэффективной жидкостной хроматографии на стальной колонке Nucleosil 100-7 (“Элсико”, Москва), используя элюент ацетонитрил–гексан–метанол–ортофосфорная кислота (918 : 30 : 30 : 17.5). Детектирование проводили по степени поглощения света при 206 нм (Arduini et al., 1996). Соотношение между компонентами оценивали по величинам площадей пиков на хроматограммах.
Данные в табл. 1 и 2 представлены в виде M ± SE (ошибка среднего арифметического). Обработка результатов проводилась при помощи непараметрического метода теста ранговых сумм Вилкоксона–Манна–Уитни в открытой среде программирования R (Коросов, Горбач, 2007). Различия считаются достоверными при p ≤ 0.05.
Таблица 1.
Содержание общих липидов и липидных классов (фосфолипиды, триацилглицерины, диацилглицерины, эфиры холестерина, холестерин, свободные жирные кислоты) (% сухой массы) у сеголеток атлантического лосося (Salmo salar L.), выращиваемых на Выгском рыбоводном заводе при разных световых режимах. Обозначения: n – число проб, 16:8 – 16 ч освещения и 8 ч затемнения, 24:0 – постоянное освещение, ОЛ – общие липиды, ФЛ – фосфолипиды, ТАГ – триацилглицерины, ДАГ – диацилглицерины, ЭХС – эфиры холестерина, ХС – холестерин, СЖК – свободные жирные кислоты
| Месяц | Сентябрь | Октябрь | ||||
|---|---|---|---|---|---|---|
| Режим освещения | Контроль | 16:8 | 24:0 | Контроль | 16:8 | 24:0 |
| n | 20 | 20 | 20 | 20 | 20 | 20 |
| Масса*, г | 2.47 ± 0.09 | 2.51 ± 0.08 | 2.62 ± 0.19 | 3.68 ± 0.13A | 3.50 ± 0.15A | 3.74 ± 0.24A |
| Масса*, г min–max |
1.88–3.09 | 1.90–3.01 | 1.55–4.30 | 3.04–4.7 | 2.58–4.94 | 2.49–5.45 |
| Длина (TL)*, см | 6.12 ± 0.05 | 6.09 ± 0.07 | 6.18 ± 0.14 | 7.16 ± 0.08A | 7.04 ± 0.10A | 7.12 ± 0.14A |
| Длина (TL)*, см min–max | 5.8–6.5 | 5.5–6.4 | 5.4–7.3 | 6.72–7.73 | 6.44–7.92 | 6.22–8.15 |
| ОЛ | 27.13 ± 0.34 | 26.80 ± 0.91 | 26.59 ± 0.39 | 32.81 ± 0.87A | 34.23 ± 0.78A | 32.72 ± 0.94A |
| ФЛ | 4.02 ± 0.08 | 3.69 ± 0.13 | 3.84 ± 0.07 | 5.66 ± 0.36A | 5.67 ± 0.13A | 4.68 ± 0.11A1, 2 |
| ДАГ | 1.22 ± 0.03 | 1.22 ± 0.06 | 1.24 ± 0.03 | 1.37 ± 0.10 | 1.26 ± 0.04 | 1.15 ± 0.031, 2 |
| ХС | 3.64 ± 0.04 | 3.19 ± 0.111 | 3.45 ± 0.061, 2 | 4.35 ± 0.12A | 4.80 ± 0.09A1 | 4.55 ± 0.11A2 |
| СЖК | 1.48 ± 0.06 | 1.49 ± 0.07 | 1.80 ± 0.071, 2 | 0.72 ± 0.04A | 0.89 ± 0.04A1 | 0.95 ± 0.04A1 |
| ТАГ | 15.00 ± 0.22 | 15.34 ± 0.521 | 14.85 ± 0.232 | 18.26 ± 0.73A | 19.39 ± 0.56A | 19.77 ± 0.69A |
| ЭХС | 1.77 ± 0.05 | 1.86 ± 0.08 | 1.41 ± 0.051, 2 | 2.45 ± 0.15A | 2.20 ± 0.13 | 1.63 ± 0.06A1, 2 |
| ХС/ФЛ | 0.91 ± 0.02 | 0.87 ± 0.011 | 0.90 ± 0.02 | 0.79 ± 0.03A | 0.85 ± 0.01 | 0.97 ± 0.01A1, 2 |
| ТАГ/ФЛ | 3.75 ± 0.06 | 4.17 ± 0.071 | 3.87 ± 0.032 | 3.4 ± 0.21 | 3.43 ± 0.09A | 4.22 ± 0.08A1, 2 |
Примечание. * – размерно-весовые характеристики сеголеток взятых для биохимического анализа, A – отличия достоверны (p ≤ 0.05) от таковых у рыб в сентябре; 1 – отличия достоверны (p ≤ 0.05) от таковых у рыб, выращиваемых при заводском освещении (контроль); 2 – отличия достоверны (p ≤ 0.05) от таковых у рыб, выращиваемых в условиях режима 16:8.
Таблица 2.
Содержание индивидуальных фосфолипидов (% сухой массы) у сеголеток атлантического лосося (Salmo salar L.), выращиваемых на Выгском рыбзаводе при разных световых режимах. Обозначения: n – число проб, ФИ – фосфатидилинозитол, ФС – фосфатидилсерин, ФЭА – фосфатидилэтаноламин, ФХ – фосфатидилхолин, ЛФХ – лизофосфатидилхолин, СФМ – сфингомиелин
| Месяц | Сентябрь | Октябрь | ||||
|---|---|---|---|---|---|---|
| Режим освещения | Контроль | 16:8 | 24:0 | Контроль | 16:8 | 24:0 |
| n | 20 | 20 | 20 | 20 | 20 | 20 |
| Масса*, г | 2.47 ± 0.09 | 2.51 ± 0.08 | 2.62 ± 0.19 | 3.68 ± 0.13A | 3.50 ± 0.15A | 3.74 ± 0.24A |
| Масса*, г min–max |
1.88–3.09 | 1.90–3.01 | 1.55–4.30 | 3.04–4.7 | 2.58–4.94 | 2.49–5.45 |
| Длина (TL)*, см | 6.12 ± 0.05 | 6.09 ± 0.07 | 6.18 ± 0.14 | 7.16 ± 0.08A | 7.04 ± 0.10A | 7.12 ± 0.14A |
| Длина (TL)*, см min–max | 5.8–6.5 | 5.5–6.4 | 5.4–7.3 | 6.72–7.73 | 6.44–7.92 | 6.22–8.15 |
| ФЛ | 4.02 ± 0.08 | 3.69 ± 0.13 | 3.84 ± 0.07 | 5.66 ± 0.36A | 5.67 ± 0.13A | 4.68 ± 0.11A1, 2 |
| ФИ | 0.17 ± 0.01 | 0.15 ± 0.011 | 0.11 ± 0.011 | 0.07 ± 0.00A | 0.07 ± 0.01A | 0.06 ± 0.01A |
| ФС | 0.04 ± 0.004 | 0.03 ± 0.003 | 0.03 ± 0.0041 | 0.09 ± 0.01A | 0.08 ± 0.01A | 0.08 ± 0.01A |
| ФЭА | 0.56 ± 0.02 | 0.48 ± 0.03 | 0.49 ± 0.03 | 0.96 ± 0.05A | 1.07 ± 0.03A | 0.91 ± 0.02A2 |
| ФХ | 2.97 ± 0.06 | 2.79 ± 0.11 | 2.99 ± 0.05A | 4.19 ± 0.33A | 4.12 ± 0.09A | 3.39 ± 0.09A1, 2 |
| ЛФХ | 0.26 ± 0.02 | 0.23 ± 0.02 | 0.21 ± 0.011 | 0.09 ± 0.01A | 0.08 ± 0.01A | 0.05 ± 0.00A1, 2 |
| СФМ | 0.005 ± 0.001 | 0.003 ± 0.001 | 0.01 ± 0.0012 | 0.01 ± 0.00A | 0.01 ± 0.00A | 0.01 ± 0.00A |
| Неизвестные | 0.01 ± 0.003 | 0.01 ± 0.002 | 0.01 ± 0.001 | 0.25 ± 0.04A | 0.24 ± 0.02A | 0.17 ± 0.02A2 |
Примечание. * – размерно-весовые характеристики сеголеток взятых для биохимического анализа, A – отличия достоверны (p ≤ 0.05) от таковых у рыб в сентябре; 1 – отличия достоверны (p ≤ 0.05) от таковых у рыб, выращиваемых при заводском освещении (контроль); 2 – отличия достоверны (p ≤ 0.05) от таковых у рыб, выращиваемых в условиях режима 16:8.
Исследования выполнены на базе лаборатории экологической биохимии и с использованием оборудования Центра коллективного пользования ФИЦ “Карельский научный центр Российской академии наук”.
РЕЗУЛЬТАТЫ
Результаты исследований по влиянию разных режимов фотопериода на липидный профиль сеголеток лосося при его искусственном выращивании представлены в табл. 1 и 2.
У сеголеток из трех бассейнов с разным режимом освещения, включая контрольный, отобранных в сентябре, липидный профиль достоверно не отличался по содержанию ОЛ (в пределах 26.59–27.13% сухой массы), в том числе суммарных ФЛ (3.69–4.02%) и ДАГ (1.22–1.24%). При режимах 16:8 и 24:0 у сеголеток отмечено достоверно значимое снижение количества ХС, минорных ФИ и ФС, а также снижение ЛФХ и ЭХС – при режиме 24:0, индекса ХС/ФЛ – при 16:8. Причем содержание ТАГ и индекс ТАГ/ФЛ повысились у сеголеток при режиме освещения 16:8, а СФМ и СЖК – при режиме 24:0 по сравнению с контролем. Наибольшие изменения липидного профиля у сеголеток в сентябре установлены при режиме 24:0. Снижение при режиме 24:0 у молоди в разной степени отдельных классов липидов (ФИ, ФС, ЛФХ, ЭХС) положительно коррелировало с повышением СЖК. При этом у сеголеток лосося в сентябре при режиме 24:0, наблюдалось повышение размерно-весовых характеристик – 2.62 г и 6.18 см против 2.51 г и 6.09 см; 2.47 г и 6.12 см при режиме 16:8 и контроле соответственно.
У сеголеток, отобранных в октябре, в целом (при всех режимах, включая контроль) отмечено повышение содержания ОЛ (в пределах 32.72–34.23% сухой массы), в том числе доминирующих запасных ТАГ (18.26–19.77%), а также ФЛ и ХС в октябре по сравнению с сентябрем. Основные изменения липидного спектра при влиянии двух режимов фотопериода отмечены у сеголеток, адаптированных к режиму 24:0 (относительно контроля) и связаны со снижением содержания структурных ФЛ (в том числе ФХ, ЛФХ), ДАГ, ЭХС и повышением СЖК, индексов ХС/ФЛ и ТАГ/ФЛ. При этом у рыб при режиме 16:8, относительно контроля, установлено достоверное повышение содержания ХС, СЖК и снижение ЭХС. У сеголеток, рост и развитие которых проходило при режиме фотопериода 24:0, отмечена тенденция к повышению веса – 3.74 г против 3.50 г и 3.68 г – (соответственно, при режиме 24:0, 16:8 и контроле).
ОБСУЖДЕНИЕ
Липиды, как известно, являются не только структурными компонентами живых систем и источником энергии, но и выполняют сигнальные функции, модулируя активность клеточных ферментов. Поэтому модификации липидного окружения организмов, вызванные воздействием различных факторов, оказывают влияние на целый ряд физиологических процессов, включая рост и развитие (Hochachka, Somero, 2002; Arts, Kohler, 2009). Результаты исследований влияния световых режимов на липидный статус сеголеток атлантического лосося свидетельствуют о том, что у сеголеток в сентябре, на фоне отсутствия изменений в содержании ОЛ, суммарных ФЛ и ДАГ отмечено снижение ХС и его запасной формы ЭХС, а также минорных ФЛ (ФИ, ФС, ЛФХ), что положительно коррелирует с повышением СЖК (в 1.2 раза). Эти изменения в большей степени отмечены у сеголеток, содержащихся в бассейнах при фотопериоде 24:0. Установленные модификации указывают на более активные метаболические процессы у рыб в условиях круглосуточного освещения. Известно, что у рыб при активации физиологических процессов из липидов быстро мобилизуются жирные кислоты, образуя пул СЖК, обеспечивая им приток энергии (Саутин, 1989). Усиление окислительных реакций в отдельных липидах вполне могло привести к повышению СФМ (в 2 раза), что способствует ригидности биомембран и может рассматриваться как компенсаторная реакция на продолжительное освещение.
Совокупность изменений отдельных классов ФЛ, особенно минорных, которые, как известно, являются посредниками многих сигнальных механизмов регуляции важнейших метаболических процессов, направлена, по-видимому, на обеспечение адаптации сеголеток лосося в ответ на воздействие такого мощного физического фактора как непрерывное освещение. При увеличении суточного периода освещения молодь рыб наиболее эффективно усваивает корм, отличается более высокой жизнеспособностью и скоростью роста (Власов и др., 2013). В нашем эксперименте в сентябре сеголетки лосося при режиме 24:0 имели сравнительно лучший вес и рост – 2.62 г и 6.18 см против 2.51 г и 6.09 см – при режиме 16:8; 2.47 г и 6.12 см – в контроле.
Следует отметить, что у сеголеток в октябре, во всех исследуемых вариантах фотопериода, включая контроль по сравнению с сентябрем, отмечено повышение ОЛ за счет запасных ТАГ и структурных липидов – ХС и ФЛ (в том числе ФС, ФЭА, ФХ, СФМ), что свидетельствует не только о влиянии разного режима фотопериода, но, возможно, и температурного фактора. В октябре температура снизилась на 4°С (до 9.8–2.4°С) по сравнению с сентябрем (13.8–9.8°С). Адаптация сеголеток к экспериментальным световым режимам на уровне липидов может реализоваться разными биохимическими механизмами. С одной стороны, при экспериментальных световых режимах у сеголеток повышается интенсивность липолиза, связанная с мобилизацией энергетических компонентов липидов, на что указывает снижение содержания ЭХС, ДАГ и ФЛ, включая ФХ и ЛФХ, и повышение СЖК, а также индексов ХС/ФЛ, ТАГ/ФЛ (при режиме 24:0). Следует отметить, что снижение ДАГ в октябре у сеголеток 0+ при режиме 24:0, возможно, связано с комплексным действием продолжительности освещения и снижением температуры. Диацилглицерины являются мультифункциональными веществами, предшественниками не только ТАГ, но и многих ФЛ, а направление их метаболических путей регулируется как внутренними, так и внешними факторами среды (Саутин, 1989). При этом следует учитывать не только содержание ХС и ФЛ, но и их соотношение ХС/ФЛ. Так, в октябре при исследуемых световых режимах у сеголеток установлено повышение индекса соотношения мембранных липидов ХС/ФЛ (до 0.97 при режиме 24:0 и до 0.85 при режиме 16:8 против 0.79 в контроле) за счет снижения содержания ФЛ (главным образом ФХ, а также ЛФХ). Изменение соотношения ХС/ФЛ является одним из ключевых механизмов регуляции физико-химического состояния биомембран и их ионной проницаемости, что влияет на различные обменные процессы, такие как (скорость транспорта ионов, метаболитов и воды (Нетюхайло, Тарасенко, 2001; Perevozchikov, 2008). Результатом может быть ингибирование окисления как ХС, так и отдельных минорных классов ФЛ (ФИ, ФС, ФЭА, СФМ). Все отмеченные изменения липидного профиля сеголеток лосося в процессе развития в условиях эксперимента в большей степени проявились в октябре при круглосуточном режиме освещения 24:0. Кроме того, к этому периоду как в контроле, так и при обоих световых режимах у сеголеток возрастает содержание запасных ТАГ и повышается индекс ТАГ/ФЛ (при 24:0), что свидетельствует о повышении у рыб энергетического потенциала, который поддерживается за счет более эффективного конвертирования корма в условиях дополнительного освещения, а также может быть связан и с температурным фактором. Возможно, снижение температуры воды в октябре повлияло на повышение активности липазы в желудочно-кишечном тракте рыб, что способствовало наилучшему конвертированию пищи. Так результаты работы китайских ученых показали, что молодь амурского осетра хорошо переваривает липиды при пониженной температуре (14°С), а протеины – при 21 и 28°С (Hong-jie et al., 2007).
Отмеченные изменения в содержании основных липидных классов положительно коррелируют с тенденцией повышения темпов роста сеголеток при световом режиме 24:0. Следует отметить, что данные согласуются с опубликованными ранее (Nemova et al., 2020) результатами изучения жирнокислотного состава молоди лосося при варьировании световых режимов в аналогичном эксперименте.
ЗАКЛЮЧЕНИЕ
Введение дополнительного освещения при заводском выращивании молоди атлантического лосося на этапе сеголеток приводит к количественным и качественным модификациям структурных и запасных липидов и их соотношений (индексов), направленных на регуляцию жизненных функций сеголеток лосося путем таких компенсаторных изменений липидов, которые обеспечивают оптимальные адаптационные возможности их выживания. Варьирование световых режимов при выращивании молоди лосося в условиях северных рыборазводных заводов может влиять на получение более жизнестойкой, готовой к выпуску в естественную среду молоди за счет ускорения процессов ее роста. Дополнительное освещение может применяться с целью ускорения роста молоди лосося, наступления периода смолтификации, отсрочки полового созревания. Кроме того, полученные результаты о модификации липидного состава сеголеток при использовании дополнительного освещения в процессе развития могут использоваться в практике выращивания молоди лосося в заводских условиях при расчетах кормовых коэффициентов, объемов используемого корма, а также для характеристики ее физиологического состояния.
Список литературы
Бретт Д. Факторы среды и рост рыб // Биоэнергетика и рост рыб / Под ред. Хоара У., Рендолла Д., Бретта Дж. М.: Лег. и пищ. пром-сть, 1983. С. 275–345.
Власов В.А., Маслова Н.И., Пономарев С.В., Боканева Ю.М. Влияние света на рост и развитие рыб // Вестник АГТУ. Сер. Рыбное хозяйство. 2013. № 2. С. 24–34.
Кейтс М. Техника липидологии: Выделение, анализ и идентификация липидов. М.: Мир, 1975. 322 с.
Коросов А.В., Горбач В.В. Компьютерная обработка биологических данных. Петрозаводск: Изд-во ПетрГУ, 2007. 76 с.
Нетюхайло Л.Г., Тарасенко Л.М. Особенности липидного состава плазматических мембран тканей легких при остром эмоционально-болевом стрессе у крыс // Украинский биохимический журн. 2001. Т. 73. № 1. С. 115–117.
Ручин Б.А. Влияние фотопериода на рост, физиологические и гематологические показатели молоди сибирского осетра Acipenser baerii // Известия РАН. Серия биологическая. 2007. № 6. С. 698–704.
Ручин Б.А. Влияние фотопериода на энергетические показатели карповых рыб // Астраханский вестник экологического образования. 2012. № 4(22). С. 144–150.
Саутин Ю.Ю. Проблема регуляции адаптационных изменений липогенеза, липолиза и транспорта липидов у рыб // Успехи современной биологии. 1989. Т. 107. Вып. 1. С. 131–147.
Arduini A., Peschechera A., Dottori S. et al. High-performance liquid chromatography of long-chain acylcarnitine and phospholipids in fatty acid turnover studies // J. Lipid Res. 1996. V. 37(2). P. 684–689.
Arts M.T., Kohler C.C. Health and conditions in fish: the influence of lipids on membrane competency and immune response // Lipids in Aquatic Ecosystems. Dordrecht; Heidelberg; London; N.Y.: Springer, 2009. P. 237–257.
Björnsson B.T., Stefansson S.O., McCormick S.D. Environmental endocrinology of salmon smoltification // General and Comparative Endocrinology. 2011. V. 170. P. 290–298.
Boeuf G., Le Bail P.-Y. Does light have an influence on fish growth? // Aquaculture. 1999. V. 177(3). P. 129–152.
Clarke W.C., Sheinbourn J.E., Brett J.N. Effect of articial photoperiod cycles, temperature and sality on growth and smolting in underyearlings coho. Chinook // Aquaculture. 1981. P. 105–116.
olch J., Lees M., Sloan-Stanley G.H. A simple method for the isolation and purification of total lipids animal tissue (for brain, liver and muscle) // J. Biol. Chem. 1957. V. 226. P. 497–509
Hellwig J. Definig parameters for a reproducible TLC-separation of phospholipids using ADC 2. Diploma thesis, University of Applied Sciences Northwestern Switzerland (FHNW), 2005.
Hochachka P.W., Somero G.N. Biochemical Adaptation: Mechanism and Process Physiological Evolution. N.Y.: Oxford University press, 2002. 466 p.
Mäkinen T., Ruohonen K. Effect of delayed photoperiod on the growth of a Finnish rainbow trout (Oncorhynchus mykiss Walbaum) stock // J. Appl. Ichthyol. 1992. V. 8. P. 40–50.
Murzina S.A., Nefedova Z.A., Ruokolainen T.R. et al. Dynamics of lipid content during early development of freshwater salmon Salmo salar L. // Russ. J. Dev. Biol. 2009. V. 40. P. 165–170. https://doi.org/10.1134/S1062360409030059
Hong-jie T., Ping Z., Long-zhen Z. et al. The influence of water temperature on the activity of digestive enzymes of juvenile Amur sturgeon, Acipenser schrenckii // J. Fish. Sei. China. 2007. V. 14. № l. P. 126–131.
Metcalfe N.B., Thorpe J.E. Determinants of geographical variation in the age of seaward-migrating salmon, Salmo salar // J. Animal Ecology. 1990. V. 59. P. 135–145.
Nemova N.N., Nefedova Z.A., Pekkoeva S.N. et al. The effect of the photoperiod on the fatty acid profile and weight in hatchery-reared underyearlings and yearlings of atlantic salmon Salmo salar L. // Biomolecules. 2020. V. 10. № 6. P. 845. https://doi.org/10.3390/biom10060845
Olsen R.E., Henderson R.J. The rapid analysis of neutral and polar marine lipids using double-development HPTLC and scanning densitometry // J. Exp. Mar. Biol. Ecol. 1989. V. 129. P. 189–197.
Perevozchikov A.P. Sterols and their transport in animal development // Russ. J. Dev. Biol. 2008. V. 39. P. 131–150. https://doi.org/10.1134/S1062360408030016
Taylor J.F., North B.P., Porter M.J.R. et al. Photoperiod can be used to enhance growth and improve feeding efficiency in farmed rainbow trout, Oncorhynchus mykiss // Aquaculture. 2006. V. 256. P. 216–234.
Villarreal C.A., Thorpe J.E., Miles M.S. Influence of photoperiod on growth changes in juvenile Atlantic salmon, Salmo salar L. // J. Fish Biol. 1988. V. 33. P. 15–30.
Дополнительные материалы отсутствуют.


