Онтогенез, 2021, T. 52, № 2, стр. 120-128
Опосредованное ооцитом влияние серотонина на функциональный статус клеток гранулезы
Д. А. Никишин a, *, Ю. В. Храмова b, Н. М. Алешина a, Л. А. Мальченко a, Ю. Б. Шмуклер a
a Институт биологии развития им. Н.К. Кольцова РАН
119334 Москва, ул. Вавилова, 26, Россия
b Московский государственный университет им. М.В. Ломоносова
119234 Москва, Ленинские горы, 1, стр. 12, Россия
* E-mail: d.nikishin@idbras.ru
Поступила в редакцию 07.05.2020
После доработки 02.09.2020
Принята к публикации 09.09.2020
Аннотация
В яичнике млекопитающих серотонин имеет все компоненты, необходимые для осуществления его сигнальной функции, и влияет на функциональную активность клеток гранулезы. В то же время накопление серотонина с помощью специфического транспортера SERT происходит преимущественно в ооцитах растущих овариальных фолликулов, и практически отсутствует в клетках гранулезы. На экспериментальной модели культуры овариальных фолликулов проведен количественный анализ экспрессии мРНК маркеров пролиферации, апоптоза и функционального состояния фолликулярных клеток, а также ооцитарных факторов роста. Серотонин (1 мкМ) не проявляет выраженных митогенных, про- и антиапоптотических свойств и не влияет на экспрессию маркеров стероидогенеза. При этом серотонин стимулирует в клетках гранулезы экспрессию генов циклинов Ccnd1, Ccnd2, Ccne1, а также Has2, Ptgs2, Ptgfr, Igfbp и Ihh. Кроме того, добавление серотонина приводит к увеличению экспрессии Gdf9 в ооцитах. Наблюдается более выраженный по сравнению с первичной культурой клеток гранулезы эффект серотонина, который во всех случаях, за исключением циклинов, отменяется флуоксетином (10 мкМ). Полученные результаты свидетельствует о том, что функциональная активность клеток гранулезы регулируется серотонином через его воздействие на ооцит и опосредовано активностью SERT.
ВВЕДЕНИЕ
Хорошо известно, что серотонин проявляет физиологическую активность на самых ранних стадиях индивидуального развития (Buznikov, 2007) и продолжает играть важную роль плейотропного гормона вне нервной системы у взрослых животных (Amireault et al., 2013). Большая часть серотонина у позвоночных синтезируется энтерохромаффинными клетками желудочно-кишечного тракта, где он играет роль важного регулятора гладкомышечной моторики и секреторной активности (Mawe, Hoffman, 2013). Здесь же он попадает в кровяное русло и накапливается в тромбоцитах, играя важную роль в процессах вазоконстрикции и свертывания крови (Mercado, Kilic, 2010). Гуморальное воздействие циркулирующего серотонина на клетки может быть опосредовано активацией мембранных рецепторов, влекущей запуск соответствующих сигнальных каскадов, и/или захватом его внутрь клеток с помощью мембранного транспортера SERT, после чего он может участвовать в посттрансляционной модификации белков посредством серотонилирования (Paulmann et al., 2009). Изменения концентрации циркулирующего серотонина ассоциировано с рядом патологических состояний, как центральной нервной системы, так и периферических органов (Mercado, Kilic, 2010).
Одной из мишеней периферического серотонина является яичник, где он детектируется в физиологически активных концентрациях (Bòdis et al., 1992) и имеет все компоненты, необходимые для осуществления его сигнальной функции (Dubé, Amireault, 2007). Несмотря на наличие экспрессии ферментов синтеза серотонина, основным механизмом, обеспечивающим накопление серотонина в яичнике, является его захват с помощью специфического транспортера SERT, который происходит преимущественно в ооцитах растущих овариальных фолликулов, и практически отсутствует в клетках гранулезы (Nikishin et al., 2019). Наиболее выраженным физиологическим эффектом серотонина на функцию яичника, проявляющимся у разных видов млекопитающих, является активация секреции стероидных гормонов клетками гранулезы, которая опосредуется рецепторными механизмами (Koppan et al., 2004). Нами ранее показано влияние серотонина на экспрессию маркеров функционального состояния клеток гранулезы, которое, ввиду отсутствия активности SERT, скорее всего, опосредовано активацией рецепторов (Никишин и др., 2018а). Однако, системное подавление механизма захвата серотонина путем нокаута гена Sert или применения селективных ингибиторов обратного захвата серотонина (СИОЗС), негативно влияет на функциональную активность клеток гранулезы, в том числе угнетает секрецию эстрадиола (Zha et al., 2017). По всей вероятности, накопление серотонина в ооцитах растущих фолликулов опосредованно влияет на функциональную активность клеток гранулезы.
Данная работа посвящена исследованию влияния серотонина на функциональный статус фолликулярных клеток в культуре изолированных овариальных фолликулов и выявлению роли механизма обратного захвата серотонина в этом процессе.
МАТЕРИАЛЫ И МЕТОДЫ
Первичные многослойные овариальные фолликулы в стерильных условиях выделяли из яичников мышей линии C57BL/6 (Питомник лабораторных животных “Столбовая”) в возрасте 14 дней. Яичники выделяли, разделяли на 8 частей, переносили в среду Лейбовица L15 (Biosera, Франция) с добавлением 50 мкг/мл Liberase DH (Roche, Швейцария) и инкубировали при 37°C в течение 30 мин. В процессе инкубации ткань яичника время от времени разрывали двумя инсулиновыми иглами. Изолированные фолликулы отмывали от ферментов и оценивали под контролем стереомикроскопа по следующим критериям: 1) диаметр 100–130 мкм; 2) поверхность гладкая и не повреждена; 3) один-два слоя клеток гранулезы (возможно наличие нескольких распластанных клеток теки); 4) наличие центрально расположенного округлого ооцита (см. рис. 3г). Овариальные фолликулы, отвечающие этим критериям, рандомно переносили в лунки 6-луночного культурального планшета (Corning, США), содержащие 3 мл культуральной среды DMEM/F-12 (Панэко, Россия), с добавлением 5% эмбриональной телячьей сыворотки (Biosera, Франция), 3 мМ аланил-глутамина (Панэко, Россия), 0.1 МЕ/мл ФСГ (Merck Serono S.A., Швейцария), 0.1 мкМ андростендиона (Sigma-Aldrich, США), 100 ЕА/мл пенициллина (Панэко, Россия) и 0.1 мг/мл стрептомицина (Панэко, Россия) и культивировали в течение 6 суток в атмосфере 5% CO2 при 37°C и ежедневной смене среды. Далее фолликулы, которые прикрепились и активно росли (см. рис. 3д), отмывали от сыворотки и культивировали в среде DMEM/F-12 c добавлением 3 мМ аланил-глутамина, инсулин-трансферрин-селеновой добавки (Панэко, Россия), 0.1 МЕ/мл ФСГ, 0.1 мкМ андростендиона, 100 ЕА/мл пенициллина и 0.1 мг/мл стрептомицина. В экспериментальных группах к клеткам гранулезы добавляли 1 мкМ серотонина (5HT); или 1 мкМ серотонина и 10 мкМ флуоксетина (5HT + FLU). Смену культуральной среды проводили каждые 12 ч. Через 48 ч среду заменяли на DMEM/F-12 с добавлением 1 мг/мл коллагеназы I (Панэко, Россия) и 100 мкг/мл ДНКазы I (Sigma-Aldrich, США) и инкубировали 30 мин при 37°C и периодическом аккуратном пипетировании. Ооциты из диссоциированных фолликулов собирали стриппером под контролем стереомикроскопа и использовали для исследования экспрессии генов Bmp6, Bmp15, Gdf9 и Igf1. Клетки гранулезы пропускали через 40 мкм сито (SPL Lifesciences, Корея) и осаждали центрифугированием в течение 5 мин при 1000 g, после чего использовали для исследования экспрессии генов Bad, Bax, Bcl2, Casp3, Ccna1, Ccnb1, Ccnd1, Ccnd2, Ccne1, Cyp11a1, Cyp17a1, Cyp19a1, Foxo3, Fshr, Has2, Igfbp4, Ihh, Lhcgr, Mki67, Trp53, Pcna, Ptgfr, Ptgs2 и Star.
Тотальную РНК из полученных проб выделяли с помощью реагента ExtractRNA (Евроген, Россия), используя 3 мкг гликогена в качестве соосадителя, и обрабатывали ДНКазой I (Thermo Fisher Scientific, США). Библиотеки кДНК синтезировали с помощью набора реактивов Maxima H Minus с применением рандомных гексаолигонуклеотидов (Thermo Scientific, США). ПЦР в реальном времени проводили на амплификаторе 7500 Real-Time PCR System (Applied Biosystems, США) с использованием коммерческой смеси qPCRmix-HS SYBR+HighROX (Евроген, Россия). Относительную экспрессию генов (NRQ) рассчитывали методом ddCt с нормировкой на ген Rps18 и контрольную пробу. Последовательности специфических олигонуклеотидов для проведения ПЦР приведены в табл. S1 . Эксперимент проведен в четырех повторностях. Статистическую обработку полученных результатов проводили в программе Graphpad Prism 5 (GraphPad Software, Inc., США) с применением t-критерия Вилкоксона.
Для оценки жизнеспособности фолликулов в ходе длительного культивирования, было проведено окрашивание фолликулов, претерпевших все экспериментальные манипуляции, реагентом ReadyProbes™ Cell Viability Imaging Kit, Blue/Red (Thermo Fisher Scientific, США) и последующее выявление живых и мертвых клеток на лазерном сканирующем конфокальном микроскопе Olympus FV10i (Лаборатория конфокальной микроскопии ЦКП МГУ им. М.В. Ломоносова). Для оценки активности захвата серотонина компонентами овариального фолликула в условиях 2D-культуры, были проведены инкубации культивируемых фолликулов с 1 мкМ серотонина в течение 2 ч. Фолликулы фиксировали в 4%-м параформальдегиде (pH 7.5) и окрашивали кроличьими антителами против серотонина (S5545 Sigma-Aldrich, США, разведение 1 : 1000) и козьими антителами против Ig кролика, конъюгированными с флуорофором CF™568 (SAB4600085 Sigma-Aldrich, США). Специфичность иммуногистохимической реакции оценивали по отсутствию флуоресценции при окрашивании только вторичными антителами. Препараты анализировали на лазерном сканирующем конфокальном микроскопе Zeiss LSM 880 (Группа оптических методов ЦКП ИБР РАН) и регистрировали иммунофлуоресценцию на срединном оптическом срезе при постоянных параметрах интенсивности лазера и чувствительности детектора. Уровень иммунофлуоресценции на полученных изображениях определяли с помощью программы ImageJ. Полученные результаты обрабатывали статистически с помощью программы Graphpad Prism 5 (GraphPad Software, Inc., США).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Работа была выполнена на изолированных преантральных овариальных фолликулах, культивируемых на поверхности пластика (2D-культура) в течение 6 сут и 48 ч эксперимента. В ходе культивирования фолликулы прикреплялись к поверхности, распластывались и росли, оставаясь при этом морфологически целостными (см. рис. 1в). Проведенное в конце эксперимента выявление живых и мертвых клеток (рис. 1) показало, что в ходе культивирования как клетки гранулезы, так и ооциты остаются живыми (рис. 1б, 1д, 1е). Незначительное количество мертвых фолликулярных клеток выявлялось на поверхности некоторых фолликулов (рис. 1г, 1е). Иммуногистохимическое исследование активности захвата серотонина в овариальных фолликулах в условиях 2D-культуры показало, что при добавлении серотонина в среду происходит его накопление в ооцитах, тогда как в клетках гранулезы его количество не изменяется (рис. 2). Данные результаты полностью согласуются с данными, полученными ранее на изолированных овариальных фолликулах (Никишин и др., 2018б) и фрагментах овариальной ткани (Nikishin et al., 2019), что подтверждает адекватность используемой экспериментальной модели.
Рис. 1.
Выявление живых и мертвых клеток в овариальных фолликулах после 6 сут предварительного культивирования и 48 ч культивирования в бессывороточной среде. (а, б) – срединный конфокальный оптический срез, проходящий через ядра ооцитов; (в) – микрофотография в фазовом контрасте; (г–е) – максимальная проекция стопки конфокальных микрофотографий. (а, г) – мертвые клетки, окрашенные иодидом пропидия; (б, в) – ядра живых клеток, окрашенные красителем Hoechst 33342; (е) – совмещенное изображение мертвых клеток (красный) и ядер живых клеток (синий), пунктиром обозначены границы ооцитов. Масштабный отрезок 100 мкм.
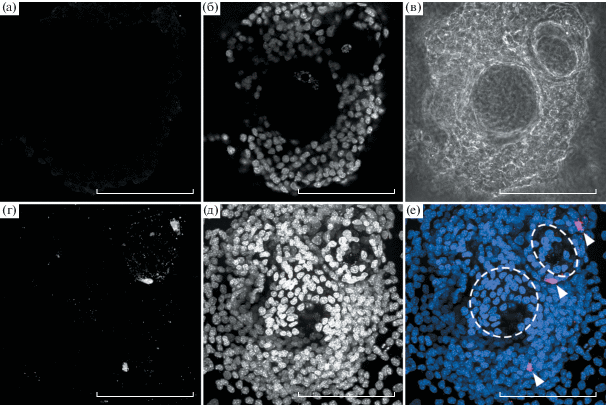
Рис. 2.
Иммуногистохимическое выявление активности захвата серотонина в культуре овариальных фолликулов. (а, б, г, д) – совмещенные конфокальные срединные оптические срезы овариальных фолликулов, культивируемых в течение 6 сут (а, б), и дополнительно культивируемых в бессывороточной среде в течение 48 ч (г, д), окрашенных антителами против серотонина (красный) и красителем Hoechst 33342 (белый). (а, г) – контроль; (б, д) – инкубация с 1 мкМ серотонина в течение 2 ч. Масштабный отрезок 100 мкм. (в, е) – измерение уровня иммунофлуоресценции серотонина в клетках гранулезы и ооцитах овариальных фолликулов, культивируемых в течение 6 сут (в), и дополнительно культивируемых в бессывороточной среде в течение 48 ч (Е). M ± SD, * – p < 0.0001 по t-критерию Стьюдента.

Функциональный статус овариального фолликула в период активного роста выражается, прежде всего, показателями функционального состояния клеток гранулезы – важнейшими из которых являются пролиферативная активность, отсутствие апоптоза, стероидогенная активность и маркеры степени дифференцировки (Kranc et al., 2017). Для оценки этих показателей в работе использовали количественный анализ экспрессии мРНК генов, являющихся маркерами функционального состояния клеток гранулезы (рис. 3а, 3б). Снижение пролиферативной активности, в сочетании с активацией механизмов клеточной гибели, является маркером атретических процессов (Zhen et al., 2014). При добавлении серотонина к культуре изолированных овариальных фолликулов гены-маркеры пролиферации Mki67 и Pcna (а также циклинов Ccna1 и Ccnb1) не изменили уровень экспрессии относительно контроля. Это говорит об отсутствии выраженного митогенного эффекта серотонина на клетки гранулезы. В то же время, количественный анализ выявил достоверное увеличение уровня экспрессии циклина Ccnd1 в 1.58 раз (p = 0.0294), Ccnd2 в 1.63 раз (p = 0.0409) и Ccne1 в 1.49 раз (p = 0.044). Циклины D и E являются ключевыми регуляторными белками, которые способствует переходу клеток к фазе S через фазу G1 (Bertoli et al., 2015). Селективный ингибитор обратного захвата серотонина флуоксетин не отменяет эффект серотонина на экспрессию циклинов, что говорит о том, что в данном эффекте не участвует SERT, и он, скорее всего, опосредован воздействием на рецепторы серотонина. Таким образом, эффект серотонина на пролиферативные свойства клеток гранулезы ограничивается влиянием на уровень экспрессии регуляторов клеточного цикла, но не приводит к увеличению пролиферации. Уровень апоптоза, особенно в условиях культуры, является очень важным показателем функционального статуса овариального фолликула. Серотонин, в зависимости от типа активируемого рецептора, способен выступать как про- так и антиапоптотическим агентом (Azmitia, 2001). В нашем эксперименте не выявлено статистически значимых изменений уровня экспрессии как генов-маркеров апоптоза Bax, Bad, Bcl2, Casp3, Trp53, так и Foxo3, который является инициатором апоптоза в клетках гранулезы, что указывает на отсутствие выраженного про- и антиапоптотического эффекта серотонина.
Рис. 3.
Эффект серотонина и флуоксетина на функциональный статус овариальных фолликулов в культуре in vitro. (а–в) – изменение уровня экспрессии в клетках гранулезы маркеров их функциональной активности (а, б) и уровня экспрессии в ооцитах факторов роста (в) в культуре изолированных овариальных фолликулов при добавлении 1 мкМ серотонина (5HT) и 1 мкМ серотонина с 10 мкМ флуоксетина (5HT + FLU). NRQ – нормированная на контрольную пробу относительная экспрессия гена, в качестве референсного гена использовали Rps18. Красной линией обозначена экспрессия генов в контрольной пробе, принятая за 1. * – p < 0.05 по t-критерию Вилкоксона. (г–д) – первичный многослойный овариальный фолликул сразу после изоляции (г) и через 6 дней культуры in vitro (д). Масштабный отрезок 100 мкм.

Важнейшими показателями функциональной активности соматических компонентов овариального фолликула является экспрессия ключевых стероидогенных ферментов, а также гена Star, кодирующего эффектор скорость-лимитирующей стадии стероидогенеза (Bao et al., 1997; Zhen et al., 2014). Несмотря на литературные данные о влиянии серотонина на стероидогенную активность, при анализе экспрессии генов Cyp11a1, Cyp17a1, Cyp19a1 и Star достоверных различий между группами не выявлено. По всей видимости, описанные в литературе эффекты связаны с регуляцией активности компонентов системы синтеза стероидных гормонов на посттранскрипционных стадиях. Количественными маркерами степени дифференцировки клеток гранулезы являются гены рецептора фолликулостимулирующего гормона Fshr и рецептора лютеинизирующего гормона Lhcgr (Bao et al., 1997), а также гиалуронансинтазы Has2, связывающего инсулиноподобный фактор роста белка Igfbp4, рецептора простагландина F2-альфа Ptgfr, циклооксигеназы Ptgs2 и лиганда Hedgehog-сигнального пути Ihh (Zhen et al., 2014). При анализе экспрессии генов Fshr и Lhcgr достоверных различий между группами не выявлено. В то же время, уровень экспрессии гена Ptgs2 при добавлении серотонина увеличивается в 4.59 раз (p = 0.0425), Has2 – в 2.26 раз (p = 0.0492), Igfbp4 – в 1.56 раз (p = 0.0373), Ihh – 1.5 раз (p = = 0.0045), Ptgfr – в 1.4 раз (p = 0.0172). При этом добавление флуоксетина снижает уровень экспрессии генов до уровня, статистически не отличающегося от контроля, что говорит о наличии вклада захвата серотонина в реализацию этого эффекта. Экспрессия данных генов характерна для зрелых клеток кумулюса, в которых они обеспечивают синтез межклеточного матрикса, необходимого для экспансии кумулюса, и функционирование ключевых механизмов межклеточной сигнализации (Diaz et al., 2007). Таким образом, серотонин проявляет признаки фактора, способствующего созреванию клеток гранулезы и их дифференцировке в направлении кумулюса.
Одной из целей данной работы было сопоставление полученных результатов с эффектами серотонина, наблюдаемыми в экспериментах на первичной культуре клеток гранулезы, в отсутствие возможного влияния ооцитов (см. рис. 4). При прямом воздействии серотонина на клетки гранулезы наблюдался сходный эффект на экспрессию генов-показателей их функциональной активности, однако статистически значимый эффект наблюдался только для генов Ccnd1, Has2 и Ihh (Никишин и др., 2018а). В культуре изолированных овариальных фолликулов наблюдается более выраженный эффект серотонина, что, по всей вероятности, объясняется большей восприимчивостью клеток гранулезы к воздействию серотонина в этих условиях, более приближенных к нативному состоянию. Известно, что ооциты теснейшим образом связаны с фолликулярными клетками и взаиморегулируют их функциональное состояние (Kidder, Vanderhyden, 2010). Логично предполагать, что усиление влияния серотонина на функциональную активность клеток гранулезы связано с дополнительным воздействием ооцитов. В пользу этого предположения говорит отмена наблюдаемых эффектов при ингибировании обратного захвата серотонина, который активен в ооцитах, но не в клетках гранулезы. Учитывая, что, помимо мембранного транспортера серотонина, в ооцитах экспрессируется везикулярный транспортер моноаминов (Никишин и др., 2018в), есть вероятность, что ооцит экскретирует накопленный серотонин и создает вокруг себя локальную область его повышенной концентрации, усиливая таким образом его воздействие на клетки гранулезы. С другой стороны, серотонин во многих типах клеток играет роль регулятора секреторной активности (Paulmann et al., 2009). Серотонин, накопленный в ооците, вероятно, может влиять на секрецию белковых факторов роста, играющих важную роль в поддержании полноценной жизнедеятельности фолликулярных клеток (Kidder, Vanderhyden, 2010).
Рис. 4.
Схема прямого и опосредованного ооцитом влияния серотонина (5HT) на функциональную активность клеток гранулезы. В культуре клеток гранулезы (1) серотонин стимулирует экспрессию циклина D1 Ccnd1, гиалуронансинтазы Has2 и сигнальной молекулы Ihh (по: Никишин и др., 2018). В культуре растущих овариальных фолликулов (2–5) происходит (2) накопление серотонина в ооцитах за счет активности мембранного транспортера SERT, которая ингибируется флуоксетином (FLU). (3) Серотонин стимулирует в клетках гранулезы экспрессию циклинов Ccnd1, Ccnd2 и Ccne1, ответственных за переход к синтетической фазе клеточного цикла. Эффект не отменяется флуоксетином. (4) Серотонин стимулирует экспрессию в клетках гранулезы маркеров зрелости Has2, Ptgs2, Ptgfr, Ihh и Igfbp4. Эффект отменяется флуоксетином. (5) Серотонин стимулирует экспрессию в ооцитах фактора роста Gdf9. Эффект отменяется флуоксетином. (6) GDF9 является регулятором функционального состояния фолликулярных клеток (Gui, Joyce, 2005).

Для проверки этого предположения, исследованы эффекты серотонина и флуоксетина на экспрессию в ооцитах ключевых факторов роста, регулирующих функциональный статус фолликулярных клеток (рис. 3в). В культуре изолированных фолликулов при воздействии серотонина уровень экспрессии Bmp15, Bmp6, Igf1 в ооцитах не изменяется, при этом Gdf9 – увеличивается в 1.52 раз (p = 0.0116), причем в присутствии флуоксетина данный эффект снижается, что говорит о вовлеченности механизмов транспорта серотонина в этот эффект. Известно, что GDF9 является одним из ключевых факторов, регулирующих процесс фолликулогенеза на стадии фолликулярного роста и овуляции. Так, например, под действием GDF9 в клетках кумулюса возрастает экспрессия генов Has2 и Ptgs2 (Gui, Joyce, 2005). По всей видимости, захват серотонина ооцитами в растущих овариальных фолликулах, действительно, способствует синтезу и секреции факторов, которые влияют на функциональную активность клеток гранулезы.
Механизм влияния захвата серотонина ооцитом на экспрессию генов и секрецию факторов роста пока остается неясным. Возможность внутриклеточной сигнальной активности серотонина является предметом многолетних дискуссий – именно на ооцитах и ранних эмбрионах были получены фармакологические свидетельства внутриклеточной активности серотониновых рецепторов, которая остается неисследованной (Шмуклер, Никишин, 2018). С другой стороны, внутри клетки серотонин способен принимать участие в регуляции активности белков путем их серотонилирования (Bader, 2019). Этот механизм задействован в регуляции секреторной активности в тромбоцитах (Walther et al., 2003) и β-клетках поджелудочной железы (Paulmann et al., 2009), может влиять на экспрессию генов путем модификации гистонов (Farrelly et al., 2019) и, вполне вероятно, также активен в ооцитах.
Таким образом, в экспериментах на культуре изолированных овариальных фолликулов выявлены эффекты серотонина на экспрессию нескольких генов-показателей функциональной активности клеток гранулезы (Ccnd1, Ccnd2, Ccne1, Has2, Ptgs2, Ptgfr, Igfbp и Ihh), а также важнейшего ооцитарного фактора роста Gdf9. Большая часть наблюдаемых эффектов отменяется флуоксетином, следовательно, опосредована активностью специфического транспортера серотонина SERT. Полученный результат является очень важным свидетельством того, что овариальный серотонин воздействует на функциональную активность клеток гранулезы опосредованно через влияние на ооцит, и требует дальнейшего более внимательного исследования.
Список литературы
Никишин Д.А., Алешина Н.М., Семенова М.Л. и др. Влияние серотонина на экспрессию маркеров функционального состояния клеток гранулезы в культуре in vitro // Фундаментальные аспекты психического здоровья. 2018а. № 4. С. 12–17.
Никишин Д.А., Алешина Н.М., Шмуклер Ю.Б. Синтез и мембранный транспорт серотонина в развивающемся овариальном фолликуле мыши // ДАН. 2018б. Т. 478. № 1. С. 103–106.
Никишин Д.А., Храмова Ю.В., Багаева Т.С. и др. Экспрессия компонентов серотонинергической системы в фолликулогенезе и доимплантационном развитии мыши // Онтогенез. 2018в. Т. 49. № 3. С. 208–216.
Шмуклер Ю.Б., Никишин Д.А. О внутриклеточной рецепции медиаторов // Нейрохимия. 2018. Т. 35. № 4. С. 289–293.
Amireault P., Sibon D., Côté F. Life without peripheral serotonin: Insights from tryptophan hydroxylase 1 knockout mice reveal the existence of paracrine/autocrine serotonergic networks // ACS Chem. Neurosci. 2013. V. 4. № 1. P. 64–71.
Azmitia E.C. Modern views on an ancient chemical: serotonin effects on cell proliferation, maturation, and apoptosis // Brain Res. Bull. 2001. V. 56. № 5. P. 413–424.
Bader M. Serotonylation: Serotonin signaling and epigenetics // Front. Mol. Neurosci. 2019. V. 12. P. 288.
Bao B., Garverick H.A., Smith G.W. et al. Changes in messenger ribonucleic acid encoding luteinizing hormone receptor, cytochrome P450-side chain cleavage, and aromatase are associated with recruitment and selection of bovine ovarian follicles // Biol. Reprod. 1997. V. 56. № 5. P. 1158–1168.
Bertoli C., Skotheim J.M., Bruin R.A.M.De. Control of cell cycle transcription during G1 and S phases // Nat. Rev. Mol. Cell Biol. 2015. V. 14. № 8. P. 518–528.
Bòdis J., Bognàr Z., Hartmann G. et al. Measurement of noradrenaline, dopamine and serotonin contents in follicular fluid of human graafian follicles after superovulation treatment // Gynecol. Obstet. Invest. 1992. V. 33. № 3. P. 165–167.
Buznikov G.A. Preneural transmitters as regulators of embryogenesis. Current state of problem // Russ. J. Dev. Biol. 2007. V. 38. № 4. P. 213–220.
Diaz F.J., Wigglesworth K., Eppig J.J. Oocytes determine cumulus cell lineage in mouse ovarian follicles // J. Cell Sci. 2007. V. 120. № 8. P. 1330–1340.
Dubé F., Amireault P. Local serotonergic signaling in mammalian follicles, oocytes and early embryos // Life Sci. 2007. V. 81. № 25–26. P. 1627–1637.
Farrelly L.A., Thompson R.E., Zhao S. et al. Histone serotonylation is a permissive modification that enhances TFIID binding to H3K4me3 // Nature. 2019. V. 567. № 7749. P. 535–539.
Gui L.-M., Joyce I.M. RNA interference evidence that growth differentiation factor-9 mediates oocyte regulation of cumulus expansion in mice // Biol. Reprod. 2005. V. 72. № 1. P. 195–199.
Kidder G.M., Vanderhyden B.C. Bidirectional communication between oocytes and follicle cells: Ensuring oocyte developmental competence // Can. J. Physiol. Pharmacol. 2010. V. 88. № 4. P. 399–413.
Koppan M., Bodis J., Verzar Z. et al. Serotonin may alter the pattern of gonadotropin-induced progesterone release of human granulosa cells in superfusion system // Endocrine. 2004. V. 24. № 2. P. 155–159.
Kranc W., Budna J., Kahan R. et al. Molecular basis of growth, proliferation, and differentiation of mammalian follicular granulosa cells // J. Biol. Regul. Homeost. Agents. 2017. V. 31. № 1. P. 1–8.
Mawe G.M., Hoffman J.M. Serotonin signalling in the gut-functions, dysfunctions and therapeutic targets // Nat. Rev. Gastroenterol. Hepatol. 2013. V. 10. № 8. P. 473–486.
Mercado C.P., Kilic F. Molecular mechanisms of SERT in platelets: regulation of plasma serotonin levels // Mol. Interv. 2010. V. 10. № 4. P. 231–241.
Nikishin D.A., Alyoshina N.M., Semenova M.L. et al. Analysis of expression and functional activity of aromatic L-amino acid decarboxylase (DDC) and serotonin transporter (SERT) as potential sources of serotonin in mouse ovary // Int. J. Mol. Sci. 2019. V. 20. № 12. P. 3070.
Paulmann N., Grohmann M., Voigt J.-P. et al. Intracellular serotonin modulates insulin secretion from pancreatic beta-cells by protein serotonylation // PLoS Biol. 2009. V. 7. № 10. P. e1000229.
Walther D.J., Peter J.-U., Winter S. et al. Serotonylation of small GTPases is a signal transduction pathway that triggers platelet alpha-granule release // Cell. 2003. V. 115. № 7. P. 851–862.
Zha W., Ho H.T.B., Hu T. et al. Serotonin transporter deficiency drives estrogen-dependent obesity and glucose intolerance // Sci. Rep. 2017. V. 7. № 1. P. 1137.
Zhen Y.-H., Wang L., Riaz H. et al. Knockdown of CEBPβ by RNAi in porcine granulosa cells resulted in S phase cell cycle arrest and decreased progesterone and estradiol synthesis // J. Steroid. Biochem. Mol. Biol. 2014. V. 143. P. 90–98.
Дополнительные материалы
- скачать ESM.docx
- Table S1. Specific oligonucleotides used for real-time PCR.
Таблица S1. Специфические олигонуклеотиды, использованные для проведения ПЦР в реальном времени.


