Онтогенез, 2021, T. 52, № 2, стр. 108-119
Сравнительно-видовая характеристика липидов и их динамика в процессе эмбрионального и раннего постэмбрионального развития Атлантического лосося (Salmo salar L.) и кумжи (Salmo trutta L.)
В. П. Воронин a, *, С. А. Мурзина a, **, З. А. Нефедова a, С. Н. Пеккоева a, Т. Р. Руоколайнен a, М. А. Ручьев a, Н. Н. Немова a
a Институт биологии – обособленное подразделение Федерального исследовательского центра
“Карельский научный центр Российской академии наук”
185910 Петрозаводск, ул. Пушкинская, 11, Россия
* E-mail: voronen-viktor@mail.ru
** E-mail: murzina.svetlana@gmail.com
Поступила в редакцию 07.07.2020
После доработки 10.11.2020
Принята к публикации 16.11.2020
Аннотация
Проведено сравнительно-видовое исследование содержания общих липидов и липидов отдельных классов (общих фосфолипидов и их фракций, триацилглицеринов, диацилглицеринов, эфиров холестерина, холестерина, свободных жирных кислот) в неоплодотворенной икре, в процессе эмбрионального (оплодотворение, бластула, гаструла, органогенез, пигментация глаз, предличинка) и раннего постэмбрионального развития (личинка с желточным мешком) атлантического лосося (Salmo salar L.) и кумжи (Salmo trutta L.). Сравнительно высокое содержание общих липидов (за счет фракции запасных триацилглицеринов) в икре исследованных видов перед оплодотворением, особенно у лосося, можно рассматривать как необходимую предпосылку их дальнейшего эмбрионального и постэмбрионального развития. Динамика липидного состава в икре исследованных видов в процессе эмбриогенеза различалась, что является особенностью метаболизма липидов у этих видов. На этапах активного клеточного деления (бластула, гаструла, органогенез) в эмбриогенезе атлантического лосося и кумжи отмечено увеличение концентрации лизофосфатидилхолина. На более поздних стадиях их эмбрионального (пигментация глаз, предличинка) и раннего постэмбрионального (личинка с желточным мешком) развития обнаружено возрастание концентрации фосфатидилсерина. Биохимическая разнокачественность, обусловленная разным количественным содержанием липидов отдельных классов на исследованных стадиях развития, связана, по-видимому, с особенностями эмбрионального развития исследованных видов, в частности, разновременностью этих процессов.
ВВЕДЕНИЕ
Атлантический лосось (Salmo salar L.) и кумжа (Salmo trutta L.) являются одними из наиболее ценных видов лососевых рыб пресноводных экосистем Кольского полуострова и характеризуются высокой вариабельностью жизненных стратегий (Павлов и др., 2008). Реализация всего комплекса сформировавшихся на протяжении эволюции вида адаптаций, направленных на поддержание репродуктивной функции и выживание потомства, в конечном счете, приводит к формированию фенотипа, наиболее устойчивого к изменению факторов среды. Так, для кумжи известна самая высокая экологическая пластичность по сравнению с другими видами лососевых рыб (Шустов, Веселов, 2006; Jonsson, Jonsson, 2011), а ее широкая изменчивость обеспечивает возможность освоения и использования ресурсов населяемой акватории, чем объясняется популяционная дифференциация вида на ряд подвидов, наличие различных экологических форм, географических рас (Шустов, Веселов, 2006; Тагизадэ, 2007; Павлов, Савваитова, 2008). Кумжа Белого моря демонстрирует развитые способности и потенциал к заселению новых пространств и успешно освоила разнообразные и различающиеся по ряду характеристик пресноводные водоемы (ручьи, озерно-речные системы), она благополучно обитает в открытых, прибрежных и эстуарных участках моря (Кузищин, 1997).
Генетически детерминированная дифференциация эмбрионов, личинок и мальков, приводящая при действии различных факторов среды к образованию сложной возрастной и субпопуляционной структуры лососевых рыб, обусловлена целым комплексом физиолого-биохимических адаптаций, определяющих выбор оптимальной стратегии раннего развития молоди лососевых рыб и специфику их жизненного цикла (Веселов, Калюжин, 2001; Tocher, 2003; Murzina et al., 2014). Биохимические адаптации формируются комплексом показателей различных метаболических путей, включая липиды и их жирнокислотные компоненты, которые, как было показано ранее (Павлов и др., 2008; Johnson, 2009; Нефедова и др., 2010, 2014, 2018; Jonsson, Jonsson, 2011; Arslan et al., 2016; Мурзина и др., 2017; Mueller et al., 2017), выступают в качестве одного из ключевых показателей успешного эмбрионального развития и последующего расселения сеголеток лососевых рыб из нерестовых гнезд по биотопам.
Целью настоящего исследования являлось выявление общих и специфических (видовых) особенностей липидного профиля и динамики содержания отдельных липидов в процессе эмбрионального и раннего постэмбрионального развития кумжи (Salmo trutta L.) и атлантического лосося (Salmo salar L.).
МАТЕРИАЛЫ И МЕТОДЫ
Неоплодотворенная икра была получена от самок атлантического лосося, выловленного в р. Сума (басс. Белого моря), и кумжи, выловленной в озере Янисъярви (басс. Ладожского озера), в октябре при температуре воды 8.6 и 9.6°С соответственно. После оплодотворения икру перевезли в рыбное хозяйство в пос. Суйстамо и поместили в заводской инкубационной лоток с естественной проточностью из р. Улмасен-йоки (61°54′51″ с.ш.; 31°08′56″ в.д.) (Supplementary materials 1). На биохимический анализ отбирали как неоплодотворенную икру лосося и кумжи, так и икру на разных стадиях эмбрионального развития (табл. 1).
Таблица 1.
Даты сбора (по градусодням, г.д.) икры двух видов лососевых рыб (Salmo salar L. и Salmo trutta L.) на разных стадиях развития
| Номер этапа | Стадия развития икры | Вид | Дата | Градусодни (г.д.) |
|---|---|---|---|---|
| 0 этап | Неоплодотворенная икра | Атлантический лосось | 10 октября | 0 г.д. |
| Кумжа | 12 октября | 0 г.д. | ||
| 1 этап | Оплодотворенная икра | Атлантический лосось | 10 октября | 2.5 г.д. |
| Кумжа | 12 октября | 2.4 г.д. | ||
| 2 этап | Бластула | Атлантический лосось | 14 октября | 38 г.д. |
| Кумжа | 14 октября | 18 г.д. | ||
| 3 этап | Гаструла | Атлантический лосось | 26 октября | 129 г.д. |
| Кумжа | 26 октября | 110 г.д. | ||
| 4 этап | Органогенез | Атлантический лосось | 15 ноября | 209 г.д. |
| Кумжа | 15 ноября | 189 г.д. | ||
| 5 этап | Пигментация глаз | Атлантический лосось | 2 февраля | 287 г.д. |
| Кумжа | 2 февраля | 267 г.д. | ||
| 6 этап | Предличинка | Атлантический лосось | 18 апреля | 331 г.д. |
| Кумжа | 18 апреля | 312 г.д. | ||
| 7 этап | Личинка | Атлантический лосось | 18 апреля | 331 г.д. |
| Кумжа | 18 апреля | 312 г.д. |
На каждой стадии развития брали по 20 икринок (индивидуально) лосося и кумжи. После гомогенизации проб в 10-кратном объеме смеси хлороформ-метанол (2 : 1 по объему) проводили экстракцию общих липидов (ОЛ) по методу Фолча (Folch et al., 1957) смесью хлороформ-метанол (2 : 1 по объему). Содержание общих липидов определяли весовым методом (Сидоров и др., 1972). Качественное и количественное определение липидов отдельных классов – общих фосфолипидов (ФЛ), диацилглицеринов (ДАГ), триацил-глицеринов (ТАГ), эфиров холестерина (ЭХС), холестерина (ХС), свободных жирных кислот (СЖК) осуществляли при помощи метода высокоэффективной тонкослойной хроматографии (ВЭТСХ). Фракционирование общих липидов проводили на ультрачистых пластинках HPTLC Silicagel 60 F254 Premium Purity (Merck, Германия). Нанесение пробы (объем 2 мкл) проводили с использованием полуавтоматического аппликатора Linomat 5 (CAMAG, Швейцария). В качестве элюента, а также раствора для насыщения автоматической хроматографической камеры ADC2 (CAMAG, Швейцария), использовали систему растворителей гексан–диэтиловый эфир–уксусная кислота (32 : 8 : 0.8 по объему) (Olsen, Henderson, 1989). Влажность в хроматографической камере поддерживали перенасыщенным раствором цинка азотнокислого (ZnNO3 ⋅ 6H2О). Проявление липидных пятен осуществляли в растворе медного купороса (CuSO4) с ортофосфорной кислотой (H3PO4) и нагреванием до 160°С с последующим качественным и количественным определением липидных компонентов при длине волны 350 нм на дейтериевой лампе (Hellwig, 2008) на спектроденситометре TLC Scanner 4 (CAMAG, Швейцария). Идентификацию липидов разных классов проводили с использованием референтных стандартов соответствующих веществ (“Sigma-Aldrich”, США) с учетом соответствия значений Rf.
Качественное и количественное определение отдельных фосфолипидных фракций – фосфатидилхолина (ФХ), фосфатидилэтаноламина (ФЭА), фосфатидилсерина (ФС), фосфатидилинозитола (ФИ), лизофосфатидилхолина (ЛФХ), сфингомиелина (СФМ) проводили методом высокоэффективной жидкостной хроматографии (ВЭЖХ). Анализ выполняли с использованием жидкостного хроматографа “Стайер” (ООО “Аквилон”, Россия) с колонкой размером 250 × 4 мм, наполненной сорбентом Нуклеосил 100-7 (“Элсико”, Россия). В качестве подвижной фазы использовали смесь ацетонитрил–метанол–гексан–85% фосфорная кислота (918 : 30 : 30 : 17.5 по объему) со скоростью потока 540 мкл/час. Определение анализируемых липидных компонентов осуществляли на спектрофотометре по поглощению в ультрафиолетовом свете при длине волны 206 нм (Arduini et al., 1996).
Статистическую обработку результатов проводили в открытой программируемой среде R (версия 3.6.1.) с использованием дополнительных пакетов “dplyr” (версия 0.8.3), “psych” (версия 1.8.12), “coin” (версия 1.3-1), “ggplot2” (версия 3.3.0), “corrgram” (версия 1.13). Достоверность различий между липидными компонентами на отдельных стадиях развития определяли непараметрическим критерием Вилкоксона–Манна-Уитни (Ивантер, Коросов, 2003; Кабаков, 2016; Уикем, Гроулмунд, 2019). Различия между отдельными липидными показателями считали достоверными при р ≤ 0.05. Корреляцию липидных компонентов на отдельных стадиях развития рассчитывали по методу Пирсона.
Исследование было выполнено на базе лаборатории экологической биохимии с использованием оборудования ЦКП Федерального исследовательского центра “Карельский научный центр Российской академии наук”.
РЕЗУЛЬТАТЫ
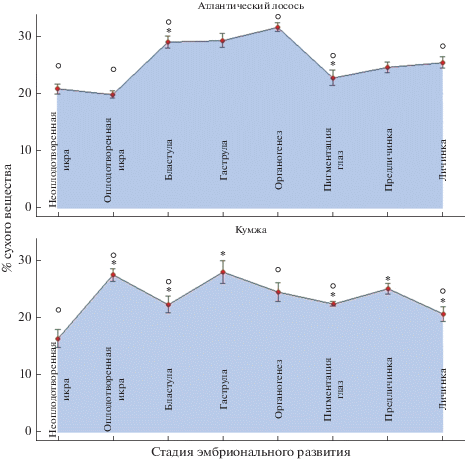
Результаты исследования содержания общих липидов (ОЛ) в неоплодотворенной икре и сразу после оплодотворения, а также на отдельных стадиях эмбрионального и раннего постэмбрионального развития атлантического лосося и кумжи представлены на рис. 1. Установлено, что содержание ОЛ в неоплодотворенной икре атлантического лосося и кумжи достоверно различалось (20.79 и 16.27% сухого вещества соответственно), в основном за счет запасных липидов – триацилглицеринов (ТАГ). В процессе эмбрионального развития икры на этапе активного клеточного деления (бластула, гаструла, органогенез, пигментация глаз) у обоих видов лососевых рыб отмечено общее увеличение содержания ОЛ до 27.91% сухого вещества у кумжи и до 31.55% у лосося с последующим снижением соответственно до 20.56 и 25.40% сухого вещества в период выклева личинки. При этом динамика изменения содержания ОЛ на разных стадиях эмбриогенеза лосося и кумжи различалась. Во время эмбрионального развития содержание ОЛ варьирует (в среднем) в пределах 23–24% сухого вещества. На стадии гаструлы и органогенеза содержание ОЛ достигает 27.91 и 31.55% сухого вещества у кумжи и лосося соответственно.
Рис. 1.
Изменение содержания общих липидов (ОЛ) в неоплодотворенной икре, на отдельных стадиях эмбрионального и раннего постэмбрионального развития атлантического лосося (Salmo salar L.) и кумжи (Salmo trutta L.). Примечание к рис. 1: Динамика содержания ОЛ представлена в формате M ± SE. * – отличия достоверны (р ≤ 0.05) от предыдущей стадии развития, о – отличия достоверны (р ≤ 0.05) между атлантическим лососем (Salmo salar L.) и кумжей (Salmo trutta L.) на соответствующей стадии развития.
На рис. 2 приведены результаты качественного и количественного анализа липидов отдельных классов. Показано, что в количественном отношении доминирует фракция запасных ТАГ как в неоплодотворенной икре лосося и кумжи, так и в икре в процессе эмбрионального развития. Содержание ТАГ в неоплодотворенной икре составило 11.42 и 8.93% сухого вещества у лосося и кумжи соответственно. В процессе эмбрионального развития содержание ТАГ варьировало в пределах 10.83–17.95 и 12.08–15.03% сухого вещества, а на стадии личинки (с желточным мешком) – 13.93 и 10.33% сухого вещества у атлантического лосося и кумжи соответственно. В икре кумжи установлено достоверное увеличение содержания ТАГ на стадии оплодотворения, тогда как у атлантического лосося – на стадии формирования бластулы. На данных стадиях развития установлены корреляции этого показателя с увеличением содержания общих фосфолипидов (ФЛ) (r = 0.84 и 0.84 соответственно) и диацилглицеринов (ДАГ) (r = 0.44 и 0.62 соответственно), а также с общим снижением содержания свободных жирных кислот (СЖК) (r = 0.27 и –0.04 соответственно) (Supplementary materials 1). Для кумжи и атлантического лосося выявлено накопление запасных ТАГ на ранних стадиях эмбрионального развития (бластула, гаструла, органогенез) до 15.03 и 17.95% сухого вещества соответственно, коррелирующих с увеличением содержания ДАГ (r = 0.55 и 0.49 соответственно) и уменьшением концентрации СЖК (r = 0.23 и –0.28 соответственно), относительно оплодотворенной икры. Однако стоит отметить разнонаправленность динамики СЖК (положительная корреляция у кумжи и отрицательная – у атлантического лосося) на данных стадиях развития у исследованных видов рыб. На этапах подготовки к выклеву и непосредственно в момент выклева личинки отмечено увеличение количества ТАГ у атлантического лосося (до 12.46 и 13.93% сухого вещества на стадиях предличинки и личинки соответственно). При этом у предличинок кумжи выявлено увеличение ТАГ до 12.45% сухого вещества, тогда как у личинок – снижение до 10.33% сухого вещества.
Рис. 2.
Изменение содержания липидов отдельных классов (общих фосфолипидов, диацилглицеринов, триацилглицеринов, холестерина, эфиров холестерина, свободных жирных кислот) в неоплодотворенной икре, на разных стадиях эмбрионального и раннего постэмбрионального развития атлантического лосося (Salmo salar L.) и кумжи (Salmo trutta L.). Примечание к рис. 2: ФЛ – общие фосфолипиды, ДАГ – диацилглицерины, ТАГ – триацилглицерина, ХС – холестерин, ЭХС – эфиры холестерина, СЖК – свободные жирные кислоты; 0 – неоплодотворенная икра, 1 – оплодотворенная икра, 2 – бластула, 3 – гаструла, 4 – органогенез, 5 – пигментация глаз, 6 – предличинка, 7 – личинка. Динамика липидных классов представлена в формате M ± SE. * – отличия достоверны (р ≤ 0.05) от предыдущей стадии развития, о – отличия достоверны (р ≤ 0.05) между атлантическим лососем (Salmo salar L.) и кумжей (Salmo trutta L.) на соответствующей стадии развития.
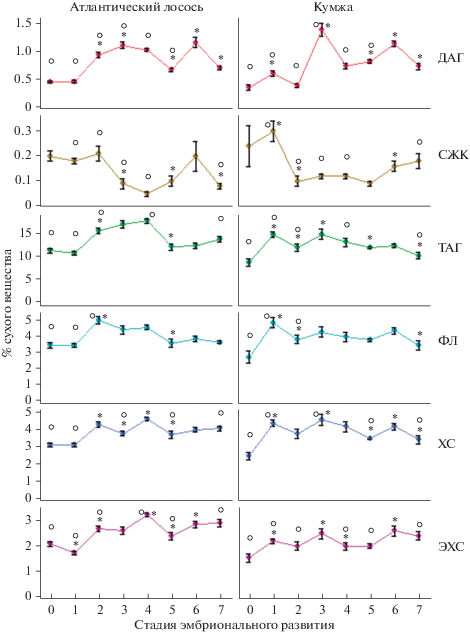
Отличительной особенностью кумжи является также достоверно более низкое содержание эфиров холестерина (ЭХС) по сравнению с атлантическим лососем (1.57–2.66 и 1.78–3.30% сухого вещества соответственно), на протяжении практически всего периода эмбрионального развития (рис. 2).
Рис. 3.
Изменение содержания фосфолипидов отдельных классов (фосфатидилхолин, фосфатидилэтаноламин, фосфатидилсерин, фосфатидилинозитол, лизофосфатидилхолин, сфингомиелин) в неоплодотворенной икре, на разных стадиях эмбрионального и раннего постэмбрионального развития атлантического лосося (Salmo salar L.) и кумжи (Salmo trutta L.). Примечание к рис. 3: ФХ – фосфатидилхолин, ФЭА – фосфатидилэтаноламин, ФС – фосфатидилсерин, ФИ – фосфатидилинозитол, ЛФХ – лизофосфатидилхолин, СФМ – сфингомиелин; 0 – неоплодотворенная икра, 1 – оплодотворенная икра, 2 – бластула, 3 – гаструла, 4 – органогенез, 5 – пигментация глаз, 6 – предличинка, 7 – личинка. Динамика фосфолипидных классов представлена в формате M ± SE. * – отличия достоверны (р ≤ 0.05) от предыдущей стадии развития, о – отличия достоверны (р ≤ 0.05) между атлантическим лососем (Salmo salar L.) и кумжей (Salmo trutta L.) на соответствующей стадии развития.
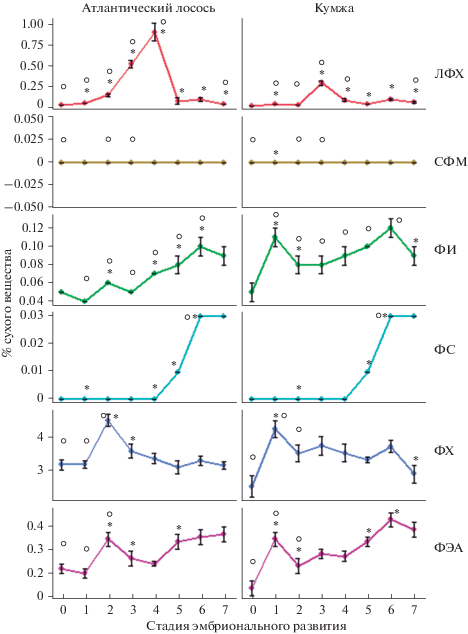
Результаты исследования содержания липидов в процессе развития лососевых рыб, представленные на рис. 2, свидетельствуют о том, что по количественному содержанию на втором и третьем месте после ТАГ располагаются структурные фосфолипиды (ФЛ) и холестерин (ХС), содержание которых в неоплодотворенной икре атлантического лосося составило 3.49 и 3.10% сухого вещества, а для кумжи – 2.74 и 2.44% сухого вещества соответственно. На стадиях эмбрионального и раннего постэмбрионального развития отмечены вариации в содержании данных липидов для атлантического лосося в диапазоне 3.62–5.05 и 3.09–4.63% сухого вещества, а для кумжи – 3.46–4.88 и 3.40–4.53% сухого вещества. Динамика ФЛ и ХС в икре исследованных видов лососевых рыб сходна и коррелирует между собой (r = 0.86 и 0.78 для кумжи и атлантического лосося соответственно). Основными классами фосфолипидов у обоих видов лососевых рыб являются фосфатидилхолин (ФХ) и фосфатидилэтаноламин (ФЭА) (рис. 3). Установлено, что у кумжи увеличение содержания ФХ происходит на стадии оплодотворения икры, тогда как у лосося – на стадии бластулы (Supplementary materials 2). Дальнейшее изменение содержания ФХ в эмбриогенезе демонстрирует тенденцию к снижению общего количества данной фракции ФЛ до 3.16 и 2.90% сухого вещества у личинок лосося и кумжи соответственно. Для ФЭА в этот же период установлена тенденция к увеличению содержания от 0.23 и 0.15 до 0.37 и 0.39% сухого вещества у лосося и кумжи.
Также отмечено накопление фосфатидилсерина (ФС) в икре на ранних постэмбриональных стадиях развития (до 0.03% сухого вещества у кумжи и лосося), а также и увеличение минорного фосфатидилинозитола (ФИ) (до 0.12 и 0.10% сухого вещества у кумжи и лосося соответственно) в процессе развития эмбриона. На стадиях гаструляции и органогенеза выявлено статистически значимое превалирование лизофосфатидилхолина (ЛФХ) у атлантического лосося по сравнению с кумжей – 0.52–0.91 и 0.29–0.08% сухого вещества соответственно. Наибольшая концентрация ЛФХ у лосося отмечена на стадии органогенеза с одновременным снижением метаболически связанного ФХ (до 3.36% сухого вещества), а у кумжи – на стадии гаструляции, однако у последней отмечено сохранение уровня ФХ (в пределах 3.53–3.75% сухого вещества).
ОБСУЖДЕНИЕ
Высокое содержание ОЛ в икре является характерным признаком лососевых рыб, связанным с их образом жизни, спецификой питания, а также экологическими особенностями размножения (Atchison, 1975; Zengin, Akpinar, 2006; Павлов и др., 2007a, 2007б; Bell, Tocher, 2009; Jonsson, Jonsson, 2011). Обнаруженные количественные различия в содержании ОЛ у кумжи и лосося в неоплодотворенной икре, а также на некоторых стадиях эмбриогенеза и раннего постэмбрионального развития (личинка с желточным мешком) указывают на видоспецифичность липидного метаболизма раннего онтогенеза у исследованных видов, что, по-видимому, является одним из факторов, определяющих разновременность развития и различия сроков выклева личинок. Ранее (Нефедова и др., 2010; Murzina et al., 2014) была продемонстрирована разнокачественность липидного профиля текучей икры из разных частей яичника атлантического лосося и горбуши (Oncorhynchus gorbuscha), которая впоследствии может сказываться на способности к оплодотворению, росте и развитии зародыша и дальнейшей дифференциации молоди лососевых рыб.
Низкая температура и длительный инкубационный период развивающейся икры в зимнее время, а также выклев личинок весной в специфических трофических условиях (при недостатке кормовых объектов), по-видимому, определяют высокий уровень запасных ТАГ в икре лососевых рыб (MacFarlane, Norton, 1999; Halver, 2000). На начальных стадиях эмбрионального развития (бластула, гаструла) ТАГ не используются в качестве источника энергии, поскольку на данных этапах преобладают реакции гликолиза (Мильман и др., 1977), а поглощение кислорода невелико (Рыжков, 1976; Озернюк, 1985; Юровицкий, 1999). Кроме того, согласно данным литературы (Tocher et al., 1985; Cejas et al., 2004), на ранних стадиях развития зародыша возможен синтез ТАГ de novo. Для обоих видов лососевых рыб отмечено накопление ТАГ на ранних стадиях эмбрионального развития, тогда как на поздних стадиях эмбрионального развития (органогенез, пигментация глаз, предличинка) и раннего постэмбрионального развития прослеживается общее снижение содержания ТАГ, что указывает на использование данного класса липидов в качестве энергетического источника. Установленные различия во времени использования ТАГ в качестве энергетических компонентов в процессе эмбриогенеза лосося и кумжи определяются, скорее всего, видовой спецификой развития эмбриона, а на уровне метаболизма липидов – регуляцией активности фермента липазы или активацией фермента липазы.
Отмеченное снижение содержания ТАГ у обоих видов рыб на стадии пигментации глаз связано, скорее всего, с усилением метаболических процессов – на данной стадии эмбрионального развития начинает функционировать печень, где протекают процессы липогенеза (Игнатьева, 1979; Озернюк, 1985; Рыжков, Крупень, 2004). Ранее было показано (Нефедова, 1989), что масса желтка эмбриона лосося от стадии дробления до пигментации глаз может снижаться до 24% за счет деградации липидных компонентов (в том числе энергетических ТАГ), что было также подтверждено в настоящей работе.
Известно, что до перехода на экзогенное питание личинки лососевых рыб в течение нескольких дней после выклева получают энергию преимущественно за счет собственных запасов (Эколого-биохимический статус…, 2016; Jin Y. et al., 2019). У личинок кумжи было отмечено снижение содержания ТАГ по сравнению с предыдущей стадией развития (предличинкой), что указывает на активную деградацию ТАГ, тогда как у атлантического лосося установлено повышение содержания ТАГ. Отсутствие у личинок лосося достоверных различий между данными стадиями развития в количественном содержании ТАГ, вероятно, связано с тем, что личинки лосося в качестве энергетических источников, предпочтительнее используют углеводы, а личинки кумжи – липиды. Похожие результаты были получены и в других работах (Лапин, Шатуновский, 1981; Нефедова, 1989; Немова и др., 2014; Мурзина и др., 2017).
Динамика использования ТАГ в качестве энергетических источников подтверждается ее корреляцией с динамикой его метаболического предшественника – ДАГ, а также продуктов гидролиза ТАГ – СЖК. Обнаружено (Supplementary materials 1), что коэффициенты корреляции СЖК у атлантического лосося и кумжи различаются, что указывает на различия в метаболизме липидов в эмбриогенезе этих видов рыб. Повышенное содержание СЖК отмечено на стадии оплодотворения у кумжи и на стадии бластулы у лосося, а также после пигментации глаз у обоих видов, что указывает на активные метаболические процессы (липолиз) на данных этапах развития. Эти данные согласуются с представлениями о том, что СЖК активно используется в качестве энергетического источника при усилении физиологических процессов (Cowey et al., 1985). Кроме того, увеличение содержания СЖК оказывает влияние на многие клеточные процессы, такие как регуляция деятельности некоторых ферментов, участие в передаче клеточного сигнала, модулирование связывания стероидных гормонов с рецепторами, транскрипция некоторых генов (Когтева, Безуглов, 1998).
Установленная пониженная концентрация ЭХС в икре кумжи определяется разной потребностью организма в липидах отдельных классов. Стоит отметить, что динамика изменения содержания ЭХС у кумжи и лосося в процессе эмбриогенеза в основном сходна, однако некоторые различия обнаружены на стадии оплодотворения икры – снижение содержания ЭХС у лосося (с 2.13 до 1.78% сухого вещества) и увеличение его содержания у кумжи (с 1.57 до 2.24% сухого вещества). Это может быть связано с более активным разрушением кортикальных альвеол на стадии оплодотворения у лосося с последующим высвобождением холестеринэстеразы по сравнению с кумжей (Ionescu et al., 1979; Gwatkin et al., 1980).
Развивающаяся в эмбриогенезе икра является “закрытой”, относительно гомогенной системой, находящейся на полном “самообеспечении” нормального развития эмбриона. Взаимосвязанное изменение общих ФЛ и ХС в процессе развития икры согласуется с необходимостью поддержания определенной структуры биомембраны клетки, в частности ее жидкостности (Болдырев и др., 2006). На стадии оплодотворения происходит увеличение содержания ФЛ и ХС, что является основной характеристикой существующих различий между лососем и кумжей, поскольку именно эту стадию развития икры связывают (Finn et al., 1995) с началом процессов деления клеток и “ригидностью биомембраны” от воздействий внешней среды. При этом, данные об общем снижении содержания ФХ и увеличении ФЭА в процессе развития исследованных видов лососевых рыб указывают, по-видимому, на перестройку фосфолипидного каркаса мембраны при подготовке к выклеву личинки.
Отмеченное накопление ФС в икре на ранних постэмбриональных стадиях развития, указывает на процессы индицирования активности Na+/K+-АТФ-азы – основного компонента осмотической регуляции (Болдырев и др., 2006). Увеличение минорного ФИ в процессе развития эмбриона определяется участием данного ФЛ в регуляции обмена кальция внутри клетки в качестве вторичного мессенджера (Радченко и др., 2005). В совокупности, увеличение синтеза ХС, снижение содержания ФХ и повышение концентрации ФЭА, ФС и ФИ указывает на активную клеточную перестройку организма, направленную на увеличение жидкостности биомембран как для оптимальной работы мембраносвязанных ферментов, так и для передачи сигналов внутрь клетки. Оптимальное соотношение холестерина к фосфолипидам (ХС/ФЛ), коэффициента Дьерди, который описывает микровязкость биомембраны, свидетельствует о влиянии этого параметра на активность мембраносвязанных ферментов и обменные процессы в развивающемся организме (Crockett, 1998; Mitra et al., 2004). На протяжении всего эмбрионального и раннего постэмбрионального развития икры это соотношение сохранялось в пределах одинаковых значений у обоих видов лососевых рыб. Только у ранних личинок в период после выклева икры из оболочек была отмечена тенденция к увеличению ХС/ФЛ до 1.00 и 1.10% сухого вещества у кумжи и атлантического лосося соответственно.
У атлантического лосося отмечена высокая концентрация ЛФХ на стадии органогенеза с одновременным снижением метаболически связанного с ним ФХ, тогда как у кумжи – на этапе гаструляции с сохранением уровня ФХ, что, вероятнее всего, связанно с реацилированием ЛФХ (Карагезян, 1972; Murzina, 2009). Известно, что накопление ЛФХ увеличивает проницаемость мембраны для ионов (Осадчая и др., 2004). Кроме того, ЛФХ под действием фосфолипазы D может превращаться в лизофосфатидную кислоту, которая, в свою очередь, тесно связана с процессами дифференциации клетки, ее ростом, подвижностью и выживанием (Бердичевец и др., 2010).
ЗАКЛЮЧЕНИЕ
При исследовании липидного профиля и динамики содержания отдельных липидов в процессе эмбрионального и раннего постэмбрионального развития кумжи и атлантического лосося была показана биохимическая разнокачественность (количественная) липидов как по стадиям развития, так и между исследованными видами рыб. Высокое содержание общих липидов и их энергетических форм в икре исследованных лососевых рыб обусловлено необходимостью их использования в последующем эмбриональном и раннем личиночном развитии в экологических условиях, сложившихся в биотопах, в которых молодь развивается до наступления смолтификации и перехода из пресной среды в морскую. Несмотря на то, что эти процессы генетически детерминированы, они тесно связаны и регулируются эпигенетическими условиями, связанными с условиями среды обитания (температурой, уровнем растворенного кислорода, фотопериодом и др.). Так изменения содержания и соотношения индивидуальных ФЛ (ФХ, ФЭА, ФС) можно рассматривать как компенсаторную адаптацию эмбрионального и раннего постэмбрионального развития исследуемых рыб, направленную на поддержание оптимальной микровязкости биомембран. Кроме того, данные об изменении таких физиологически активных веществ липидной природы как ФИ, ЛФХ и ДАГ в процессе эмбрионального развития лосося и кумжи можно рассматривать с точки зрения их значимости в регуляции биохимических и физиологических процессов в качестве вторичных мессенджеров.
На общий механизм адаптации к освоению новой среды обитания у обоих видов лососевых рыб после выклева личинки из оболочки свидетельствуют данные о повышении содержания ФС, минорного фосфолипида, участвующего в регуляции фермента осморегуляции, который активируется при переходе особей из пресной среды в морскую. Кроме того, известно, что ФС принимает активное участие в процессах нейрогенеза, что особенно важно для развивающейся молоди. Обнаруженные различия между атлантическим лососем и кумжей (более высокое содержание ОЛ, запасных ТАГ и ЭХС, а также метаболические изменения некоторых структурных липидов и, особенно, фосфолипидов) на отдельных этапах эмбрионального и раннего постэмбрионального развития, отражают особенности жизненной стратегии исследованных видов рыб. Для икры атлантического лосося характерно накопление энергетически ценных липидных компонентов (в частности ТАГ и ЭХС) на этапе активного клеточного деления, тогда как в икре кумжи отмечено варьирование содержания данных липидных компонентов на протяжении эмбрионального развития. В период выклева личинок из оболочек отмечено общее снижение содержания данных компонентов.
Таким образом, результаты изучения липидного профиля в икре в эмбриогенезе и у ранней личинки атлантического лосося и кумжи свидетельствуют как об общих механизмах, так и о специфических различиях, определяющих биохимическую разнокачественность организмов, отражающую, в свою очередь фенотипическую разнокачественность, которая в последующем определяет внутрипопуляционное разнообразие вида, специфику жизненной стратегии, сроки развития и готовности молоди к смолтификации.
Список литературы
Бредичевец И.Н., Тяжелова Т.В., Шимшилашвили Х.Р. и др. Лизофосфатидная кислота – липидный медиатор с множеством биологических функций. Пути биосинтеза и механизм действия. Обзор // Биохимия. 2010. Т. 75. № 9. С. 1213–1223.
Болдырев А.А., Кяйвяряйнен Е.И., Илюха В.А. Биомембранология: Учебное пособие. Петрозаводск: Изд-во КарНЦ РАН, 2006. 226 с.
Веселов А.Е., Калюжин С.М. Экология, поведение и распределение молоди атлантического лосося. Петрозаводск: Карелия, 2001. 160 с.
Ивантер Э.В., Коросов А.В. Введение в количественную биологию. Петрозаводск: Изд-во Петрозаводск. ун-та, 2003. 304 с.
Игнатьева Г.М. Ранний эмбриогенез рыб и амфибий (сравнительный анализ временных закономерностей развития). М.: Наука, 1979. 304 с.
Кабаков Р.И. R в действии. Анализ и визуализация данных в программе R / Пер. с англ. Полины А. Волковой. М.: ДМК Пресс, 2014. 588 с.
Карагезян К. Фосфолипиды и их роль в жизнедеятельности организма. Ереван, 1972. 29 с.
Когтева Г.С., Безуглов В.В. Ненасыщенные жирные кислоты как эндогенные биорегуляторы // Биохимия. 1998. Т. 63. № 1. С. 6–15.
Кузищин К.В. Особенности формирования внутривидовой разнокачественности у кумжи Salmo trutta L. Белого моря: автореферат дис…канд. биол. наук. М.: МГУ им. М.В. Ломоносова, 1997. 17 с.
Лапин В.И., Шатуновский М.И. Особенности состава, физиологическое и экологической значение липидов рыб // Успехи современной биологии. 1981. Т. 92. Вып. 3(6). С. 380–394.
Мильман Л.С., Юровицкий Ю.Г., Ермолаева Л.П. Контроль углеводного обмена на различных стадиях оогенеза // Соврем. проблемы оогенеза. М.: Наука, 1977. С. 249–264.
Мурзина С.А., Нефедова З.А., Пеккоева С.Н. и др. Содержание липидных компонентов у молоди кумжи Salmo trutta L. из реки Орзега (бассейн Онежского озера): II. Динамика уровня липидов в мальковом периоде развития // Ученые записки Петрозаводского государственного университета. 2017. Т. 6. № 167. С. 7–11.
Немова Н.Н., Нефедова З.А., Мурзина З.А. Особенности динамики липидов в раннем развитии атлантического лосося Salmo salar L. // Труды Карельского научного центра РАН. 2014. № 5. С. 44–52.
Нефедова З.А. Липидный статус лосося на ранних этапах онтогенеза: дис. … канд. биол. наук. Харьков: Харьковский Государственный университет им. А.М. Горького, 1989. 225 с.
Нефедова З.А., Мурзина С.А., Веселов А.Е. и др. Разнокачественность липидных и жирнокислотных спектров у сеголеток атлантического лосося Salmo salar L., различающихся размерно-весовыми характеристиками // Сибирский экологический журн. 2014. Т. 21. № 4. С. 639–645.
Нефедова З.А., Мурзина С.А., Пеккоева С.Н. и др. Сравнительная характеристика жирнокислотного профиля смолтов кумжи (Salmo trutta L.) и атлантического лосося (Salmo salar L.) в период смолтификации (река Индера, Бассейн Белого моря) // Известия РАН. Сер. биол. 2018. Т. 2. С. 144–149.
Нефедова З.А., Мурзина С.А., Руоколайнен Т.Р. и др. Липидный состав разных порций текучей икры атлантического лосося Salmo salar L. // Современные проблемы физиологии и биохимии водных организмов. Экологическая физиология и биохимия водных организмов. 2010. Т. 1. С. 215–218.
Озернюк Н.Д. Энергетический обмен в раннем онтогенезе рыб. М.: Наука, 1985. 175 с.
Осадчая Л.М., Галкина О.В., Ещенко Н.Д. Влияние коразола на активность Na+,K+-АТФазы и интенсивность ПОЛ в нейронах и нейроглии // Биохимические и молекулярно – биологические основы физиологических функций. 2004. № 37. С. 220–226.
Павлов Д.С., Лупандин А.И., Костин В.В. Механизмы покатной миграции молоди речных рыб. М.: Наука, 2007а. 211 с.
Павлов Д.С., Мещерякова О.В., Веселов А.Е. и др. Показатели энергетического обмена у молоди атлантического лосося Salmo salar L., обитающей в главном русле и притоке реки Варзуга (Кольский полуостров) // Вопр. ихтиол. 2007б. Т. 47. № 6. С. 819–826.
Павлов Д.С., Нефедова З.А., Веселов А.Е. и др. Липидный статус сеголеток атлантического лосося Salmo salar из разных микробиотов реки Варзуга // Вопросы ихтиологии. 2008. Т. 48. № 5. С. 679–685.
Павлов Д.С., Савваитова К.А. К проблеме соотношения анадромии и резидентности у лососевых рыб (Salmonidae) // Вопросы ихтиологии. 2008. Т. 48. № 6. С. 810–824.
Радченко В.В., Меркулова М.И., Шуваева Т.М. и др. Функциональная экспрессия и свойства Sec 14 p-подобного белка с молекулярной массой 45 кДа из обонятельного эпителия крысы // Биохимия. 2005. Т. 70. № 12. С. 1631–1638.
Рыжков Л.П. Морфофизиологические закономерности и трансформация вещества и энергии в раннем онтогенезе пресноводных рыб. Петрозаводск: ПетрГУ, 1976. 288 с.
Рыжков Л.П., Крупень И.М. Пресноводный лосось Онежского озера: Монография. Петрозаводск: Изд-во Петрозаводск. ун-та, 2004. 152 с.
Сидоров В.С., Лизенко Е.И., Болгова О.М. и др. Липиды рыб. 1. Методы анализа. Тканевая специфичность ряпушки Coregonus albula L. // Лососевые (Salmonidae) Карелии. Петрозаводск: Карельский филиал АН СССР. 1972. № 1. С. 152–163.
Тагизадэ В. Особенности морфогенетической изменчивости молоди кумжи из рек Ирана: дис. … канд. биол. наук. М.: МГУ им. М.В. Ломоносова, 2007. 148 с.
Уикем Х, Гроулмунд Г. Язык R в задачах науки о данных: импорт, подготовка, обработка, визуализация и моделирование данных. Пер. с англ. СПб.: Изд-во “Альфа-книга. 2019. 592 с.
Шустов Ю.А., Веселов А.Е. Современное состояние и пути сохранения озерной кумжи Salmo trutta m. Lacustris L. в водоемах Карелии // Лососевидные рыбы Восточной Фенноскандии. Петрозаводск, 2006. С. 198–210.
Эколого-биохимический статус молоди атлантического лосося Salmo salar L. из некоторых рек бассейна Белого моря / Под общ. ред. Немовой Н.Н. Петрозаводск: РИО КарНЦ РАН, 2016. 205 с.
Юровицкий Ю.Г. Отношения зародыша и желтка в развитии костистых рыб // Онтогенез. 1999. Т. 30. № 3. С. 205–209.
Arduini A., Peschechera A., Dottori S. et al. High-performance liquid chromatography of long-chain acylcarnitine and phospholipids in fatty acid turnover studies // J. Lipid Res. 1996. V. 37. P. 684–689.
Arslan M., Alaybasi S., Altun E. et al. Changes in lipids, fatty acids, lipid peroxidation and antioxidant defence system during the early development of wild brown trout (Salmo trutta) // Turkish Journal of Fisheries and Aquatic Sciences. 2016. V. 16. № 3. P. 703–714.
Atchison G.J. Fatty acid levels in developing brook trout (Salvelinus fontinalis) eggs and fry // J. Fisheries Board of Canada. 1975. V. 32. № 12. P. 2513–2515.
Bell M.V., Tocher D.R. Biosynthesis of fatty acids; general principles and new directions // Lipids in Aquatic Ecosystems / Eds. Arts M.T., Brett M., Kainz M. NY: Springer, 2009. P. 211–236.
Cejas J.R., Almansa E., Jerez S. et al. Changes in lipid class and fatty acid composition during development in white seabream (Diplodus sargus) eggs and larvae // Compar. Biochem. Physiol. B. 2004. V. 139. № 2. P. 209–216.
Cowey C.B., Bell J.G., Knox D. et al. Lipids and lipid antioxidant systems in developing eggs of salmon (Salmo salar) // Lipids. 1985. V. 20. № 9. P. 567–572.
Crockett E.L. Cholesterol function in plasma membranes from ectotherms: membrane-specific roles in adaptation to temperature // Integrative and Comparative Biology. 1998. V. 38. № 2. P. 291–304.
Finn R.N., Henderson J.R., Fyhn H.J. Physiological energetics of developing embryos and yolk-sac larvae of Atlantic cod (Gadus morhua). II. Lipid metabolism and enthalpy balance // Marine Biology. 1995. V. 124. № 3. P. 371–379.
Folch J., Lees M., Sloane Stanley G.H. A simple method for the isolation and purification of total lipids from animal tissues // J. Biol. Chem. 1957. V. 226. № 5. P. 497–509.
Gwatkin R.B.L., Williams D.T., Hartmann J.F. et al. The zona reaction of Hamster and Mouse egg: production in vitro by a trypsin-like protease from cortical granules // Reprod. Fert. 1980. V. 32. P. 259–265.
Ionescu V.M., Mester R., Scripcarin D. et al. Cytochemical localization and electrophoretical characterization of acid phosphatase in fish ovary // Rev. Roum. Biol. 1979. V. 24. № 2. P. 117–123.
Jin Y., Olsen R.E., Ostensen M.A. et al. Transcriptional regulation of lipid metabolism when salmon fry switches from endogenous to exogenous feeding // Aquaculture. 2019. V. 503. P. 422–429.
Johnson R.B. Lipid deposition in oocytes of teleost fish during secondary oocyte growth // Reviews in Fisheries Science. 2009. V. 17. № 1. P. 78–89.
Jonsson B., Jonsson N. Habitats as template for life histories / Ecology of Atlantic Salmon and Brown Trout. Springer, Dordrecht, 2011. 720 p.
Halver J.E. Lipids and Fatty Acids. Washington, 2000. 246 p.
Hellwig J. Definig parameters for a reproducible TLC – separation of phospholipids using ADC 2. Diploma thesis, University of Applied Sciences Northwestern Switzerland (FHNW), 2008.
MacFarlane R.B., Norton E.C. Nutritional dynamic during embryonic development in the viviparous genus Sebastes their application to the assessment of reproductive success // Fish Biol. 1999. V. 97. P. 273–281.
Mitra K., Ubarretxena-Belandia I., Taguchi T. et al. Modulation of the bilayer thickness of exocytic pathway membranes by membrane proteins rather than cholesterol // Proc. Natl. Acad. Sci. USA. 2004. V. 101. № 12. P. 4083–4088.
Mueller C.A., Doyle L., Eme J. et al. Lipid content and fatty acid profile during lake whitefish embryonic development at different incubation temperatures // Comparative Biochemistry and Physiology Part A: Molecular & Integrative Physiology. 2017. V. 203. P. 201–209.
Murzina S.A., Nefedova Z.A., Veselov A.E. et al. Changes in fatty acid composition during embryogenesis and in young age groups (0+) of Atlantic salmon Salmo salar L. The role of rheotactic behavior and lipid composition of fry in the formation of phenotypic groups of salmon in large Arctic rivers // Salmon: Biology, Ecological Impacts and Economic Importance / P.T.K. Woo, D.J. Noakes. Eds. N.Y.: Nova Science Publishers, 2014. P. 47–67.
Murzina S.A., Nefedova Z.A., Ruokolainen T.R. et al. Dynamics of lipid content during early development of freshwater salmon Salmo salar L. // Russ. J. Dev. Biol. 2009. V. 40. P. 165–170. https://doi.org/10.1134/S1062360409030059
Olsen R.E., Henderson R.J. The rapid analysis of neutral and polar marine lipids using double-development HPTLC and scanning densitometry // J. Exp. Mar. Biol. Ecol. 1989. V. 129. P. 189–197.
Tocher D.R. Metabolism and functions of lipids and fatty acids in teleost fish // Reviews in Fisheries Science. 2003. V. 11. № 2. P. 107–184.
Tocher D.R., Fraser A.J., Sargent J.R. et al. Fatty acid composition of phospholipids and neutral lipids during embryonic and early larval development in Atlantic herring (Clupea harengus L.) // Lipids. 1985. V. 20. P. 69–74.
Zengin H., Akpinar M.A. Fatty acid composition of Oncorhynchus mykiss during embryogenesis and other developmental stages // Biologia. 2006. V. 61. № 3. P. 305–311.
Дополнительные материалы
- скачать ESM.docx
- Дополнительные материалы


