Онтогенез, 2021, T. 52, № 3, стр. 208-219
Изменения популяции микроглиоцитов при формировании спинного мозга свидетельствуют об участии микроглии в регуляции нейроногенеза и синаптогенеза
Е. А. Колос a, *, Д. Э. Коржевский a
a Федеральное государственное бюджетное научное учреждение “Институт экспериментальной медицины”
197376 Санкт-Петербург, ул. Академика Павлова, 12, Россия
* E-mail: koloselena1984@yandex.ru
Поступила в редакцию 01.12.2020
После доработки 24.01.2021
Принята к публикации 27.01.2021
Аннотация
Изучены локализация и распределение микроглиоцитов в эмбриональном спинном мозге (СМ) крысы в период формирования предшественников двигательных нейронов. Для идентификации клеток микроглии применяли антитела к белку Iba-1. Для исследования динамики развития клеток эмбрионального СМ использовали следующие иммуногистохимические маркеры: виментин (маркер клеток радиальной глии), даблкортин (маркер нейробластов) и синаптофизин (маркер синаптических везикул). Показано, что предшественники микроглии проникают в дорзальную часть спинного мозга на 12 сут эмбрионального развития, а в области формирующихся мотонейронов обнаруживаются на 14-е сутки. Установлено, что эмбриональные микроглиоциты находятся в тесных взаимоотношениях с отростками радиальной глии и отростками нейробластов передних рогов. Исследование динамики развития эмбрионального СМ крысы и сопоставление процессов его гистогенеза с локализацией и морфологическими изменениями эмбриональной микроглии указывает на ее участие в синаптогенезе и в дифференцировке мотонейронов (нейроногенезе).
ВВЕДЕНИЕ
Микроглиоциты являются автономной самообновляющейся популяцией фагоцитирующих клеток ЦНС, осуществляющих непрерывный контроль внеклеточной среды как при физиологических, так и при патологических состояниях. Согласно современным представлениям, микроглиоциты происходят из эритромиелоидных клеток-предшественников желточного мешка, проникающих в ЦНС на ранних этапах пренатального развития и способных сохраняться в постнатальном периоде. После формирования гематоэнцефалического барьера, популяция микроглии поддерживается путем пролиферации (Tseng et al., 1982; Ginhoux et al., 2010; Коржевский и др., 2012). Большинство исследований, посвященных происхождению микроглиоцитов было выполнено на мышах и рыбках данио. Значительно меньше информации о ранней колонизации клетками микроглии нервной системы крыс (Tseng et al., 1982; Wang et al., 1996). Показано, что в физиологических условиях микроглия присутствует в ЦНС в неактивированной (разветвленной) форме. Разветвленные микроглиальные клетки способны реагировать на возникающие изменения гомеостаза ЦНС, вступая в процесс активации, что сопровождается разнообразными морфофункциональными изменениями. Известно, что микроглия зрелой ЦНС осуществляет защиту от повреждающих агентов путем фагоцитоза, презентации антигенов и секреции про- и противовоспалительных цитокинов; осуществляет реорганизацию нейронных цепей путем непосредственного взаимодействия с синапсами, их элиминации и модулирования активности нейронов; выполняет нейропротекторную функцию, стимулирует рост аксонов, способствуют выживанию и дифференцировке предшественников олигодендроцитов (Tremblay et al., 2010; Tay et al., 2017; Li et al., 2020). В многочисленных исследованиях изучается участие этих клеток в патогенезе нейродегенеративных заболеваний (рассеянный склероз, болезнь Альцгеймера и др.), их реакция на инфекционные поражения нервной системы и травмы головного и спинного мозга (Колос, Коржевский, 2020). Большое внимание в научной литературе уделяется микроглиальным клеткам как регуляторам развития головного мозга в норме и при повреждающих воздействиях в пренатальном и раннем постнатальном периодах (Pont-Lezica et al., 2011, 2014; Michell-Robinson et al., 2015; Lenz, Nelson, 2018; Sufieva et al., 2020). Развитие микроглии, как первого представителя глиальных клеток в нервной трубке, происходит в непосредственной близости от дифференцирующихся нейронов, астроцитов и олигодендроцитов. Астроциты и олигодендроциты появляются в развивающемся спинном мозге (СМ) на более поздних стадиях пренатального развития (Chaboub, Deneen, 2012; Tien et al., 2012; Chen et al., 2017). Это свидетельствует о важной роли микроглиоцитов при развитии нервной системы. До сих пор остается много неизученных вопросов, касающихся участия микроглии в процессах гистогенеза СМ и в поддержании его гомеостаза. Функции, выполняемые предшественниками микроглиоцитов на разных этапах пренатального развития, а также особенности заселения развивающегося СМ микроглиальными клетками остаются неясными. Исследования, касающиеся изучения микроглии в эмбриональном спинном мозге млекопитающих, немногочисленны и выполнены на эмбрионах мышей и птиц (Calderó et al., 2009; Rigato et al., 2011).
Цель настоящего исследования состояла в изучении распределения микроглиальных клеток в спинном мозге крысы в период эмбрионального и раннего постнатального развития.
МАТЕРИАЛЫ И МЕТОДЫ
В настоящем исследовании изучен формирующийся СМ крыс, начиная с 11 сут эмбрионального развития, то есть с момента закрытия нервной трубки (Altman, Bayer, 2001), до рождения. Работа выполнена на эмбрионах крыс Вистар 11–19 сут развития (Е11–Е19, n = 30) и новорожденных крысах (Р1, n = 3). Работа с животными проводилась в соответствии с “Правилами проведения работ с использованием экспериментальных животных” и с соблюдением Европейской конвенции о защите позвоночных животных, используемых для экспериментов или в иных научных целях (1986 г.). Исследование одобрено этическим комитетом ФГБНУ “ИЭМ” (протокол № 3/19 от 25 апреля 2019). У эмбрионов и новорожденных крыс выделяли фрагменты СМ в области шейного отдела на уровне 3–5 сегмента. Материал фиксировали в цинк-этанол-формальдегиде (Korzhevskii et al., 2015) в течение суток, обезвоживали в спиртах возрастающей концентрации и ксилоле, заливали в парафин. Изготавливали серийные срезы толщиной 5 мкм. Для выявления клеток микроглии применяли поликлональные козьи антитела к кальций-связывающему белку Iba-1 (ionized calcium-binding adapter molecule 1) (разведение 1 : 200, AbCam, Великобритания). Белок Iba-1 является маркером микроглиоцитов нервной системы и других фагоцитирующих клеток и позволяет идентифицировать эти клетки как во взрослом организме (Колос, Коржевский, 2020; Streit et al., 2014; Kongsui et al., 2014), так и в эмбриогенезе (Rigato et al., 2011; Ueno et al., 2013; Marsters et al., 2020). Перед проведением иммуногистохимической реакции на Iba-1 производили тепловое демаскирование антигена. Блокировку эндогенной пероксидазы и неспецифических сайтов связывания антигена, а также выявление связавшихся первичных антител проводили с использованием реагентов из набора Anti-Goat HRP-DAB Cell & Tissue Staining Kit (кат. № S008, R&D Systems, США). Продукт иммуногистохимической реакции выявляли с применением 3,3'‑диаминобензидина (DАВ+, K3468, Agilent, США). Часть препаратов окрашивали толуидиновым синим по Нисслю. Для маркирования формирующихся синаптических контактов в вентральной части СМ эмбрионов крыс и новорожденных животных проводили иммуногистохимическое выявление синаптофизина – гликопротеина мелких пресинаптических пузырьков нервных клеток (Колос и др., 2015) с применением кроличьих поликлональных первичных антител (MON-RTU1195, Monosan, Нидерланды). В качестве вторичных антител применяли реагенты из набора Reveal Polyvalent HRP/DAB Detection System kit (SpringBioscience, США). Продукт иммуногистохимической реакции выявляли с применением 3,3'-диаминобензидина (DАВ+, K3468, Agilent, США). Полученные препараты анализировали с использованием светового микроскопа Leica DM750 (Германия), изображения получали с применением фотокамеры ICC50 (Leica, Германия). Обработку изображений производили с помощью программного обеспечения LAS EZ (Leica, Германия).
Для флуоресцентной микроскопии с целью выявления Iba1-содержащих клеток в качестве вторичных реагентов применяли биотинилированные антитела против иммуноглобулинов козы из набора R&D Systems (CTS008, R&D Systems, США), а также конъюгат стрептавидина с флуорохромом Cy2 (#016-220-084, Jackson ImmunoResearch, США). Для идентификации радиальной глии в формирующемся СМ эмбрионов крыс применяли моноклональные антитела к виментину (Клон V-9, M0725, Agilent, США) и вторичные антитела, конъюгированные с тетраметилродаминизотиоцианатом (TRITC) (Agilent, США). Нейриты дифференцирующихся нейронов передних рогов СМ эмбрионов крыс выявляли с помощью поликлональных кроличьих антител к даблкортину (DCX) (ab18723, Abcam, Великобритания, разведение 1 : 500) и вторичных антител, конъюгированных с тетраметилродаминизотиоцианатом (TRITC) (Agilent, США). Препараты анализировали с применением конфокального лазерного микроскопа LSM 800 (Zeiss, Германия). Для возбуждения флуоресценции Cy2 применяли лазер 488 нм, для TRITC – 561 нм. Анализ изображений проводили с использованием программы ZEN 2012 (Zeiss, Германия).
С целью оценки специфичности взаимодействия антител с тканевыми антигенами и для выявления возможного неспецифического окрашивания для каждой иммуногистохимической реакции проводили отрицательный и положительный контроль. Вместо первичных антител на срезы наносили разбавитель для антител (S0809) (Dako, Дания). В качестве положительного контроля были использованы микроглиоциты на срезах СМ взрослых животных.
Для оценки изменений количества микроглиоцитов в изучаемой области производили подсчет числа Iba-1-иммунопозитивных клеток, содержащих ядро в плоскости среза, на единицу площади (1 мм2) базальной пластинки спинного мозга эмбрионов и вентральной части СМ новорожденных крыс.
Измерение площади изучаемой области осуществляли с использованием программы ImageJ (NIH, США). Данные гистограммы приведены как среднее значение в группе со стандартной ошибкой. Статистический анализ различий между группами проводили с использованием непараметрического критерия Краскела–Уоллиса (непараметрический дисперсионный анализ) с последующим проведением попарных сравнений с помощью критерия Манна–Уитни при p < 0.05.
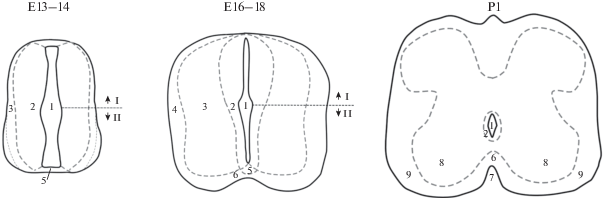
Структурные особенности Iba-1-содержащих клеток определяли с учетом их топографии в пределах вентральной части (эпендимный, мантийный и маргинальный слои базальной пластинки) формирующегося спинного мозга крыс. На рис. 1 приведены схемы поперечных срезов СМ крыс на разных сроках развития с указанием зон, названия которых используются авторами настоящего исследования для обозначения локализации Iba-1-иммунопозитивных клеток.
Рис. 1.
Схемы поперечных срезов шейного отдела СМ крыс на Е13–14, Е16–18 и Р1. I – алярная пластинка; II – базальная пластинка; 1 – формирующийся центральный канал; 2 – эпендимный слой; 3 – мантийный слой; 4 – маргинальный слой; 5 – донная пластинка; 6 – передняя белая спайка; 7 – передняя срединная щель; 8 – серое вещество передних рогов СМ; 9 – белое вещество передних рогов СМ.
РЕЗУЛЬТАТЫ
На поперечных гистологических срезах эмбрионального СМ отмечено несколько зон концентрации Iba-1-иммунопозитивных клеток в разных его частях. В настоящей работе основное внимание уделяли вентральной части формирующегося СМ, поскольку именно здесь закладываются основные нейроны, обеспечивающие двигательные функции.
Установлено, что на Е11 в нервной трубке, которая представлена псевдомногослойным нейроэпителием, Iba-1-иммунопозитивные (Iba1+) клетки отсутствуют. На следующие сутки развития (Е12) единичные иммунопозитивные клетки начинают проникать в формирующийся спинной мозг крысы, преимущественно в дорзальной части.
Начиная с Е13, в вентральной части развивающегося СМ эмбрионов крыс можно идентифицировать слой округлых нейробластов в зоне дифференцирующихся клеток, дающих начало серому веществу передних рогов СМ. Среди них присутствуют единичные клетки, ориентированные медиолатерально и имеющие отросток, направленный к наружной поверхности СМ, в последствии формирующие передний корешок СМ. На этом сроке нами не было отмечено присутствие Iba-1-иммунопозитивных клеток среди нейробластов развивающихся передних рогов. Крайне редко были отмечены единичные Iba1+ клетки в эпендимной зоне.
На Е14 в СМ эмбрионов крыс идентифицируются три концентрических слоя: эпендимный, мантийный и маргинальный. Мантийный слой базальной пластинки в вентро-латеральной части представлен округлыми клетками, некоторые из которых имеют длинные отростки, проходящие к периферии развивающегося СМ и формирующие презумптивные передние корешки СМ. Также в этой зоне идентифицируются дорзо-вентрально ориентированные комиссуральные вставочные нейробласты. Iba1+ клетки в вентральной части мантийного слоя немногочислены, чаще располагаются на границе между мантийным и маргинальным слоями. Такие иммунопозитивные клетки имеют веретеновидное или округлое тело с одним или двумя отростками. Единичные амебоидные клетки присутствуют в области формирующихся мотонейронов.
На 15 сут в мантийном слое базальной пластинки идентифицируются дорзо-вентрально ориентированные комиссуральные нейробласты, кластеры молодых мотонейронов и окружающие их вставочные нейробласты. Клетки донной пластинки имеют отростки, которые достигают базальной мембраны СМ и в последствии формируют вентральную срединную щель. В мантийном слое базальной пластинки на Е15 выявлены крупные амебоидные Iba1+ клетки нередко образующие группы (рис. 2а; рис. 5б). Кроме того, на этом сроке также были отмечены амебоидные иммунопозитивные клетки в области, прилежащей к формирующейся передней белой спайке: небольшие скопления Iba1+ клеток локализуются между донной пластинкой и мантийной зоной базальной пластинки. Отдельные амебоидные Iba-1+ клетки этой зоны ориентированы горизонтально, они повторяют направление аксонов, формирующих переднюю белую спайку. Среди отростков клеток донной пластинки, образующих срединную борозду СМ, иммунопозитивных клеток не обнаружено. В маргинальном слое базальной пластинки идентифицируются иммунопозитивные клетки веретеновидной и амебиодной формы без отростков. Такие клетки часто ориентированы вдоль волокон маргинального слоя.
Рис. 2.
Iba-1-иммунопозитивные клетки формирующегося спинного мозга эмбриона крысы на 15 сутки развития. Стрелка – апоптозное тельце. Иммуногистохимическая реакция на белок Iba-1, докраска толуидиновым синим (а); иммунофлуоресцентная реакция на белок Iba-1 (Cy2 – зеленое окрашивание) и виментин (TRITC – красное окрашивание); конфокальная лазерная микроскопия (б). Масштаб 20 мкм (а), 50 мкм (б).

Отдельные Iba-1-иммунопозитивные клетки прилежат к Vim-содержащим отросткам радиальной глии. Также выявлены единичные амебоидные клетки, ориентированные медиолатерально на границе маргинальной и мантийной зоны базальной пластинки, перпендикулярно по отношению к виментин-содержащим отросткам (рис. 2б).
В вентральной части спинного мозга эмбрионов крыс Е16–17 определяются области формирования интернейронов и изолированные формирующиеся двигательные ядра. На Е16–17 в мантийной зоне базальной пластинки (формирующееся серое вещество передних рогов СМ) амебоидные иммунопозитивные клетки преобладают в области формирующихся двигательных ядер СМ. Однако отдельные Iba1+ клетки с амебоидной морфологией присутствуют и среди развивающихся интернейронов. На этом сроке также были выявлены единичные амебоидные иммунопозитивные клетки в области формирующейся передней белой спайки.
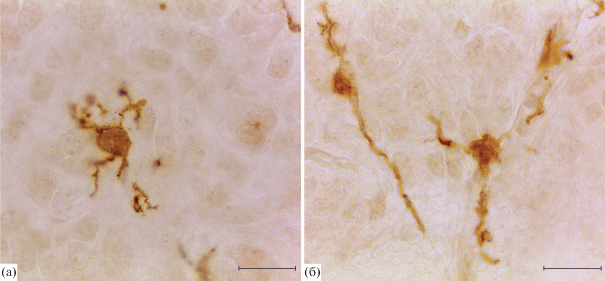
Также в этот период развития в маргинальном слое базальной пластинки идентифицированы Iba1-содержащие амебоидные клетки, находящиеся в непосредственной близости к DCX-иммунопозитивным волокнам и, вероятно, взаимодействующие с ними (рис. 3а), а также Iba-1-иммунопозитивные клетки веретеновидной формы, ориентированные вдоль Vim-иммунопозитивных отростков радиальной глии (рис. 3б). Отдельные Iba-1+ клетки окружают Vim-содержащие структуры, расположенные непосредственно под оболочками СМ – субпиальные ножки радиальной глии.
Рис. 3.
Iba-1-иммунопозитивные клетки вблизи отростков молодых нейронов (а) и отростков радиальной глии (б) в СМ крысы на 16 сут эмбрионального развития. Двойная иммуноцитохимическая реакция на белок Iba-1 (Cy2 – зеленое окрашивание) и даблкортин (TRITC – красное окрашивание) (а); двойная иммуноцитохимическая реакция на белок Iba-1 (Cy2 – зеленое окрашивание) и виментин (TRITC – красное окрашивание) (б). Конфокальная лазерная микроскопия. Масштаб 20 мкм.

Спинной мозг эмбрионов 18 сут развития имеет ряд отличий по сравнению с предыдущими сроками. Редуцируется эпендимный слой, презумптивный центральный канал становится уже, в мантийном слое можно видеть области формирования дорзальных и вентральных рогов, расширился маргинальный слой, вентральная и дорзальная срединные борозды становятся более заметными.
На Е18 в формирующемся сером веществе передних рогов СМ иммунопозитивные клетки распределены достаточно равномерно как в области формирующихся двигательных ядер, так и среди молодых интернейронов. Отдельные Iba1-содержащие клетки имеют округлое тело и несколько тонких разветвленных отростков (рис. 4а). Однако большая часть Iba1-содержащих клеток имеет неправильную форму с утолщенными маловетвящимися отростками.
Рис. 4.
Iba-1-иммунопозитивные клетки формирующегося серого вещества передних рогов спинного мозга крысы (а) и зоны формирующейся передней белой спайки (б) на 18 сутки эмбрионального развития. Иммуногистохимическая реакция на белок Iba-1. Масштаб 20 мкм.
Иммунопозитивные клетки в области формирующейся передней белой спайки на Е18 имеют морфологические признаки рамифицированных микроглиоцитов. Их тонкие длинные отростки нередко ориентированы вдоль волокон, расположенных под донной пластинкой и формирующих белую спайку и вдоль отростков клеток донной пластинки, формирующих срединную борозду (рис. 4б).
Через сутки (Е19) эпендимный слой СМ крысы уменьшается, центральный канал сужается, расширяется область формирующегося серого вещества и белого вещества СМ, вентральная и дорзальная борозды, которые делят белое вещество углубляются. На Е19 в формирующемся сером веществе передних рогов СМ гипертрофированные (рис. 5г) и амебоидные микроглиоциты выявлены преимущественно среди молодых интернейронов, редкие из них присутствуют в области формирующихся двигательных ядер. В формирующемся белом веществе передних рогов СМ также выявлены Iba1-иммунопозитивные клетки. Это мелкие клетки неправильной формы или веретеновидные клетки, ориентированные вдоль волокон, проходящих через белое вещество.
Рис. 5.
Синаптофизин-иммунопозитивные структуры и микроглиоциты в спинном мозге крыс на 15 сут (а, б), 19 сут (в, г) эмбрионального развития и после рождения (д, е). Иммуногистохимические реакции на синаптофизин (а, в, д) и белок Iba-1 (б, г, е). Масштаб 50 мкм (а, б); 20 мкм (в, г, д, е).
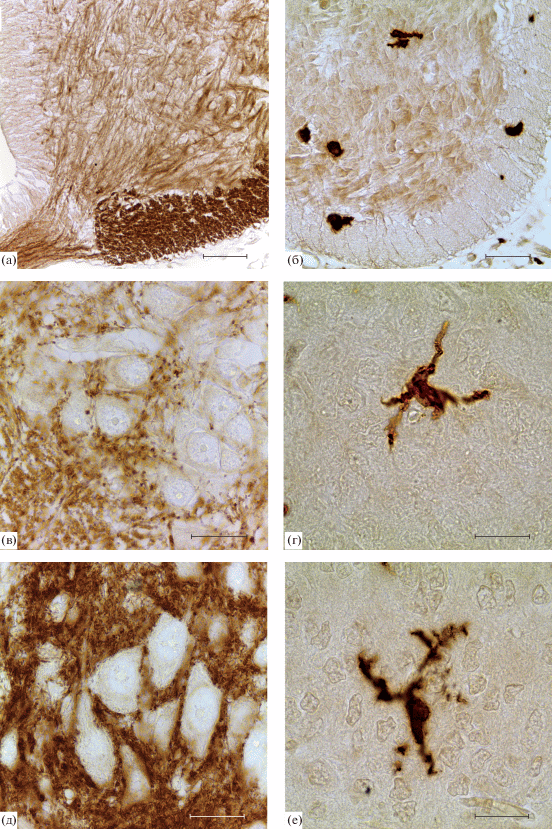
Спинной мозг новорожденной крысы отличается от эмбрионального увеличенными размерами белого и серого вещества. В первые сутки после рождения (Р1) в спинном мозге крыс присутствует большое количество Iba-содержащих клеток. В сером веществе вентральных рогов СМ, иммунопозитивные клетки распределены равномерно и имеют неправильную форму с утолщенными маловетвящимися отростками (рис. 5е) или имеющие толстые короткие отростки (гипертрофированные и кустистые микроглиоциты). Единичные клетки имеют длинные тонкие разветвленные отростки. Иммунопозитивные клетки передней белой спайки имеют округлые тела и ветвящиеся отростки, ориентированные вдоль аксонов комиссуральных нейронов или нервных волокон, образующих срединную борозду. Однако микроглиоциты этой зоны по морфологическим признакам отличаются от рамифицированной микроглии взрослых животных, среди них преобладают гипертрофированные клетки.
С применением метода иммуногистохимического выявления синаптофизина было показано, что начиная с 15 сут эмбрионального развития в формирующихся передних рогах СМ крыс идентифицируются иммунопозитивные отростки нейробластов (рис. 5а). К 19 суткам развития иммунореактивность проявляют синаптоподобные округлые структуры, расположенные на поверхности нейробластов и их отростков (рис. 5в). В передних рогах спинного мозга новорожденных крыс реакция на синаптофизин позволила выявить большое количество синаптических бутонов вокруг тел нейронов и их отростков (рис. 5д).
При проведении отрицательного контроля для иммуногистохимических реакции для всех используемых в исследовании антител на препаратах окрашивания выявлено не было. При проведении положительного контроля иммунореактивность отмечена в микроглиоцитах СМ. Неспецифицеского окрашивания и автофлуоресценции не наблюдалось.
Количественный анализ показал, что с момента входа первых микроглиоцитов в вентральную часть СМ (Е14) до рождения плотность распределения клеток микроглии увеличивается более чем в 5 раз (р < 0.05) (рис. 6). Установлено, что наибольшее изменение количества клеток наблюдается в ранний период эмбриогенеза – между Е14 и Е15. Число микроглиоцитов на единицу площади базальной пластинки СМ в этот период возрастает в три раза (р < 0.05) (рис. 6).
ОБСУЖДЕНИЕ
В последние годы многочисленные исследования доказывают значимую роль клеток микроглии в развитии ЦНС (Ueno et al., 2013; Pont-Lezica et al., 2014; Reemst et al., 2016). Однако распределение микроглиоцитов в развивающемся СМ и их функциональное значение на разных этапах эмбриогенеза не ясно до сих пор. Проведенное в настоящей работе сопоставление процессов, происходящих в развивающемся СМ, с распределением и локализацией микроглицитов позволило предположить участие этих клеток, как первых активно функционирующих глиоцитов, в пренатальном нейроно- и глиогенезе.
Показано, что в эмбриональном СМ микроглиальные клетки, не обладают длинными отростками, а имеют амебоидную, кустистую или гипертрофированную форму вплоть до позднего пренатального и раннего постнатального периода. То есть, по морфологичесским признакам эмбриональная микроглия близка к активированному типу микроглиоцитов взрослого спинного мозга (Колос, Коржевский, 2020). Однако недавние исследования демонстрируют, что развивающаяся микроглия не вступает в классический процесс активации, в противоположность микроглии взрослых животных, которая активируется в ответ на воспаление или нейродегенерацию. Эмбриональная микроглия фенотипически значительно отличается от активированной микроглии взрослых животных (Bennett et al., 2016). Также ряд исследований демонстрирует более высокую скорость миграции эмбриональных микроглиоцитов по сравнению с активированными клетками взрослой ЦНС (Stence et al., 2001; Swinnen et al., 2013). Вероятно, форма клеток, лишенных длинных разветвленных отростков, позволяет поддерживать высокую мобильность микроглиоцитов и обеспечивать миграцию и колонизацию различных областей развивающегося СМ. Таким образом, эмбриональная микроглия обладает уникальными свойствами, отличающими ее от “активированных” и “покоящихся” микроглиоцитов ЦНС взрослых животных.
Нами отмечено, что на поздних сроках эмбриогенеза и в раннем постнатальном периоде, наряду с гипертрофированным, кустистым и амебиодными клетками микроглии, в передних рогах СМ крыс появляются первые клетки с длинными тонкими ветвящимися отростками (после Е18). Можно предположить, что такие морфологические изменения связаны с переходом клеток от высокой мобильности к стационарному состоянию с преобладанием контролирующих функций с целью выявления отклонений гомеостаза, контроля функционирования нейронных сетей и синаптического ремоделирования.
Настоящее исследование эмбриональной микроглии на разных сроках формирования спинного мозга показало, что ее локализация изменяется в разные периоды развития. Динамика распределения микроглиальных клеток может быть связана с гистогенетическими процессами, происходящими в развивающемся СМ, такими как пролиферация, программируемая клеточная гибель, миграция и дифференцировка, синаптогенез, развитие и реорганизация нейронных цепей.
Микроглиоциты являются резидентными макрофагами ЦНС и способны к фагоцитозу. Возможно, одна из их функций в эмбриогенезе связана с апоптозом нейробластов. В ходе настоящего исследования в базальной пластинке эмбрионального СМ были обнаружены единичные апоптозные тельца. Основываясь на литературных данных можно предположить, что идентифицированная нами амебоидная микроглия, присутствующая в области формирующихся мотонейронов, начиная с Е15 может принимать активное участие в их программируемой клеточной гибели, происходящей в вентральной части эмбрионального СМ в этот период.
Нами отмечено, что проникновение ранней микроглии в мантийный слой базальной пластинки (будущее серое вещество передних рогов СМ) совпадает с важной стадией развития СМ, во время которой нейронные сети становятся функциональными и начинается синаптогенез. По литературным данным известно, что синаптогенез в вентральной части СМ крыс начинается с Е13.5 (Vaughan, Grieshaber, 1973; Prasad et al., 2008). Согласно данным авторов, на Е13.5 и Е14.5 в вентральной части СМ крысы идентифицируются единичные аксосоматические синаптические контакты, содержащие немногочисленные синаптические пузырьки (по 3–4 в бутоне). Позднее, в период появления первых рефлексов (Е 15.5 и 16.5) количество бутонов увеличивается, число синаптических пузырьков в зоне пресинаптической мембраны также возрастает (Vaughan, Grieshaber, 1973). Пик синаптогенеза в СМ наблюдается в период Е16–17 (May, Biscoe, 1975). По нашим данным синаптофизин, являющийся белком синаптических везикул (Колос и др., 2015), начиная с Е15, идентифицируется в отростках развивающихся двигательных, вставочных и комиссуральных нейронов, что свидетельствует о начале его активной транспортировки от тела нервных клеток к незрелым синаптическим контактам в области передних рогов СМ. Синаптофизин участвует в регуляции функционирования синапсов, включая такие процессы как экзоцитоз, биогенез и эндоцитоз везикул (Kwon, Chapman, 2011). Синаптофизин-содержащие синаптоподобные округлые структуры вблизи тел молодых нейронов и их отростков идентифицированы нами, начиная с Е19, в период активного функционирования нейронных цепей.
В настоящем исследовании Iba-1-иммунопозитивные клетки в области формирующихся передних рогов впервые обнаружены, начиная с Е14, в период начала образования первых незрелых синаптических контактов в вентральной части формирующегося СМ. Во время наиболее активного синаптогенеза (Е16–17) популяция микроглиоцитов в этой области увеличивается. Это может быть связано с участием эмбриональных микроглиоцитов в процессе образования, устранения избыточных и ремоделирования синаптических контактов.
После рождения в СМ крыс продолжается активный синаптогенез и развитие нейронных сетей. В передних рогах СМ новорожденных животных идентифицируется большое количество округлых синаптофизин-иммунопозитивных синаптических бутонов на телах и отростках нейронов. По нашим данным в этот период в вентральной части СМ популяция микроглиоцитов достаточно многочисленна, что связано с активным синаптогенезом, происходящим в этой области. Как известно, в развивающейся ЦНС нейронная сеть не обладает точностью и структурированностью, характерной для зрелой нервной системы (Hua, Smith, 2004). Количество образовавшихся синапсов избыточно. В процессе синаптического прунинга большое количество контактов удаляются, оставшиеся же поддерживаются, созревают и контролируются. Считается, что основными клетками-модуляторами синаптической обрезки в процессе развития ЦНС являются микроглиоциты (Wake et al., 2009; Tremblay et al., 2010; Schafer et al., 2012). Имея достаточную степень ветвления отростков, микроглия в постнатальном периоде способствует созреванию синаптических контактов (Mosser et al., 2017), контролирует их функциональное состояние и потенциально способствует устранению нефункциональных соединений (Wake et al., 2009; Kim et al., 2017; Filipello et al., 2018).
В настоящем исследовании было отмечено увеличение количества Iba1-иммунопозитивных клеток в маргинальном слое базальной пластинки СМ, начиная с 15 сут эмбрионального развития крыс. С применением метода двойного иммунофлуоресцентного окрашивания установлено, что микроглиоциты этой области СМ располагаются в непосредственной близости от DCX-содержащих аксонов молодых мотонейронов, проходящих через белое вещество передних рогов и формирующих презумптивные передние корешки СМ. Такое взаимодействие может свидетельствовать о влиянии эмбриональных микроглиоцитов на рост нейритов. Существуют косвенные доказательства того, что микроглиоциты способны оказывать влияние на рост аксонов (блокировать или стимулировать) и изменять направление их роста. Предполагается, что в развивающейся ЦНС, особенно в белом веществе, они способствуют росту аксонов и, возможно, направляют нейриты путем синтеза тромбоспондина, IGF1, NT3 и направляющих молекул, таких как Slit, Netrin; а также ингибируют рост, синтезируя RGMa (Chamak et al., 1994; Wehrle et al., 2005; Hata et al., 2006; Ueno et al., 2013; Reemst et al., 2016). Однако детали таких взаимодействий остаются неизученными до настоящего времени. Также не известно, происходят ли такие процессы во время нормального развития ЦНС или лишь при повреждении.
В настоящем исследовании отмечено, что на ранних стадиях развития (начиная с Е15) Iba-1-иммунопозитивные клетки накапливаются в области формирования передней белой спайки. Эта структура (commissura alba anterior) представляет собой пучок нервных волокон комиссуральных интернейронов, обеспечивающих связь с нейронами на контралатеральной стороне спинного мозга. Возможно, выявленные в данной области микроглиальные клетки могут оказывать влияние, совместно с клетками донной пластинки, на прохождение нейритами срединной линии СМ. В исследованиях, проведенных in vitro, продемонстрированно, что микроглия принимает активное участие в росте нейритов путем экспрессии BDNF, секреции плазминогена и тромбоспондина (Nagata et al., 1993; Chamak et al., 1994; Yang et al., 2012). Считается, что микроглия, локализованная в области формирующихся трактов белого вещества в различных отделах головного мозга, способствует росту аксонов, формирует путь роста пучка отростков нейронов путем фагоцитоза избыточных клеток и отростков, устраняя гибнущие аксоны. Также можно предположить, что микроглиоциты формирующейся зоны передней белой спайки участвуют в контроле процесса формирования пучка нервных волокон из отдельных аксонов (фасцикуляции аксонов). В пользу этого предположения свидетельствуют результаты исследований Понт-Лезика с соавт. (2014). На модели системного пренатального воспаления и с истощением популяции микроглиоцитов авторами было продемонстрировано, что изменение активности микроглии мозолистого тела привело к дефасцикуляции дорсальных каллозальных аксонов (Pont-Lezica et al., 2014).
С применением двойного маркирования нами показано, что в формирующемся белом вещества передних рогов СМ крыс часть Iba-1-содержащих клеток, преимущественно веретеновидной формы, располагаются в непосредственно близости от тонких Vim-иммунопозитивных отростков радиальной глии, а также в контакте с субпиальными ножками радиальной глии, образующими пограничную глиальную мембрану. Взаимодействие микроглиоцитов с радиальной глией было отмечено ранее в формирующейся сетчатке глаза (Sanchez-Lopez et al., 2004) и в развивающемся спинном мозге мышей (Rezaie, Male, 1999; Rigato et al., 2011). Такое расположение может свидетельствовать о радиальной миграции развивающихся микроглиоцитов по отросткам радиальной глии. Кроме того, по литературным данным известно, что микроглиоциты, продуцируя оксид азота (NO), способны регулировать переход от нейроногенеза к глиогенезу и способствовать созреванию астроглии (Béchade et al., 2011). Для понимания взаимодействия этих двух глиальных популяций в эмбриогенезе требуются дополнительные исследования.
ЗАКЛЮЧЕНИЕ
В настоящем исследовании показано, что первые клетки ранней микроглии обнаруживаются в дорзальной части СМ на 12 сут пренатального развития. В вентральной части эмбрионального СМ единичные микроглиоциты появляются на 14 сут, в период формирования DCX-содержащих нейробластов. Скопления микроглиоцитов в этой области наблюдаются, начиная с 15 сут, в период накопления синаптофизина и активного функционирования нейронных цепей. В дальнейшем в вентральной части СМ постоянно присутствуют группы клеток микроглии, вероятно, осуществляющие регуляцию процесса синаптогенеза, роста отростков дифференцирующихся нейронов и функционирования нейронных цепей. Установлено, что в период с момента появления первых клеток микроглии в вентральной части эмбрионального СМ до рождения количество микроглиоцитов увеличивается более чем в 5 раз. Причем наибольший рост числа микроглиоцитов в вентральной части СМ наблюдается в ранний период эмбриогенеза – между 14 и 15 сут. Отмечено, что микроглиоциты передних рогов спинного мозга в процессе развития претерпевают морфологические изменения: от круглых амебоидных клеток в раннем эмбриогенезе до отростчатых микроглтоцитов на поздних сроках эмбригенеза и в постнатальном периоде. Установлено, что клетки эмбриональной микроглии СМ находятся в тесных взаимоотношениях не только с отростками DCХ-иммунопозитивных нейробластов, но и с радиальными глиоцитами. Это свидетельствует о том, что микроглиоциты, как первые дифференцированные клетки СМ, обладающие значительным регуляторным потенциалом, оказывают влияние как на нейроногенез, так и на глиогенез.
Список литературы
Колос Е.А., Григорьев И.П., Коржевский Д.Э. Маркер синаптических контактов – синаптофизин // Морфология. 2015. Т. 147. № 1. С. 78–82.
Колос Е.А., Коржевский Д.Э. Микроглия спинного мозга в норме и при патологии // Acta Naturae (русскоязычная версия). 2020. Т. 12. № 1(44). С. 4–17.
Коржевский Д.Э., Кирик О.В., Сухорукова Е.Г. и др. Структурная организация микроглиоцитов стриатума после транзиторной фокальной ишемии // Морфология. 2012. Т. 141. № 2. С. 28–32.
Altman J., Bayer S.A. Development of the human spinal cord: An interpretation based on experimental studies in animals. New York: Oxford University Press, 2001. 542 р.
Béchade C., Pascual O.,Triller A., Bessis A. Nitricoxide regulates astrocyte maturation in the hippocampus: involvement of NOS2 // Mol. Cell. Neurosci. 2011. V. 46. P. 762–769.
Bennett M.L., Bennett F.C., Liddelow S.A., et al. New tools for studying microglia in the mouse and human CNS // Proc. Natl. Acad. Sci. USA. 2016. V. 113. № 12. E1738–E1746.
Calderó J., Brunet N., Ciutat D., et al. Development of microglia in the chick embryo spinal cord: implications in the regulation of motoneuronal survival and death // J. Neurosci. Res. 2009. V. 87. № 11. P. 2447–2466.
Chaboub L.S., Deneen B. Developmental origins of astrocyte heterogeneity: the final frontier of CNS developmen // Dev. Neurosci. 2012. V. 34. P. 379–388.
Chamak B., Morandi V., Mallat M. Brain macrophages stimulate neurite growth and regeneration by secreting thrombospondin // J. Neurosci. Res. 1994. V. 38. № 2. P. 221–233.
Chen V.S., Morrison J.P., Southwell M.F. et al. Histology atlas of the developing prenatal and postnatal mouse central nervous system, with emphasis on prenatal days E7.5 to E18.5 // Toxicol. Pathol. 2017. V. 45. P. 705–744.
Filipello F., Morini R., Corradini I. et al. The microglial innate immune receptor TREM2 is required for synapse elimination and normal brain connectivity // Immunity. 2018. V. 48. № 5.
Ginhoux F., Greter M., Leboeuf M. et al. Fate mapping analysis reveals that adult microglia derive from primitive macrophages // Science. 2010. V. 330. № 6005. P. 841–845.
Hata K., Fujitani M., Yasuda Y. et al. RGMa inhibition promotes axonal growth and recovery after spinal cord injury // J. Cell Biol. 2006. V. 173. № 1. P. 47–58.
Hua J.Y., Smith S.J. Neural activity and the dynamics of central nervous system development // Nat. Neurosci. 2004. V. 7. № 4. P. 327–332.
Kim H.-J., Cho M.-H., Shim W.H. et al. Deficient autophagy in microglia impairs synaptic pruning and causes social behavioral defects // Mol. Psychiatry. 2017. V. 22. P. 1576–1584.
Kongsui R., Beynon S.B., Johnson S.J., Walker F.R. Quantitative assessment of microglial morphology and density reveals remarkable consistency in the distribution and morphology of cells within the healthy prefrontal cortex of the rat // J. Neuroinflammation. 2014. № 11:182.
Korzhevskii D.E., Sukhorukova E.G., Kirik O.V., Grigorev I.P. Immunohistochemical demonstration of specific antigens in the human brain fixed in zinc-ethanol-formaldehyde // European J. Histochemistry. 2015. V. 59. № 3. P. 233–237.
Kwon S.E., Chapman E.R. Synaptophysin regulates the kinetics of synaptic vesicle endocytosis in central neurons // Neuron. 2011. V. 70. № 5. P. 47–54.
Lenz K.M., Nelson L.H. Microglia and beyond: innate immune cells as regulators of brain development and behavioral function // Front. Immunol. 2018. V. 9. P. 698.
Li Y., He X., Kawaguchi R. et al. Microglia-organized scar-free spinal cord repair in neonatal mice // Nature. 2020. V. 587. № 7835. P. 613–618.
Marsters C. M., Nesan D., Far R. et al. Embryonic microglia influence developing hypothalamic glial populations // J. Neuroinflam. 2020. V. 17. P. 146.
May M.K., Biscoe T.J. An investigation of the foetal rat spinal cord I. Ultrastructural observations on the onset of synaptogenesis // Cell Tissue Res. 1975. V. 158. P. 241–249.
Michell-Robinson M.A., Touil H., Healy L.M. et al. Roles of microglia in brain development, tissue maintenance and repair // Brain. 2015. V. 138. Р. 1138–1159.
Mosser C.A., Baptista S., Arnoux I., Audinat E. Microglia in CNS development: Shaping the brain for the future // Prog Neurobiol. 2017. V. 149–150. P. 1–20.
Nagata K., Nakajima K., Takemoto N. et al. Microglia-derived plasminogen enhances neurite outgrowth from explant cultures of rat brain // Int. J. Dev. Neurosci. 1993. V. 11. P. 227–237.
Pont-Lezica L., Béchade C., Belarif-Cantaut Y. et al. Physiological roles of microglia during development // J. Neurochem. 2011. V. 119. № 5. P. 901–908.
Pont-Lezica L., Beumer W., Colasse S. et al. Microglia shape corpus callosum axon tract fasciculation: functional impact of prenatal inflammation // Eur. J. Neurosci. 2014. V. 39. № 10. Р. 1551–1557.
Prasad T., Wang X., Gray P.A., Weiner J.A. A differential developmental pattern of spinal interneuron apoptosis during synaptogenesis: insights from genetic analyses of the protocadherin-γ gene cluster // Development. 2008. V. 135. № 24. P. 4153–4164.
Reemst K., Noctor S.C., Lucassen P.J., Hol E.M. The indispensable roles of microglia and astrocytes during brain development // Front. Hum. Neurosci. 2016. V. 10. P. 566.
Rezaie P., Male D. Colonisation of the developing human brain and spinal cord by microglia: a review // Microsc. Res. Tech. 1999. V. 45. P. 359–382.
Rigato C., Buckinx R., Le-Corronc H. et al. Pattern of invasion of the embryonic mouse spinal cord by microglial cells at the time of the onset of functional neuronal networks // Glia 2011. V. 59. № 4. P. 675–695.
Sanchez-Lopez A., Cuadros M.A., Calvente R. et al. Radial migration of developing microglial cells in quail retina: A confocal microscopy study // Glia. 2004. V. 46. № 3. P. 261–273.
Schafer D.P., Lehrman E.K., Kautzman A.G. et al. Microglia sculpt postnatal neural circuits in an activityand complement-dependent manner // Neuron. 2012. V. 74. P. 691–705.
Stence N., Waite M., Dailey M.E. Dynamics of microglial activation: a confocal time-lapse analysis in hippocampal slices // Glia. 2001. V. 33. № 3. P. 256–266.
Streit W.J., Xue Q.S., Tischer J., Bechmann I. Microglial pathology // Acta Neuropathol. Commun. 2014. V. 26. № 2. P. 142.
Swinnen N., Smolders S., Avila A. et al. Complex invasion pattern of the cerebral cortex by microglial cells during development of the mouse embryo // Glia. 2013. V. 61. № 2. P. 150–163.
Sufieva D.A., Razenkova V.A., Antipova M.V., Korzhevskii D.E. Microglia and tanycytes of the infundibular recess of the brain in early postnatal development and during aging // Russ. J. Dev. Biol. 2020. V. 51. P. 189–196.
Tay T.L., Savage J.C., Hui C.W. et al. Microglia across the lifespan: from origin to function in brain development, plasticity and cognition // J. Physiol. 2017. V. 595. № 6. P. 1929–1945.
Tien A.C., Tsai H.H., Molofsky A.V. et al. Regulated temporal-spatial astrocyte precursor cell proliferation involves BRAF signalling in mammalian spinal cord // Development. 2012. V. 139. P. 2477–2487.
Tremblay M.E., Lowery R.L., Majewska A.K. Microglial interactions with synapses are modulated by visual experience // PLoS Biol. 2010. V. 8. e1000527.
Tseng C.Y., Ling E.A., Wong W.C. Light and electron microscopic and cytochemical identification of amoeboid microglial cells in the brain of prenatal rats // J. Anat. 1983. V. 136. Pt 4. P. 837–849.
Ueno M., Fujita Y., Tanaka T. et al. Layer V cortical neurons require microglial support for survival during postnatal development // Nat. Neurosci. 2013. V. 16. № 5. P. 543–551.
Vaughan J.E., Grieshaber J.A. A morphological investigation of an early reflex pathway in developing rat spinal cord // J. Comp. Neurol. 1973. V. 148. № 2. P. 177–209.
Wake H., Moorhouse A.J., Jinno S. et al. Resting microglia directly monitor thefunctional state of synapses in vivo and determine the fate of ischemic terminals // J. Neurosci. 2009. V. 29. № 13. P. 3974–3980.
Wang C.C., Wu C.H., Shieh J.Y. et al. Immunohistochemical study of amoeboid microglial cells in fetal rat brain // J. Anat. 1996. V. 189. Pt 3. P. 567–574.
Wehrle R., Camand E., Chedotal A. et al. Expression of netrin-1, slit-1 and slit-3 but not of slit-2 after cerebellar and spinal cord lesions // Eur. J. Neurosci. 2005. V. 22. P. 2134–2144.
Yang H., Feng G.D., Liang Z. et al. In vitro beneficial activation of microglial cells by mechanically-injured astrocytes enhances the synthesis and secretion of BDNF through p38MAPK // Neurochem. Int. 2012. V. 61. № 2. P. 175–186.
Дополнительные материалы отсутствуют.



