Онтогенез, 2021, T. 52, № 3, стр. 195-207
Развитие 3D церебральных агрегатов в желудочках мозга взрослых мышей
К. К. Сухинич a, *, К. М. Шакирова b, Э. Б. Дашинимаев a, b, М. А. Александрова a
a ФГБУН Институт биологии развития им. Н.К. Кольцова РАН
119334 Москва, ул. Вавилова, 26, Россия
b ФГБОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России
117997 Москва, ул. Островитянова, 1, Россия
* E-mail: sukhinichkirill@gmail.com
Поступила в редакцию 17.01.2021
После доработки 29.01.2021
Принята к публикации 03.02.2021
Аннотация
Церебральные органоиды – это трехмерные клеточные культуры, формирующиеся из специфичных для мозга типов клеток, возникающих из эмбриональных или плюрипотентных стволовых клеток. Органоиды дают возможность изучения ранних этапов развития мозга и заболеваний центральной нервной системы. Однако моделирование органоидов связано с рядом пока нерешенных задач. Методики получения органоидов включают сложный процесс культивирования клеток, требующий специальных сред, ростовых факторов, и зачастую, использование биореактора. Даже в стандартизованных условиях формируются структуры различные по морфологии: от неорганизованных клеточных агрегатов, до структурированных мини мозгов, которые и отбираются для изучения. По естественным причинам органоиды, выращенные in vitro не имеют кровоснабжения, что ограничивает их развитие. Мы попытались получить церебральные агрегаты, подобные органоидам, в модели in vivo, где обеспечивается рост сосудов и кровоснабжение ткани, для чего трансплантировали суспензию клеток из неокортекса эмбриона мыши в боковые желудочки мозга взрослых мышей. Поэтому, средой для культивирования служила спинномозговая жидкость, а биореактором – боковые желудочки мозга, где она циркулирует. Результаты показали, что неокортекс от Э14.5 является подходящим источником стволовых/прогениторных клеток, которые самоорганизуются в трехмерные агрегаты и васкуляризуются in vivo. Агрегаты состояли из центрального слоя зрелых нейронов, свободной от клеток маргинальной зоны и пограничной глиальной мембраны, что имело сходство с церебральными органоидами. Таким образом, для получения васкуляризованных клеточных агрегатов, напоминающих церебральные органоиды, могут быть использованы боковые желудочки мозга взрослой мыши.
ВВЕДЕНИЕ
Изучение развития мозга в нормальных и патологических состояниях проводится главным образом на лабораторных грызунах, но, когда речь заходит о мозге человека, превращается в очень сложную задачу, поскольку эксперименты in vivo проводить невозможно. Частично этот барьер можно преодолеть, используя иммунодефицитных животных для трансплантации нейральных клеток человека, которые достаточно длительное время могут развиваться в мозге реципиента, что позволяет исследовать их дифференцировку (Han et al., 2013; Mansour et al., 2018). Множество работ по развитию мозга млекопитающих проводится на адгезивных культурах in vitro (Koo et al., 2019). Однако при 2D культивировании не формируются трехмерная организация нервных и глиальных клеток и специфические пространственные межклеточные взаимодействия характерные для развивающегося мозга (Pacitti et al., 2019). Не так давно была продемонстрирована возможность создания трехмерных органоидов in vitro (Watanabe et al., 2005; см. обзор Sukhinich, Aleksandrova, 2020). Церебральные органоиды представляют собой самоорганизующиеся клеточные трехмерные агрегаты, состоящие из специфичных для мозга типов клеток, возникших из эмбриональных или плюрипотентных стволовых клеток (Qian et al., 2019). В органоидах воспроизводятся морфо-генетические процессы ранних этапов развития, в том числе специфическая миграция клеток и цитоархитектоника эмбрионального мозга (Eiraku et al., 2011; Mariani et al., 2012; Todd et al., 2013). Модель органоида также оказалась успешной для изучения ряда заболеваний центральной нервной системы, среди них, например, микроцефалия (Lancaster et al., 2013) и даже болезнь Альцгеймера (Gonzalez et al., 2018). Однако, несмотря на широкий интерес к моделированию органоидов, технология их воспроизводства связана с рядом пока не решенных задач. Первое, это сложный, многоэтапный процесс культивирования клеток, в результате которого только некоторые органоиды приобретают характерную гистотипическую организацию, и второе, отсутствие в органоидах васкуляризации и некоторых типов клеток, специфичных для мозга, что ограничивает его рост. Интересным подходом может быть выращивание органоидов в “естественной среде микроокружения”, а именно, в полостях желудочков мозга экспериментальных животных in vivo. В этой модели можно избежать необходимости в специальных питательных средах, так как они заменяются спинномозговой жидкостью, которая является биологически активной средой (Rahimi, Woehrer, 2017), оказывает важное регулирующее влияние на прогениторные клетки в процессе нейрогенеза коры головного мозга (Lehtinen et al., 2011), кроме того возможно использовать уже коммитированные типы клеток. Целью настоящего исследования было изучение способности к самоорганизации в трехмерные агрегаты, подобные органоидам, трансплантированных стволовых и прогениторных клеток эмбрионального неокортекса при их развитии в ликворе желудочков мозга взрослой мыши.
МАТЕРИАЛЫ И МЕТОДЫ
Животные
Трансгенных гетерозиготных мышей линии C57BL/6-Tg(ACTB-EGFP)10sb/J (Jackson Laboratories, Bar Harbor, ME) и мышей линии C57Bl/6 использовали для получения датированной беременности и трансплантации. Утро, когда была обнаружена вагинальная пробка, было отмечено как Э0.5. На сроках развития Э14.5 (n = 4) и Э19.5 (n = 4) из эмбрионов трансгенных мышей EGFP выделяли ткань фронтальной части неокортекса.
ОТ-ПЦР
Выделение РНК проводили согласно протоколу к коммерческому набору компании “Qiagen” RNeasy Kit (Qiagen, #74004) с использованием “Qiagen” DNase Kit (Qiagen, #79254) для удаления остатков геномной ДНК. Лизис образцов неокортекса проводили без предварительной гомогенизации органа. Для получения первой цепи кДНК на матрице выделенной РНК использовали коммерческий набор компании “Евроген” MMLV RT kit (Evrogen, #SK021). Ввиду разного расположения на транскрипте мишений амплификации для синтеза кДНК использовали смесь случайных декануклеотидных праймеров и олиго(dT) праймера в соотношении 1 : 1 (праймеры включены в набор MMLV RT kit). Для одной реакции брали 1 мкг РНК. Для проведения ОТ-ПЦР в реальном времени были подобраны праймеры с помощью онлайн ресурса NCBIPrimer-BLAST (табл. 1). Преимущественно подбирали праймеры к последовательностям, лежащим на стыке экзонов для избежания амплификации геномной ДНК. ПЦР в реальном времени проводили с использованием амплификатора CFX96 Touch (Bio-Rad). Для ОТ-ПЦР использовали готовую коммерческую смесь qPCRmix-HSSYBR компании “Евроген” (Evrogen, #PK147L). Оценку экспрессии проводили по методу 2ΔСt, где в качестве контрольного образца использовалась культура иммортализированных мышиных фибробластов 3T3-NIH. Нормализацию результатов проводили по экспрессии генов домашнего хозяйства GAPDH и ACTB. Значения 2ΔCt использованы для расчета изменения уровня экспрессии изучаемых генов: R = 2–∆Сt, для удобства построения графиков полученные данные были представлены в формате Log10(R).
Таблица 1.
Праймеры, использованные для ОТ-ПЦР в реальном времени
| Ген | Последовательность, 5'–3' |
|---|---|
| GAPDH | Fv: TGCACCACCAACTGCTTAGC Rv: GGCATGGACTGTGGTCATGAG |
| ACTB | Fv: CCCTGAACCCTAAGGCCAAC Rv: ATGGCTACGTACATGGCTGG |
| DCX | Fv: CCCCATGTGTGTGAGGTGTT Rv: GCTCTTTGGCTGCCCAGTAT |
| GFAP | Fv: TGAATCGCTGGAGGAGGAGA Rv: GCCACTGCCTCGTATTGAGT |
| NES | Fv: GGCTGTATTCCCCTCCATCG Rv: CCAGTTGGTAACAATGCCATGT |
| NEUN | Fv: GGATTCGGGTTCGTAACTTTC Rv: GGCGTGACCATCTTCTTGTT |
| PAX6 | Fv: ACCCAAGAGCAGATTGAGGC Rv: TTGGCTGCTAGTCTTTCCCG |
| SOX2 | Fv: TGCGCGCTCTGCACAT Rv: GAAGCGTGTACTTATCCTTCTTCA |
| SYP | Fv: CCAATCAGATGTAATCTGGTCAGT Rv: AGGCCTTCTCTTGAGCTCTT |
| TUBB3 | Fv: CAGCGGCAACTATGTAGGGG Rv: CCAGGTTCCAAGTCCACCAG |
Трансплантация
При приготовлении суспензии клеток для трансплантации ткань неокортекса, полученную от мышей Э14.5 (число эмбрионов, n = 4), диссоциировали с использованием раствора Аккутазы (Sigma-Aldrich, США) и промывали в растворе Хэнкса (Gibco). Объем каждого трансплантата составлял 1.5 мкл и содержал 300 000 клеток. Взрослых мышей C57Bl/6 (n = 9) анестезировали изофлураном. Операционная поверхность была выбрита, кожа между ушами разрезана, кости черепа истончены. Суспензию фронтального неокортекса вводили стереотаксически шприцем Гамильтона. Инъекции выполнялись в следующих координатах относительно Брегмы: +0.3 мм (антерио-постериально), 1 мм (латерально), 1.5 мм (дорсо-вентрально). Иммуносупрессия не проводилась.
Приготовление срезов
На 5-й, 30-й и 90-й дни после трансплантации выполняли транскардиальную перфузию с использованием фосфатно-солевого буфера (Phosphate buffered saline, PBS) и 4% параформальдегида. Каждый мозг был извлечен из черепа и инкубирован в течение ночи в том же фиксаторе. Затем мозг промывали в PBS и переносили в 30% сахарозу на PBS. Коронарные срезы получали с помощью криостата (Leica CM1900), толщина срезов составляла 40 мкм. Тот же протокол был использован для мозга эмбрионов мыши Э14.5. Срезы хранили в растворе криопротектора при –20°C.
Иммуногистохимия
Предметные стекла со срезами инкубировали в течение одного часа при комнатной температуре в блокирующем растворе: смеси 5% нормальной козьей сыворотки (Sigma-Aldrich), 0.3% Triton X-100 (Triton) и 0.01 M PBS (pH 7.4). После этого инкубировали в течение ночи при 4°C в смеси блокирующего раствора и первичных антител. Были использованы следующие антитела: кроличьи антитела против NeuN (Abcam, ab104225, 1 : 500); кроличьи антитела против GFAP (Abcam, ab7260, 1 : 800); куриные антитела против GFP (MolecularProbes, A-11122, 1 : 500), кроличьи антитела против Sox2 (Abcam, ab92494, 1 : 500); кроличьи антитела против DCX (Abcam, ab18723, 1 : 800); кроличьи антитела против Pax6 (Abcam, ab195045, 1 : 500); кроличьи антитела против beta-III tubulin (Abcam, ab18207, 1: 500); кроличьи антитела против Synaptophysin (Abcam, ab32127, 1 : 600). Затем срезы промывали и инкубировали в течение 2 ч в смеси 0.3% Triton X-100 (Triton), 0.01 M PBS (pH 7.4) и следующих вторичных антител: козьи антитела против IgY цыпленка (Abcam, ab150169, AlexaFluor488, 1 : 600), и козьи антитела против IgG кролика (Abcam, ab150080, AlexaFluor 594, 1 : 600). Для визуализации сосудов срезы окрашивали лектином (Lycopersicon Esculentum) меченым флуорохромом DyLight® 594 (Vector Laboratories, DL-1177-1). Затем срезы промывали в PBS и ядра окрашивали раствором DAPI (2 мкг/мл, Sigma, D9542). Гистологические изображения получали с помощью флуоресцентного микроскопа BZ-9000E (Keyence, Япония).
РЕЗУЛЬТАТЫ
Характеристика клеток эмбрионального неокортекса
Для выбора наиболее подходящего материала для трансплантации было проведено исследование неокортекса эмбрионов двух стадий развития Э14.5 и Э19.5. Метод количественного ОТ-ПЦР в реальном времени показал, что на стадии Э19.5 происходит статистически значимое снижение маркеров стволовых клеток Sox2 и тенденция к снижению Nes (nestin). При этом происходит статистически значимое повышение экспресии NeuN и Syp (synaptophysin) по сравнению с Э14.5, что свидетельствует о процессах дифференцировки в нейроны. Наиболее важным показателем является изменение экспрессии мРНК гена астроцитов – GFAP, который на Э14.5 в нейрогенной фазе дифференцировки вообще не экспрессировался, а на Э19.5, в глиогенной фазе, показывает высокий уровень (рис. 1). Стоит отметить, что на обоих сроках наблюдается стабильная экспрессия маркера недифференцированных нейронов: Dсx (doublecortin) и Tubb3 (beta-III tubulin). Для подтверждения малодифференцированного статуса неокортекса Э14.5 было проведено иммуногистохимическое исследование (ИГХ) с использованием нейрональных маркеров (рис. 2). Результаты ИГХ анализа показали, что клетки с маркерами нейральных стволовых клеток (НСК) Pax6 и Sox2 распределены строго в V-SVZ (вентрикулярно-субвентрикулярная зона) и отсутствуют в других слоях коры. Мигрирующие нейробласты, экспрессирующие DСX, занимают промежуточную зону коры мозга. В зоне кортикальной пластинки располагаются нейробласты, экспрессирующие маркер ранних нейронов beta-III tubulin. За пределами V-SVZ все нейроны экспрессируют маркер синаптических контактов synaptophysin, поскольку синаптические везикулы уже присутствуют в растущих аксонах и их окончаниях, несмотря на то, что стабильных синапсов на этой стадии развития еще нет. Ядерный маркер зрелых нейронов NeuN экспрессируется в клетках на очень низком уровне, что, свидетельствует о малом числе дифференцированных нейронов. Таким образом, низкий уровень дифференцировки клеток эмбрионального неокортекса Э14.5, а также отсутствие в нем астроцитов делает его более подходящим материалом для трансплантации по сравнению с неокортексом стадии Э19.5.
Рис. 1.
Сравнение экспрессии нейральных маркеров в клетках мозга эмбрионов мыши на стадиях Э14.5 и Э19.5. На стадии Э19.5 клетки становятся более зрелыми и начинается глиогенез. Данные отображены в формате Log10(R), где R = 2–2ΔСt. * – p < 0.05 по критерию Уилкоксона–Манна–Уитни, разница в экспрессии статистически значима.
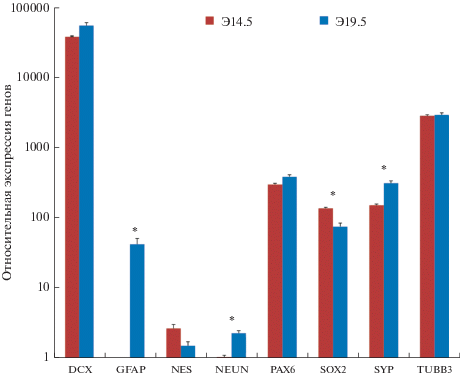
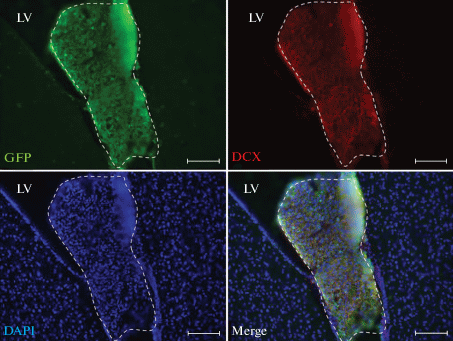
Рис. 2.
Иммуногистохимическое исследование неокортекса эмбриона мыши стадии Э14.5. Незрелые нейроны (Beta-IIItubulin+) находятся в кортикальной пластинке. Нейробласты DCX+ занимают интермедиальную зону, в их аксонах выявляется синаптофизин (Synaptophysin). Нейральные стволовые клетки (Sox2+, Pax6+) выявляются только в вентрикулярной и субвентрикулярной зоне. Зрелые нейроны (NeuN+) находятся в кортикальной пластинке. LV – латеральный желудочек. Масштабный отрезок: 100 мкм.

Клетки эмбрионального неокортекса формируют трехмерные агрегаты после трансплантации в желудочек мозга мышей
На момент трансплантации клетки в суспензии были ошарены, располагались единично или образовывали небольшие агрегаты. После трансплантации суспензии охарактеризованных клеток эмбрионального неокортекса мыши (стадия Э14.5) в желудочек мозга взрослых мышей морфологическое исследование проводили через 5, 30, 90 сут после операции. Через 5 сут было показано присутствие трансплантата в желудочке мозга взрослых мышей (рис. 3). Однако на таком раннем сроке трансплантаты были еще плохо интегрированы в ткань, что приводило к “выпадению” ряда трансплантатов при работе со свободноплавающими срезами. Тем не менее, удалось показать, что пересаженные клетки располагаются именно в боковом желудочке мозга, они не “вымываются” спиномозговой жидкостью, и уже формируют объемный трансплантат, в котором клетки расположены хаотично. ИГХ анализ позволил обнаружить, что на данном сроке клетки трансплантата имеют положительную реакцию к DCX, что указывает на процессы миграции клеток внутри клеточного агрегата.
Рис. 3.
Трансплантат клеток эмбрионального неокортекса мышей (Э14.5) через 5 сут после пересадки в желудочек мозга мыши. Положительная иммуногистохимическая реакция клеток трансплантата к маркеру нейробластов DCX. Трансплантат выделен пунктиром. LV – латеральный желудочек. Масштабный отрезок: 100 мкм.
К 30 сут после операции трансплантаты значительно увеличивались в размере, и мигрирующие DCX+ клетки уже не выявлялись. Несмотря на индивидуальные различия в размерах, трансплантаты уже имели четкую цитоархитектонику. В центральной части трансплантата группировались зрелые нейроны, положительные к маркеру NeuN (рис. 4), в то время как по периферии была определена маргинальная зона без NeuN+ нейронов, подобная первому слою коры мозга. На этом сроке исследования положительные к GFAP астроциты были равномерно распределены по трансплантату (рис. 5). Морфологически было выявлено врастание сосудов в трансплантат.
Рис. 4.
Структура трансплантата из клеток эмбрионального неокортекса мышей (Э14.5) в желудочке мозга реципиента (30 сут). Положительная иммуногистохимическая реакция клеток к маркеру зрелых нейронов NeuN. Плотное скопление клеток в центральной области, на периферии образуется маргинальная зона. Трансплантат выделен пунктиром. LV – латеральный желудочек. Масштабный отрезок: 100 мкм.

Рис. 5.
Структура трансплантата из клеток неокортекса мышей (Э14.5) в желудочке мозга реципиента (30 сут). GFAP+ астроциты распределены равномерно по трансплантату. Трансплантат выделен пунктиром. LV – латеральный желудочек. Масштабный отрезок: 100 мкм.

На 90 сут трансплантаты были хорошо развиты. Положительных к DCX+ нейробластов в них выявлено не было, что свидетельствовало о завершении миграции клеток и процессов дифференцировки. Дифференцированные NeuN+ нейроны распределялись в центральной части трансплантата. Они располагались менее плотно в центре и плотнее на периферии центральной области. По размерам ядер клеток можно предположить, что крупные нейроны, находящиеся на периферии центральной области являются нейронами V–VI слоя коры, которые формируются в первую очередь. На периферии трансплантата была выявлена зона без NeuN+ клеток, соответствующая первому слою коры (рис. 6). Окрашивание на маркер синаптических контактов synaptophysin было достаточно равномерно по ткани трансплантата (рис. 7). Также равномерно по трансплантату были распределены Sox2+ клетки (рис. 8). Распределение астроцитов (GFAP+) имело характерный паттерн: равномерное распределение по трансплантату и формирование зоны пограничной глиальной мембраны (glia limitans) на границе между трансплантатом и желудочком мозга реципиента. Формирования рубца на месте контакта трансплантата и реципиента не выявлялось (рис. 9). Помимо структурной организации, была выявлена обширная васкуляризация трансплантата кровеносными сосудами со стороны мозга реципиента (рис. 10). Одновременно было обнаружено, что в области контакта трансплантата с субвентрикулярной зоной взрослого мозга идет миграция DCX+ клеток, причем вдоль сосудов. Можно предположить, что это недифференцированные нейроны, возникшие из собственных эндогенных стволовых клеток реципиента (рис. 11). Миграции клеток из трансплантата в ткань мозга реципиента не было выявлено ни на одном сроке наблюдения. Наличие цитоархитектоники и отсутствие миграции в ткань мозга реципиента указывает на то, что полученные трансплантаты представляют собой структуры напоминающие органоиды.
Рис. 6.
Структура трансплантата из клеток эмбрионального неокортекса мышей (Э14.5) через 90 сут после пересадки в желудочек мозга мыши. Положительная иммуногистохимическая реакция клеток трансплантата к маркеру зрелых нейронов NeuN. Нейроны занимают центральную область, по периферии образуется маргинальная зона. В трансплантате видны сосуды (отмечены стрелками). Трансплантат выделен пунктиром. LV – латеральный желудочек. Масштабный отрезок: 100 мкм.

Рис. 7.
Трансплантат из клеток эмбрионального неокортекса мышей (Э14.5) в желудочке мозга реципиента через 90 сут после операции. Положительная иммуногистохимическая реакция клеток трансплантата к Synaptophysin (Syp). В ткани четко выражены сосуды (отмечены стрелками). Трансплантат выделен пунктиром. LV – латеральный желудочек. Масштабный отрезок: 100 мкм.

Рис. 8.
Структура трансплантата в желудочке мозга реципиента через 90 суток после операции. Положительная иммуногистохимическая реакция клеток трансплантата к Sox2. Трансплантат выделен пунктиром. LV – латеральный желудочек. Масштабный отрезок: 100 мкм.

Рис. 9.
Трансплантат из клеток эмбрионального неокортекса мышей (Э14.5) через 90 сут после операции в желудочке мозга реципиента. Положительная иммуногистохимическая реакция клеток к маркеру астроцитов GFAP. На границе трансплантата клетки образуют пограничную глиальную мембрану (glia limitans). Между тканями трансплантата и реципиента глиального рубца не образуется. Трансплантат выделен пунктиром. LV – латеральный желудочек. Масштабный отрезок: 100 мкм.

Рис. 10.
Трансплантат из клеток эмбрионального неокортекса мышей (Э14.5) в желудочке мозга реципиента через 90 сут после операции. Васкуляризация трансплантата, выявленная с помощью лектина с флуоресцентной меткой. Сосуды отмечены стрелками. Масштабный отрезок: 40 мкм.
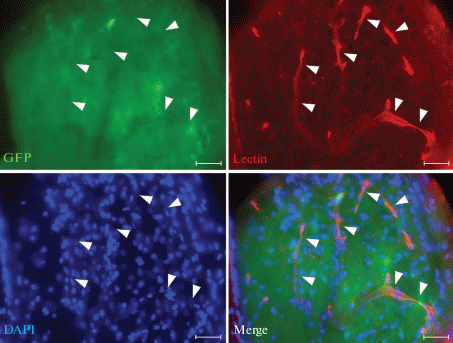
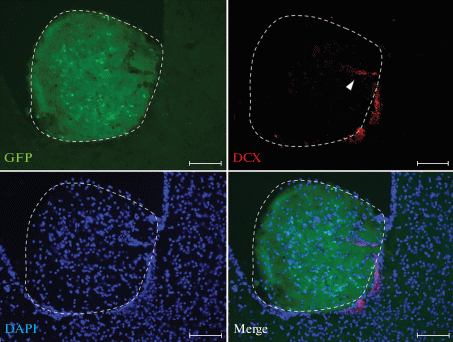
Рис. 11.
Трансплантат из клеток эмбрионального неокортекса мышей (Э14.5) в желудочке мозга реципиента через 90 сут после операции. Миграция DCX+ клеток субвентрикулярной зоны реципиента в трансплантат вдоль врастающих сосудов. Трансплантат выделен пунктиром. LV – латеральный желудочек. Масштабный отрезок: 100 мкм.
ОБСУЖДЕНИЕ
В настоящей работе мы пытались смоделировать адекватные условия для выращивания церебральных 3D агрегатов, используя трансплантацию стволовых и прогениторых клеток эмбрионального неокортекса мышей в латеральные желудочки мозга взрослых мышей, где циркулирует биологически активная спинномозговая жидкость и возможно кровоснабжение со стороны мозга реципиента (Lehtinen et al., 2011; Rahimi, Woehrer, 2017). Следует заметить, что полости боковых желудочков мозга, благодаря их микроокружению, неоднократно использовали для трансплантации разных типов нейральных и ненейральных клеток. Каждая научная группа ставила конкретную задачу в связи с тем, что или клетки плохо растут в паренхиме, или из-за необходимости попадания продуктов синтеза клеток непосредственно в спинномозговую жидкость (Freed et al., 1990; Zheng et al., 2006; Henzi et al., 2018; Barati et al., 2019). В нашу задачу входила отработка модели для изучения самоорганизации и васкуляризации неокортикальных клеток, выделенных из эмбрионального мозга и культивированных в латеральном желудочке взрослых мышей. Для трансплантации были выбраны клетки неокортекса эмбрионов GFP мышей Э14.5, которые находятся на стадии нейроногенеза и, в отличие от некоммитированных эмбриональных и индуцированных плюрипотентных стволовых клеток не могут формировать тератомы (Gutierrez-Aranda et al., 2010). Используя ОТ-ПЦР в реальном времени мы определили состояние дифференцировки клеток в неокортексе эмбрионов стадий Э14.5 и Э19.5. По экспрессии мРНК генов стволовых клеток Pax6, Sox2, Nes; малодифференцированных нейронов Dсx, Tubb3; дифференцированных нейронов NeuN; астроцитов GFAP и синаптофизина Syp (начинает экспрессироваться в недифференцированных нейронах) было показано, что предпочтительнее для трансплантации клетки коры Э14.5. В них высокой уровень экспрессии маркеров стволовых клеток, отсутствуют дифференцированные нейроны и нет глиальных клеток. Результаты ОТ-ПЦР мы подтвердили иммуногистохимическим анализом срезов, где была получена картина распределения разных типов клеток по слоям в неокортексе Э14.5 эмбрионов, что в целом соответствовало ранее проведенными исследованиями (Englund et al., 2005; Hori et al., 2014; Lodato, Arlotta, 2015; Güven et al., 2019). Следующим шагом в разработке технологии получения церебральных 3D агрегатов in vivo была непосредственно трансплантация клеток эмбрионального неокортекса мышей в желудочек мозга взрослых мышей. Выделенные фронтальные отделы неокортекса Э14.5 использовали для приготовления суспензии, в процессе обработки клетки теряли контакты и ошаривались. В результате полученная суспензия состояла из небольших агрегатов и отдельных округлых клеток не имеющих отростков. Нам удалось обнаружить, что уже через 5 сут после операции, в полости латерального желудочка формируется клеточный агрегат, в котором выявляются мигрирующие нейробласты. К 30 сут трансплантат состоял из зрелых нейронов и астроцитов. Нами было установлено, что для успешного развития 3D кортикальных агрегатов в желудочках мозга необходим длительный срок, в нашем эксперименте 90 сут. Согласно данным литературы для развития церебральных органоидов в системе in vitro также требуется длительный срок, около 60 сут (Eiraku et al., 2008; Fan et al., 2019), а при трансплантации стволовых клеток в желудочек мозга молодых крыс, рост трансплантата заканчивается через 60 дней (Pothayee et al., 2018). В нашем эксперименте было установлено, что к 90 сут в клетках 3D церебрального трансплантата экспрессируется маркер зрелых нейронов NeuN+. Цитоархитектоника трансплантата выглядела следующим образом: дифференцированные нейроны располагались только в центральной части трансплантата, на периферии выявлялась зона без клеток, что напоминало маргинальную зону или первый слой неокортекса. Судя по литературным источникам (Pothayee et al., 2018), данный факт ранее не наблюдался в трансплантатах, полученных из кортикальных НСК. На периферии трансплантата формировалась зона пограничной мембраны, которая, как и в нормальном мозге, была сформирована GFAP+ астроцитами. Пограничная мембрана трансплантата во многих местах соприкасалась с эпендимой стенки желудочка, однако, глиального рубца между тканями донора и реципиента не возникало, что констатировали и другие исследователи (Pothayee et al., 2018). Мы наблюдали описанное другими авторами проникновение DCX+ клеток реципиента в ткань трансплантата (Pothayee et al., 2018), но не выявили миграции GFP клеток из трансплантата в ткань реципиента, также описанную этими авторами. В трансплантатах были выявлены клетки, экспрессирующие Sox2. Согласно данным литературы Sox2 обычно считают маркером нервных стволовых клеток, которые распределяются в разных областях эмбрионального и взрослого мозга. Однако, его экспрессия также была описана и в дифференцированных нейронах в различных областях нервной системы (особенно в таламусе, стриатуме, неокортексе) (Ferri et al., 2004). Кроме того, есть данные об экспрессии Sox2 в отдельных астроцитах (Cahoy et al., 2008). Таким образом, обнаруженная нами в некоторых клетках трансплантатов экспрессия Sox2 не может достоверно говорить от том, что в нем присутствуют стволовые клетки, а требует дальнейшего исследования. В нашем исследовании маркер синаптических визикул синаптофизин был выявлен в трансплантате. По данным Pothayee et al. (2018), в подобных трансплантатах наличие зрелых синапсов на клетках выявляется с помощью электронной микроскопии. В дополнение к архитектонической организации 3D церебральных агрегатов, мы также обнаружили их васкуляризацию со стороны мозга реципиента. Мы морфологически выявляли сосуды в 30 суточных трансплантатах, а по данным Потаи (Pothayee et al., 2018) васкуляризация начинается на 6–8 сут. Интересно, что согласно литературным данным, церебральные органоиды, полученные in vitro и трансплантированные в паренхиму мозга грызунов также васкуляризируются (Mansour et al., 2018). Проводя сравнение между нашей работой и работами Потаи и Мансур (Pothayee et al., 2018; Mansour et al., 2018) необходимо обратить внимание на различие задач и результатов. Они изучили кооперацию между подсаженными клетками и мозгом реципиента, взаимный рост волокон, миграцию клеток и васкуляризацию. В то время как мы показали возможность самоорганизации суспензированных клеток неокортекса в 3D структуры, напоминающие кортикальные церебральные органоиды (рис. 12). Использование маркеров для специфических нейронов слоев неокортекса позволит в дальнейшем точнее определить их структуру. Кроме того, эту модель можно использовать для изучения развития клеток человека, при условии работы с иммунодефицитными мышами.
ЗАКЛЮЧЕНИЕ
Исследование церебральных органоидов имеет большое значение для фундаментальной науки и медицины. В настоящей работе представлен альтернативный экспериментальный подход к созданию 3D агрегатов, подобных церебральным органоидам. Использовано культивирование неокортикальных стволовых и малодифференцированных клеток в полостях желудочка мозга экспериментальных животных in vivo без специальных питательных сред, которые заменяются спинномозговой жидкостью. Формирование 3D агрегатов с выраженной цитоархитектоникой происходит в течение 90 дней. Характерной особенностью этих структур является их высокая степень васкуляризации, которая отличает их от органоидов, созданных in vitro. Таким образом, желудочки мозга мыши могут служить инкубатором для развития васкуляризованных трехмерных церебральных структур, напоминающих органоиды.
Список литературы
Barati S., Kashani I.R., Moradi F. et al. Mesenchymal stem cell mediated effects on microglial phenotype in cuprizone-induced demyelination model // Cell. Bio. Chem. 2019. V. 120. № 8. P. 13952–13964.
Cahoy J.D., Emery B., Kaushal A. et al. A transcriptome data base for astrocytes, neurons, and oligodendrocytes: a new resource for understanding brain development and function // J. Neurosci. 2008. V. 28. № 1. P. 264–278.
Eiraku M., Watanabe K., Matsuo-Takasaki M. et al. Self-organized formation of polarized cortical tissues from ESCs and its active manipulation by extrinsic signals // Cell. Stem. Cell. 2008. V. 3. № 5. P. 519–532.
Eiraku M., Takata N., Ishibashi H. et al. Self-organizing optic-cup morphogenesis in three-dimensional culture // 2011. V. 472. № 7341. P. 51–56.
Englund C., Fink A., Lau C. et al. Pax6, Tbr2, and Tbr1 are expressed sequentially by radial glia, intermediate progenitor cells, and postmitotic neurons in developing neocortex // J. Neurosci. 2005. V. 25. № 1. P. 247–251.
Fan W., SunY., Shi Z. et al. Mouse induced pluripotent stem cells derived Alzheimer’s disease cerebral organoid culture and neural differentiation disorders // Neurosci. Lett. 2019. V. 711. № 134433.
Ferri A.L.M., Cavallaro M., Braida D. et al. Sox2 deficiency causes neurodegeneration and impaired neurogenesis in the adult mouse brain // Development. 2004. V. 131. № 15. P. 3805–3819.
Freed W.J., Poltorak M., Becker J.B. Intracerebral adrenal medulla grafts: a review // Exp. Neurol. 1990. V. 110. № 2. P. 139–166.
Gonzalez C., Armijo E., Bravo-Alegria J. et al. Modeling amyloid beta and tau pathology in human cerebral organoids // Mol. Psychiatry. 2018. V. 23. № 12. P. 2363–2374.
Gutierrez-Aranda I., Ramos-Mejia V., Bueno C. et al. Human induced pluripotent stem cells develop teratoma more efficiently and faster than human embryonic stem cells regardless the site of injection // Stem. Cells. 2010. V. 28. № 9. P. 1568–1570.
Güven A., Kalebic N., Long K.R. et al. Extracellular matrix-inducing Sox9 promotes both basal progenitor proliferation and gliogenesis in developing neocortex // eLife. 2020. P. 9. e49808.
Han X., Chen M., Wang F. et al. Forebrain engraftment by human glial progenitor cells enhances synaptic plasticity and learning in adult mice // Cell. Stem. Cell. 2013. V. 12. № 3. P. 342–353.
Hori K., Nagai T., Shan W. et al. Cytoskeletal regulation by AUTS2 in neuronal migration and neuritogenesis // Cell. Rep. 2014. V. 9. № 6. P. 2166–2179.
Henzi R., Guerra M., Vio K. et al. Neurospheres from neural stem/neural progenitor cells (NSPCs) of non-hydrocephalic HTx rats produce neurons, astrocytes and multiciliated ependyma: the cerebrospinal fluid of normal and hydrocephalic rats supports such a differentiation // Cell. Tissue. Res. 2018. V. 373. № 2. P. 421–438.
Koo B., Choi B., Park H. et al. Past, present, and future of brain organoid technology // Mol. Cells. 2019. V. 42. № 9. P. 617–627.
Lancaster M.A., Renner M., Martin C.A. et al. Cerebral organoids model human brain development and microcephaly // Nature. 2013. V. 501. № 7467. P. 373–379.
Lehtinen M.K., Zappaterra M.W., Chen Xi. et al. The cerebrospinal fluid provides a proliferative niche for neural progenitor cells // Neuron. 2011. V. 69. № 5. P. 893–905.
Lodato S., Arlotta P. Generating neuronal diversity in the mammalian cerebral cortex // Annu. Rev. Cell. Dev. Biol. 2015. V. 31. P. 699–720.
Mansour A.A., Gonçalves J.T., Bloyd C.W. et al. An in vivo model of functional and vascularized human brain organoids // Nat. Biotechnol. 2018. V. 36. № 5. P. 432–441.
Mariani J., Simonini M.V., Palejev D. et al. Modeling human cortical development in vitro using induced pluripotent stem cells // Proc. Natl. Acad. Sci. USA. 2012. V. 109. № 31. P. 12770–12775.
Pacitti D., Privolizzi R., Bax B.E. Organs to cells and cells to organoids: The evolution of in vitro central nervous system modelling // Front. Cell. Neurosci. 2019. Apr. 9. V. 13. № 129.
Pothayee N., Maric D., Sharer K. et al. Neural precursor cells form integrated brain-like tissue when implanted into rat cerebrospinal fluid // Commun. Biol. 2018. V. 1. № 114.
Qian X., Song H., Ming G.L. Brain organoids: advances, applications and challenges // Development. 2019. V. 146. № 8. pii: dev166074.
Rahimi J., Woehrer A. Overview of cerebrospinal fluid cytology // Handb. Clin. Neurol. 2017. V. 145. P. 563–571.
Sukhinich K.K., Aleksandrova M.A. Cerebral organoids: A model of brain development // Russian J. Developmental Biology. 2020. V. 51. P. 231–245.
Todd G.K., Boosalis C.A., Burzycki A.A. et al. Towards neuronal organoids: a method for long-term culturing of high density hippocampal neurons // PLoS One. 2013. V. 8. № 4. P. e58996.
Watanabe K., Kamiya D., Nishiyama A. et al. Directed differentiation of telencephalic precursors from embryonic stem cells // Nat. Neurosci. 2005. V. 8. № 3. P. 288–296.
Zheng T., Marshall G.P. 2nd, Laywell E.D., Steindler D.A. Neurogenic astrocytes transplanted into the adult mouse lateral ventricle contribute to olfactory neurogenesis, and reveal a novel intrinsic subependymal neuron // Neuroscience. 2006. V. 142. № 1. P. 175–185.
Дополнительные материалы отсутствуют.



