Онтогенез, 2021, T. 52, № 4, стр. 260-286
Молекулярные стратегии трансдифференцировки клеток ретинального пигментного эпителия у амфибий и млекопитающих in vivo
Э. Н. Григорян a, *, Ю. В. Маркитантова a, **
a Институт биологии развития им. Н.К. Кольцова РАН
119334 Москва, ул. Вавилова, 26, Россия
* E-mail: leonore@mail.ru
** E-mail: yuliya.mark@gmail.com
Поступила в редакцию 08.03.2021
После доработки 28.03.2021
Принята к публикации 31.03.2021
Аннотация
Ретинальный пигментный эпителий (РПЭ) является клеточным источником регенерации сетчатки у амфибий in vivo и развития заболеваний сетчатки у млекопитающих и человека. В основе обоих процессов лежит трансдифференцировка клеток РПЭ – превращение в клетки иных фенотипов: в первом случае нейральные, во втором – мезенхимные. В обзоре описаны основные этапы трансдифференцировки клеток РПЭ: инициация процесса, миграция и пролиферация клеток, дедифференцировка, репрограммирование и специализация клеток в новых направлениях. Приведена информация о молекулярно-генетических механизмах, обеспечивающих прохождение клетками этих этапов. Представлены молекулярные участники регуляции трансдифференцировки со стороны целого организма, локального клеточного микроокружения (ростовых факторов, сигнальных каскадов), экспрессии транскрипционных факторов, а также регуляции со стороны эпигенома. Отмечены сходства и отличия в молекулярно-генетических механизмах реализации различающихся стратегий трансдифференцировки РПЭ у амфибий и млекопитающих. Обнаружение молекулярных ключевых участников этого выбора служит как развитию теории клеточного репрограммирования, так и разработке подходов для лечения пролиферативных заболеваний сетчатки человека, ассоциированных с патологиями РПЭ.
СПИСОК СОКРАЩЕНИЙ
РПЭ – ретинальный пигментный эпителий
НС – нейральная сетчатка
ТФ – транскрипционный фактор
ЭМП – эпителиально-мезенхимный переход
ЭМ – эпиретинальная мембрана
ПВР – пролиферативная витреоретинопатия
ВКМ – внеклеточный матрикс
ПЦР – полимеразная цепная реакция
ВВЕДЕНИЕ
В нормальных, не патологических для тканей организма условиях, клетки взрослых позвоночных сохраняют стабильность дифференцировки. Изменение клеточной идентичности означало бы невозможность для ткани сохранять свою целостность и должным образом функционировать в составе организма. Стабильность дифференцировки достигается посредством эпигенетической регуляции в совокупности с экспрессией транскрипционных факторов (ТФ). И то, и другое, в свою очередь, диктуется клеточным микроокружением и общеорганизменными регуляторными факторами (Holliday, 2006; Григорян, 2018; Basinski et al., 2021). Противоположными состоянию стабильности являются де- и трансдифференцировка клеток, широко исследуемые со времени открытия Дж. Гордоном (Gurdon, 1962) превращения дифференцированных зрелых клеток кишечного эпителия головастиков в клетки со свойствами оплодотворенных ооцитов при трансплантации ядер. Пристальный интерес к изменениям клеточной идентичности у позвоночных в течение полувека привел к накоплению данных, свидетельствующих о том, что подобное происходит в направленных лабораторных экспериментах, при патологии и болезнях, а также при регенерации (см. обзоры: Jopling et al., 2011; Merell, Stanger, 2016). У взрослых рыб и амфибий процессы клеточных де- и трансдифференцировки лежат в основе регенерации утраченных или поврежденных тканей и органов (Alvarado, Tsonis, 2006; Jobling et al., 2010).
Ярчайшими, ставшими классическими, примерами регенерации посредством трансдифференцировки является восстановление сетчатки и хрусталика из клеток пигментированных эпителиев глаза Urodela (Okada, 1980, 1991; Eguchi, 1986). Эти модели на протяжении многих лет многосторонне исследовались. Основными этапами были: изучение клеточного поведения, морфологии клеток, динамики пролиферации, изменений общих и специфических синтезов, изменений микроокружения и молекул надклеточной и внутриклеточной регуляции процесса, и наконец, исследования молекулярно-генетического паттерна экспрессии генов. Причиной столь масштабных исследований было стремление максимально раскрыть внутри- и внеклеточные механизмы, лежащие в основе тканевой и органной регенерации у позвоночных животных. Понимание трансдифференцировки на клеточном и молекулярном уровнях приближало разработку способов лечения заболеваний, при которых конверсия клеточного типа играет ключевую роль, а также формировало основу для биотехнологического воспроизводства условий, стимулирующих регенерацию тканей глаза у млекопитающих и человека.
В лабораториях ИБР РАН, благодаря профессорам О.Г. Строевой и В.И. Миташову, создавшим и обогатившим направление исследований развития и регенерации тканей глаза в норме и патологии, особое внимание уделялось модели регенерации сетчатки за счет клеток ретинального пигментного эпителия (РПЭ) у Urodela (Stroeva, Mitashov, 1983; Mitashov, 1996, 1997). Параллельно в мире изучался вопрос пролиферативных заболеваний и эпителиально-мезенхимного перехода (ЭМП) клеток РПЭ сетчатки глаза млекопитающих и человека. В частности, изучались молекулярные механизмы процессов пролиферации и конверсии клеток РПЭ в мезенхимном направлении, приводящие к развитию пролиферативной витреоретинопатии (ПВР, PVR) (Morescalchi et al., 2013; Idrees et al., 2019; Zou et al., 2020), а также таких заболеваний как пролиферативная диабетическая ретинопатия (Abu El-Rasral, 2013) и субретинальный фиброз (Lopez et al., 1996).
В статье обобщен ряд ключевых, полученных ранее, и современных сведений, раскрывающих явление трансдифференцировки на примере конверсии клеток РПЭ глаза у амфибий и млекопитающих. Две различающиеся стратегии изменений дифференцировки РПЭ – в нейральном направлении у амфибий и мезенхимном у млекопитающих – находятся под многоуровневым регуляторным контролем, коротко освещенном в данном обзоре. Обсуждаются вопросы времени и условий выбора клетками РПЭ разных молекулярных стратегий для конверсии в разных направлениях. Внимание уделено вопросу генетического и эпигенетического состояний клеток РПЭ на ключевом этапе трансдифференцировки – при входе клеток в пролиферативный цикл и фазу репрограммирования генома.
РЕТИНАЛЬНЫЙ ПИГМЕНТНЫЙ ЭПИТЕЛИЙ ПОЗВОНОЧНЫХ ЖИВОТНЫХ
РПЭ взрослых позвоночных является высокоспециализированной тканью – эпителиальным монослоем пигментированных, поляризованных клеток, с характерными и общими для всех изученных позвоночных чертами. РПЭ расположен между нейральной сетчаткой (НС) и ее васкулярным слоем, снабжающим НС необходимыми веществами и кислородом (Панова, 1993; Strauss, 2005; Fuhrmann, 2014) (рис. 1a). Помимо переноса веществ по базально-апикальному градиенту клеток, РПЭ выполняет ряд важных функций, производя факторы и сигнальные молекулы, поддерживающие гомеостаз и нормальное функционирование сетчатки (Strauss, 2005; Sparrow et al., 2010). При этом основной функцией РПЭ является фагоцитоз слущивающихся наружных сегментов фоторецепторов НС, а затем их переваривание с помощью лизосом. Это позволяет фоторецепторам синтезировать новые отростки для световосприятия, обеспечивает жизнеспособность клеток и метаболизм ретиноидов. До сих пор, несмотря на определенную гетерогенность клеточной популяции РПЭ, нет сведений о наличии в нативном его слое in situ стволовых или прогениторных клеток (Burke et al., 1996; Burke, Hjelmeland, 2005; Strauss, 2005).
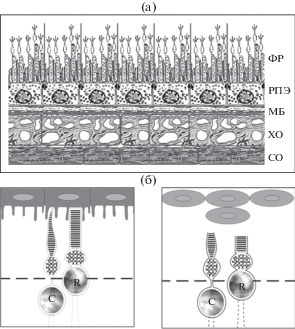
Рис. 1.
Схематическое изображение ретинального пигментного эпителия во взаимодействии с окружающими тканями задней стенки глаза позвоночных животных. (a) – нормальный глаз. ФР – фоторецепторы, РПЭ – ретинальный пигментный эпителий; МБ – мембрана Бруха; ХО – хороидальная оболочка: СО – склеральная оболочка. (б) – разобщение ретинального пигментного эпителия с фоторецепторными клетками сетчатки (справа) по сравнению с нормальным состоянием (слева). С – колбочки (cones); R – палочки (rods).
ДЕ- И ТРАНСДИФФЕРЕНЦИРОВКА КЛЕТОК РПЭ, ОПРЕДЕЛЕНИЕ КЛЕТОЧНОЙ ИДЕНТИЧНОСТИ
Термин дедифференцировка предполагает возврат дифференцированной клетки в состояние с бóльшим потенциалом развития, близким таковому у стволовых и прогениторных клеток. Наиболее ярким примером является получение индуцированных плюрипотентных клеток (ИПСК) из культивируемых эмбриональных и зрелых фибро-бластов мыши in vitro посредством создания условий для сверхэкспрессии в них ряда ТФ: Oct4, Sox2, Klf4 и c-myc (OSKM) (Takahashi, Yamanaka, 2006). Среди других, менее известных примеров, выявлен ТФ MyoD, экспрессия которого после трансфекции гена, способствует превращению клеток РПЭ, а также фибробластов и хондроцитов в мышечные клетки in vitro (Davis et al., 1987; Tapscott et al., 1987; Weintraub et al., 1989; Tapscott, Weintraub, 1991). In vivo явление дедифференцировки показано для различных тканей амфибий, а также высших позвоночных после повреждения и в условиях патологии (Szibor et al., 2014; Yao, Wang, 2020).
“Трансдифференцировка” – термин, вошедший в научный обиход в 60–70-х годах прошлого столетия (Weissenfels, Hundgen, 1968; Okada, 1975; Eguchi, 1979). Исходно он отражал превращение полностью дифференцированного клеточного типа в иной, также дифференцированный тип, минуя промежуточный этап – дедифференцировку (Mills et al., 2019). Позже термин “трансдифференцировка” утвердился как подразумевающий по умолчанию наличие промежуточного состояния, необходимого для потери клетками исходных фенотипических черт, пролиферации и возникновения черт другого клеточного типа (Okada, 1980). Трансдифференцировка является глубокой реорганизацией клетки на всех уровнях – от транскрипционного до морфогенетического (при формировании de novo ткани из претерпевших конверсию клеток). В этой связи внеклеточные сигналы, регулирующие процесс трансдифференцировки, должны работать координировано, носить четкий пространственно-временной характер. Многие из регулирующих факторов известны (см. ниже), однако, картина их динамической сети in vivo еще далека до полной. В настоящее время предполагается, что работа ТФ и регулируемый эпигенетический ландшафт, способные активировать или подавлять ту или иную программу экспрессии генов, лежат в центре событий трансдифференцировки (Powell, 2013; Merell, Stanger, 2018; Grigoryan, 2020; Vanden Bosch, Reh, 2020).
Таким образом, при трансдифференцировке имеет место смена “клеточной идентичности” (“cell identity”), определяемой в разное время с разной степенью точности. Традиционно специфические клеточные типы определяли, используя морфологические критерии. Позже выяснилось, что этого недостаточно: невидимая морфологически, но присутствующая на других уровнях изучения гетерогенность, как исходной ткани, так и формирующейся в ходе трансдифференцировки, требовала уточнений. В нативном РПЭ выявлены региональные отличия в экспрессии структурных молекул (Schmidt, Peisch, 1986; Burke et al., 1996; Burke, Hjelmeland, 2005; Durairaj et al., 2012) и в способности к пролиферации в слое (Строева, 1971; Al-Hussaini et al., 2008; Григорян, 2015). При ЭМП клетки РПЭ млекопитающих тоже имеют отличия по степени проявления мезенхимного фенотипа как in vitro, так и в ходе ПВР и других пролиферативных заболеваний сетчатки (Chtcheglova et al., 2020). Важным этапом стало применение иммунохимических и молекулярных методов, способных выявить локализацию и уровень экспрессии генов, отвечающих за синтез структурных белков, ТФ и сигнальных молекул. В последнее время стало возможным изучение геномов и транскриптомов представителей Urodela-объектов исследования трансдифференцировки (Bruckskotten et al., 2012; Nakamura et al., 2014; Nowoshilow et al., 2018; Biscotti et al., 2020); получило развитие изучение эпигенома клеток глаза позвоночных (Aldiri et al., 2017; Corso-Diaz et al., 2018; Dvorianchikova et al., 2019). Арсенал современных подходов и методов отсутствовал на этапе морфологических исследований трансдифференцировки, однако, именно тогда О.Г. Строевой и В.И. Миташовым в основу направления работы было заложено представление о “переключении работы генов”, как основополагающем событии конверсии клеточного типа (Строева, Миташов, 1970; Stroeva, Mitashov, 1981). Это позволило со временем вывести решение проблемы трансдифференцировки на уровень изучения ее молекулярных механизмов и регуляции in vivo.
ТРАНСДИФФЕРЕНЦИРОВКА КЛЕТОК РПЭ У ВЗРОСЛЫХ АМФИБИЙ И МЛЕКОПИТАЮЩИХ IN VIVO
РПЭ хвостатых амфибий (Urodela) обладает способностью к регенерации сетчатки и дает яркий пример естественной конверсии в ретинальные клетки in vivo. После повреждений глаза (отслойки сетчатки, ее удаления, перерезки зрительного нерва) РПЭ становится источником воспроизводства новой сетчатки (Stone, 1950; Hasegawa, 1958; Keefe, 1973; Stroeva, Mitashov, 1983; Mitashov, 1996, 1997; Chiba, Mitashov, 2007; Yasumuro et al., 2017) (рис. 2а). Основными событиями процесса трансдифференцировки являются: выход клеток из слоя РПЭ, потеря исходных черт и свойств (дедифференцировка), амплификация, формирование промежуточной популяции пролиферирующих нейробластов, выход их из цикла репродукции и дифференцировка ретинальных клеточных типов. Потенции клеток РПЭ в качестве клеток-источников для восстановления сетчатки обнаружены и у взрослых бесхвостых амфибий, лягушек X. laevis (Свистунов, Миташов, 1983). Позже показано, что при сохранении ограничивающей внутренний край сетчатки васкулярной мембраны в ходе удаления исходной сетчатки, клетки РПЭ покидают слой, мигрируют, осев на мембране пролиферируют и формируют регенерат так же, как это происходит у Urodela (Yoshii et al., 2007; Araki et al., 2007).
Рис. 2.
Последовательные стадии регенерации сетчатки у амфибий (а) и развития пролиферативной ретинопатии у млекопитающих (б). НС – нейральная сетчатка; РПЭ – ретинальный пигментный эпителий; КлРПЭ – трансдифференцирующиеся клетки РПЭ; РС – регенерат сетчатки; ЭМП – эпителиомезенхимный переход; ЭМ – эпиретинальная мембрана.

У человека, как и у амфибий, в ответ на повреждение сетчатки клетки РПЭ теряют свои эпителиальные характеристики, вымещаются из слоя, мигрируют и пролиферируют, трансдифференцируясь при этом в мезенхимные клетки, подобные миофибробластам; при движении за пределы сетчатки они избегают клеточной гибели и синтезируют компоненты ВКМ, участвуя в формировании эпиретинальной мембраны (ЭМ) (рис. 2б) (Kirchhof, Sorgente, 1989; Abe et al., 1998; Tamiya et al., 2010; Wu et al., 2018). Образование ЭМ в ответ на повреждение НС (чаще разрыв и отслойку) приводит к сокращению ЭМ вместе с НС, что вызывает снижение зрения. Описаны этапы процесса и их регуляция (Garweg et al., 2013; Tamiya, Kaplan, 2016; Zou et al., 2020). ЭМП клеток РПЭ млекопитающих может иметь место не только при патологиях (заболеваниях) глаза, но и в процессе восстановления слоя, например, после воздействия лазером (Han et al., 2015). Превращения клеток РПЭ млекопитающих in vivo при ЭМП подпадает под определение “трансдифференцировка”, хотя встречаются и другие определения, например, “дисфункция РПЭ” (Zhou et al., 2020).
Большая информация, свидетельствующая о возможности трансдифференцировки клеток РПЭ млекопитающих и человека накоплена в результате экспериментов in vitro. Исследования свидетельствуют о проявлении клетками РПЭ свойств мультипотентных. РПЭ взрослых грызунов (Engelgardt et al., 2005) и человека (Милюшина и др., 2009; Milyushina et al., 2011, 2012; Li et al., 2019) в условиях in vitro в присутствии морфогенов и факторов роста демонстрирует пролиферацию, дедифференцировку и в некоторых случаях продукцию нейронов. На стадии дедифференцировки клетки РПЭ человека приобретают черты нейроэпителиальных клеток, экспрессируют гены OCT4, NANOG, KLF4, OTX2, PAX6 и NESTIN (Милюшина и др., 2009, 2011, 2012; Кузнецова и др., 2014). В работе Салеро и др. (Salero et al., 2012) показано, что клетки РПЭ человека in vitro способны не только к воспроизводству своего фенотипа и производству нейронов, но и клеток c признаками мезенхимных (адипо-, остео- и хондрогенной) дифференцировок. На линии клеток РПЭ человека ARPE-19 показано, что сигнальный путь Wnt является одним из регуляторов ЭМП (Chen et al., 2012). Все это позволило пересмотреть существовавший взгляд на то, что конверсия РПЭ может происходить только в пределах “возможностей глазного зачатка”, а именно в эктодермальном направлении. Все эти данные свидетельствует о заложенной в РПЭ двойной компетенции. Молекулярные изменения в клетках культивированного РПЭ млекопитающих имеют сходство с событиями, происходящими в РПЭ амфибий при регенерации сетчатки in vivo (Engelhardt et al., 2005; Milyushina et al., 2012). Это указывает на консервативную молекулярно-генетическую природу механизмов трансдифференцировки РПЭ у низших и высших позвоночных.
ИНИЦИАЦИЯ ПРОЦЕССА КЛЕТОЧНОЙ КОНВЕРСИИ В РПЭ АМФИБИЙ И МЛЕКОПИТАЮЩИХ
Вопросы инициации конверсии клеток РПЭ у амфибий и у млекопитающих были подробно рассмотрены для определения сходства и отличий клеточных событий (обзоры: Grigoryan, 2012; Chiba, 2014). Установлено, что триггером трансдифференцировки является разобщение НС и РПЭ, в частности разрушение интерфоторецепторного матрикса (IPM), обеспечивающего взаимодействие между двумя тканями сетчатки и их жизнеспособность (Lazarus, Hagemann, 1992; Панова, 1994; Uehara et al., 2001) (рис. 1б). Дезинтеграция является триггером событий, суммированных в общем виде в табл. 1. Ранние события после разобщения НС и РПЭ у позвоночных связаны с нарушениями редокс-гомеостаза, развитием окислительного стресса, запускающими в клетках воспалительную реакцию и иммунный ответ (Маркитантова, Симирский, 2020). На самых начальных этапах превращений клеток РПЭ существует большое сходство вне зависимости от того, что стало причиной разобщения РПЭ с НС, и какую стратегию клетки РПЭ выберут в дальнейшем – стать нейронами при регенерации НС у амфибий или приобрести мезенхимную дифференцировку при ЭМП у млекопитающих. В обоих случаях наблюдается дезинтеграция клеток в слое РПЭ, нарушение в системе контактов и межклеточных взаимодействий, изменения во взаимодействиях с подлежащими тканями, приобретение способности к миграции (обзоры: Grigoryan, 2012; Chiba, 2014). Имеют место реорганизация цитоскелета и композиции ВКМ на фоне изменений со стороны циркулирующей крови и иммунной системы. Все эти изменения, приводят к дестабилизации фенотипа РПЭ, фенотипической трансформации при выходе из слоя и миграции клеток. Параллельно происходит down-регуляция экспрессии молекул – компонентов зрительного цикла (Rattner et al., 2008; Garcia-Ramirez et al., 2009) и экспрессии белков специфичных для РПЭ (Chiba et al., 2006; Авдонин и др., 2008). В то же время имеет место up-регуляция экспрессии белков теплового шока (HSPs) (Faktorovich et al., 1992; Geller et al., 2001), ряда ростовых факторов (PEDF, VEGF, FGF, CNTF, IGF, TGF) и компонентов их сигнальных путей (обзор: Strauss, 2005; Abu El-Asrar et al., 2007; Chen et al., 2015; Farjood, Vargis, 2017). Увеличивается экспрессия проапоптотических ферментов и генов быстрого реагирования на стресс (“immediate early response genes” и AP-1 complex) (Kaneko et al., 1999; Reme et al., 2003; Geller et al., 2001). Все связанные с разобщением РПЭ и НС события, и у амфибий, и у млекопитающих, можно расценивать как универсальные ответы на клеточный стресс (Rattner et al., 2008; Grigoryan, 2012). Тем не менее, помимо сходства и универсальности ранних клеточных реакций, участия сигнальных путей, действие которых направленно на защиту клетки от стресса, существуют эволюционно закрепленные функциональные особенности в стратегиях поведения клеток РПЭ у хвостатых амфибий и млекопитающих (Маркитантова, Симирский, 2020).
Таблица 1.
Сходство основных событий и их клеточных и молекулярных последствий при нарушении связи клеток ретинального пигментного эпителия и нейральной сетчатки
| Основные события при нарушении связи РПЭ и НС | Клеточные и молекулярные последствия инициации трансдифференцировки РПЭ in vivo у амфибий | Клеточные и молекулярные последствия инициации трансдифференцировки РПЭ при отслойке сетчатки у человека |
|---|---|---|
| Разрушение связи апикальных отростков РПЭ и фоторецепторов | Разрушение ИФМ, ослабление и потеря контактов между клетками РПЭ и связи с мембраной Бруха, выход клеток из слоя, потеря эпителиальной морфологии, вход в S-фазу клеточного цикла | Разрушение ИФМ, ослабление и потеря контактов между клетками РПЭ и связи с мембраной Бруха, выход клеток из слоя, потеря эпителиальной морфологии, вход в S-фазу клеточного цикла |
| Нарушение зрительного цикла, апоптоз части клеток в РПЭ и НС | Прекращение синтеза меланина, down-регуляция белков зрительного цикла и специфических белков РПЭ | Прекращение синтеза меланина, down-регуляция белков зрительного цикла и специфических белков РПЭ |
| Изменения в кровеносной и иммунной системах в задней стенке глаза | Активация фибринолитических компонентов крови (TF, thrombin) и системы комплемента (С3, С5) | Активация фибринолитических компонентов крови (tPA), белков и клеток воспаления |
| Активация ростовых факторов и сигнальных путей | FGF2, IGF1, TGFβ, MEK-ERK | PEDF, VEGF, FGF1,2, CNTF, BDNF, IGF1, TGFβ, MAPK-ERK |
| Up-регуляция экспрессии HSPs и генов раннего реагирования (immediate-early response genes) | HSPs 70, 90; c-Myc | HSPs, c-Fos, c-Jun, AP1-complex |
| Ремоделирование внеклеточного матрикса и цитоскелета РПЭ | Участие фибронектина, ламинина, тенасцина и N-CAM. Ингибирование цитокератинов и начало экспрессии белков нейрофиламентов (NF-200) | Участие ламинина и интегринов. Изменение композиции кадгеринов, цитокератинов, виментина и GFAP. Инициация экспрессии белков гладкомышечного актина (α-SMA) |
ИЗМЕНЕНИЯ ЦИТОСКЕЛЕТА, КОНТАКТОВ И КОМПОНЕНТОВ ВКМ В ХОДЕ ТРАНСДИФФЕРЕНЦИРОВКИ КЛЕТОК РПЭ АМФИБИЙ И МЛЕКОПИТАЮЩИХ
Цитоскелет клеток РПЭ является отражением его эпителиальной и функциональной специализации, а также фенотипической пластичности. Мы исследовали состояние цитоскелета клеток РПЭ тритона Pl. waltlii в норме и в начале конверсии. Индукция к репрограммированию РПЭ путем изоляции НС (удаление, отслойка) приводила к ингибированию экспрессии цитокератинов в клетках, находящихся еще в слое РПЭ (Григорян, 1995; Григорян, Антон, 1995). То же наблюдалось при изоляции и диссоциации клеток РПЭ тритона, что было вызвано меняющимися условиями: потерей контактов клеток друг с другом, выстилающей РПЭ мембраной Бруха и фоторецепторами НС, т.е. с утерей трехмерного окружения. В то же время, в первых, выселяющихся из слоя и меняющих фенотип клетках РПЭ, инициировалась экспрессия пан-нейрального белка NF-200, при наличии в цитоплазме пигментных гранул (Григорян, Антон, 1993). В ходе развития популяции нейробластов (клеток потомков РПЭ) ее дифференцировки и морфогенеза белки NF-200 накапливались. Данные свидетельствуют о том, что замещение специфических белков цитоскелета РПЭ (цитокератинов на пан-нейральные белки) входит в программу трансдифференцировки. Высокая скорость переключения на считывание с генов, кодирующих белки NF-200, свидетельствует о лабильном состоянии системы регуляции экспрессии генов. Вопрос молекулярных изменений в системе клеточных контактов, мало изучен. Предварительные данные о локализации белков ZO (zonula occludens), ассоциированных с плотными контактами РПЭ, показали увеличение экспрессии ZO-1 и перераспределение по клеточным поверхностям РПЭ. По мере дальнейшей миграции и дедифференцировки клеток РПЭ экспрессия белка ZO-1 снижалась, что вызвано полной утерей контактов и контактного ингибирования в слое РПЭ (Николаев, 2018). В стабилизации и пластичности клеточной дифференцировки существенную роль играет ВКМ (Hausman, 2007; Bonnans et al., 2014). Нами отмечены динамические изменения в локализации и экспрессии фибронектина (FN) в случае микрохирургической отслойки сетчатки у тритона. На 10-е сут иммунореакция FN-антигенов на обработку антителами снижалась на базальной поверхности, но усиливалась на латеральных поверхностях клеток РПЭ, входящих в это время в фазу пролиферации (Григорян и др., 1990). Те же закономерности в норме и процессе конверсии РПЭ тритона отмечены позже Ортизом и соавторами (Ortiz et al., 1992). Поскольку FN-адгезионный компонент мембраны Бруха и способствует прикреплению клеток РПЭ, снижение его содержания при конверсии можно рассматривать как явление, способствующее выходу клеток из слоя. На роль регуляторов трансдифференцировки РПЭ претендуют и другие компоненты ВКМ и базальных мембран: тенасцин и N-CAM, также меняющие свою экспрессию в процессе конверсии РПЭ тритона (Mitashov et al., 1995). На раннем этапе трансдифференцировки РПЭ тритона, обнаружена ядерная транслокация бета-катенина (β-catenin) одновременно со снижением иммунореактивности N-Сad (N-кадгерина), что служит входу клеток в S-фазу (Yasumuro et al., 2017).
Состояние межклеточных контактов и ВКМ во многом определяют судьбу клеток РПЭ при пролиферативных заболеваниях сетчатки млекопитающих (Hiscott et al., 1999). Существенная роль в конверсии клеток РПЭ при ПВР принадлежит полипептиду ZO-1 и Е-Cad (Е-кадгерину), присутствующему в сайтах межклеточной адгезии. Белки обоих типов участвуют в формировании плотных контактов и адгезии, необходимых для сохранения эпителиальной дифференцировки и функции РПЭ (Stevenson et al., 1986; Lee et al., 2007). Внутриклеточным белком-маркером эпителио-мезенхимной дифференцировки, прежде всего, является сократительный белок α-SMA (гладкомышечный актин альфа), обеспечивающий клеточную подвижность РПЭ. Кроме того, присутствует виментин (Vim), играющий важную роль в стабилизации структуры мигрирующих клеток. Продуцируемый клетками FN является маркерным белком фиброза при формировании ЭМ, необходимым для депонирования микрофибрилл (Lee et al., 2007; Zou et al., 2020). В результате перестройки межклеточных контактов, подвергающийся ЭМП РПЭ приобретает мезенхимоподобный фенотип, характеризующийся усиленной экспрессией белков цитоскелета (Vim, a-SMA), повышенным отложением белков ВКМ, включая коллаген и фибронектин (Imamichi, Menke, 2007). В процессе ЭМП в РПЭ in vivo происходит снижение экспрессии десмоплакина, белков промежуточных филаментов и других компонентов участвующих в формировании десмосом. Процесс сопровождается также сменой паттерна экспрессии цитокератинов, свойственных нативному РПЭ (цитокератины 8 и 18) (Sheridan et al., 2005), заменяются цитокератинами 7 и 19, усиливается экспрессия коллагена I типа и FN (Philp, Nachmias, 1987; Kigasawa et al., 1998). Фенотипические изменения РПЭ при ЭМП и миграции включают снижение экспрессии эпителиальных маркеров ZO-1 и E-Cad, и увеличение экспрессии мезенхимных маркеров – α-SMA, Vim, и FN (Lee et al., 2007). Для мыши показано увеличение активности ТФ ZONAB и снижение ZO-1 при изменении фенотипа РПЭ от пигментированного эпителиального к фибробластоподобному (Georgiadis et al., 2010).
ПРОЛИФЕРАЦИЯ, КАК СОСТАВЛЯЮЩАЯ ПРОЦЕССА КОНВЕРСИИ КЛЕТОК РПЭ У АМФИБИЙ И МЛЕКОПИТАЮЩИХ
В изучении пролиферативных процессов в РПЭ в развитии глаза и при клеточной конверсии большой вклад внесен О.Г. Строевой и В.И. Миташовым (Строева, 1962; Stroeva, Mitashov, 1983; Миташов, 1969а, 1969б, 1970, 1974). С помощью импульсного мечения 3Н-тимидином у тритонов T. vulgaris в нативном РПЭ удалось выявить до 3% синтезирующих ДНК клеток (Григорян, Миташов, 1979). Позже при использовании метода долговременной доставки аналога тимидина – бромдезоксиуридина (BrdU), а также при многократном введении 3Н-тимидина, наличие в РПЭ тритонов редких клеток в фазе синтеза ДНК подтвердилось (Новикова и др., 2008). Пролиферация клеток нативного РПЭ характеризовалась длинным S-периодом и крайне редкими митозами. Есть данные, свидетельствующие о присутствии пролиферирующих клеток в РПЭ млекопитающих (Al-Hussaini et al., 2008; Stern, Temple, 2015). Отмечено, что медленно пролиферирующие клетки в слое РПЭ позвоночных в норме и при повреждении локализованы на периферии – области наиболее позднего созревания этой ткани (Строева, 1971; Синицина, 1971; Миташов, 1974; Kiilgaard et al., 2007). У тритона пролиферация в РПЭ инициируется на первой неделе после разобщения его с клетками НС, затем возрастает и в течение 2 нед. держится на высоком уровне. Параллельным событием является прекращение синтеза меланина и все более углубляющаяся дедифференцировка (Григорян, Миташов, 1979). В ходе амплификации для клеток РПЭ показаны уменьшение времени клеточного цикла и изменения его параметров: сокращение G1 и увеличение S-фазы (Миташов, 1969б; Stroeva, Mitashov, 1983). Выяснено также, что у тритона для проявления первых черт специализации в регенерате сетчатки клеткам нужно пройти 6–7 делений, что свидетельствует о необходимости накопления определенной численности клеток в бластеме сетчатки для окончательного приобретения клетками новых черт – нейрональной и глиальной дифференцировок (Миташов, 1970; Mitashov, 1980). Позже сделаны попытки выявления молекулярного механизма входа клеток РПЭ в S-фазу клеточного цикла, вызванного разобщением РПЭ и НС (Mizuno et al., 2012; Yoshikawa et al., 2012; Yasumuro et al., 2017). Мизуно и соавторы исследовали активацию MEK–ERK-каскада в РПЭ in vivo после удаления НС (Mizuno et al., 2012). Активация сигнального пути была выявлена через 30 мин после ретинэктомии. Изменения активности пути MEK–ERK изучали при кратковременном культивирования РПЭ в составе задней стенки глаза тритона (Yoshikawa et al., 2012). Отмечены основные составляющие этого события: высвобождение клеток РПЭ из-под влияния контактного ингибирования, MEK–ERK, гепарин-зависимый сигнальный путь. По мнению авторов, активация MEK–ERK происходит за счет up-регуляции сигнального пути по механизму положительной обратной связи. Данные свидетельствуют о том, что клетки РПЭ тритона обладают механизмом быстрого запуска индуцирующего пролиферацию сигнального каскада и о поддержании его в активированной форме еще в течение 7–10 дней (Mizuno et al., 2012; Yoshikawa et al., 2012).
Вопрос пролиферативной активности РПЭ млекопитающих и человека подробно рассмотрен в обзоре (Stern, Temple, 2015). Раннее созревание и стабилизация дифференцировки РПЭ, а также численности популяции в норме in vivo определяют возможность крайне редких митотических делений (Строева, 1961). Однако ситуация меняется если дифференцировка РПЭ дестабилизирована разобщением с НС, при патологиях, а также в условиях in vitro в результате воздействий со стороны вносимых в среду ростовых факторов. У человека, как указано выше, индукция пролиферации in vivo чаще всего сопровождается ЭМП и возникновением мезенхимных клеток (Casaroli-Marano et al., 1999; Tamiya et al., 2010). В ряде других случаев, таких, например при возраст-зависимой макулярной дегенерации, пролиферация – нечастое событие и не приводит к восполнению слоя РПЭ после гибели части его клеток (Stern, Temple, 2015).
Пролиферативная активность РПЭ млекопитающих и человека изучалась in vitro (Flood et al., 1980; Stern, Temple, 2015). Отмечено, что активный рост РПЭ in vitro чаще всего приводит к появлению клеток, различающейся морфологии в спектре от эпителиальных до фибробластоподобных (Tamiya et al., 2010; Милюшина и др., 2011). Пролиферация сопровождает и проявление более широких, свойственных стволовым клеткам потенций РПЭ, в определенных условиях in vitro оказывающихся способными входить в клеточный цикл и продуцировать клетки как нейрональной, так и мезенхимной линий (Salero et al., 2012). В настоящее время разработаны условия in vitro, позволяющие избежать ЭМП и нарабатывать большую численность клеток, имеющих фенотип, близкий к исходному. Исследования их свойств на уровне транскриптома выявляют экспрессию маркеров поверхности и функционирования, близкие таковым нативных клеток РПЭ (Hu, Bok, 2001; Blenkinsop et al., 2013, 2015). При изучении механизма входа клеток РПЭ человека в фазу синтеза ДНК in vitro установлено, что, как и в случае инициации пролиферации клеток РПЭ амфибий, ключевую роль играют митоген-активированная протеин киназа (MAPK) и киназа, регулируемая внеклеточным сигналом (ERK) (Zhang, Liu, 2002). На этом сигнальном пути рецептор ростового фактора активирует rasGTP-азу, что приводит к MAPK/ERK фосфорилированию (Hecquet et al., 2002). MAPK/ERK в свою очередь, регулирует экспрессию транскриптов: c-myc, Pax6, klf4, и MITF, свидетельствующих о понижении уровня дифференцировки РПЭ (Bharti et al., 2006).
МОЛЕКУЛЯРНО-ГЕНЕТИЧЕСКИЕ СОБЫТИЯ, ПРОИСХОДЯЩИЕ ПРИ РЕПРОГРАММИРОВАНИИ РПЭ IN VIVO У ХВОСТАТЫХ АМФИБИЙ
Регенерация НС у хвостатых амфибий осуществляется под координированным контролем работы генных сетей, в которых ведущую роль играют ТФ и сигнальные белки, запускающие или ингибирующие ключевые сигнальные каскады (Chiba, Mitashov, 2007). В лаборатории под руководством В.И. Миташова в середине 90-х начались работы по определению молекулярно-генетического профиля клеток РПЭ и пигментного эпителия радужки на разных этапах регенерации сетчатки и хрусталика у взрослого тритона Pl. waltlii (Mitashov et al., 1995; Markitantova et al., 2003; Маркитантова и др., 2004; Миташов, 2007). Изучение нативного РПЭ тритона показало, что клетки экспрессируют гены, ответственные за специализацию и меланогенную дифференцировку (Маркитантова и др., 2004; Авдонин и др., 2008; 2010; Маркитантова и др., 2010, 2014, 2015; Grigoryan, Markitantova, 2016). Основное направление наших исследований было связано с поиском и изучением экспрессии регуляторных генов, и генов, кодирующих молекулы, взаимодействия которых могут запускать и контролировать трансдифференцировку РПЭ, последующую пролиферацию нейробластов и дифференцировку клеток, приводящих к восстановлению НС.
В основу подхода к изучению механизмов репрограммирования РПЭ и регенерации сетчатки легла гипотеза сходства регуляторных механизмов, контролирующих процессы развития и регенерации одноименных тканей. Впервые с использованием метода ОТ-ПЦР и гибридизации in situ, в регенерирующей сетчатке взрослых Pl. waltlii мы идентифицировали гомеобокссодержащие гены “глазного поля” Pax6, Prox1, Six3, принадлежащие регуляторной сети, контролирующей процессы развития тканей глаза (Маркитантова и др., 2004). Со временем реэкспрессия ряда ключевых эволюционно консервативных генов, кодирующих ТФ и сигнальные белки Pax6, Prox1, Six3, Otx2, Fgf2 была выявлена в регенерации хрусталика и сетчатки у других видов амфибий, в том числе хвостатых (Markitantova et al., 2004; Chiba, Mitashov, 2007; Veldman et al., 2007; Авдонин и др., 2010; Маркитантова и др., 2010, 2014; Sousounis et al., 2013). Мы исследовали пространственно-временной характер распределения гомеобоксных Pax6, Prox1, Six3, Pitx1, Pitx2 и тканеспецифичных генов RPE65 и Otx2 в начале конверсии РПЭ и на последовательных стадиях регенерации сетчатки тритона Pl. waltlii, с использованием методов ПЦР, гибридизации in situ и иммунохимии (Маркитантова и др., 2004, 2010; Авдонин и др., 2010). Изучение локализации и распределения мРНК показало, что транскрипция мРНК генов Pax6, Prox1 и Six3 в нативном РПЭ не наблюдается, и что эти гены активируются на ранних этапах регенерации сетчатки (Маркитантова и др., 2004). С внедрением в исследование методов ПЦР, удалось получить более полную картину динамики экспрессии изучаемых генов на последовательных стадиях регенерации, начиная с ранних. Так, с помощью ОТ-ПЦР было показано, что активация генов Pax6, Six3, FGF2 происходит на фоне подавления уровня экспрессии мРНК регуляторного гена Otx2, контролирующего исходную меланогенную дифференцировку клеток РПЭ, а также гена-маркера дифференцировки РПЭ – RPE65 (Авдонин и др., 2008). По данным литературы на ранней стадии регенерации сетчатки наблюдается снижение уровня экспрессии не только гена Otx2, но и маркеров меланогенеза – RPE65, CRBP, являющихся мишенями для Otx2 (Sakami et al., 2005). Наши результаты нашли соответствие с данными об изменении уровня экспрессии ключевых регуляторных генов Pах6, Mitf, Otx2 на ранних стадиях развития глаза позвоночных. Показано, что в основе формирования нейробластов развивающейся сетчатки лежат антагонистические взаимодействия между этими генами (Baumer et al., 2002). Следует отметить, что в депигментирующихся клетках РПЭ зарегистрированы низкие уровни мРНК Pax6, Prox1 и Six3, по сравнению с пролиферирующими нейробластами, образующими зачаток сетчатки и характеризующимися активной экспрессией, обнаруженной на ранних стадиях регенерации во всех нейробластах зачатка НС (Маркитантова и др., 2004). В активно пролиферирующих нейробластах будущей сетчатки мы идентифицировали транскрипционную активность гена нуклеостемина (Ns), кодирующего белок ядрышка. Cолокализация нуклеостемина и Fgf2 в нейробластах регенерирующей сетчатки позволила выдвинуть предположение об их участии в регуляции пролиферации клеток в составе общего сигнального пути (Маркитантова и др., 2014, 2015; Markitantova et al., 2020). При этом, с учетом профиля экспрессии ряда изученных регуляторных генов и белков, клетки РПЭ тритонов могут быть отнесены к категории клеток с “молодым” фенотипом. Это означает, что в них на низком уровне поддерживается экспрессия ТФ из числа регуляторов раннего развития глаза (early eye-field genes) (Рах6, Otx2, Mitf, Pitx1, Pitx2, Hes1), участвующих в специфическом молекулярном контексте в контроле дифференцировки РПЭ в эмбриогенезе (RPE65, Pax6, Otx2, Mitf, Pitx1, Pitx2) (рис. 3) (Grigoryan, Markitantova, 2016).
Рис. 3.
Микрофото (слева) клеток ретинального пигментного эпителия (РПЭ) вскоре после разобщения его с фоторецепторами в результате отслойки сетчатки у тритона. Голубые стрелки – клетки, находящиеся еще в слое РПЭ; красные стрелки – клетки РПЭ, в начале процесса трансдифференцировки, покинувшие слой РПЭ. Видны отличия в состоянии хроматина. Справа – выявленные гены и белки (суммированные сведения), красные стрелки указывают отличия в экспрессии по сравнению с клетками, сохраняющимися в слое РПЭ.

Наши данные продемонстрировали участие перечисленных выше генов в формировании регуляторной сети, контролирующей как трансдифференцировку клеток РПЭ, так и последовательные стадии регенерации сетчатки. Одним из важных результатов явилось обнаружение сходного с развитием паттерна экспрессии генов интереса на ранней стадии регенерации – в нейробластах регенерирующей НС. Полученные данные позволили также сделать вывод о том, что после ретинэктомии в клетках РПЭ глаза тритона репрессируются гены, определяющие их исходный фенотип, и одновременно экспрессируются новые регуляторные гены, перепрограммирующие РПЭ для приобретения ими свойств стволовых клеток (Маркитантова и др., 2004; Chiba, Mitashov, 2007). Таким образом, предположения, сделанные О.Г. Строевой и В.И. Миташовым о “переключении работы генов” (Строева, Миташов, 1970; Stroeva, Mitashov, 1981) нашли свое экспериментальное подтверждение.
В РПЭ и при регенерации сетчатки глаза тритона вида Pl. waltlii мы впервые идентифицировали гомеобокс-содержащие гены Pitx1, Pitx2 и определили локализацию соответствующих белковых продуктов (Авдонин и др., 2008; Маркитантова и др., 2010; Авдонин и др., 2010). Ранее с помощью генного нокаута, было продемонстрировано участие Pitx2 в регуляции экспрессии генов Otx2 и Mitf, контролирующих меланогенез в ходе дифференцировки клеток РПЭ мыши. В экспериментах по оверэкспрессии гена Pitx1 было обнаружено существенное снижение экспрессии генов Otx2, Pax6, а также нейрального маркера b-тубулина в глазном бокале и мозге (Evans, Gage, 2005). Согласно этим сведениям, и Pitx1, и Pitx2 находятся на верхней ступени иерархии генов, контролирующих процессы меланогенеза и нейрогенеза. У хвостатых амфибий после травмы тканей отмечена также активация генов иммунного ответа и протоонкогенов, из числа ТФ – с‑fos, c-myc, c-jun (Maki et al., 2009).
Важным стало определение времени, когда происходит репрограммирование, когда реализуется решение клеток РПЭ тритона пойти по иному пути. С помощью количественной ПЦР на изолированных клетках удалось выяснить, что первые дочерние клетки РПЭ на 10-й день после ретинэктомии инициируют работу генов плюрипотентности c-Myc, Klf4 и Sox2, а также Mitf и Pax6 (Islam et al., 2014). По времени это совпадает со входом клеток в пролиферативную фазу и экспрессией маркера нейральных стволовых клеток Musashi-1 (Kaneko, Chiba, 2009), а также пан-нейрального маркера NF (Григорян, Антон, 1993). Важно, что в это время экспрессия гена, кодирующего специфический белок РПЭ – RPE65, была сходной по уровню как для интактных клеток РПЭ, так и для первых клеток зачатка НС. Это свидетельствовало о сохранении одного из основных признаков исходной дифференцировки в момент появления клеток с признаками мультипотентности. Позже в клетках зачатка экспрессия RPE65 подавлялась, в то время как гены мультипотентности продолжали экспрессироваться до 14–15-го дней регенерации, до формирования многорядного зачатка НС, после чего уже в полную силу включались гены пронейральной дифференцировки и затем гены специфических клеточных типов и глии.
Совокупность полученных нами и коллегами сведений, свидетельствует о частичном сохранении РПЭ интактных, половозрелых хвостатых амфибий клеточного, молекулярно-генетического и эпигенетического профилей, характерных для ювенильных состояний, наряду с экспрессией всех признаков функциональной специализации (Grigoryan, Markitantova, 2016; Grigoryan, 2020). Эти данные согласуются с результатами работы на РПЭ куриного эмбриона (ст. Е4), также способного к смене клеточного типа in vivo и экспрессирующего ряд факторов – маркеров клеточной плюрипотентности (klf4, c-myc, lin-28) (Luz-Madrigal et al., 2014). Некоторые регуляторные белки, такие как Wnt, гликопротеины, в кооперации с ТФ плюрипотентности Oct4, Sox2, Nanog, участвуют в регуляции пролиферации клеток, в частности, поддержании пула стволовых клеток при регенерации тканей (Desai et al., 2010; Katsman et al., 2012; Khan et al., 2015). Накопленные экспериментальные результаты дают основания предполагать, что на самых ранних стадиях регенерации НС в тканях заднего сектора глаза в большей мере востребованы факторы, участвующие в защите клеток РПЭ от гибели и поддержании их функций. Для амфибий и высших позвоночных в качестве еще одного из таких факторов обсуждается эпидермальный фактор роста (Egf) (Defoe, Grindstaff, 2004).
Итак, существенным достижением в исследованиях молекулярных механизмов регенерации сетчатки у хвостатых амфибий стало обнаружение сходства основной сети регуляторных генов, контролирующей процессы развития и регенерации сетчатки, сходство молекулярных механизмов процессов клеточной дифференцировки после образования слоя нейробластов в развитии и при регенерации. Однако, существуют и различия. Они связаны с отличием клеточных источников формирования НС: в ходе эмбрионального развития источником служат клетки внутреннего слоя глазного бокала, а в процессе регенерации сетчатки клетки РПЭ.
МОЛЕКУЛЯРНО-ГЕНЕТИЧЕСКИЕ СОБЫТИЯ, ПРОИСХОДЯЩИЕ ПРИ РЕПРОГРАММИРОВАНИИ РПЭ IN VIVO У МЛЕКОПИТАЮЩИХ И ЧЕЛОВЕКА
Процесс ЭМП играет важную роль в развитии органов, клеточном репрограммировании, а также процессах метастазирования (Kalluri, Weinberg, 2009). Целостность РПЭ поддерживается координированным взаимодействием генов, контролирующих процессы, обеспечивающие стабильное дифференцированное состояние этой ткани (Strauss, 2005). Утрата фенотипических черт РПЭ при патологических состояниях лежит в основе возникновения и прогрессирования пролиферативных нарушений в глазу, таких как ПВР. ЭМП клеток РПЭ как часть аберрантной реакции при ранозаживлении при данной патологии способствует формированию ЭМ (Snead et al., 2008; Tamiya, Kaplan, 2016). Особенности ЭМП в РПЭ млекопитающих связаны с утратой полярности, специализированных плотных межклеточных контактов (tight junctions), реорганизацией цитоскелета, и приобретением свойств мезенхимальных клеток (Philp, Nachmias, 1987; Huang et al., 2012). Основным событием реорганизации цитоскелета в РПЭ при ЭМП является смена паттернов экспрессии кадгеринов (Thiery, Sleeman, 2006; Imamichi, Menke, 2007): при каноническом ЭМП в РПЭ происходит подавление экспрессии N-кадгерина (CDH2) и переключение на экспрессию кадгеринов, специфичных для РПЭ, таких как E (CDH1) и R (CDH3) (Maeda et al., 2005; Nieto, 2011).
Молекулярные основы ЭМП в РПЭ, включая изменения в экспрессии и регуляции генов, остаются плохо изученными (Vadigepalli et al., 2003; Nazarieh et al., 2016). Они включают изменения в экспрессии функционально значимых генов под контролем специфических ТФ в генетической сети, в контексте паттернов скоординированной регуляции в РПЭ в норме и в процессе ЭМП. Один из аспектов этой регуляции предполагает упомянутое выше переключение экспрессии подтипов кадгериновых белков. Процесс ЭМП в РПЭ сопровождается подавлением экспрессии ТФ, индуцирующих ЭМП (ЭМП-ТФ), таких как Snail, Slug, ZEB1/2, TWIST, GSC (Choudhary et al., 2015) и других, вызывающих классический ЭМП при фиброзной и онкотрансформации (Hua et al., 1998; Kang, Massague, 2004). Взаимодействия с этими TФ играют центральную роль в механизмах репрессии E-кадгерина в мезенхимальных клетках, поскольку она является одним из важных условий для возврата в эпителиальное состояние.
С применением методов компьютерного моделирования, биоинформационного и биохимического анализа, обнаружены биологически значимые ТФ, способные регулировать фенотип клеток РПЭ (Pratt et al., 2008). В промоторах ряда генов идентифицированы специфические элементы, отвечающие за транскрипцию (TRE) при связывании с ТФ – кандидатами на роль главных “узлов” в транскрипционной сети, регулирующей ЭМП в РПЭ. Среди предсказанных мишеней действия ТФ, рассматриваемых в качестве потенциальных терапевтических мишеней в профилактике и лечении пролиферативных заболеваний сетчатки и РПЭ человека находятся: Oct-1, ядерный фактор гепатоцитов 1 (HNF-1), ядерный фактор транскрипции GATA-1, SMAD3, фактор транскрипции E (TFE), фактор регуляции интерферона-1 (IRF), HNF3alpha, E2F, CDP, SP3, гомео-бокссодержащий ген NKX3A, связывающий регуляторный элемент стерола белок-1 (SREBP-1), фактор-усилитель лимфоцитов-1 (LEF-1), а также N- и R-кадгеринов. Дифференциальная и скоординированная экспрессия функциональных кластеров регуляторных генов во время ЭМП РПЭ подтверждена ПЦР с обратной транскрипцией (Pratt et al., 2008).
В качестве моделей для выявления механизмов приобретения эпителиального фенотипа и ЭМП, широко используются клетки РПЭ, полученные из человеческих эмбриональных стволовых клеток (hESC), РПЭ плода человека и РПЭ клеточной линии ARPE19 (Vaajasaari et al., 2011; Buchholz et al., 2013; Lynn et al., 2017; Zhou et al., 2020). Важную роль в определении эпителиальной судьбы РПЭ играет ТФ – протоонкоген FOXM1 (Benayoun et al., 2011). На отмеченных модельных системах показано, что РПЭ претерпевает ЭМП, зависимым от ТФ FOXM1 способом. Сверхэкспрессия FOXM1 приводит к усилению свойств эпителиального фенотипа, о чем свидетельствует повышенная экспрессия маркера РПЭ – премеланосомного белка PMEL17. Предполагается, что это достигается за счет непосредственной регуляции пролиферации РПЭ. Установлено также, что FOXM1 напрямую регулирует пролиферацию клеток РПЭ посредством контроля кластеров генов, связанных с пролиферацией (клеточным циклом, репликацией ДНК, биогенезом рибосом). Связь с пролиферацией подтверждается ассоциацией FOXM1 с промоторами генов, регулирующий клеточный цикл (Chen et al., 2013). Нокдаун FOXM1 с помощью siRNA приводит к снижению экспрессии позитивных регуляторов клеточного цикла (CDC5L, CDK12 и FZR1) и увеличению экспрессии CDKN1A, известного ингибитора клеточного цикла (Wang et al., 2005; Qu et al., 2013). Механизм ЭМП включает также участие ТФ FOXM1 в модуляции экспрессии сигнальных белков BMP7 и Wnt5B, способных передавать внеклеточные сигналы и влиять на судьбу эпителия антагонистическим образом. Действуя реципрокно, они обеспечивают поддержание эпителиального фенотипа. Экзогенный рекомбинантный Wnt5B существенно снижает экспрессию эпителиальных маркеров, меняя фенотип эпителиальных клеток в сторону мезенхимального (Choudhary et al., 2015). Взаимные антагонистические взаимодействия BMP/Wnt необходимы для самообновления РПЭ, что продемонстрировано в различных клеточных системах РПЭ (Kandyba et al., 2013; Stewart et al., 2014). Действие FOXM1 на BMP7 и Wnt5B может быть опосредованным, поскольку связывание с промоторами их генов не обнаружено. Регуляция со стороны FOXM1 может происходить посредством воздействия на другие, вышестоящие факторы, или на пост-транскрипционном уровне, как это описано для регуляции комплекса SMAD3/4 (Xue et al., 2014). В совокупности, имеющиеся экспериментальные данные указывают на то, что FOXM1 регулирует пролиферацию клеток РПЭ, действуя как активатор или репрессор генно-зависимым образом.
В наших работах, а также коллегами из Японии, были выявлены некоторые особенности экспрессии ряда генов, кодирующих ТФ, в том числе Pax6, Otx2, Fgf2 при регенерации сетчатки у хвостатых амфибий, в отличие от моделей повреждения сетчатки у млекопитающих. Дополнительным подтверждением выдвинутой нами гипотезы о клеточных и молекулярных особенностях РПЭ Urodela, позволяющих этим клеткам естественное репрограммирование (natural reprogramming) в нейроны сетчатки, являются результаты, полученные японскими исследователями в 2016 г. (Casco-Robles et al., 2016). Эта работа, проведенная с помощью нокаута гена Pax6 с использованием технологии Cre-lox у личинок тритонов Cynops pyrrhogaster, явилась ключевым исследованием в понимании различий в выборе путей конверсии РПЭ – приобретении нейральной или мезенхимной дифференцировок (Сasco-Robles et al., 2016). Так, у хвостатых амфибий ключевой фактор транскрипции Pax6 отвечает за репрограммирование клеток РПЭ в клетки НС при ее регенерации in vivo. Оказалось, что отсутствие экспрессии этого мастер гена блокирует регенерацию НС у взрослых тритонов и индуцирует в клетках РПЭ тритона выход в мезенхимную дифференцировку, как известно, обусловливающую ПВР у человека. Вместо участия в регенерации НС клетки, покидая слой РПЭ, формировали многоклеточные агрегаты, не способные к организации упорядоченного слоя. В агрегатах наблюдалась экспрессия маркерных белков миофибробластов – альфа-гладкомышечного актина (alpha-SMA), виментина (Vim) и N-кадгерина (N-Cad). Предполагается, что в ходе эволюции механизм, используемый Urodela для регенерации сетчатки, эволюционировал таким образом, что его модификация в конечном итоге у амниот легла в основу РПЭ-зависимых патологий (Сasco-Robles et al., 2016). Важно отметить тот факт, что данный выбор клетками РПЭ осуществляется рано, сразу после выхода клеток из слоя, в норме сдерживающего трансформации фенотипа РПЭ. Кроме консервативных функций, установленных для ТФ, и, в частности для Pax6, существуют различия в стратегиях поведения и трансдифференцировки клеток РПЭ у эволюционно отдаленных видов позвоночных, объясняемые особенностями в регуляции клеточными процессами, как на локальном, эпигенетическом, так и организменном уровнях (Маркитантова, Симирский, 2020). Следовательно, для рассматриваемой нами системы трансдифференцировки клеток РПЭ в нейральную ткань сетчатки у взрослых амфибий и при ЭМП клеток РПЭ у млекопитающих, напрашивается заключение, что в обоих случаях имеет место близкая молекулярная основа, но содержащая модификации работы ключевых генов. В свою очередь, эти модификации обусловлены действием регуляторных механизмов (как вне- так и внутриклеточных), влияющих на эпигеном клеток РПЭ.
МОЛЕКУЛЯРНЫЕ МЕХАНИЗМЫ РЕГУЛЯЦИИ СО СТОРОНЫ МИКРООКРУЖЕНИЯ ТРАНСДИФФЕРЕНЦИРОВКИ РПЭ ПРИ РЕГЕНЕРАЦИИ СЕТЧАТКИ У АМФИБИЙ
Понимание регуляции со стороны клеточного микроокружения являются ключом к направленному изменению поведения клеток РПЭ с целью восстановления сетчатки и/или ингибированию патологических состояний РПЭ. В процессе изучения двух стратегий конверсии РПЭ у амфибий и млекопитающих выше мы отметили сходство в клеточном поведении, инициации, прогрессе трансдифференцировки, а также последовательности ее основных этапов. В то же время накопленная информация свидетельствует о том, что в регуляционных факторах микроокружения и в малоизученном пока паттерне их экспрессии присутствуют отличия. Известно, что многие регуляторные факторы производятся и секретируются как НС, так и собственно клетками РПЭ, в ответ на разобщение с сетчаткой (Grigoryan et al., 2012; Pastor et al., 2016).
Среди изучаемых сигнальных белков, которые вовлечены в контроль регенерации сетчатки, внимание приковано к участникам молекулярных каскадов Fgf, Bmp, Wnt, Shh (Hayashi et al., 2004; Mercer et al., 2012; Григорян и др., 2013; Sherpa et al., 2014; Grigoryan, Markitantova, 2016). В наибольшей степени нами изучена роль сигнального пути FGF2, являющегося ключевым для регенерации сетчатки у тритона (Маркитантова и др., 2014). В исследованиях работы компонентов сигнального каскада FGF2 обнаружено, что в ранний период после удаления сетчатки в регенерате происходит down-регуляция гена fgf2, что свидетельствует о подавлении сигналов Fgf2 до инициации пролиферации клеток РПЭ, сразу после ретинэктомии (Маркитантова и др., 2014). Согласно сведениям, полученным зарубежными коллегами для других видов Urodela, и нашим данным по Pl. waltlii, Fgf2 не является первичным, индуцирующим процесс конверсии клеток РПЭ, а выполняет эволюционно консервативную функцию митогена. Усиление экспрессии и митогенный эффект Fgf2 связан с более поздней по времени стимуляцией пролиферативной активности нейробластов регенерата НС и периодом резкого ее возрастания (Susaki, Chiba, 2007; Mercer et al., 2012; Маркитантова и др., 2014). Основным источником сигналов FGF может служить сосудистая оболочка глаза (Azuma et al., 2005; Araki et al., 2007). Наблюдаемая нами активация FGF2 в раннем регенерате НС, представленном слоем нейробластов, и в клетках Мюллера дифференцированной НС (Маркитантова и др., 2014), коррелирует с ранним формированием в ходе регенерации клеток макроглии, которая, возможно, является еще одним источником этого фактора (Sakami et al., 2005). Иммуногистохимически определена локализация белка FGF2 и его рецепторов Fgfr2 в РПЭ и хороиде, а также во внутренней НС, зрительном нерве и ростовой зоне (pars ciliaris и ora serrata) нативного глаза тритона. С помощью ПЦР в реальном времени обнаружено, что гены и белки FGF2 обладают дифференциальной экспрессией не только в ходе регенерации сетчатки in vivo, но и in vitro (Маркитантова и др., 2014; Markitantova et al., 2020). Для белков теплового шока (HSPs), обнаруженных нами в сетчатке тритонов и различно экспрессируемых в норме и при регенерации, помимо их шаперонной активности, также предполагается регуляторная роль в конверсии РПЭ. В трансдифференцировке РПЭ у тритона показано участие сигнального пути Notch (Kaneko et al., 2001; Nakamura, Chiba, 2007). Прослежена динамика экспрессии Notch-1, возрастающей по мере развития регенерата НС и снижающаяся при выходе клеток в дифференцировку. Введение блокатора DAPT приводит к преждевременному созреванию нейронов в бластеме НС. Выяснено также, что клетки РПЭ тритона в ходе регенерации НС дифференциально экспрессируют сигнальные молекулы Hes-1, neurogenin1 и Delta. На роль участника регуляционной сети микроокружения клеток РПЭ претендует и сигнальный путь Wnt/β-catenin, регулирующий регенерацию сетчатки у рыб и куриного эмбриона (Meyers et al., 2012; Gallina et al., 2016).
Факторы микроокружения работают локально и короткодистантно, и в экспрессии обнаруживают сходство с активностью в период гистогенеза сетчатки глаза. Однако эти события в иерархии системы надклеточного сигнализирования находятся ниже системных, общеорганизменных факторов. К последним относятся: гормоны, факторы иммунной системы и крови. Хвостатые амфибии, животные с наиболее высоким регенераторным потенциалом, являясь педоморфными, демонстрируют ускоренное половое созревание, тормозящее соматическое развитие (Grigoryan, 2021). В основе феномена лежит активность тиреоидного гормона (ТГ) – главного регулятора метаморфоза у амфибий. В свою очередь, действие ТГ опосредовано его рецепторами, являющимися ядерными ТФ, и экспрессией генов met1–3. Показана регуляция функции ТГ со стороны “гена гетерохронии” lin28, члена семейства генов Lin28, кодирующих ТФ, известные в качестве индукторов плюрипотентности соматических клеток высших позвоночных (Faunes et al., 2017). Можно предположить роль этого и подобных ему генов в поддержании клеток на уровне дифференцировки, пермиссивном для конверсии в нейрональном направлении через регуляцию ТГ, TСГ (тироид-стимулирующего гормона) и других гормонов. В областях регенерации хрусталика, конечности и сетчатки у тритона была выявлена экспрессия факторов иммунной системы комплемента – С3 и С5 (Kimura et al., 2003). Комплемент C3a способен индуцировать регенерацию сетчатки из РПЭ у эмбриона цыпленка через активацию регулятора транскрипции STAT3, в свою очередь активирующего факторы ответа на повреждение и воспаление IL-6, IL-8 и TNF. Это, в итоге, приводит к регуляции генов сигнального пути Wnt2b, а также генов Six3 и Sox2, кодирующих ТФ, характерные для прогениторных клеток (Haynes et al., 2013). Все эти данные служат накоплению информации, необходимой для последовательного выстраивания сети, регулирующей трансдифференцировку РПЭ у Urodela.
МОЛЕКУЛЯРНЫЕ МЕХАНИЗМЫ РЕГУЛЯЦИИ ПРОЦЕССА ТРАНСДИФФЕРЕНЦИРОВКИ РПЭ СО СТОРОНЫ МИКРООКРУЖЕНИЯ ПРИ ПВР У МЛЕКОПИТАЮЩИХ
В качестве основного регулятора стабилизации эпителиального фенотипа РПЭ, кадгерин-зависимой межклеточной адгезии и пигментации клеток у млекопитающих рассматривается сигнальный путь Wnt/β-catenin (Burke, 2008). В ходе ЭМП клетки РПЭ теряют черты специализации, межклеточные контакты и адгезию, приобретают характеристики мигрирующих мезенхимных клеток (Kigasawa et al., 1998; Tosi et al., 2014; Tamiya, Kaplan, 2016). Вместо синтеза характерных для РПЭ внутриклеточных белков, таких как цитокератины, клетки экспрессируют α-SMA и белки стресс фибрилл (Feist et al., 2014). Эти события происходят под контролем ростовых факторов и резидентных клеток воспаления, находящихся в циркулирующей крови и стекловидном теле глаза (Wiedemann, 1992; Pastor et al., 2002) (рис. 4). В контроле со стороны иммунной системы участвуют цитокины – интерлейкины – (IL-) 1, IL-6, IL-8, IL-10, а также интерферон-гамма (INF-γ) (Morescalchi et al., 2013). Существующие представления о патогенезе ПВР включают изменение локальных концентраций не только цитокинов, но и ряда ростовых факторов, управляющих процессами трансдифференцировки, миграции, пролиферации и формирования ВКМ (Parmeggiani et al., 2010). В первую очередь к ним относится трансформирующий фактор роста бета (TGFβ), а также фактор роста гепатоцитов (HGF), фактор роста, выделенный из тромбоцитов (PDGF), сигнальные пути Notch, Wnt/β-catenin, и сигнальный путь Hippo (Bochaton-Piallat et al., 2000; Spraul et al., 2004; Stern, Temple, 2015; Chen et al., 2015). TGFβ обнаруживается в глазах пациентов с ПВР, на уровне экспрессии, положительно коррелирующим с развитием патологии (Connor et al., 1989; Shu et al., 2017). Роль TGFβ в трансдифференцировке в мезенхимном направлении многократно показана как для человека (Stocks et al., 2001; Li et al., 2011; Xiao et al., 2014; Dvashi et al., 2015), так и на мышиной модели PVR (Saika et al., 2004; Saika et al., 2007). У человека TGFβ2 активирует p38 MAPK сигнальный путь, а при его ингибировании происходит подавление синтеза коллагена I типа (Kimoto et al., 2004). Обнаружено, что наряду с TGFβ активируется и TNFα, то есть имеет место влияющее на прогресс ЭМП комбинаторное действие этих факторов. У человека рецепторы этих сигнальных молекул обнаружены в нативном РПЭ (Strunnikova et al., 2010; Boles et al., 2020). Роль TGFβ, привлекающая наибольшее внимание исследователей, выявлена в активации многих сигнальных каскадов при ЭМП клеток РПЭ, что, в свою очередь, дает ключи к лечению ПВР (Yang et al., 2015). Помимо TGFβ в исследованиях моделей ЭМП клеток РПЭ in vivo и in vitro продемонстрирована важная роль сигнального пути Smad. У мышей, дефицитных по Smad показано подавление процесса конверсии РПЭ после индукции ЭМП с помощью TGFβ, а также в случае экспериментальной отслойки НС (Saika et al., 2004). Как отмечено выше, клетки РПЭ быстро отвечают на отслойку НС активацией ERK сигнального пути и повышением экспрессии ТФ AP-1. Основной фактор роста FGF2 также включен в ранний ответ РПЭ на отслойку НС (Geller et al., 2001), как и при конверсии РПЭ у тритона.
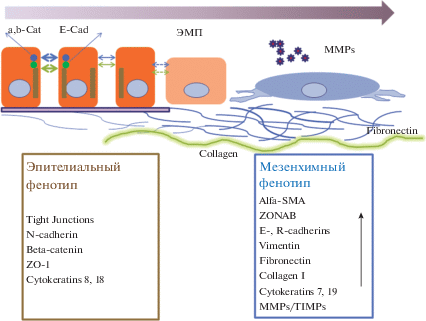
Рис. 4.
Изменения композиции белков контактов клеток РПЭ и ВКМ при пролиферативной ретинопатии у млекопитающих. ЭМТ – эпиталиально-мезенхимный переход; MMPs/TIMPs – матриксные металлопротеиназы и их тканевые ингибиторы.
Как упомянуто выше, есть экспериментальные доказательства того, что клетки РПЭ взрослого человека in vitro могут демонстрировать свойства нейрональных клеток. Это предполагает поиск факторов, препятствующих трансдифференцировке РПЭ в нейральные клетки сетчатки in situ и, напротив, индуцирующих дифференцировку клеток РПЭ в нейрональном направлении, за счет подавления ЭМП, для восстановления НС после травмы или патологии. Действие FGF2 in vitro на клетки РПЭ человека проявляется в консервативной функции в качестве митогена для поддержания пролиферации клеток, а на генном уровне – для модуляции экспрессии генов, принимающих участие в нейральной дифференцировке (Шафеи и др., 2017). Однако, в данной системе, появление клеток нейрального фенотипа регистрируется на фоне сохранения свойств клеток мезенхимной линии дифференцировки, о чем свидетельствует экспрессия широкого ряда маркеров не нейрональной природы. Методами иммуноцитохимии, ПЦР, ПЦР-РВ и МТТ-теста получены данные о роли сигнальных путей TGFb/BMPs, WNT, Notch и FGF в регуляции пластичности клеток ARPE-19 взрослого человека. В клетках РПЭ глаза взрослого человека in vitro зарегистрирована транскрипция мРНК Notch и BMPs, лигандов сигнальных путей, способных ингибировать нейральную дифференцировку клеток. Сигналы Wnt способны модулировать экспрессию белков Notch и BMPs. Wnt1 усиливает пронейральную дифференцировку, в то время как Wnt7a влияет на дедифференцирующиеся in vitro клетки РПЭ контекст зависимо, усиливая в одних клетках процессы нейральной дифференцировки, в других – редифференцировку в пигментированные эпителиальные клетки (Kuznetsova et al., 2014; Ржанова и др., 2020).
Таким образом, регуляторные события, происходящие при конверсии клеток РПЭ млекопитающих в мезенхимном направлении, как и в случае конверсии РПЭ в нейральном направлении у амфибий, разнообразны, имеют сходства и отличия, но до конца не определены. Это делает сопоставления затруднительными, однако, очевидно, что регуляционные сети при выборе разных стратегий трансдифференцировки имеют для амфибий и млекопитающих свои специфические динамические паттерны.
ИЗМЕНЕНИЯ ЭПИГЕНЕТИЧЕСКОГО ЛАНДШАФТА В ХОДЕ ТРАНСДИФФЕРЕНЦИРОВКИ РПЭ У АМФИБИЙ И ПАТОЛОГИИ СЕТЧАТКИ У МЛЕКОПИТАЮЩИХ
Как мы видим, ключевым и в настоящее время хорошо документированным событием трансдиффренцировки РПЭ у амфибий является репрограммирование, переключение генной программы, обеспечивающей эпителиальную, меланогенную дифференцировку, на программу, приводящую к нейральной и глиальной дифференцировкам. Каким образом осуществляется регуляция репрограммирования со стороны эпигенома – вопрос детального изучения в будущем. В настоящее время есть понимание того, что существенную роль в уровне экспрессии тех или иных генов играет динамическая композиция хроматина (Venters, Pugh, 2009; Chen, Dent, 2014). Характер перестроек хроматина при репрограммировании РПЭ тритона и их роль в активации транскрипционной программы, обеспечивающей ретиногенную дифференцировку изучен предварительно. Мы предприняли попытку охарактеризовать состояние хроматина в начале конверсии РПЭ тритона при разобщении РПЭ и НС, вызванном облучением сетчатки ярким светом или механической отслойкой (Маркитантова и др., 2015; Николаев и др., 2017). Данные свидетельствуют о том, что на 7–10-й дни после разобщения РПЭ и НС в вымещающихся из слоя клетках РПЭ, происходит реорганизация хроматина, очевидная на окрашенных полутонких срезах, при сравнении с клетками, сохраняющимися в слое РПЭ (рис. 3). В ядрах клеток в слое РПЭ наблюдалось диффузное распределение небольших локусов компактизации, прикрепленных к ядерной мембране (пристеночный гетерохроматин). В вымещающихся клетках РПЭ имело место увеличение объемов компактизованного хроматина (прицентромерный гетерохроматин), менялось соотношение конденсированного и диффузного хроматина в пользу первого, происходило центробежное его смещение, снижалось число компактизованных областей хроматина при увеличении их объемов, имел место фолдинг ядерной мембраны (Маркитантова и др., 2015). Всем этим изменениям была дана количественная оценка при использовании программ компьютера (Николаев, 2018). Описанные изменения, как известно, не предусматривают активной транскрипции, но напротив, свидетельствуют о репрессии этого процесса (Popova, Barnstable, 2019). Мы предполагаем, что обнаруженные нами изменения хроматина и ядерной мембраны в репрограммируемых клетках РПЭ тритонов связаны с ответом на клеточный стресс, уходом от клеточной гибели и подготовкой к пролиферации. Помимо событий, связанных с реорганизацией хроматина, известно также, что в РПЭ взрослых тритонов присутствует экспрессия кодируемого геном Ns нуклеостемина, регулятора транскрипционной активности, характерного для стволовых и малодифференцированных клеток, маркера пролиферации (Maki et al., 2009; Маркитантова и др., 2014, 2015). Работа гена Ns в ткани РПЭ также является эпигенетическим пререквизитом высокой пластичности их дифференцировки при регенерации in vivo (Маркитантова и др., 2014).
В исследовании эпигенетического ландшафта клеток нативного РПЭ взрослых мышей Дворянчикова и соавторы (Dvoriantchikova et al., 2019) опирались на факты о свойствах ретинальных прогениторов, общих для РПЭ и НС, развивающихся из общего зачатка (Лопашов, Строева, 1961; Chow, Lang, 2001; Graw, 2010). Возникло предположение, что клетки РПЭ взрослых мышей могут сохранять сходства эпигенома, присущие ретинальным предшественникам. Авторам (Dvoriantchikova et al., 2019) удалось показать, что состояние метиломов в клетках РПЭ эмбрионов и взрослых мышей, действительно, сходно: большинство промоторов генов находится в открытом (активном) хроматине, характерном для эпигенетически мобильных стволовых и прогениторных клеток. В то же время детальный анализ метилирования генов, ответственных за спецификацию ретинальных фенотипов, указал на локализацию промоторов генов, контролирующих дифференцировку не фоторецепторных нейронов, в репрессированных участках хроматина, находящихся в неметилированных (слабо метилированных) его областях. По мнению авторов (Dvoriantchikova et al., 2019), активация этих генов возможна в присутствии “пионерских” ТФ, способных инициировать транскрипционные события в закрытом хроматине. В то же время большинство генов, ответственных за фоторецепторную дифференцировку, оказались высоко метилированы. Таким образом, деметилирование регуляторных элементов фоторецепторных генов – второй механизм, необходимый для реализации конверсии клеток РПЭ в ретинальном направлении. Предполагается, что оба механизма (работа пионерских ТФ и деметилирование регуляторных элементов фоторецепторных генов) присущи РПЭ амфибий и работают при регенерации сетчатки после повреждения (Dvoriantchikova et al., 2019). Не исключено также, что у тритонов, исходно обладающих ювенильными свойствами (Григорян, 2016; Grigoryan, 2021) понижение уровня дифференцировки в ходе репрограммирования, не требует масштабных модификаций работы генов, при одновременном наличии пермиссивного для быстрого переключения программ эпигеноме. Подтверждением этого предположения может быть упомянутая выше, обнаруженная нами в нативных клетках РПЭ тритонов совместная работа генов, кодирующих признаки как исходной, так и новой дифференцировок (Grigoryan, Markitantova, 2016). Роль ТФ, обладающих свойствами “пионерских”, то есть способных индуцировать прямое репрограммирование клеток РПЭ человека, обсуждается в обзоре Ржановой и соавторов (2020). Авторы предполагают, что терминально дифференцированный РПЭ млекопитающих богат эпигенетическими регуляторными механизмами, жестко фиксирующими специфические паттерны экспрессии генов (Ржанова и др., 2020).
У млекопитающих и человека нарушения состояния хроматина и изменения эпигенетической регуляции работы генов при многих заболеваниях приводят к использованию патологических программ экспрессии генов, в том числе кодирующих ферменты, отвечающие за модификации ДНК и гистоновых белков, в свою очередь определяющих архитектуру хроматина (Mirabella et al., 2016; Popova, Barnstable, 2019; Basinski et al., 2021). Врожденные нарушения в сетчатке млекопитающих, такие как микрофтальмия, анофтальмия и колобома ассоциируются с изменениями в работе регуляторных генов, кодирующих ТФ (Markitantova, Simirskii, 2020), а также генов, кодирующих эпигенетические белки, в свою очередь, реорганизующие хроматин (Oliver et al., 2016; Basinski et al., 2021). Накоплена информация об эпигенетических изменениях и их связи с ТФ и о последствиях этой связи в ходе ЭМП. Однако, внимание в основном уделено случаям ЭМП при развитии опухолей (Wang, Shang, 2013; Sun, Fang, 2016). Если опираться на эту информацию в совокупности с полученной на моделях РПЭ-зависимой патологии НС, а также в экспериментах in vitro, становится ясно, что программа конверсии РПЭ при ЭМП в ходе развития ПВР регулируется как ТФ, так и эпигенетическими изменениями. Последними являются – метилирование ДНК, модификации гистонов, а также микроРНК (miRNAs), способные ингибировать трансляцию ряда генов. В патогенезе ПВР выявлена важная роль miR-29b, осуществляющей негативную регуляцию Akt2 сигнального пути (Li et al., 2016). Определена роль ингибитора деацетилазы гистонов (HDACi) – трихостатина, ингибирующего канонический сигнальный путь Smad и сигнальные пути Jagged/Notch, PI3K/Akt, и MAPK/ERK1/2. Ингибитор устранял TGFβ-индуцированные морфологические изменения клеток РПЭ человека в мезенхимном направлении и предотвращал up-регуляцию α-SMA, FN, коллагена I и IV типов (Xiao et al., 2014). Попытки воздействия с помощью miRNA на ключевые, определяющие ЭМП сигнальные пути, были сделаны на культуре клеток линии ARPE-19 человека (Fuches et al., 2020). TGFβ, активирующий сигнальные белки SMAD2 и SMAD3, воздействует на активность ряда генов, среди которых VEGFA. Ингибируя этот процесс, Fuchs et al. (2020) использовали miR-302d и miR-93, способные регулировать сигнальный путь TGFβ на разных уровнях. miR-302d и miR-93 направляли TGFβ-зависимую конверсию клеток ARPE-19 в мезенхимном направлении вспять, возвращая клеткам ARPE-19 признаки эпителиальной дифференцировки. Предполагается, что данный подход в дальнейшем может быть использован при лечении ПВР (Fuchs et al., 2020).
Продолжается поиск молекулярных регуляторов детерминации эпителиальной судьбы РПЭ и ее переключения на путь мезенхимной или иной дифференцировки, с использованием современных методов анализа транскриптома, генома, протеома, что лежит в основе разработки перспективных подходов клеточной терапии для поддержания стабильности и жизнеспособности РПЭ (Alge et al., 2003; Pratt et al., 2008; Du et al., 2016; Saini et al., 2017; Boles et al., 2020). Возникновение ЭМ, полученных от пациентов с ПВР, связано с активацией сигнальных путей TGF-b и TNF-a (Asato et al., 2013; Roybal et al., 2018), которые синергетически могут активировать программу ЭМП в клетках РПЭ взрослого человека (RPESC). Повышение уровня TGF-b (Kita et al., 2008) и TNF-a (Korthagen et al., 2015) было отмечено в стекловидном теле пациентов с ПВР и коррелирует с тяжестью этого заболевания. Для выявления механизмов этих процессов предпринимаются попытки создания карты связанных эпигенетических и транскрипционных изменений в РПЭ в норме и в случае ЭМП (Choudhary et al., 2015). Показано, что наиболее заметные эпигеномные изменения, сопровождающие ЭМП, связаны с усилением меток активного хроматина на многих элементах энхансеров предполагаемых мишеней связывания с ТФ – ключевыми кандидатами, которые могут быть вовлечены в регуляцию этого процесса. При сопоставлении данных анализа эпигенома и транскриптома РПЭ в норме и после обработки факторами TGF-b1 и TNF-a, был идентифицирован ландшафт регуляции генов, сопровождающий ЭМП. Ранее установлено, что в клетках РПЭ, полученных из плюрипотентных стволовых клеток человека и индуцированных в направлении ЭМП, происходит ингибирование пути TGF-b, и развитие воспалительных процессов, после обработки никотинамидом (NAM, производное витамина B3) (Saini et al., 2017). Воздействие NAM на RPESC-RPE взрослого человека, усиливающее эпителиальный фенотип, предотвращает ЭМП трансформацию и рассматривается в качестве способа терапии пациентов с ЭМ (Schiff et al., 2019). Среди эффективных стратегий, направленных на подавление сигнальных путей, вовлеченных в патологию РПЭ, рассматривается модуляция передачи сигналов RhoA/Rho-kinase, Smad или MAPK (Saika et al., 2009; Yan et al., 2009). Другие подходы предполагают блокирование экспрессии ALK5, что эффективно подавляет развитие фиброза (Ishida et al., 2006; Pannu et al., 2007), ингибирование ключевых факторов ангиогенеза (Fernґandez-Robredo et al., 2014) и деацетилазы гистонов (Xiao et al., 2014).
Подводя итоги, можно констатировать, что РПЭ низших и высших позвоночных животных обладает высокой степенью пластичности, проявляющейся в способности к смене клеточного типа – трансдифференцировке. При наблюдении за этим процессом in vivo, мы обнаруживаем две различные стратегии поведения: конверсию в нейрональном и глиальном направлении при регенерации сетчатки у амфибий и в мезенхимном при патологии сетчатки у млекопитающих и человека. В направленных условиях in vitro РПЭ млекопитающих раздвигает рамки этих возможностей, демонстрируя конверсию в фенотипы, несущие пронейральные признаки. В основе механизмов конверсии in vivo в обеих стратегиях можно обнаружить сходство, например, в инициации процесса и сопряженных с нею изменений цитоскелета и ВКМ, в пролиферативной активности, способности к миграции клеток РПЭ. Однако имеет место ряд существенных отличий, прежде всего, в молекулярно-генетических регуляционных механизмах: работе ТФ, ростовых факторов и цитокинов, компонентов сигнальных путей, а также в отличающемся эпигенетическом ландшафте. Отметим, что все три ключевые системы регуляции находятся в динамическом взаимодействии. В этой связи, опора на одну из перечисленных систем вряд ли может помочь в понимании того, каким образом можно экспериментально менять стратегии конверсии РПЭ. В этой связи дальнейшие исследования биологии клеток РПЭ, феномена трансдифференцировки РПЭ, и связи ключевых регулирующих ее разноуровневых событий, необходимы.
ЗАКЛЮЧЕНИЕ
В данном обзоре, посвященном памяти О.Г. Строевой и В.И. Миташова, приведены полученные с помощью современных методов свидетельства, подтверждающие ранее заложенную ими в основе работы гипотезу о “переключении работы генов”, как базового явления процесса клеточной конверсии. За последние два десятилетия, осуществлены исследования, раскрывающие сложные молекулярные механизмы явления. Обнаружены ключевые гены и белки, определяющие исходную меланогенную, эпителиальную дифференцировку РПЭ и вновь возникающие при конверсии нейральную, глиальную и спектр мезенхимных дифференцировок как in vivo, так и in vitro. Определены системы внутриклеточных перестроек цитоскелета, клеточной поверхности и ВКМ, а также изменения молекулярных межклеточных взаимоотношений в слое РПЭ и с прилежащими тканями за его пределами. Выявлены регуляторные механизмы процесса конверсии РПЭ в терминах работы цитокинов, ростовых факторов и их сигнальных путей. И, наконец, начаты исследования изменений эпигенетического ландшафта и других условий экспрессии генов в ходе конверсии клеток РПЭ, в перспективе открывающих возможность экспериментального “переключения работы генов”. По-видимому, этот аспект изучения процесса трансдифференцировки, как и дальнейшее выстраивание сетей его регулирования, а также поиск их ключевых молекулярных участников – представляет собой логическое продолжение направления, заложенного в свое время О.Г. Строевой и В.И. Миташовым. Параллельные исследования стратегии трансдифференцировки клеток РПЭ в мезенхимном направлении у млекопитающих in vivo дают возможность не только сопоставления двух различных молекулярных стратегий РПЭ (ведущих к регенерации сетчатки у амфибий и патологии у млекопитающих), но и для попытки моделирования условий, пермиссивных для регенерации сетчатки и запрещающих развитие патологии.
Исследование регенерации сетчатки за счет РПЭ имеет и другие важные точки современных приложений. Оно необходимо для понимания способов репрограммирования in vivo (naturally regulated reprogramming), способов индукции мультипотентности, а также способов обретения клетками полноценной, стабилизированной нейральной дифференцировки. Важно, что клетки РПЭ у Urodela и высших позвоночных обнаруживают сходство по многим своим свойствам, а потому дальнейшее изучение и понимание сходств и отличий на молекулярном уровне двух различных стратегий конверсии клеток, имеющих один и тот же фенотип, более чем уместно. Оно, в свою очередь, требует введения в обиход дополнительных современных методов изучения, в том числе исследования транскриптомов отдельных клеток в динамике развития процесса трансдифференцировки, методов определения и индукции генетической и эпигенетической модификаций и других.
Список литературы
Авдонин П.П., Григорян Э.Н., Маркитантова Ю.В. Транскрипционный фактор Pitx2: локализация при регенерации сетчатки тритона // Изв. РАН. Сер. биол. 2010. Т. 435. № 3. С. 283–288 (Avdonin P.P., Grigoryan E.N., Markitantova Y.V. Transcriptional factor Pitx2: localization during newt retina regeneration // Biology Bulletin. 2010. V. 37. № 3. P. 231–235).
Авдонин П.П., Маркитантова Ю.В., Зиновьева Р.Д., Миташов В.И. Экспрессия регуляторных генов Pax6, Otx2, Six3 и FGF2 в процессе регенерации сетчатки у тритона // Изв. РАН. Сер. биол. 2008. № 4. С. 414–421 (Avdonin P.P., Markitantova Yu.V., Zinovieva R.D., Mitashov V.I. Expression of regulatory genes Pаx6, Otx2, Six3, and FGF2 during newt retina regeneration // Biology Bulletin. 2008. V. 35. P. 355).
Григорян Э.Н. Полная отслойка сетчатки вызывает изменения экспрессии цитокератинов в клетках пигментного эпителия сетчатки у тритонов // Известия РАН. Сер. биологическая. 1995. № 4. С. 412–421 (Grigoryan E.N. The complete neural retina detachment induces the changes of cytokeratin expression in retinal pigmented epithelium cells in newts // Izv. Akad. Nauk Ser. Biol. № 4. P. 412–421).
Григорян Э.Н. Высокая регенерационная способность хвостатых амфибий (Urodela) как результат проявления половозрелыми животными ювенильных черт // Онтогенез. 2016. Т. 1. С. 83–92. (Grigoryan E.N. High regenerative ability of tailed amphibians (Urodela) as a result of the expression of juvenile traits be mature animals // Russian Journal of Developmental Biology. 2016. V. 47. № 2. P. 83–92).
Григорян Э.Н. Молекулярные факторы поддержания и активации “молодого фенотипа” клеток-источников регенерации тканей глаза // Биохимия. 2018. Т. 83. № 11. С. 1627–1642 (Grigoryan E.N. Molecular factors of the maintenance and activation of the juvenile phenotype of cellular sources for eye tissue regeneration // Biochemistry (Moscow). 2018. V. 83. P. 1627–1642).
Григорян Э.Н. Факторы компетенции клеток ретинального пигментного эпителия для репрограммирования в нейрональном направлении при регенерации сетчатки у тритона // Известия РАН. Серия биологическая. 2014. № 1. С. 5–16 (Grigoryan E.N. Competence factors of retinal pigment epithelium cells for reprogramming in the neuronal direction during retinal regeneration in newts // Izv. Akad. Nauk Ser. Biol. 2015. V. 1. P. 5–16).
Григорян Э.Н., Антон Г.Д. Появление и распределение белка нейрофиламентов НФ-200 в трансдифференцирующихся клетках пигментного эпителия и других клетках глаза в процессе регенерации сетчатки у тритонов // Онтогенез. 1993. Т. 24. № 4. С. 39–52 (Grigoryan E.N., Anton H.J. An appearance and distribution of neurofilament proteins (NF-200) in transdifferentiating retinal pigment cells and other eye cells during the process of neural retina regeneration in newts // Russian J. Developmental Biology. 1993. V. 24. № 4. P. 39–52).
Григорян Э.Н., Антон Г.Дж. Анализ экспрессии кератинов в клетках пигментного эпителия сетчатки в процессе их трансдифференцировки у тритонов // Онтогенез. 1995. Т. 26. № 4. С. 310–323. (Grigoryan E.N., Anton H.J. The appearance and distribution of the NF-200 neurofilament protein in transdifferentiating cells of the pigment epithelium and in other eye cells during retinal regeneration in tritons // Russian J. Developmental Biology. 1993. V. 24. № 4. P. 39–52).
Григорян Э.Н., Миташов В.И. Радиоавтографическое исследование пролиферации и синтеза меланина в клетках пигментного эпителия при регенерации глаза у тритонов // Онтогенез. 1979. Т. 10. № 2. С. 137–144 (Grigoryan E.N., Mitashov V.I. Radioautographic investigation of proliferation and melanin synthesis in retinal pigment epithelium cells during eye regeneration in newts // Russian J. Developmental Biology. 1979. V. 10. № 2. P. 137–144).
Григорян Э.Н., Дольникова А.Е., Белкин В.М. Распределение фибронектина в процессе трансдифференцировки и пролиферации клеток глаза после отслойки сетчатки и удаления хрусталика у тритонов // Онтогенез. 1990. Т. 21. № 4. С. 403–408 (Grigoryan E.N., Dol’nikova A.E., Belkin V.M. Fibronectin distribution during the transdifferentiation and proliferation of eye cells after retinal detachment and removal of the crystalline lens in newts // Russian J. Developmental Biology. 1990. V. 21. P. 403–408).
Кузнецова А.В., Григорян Э.Н., Александрова М.А. Ретинальный пигментный эпителий глаза взрослого человека – потенциальный источник клеток для восстановления сетчатки // Цитология. 2011. Т. 53. С. 505–512 (Kuznetsova A.V., Grigoryan E.N., Aleksandrova M.A. Human adult retinal pigment epithelial cells as potential cell source for retina recovery // Cell Tissue Biol. 2011. V. 5. № 5. P. 495–502).
Лопашов Г.В., Строева О.Г. Развитие глаза в свете экспериментальных исследований. М.: Изд. АН СССР. 1963. 205 с.
Маркитантова Ю.В., Авдонин П.П., Григорян Э.Н., Зиновьева Р.Д. Идентификация в регенерирующей сетчатке тритона гена-регулятора эмбриогенеза Pitx1 // Доклады академии наук. 2010. Т. 435. № 3. С. 420–423 (Markitantova Yu.V., Avdonin P.P., Grigoryan E.N., Zinovieva R.D. Identification of the Pitx1 embryogenesis regulatory gene in a regenerating newt retina // Doklady Biological Sciences. 2010. V. 435(1): 421–424). https://doi.org/10.1134/S0012496610060141
Маркитантова Ю.В., Авдонин П.П., Григорян Э.Н. Компоненты сигнального пути FGF2 в тканях заднего сектора у взрослых тритонов Pleurodeles waltl // Изв. РАН. Сер. биол. 2014. 41. С. 297–305 (Markitantova Yu.V., Avdonin P.P., Grigoryan E.N. FGF2 signaling pathway components in tissues of the posterior eye sector in the adult newt Pleurodeles waltl // Biol. Bull. 2014. V. 41. P. 297–305).
Маркитантова Ю.В., Авдонин П.П., Григорян Э.Н. Экспрессия нуклеостемина в процессе репрограммирования in situ клеток пигментного эпителия глаза при регенерации сетчатки у взрослого тритона // Цитология. 2014. Т. 56. № 9. С. 671–672.
Маркитантова Ю.В., Авдонин П.П., Григорян Э.Н. Идентификация гена нуклеостемина в тканях глаза взрослого тритона Pleurodeles waltl // Известия РАН. Сер. биол. 2015. № 5. С. 453–460.
Маркитантова Ю.В., Макарьев Е.О., Смирнова Ю.А., Зиновьева Р.Д., Миташов В.И. Исследование паттерна экспрессии регуляторных генов Pax6, Prox1 и Six3 в ходе регенерации структур глаза тритона // Известия РАН. Сер. биол. 2004. № 5. С. 522–531 (Markitantova Yu.V., Makar’ev E.O., Smirnova Yu.A., Zinov’eva R.D., Mitashov V.I. Analysis of the expression pattern of regulatory genes Pax6, Prox1, and Six3 during regeneration of eye structures in the newt // Izv. Akad. Nauk Ser. Biol. 2004. (5): 522–531).
Маркитантова Ю.В., Поплинская В.А., Григорян Э.Н. Реорганизация хроматина в процессе репрограммирования пигментного эпителия при регенерации сетчатки тритона // Материалы международной конференции Хромосома-2015. С. 123–124.
Маркитантова Ю.В., Симирский В.Н. Роль редокс-системы в инициации регенерационного ответа нейральных тканей глаза позвоночных // Онтогенез. 2020. Т. 51. № 1. С. 19–34. (Markitantova Yu.V., Simirskii V.N. Role of the redox system in initiation of a regenerative response of neural eye tissues in vertebrates // Russian J. Developmental Biology. 2020. V. 51. № 1. P. 16–30).https://doi.org/10.1134/S106236042001004X
Миташов В.И. Динамика синтеза ДНК в пигментном эпителии в процессе восстановления глаза после хирургического удаления сетчатки у взрослых гребенчатых тритонов (Triturus cristatus) // Цитология. 1969а. Т. 11. № 4. С. 434–446.
Миташов В.И. Характеристика митотических циклов клеток пигментного эпителия и зачатка сетчатки у взрослых тритонов (Triturus cristatus, Triturus taeniatus) // Докл. АН СССР. 1969б. Т. 189. № 3. С. 666–669.
Миташов В.И. Динамика синтеза ДНК в клетках пигментного эпителия взрослых тритонов при восстановлении глаза после перерезки зрительного нерва и кровеносных сосудов // Цитология. 1970. Т. 12. № 12. С. 1521–1529.
Миташов В.И. Пролиферация клеток пигментного эпителия сетчатки взрослых тритонов на поздних стадиях восстановления удаленной сетчатки // Онтогенез. 1974. Т. 5. № 1. С. 80–83.
Милюшина Л.А., Кузнецова А.В., Григорян Э.Н., Александрова М.А. Фенотипическая пластичность клеток ретинального пигментного эпителия глаза взрослого человека in vitro // Клеточные технол. биол. мед. 2009. Т. 2. С. 71–76.
Николаев А.А., Маркитантова Ю.В., Григорян Э.Н. Характеристика некоторых молекулярно-генетических и эпигенетических событий при регенерации сетчатки у Urodella путем репрограммирования РПЭ // Гены и клетки. 2017. Т. 12. № 3. С. 178.
Николаев А.А. Эпигенетические особенности репрограммирования пигментного эпителия при регенерации сетчатки глаза после фотоиндуцированной отслойки у тритона Pleurodeles waltl // Выпускная квалификационная работа бакалавра. М.: МГУ, 2018. 92 с.
Новикова Ю.П., Поплинская В.А., Алейникова К.С., Григорян Э.Н. Исследование локализации накопления клеток в S-фазе в сетчатке глаза тритона Pleurodeles waltlii после искусственной отслойки от пигментного эпителия // Онтогенез. 2008. Т. 39. № 2. С. 143–150 (Novikova I.P., Poplinskaia V.A., Aleinikova K.S., Grigorian E.N. A study of the localization and accumulation of S-phase cells in the retina of newt Pleurodeles waltl after experimental pigment epithelial detachment // Russian J. Developmental Biology. 2008. V. 39. P. 116–121).
Панова И.Г. Цитоструктура и цитохимия пигментного эпителия сетчатки // Изв. РАН. Сер. биол. 1993. № 2. С. 165–190.
Панова И.Г. Межфоторецепторный матрикс: развитие, состав и функциональное значение // Онтогенез. 1994. Т. 25. № 1. С. 5–12.
Ржанова Л.А., Кузнецова А.В., Александрова М.А. Репрограммирование дифференцированного ретинального пигментного эпителия млекопитающих и человека: современные достижения и перспективы // Онтогенез. 2020. Т. 51. № 4. С. 254–274 (Rzhanova L.A., Kuznetsova A.V., Aleksandrova M.A. Reprogramming of differentiated mammalian and human retinal pigment epithelium: current achievements and prospects // Russian J. Developmental Biology. 2020. V. 51. № 4. P. 212–230).
Свистунов С.А., Миташов В.И. Радиоавтографическое исследование пролиферации клеток пигментного эпителия сетчатки у альбиносов шпорцевых лягушек // Онтогенез. 1983. Т. 14. С. 382–389.
Строева О.Г. Морфогенез и врожденные аномалии глаза млекопитающих. М.: Наука, 1971. 242 с.
Строева О.Г. Наследственные и экзогенные колобомы сетчатки и нормальный морфогенез глаза // Журн. общ. биол. 1961. Т. 22. С. 436–443.
Строева О.Г., Миташов В.И. Дифференцировка и дедифференцировка пигментированных частей глаза позвоночных животных при метаплазии // Метаплазия тканей. М.: Наука, 1970. С. 93–105.
Строева О.Г. Превращение пигментного эпителия в сетчатку на продвинутых стадиях эмбриогенеза крыс // Докл. Акад. Наук СССР. 1962. Т. 143. С. 991–993.
Синицина В.Ф. Синтез ДНК и кинетика клеточных популяций при эмбриональном гистогенезе сетчатки мыши // Архив. анат., гистол., эмбриол. 1971. Т. 61. № 6. С. 58–67.
Шафеи Е.В., Куринов А.М., Кузнецова А.В., Александрова М.А. Репрограммирование клеток ретинального пигментного эпителия человека под влиянием bFGF in vitro // Клеточные технологии в биологии и медицине. 2017. № 2. С. 128–136 (Shafei E.V., Kurinov A.M., Kuznetsova A.V., Aleksandrova M.A. Reprogramming of human retinal pigment epithelial cells under the effect of bFGF in vitro // Bulletin of Experimental Biology and Medicine. 2017. V. 163. 4. P. 574–582). https://doi.org/10.1007/s10517-017-3852-5
Шафеи Е.В., Ржанова Л.А., Новикова Ю.П., Куринов А.М., Григорян Э.Н., Александрова М.А., Кузнецова А.В. Ответ клеток ретинального пигментного эпителия человека на воздействие кондиционированных сред регенератов сетчаток тритона // Цитология. 2020. Т. 62. № 9. С. 728–743 (Shafei E.V., Rzhanova L.A., Novikova Y.P., Kurinov A.M., Grigoryan E.N., Aleksandrova M.A., Kuznetsova A.V. Response of human retinal pigment epithelial cells to the effect of the conditioned media of newt retinal regenerates // Tsitologiya. 2020. V. 62. № 9. P. 638–653).
Abe T., Sato M., Tamai M. Dedifferentiation of the retinal pigment epithelium compared to the proliferative membranes of proliferative vitreoretinopathy // Curr. Eye Res. 1998. V. 17. № 12. P. 1103–1109.
Abu El-Asrar A.M., van den Steen P.E., Al-Amro S.A. et al. Expression of angiogenic and fibrogenic factors in proliferative vitreoretinal disorders // Int. Ophthalmol. 2007. V. 27. P. 11–22.
Abu El-Asrar A.M., Midena E., Al-Shabrawey M., Mohammad G. New developments in the pathophysiology and management of diabetic retinopathy // J. Diabetes Res. V. 2013. P. 2013: 424258.
Alge C.S., Suppmann S., Priglinger S.G. et al. Comparative proteome analysis of native differentiated and cultured dedifferentiated human RPE cells // Invest. Ophthalmol. Vis. Sci. 2003. V. 44. № 8. P. 3629–3641.
Ahlstromand J.D., Erickson C.A. The neural crest epithelial mesenchymal transition in 4D: a “tail” of multiple non-obligatory cellular mechanisms // Development. 2009. V. 136. №. 11. P. 1801–1812.
Aldiri I., Xu B., Wang L. et al. The dynamic epigenetic landscape of the retina during development, reprogramming, and tumorigenesis // Neuron. 2017. V. 94. № 3. P. 550–568.
Al-Hussaini H., Vugler A., Semo M., Jeffery G. Mature mammalian retinal pigment epithelium cells proliferate in vivo // Mol. Vis. 2008. V. 14. P. 1784–1791.
Alvarado S.A., Tsonis P.A. Bridging the regeneration gap: Genetic insights from diverse animal models // Nat. Rev. Genet. 2006. V. 7. P. 873–884.
Araki M. Regeneration of the amphibian retina: role of tissue interaction and related signaling molecules on RPE transdifferentiation // Develop. Growth Differ. 2007. V. 49. № 2. P. 109–120.
Asato R., Yoshida S., Ogura A., Nakama T., Ishikawa K., Nakao S., Sassa Y., Enaida H., Oshima Y., Ikeo K. et al. Comparison of gene expression profile of epiretinal membranes obtained from eyes with proliferative vitreoretinopathy to that of secondary epiretinal membranes // PLoS One. 2013. V. 8. e54191.
Azuma N., Tadokoro K., Asaka A. et al. Transdifferentiation of the retinal pigment epithelia to the neural retina by transfer of the Pax6 transcriptional factor // Hum. Mol. Genet. 2005. V. 14. № 8. P. 1059–1068.
Basinski B.W., Balikov D.A., Aksu D., Li Q., Rao R.C. Ubiquitous chromatin modifiers in congenital retinal diseases: Implications for disease modeling and regenerative medicine // Trends in Molecular Medicine. 2021. In press.
Benayoun B.A., Caburet S., Veitia R.A. Forkhead transcription factors: key players in health and disease // Trends Genet. 2011. V. 27. P. 224–232. https://doi.org/10.1016/j.tig.2011.03.003
Bharti K., Nguyen M.T., Skuntz S., Bertuzzi S., Arnheiter H. The other pigment cell: specification and development of the pigmented epithelium of the vertebrate eye // Pigment Cell Res. 2006. V. 19. P. 380–394.
Biscotti M.A., Carducci F., Barucca M. et al. The transcriptome of the newt Cynops orientalis provides new insights into evolution and function of sexual gene networks in sarcopterygians // Sci. Rep. 2020. V. 10. P. 5445.
Blenkinsop T.A., Saini J.S., Maminishkis A. et al. Human adult retinal pigment epithelial stem cell–derived RPE monolayers exhibit key physiological characteristics of native tissue // Invest. Ophthalmol. Vis. Sci. 2015. V. 56. № 12. P. 7085–7099.
Blenkinsop T.A., Salero E., Stern J.H., Temple S. The culture and maintenance of functional retinal pigment epithelial monolayers from adult human eye // Methods Mol. Biol. 2013. V. 945. P. 45–55.
Bochaton-Piallat M.L., Kapetanios A.D., Donati G. et al. TGF-beta1, TGF-beta receptor II and ED-A fibronectin expression in myofibroblast of vitreoretinopathy // Invest. Ophthalmol. Vis. Sci. 2000. V. 41. P. 2336–2342.
Boles N., Fernandes M., Swigut T., Srinivasan R. et al. Epigenomic and transcriptomic changes during human RPE EMT in a stem cell model of epiretinal membrane pathogenesis and prevention by nicotinamide // Stem Cell Reports. 2020. V. 14. P. 631–647.
Bonnans C., Chou J., Werb Z. Remodelling the extracellular matrix in development and disease // Nature Reviews Molecular Cell Biology. 2014. V. 15. P. 786–801.
Bruckskotten M., Looso M., Reinhardt R., Braun T., Borchardt T. Newt-omics: a comprehensive repository for omics data from the newt Notophthalmus viridescens // Nucleic Acids Res. 2012. V. 40 (Database issue). P. D895–D900.
Buchholz D.E., Pennington B.O., Croze R.H., Hinman C.R., Coffey P.J. et al. Rapid and efficient directed differentiation of human pluripotent stem cells into retinal pigmented epithelium // Stem Cells Transl. Med. 2013. V. 2. P. 384–393. https://doi.org/10.5966/sctm.2012-0163
Burke J.M. Epithelial phenotype and the RPE: Is the answer blowing in the Wnt? // Prog. Retin. Eye Res. 2008. V. 27. № 6. P. 579–595.
Burke J.M., Hjelmeland L.M. Mosaicism of the retinal pigment epithelium: seeing the small picture // Mol. Interv. 2005. V. 5. P. 241.
Burke J.M., Skumatz C.M., Irving P.E., McKay B.S. Phenotypic heterogeneity of retinal pigment epithelial cells in vitro and in situ // Exp. Eye Res. 1996. V. 62. P. 63–73.
Casaroli-Marano R.P., Pagan R., Vilaro S. Epithelial-mesenchymal transition in proliferative vitreoretinopathy: intermediate filament protein expression in retinal pigment epithelial cells // Invest. Ophthalmol. Vis. Sci. 1999. V. 40. P. 2062–2072.
Casco-Robles M.M., Islam M.R., Inami W. et al. Turning the fate of reprogramming cells from retinal disorder to regeneration by Pax6 in newts // Sci. Rep. 2016. V. 6. P. 33 761.
Chen T., Dent S.Y.R. Chromatin modifiers: regulators of cellular differentiation // Nat. Rev. Genet. 2014. V. 15. № 2. P. 93–106.
Chen Z., Shao Y., Li X. The roles of signaling pathways in epithelial-to-mesenchymal transition of PVR // Mol. Vis. 2015. V. 21. P. 706–710.
Chen H.C., Zhu Y.T., Chen S.Y., Tseng S.C. Wnt signaling induces epithelial-mesenchymal transition with proliferation in ARPE-19 cells upon loss of contact inhibition // Lab. Invest. 2012. V. 92. P. 676–687.
Chen X., Muller G.A., Quaas M., Fischer M., Han N. et al. The forkhead transcription factor FOXM1 controls cell cycle-dependent gene expression through an atypical chromatin binding mechanism // Mol. Cell. Biol. 2013. V. 33. P. 227–236. https://doi.org/10.1128/MCB.00881-12
Chiba C. The retinal pigment epithelium: An important player of retinal disorders and regeneration // Exp. Eye Res. 2014. V. 123. P. 107–114.
Chiba C., Mitashov V.I. Cellular and molecular events in the adult newt retinal regeneration // Strategies for Retinal Tissue Repair and Regeneration in Vertebrates: From Fish to Human (Chiba Ch., ed.), Research Signpost, Kerala, India. 2007. P. 15–33.
Chiba C., Hoshino A., Nakamura K. et al. Visual cycle protein RPE65 persists in new retinal cells during retinal regeneration of adult newt // J. Com. Neurol. 2006. V. 495. P. 391–407.
Choudhary P., Dodsworth B.T., Sidders B., Gutteridge A., Michaelides C., Duckworth J.K. et al. A FOXM1 dependent mesenchymal-epithelial transition in retinal pigment epithelium cells // PLoS One. 2015. 10(6): e0130379. https://doi.org/10.1371/journal.pone.0130379
Chow R.L., Lang R.A. Early eye development in Vertebrates // Annu. Rev. Cell Dev. Biol. 2001. V. 17. P. 255–262.
Chtcheglova L.A., Ohlmann A., Boytsov D. et al. Nanoscopic approach to study the early stages of epithelial to mesenchymal transition (EMT) of human retinal pigment epithelial (RPE) cells in vitro // Life (Basel). 2020. V. 10. № 8. P. 128.
Connor T.B., Jr., Roberts A.B., Sporn M.B. et al. Correlation of fibrosis and transforming growth factor-beta type 2 levels in the eye // J. Clin. Invest. 1989. V. 83. P. 1661–1666.
Corso-Díaz X., Jaeger C., Chaitankar V., Swaroop A. Epigenetic control of gene regulation during development and disease: A view from the retina // Prog. Retin. Eye Res. 2018. V. 65. P. 1–27.
Davis R.L., Weintraub H., Lassar A.B. Expression of a single transfected cDNA converts fibroblasts to myoblasts // Cell. 1987. V. 51. P. 987–1000.
Defoe D.M., Grindstaff R.D. Epidermal growth factor stimulation of RPE cell survival: Contribution of phosphatidylinositol 3-kinase and mitogen-activated protein kinase pathways // Exp. Eye Research. 2004. V. 79. № 1. P. 51–59.
Du L., Yamamoto S., Burnette B.L., Huang D., Gao K., Jamshidi N., Kuo M.D. Transcriptome profiling reveals novel gene expression signatures and regulating transcription factors of TGFbeta-induced epithelial-to-mesenchymal transition // Cancer Med. 2016. V. 5. P. 1962–1972.
Durairaj C., Chastain J.E., Kompella U.B. Intraocular distribution of melanin in human, monkey, rabbit, minipig and dog eyes // Exp. Eye Res. 2012. V. 98. № 1. P. 23–27.
Dvashi Z., Goldberg M., Adir O. et al. TGF-β1 induced transdifferentiation of RPE cells is mediated by TAK1 // PLoS One. 2015. 10:e0122229.
Dvoriantchikova D., Seemungal R.J., Ivanov D. The epigenetic basis for the impaired ability of adult murine retinal pigment epithelium cells to regenerate retinal tissue // Sci. Rep. 2019. V. 9. P. 3860.
Eguchi G. Transdifferentiation in pigmented epithelial cells of vertebrate eyes in vitro // Mechanisms of Cell Change / Еds. Ebert J.D., Okada T.S. N.Y. Wiley, 1979. Р. 273–291.
Eguchi G. // Transdifferentiation and instability in cell commitment / Еds. Okada T.S., Kondoh H. Yamada Science Foundation, 1986. 433 p.
Engelhardt M., Bogdahn U., Aigner L. Adult retinal pigment epithelium cells express neural progenitor properties and the neuronal precursor protein doublecortin // Brain Res. 2005. V. 1040. P. 98–111.
Evans A.L., Gage P.J. Expression of the homeobox gene Pitx2 in neural crest is required for optic stalk and ocular anterior segment development // Hum. Mol. Genet. 2005. V. 14. № 22. P. 3347–3359. Epub 2005 Oct 3.https://doi.org/10.1093/hmg/ddi365
Faktorovich E., Steinberg R., Yasumura D. et al. Basic fibroblast growth factor and local injury protect photoreceptors from light damage in the rat // J. Neuroscience. 1992. V. 12. № 9. P. 3554–3560.
Farjood F., Vargis E. Physical disruption of cell–cell contact induces VEGF expression in RPE cells // Mol. Vis. 2017. V. 23. P. 431–446.
Faunes F., Gundermann D.G., Munoz R. et al. The heterochronic gene Lin28 regulates amphibian metamorphosis through disturbance of thyroid hormone function // Dev. Biol. 2017. V. 425. P. 142–151.
Feist R.M., Jr., King J.L., Morris R., Witherspoon C.D., Guidry C. Myofibroblast and extracellular matrix origins in proliferative vitreoretinopathy // Graefes. Arch. Clin. Exp. Ophthalmol. 2014. V. 252. P. 347–357.
Fernґandez-Robredo P., Sancho A., Johnen S. et al. Current treatment limitations in age-related macular degeneration and future approaches based on cell therapy and tissue engineering // J. Ophthalmology. 2014. Article ID510285. P. 13.
Flood M.T., Gouras P., Kjeldbye H. Growth characteristics and ultrastructure of human retinal pigment epithelium in vitro // Invest. Ophthalmol. Vis. Sci. 1980. P. 19. P. 1309–1320.
Fuchs H.R., Meister P., Lotke R., Framme C. The microRNAs miR-302d and miR-93 inhibit TGFB-mediated EMT and VEGFA secretion from ARPE-19 cells // Exp. Eye Res. 2020. V. 201. P. 108258.
Fuhrmann S., Zou C.J., Levine E.M. Retinal pigment epithelium development, plasticity, and tissue homeostasis // Exp. Eye Res. 2014. V. 0: 141–150.
Galy A., Nґeron B., Planque N., Saule S., Eychéne A. Activated MAPK/ERK kinase (MEK-1) induces transdifferentiation of pigmented epithelium into neural retina // Dev. Biol. 2002. V. 248. № 2. P. 251–264.
Garcia-Ramírez M., Hernández C., Villarroel M. et al. Interphotoreceptor retinoid-binding protein (IRBP) is downregulated at early stages of diabetic retinopathy // Diabetologia. 2009. V. 52. № 12. P. 2633–2641.
Gallina D., Palazzo I., Steffenson L. et al. Wnt/в-catenin-signaling and the formation of Muller glia-derived progenitors in the chick retina // Dev. Neurobiol. 2016. V. 76. № 9. P. 983–1002.
Garweg J.G., Tappeiner C., Halberstadt M. Pathophysiology of proliferative vitreoretinopathy in retinal detachment // Survey of Ophthalmology. 2013. V. 58. P. 321–329.
Geller S.F., Lewis G.P., Fisher S.K. FGFR1, signaling, and AP-1 expression after retinal detachment: Reactive Muller and RPE cells // Invest. Ophthalmol. Vis. Sci. 2001. V. 42. P. 1363–1369.
Georgiadis A., Tschernutter M., Bainbridge J.W.B. et al. The tight junction associated signalling proteins ZO-1 and ZONAB regulate retinal pigment epithelium homeostasis in mice // PLoS One. 2010. V. 5. № 12. P. e15730.
Grigoryan E.N. Shared triggering mechanisms of retinal regeneration in lower vertebrates and retinal rescue in higher ones // Tissue Regeneration – from Basic Biology to Clinical Application / Ed. Davies J. In Tech. Croatia, 2012. P. 145–164.
Grigoryan E.N. Potential endogenous cell sources for retinal regeneration in vertebrates and humans: Progenitor traits and specialization // Biomedicines. 2020. V. 8. P. 208.
Grigoryan E.N. Study of natural longlife juvenility and tissue regeneration in caudate amphibians and potential application of resulting data in biomedicine // J. Dev. Biol. 2021. V. 9. P. 2.
Grigoryan E.N., Markitantova Y.V. Cellular and molecular preconditions for retinal pigment epithelium (RPE) natural reprogramming during retinal regeneration in Urodela // Biomedicines. 2016. V. 4. P. 10–28.
Graw J. Eye development // Curr. Top. Dev. Biol. 2010. V. 90. P. 343–386. https://doi.org/10.1016/S0070-2153(10)90010-0
Gurdon J.B. The developmental capacity of nuclei taken from intestinal epithelium cells of feeding tadpoles // J. Embryol. Exp. Morphol. 1962. V. 10. P. 622–640.
Han J.W., Lyu J., Park Y.J. et al. Wnt/β-catenin signaling mediates regeneration of retinal pigment epithelium after laser photocoagulation in mouse eye // Invest. Ophthalmol. Vis. Sci. 2015. V. 56. P. 8314–8324.
Hasegawa M. Restitution of the eye after removal of the retina and lens in the newt Triturus pyrrhogaster // Embryologia. 1958. V. 4. P. 1–32.
Hay E.D. The mesenchymal cell, its role in the embryo, and the remarkable signaling mechanisms that create it // Dev. Dynamics. 2005. V. 233. № 3. P. 706–720.
Hayashi T., Carthew R.W. Surface mechanics mediate pattern formation in the developing retina // Nature. 2004. V. 7. № 431(7009):647-52. https://doi.org/10.1038/nature02952
Haynes T., Luz-Madrigal A., Reis E.S. et al. Complement anaphylatoxin C3a is a potent inducer of embryonic chick retina regeneration // Nat. Commun. 2013. V. 4. P. 2312.
Hecquet C., Lefevre G., Valtink M. et al. Activation and role of MAP kinase-dependent pathways in retinal pigment epithelial cells: ERK and RPE cell proliferation // Invest. Ophthalmol. Vis. Sci. 2002. V. 43. P. 3091–3098.
Hiscott P., Sheridan C., Magee R.M., Grierson I. Matrix and the retinal pigment epithelium in proliferative retinal disease // Prog. Ret. Eye Res. 1999. V. 18. P. 167–190.
Holliday R. Epigenetics: a historical overview // Epigenetics. 2006. V. 1. P. 76–80.
Hu J., Bok D. A cell culture medium that supports the differentiation of human retinal pigment epithelium into functionally polarized monolayers // Mol. Vis. 2001. V. 7. P. 14–19.
Hua X., Liu X., Ansari D.O., Lodish H.F. Synergistic cooperation of TFE3 and smad proteins in TGF-beta-induced transcription of the plasminogen activator inhibitor-1 gene // Genes Dev. 1998. V. 12. P. 3084–3095.
Huang X., Wei Y., Ma H., Zhang S. Vitreous-induced cytoskeletal rearrangements via the Rac1 GTPase-dependent signaling pathway in human retinal pigment epithelial cells // Biochemical and Biophysical Research Communications. 2012. V. 419. № 2. P. 395–400.
Idrees S., Sridhar J., Kuriyan A.E. Proliferative vitreoretinopathy: A review // Int. Ophthalmol. Clin. 2019. V. 59. № 1. P. 221–240.
Imamichi Y., Menke A. Signaling pathways involved in collagen-induced disruption of the E-cadherin complex during epithelial-mesenchymal transition // Cells Tissues Organs. 2007. V. 185. № 1–3. P. 180–190.
Islam M.R., Nakamura K., Casco-Robles M.M. et al. The newt reprograms mature RPE cells into a unique multipotent state for retinal regeneration // Sci. Rep. 2014. V. 4. P. 6043.
Ishida W., Mori Y., Lakos G. et al. Intracellular TGF-β receptor blockade abrogates smad-dependent fibroblast activation in vitro and in vivo // J. Investigative Dermatology. 2006. V. 126. № 8. P. 1733–1744.
Itoh Y., Kimoto K., Imaizumi M., Nakatsuka K. Inhibition of RhoA/Rho-kinase pathway suppresses the expression of type I collagen induced by TGF-beta2 in human retinal pigment epithelial cells // Experimental Eye Research. 2007. V. 84. № 3. P. 464–472.
Jopling C., Sleep E., Raya M. et al. Zebrafish heart regeneration occurs by cardiomyocyte dedifferentiation and proliferation // Nature. 2010. V. 464. P. 606–609.
Jopling C., Boue S., Ispizua B.J.C. Dedifferentiation, transdifferentiation and reprogramming: three routes to regeneration // Nat. Rev. Mol. Cell Biol. 2011. V. 12. P. 79–89.
Kaneko J., Chiba Ch. Immunohistochemical analysis of Musashi-1 expression during retinal regeneration of adult newt // Neurosci. Lett. 2009. V. 450. P. 252–257.
Kaneko Y., Matsumoto G., Hanyu Y. The occurrence of apoptosis during retinal regeneration in adult newts // Brain Res. Dev. Brain Res. 1999. V. 117. № 2. P. 225–228.
Kaneko Y., Hirota K., Matsumoto G., Hanyu Y. Expression pattern of a newt Notch homologue in regenerating newt retina // Brain Res. Dev. Brain Res. 2001. V. 31. P. 1, 53–62, 128.
Kandyba E., Leung Y., Chen Y.B., Widelitz R., Chuong C.M. et al. Competitive balance of intrabulge BMP/Wnt signaling reveals a robust gene network ruling stem cell homeostasis and cyclic activation // Proc. Natl. Acad. Sci. USA. 2013. V. 110. P. 1351–1356. https://doi.org/10.1073/pnas.1121312110
Kang Y., Massague J. Epithelial-mesenchymal transitions: twist in development and metastasis // Cell. 2004. V. 118. P. 277–279.
Keefe J.R. An analysis of urodelean retinal regeneration // J. Exp. Zool. 1973. V. 184. P. 185–257.
Kiilgaard J.F., Prause J.U., Prause M. et al. Subretinal posterior pole injury induces selective proliferation of RPE cells in the periphery in in vivo studies in pigs // Invest. Ophthalmol. Vis. Sci. 2007. V. 48. № 1. P. 355–360.
Kigasawa K., Ishirawa H., Obazawa H., Minamoto T., Nagai Y., Tanaka Y. Collagen production by cultured human retinal pigment epithelial cells // Tokai J. Experimental and Clinical Medicine. 1998. V. 23. № 3. P. 147–151.
Kimoto K., Nakatsuka K.., Matsuo N., Yoshioka H. p38 MAPK mediates the expression of type I collagen induced by TGF-beta 2 in human retinal pigmented epithelial cells ARPE-19 // Invest. Ophthalmol. Vis. Sci. 2004. V. 45. V. 2431–2437.
Kimura Y., Madhavan M., Call M.K. et al. Expression of complement 3 and complement 5 in newt limb and lens regeneration // J. Immunol. 2003. V. 170. P. 2331–2339.
Kirchhof B., Sorgente N. Pathogenesis of proliferative vitreoretinopathy. Modulation of retinal pigment epithelial cell functions by vitreous and macrophages // Dev. Ophthalmol. 1989. V. 16. P. 1–53.
Kita T., Hata Y., Arita R., Kawahara S., Miura M., Nakao S., Mochizuki Y., Enaida H., Goto Y., Shimokawa H., Hafezi-Moghadam A., Ishibashi T. Role of TGF-beta in proliferative vitreoretinal diseases and ROCK as a therapeutic target // Proc. Natl. Acad. Sci. USA. 2008. V. 105. P. 17504–17509.
Kuznetsova A.V., Grigoryan E.N., Aleksandrova M.A. Human adult retinal pigment epithelial cells as potential cell source for retina recovery // Cell Tissue Biol. 2011. V. 5. № 5. P. 495–502.
Kuznetsova A.V., Kurinov A.M., Aleksandrova M.A. Cell models to study regulation of cell transformation in pathologies of retinal pigment epithelium // J. Ophthalmol. 2014. V. 2014. https://doi.org/10.1155/2014/801787
Korthagen N.M., van Bilsen K., Swagemakers S.M., van de Peppel J., Bastiaans J., van der Spek P.J., van Hagen P.M., Dik W.A. Retinal pigment epithelial cells display specific transcriptional responses upon TNF-alpha stimulation // Br. J. Ophthalmol. 2015. V. 99. P. 700–704.
Lazarus H., Hageman G. Xyloside-induced disruption of inferphororeceptor matrix proteoglycans results in retinal detachment // Invest. Ophthalmol. Vis. Sci. 1992. V. 33. № 2. P. 364–376.
Lee S.C., Kwon O.W., Seong G.J. et al. Epithelio-mesenchymal transdifferentiation of cultured RPE cells // Ophthalmic Res. 2001. V. 33. P. 80–86.
Lee H., O’Meara S.J., O’Brien C., Kane R. The role of gremlin, a BMP antagonist, and epithelial-to-mesenchymal transition in proliferative vitreoretinopathy // Invest. Ophthalmol. Vis. Sci. 2007. V. 48. P. 4291–4299.
Li J., Tang X., Chen X. Comparative effects of TGF-β2/Smad2 and TGFβ2/Smad3 signaling pathways on proliferation, migration, and extracellular matrix production in a human lens cell line // Exp. Eye. Res. 2011. V. 92. P. 173–179.
Li S., Zhang H., Wang A. et al. Differentiation of adult human retinal pigment epithelial cells into dopaminergic-like cells in vitro and in the recipient monkey brain // Mol. Med. 2019. V. 25. P. 9.
Li M., Li H., Liu X. et al. MicroRNA-29b regulates TGF-β1-mediated epithelial- mesenchymal transition of retinal pigment epithelial cells by targeting AKT2 // Exp. Cell. Res. 2016. V. 345. P. 115–124.
Lopashov G.V., Stroeva O.G. Morphogenesis of the Vertebrate eye // Advances in Morphogenesis. Academic Press: N.Y. USA; London. UK, 1961. V. 1. P. 231–377.
Lynn S.A., Gareth W., Keeling E., Scott J.A., Cree A.J., Johnston D.A., Page A., Cuan-Urquizo E., Bhaskar A., Grossel M.C., Tumbarello D.A., Newman T.A., Lotery A.J., Ratnayaka J.A. Ex-vivo models of the Retinal Pigment Epithelium (RPE) in long-termculture faithfully recapitulate key structural and physiologicalfeatures of native RPE // Tissue and Cell. 2017. V. 49. P. 447–460.
Lopez P.F., Yan Q., Kohen L. et al. Retinal pigment epithelial wound healing in vivo // Arch. Ophthalmol. 1995. V. 113. P. 1437–1446.
Maeda M., Johnson K.R., Wheelock M.J. Cadherin switching: essential for behavioral but not morphological changes during an epithelium-to-mesenchyme transition // J. Cell Sci. 2005. V. 118. P. 873–887.
Maki N., Suetsugu-Maki R., Tarui H., Agata K., Del Rio-Tsonis K., Tsonis P.A. Expression of stem cell pluripotency factors during regeneration in newts // Dev. Dyn. 2009. V. 238(6):1613-6. https://doi.org/10.1002/dvdy.21959
Markitantova Yu., Makariev E., Pavlova G., Zinovieva R.D., Mitashov V. Location of the Prox1 gene expression during newt lens and retina regeneration // Doklady Biological Sciences. 2003. V. 391. № 4. P. 361–364. https://doi.org/10.1023/A:1025119121348
Markitantova Yu.V., Makar’ev E.O., Smirnova Yu.A., Zinovieva R.D., Mitashov V.I. Study of expression pattern of regulatory Genes Rax6, Rrox1, and Six3 during regeneration of newt eye structures // Izv. Akad. Nauk. Ser. Biol. 2004. № 5. P. 522–531.
Markitantova Y.V., Novikova Y.P., Poplinskaya V.A., Grigo-ryan E.N. Expression of FGF2 and nucleostemin in models of retinal regeneration in the newt under conditions of 3D organotypic culture in vitro // EC Ophthalmology. 2020. V. 10. № 12. P. 01–09. https://doi.org/10.31080/ecop.2020.11.00580
Markitantova Yu.V., Simirskii V.N. Inherited retinal diseases through the eyes of homeobox genes // Int. J. Mol. Sci. 2020. V. 21. № 5. P. 1602. https://doi.org/10.3390/ijms21051602
Mercer S.E., Cheng C-H., Atkinson D.L., Krcmery J., Guzman C.E., Kent D.T. et al. Multi-tissue microarray analysis identifies a molecular signature of regeneration // PLoS ONE. 2012. V. 7. № 12: e52375. https://doi.org/10.1371/journal.pone.0052375
Merell A.J., Stanger B.Z. Adult cell plasticity in vivo: transdifferentiation is back in style // Nat. Rev. Mol. Cell Biol. 2016. V. 17. № 7. P. 413–425.
Meyers J.R., Hu L., Moses A. et al. β-Catenin/Wnt signaling controls progenitor fate in the developing and regenerating zebrafish retina // Neural. Dev. 2012. V. 24. № 7. P. 30.
Mills J.C., Stanger B.Z., Sander M. Nomenclature for cellular plasticity: are the terms as plastic as the cells themselves? // EMBO J. 2019. V. 38. P. e103148.
Milyushina L.A., Kuznetsova A.V., Grigoryan E.N., Aleksandrova M.A. Phenotypic plasticity of retinal pigment epithelial cells from adult human eye in vitro // Bull. Exp. Biol. Med. 2011. V. 151. № 4. P. 506–511.
Milyushina L.A., Verdiev B.I., Kuznetsova A.V., Aleksandrova M.A. Expression of multipotent and retinal markers in pigment epithelium of adult human in vitro // Bull. Exp. Biol. Med. 2012. V. 153. P. 157.
Mirabella A.C., Foster B.M., Bartke T. Chromatin deregulation in disease // Chromosoma. 2016. V. 125. P. 75–93.
Mitashov V.I. Mechanisms of retina regeneration in vertebrates // Int. J. Develop. Biol. 1996. V. 40. P. 833–844.
Mitashov V.I. Retinal regeneration in amphibians // Int. J. Develop. Biol. 1997. V. 41. P. 893–905.
Mitashov V.I. Patterns of changes in mitotic cycles during cell transformation and regeneration in lower vertebrates // Tsitologiia. 1980. V. 2. P. 371–380.
Mitashov V.I. Arsanto J.P., Markitantova Y.V., Thouveny Y. Remodelling processes during neural retina regeneration in adult urodeles: An immunohistochemical survey // Int. J. Develop. Biol. 1995a. V. 39. P. 993–1003.
Mitashov V.I. Expression of regulatory and tissue-specific genes controlling the regeneration potential of vertebrate eye tissues // Ontogenez. 2007. V. 38. № 4. P. 1–10.
Mizuno A., Yasumuro H., Yoshikawa T. et al. MEK-ERK signaling in adult newt retinal pigment epithelium cells is strengthened immediately after surgical induction of retinal regeneration // Neurosci. Lett. 2012. V. 523. P. 39–44.
Morescalchi F., Duse S., Gambicorti E. et al. Proliferative vitreoretinopathy after eye injuries: an overexpression of growth factors and cytokines leading to a retinal keloid // Mediators Inflamm. 2013. P. 269787.
Nakamura K., Chiba Ch. Evidence for Notch signaling involvement in retinal regeneration of adult newt // Brain Res. 2007. V. 1136. № 1. P. 28–42. https://pubmed.ncbi.nlm.nih.gov/17217933/ – affiliation-1
Nakamura K., Islam Md.R., Takayanagi M. et al. Transcriptome for the study of early processes of retinal regeneration in the adult newt Cynops pyrrhogaster // PLoS One. 2014. V. 9. № 10: e109831.
Nazarieh M., Wiese A., Will T., Hamed M., Helms V. Identification of key player genes in gene regulatory networks // BMC Syst. Biol. 2016. V. 10. P. 88.
Nieto M.A. The ins and outs of the epithelial to mesenchymal transition in health and disease // Annu. Rev. Cell Dev. Biol. 2011. V. 27. P. 347–376. https://doi.org/10.1146/annurev-cellbio-092910-154036
Nowoshilow S., Schloissnig S., Fei J.F. et al. The axolotl genome and the evolution of key tissue formation regulators // Nature. 2018. V. 554. P. 50–55.
Oliver V.F., van Bysterveldt K.A., Merbs S.L. Chapter 22 – epigenetics in ocular medicine // Medical Epigenetics. Academic press. 2016. P. 391–412.
Okada T.S. “Transdifferentiation” of cells from chick embryonic eye tissues in cell culture // Dev. Growth Differ. 1975. V. 17. P. 289–290.
Okada T.S. Cellular metaplasia or transdifferentiation as a model for retinal cell differentiation // Curr. Top. Dev. Biol. 1980. V. 16. P. 349–380.
Okada T.S. Transdifferentiation. Oxford. Clarendon Press, 1991. 238 p.
Pannu J., Nakerakanti S., Smith E., Ten Dijke P., Trojanowska M. Transforming growth factor-β receptor type idependent fibrogenic gene program is mediated via activation of Smad1 and ERK1/2 pathways // J. Biological Chemistry. 2007. V. 282. № 14. P. 10 405–10 413.
Parmeggiani F., Campa C., Costagliola C. et al. Inflammatory mediators and angiogenic factors in choroidal neovascularization: pathogenetic interactions and therapeutic implications // Mediators of Inflamm. 2010: 546826.
Pastor J.C., de la Rua E.R., Martin F. Proliferative vitreoretinopathy: risk factors and pathobiology // Prog. Retin. Eye. Res. 2002. V. 21. P. 127–144.
Pastor J.C., Rojas J., Pastor-Idoate S. et al. Proliferative vitreoretinopathy: A new concept of disease pathogenesis and practical consequences // Prog. Ret. Eye Res. 2016. V. 51. P. 125–155.
Philp N.J., Nachmias V.T. Polarized distribution of integrin and fibronectin in retinal pigment epithelium // Invest. Ophthalmology and Visual Science. 1987. V. 28. № 8. P. 1275–1280.
Popova E.Y., Barnstable C.J. Chapter 15 – Insights into the epigenetics of retinal development and diseases // Epigenetic and Regeneration. V. 11 in Translational Epigenetics. Academic Press. 2019. P. 355–383.
Powell C., Grant A.R., Cornblath E., Goldman D. Analysis of DNA methylation reveals a partial reprogramming of the Müller glia genome during retina regeneration // Proc. Natl. Acad. Sci. USA. 2013 . V. 110. P. 19 814–19 819.
Pratt Craig H., Vadigepalli R., Chakravarthula P., Gonye G.E., Philp N.J., Grunwald G.B. Transcriptional regulatory network analysis during epithelial-mesenchymal transformation of retinal pigment epithelium // Mol. Vis. 2008. V. 14. P. 1414–1428.
Qu K., Xu X., Liu C., Wu Q., Wei J. et al. Negative regulation of transcription factor FoxM1 by p53 enhances oxaliplatin-induced senescence in hepatocellular carcinoma // Cancer Lett. 2013. V. 331. P. 105–114. https://doi.org/10.1016/j.canlet.2012.12.008
Rattner A., Toulabi, L., Williams J. et al. The genomic response of the retinal pigment epithelium to light damage and retinal detachment // J. Neuroscience. 2008. V. 28. P. 9880–9889.
Remé C., Grimm C., Hafezi F. et al. Why study rod cell death in retinal degenerations and how? // Documenta Ophthalmologica. 2003. V. 106. № 1. P. 25–29.
Roybal C.N., Velez G., Toral M.A., Tsang S.H., Bassuk A.G., Mahajan V.B. Personalized proteomics in proliferative vitreoretinopathy implicate hematopoietic cell recruitment and mTOR as a therapeutic target // Am. J. Ophthalmol. 2018. V. 186. P. 152–163.
Saika S., Kono-Saika S., Tanaka T. et al. Smad3 is required for dedifferentiation of retinal pigment epithelium following retinal detachment in mice // Lab. Invest. 2004. V. 84. P. 1245–1258.
Saika S., Yamanaka O., Nishikawa-Ishida I. et al. Effect of Smad7 gene overexpression on transforming growth factor beta-induced retinal pigment fibrosis in a proliferative vitreoretinopathy mouse model // Arch. Ophthalmol. 2007. V. 125. P. 647–654.
Saika S., Yamanaka O., Okada Y. et al. TGFβ in fibroproliferative diseases in the eye // Frontiers in Bioscience – Scholar. 2009. V. 1. № 1. P. 376–390.
Saini J.S., Corneo B., Miller J.D., Kiehl T.R., Wang Q., Boles N.C., Blenkinsop T.A., Stern J.H., Temple S. Nicotinamide ameliorates disease phenotypes in a human iPSC model of age-related macular degeneration // Cell Stem Cell. 2017. V. 20. P. 635–647. e7.
Salero E., Blenkinsop T.A., Corneo B. et al. Adult human RPE can be activated into a multipotent stem cell that produces mesenchymal derivatives // Cell Stem Cell. 2012. V. 10. P. 88–95.
Sakami S., Hisatomi O., Sakakibara S., Liu J. Downregulation of Otx2 in the dedifferentiated RPE cells of regenerating newt retina // Dev. Brain Res. 2005. V. 155. P. 49–59.
Schiff L., Boles Nathan C., Fernandes M., Nachmani B., Gentile R., Blenkinsop T.A. P38 inhibition reverses TGFβ1 and TNFα-induced contraction in a model of proliferative vitreoretinopathy // Communications Biology. 2019. 2:162.https://doi.org/10.1038/s42003-019-0406-6
Schmidt S.Y., Peisch R.D. Melanin concentration in normal human retinal pigment epithelium. Regional variation and age-related reduction // Invest. Ophthalmol. Vis. Sci. 1986. V. 27. P. 1063–1067.
Shu D.Y., Lovicu F.J. Myofibroblast transdifferentiation: the dark force in ocular wound healing and fibrosis // Prog. Ret. Eye Res. 2017. V. 60. P. 44–65.
Sparrow J.R., Hicks D., Hamel C.P. The retinal pigment epithelium in health and disease // Curr. Mol. Med. 2010. V. 10. P. 802–823.
Spraul C.W., Kaven C., Lang G.K., Lang G.E. Effect of growth factors on bovine retinal pigment epithelial cell migration and proliferation // Ophthalmic Res. 2004. V. 36. P. 166–171.
Stern J., Temple S. Retinal pigment epithelial cell proliferation // Exp. Biol. Med. (Maywood). 2015. V. 240. № 8. P. 1079–1086.
Sherpa T., Lankford T., McGinn T.E., Hunter S.S., Frey R.A., Sun Chi, Ryan M., Robison B.D., Stenkamp D.L. Retinal regeneration is facilitated by the presence of surviving neurons // Develop. Neurobiol. 2014. V. 74. P. 851–876. https://doi.org/10.1002/dneu.22167
Sousounis K., Looso M., Maki N., Ivester C.J., Braun T., Tsonis P.A. Transcriptome analysis of newt lens regeneration reveals distinct gradients in gene expression patterns // PLoS One. 2013. V. 8(4): e61445. https://doi.org/10.1371/journal.pone.0061445
Stevenson B.R., Siliciano J.D., Mooseker M.S., Goodenough D.A. Identification of ZO-1: a high molecular weight polypeptide associated with the tight junction (zonula occludens) in a variety of epithelia // J. Cell Biol. 1986. V. 103. P. 755–766.
Stewart S., Gomez A.W., Armstrong B.E., Henner A., Stankunas K. Sequential and opposing activities of Wnt and BMP coordinate zebrafish bone regeneration // Cell Report. 2014. V. 6. P. 482–498. https://doi.org/10.1016/j.celrep.2014.01.010
Strauss O. The retinal pigment epithelium in visual function // Physiol. Rev. 2005. V. 85. № 3. P. 845–888.
Stroeva O.G., Mitashov V.I. Developmental potential of vertebrate eye tissues in regeneration of retina and lens // Problems of Developmental Biology. M.: Mir Publ., 1981. P. 168–207.
Stroeva O.G., Mitashov V.I. Retinal pigment epithelium: proliferation and differentiation during development and regeneration // Int. Rev. Cytol. 1983. V. 83. P. 221–293.
Stocks S.Z., Taylor S.M., Shiels I.A. Transforming growth factor-beta1 induces alpha-smooth muscle actin expression and fibronectin synthesis in cultured human retinal pigment epithelial cells // Clin. Exp. Ophthalmol. 2001. V. 29. P. 33–37.
Strunnikova N.V., Maminishkis A., Barb J.J. Transcriptome analysis and molecular signature of human retinal pigment epithelium // Hum. Mol. Genet. 2010. V. 19. P. 2468–2486.
Sun S., Fang J. Epigenetic regulation of epithelia-mesenchymal transition // Cell Mol. Life Sci. 2016. V. 73. № 23. P. 4493–4515.
Susaki K., Chiba C. Pigment MEK mediates in vitro neural transdifferentiation of the adult newt retinal pigment epithelium cells: Is FGF2 an induction factor? // Cell Research. 2007. V. 20. № 5. P. 364–379. https://doi.org/10.1111/j.1600-0749.2007.00407.x
Szibor M., Poling J., Warnecke H. et al. Remodeling and dedifferentiation of adult cardiomyocytes during disease and regeneration // Cell Mol. Life Sci. 2014. V. 71. P. 1907–1916.
Takahashi K., Yamanaka S. Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors // Cell. 2006. V. 126. P. 663–676.
Takahashi E., Nagano O., Ishimoto T., Yae T., Suzuki Y., Shinoda T., Nakamura S., Niwa S., Ikeda S., Koga H. et al. Tumor necrosis factor-alpha regulates transforming growth factor-betadependent epithelial-mesenchymal transition by promoting hyaluronan-CD44-moesin interaction // J. Biol. Chem. 2010. V. 285. P. 4060–4073.
Tamiya S., Kaplan H.J. Role of epithelial-mesenchymal transition in proliferative vitreoretinopathy // Exp. Eye Res. 2016. V. 142. P. 26–31.
Tamiya S., Liu L., Kaplan H.J. Epithelial-mesenchymal transition and proliferation of retinal pigment epithelial cells initiated upon loss of cell-cell contact // Invest. Ophthalmol. Vis. Sci. 2010. V. 51. P. 2755–2763.
Tapscott S.J., Weintraub H. MyoD and the regulation of myogenesis by helix-loop-helix proteins // J. Clin. Invest. 1991. V. 87. № 4. P. 1133–1138.
Tapscott S.J., Davis R.L., Thayer M.J. et al. MyoD1: a nuclear phosphoprotein requiring a Myc homology region to convert fibroblasts to myoblasts // Science. 1988. V. 242. P. 405–411.
Thiery J.P., Sleeman J.P. Complex networks orchestrate epithelial-mesenchymal transitions // Nat. Rev. Mol. Cell Biol. 2006. V. 7. P. 131–142.
Tosi G.M., Marigliani D., Romeo N., Toti P. Disease pathways in proliferative vitreoretinopathy: an ongoing challenge // J. Cell. Physiol. 2014. V. 229. P. 1577–1583.
Uehara F., Ohba N., Ozawa M. Isolation and characterization of galectins in the mammalian retina // Invest. Ophthalmol. Vis. Sci. 2001. V. 42. P. 2164–2172.
Vaajasaari H., Ilmarinen T., Juuti-Uusitalo K., Rajala K., Onnela N. et al. Toward the defined and xeno-free differentiation of functional human pluripotent stem cell-derived retinal pigment epithelial cells // Mol. Vis. 2011. V. 17. P. 558–575.
VandenBosch L.S., Reh T.A. Epigenetics in neuronal regeneration // Sem. Cell. Dev. Biol. 2020. V. 97. P. 63–73.
Vadigepalli R., Chakravarthula P., Zak D.E., Schwaber J.S., Gonye G.E. PAINT: a promoter analysis and interaction network generation tool for gene regulatory network identification // OMICS. 2003. V. 7. P. 235–252.
Venters B.J., Pugh B.F. How eukaryotic genes are transcribed // Crit. Rev. Biochem. Mol. Biol. 2009. V. 44. № 2–3. P. 117–141.
Veldman M.B., Bemben M.A., Thompson R.C., Goldman D. Gene expression analysis of zebrafish retinal ganglion cells during optic nerve regeneration identifies KLF6a and KLF7a as important regulators of axon regeneration // Dev. Biol. 2007. V. 312. P. 596–612.
Wang I.C., Chen Y.J., Hughes D., Petrovic V., Major M.L. et al. Forkhead box M1 regulates the transcriptional network of genes essential for mitotic progression and genes encoding the SCF (Skp2-Cks1) ubiquitin ligase // Mol. Cell. Biol. 2005. V. 25. P. 10875–10894.
Wang Y., Shang Y. Epigenetic control of epithelial-to-mesenchymal transition and cancer metastasis // Exp. Cell Res. 2013. V. 319. № 2. P. 160–169.
Wiedemann P. Growth factors in retinal disease: proliferative vitreoretinopathy, proliferative diabetic retinopathy, and retinal degeneration // Surv. Ophthalmol. 1992. V. 36. P. 373–384.
Weintraub H., Tapscott S.J., Davis R.L. Activation of muscle-specific genes in pigment, nerve, fat, liver, and fibroblast cell lines by forced expression of MyoD // Proc. Natl. Acad. Sci. USA. 1989. V. 86. № 14. P. 5434–5438.
Weissenfels N., Hündgen M. Changing adenosine triphosphatase activity in nuclei of cultured chicken heart myoblasts during their transdifferentiation // Histochemie. 1968. V. 16. P. 119–133.
Wu J., Chen X., Liu X. et al. Autophagy regulates TGF-beta2-induced epithelial-mesenchymal transition in human retinal pigment epithelium cells // Mol. Med. Rep. 2018. V. 17. P. 3607–3614.
Xiao W., Chen X., Liu X. et al. Trichostatin A, a histone deacetylase inhibitor, suppresses proliferation and epithelial-mesenchymal transition in retinal pigment epithelium cells // Cell Mol. Med. 2014. V. 18. № 4. P. 646–655.
Xue J., Lin X., Chiu W.T., Chen Y.H., Yu G. et al. Sustained activation of SMAD3/SMAD4 by FOXM1 promotes TGF-beta-dependent cancer metastasis // J. Clin. Invest. 2014. V. 124. P. 564–579. https://doi.org/10.1172/JCI71104
Yan X., Liu Z., Chen Y. Regulation of TGF-β signaling by Smad7 // Acta Biochimica et Biophysica Sinica. 2009. V. 41. № 4. P. 263–272.
Yang S., Li H., Li M., Wang F. Mechanisms of epithelial-mesenchymal transition in proliferative vitreoretinopathy // Discov. Med. 2015. V. 20. P. 207–217.
Yao Y., Wang C.H. Dedifferentiation: inspiration for devising engineering strategies for regenerative medicine // NP J. Regen. Med. 2020. V. 5. P. 14.
Yasumuro H., Sakurai K., Toyama F. et al. Implications of a multi-step trigger of retinal regeneration in the adult newt // Biomedicines. 2017. V. 5. № 2. P. 25.
Yoshii C., Ueda Y., Okamoto M., Araki M. Neural retinal regeneration in the anuran amphibian Xenopus laevis post-metamorphosis: transdifferentiation of retinal pigmented epithelium regenerates the neural retina // Dev. Biol. 2007. V. 303. № 1. P. 45–50.
Yoshikawa T., Mizuno A., Yasumuro H. et al. MEK-ERK and heparin-susceptible signaling pathways are involved in cell-cycle entry of the wound edge retinal pigment epithelium cells in the adult newt // Pigment Cell Melanoma Res. 2012. V. 25. P. 66–82.
Zhang W., Liu H.T. MAPK signal pathways in the regulation of cell proliferation in mammalian cells // Cell Res. 2002. V. 12. P. 9–18.
Zhou M., Geathers J.S., Grillo S.L. et al. Role of epithelial-mesenchymal transition in retinal pigment epithelium dysfunction // Frontiers in Cell and Developmental Biology. 2020. 8:501.
Zou H., Shan C., Ma L. et al. Polarity and epithelial-mesenchymal transition of retinal pigment epithelial cells in proliferative vitreoretinopathy // Peer J. 2020. V. 8: e10136.
Дополнительные материалы отсутствуют.


