Онтогенез, 2021, T. 52, № 5, стр. 345-366
Применение концепции криобанка по отношению к диким и исчезающим видам отряда хищных (Carnivora)
С. Я. Амстиславский a, *, В. И. Мокроусова a, С. В. Окотруб a, b, Е. Ю. Брусенцев a, В. А. Напримеров a, c
a Федеральное государственное бюджетное научное учреждение “Федеральный исследовательский центр
Институт цитологии и генетики Сибирского отделения Российской академии наук”
630090 Новосибирск, пр. Ак. Лаврентьева, 10, Россия
b ФГАОУ ВО “Новосибирский национальный исследовательский государственный университет” (НГУ)
630090 Новосибирск, ул. Пирогова, 2, Россия
c ФГАОУ ВО “Новосибирский государственный аграрный университет” (НГАУ)
630037 Новосибирск, ул. Добролюбова, 160, Россия
* E-mail: amstis@yandex.ru
Поступила в редакцию 13.12.2020
После доработки 24.03.2021
Принята к публикации 28.03.2021
Аннотация
В статье описаны основные достижения в области криоконсервации гамет и ранних эмбрионов млекопитающих отряда хищных. Обсуждаются также проблемы применения современных репродуктивных технологий по отношению к уязвимым и исчезающим видам этого отряда. В частности, криоконсервация ооцитов и эмбрионов у исследованных видов Carnivora осложнена обилием в них липидных гранул. Обзор сфокусирован на семействах кошачьих, псовых, куньих и медвежьих, поскольку именно для этих семейств накоплен ценный опыт применения современных достижений репродуктивной биологии в отношении недоместицированных видов, в том числе исчезающих. Для сравнения приведены базовые исследования на доместицированных представителях отряда – кошке, собаке и домашнем хорьке. При этом учитываются особенности репродуктивной биологии, характерные для представителей этих семейств.
ВВЕДЕНИЕ
В настоящее время, около 1200 видов, то есть примерно четвертая часть всех существующих видов млекопитающих, находятся под угрозой исчезновения, являются редкими или вымирающими. Больше всего таких видов среди грызунов, рукокрылых, приматов, китопарнокопытных и хищных (International Union for the Conservation of Nature (IUCN), https://www.iucn.org). На сегодняшний день отряд хищные (Carnivora) включает в себя 15 семейств (по данным NCBI taxonomy browser; https://www.ncbi.nlm.nih.gov/Taxonomy/ Browser/wwwtax.cgi). Наиболее изученными из них в плане репродуктивной биологии являются псовые (Canidae), куньи (Mustelidae), медвежьи (Ursidae) и кошачьи (Felidae) (Amstislavsky et al., 2012). В каждом из этих четырех семейств есть виды с разным охранным статусом (https://www.iucn.org). Достаточно остро стоит проблема исчезновения видов в семействе кошачьих (Lamberski, 2015). По крайней мере, 16 из 36 диких представителей этого семейства являются исчезающими или уязвимыми (имеют статус endangered – EN или vulne-rable – VU) (Lamberski, 2015). Среди семейства Canidae численность 5 из 38 видов снижается (https://www.iucn.org). В семействе куньих 14 представителей из 64 имеют статусы critically endangered (CR), EN и VU (https://www.iucnredlist.org). Наиболее остро стоит проблема исчезновения видов в семействе медведей: шесть из восьми видов семейства являются уязвимыми (https://www.iucnredlist.org).
Традиционный способ поддержания численности исчезающих и редких животных in situ – это создание охраняемых территорий с максимально благоприятными условиями для жизни (Gundu, Adia, 2014). Помимо крупных заповедников создают также небольшие питомники, фермы и зоопарки для разведения небольших популяций ex situ. Между тем, при разведении диких видов хищных в неволе возникает много проблем, в том числе проблема адаптации к неволе, что препятствует их реинтродукции (Amstislavsky et al., 2008). Ввиду небольшой численности представителей редких видов хищных, живущих в зоопарках, требуется обновление их генетического материала для смягчения последствий инбридинга (Swanson et al., 2007).
Важнейшим подходом к сохранению генетического разнообразия различных таксонов млекопитающих является создание криобанков гамет и эмбрионов (Agca, 2012; Comizzoli, Holt, 2014). Этот подход, основанный на сочетании методов репродуктивной биологии и криобиологии, который впервые был предложен более 40 лет назад Б.Н. Вепринцевым и Н.Н. Ротт, становится все более важным и значимым для сохранения биоразнообразия диких видов отряда хищных (Amstislavsky et al., 2012).
Усовершенствование методов работы с гаметами и эмбрионами млекопитающих, а также создание криобанков поможет поддерживать генетическое разнообразие животных в зоопарках без перемещения их из естественной среды обитания, с использованием транспортировки криоконсервированных сперматозоидов между городами и странами, в сочетании с искусственным осеменением или экстракорпоральным оплодотворением in vitro и переносом эмбрионов (Swanson et al., 2007). Такой подход уже был продемонстрирован на гепардах (Acinonyx jubatus) с использованием замороженно-оттаяных сперматозоидов, собранных от диких самцов в Намибии, что привело к получению потомства в зоопарках Северной Америки в результате искусственного осеменения (Wildt, Roth, 1997). Наряду с этим, было получено потомство в ходе программы сохранения и восстановления исчезающего вида куньих – черноногого хорька, предпринятой в США, благодаря криоконсервации семени, его сохранения в течение длительного времени в криобанке в сочетании с искусственным осеменением (Howard et al., 2015). Кроме криоконсервированных сперматозоидов, для повышения генетического разнообразия выборки производителей, содержащихся в зоопарках и специальных центрах, может быть использован и транспорт замороженных эмбрионов. В частности, эмбрионы оцелота были транспортированы в криоконсервированном виде из Бразилии в США, и получено живое потомство, что является альтернативой транспортировки живых представителей вида (Conforti et al., 2008).
В данном обзоре будет рассмотрено применение современных репродуктивных технологий, прежде всего криоконсервации гамет и эмбрионов, в отношении четырех семейств отряда хищных: кошачьих, псовых, куньих и медвежьих. Будут изложены основные достижения и проблемы применения этих подходов по отношению к диким представителям этих семейств.
КРИОКОНСЕРВАЦИЯ СПЕРМАТОЗОИДОВ ПРЕДСТАВИТЕЛЕЙ ОТРЯДА ХИЩНЫХ
Источник сперматозоидов для криобанка семени хищных
Извлечение сперматозоидов из эпидидимисов является достаточно распространенным способом их получения у представителей хищных (Luvoni, 2006). Этот метод практикуют и в настоящее время, особенно по отношению к домашним котам, поскольку эпидидимисы взрослых котов доступны в ветеринарных клиниках после процедур плановой стерилизации (Brusentsev et al., 2018). Эпидидимальное семя также может быть получено и у диких видов хищных, как правило, post-mortem или после стерилизации по медицинским показаниям. Так, было успешно криоконсервировано эпидидимальное семя бенгальского тигра (Cocchia et al., 2009).
Между тем, “золотым стандартом” получения семени по отношению к представителям отряда Carnivora является электроэякуляция, которую успешно применяют по отношению к кошачьим (Donoghue et al., 1992; Amstislavsky et al., 2018), псовым (Johnson et al., 2014; Van den Berghe et al., 2018; Yatu et al., 2018), куньим (Van der Horst et al., 2006) и медвежьим (Anel-Lopez et al., 2017; Cai et al., 2018). В большинстве рассматриваемых нами работ на диких представителях отряда хищных исследователи используют именно эякуляторное семя (табл. 1, 2).
Таблица 1.
Криоконсервация сперматозоидов диких представителей отряда хищных (Carnivora)1
| Вид/подвид | Криопротектор (охлаждение в парах LN2, если нет сноски) | Показатели после оттаивания (жизнеспособность, подвижность, фертильность), % | Ссылка | ||
|---|---|---|---|---|---|
| Ж | П/ПП/ИПС | проверка на фертильность | |||
| Семейство кошачьих (Felidae) | |||||
| Лев (Panthera leo) | 4.7% глицерин | – | 31/15/– | – | Luther et al., 2017 |
| Ягуар (Panthera onca) | 6% глицерин | 46 | 46/–/– | – | Silva et al., 2019 |
| Суматранский тигр (Panthera tigris sumatrae) | 3% глицерин | 85 | 30–/– | + | Karja et al., 2016 |
| Бенгальский тигр (Panthera tigris tigris) | 4% глицерин* | – | 73/–/79 | + | Donoghue et al., 1992 |
| Амурский тигр (Panthera tigris altaica) | 4% глицерин* | 58/–/74 | |||
| Леопард (Panthera pardus) | 4% глицерин | – | 32/–/– | + | Jayaprakash et al., 2001 |
| Индокитайский леопард (Panthera pardus delacouri) | 5% глицерин | 42 | 37/–/– | + | Thuwanut et al., 2017 |
| Дымчатый леопард (Neofelis nebulosa) | 5% глицерин | 28 | 27/2/28 | + | Tipkantha et al., 2016 |
| Кот-рыболов (Prionailurus viverrinus) | 4% глицерин | – | –/38/– | + | Vansandt et al., 2016 |
| Суматранская кошка (Prionailurus planiceps) | 5% глицерин | 34 | 21/1/– | + | Thuwanut et al., 2011 |
| Пиренейская рысь (Lynx pardinus) | 4% глицерин | – | 34/–/43 | + | Ganan et al., 2009a |
| Рыжая рысь (Lynx rufus) | 4% глицерин | – | –/–/49 | + | Ganan et al., 2009b |
| Оцелот (Leopardus pardalis) | 4% глицерин* | 55 | 51/–/– | + | Stoops et al., 2007 |
| Онцилла (Leopardus tigrinus) | 4% глицерин* | – | –/–/51 | + | Baudi et al., 2008 |
| Кот Жоффруа (Leopardus geoffroyi) | 4% глицерин | – | –/–/46 | + | Sestelo et al., 2018 |
| Манул (Felis manul) | 4% глицерин | – | –/37/– | + | Vansandt et al., 2016 |
| Черноногая кошка (Felis nigripes) | 4% глицерин | – | –/44/– | + | Vansandt et al., 2018 |
| Барханный кот (Felis margarita) | 4% глицерин | – | –/46/– | + | Vansandt et al., 2018 |
| Семейство собачьих (Canidae) | |||||
| Песец (Alopex lagopus) | 6% глицерин | 45 | 45/–/– | – | Stasiak et al., 2014 |
| Гривистый волк (Chrysocyon brachyurus) | 7% (1 М) ДМСО | 51 | 20/–/– | – | Johnson et al., 2014 |
| Рыжий волк (Canis rufus) | 4% глицерин* | – | 11/–/– | – | Franklin et al., 2018 |
| Обыкновенная лисица (Vulpes vulpes) | 6% глицерин | – | –/–/47 | + | Yatu et al., 2018 |
| Гиеновидная собака (Lycaon pictus) | 2.5% глицерин | 58 | 33/–/59 | – | Van den Berghe et al., 2018 |
| Мексиканский волк (Canis lupus baileyi) | 4% глицерин* | 79 | –/–/– | – | Zindl et al., 2006 |
| Койот (Canis latrans) | 5% глицерин# | 24 | 20/–/– | – | Minter, DeLiberto, 2005 |
| Семейство медвежьих (Ursidae) | |||||
| Бурый медведь (Ursus arctos) | 6% глицерин# | 47 | 68/37/– | – | Anel-Lopez et al., 2017 |
| Гималайский медведь (Ursus thibetanus japanicus) | 8% глицерин | 58 | 26/–/– | – | Okano et al., 2006 |
| Семейство куньих (Mustelidae) | |||||
| Канадская выдра (Lontra canadensis) | 4% глицерин* | – | –/59/– | – | Bateman, Swanson, 2017 |
| Степной хорек (Mustela eversmanni) | 4% глицерин | 60 | –/–/– | – | Van der Horst et al., 2009 |
| Черноногий хорек (Mustela nigripes) | 4% глицерин* | – | 45/3/– | + | Howard et al., 2015 |
Таблица 2.
Криоконсервация сперматозоидов представителей отряда хищных (Carnivora) с использованием фирменных криопротективных смесей
| Вид/подвид | Криопротектор (охлаждение в парах LN2, если нет сноски) |
ЭЯ/ЭП | Показатели после оттаивания (жизнеспособность, подвижность, фертильность), % | Ссылка | ||
|---|---|---|---|---|---|---|
| Ж | П/ПП/ИПС | проверка на фертильность | ||||
| Семейство кошачьих (Felidae) | ||||||
| Домашняя кошка (Felis silvestris catus) | CaniPlus Freeze (Minitube, Germany) | ЭП | 51 | 31/7/– | + | Amstislavsky et al., 2018; Brusentsev et al., 2018 |
| SpermFreeze (FertiPro, Belgium) | ЭП | 54 | 27/15/– | + | Brusentsev et al., 2018 | |
| BotuCrio (Botupharma, USA) | ЭП | 39 | 16/3/– | – | Macente et al., 2018 | |
| Бенгальская кошка (Prionailurus bengalensis) | Freezing Medium TYB (FUJIFILM Irvine Scientific, Japan) | ЭЯ | 22 | –/–/– | – | Ha et al., 2011 |
| Дальневосточный лесной кот (Prionailurus bengalensis euptilurus) | CaniPlus Freeze (Minitube, Germany) | ЭЯ | 38 | 34/–/– | + | Amstislavsky et al., 2018 |
| Гепард (Acinonyx jubatus) | Freezing Medium TYB (FUJIFILM Irvine Scientific, Japan) | ЭЯ | – | –/–/62 | – | Terrell et al., 2012 |
| Маргай (Leopardus wiedii) | Freezing Medium TYB (FUJIFILM Irvine Scientific, Japan)# | ЭЯ | – | –/–/30 | – | Erdmann et al., 2019 |
| Пиренейская рысь (Lynx pardinus) | Biladyl (Minitub, Germany) | ЭЯ | – | 8/–/11 | + | Ganan et al., 2009a |
| Рыжая рысь (Lynx rufus) | Biladyl (Minitub, Germany) | ЭЯ | – | –/–/41 | + | Ganan et al., 2009b |
| Семейство псовых (Canidae) | ||||||
| Домашняя собака (Canis lupus familiaris) | CaniPlus Freeze (Minitube, Germany) | ЭЯ | – | –/65/– | – | Sichtar et al., 2015 |
| Рыжий волк (Canis lupus rufus) | CaniPlus Freeze (Minitube, Germany) | ЭЯ | – | 7/–/– | – | Franklin et al., 2018 |
| Семейство медвежьих (Ursidae) | ||||||
| Большая панда (Ailuropoda melanoleuca) | Freezing Medium TYB (FUJIFILM Irvine Scientific, Japan) | ЭЯ | 36 | 25/24/– | – | Cai et al., 2018 |
Весьма перспективным является также использование уретральной катетеризации для получения семени у различных диких представителей отряда хищных (Lueders et al., 2012, 2014; Kheirkhah et al., 2017; Jeong et al., 2018; Franklin et al., 2018). Между тем, в исследовании на рыжем волке было продемонстрировано, что семя, взятое с использованием уретральной катетеризации, обладало худшими характеристиками подвижности и меньшим объемом по сравнению с эякуляторным (Franklin et al., 2018). Образцы уретрального семени, полученного у азиатской золотой кошки, обладали меньшим объемом, но большей концентрацией сперматозоидов при сходных процентах подвижности по сравнению с электроэякуляторным семенем (Lueders et al., 2014). Похожие результаты были получены при применении уретральной катетеризации к африканскому льву, камышовому и дальневосточному лесному коту (Lueders et al., 2012; Kheirkhah et al., 2017; Jeong et al., 2018).
Также успешно используется на кошачьих и мануальный метод, хотя проигрывает электроэякуляции по объему полученного эякулята, превосходит ее по количеству и подвижности сперматозоидов (Buranaamnuay, 2017). Однако, данный метод получения эякулята подразумевает использование искусственной вагины и требует определенной тренировки как персонала, так и самого животного, что может быть проблемой при работе с дикими особями (Zambelli, Cunto, 2006). Следует отметить, что для домашних псов наиболее предпочтительным методом получения семени является именно мануальный способ (Nunez-Martinez et al., 2006).
Анализ литературы позволяет сделать заключение о том, что способ получения семени влияет на некоторые морфологические и функциональные показатели семени, как до, так и после криоконсервации. В частности, целостность акросомы в эпидидимальном семени как до, так и после криоконсервации, ниже по сравнению с таковым, полученным в результате электроэякуляции (Luvoni, 2006). Также целостность акросом ниже и в сперматозоидах, полученных с помощью уретральной катетеризации, по сравнению с таковыми, полученными в результате электроэякуляции (Franklin et al., 2018). Плюсом применения электроэякуляции по сравнению с уретральной катетеризацией является больший объем получаемого семени (Lueders et al., 2014; Franklin et al., 2018). Однако по имеющимся литературным данным можно сделать вывод, что мануальный метод с использованием искусственной вагины, а также применение уретральной катетеризации имеют лучшие показатели по числу сперматозоидов и их подвижности, по сравнению с электроэякуляцией (Lueders et al., 2014; Buranaamnuay, 2017).
СПОСОБЫ КРИОКОНСЕРВАЦИИ СЕМЕНИ ХИЩНЫХ И ПРОВЕРКИ ЕГО ЖИЗНЕСПОСОБНОСТИ
Этапы криоконсервации сперматозоидов и подбор криопротекоров
Данные по криоконсервации сперматозоидов диких представителей отряда хищных с использованием стандартных протоколов представлены в табл. 1. Приведенные в табл. 1 результаты свидетельствуют об эффективности криоконсервирования семени разных видов семейства кошачьих, псовых, куньих и медведей. За исключением медведей, у которых отсутствуют доместицированные виды, перед применением в отношении представителей дикой фауны, характерные для разных семейств хищных особенности криоконсервации семени изучают на домашних видах, а именно – домашних котах (Cheuqueman et al., 2018), домашних псах (Qamar et al., 2019) и домашних хорьках (van der Horst et al., 2009).
Криоконсервация сперматозоидов стала успешной после открытия криопротективных свойств глицерина (Polge et al., 1949). В настоящее время список криопротекторов, которые успешно применяют для криоконсервации гамет и эмбрионов, достаточно велик (Амстиславский и др., 2015; Elliott et al., 2017; Rajan, Matsumura, 2018). Криопротекторы разделяют на проникающие и не проникающие в клетки (Shaw, Jones, 2003). Малые (мол. масса <100) гидрофильные, проникающие в мембрану соединения, способные создавать водородную связь с молекулами воды и образовывать водородные связи, например, с белком (вместо молекулы воды), особенно эффективны в качестве криопротекторов. Наличие таких соединений в водных растворах снижает температуру образования льда (Shaw, Jones, 2003).
Для семени всех перечисленных видов сначала проводят пробоподготовку, состоящую из нескольких стадий. На первом этапе обычно производят смешивание образца семени с разбавителем, либо не содержащим основной проникающий криопротектор, либо содержащий этот криопротектор в концентрации ниже финальной, после чего смесь охлаждают до 4–5°C с последующим выдерживанием при заданной температуре в течение 1–3 ч (Van der Horst et al., 2009; Bateman, Swanson, 2017; Franklin et al., 2018; Yatu et al., 2018). В некоторых случаях, однако, этот этап эквилибрации осуществляют без добавления в разбавитель проникающего криопротектора, заменяя его на непроникающие, в частности, на глюкозу, лактозу или трегалозу (Karja et al., 2016). Иногда на первом этапе проникающий криопротектор добавляют уже в финальной концентрации (Johnson et al., 2014; Erdmann et al., 2019). На втором этапе полученную суспензию сперматозоидов смешивают со вторым разбавителем, содержащим основной проникающий криопротектор в достаточно высокой концентрации (6–16%), так, чтобы финальная концентрация основного криопротектора в смеси составила 3–8%.
Как показано, в подавляющем большинстве работ по криоконсервации сперматозоидов представителей отряда хищных в качестве основного криопротектора используют глицерин, реже – диметилсульфоксид (ДМСО) (табл. 1). При этом практически всегда в качестве дополнительного компонента криопротективной смеси используют яичный желток в концентрации 20%, заменяя его иногда на соевый лецитин. Во многих из приведенных в табл. 1 работах, наряду с основным проникающим криопротектором и яичным желтком, в криопротективную смесь добавляют непроникающие криопротекторы, такие как глюкоза (Franklin et al., 2018), фруктоза (Anel-Lopez et al., 2017; Franklin et al., 2018; Van den Berghe et al., 2018), лактоза (Karja et al., 2016) и раффиноза (Yatu et al., 2018).
Кроме того, используют готовые фирменные разбавители семени для криоконсервации сперматозоидов хищных (табл. 2). Использование таких криопротекторных смесей имеет одно существенное достоинство – стандартизацию протоколов криоконсервации. На рынке есть фирменные разбавители семени для криоконсервации различных видов млекопитающих, преимущественно человека и домашних или сельскохозяйственных животных. Для представителей отряда хищных хорошо зарекомендовали себя CaniPlus Freeze от немецкой компании Minitube (Sichtar et al., 2015; Amstislavsky et al., 2018; Brusentsev et al., 2018; Franklin et al., 2018), Freezing Medium TYB от Японско-Американской компании FUJIFILM Irvine Scientific (Ha et al., 2011; Terrell et al., 2012; Cai et al., 2018; Erdmann et al., 2019) и SpermFreeze от бельгийской компании FertiPro (Brusentsev et al., 2018).
После уравновешивания семени с криопротекторами его достаточно быстро охлаждают в парах жидкого азота (LN2) до температуры ~–120°C (Van der Horst et al., 2009; Stasiak et al., 2014; Johnson et al., 2014; Bateman, Swanson, 2017; Cai et al., 2018; Van den Berghe et al., 2018; Yatu et al., 2018) или охлаждают с использованием программного замораживателя до –100°C с последующим погружением в жидкий азот (Anel-Lopez et al., 2017). В некоторых случаях используют сухой лед и охлаждают до ~–80°C (Donoghue et al., 1992; Stoops et al., 2007; Baudi et al., 2008; Howard et al., 2015; Franklin et al., 2018). В некоторых случаях семя сразу помещают в транспортировочный сосуд (dry shipper), где оно постепенно охлаждается до температуры ~–120°C (Stoops et al., 2007; Johnson et al., 2014). На последнем этапе контейнеры с замороженной суспензией сперматозоидов помещают в криохранилище, где их сохраняют при температуре –196°C.
Для представителей семейства кошачьих при криоконсервации семени используют в качестве контейнера пластиковые соломины, которые выдерживают в парах LN2 (Amstislavsky et al., 2018; Brusentsev et al., 2018), иногда в качестве контейнера используют криопробирки, а для замораживания сухой лед (Donoghue et al., 1992; Baudi et al., 2008) или dry shipper (Stoops et al., 2007). Для замораживания семени различных видов семейства псовых применяют либо пластиковые соломины, которые выдерживают в парах LN2 (Stasiak et al., 2014; Van den Berghe et al., 2018; Yatu et al., 2018) или dry shipper (Johnson et al., 2014), либо криопробирки и сухой лед (Franklin et al., 2018). Для криоконсервации семени представителей семейства куньих используют пластиковые соломины в качестве контейнера, которые выдерживают в парах LN2 (Van der Horst et al., 2009), либо криопробирки и сухой лед (Howard et al., 2015; Bateman, Swanson, 2017). Для представителей семейства медвежьих при криоконсервации семени используют пластиковые соломины в качестве носителя и, либо выдерживают в парах LN2 (Cai et al., 2018), либо применяют программное замораживание (Anel-Lopez et al., 2017).
Как видно из данных, приведенных в табл. 1, показатели жизнеспособности и подвижности семени после криоконсервации у исследованных видов хищных не сильно зависели от концентрации применяемого криопротектора (преимущественно глицерина в качестве основного криопротектора). Согласно литературным данным, способ охлаждения образцов семени (в парах азота, программное замораживание, на сухом льду, в драйшипере), также не оказывал критического влияния на результат криоконсервации. Между тем, наш собственный опыт работы с семенем кошачьих свидетельствует о том, что способ охлаждения образцов семени в парах азота является оптимальным, по крайней мере, при работе в условиях, приближенным к полевым, и более надежным по сравнению с охлаждением в драйшипере. Как видно из приведенных в табл. 2 данных, показатели эффективности криоконсервации семени представителей хищных с применением фирменных криопротективных смесей не сильно отличаются от таковых при применении самостоятельно изготовленных смесей на основе глицерина, используемых для тех же семейств хищных. Исключением, пожалуй, является Biladyl (Minitub, Germany), который показал заметное снижение подвижности и оплодотворяющей способности сперматозоидов пиренейской и рыжей рыси по сравнению с криопротекторными смесями, приготовленными экспериментаторами на основе глицерина (Ganan et al., 2009a, 2009b).
Способы оценки эффективности криоконсервации сперматозоидов
Для подбора наиболее эффективного протокола криоконсервации семя до и после замораживания оценивают по различным показателям, таким как жизнеспособность, подвижность, морфология сперматозоидов, а также их оплодотворяющая способность. В случае работы с дикими видами животных важно подбирать методы оценки, в том числе и для проведения в “полевых” условиях, где нет доступа к полноценной лаборатории. Использование таких методов возможно, если в наличии имеется, как минимум, световой микроскоп. Для комфортной работы со сперматозоидами большинства видов млекопитающих желательно увеличение 200× или более. Для характеристики морфологический аномалий сперматозоидов необходимо более сильное увеличение (1000×).
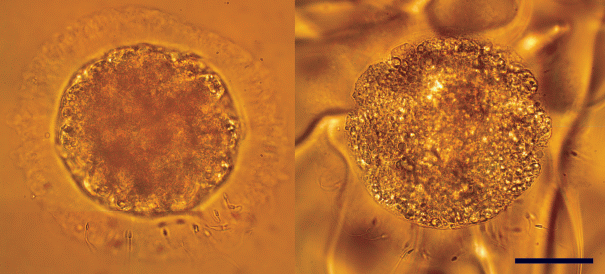
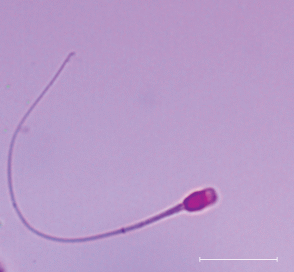
Жизнеспособность сперматозоидов различных видов млекопитающих, в том числе представителей отряда хищных, обычно оценивают по состоянию их плазматической мембраны, например, с помощью окрашивания образца смесью красителей эозина и нигрозина, при котором первый краситель проникает в сперматозоиды, но только в те, у которых повреждена мембрана, а второй создает темный фон, на котором лучше видно окрашенные сперматозоиды (Bjorndahl et al., 2003; Tipkantha et al., 2016). Альтернативно жизнеспособность сперматозоидов можно оценить с помощью гипоосмотического теста (Ramu, Jeyendran, 2012), при котором оценивается функциональная способность мембраны живых сперматозоидов поддерживать осмотическое равновесие в клетке. Данный тест, в частности, успешно применяется на сперматозоидах хищных (Silva et al., 2019). Помимо этого, применяют метод оценки с использованием флуоресцентных красителей SYBR Green I и йодистого пропидия (LIVE/DEAD тест), позволяющий получить информацию по процентному соотношению живых и мертвых сперматозоидов. В наших собственных исследованиях мы с успехом применяли эти методы для оценки жизнеспособности сперматозоидов кошачьих как на домашнем коте (Brusentsev et al., 2018), так и на дальневосточном лесном коте (Amstislavsky et al., 2018), а также на представителях рода Lynx (рис. 1).
Рис. 1.
Сперматозоид евразийской рыси (Lynx lynx) после криоконсервации, окрашенный смесью красителей эозина и нигрозина (Vital Screen, FertiPro, Бельгия). Красная окраска свидетельствует о том, что сперматозоид мертвый. Масштабная полоска: 20 мкм.
Очень важным параметром качества семени является подвижность сперматозоидов. С помощью камеры Маклера можно как в лабораторных, так и в полевых условиях оценить концентрацию сперматозоидов в образце, их общую, прогрессивную и непрогрессивную подвижность (Amstislavsky et al., 2018); в некоторых случаях используют сочетание гемоцитометра Нейбауэра (для определения концентрации) и определения процента подвижных сперматозоидов на предметном стекле (Ganan et al., 2009a, 2009b). Иногда прогрессивно подвижные сперматозоиды классифицируют по шкале от 0 до 5 и рассчитывают индекс подвижности сперматозоидов (ИПС) (Baudi et al., 2008).
Большое значение имеет и морфология сперматозоидов, которая может быть оценена окрашиванием сухого мазка с последующей световой микроскопией при большом увеличении (Amstislavsky et al., 2018; Franklin et al., 2018) или без окрашивания мазка, с применением фазового контраста (Tipkantha et al., 2016). В некоторых исследованиях дополнительно оценивают целостность акросомы окрашиванием сперматозоидов красителем кумасси бриллиантовым синим с последующей микроскопией (Larson, Miller, 1999; Ganan et al., 2009b).
Все вышеперечисленные показатели можно оценить более тщательно в условиях хорошо оборудованной лаборатории. Например, для оценки подвижности часто используют автоматические компьютерные системы (computer-assisted sperm analysis, CASA), которые рассчитывают не только процент подвижных сперматозоидов, но и скорость и траектории их движения (Luther et al., 2017). Также существуют автоматизированные системы для морфометрии сперматозоидов (Anel-Lopez et al., 2017). Оценку жизнеспособности сперматозоидов и целостности их акросом в лабораторных условиях можно проводить методом их окрашивания флуорохромами с последующим использованием флуоресцентной или конфокальной микроскопии (Amstislavsky et al., 2018; Van den Berghe et al., 2018). С помощью флуорохромов, например, JC-1 assay kit также можно оценить такие параметры, как активность митохондрий в сперматозоидах (Thuwanut et al., 2011).
Итоговой целью оценки параметров качества семени является определение его способности к оплодотворению (фертильность). Самым простым способом использования семени для оплодотворения является искусственное осеменение (ИО), однако такой способ весьма требователен к числу подвижных сперматозоидов в образце (Swanson et al., 2007). В случае работы с редкими и ценными видами хищных более экономичным выбором является экстракорпоральное оплодотворение (ЭКО) (Swanson et al., 2007). Для доместицированных видов хищных, в частности для домашней кошки, проще всего использовать гомологическое ЭКО, когда для проверки оплодотворяющей способности сперматозоидов домашнего кота ими экстракорпорально оплодотворяют ооциты домашней кошки (Brusentsev et al., 2018). Что касается диких видов хищных, то для проверки оплодотворяющей способности сперматозоидов после криоконсервации, технически проще использовать гетерологическое ЭКО. Между тем, возможность получения развивающихся эмбрионов путем гетерологического ЭКО продемонстрирована только для одного семейства отряда хищных – кошачьих. В частности, для оценки оплодотворяющей способности сперматозоидов красной рыси (Ganan et al., 2009b), пиренейской рыси (Ganan et al., 2009a) и дальневосточного лесного кота (Amstislavsky et al., 2018) были использованы ооциты домашней кошки. Поскольку для некоторых диких видов кошачьих характерен высокий процент тератозооспермии, это может ограничивать возможность применения ЭКО; в таком случае для оценки фертильности семени и получения эмбрионов может использоваться гомологическое или гетерологическое ИКСИ (интрацитоплазматическая инъекция сперматозоида). Для применения этого метода требуются единичные нормальные подвижные сперматозоиды. Метод ИКСИ был, в частности, успешно применен на гепарде, леопарде и льве c целью проверки оплодотворяющей способности сперматозоидов этих видов кошачьих после криоконсервации (Moro et al., 2014; Fernandez-Gonzalez et al., 2015).
Наш собственный опыт работы с диким представителем семейства кошачьих – дальневосточным лесным котом показал, что в условиях, приближенных к полевым, экспресс метод оценки жизнеспособности при помощи смеси красителей эозина и нигрозина и оценки их концентрации и подвижности при помощи камеры маклера оказывается вполне достаточно, по крайней мере для того, чтобы осуществить криоконсервацию семени с последующей более тщательной оценкой и изучением, в том числе и оплодотворяющей способности сперматозоидов после их оттаивания в лабораторных условиях (Amstislavsky et al., 2018). Между тем, крайне желательна предварительная апробация протоколов криоконсервации и оценки семени на доместицированном представителе семейства, в данном случае – на домашнем коте (Brusentsev et al., 2018).
Показатели жизнеспособности сперматозоидов после их криоконсервации у различных представителей отряда хищных
Анализ эффективности процедуры криоконсервации сперматозоидов (табл. 1, 2) после их оттаивания/отогрева выявил, что жизнеспособность образцов эякуляторного семени диких видов кошачьих, за исключением одного исследования составляет 22–55% (43.75 ± 6.92% в среднем). У домашнего кота жизнеспособность сперматозоидов после криоконсервации обычно несколько выше и составляет 47–65% (Chatdarong et al., 2017; Cheuqueman et al., 2018; Jara et al., 2019). Между тем, в одном исследовании на сперматозоидах суматранского тигра была отмечена исключительно высокая жизнеспособность сперматозоидов после оттаивания – 85% (Karja et al., 2016). В данном исследовании, наряду с глицерином и яичным желтком, в криопротективную смесь был добавлен дополнительный ингредиент, а именно Orvus ES paste, а в процессе эквилибрации образцов семени использовали глюкозу, лактозу или раффинозу.
Жизнеспособность эякуляторного семени у диких псовых составила 24–79% (51.4 ± 8.9% в среднем); причем для гривистого волка (Chrysocyon brachyurus) была обнаружена большая эффективность использования ДМСО по сравнению с глицерином (Johnson et al., 2014), который является основным криопротектором при замораживании сперматозоидов других представителей отряда хищных (табл. 1). Между тем, сравнение ДМСО и глицерина, в качестве основного криопротектора при криоконсервации сперматозоидов рыжего волка, показало существенно более высокие характеристики подвижности при применении глицерина (Franklin et al., 2018). Для некоторых других диких представителей отряда псовых, а именно песца, рыжей лисицы, гиеновидной собаки и мексиканского волка, глицерин в концентрации 2.5–6.0% оказывал достаточно хороший криопротективный эффект и показатели жизнеспособности и (или) подвижности для размороженного семени были не ниже 45%. Эти показатели находятся в хорошем соответствии с таковыми для домашних псов: 45% жизнеспособности семени при применении 6% глицерина в качестве основного криопротектора (Qamar et al., 2019). Между тем, для койота и рыжего волка показатели жизнеспособности и (или) подвижности семени при использовании глицерина в качестве криопротектора оказались весьма низкими (табл. 1). Достаточно перспективным, на наш взгляд, является применение фирменной криопротективной смеси на основе глицерина, созданной специально для криоконсервации сперматозоидов представителей семейства псовых – CaniPlus Freeze (Minitube, Германия). Показательно, что эта смесь, которая создавалась для работы с семенем домашних псов, оказалась эффективна при криоконсервации семени дикого представителя семейства псовых – рыжего волка (табл. 2).
Среди диких видов куньих жизнеспособность сперматозоидов была определена только у домашнего и степного хорька (Mustela eversmanni), и составляла 60% (Van der Horst et al., 2009). У других диких видов куньих, а именно – канадской выдры и черноногого хорька, была определена только подвижность сперматозоидов после процедур криоконсервации, которая также оказалась достаточно высокой, соответственно 59 и 45% (табл. 1).
У медвежьих разброс в жизнеспособности оттаянных сперматозоидов составляет 36–58% (47 ± 6.4% в среднем). Было продемонстрировано, что у большой панды и бурого медведя эти показатели могут быть улучшены с помощью селекции сперматозоидов путем центрифугирования через коллоидный раствор (Anel-Lopez et al., 2017; Cai et al., 2018).
Оплодотворяющая способность оттаянного семени диких кошачьих в большинстве случаев определялась с помощью гетерологического ЭКО ооцитов домашней кошки (табл. 1, 2); процент дробления при этом составил 11–61%, в среднем 41.0 ± 5.3% в зависимости от вида: пиренейская рысь – 11% (Ganan et al., 2009a), рыжая рысь – 24% (Ganan et al., 2009b), оцелот – 29% (Stoops et al., 2007), дальневосточный лесной кот – 36% (Amstislavsky et al., 2018), барханный кот – 41% (Vansandt et al., 2018), индокитайский леопард – 46% (Thuwanut et al., 2017), кот Жоффруа – 46% (Sestelo et al., 2018), черноногая кошка – 59% (Vansandt et al., 2018), кот-рыболов – 60% (Vansandt et al., 2016) и манул – 61% (Vansandt et al., 2016). Также проводили оценку на фертильность по доле оплодотворившихся ооцитов для суматранского тигра (Karja et al., 2016) и для дымчатого леопарда, которая составляла 46 и 16% соответственно (Tipkantha et al., 2016). Лишь в случае бенгальского и амурского тигра проводилось гомологическое ЭКО ооцитов тигрицы, которое показало 70% дробления (Donoghue et al., 1992). Для некоторых видов собачьих и куньих проводили ИО, при этом частота наступления беременности у обыкновенной лисицы достигала 81% (Yatu et al., 2018), а у черноногого хорька – 28% (Howard et al., 2015).
Достижения и проблемы криоконсервации сперматозоидов представителей отряда хищных
В отряде хищных насчитывается 15 семейств (по данным NCBI taxonomy browser; https://www. ncbi.nlm.nih.gov/Taxonomy/Browser/wwwtax.cgi). Общей проблемой для отработки наиболее эффективных репродуктивных технологий по отношению к большинству этих семейств, является отсутствие доместицированных видов. Лишь для кошачьих, псовых и куньих имеются доместицированные представители, а именно – домашняя кошка, собака и хорек фуро, которые позволяют отработать соответствующие технологии получения и криоконсервации гамет и эмбрионов (Wildt et al., 1992), в частности, сперматозоидов, которые потом легче адаптировать к диким представителям этих семейств. Именно по этой причине, лишь для диких представителей данных трех семейств, а также медведей, имеются успешные работы с достаточно высокими показателями жизнеспособности семени после криоконсервации, что и отражено в табл. 1 и 2. Отдельно следует упомянуть медведей. Для этого семейства хищных нет доместицированных видов, которые могли бы быть использованы в качестве “модели” для отработки технологий, направленных на изучение диких видов. Между тем, как говорилось выше, шесть из восьми видов семейства являются уязвимыми. Соответственно, на это семейство были направлены большие усилия исследователей, и имеются работы по криоконсервации семени медвежьих (табл. 1, 2). По остальным видам хищных, не принадлежащих к этим четырем семействам, имеются лишь единичные работы, в которых обсуждается криоконсервация семени (Rodrigues da Paz, dos Santos Avila, 2015; Komatsu et al., 2021).
Серьезной проблемой, по крайней мере, для кошачьих, является тератоспермия, то есть присутствие сперматозоидов с морфологическими нарушениями, характерная для некоторых представителей данного семейства (Pukazhenti et al., 2006; Howard, Wildt, 2009). Низкий процент нормальных сперматозоидов (менее 40%) характерен для львов, ягуарунди, техасского подвида пумы; еще более низкий процент (20% и ниже) характерен для гепарда, дымчатого леопарда, и флоридского подвида пум, известного больше как “пантеры Флориды” (Pukazhenti et al., 2006). Между тем, как по данным этих авторов, так и по нашим собственным наблюдениям, для бенгальской кошки, в частности для подвида этой кошки – дальневосточного лесного кота, а также для некоторых других представителей кошачьих, не характерна тератоспермия (Pukazhenti et al., 2006). Авторы данного исследования считают, что тератоспермия характерна, в наибольшей мере, для тех видов кошачьих, у которых, в силу тех или иных причин, снижен уровень гетерозиготности и для которых уровень инбридинга достаточно высок; характерным примером таких кошачьих являются гепарды и “пантеры Флориды” (Pukazhenti et al., 2006). Следует отметить, что проблема тератоспермии характерна не только для кошачьих. Высокий уровень тератоспермии отмечен для черноного хорька (Howard, Wildt, 2009), вида куньих, который был на грани полного исчезновения и был восстановлен из популяции, которая состояла из 18 особей, причем лишь семь из них (три самца и четыре самки) были отобраны для программы восстановления этого вида куньих (Howard et al., 2015).
Как уже было сказано выше, основным способом взятия семени у живых представителей диких видов хищных является электроэякуляция, которую осуществляют под наркозом (Swanson, 2003). Имеются лишь отдельные исключения, в частности, обыкновенная лисица и песец, у которых, в условиях разведения на ферме, удавалось систематически получать эякулят мануальным способом (Jalkanen, 1993; Andraszek et al., 2020). Несмотря на то, что дозы и тип наркоза достаточно хорошо отработаны для представителей разных семейств отряда хищных, тем не менее, это является серьезным воздействием на животное, и сопряжено с определенным риском для его здоровья. Исходя из нашего опыта работы с куньими и кошачьими, проблемой является также то, что у некоторых особей вообще не удается получить эякуляцию при применении этого способа.
Проведенный анализ литературы позволяет сделать вывод о том, что в качестве основного криопротектора для замораживания семени различных представителей хищных чаще всего использует глицерин. Именно этот криопротектор был впервые использован для замораживания сперматозоидов более 70 лет назад (Polge et al., 1949) и до сих пор является криопротектором выбора при криоконсервации семени хищных (табл. 1). Использование данного криопротектора в некоторых случаях позволяет получить достаточно высокие показатели жизнеспособности и подвижности сперматозоидов различных представителей семейства кошачьих, псовых, медвежьих и куньих. Применение фирменных криопротекторных смесей (табл. 2), в целом, не дает ощутимого прироста показателей жизнеспособности после криоконсервации сперматозоидов различных видов диких хищных по сравнению с самостоятельно приготовленными криопротекторными смесями на основе глицерина (табл. 1). Между тем, использование фирменных криопротекторных смесей создает определенные преимущества при работе в условиях приближенным к полевым, о чем свидетельствует и наш собственный опыт (Amstislavsky et al., 2018).
Данные по жизнеспособности сперматозоидов после криоконсервации, полученные на представителях разных семейств хищных, тяжело поддаются сравнению, так как исследователи рассматривали различные индикаторы, такие как жизнеспособность, подвижность, оплодотворяющая способность сперматозоидов с использованием разных методов. В частности, фертильность (оплодотворяющую способность) сперматозоидов исследовали либо путем гомологического, либо путем гетерологического ЭКО, либо путем ИО. Создает определенные сложности и является достаточно серьезной проблемой также малый объем эякулята при работе с некоторыми дикими видами хищных (Luvoni, 2006; Franklin et al., 2018). Именно малый объем эякулята и относительный дефицит семени является важным аргументом в пользу выбора именно ЭКО, при работе с криоконсервированным семенем диких видов хищных семейства кошачьих, для этого способа требуется в сотни раз меньше подвижных жизнеспособных сперматозоидов, чем для ИО (Swanson et al., 2007).
Между тем, выбор того или иного способа работы с семенем, находящимся в криобанке, определяется конкретным видом хищных и осуществляется либо с экспериментальными целями, либо в контексте программы сохранения этого вида. Показательным примером, который, без сомнения является серьезным достижением в данной области, является применение криобанка в контексте усилий по сохранению вида черноногого хорька (Mustela nigripes) в Северной Америке (Howard et al., 2015). Более 130 потомков было получено путем ИО в ходе многолетней программы восстановления численности этого вида куньих (Howard, Wildt, 2009; Howard et al., 2015). Следует отметить, что, несмотря на то, что в большинстве случаев для этого использовали сперматозоиды не подвергавшееся криоконсервации, потомство было получено также и после ИО сперматозоидами, взятыми из криобанка, причем в некоторых случаях, эти сперматозоиды сохранялись в криобанке в течение двух десятилетий (Howard et al., 2015). Это может рассматриваться как несомненное достижение, поскольку криоконсервация мужских гамет в сочетании с другими методами, была успешно использована для восстановления вида хищных, находившегося на грани полного исчезновения.
КРИОКОНСЕРВАЦИЯ ООЦИТОВ И ПРЕИМПЛАНТАЦИОННЫХ ЭМБРИОНОВ ПРЕДСТАВИТЕЛЕЙ ОТРЯДА ХИЩНЫХ
Источник ооцитов и эмбрионов для криобанка представителей отряда хищных
Способы получения ооцитов и эмбрионов различаются в зависимости от вида животного и цели дальнейшего использования. В случае лабораторных модельных видов (например, домашняя кошка) чаще всего используют яичники, извлеченные после рутинной операции овариогистерэктомии в ветеринарных клиниках. Из таких яичников выделяют кумулюс-ооцитные комплексы (КОК) путем измельчения ткани кортекса и аспирации ооцитов из фолликулов. После процедуры сбора КОК-сы подвергаются селекции по качеству на основе морфологических критериев. Например, среди кошачьих КОК-сов наиболее пригодными для дальнейшего развития считаются такие, которые имеют правильную сферическую форму, темную однородную ооплазму и окружены не менее чем пятью слоями кумулюсных клеток (Wood, Wildt, 1997). Ооциты в таких комплексах, как правило, находятся на стадии герминального везикула (т.е. незрелые); их либо сразу криоконсервируют, либо вначале осуществляют дозревание in vitro с целью последующей криоконсервации или оплодотворения in vitro. При работе с редкими дикими видами хищных такая методика используется только при наличии медицинских показаний для операции (Boutelle et al., 2011) или post mortem: в случаях гибели особей, содержащихся в зоопарках, чтобы сохранить ценный генетический материал (Kochan et al., 2019). Иногда для получения ооцитов от диких видов хищных применяют гормонально индуцированную стимуляцию суперовуляции с последующей лапароскопической пункцией антральных фолликулов (Pope et al., 2006, 2012; Mastromonaco, Songsasen, 2020).
Особенностью представителей семейства псовых является то, что у них овуляция происходит не на стадии MII, а на более ранней стадии мейоза; при этом ооциты после овуляции дозревают в яйцеводах (Chastant-Maillard et al., 2011). С этим связаны проблемы создания условий для дозревания in vitro ооцитов диких представителей этого семейства (Amstislavsky et al., 2012). Между тем, были предприняты вполне успешные попытки криоконсервации ооцитов диких представителей семейства псовых (табл. 3) Есть несколько работ, посвященных in vitro дозреванию ооцитов представителей отряда медвежьих, например, барибала (Johnston et al., 1994) и бурого медведя (Yin et al., 2007). Что касается криоконсервации ооцитов медвежьих и куньих, в настоящее время пока не опубликовано работ на эту тему.
Таблица 3.
Криоконсервация ооцитов диких представителей отряда хищных (Carnivora)
| Вид животного | Криопротекторы | Характер криоконсервации, тип носителя | Лучший результат | Ссылка на исследование |
|---|---|---|---|---|
| Семейство кошачьих (Felidae) | ||||
| Сервал (Leptailurus serval)MII | Cryotech Vitrification kit (Cryotech, Japan) | Витрификация с использованием Rapid-I (Vitrolife, Sweden) | 70% живых ооцитов после окрашивания | Nowak et al., 2019 |
| Манул (Otocolobus manul)MII |
60% живых ооцитов после окрашивания | |||
| Семейство псовых (Canidae) | ||||
| Обыкновенная лисица (Vulpes vulpes)GV | 15% ЭГ, 15% ДМСО | Витрификация с использованием криопетли (cryoloop) | 42% ооцитов возобновивших мейоз, 5% дозревших до стадии MII после IVM | Cao et al., 2017 |
| Мексиканский волк (Canis lupus baileyi)GV | 15% ЭГ, 15% ДМСО, 0.5 М сахарозы | Витрификация с использованием Cryotop (Kitazato, Japan) | 41% живых ооцитов после окрашивания | Boutelle et al., 2011 |
Эмбрионы для криоконсервации могут быть получены in vitro или in vivo. В первом случае оплодотворение ооцитов можно произвести путем традиционного ЭКО или с помощью ИКСИ (Pope, 2012, 2014). Эмбрионы представителей хищных, развившиеся in vivo чаще всего получают путем хирургического извлечения их из репродуктивных путей спустя несколько дней после оплодотворения in vivo (путем спаривания с самцом либо после ИО) у наркотизированных животных с сохранением их репродуктивной функции (Lindeberg et al., 2003; Piltti et al., 2004; Guaitolini et al., 2012).
Способы криоконсервации ооцитов и эмбрионов представителей отряда хищных
Существуют два способа замораживания ооцитов и эмбрионов млекопитающих – программное замораживание и витрификация (Whittingham et al., 1972; Rall, Fahy, 1985; Saragusty, Arav, 2011). Программное замораживание является равновесным процессом, который характеризуется низкими скоростями охлаждения для поддержания внутриклеточной воды в переохлажденном состоянии, что способствует перемещению воды из внутриклеточных компартментов во внеклеточные, в конце концов, по окончании процесса внутриклеточные кристаллы льда образуются, но они мелкие и, соответственно, не слишком вредоносные для клеток (Mazur, 1990). В принципиальную схему программы входит первый этап охлаждения со скоростью 1–2°С/мин до температуры около –5…–7°С, при которой проводят принудительную нуклеацию льда во избежание спонтанной кристаллизации, и второй этап более медленного охлаждения (десятые доли градуса в минуту) до температуры ниже –30°С, при которой можно помещать носитель в жидкий азот. Для предотвращения повреждения и гибели клеток в процессе замораживания применяют различные криопротекторы, как описано выше.
Витрификация (стеклование) основывается на предположении о том, что при высоких концентрациях криопротектора и очень быстром снижении температуры клетки переходят в стекловидное состояние (витрифицируются), минуя стадию кристаллизации (Mazur, 1990). Переход раствора в аморфную фазу происходит обычно при высоких скоростях охлаждения – более 500°С/мин; при проведении витрификации используют криопротекторы в концентрации от 4 до 7 молей, то есть выше, чем при программном замораживании (Saragusty, Arav, 2011). В большинстве современных методов такие скорости охлаждения достигаются погружением материала непосредственно в жидкий азот (–196°С) или в переохлажденный воздух – например, закрытые системы Rapid-I (Nowak et al., 2019). Закрытые системы отличаются от открытых отсутствием прямого контакта материала с жидким азотом, который может привести к контаминации образца; однако при этом они могут проигрывать по скорости охлаждения и, следовательно, эффективности (Vajta et al., 2015). Наиболее популярными являются открытые системы, такие как OPS – open pulled straw (Luciano et al., 2009), Cryotop и Cryoloop (Mikolajewska et al., 2012). Помимо скорости охлаждения, важную роль также играют объем и вязкость среды, в которой криоконсервируют образцы (Saragusty, Arav, 2011).
Оба метода криоконсервации имеют свои преимущества и недостатки. Преимущество медленного замораживания заключается в использовании низких концентраций криопротекторов, тогда как для витрификации требуются высокие концентрации, которые связаны с химической токсичностью и осмотическим шоком (Shaw, Jones, 2003). Однако витрификация является быстрым методом, позволяющим избежать этапа длительного охлаждения, что снижает криоповреждения, возникающие в клетках при их охлаждении до околонулевых температур и при замораживании клеток в результате кристаллизации внутриклеточной воды (Kim, 2013). Это преимущество особенно существенно при криоконсервации ооцитов и эмбрионов тех видов, у которых высокое содержание липидов в их репродуктивных клетках (Amstislavsky et al., 2019).
Способы оценки жизнеспособности ооцитов и эмбрионов в процессе и после криоконсервации
Существуют многочисленные способы оценки жизнеспособности ооцитов после процедуры криоконсервации. В работе Новак с соавторами (2019), для оценки выживаемости ооцитов сервала (Leptailurus serval) и манула (Otocolobus manul) после витрификации, их окрашивали флуоресцентными красителями: бромистым этидием (ETBr) в сочетании с диацетатом флуоресцеина (FDA). Живые ооциты с неповрежденной клеточной мембраной светятся в зеленом диапазоне длин волн, в то время как мертвые ооциты светятся ярко-оранжевым (Nowak et al., 2019). Помимо этого, используют пропидия йодид (PI), который окрашивает только мертвые ооциты с поврежденной мембраной; именно этот метод применили для оценки выживания ооцитов мексиканского волка после криоконсервации (Canis lupus baileyi) (Boutelle et al., 2011). Также применяют методы световой, флуоресцентной и конфокальной микроскопии, кроме того, используют электронную микроскопию для оценки изменений в ооцитах после криоконсервации, в том числе и на субклеточном уровне (Turathum et al., 2010; Apparicio et al., 2013; Cao et al., 2017). Для оценки эффективности криоконсервации исследуют также митохондрии после окрашивания их митотрэкером (Cao et al., 2017). После витрификации ооцитов обыкновенной лисицы (Vulpes vulpes) оценивали содержание глутатиона – тиолового соединения, необходимого для пролиферации клеток, транспорта аминокислот, синтеза белков и ДНК, поддержания окислительно-восстановительного баланса. Было показано, что концентрация данного вещества значительно снижается в витрифицированных ооцитах после их оттаивания по сравнению с контролем (Cao et al., 2017). Важным методом оценки жизнеспособности ооцитов хищных после криоконсервации является их способность к оплодотворению и дальнейшему развитию эмбриона, как было показано в работе Лювони и Пеллиццари (2000) на ооцитах домашней кошки (Felis silvestris catus) (Luvoni, Pellizzari, 2000).
Эффективность криоконсервации эмбрионов оценивают по их способности к развитию в культуре in vitro после цикла замораживания/оттаивания (Crichton et al., 2003; Mokrousova et al., 2020b). Наиболее убедительный способ проверки жизнеспособности эмбрионов после криоконсервации – это трансплантация их соответствующему реципиенту. Такие работы на представителях отряда хищных проведены преимущественно на домашних кошках (Dresser et al., 1988; Pope, 2000, 2014), собаках (Nagashima et al., 2015; Hori et al., 2016) и хорьках (Lindeberg et al., 2003; Piltti et al., 2004; Sun et al., 2008), а также на нескольких диких видах кошачьих (Pope et al., 2006; Conforti et al., 2008; Pope et al., 2012).
Способов оценить происходящие в живых клетках процессы, непосредственно в ходе охлаждения и замораживания эмбрионов и ооцитов, не много. Классическим методом является криомикроскопия, в ходе которого можно следить за ходом кристаллизации в охлаждаемых образцах (Mazur, 1990). На рис. 2 представлен эмбрион домашней кошки до начала охлаждения и в процессе охлаждения, данные получены с использованием криомикроскопа. Существуют и другие методы, которые позволяют “заглянуть внутрь” образца при его охлаждении. В частности, метод спектроскопии комбинационного рассеяния света (КРС) позволяет получить информацию о ходе кристаллизации в образце в процессе его охлаждения и оценить соотношение жидкой и твердой фазы воды (Karpegina et al., 2016). В ходе наших исследований с применением этой методики по отношению к эмбрионам и ооцитам домашней кошки удалось оценить температуру фазового перехода в процессе их охлаждения (Okotrub et al., 2018; Mokrousova et al., 2020b). Данная методика позволяет получать информацию об отдельных клетках в реальном времени в процессе их охлаждения, не вводя в клетки каких-либо меток. Наряду со спектроскопией КРС, для неинвазивного мониторинга живых клеток применяют также инфракрасную (ИК) спектроскопию (Ishigaki et al., 2016).
Современные достижения и проблемы криоконсервации ооцитов представителей отряда хищных
Ооциты и преимплантационные эмбрионы всех представителей отряда хищных, например, домашней кошки, содержат большое число внутриклеточных липидных гранул – ЛГ (Guraya, 1965; Amstislavsky et al., 2019). Содержание большого числа ЛГ в репродуктивных клетках млекопитающих может оказывать влияние на эффективность их криоконсервации (Hwang, Hochi, 2014; Amstislavsky et al., 2019). При этом, как мы полагаем, большую роль может играть не только количественный, но и качественный состав ЛГ, например, степень ненасыщенности содержащихся в них липидов. Существует предположение, что чем больше ненасыщенных жирных кислот содержится в ЛГ, тем ниже точка фазового перехода липидов при охлаждении клеток (Okotrub et al., 2018) и тем выше может быть эффективность их криоконсервации (Amstislavsky et al., 2019). Одним из способов модификации липидного состава ооцитов и эмбрионов млекопитающих является введение жирных насыщенных и ненасыщенных жирных кислот (Aardema et al., 2017; Брусенцев и др., 2020; Ranneva et al., 2020). Поскольку спектры КРС чувствительны к структуре молекул и их окружению, измеряя КРС можно определять концентрацию веществ, их фазовое состояние и фазовые переходы (Mokrousova et al., 2020a, 2020b; Ranneva et al., 2020). С помощью спектроскопии КРС было показано, что клеточные липиды претерпевают размытый фазовый переход, при котором наблюдается разделение фаз (Mokrousova et al., 2020b). Нами было изучено распределение стеариновой кислоты, меченной дейтерием, в липидных гранулах ооцитов домашней кошки после культивирования in vitro (Ranneva et al., 2020). Исследование показало, что встраивание жирной кислоты происходит во все липидные гранулы ооцита. Кроме того, различные гранулы одного ооцита имеет разную концентрацию введенной кислоты в зависимости от времени культивирования (Ranneva et al., 2020). В настоящее время, данная работа продолжается нами в плане изучения влияния культивирования эмбрионов домашней кошки с линолевой кислотой на их способность переживать охлаждение и криоконсервацию (рис. 2).
Ооциты представителей отряда хищных иногда, хотя и редко, криоконсервируют путем программного замораживания (Luvoni, Pellizzari, 2000), чаще используют витрификацию (Boutelle et al., 2011; Galiguis et al., 2014; Cao et al., 2017; Turathum et al., 2018; Nowak et al., 2019). Результаты этих работ представлены в табл. 3. Исходя из теоретических предпосылок, в качестве наиболее предпочтительного криопротектора для криоконсервации ооцитов хищных млекопитающих может выступать ДМСО, поскольку именно он обладает липофильными свойствами и может легко проходить через цитоплазматические мембраны клеток, и, возможно, даже проникать непосредственно в ЛГ (Кулешова и др., 2014). Действительно, чаще всего, протокол, предназначенный для криоконсервации ооцитов представителей семейств отряда хищных, включает в качестве одного из криопротекторов именно ДМСО (Boutelle et al., 2011; Galiguis et al., 2014; Cao et al., 2017; Turathum et al., 2018). В частности, с применением смеси криопротекторов, имеющих в своем составе ДМСО, успешно удалось витрифицировать ооциты домашней собаки (Turathum et al., 2010), кошки (Galiguis et al., 2014), обыкновенной лисицы (Cao et al., 2017) и мексиканского волка (Boutelle et al., 2011).
Между тем, для этих же целей иногда используют стандартные коммерческие наборы для витрификации. В частности, в работе Аппаричио с соавторами (Apparicio et al., 2013) КОК-сы домашней кошки были витрифицированы с использованием фирменной смеси криопротекторов предназначенной для ооцитов крупного рогатого скота (Apparicio et al., 2013). Относительно недавно, ооциты сервала (Leptailurus serval) и манула (Otocolobus manul) криоконсервировали с использованием специального набора для витрификации, используемого в медицине: Cryotech Vitrification kit (Cryotech, Japan) (Nowak et al., 2019).
Достижения и проблемы криоконсервации эмбрионов представителей отряда хищных
На домашних кошках, собаках и хорьках были отработаны протоколы, как программного замораживания (Dresser et al., 1988; Gomez et al., 2003; Lindeberg et al., 2003; Tsujioka et al., 2008; Pope et al., 2011), так и витрификации (Piltti et al., 2004; Hori et al., 2016). Эти протоколы были применены к диким видам хищных. При этом наибольшее число работ по криоконсервации эмбрионов среди представителей отряда Carnivora было выполнено на кошачьих (Pope et al., 2012; Amstislavsky et al., 2012).
Как правило, программное замораживание при криоконсервации эмбрионов кошачьих используют чаще, чем витрификацию. Имеется лишь несколько исследований по витрификации эмбрионов кошачьих, причем все они проведены на домашней кошке. В одном из недавних исследований был выявлен высокий уровень апоптоза после витрификации эмбрионов домашних кошек (Ochota, Nizanski, 2018). Программное замораживание оказалось более щадящим способом по отношению к кошачьим эмбрионам, чем витрификация, если судить как по развитию эмбрионов в культуре in vitro (Pederson et al., 2009), так и по получению живого потомства (Pope et al., 2012). Результат получения живого потомства после витрификации эмбрионов домашней кошки обычно хуже, чем после программного замораживания. В исследовании, в котором эмбрионы домашней кошки после витрификации и оттаивания были пересажены реципиентам, родилось лишь пять котят: 6% от общего числа подсаженных эмбрионов. При этом наблюдались осложненные роды, всем кошкам приходилось делать кесарево сечение; более того, выжил лишь один котенок из пяти рожденных (Pope et al., 2012). В нашем недавнем исследовании не было обнаружено статистических различий по частоте развития in vitro и фрагментации ядер эмбрионов домашних кошек после замораживания/оттаивания и витрификации/отогрева (Mokrousova et al., 2020b). При сравнении же программного замораживания и витрификации по отношению к эмбрионам собаки, выяснилось, что, напротив, витрификация оказалась предпочтительнее, в связи с тем, что только после витрификации удалось получить живое потомство (Hori et al., 2016).
По отношению к куньим (Mustelidae) прямого сравнения витрификации и программного замораживания в рамках одного исследования не проводилось. Между тем, удалось успешно криоконсервировать эмбрионы домашнего хорька (Mustela putorius furo) при применении обоих этих способов и получить живое потомство как после программного замораживания (Lindeberg et al., 2003), так и после витрификации (Piltti et al., 2004; Sun et al., 2008).
До настоящего времени все случаи успешного применения криоконсервации эмбрионов диких представителей отряда Carnivora были отмечены исключительно на кошачьих (табл. 4). Так с использованием смеси пропиленгликоля и сахарозы в качестве криопротекторов удалось криоконсервировать дробящиеся эмбрионы африканской дикой кошки (Felis silvestris lybica), а после оттаивания и эмбриотрансфера от одной из кошек-реципиентов получить живого котенка (Pope, 2000). Та же самая смесь криопротекторов и сходный протокол замораживания были использованы для криоконсервации морул каракала (Caracal caracal); после эмбриотрансфера взятых из криобанка эмбрионов родились три нормальных котенка (Pope et al., 2006). Аналогичным способом были успешно заморожены двухклеточные эмбрионы черноногой кошки (Felis nigripes), при этом удалось получить от одной кошки-реципиента двух живых котят (Pope et al., 2012). Для криоконсервации бластоцист оцелота (Leopardus pardalis mitis) в качестве криопротектора использовали этиленгликоль; после оттаивания и эмбриотрансфера было получено три котенка (Conforti et al., 2008).
Таблица 4.
Криоконсервация преимплантационных эмбрионов диких представителей отряда хищных (Carnivora)
| Вид животного | Крио-протекторы | Стадия | Тип крио-консервации | % развития1 | % беременных самок | % рождения2 | Ссылка на исследование |
|---|---|---|---|---|---|---|---|
| Семейство кошачьих (Felidae) | |||||||
| Африканская дикая кошка (Felis silvestris lybica) | 10% ПГ и 0.125 М сахарозы | Дробления | Программное замораживание3 | – | 14.3 (1/7) | 1.8 (1/55)5 | Pope, 2000 |
| Амурский тигр (Panthera tigris altaica) | 16.5% ЭГ, 16.5% ДМСО и 0.5 М сахарозы | 2-кл и 4-кл | Витрификация4 | 46 (32/70) | – | – | Crichton et al., 2003 |
| Каракал (Caracal caracal) | 10% ПГ и 0.125 М сахарозы | Морулы | Программное замораживание3 | – | 33.3 (3/9) | 2.8 (3/109)5 | Pope et al., 2006 |
| Оцелот (Leopardus pardalis mitis) | 10% ЭГ | Бластоцисты | Программное замораживание3 | – | 33.3 (3/9) | 12.5 (3/24)6 | Conforti et al., 2008 |
| Черноногая кошка (Felis nigripes) | 10% ПГ и 0.125 М сахарозы | 2-кл | Программное замораживание3 | – | 50 (1/2) | 14.3 (2/14)5 | Pope et al., 2012 |
1 После отогрева и культивирования in vitro (число развивающихся эмбрионов/общее число эмбрионов в эксперименте по культивированию); 2 доля котят от общего числа трансплантированных эмбрионов (число котят/число эмбрионов); 3 с использованием классической схемы с модификацией; 4 с использованием OPS (open pulled straw) в качестве метода витрификации; 5 преимплантационные эмбрионы трансплантировали животным реципиентам после отогрева и культивирования in vitro; 6 преимплантационные эмбрионы трансплантировали животным реципиентам сразу после их отогрева, минуя процесс их культивирования in vitro.
Таким образом, практически все успешные исследования по криоконсервации эмбрионов диких видов кошачьих выполнены путем программного замораживания. Исключение составляет только амурский тигр (Panthera tigris altaica); в данном случае эффективной процедурой криоконсервации оказалась витрификация, а программное замораживание оказалось не эффективным (Crichton et al., 2003). Однако живое потомство после этих процедур получено не было, что не позволяет полностью оценить потенциал применения витрификации по отношению к эмбрионам кошачьих.
ЗАКЛЮЧЕНИЕ
Различные представители отряда хищных находятся под угрозой исчезновения или являются уязвимыми. Репродуктивные технологии, направленные на сохранение генетического разнообразия диких видов этого отряда, применялись, чаще всего, по отношению к кошачьим, псовым, куньим и медвежьим. Лишь на кошачьих успешно применяли криоконсервацию в отношении как эмбрионов, так сперматозоидов и ооцитов диких видов этого семейства. В отношении диких представителей семейства псовых криоконсервацию успешно применяли по отношению к сперматозоидам и ооцитам. Что касается диких видов медвежьих и куньих, то в отношении этих семейств криоконсервацию применяли лишь на сперматозоидах. В целом, эффективность криоконсервации гамет и эмбрионов хищных ниже, чем для большинства лабораторных и сельскохозяйственных видов животных. Для многих видов хищных протоколы криоконсервации репродуктивных клеток, на сегодняшний день, вообще отсутствуют.
Электроэякуляция, на сегодняшний день, является наиболее универсальным приемом получения семени у диких представителей отряда хищных. Между тем объем эякулята, концентрации сперматозоидов, процент тератоспермии может существенно отличаться у разных видов даже в пределах одного семейства. Соответственно, используют разные подходы, в случае если семени достаточно много, применяют ИО, если имеется ограниченное число сперматозоидов, то используют классическое ЭКО, либо осуществляют ИКСИ, если качество мужских гамет плохое или сперматозоидов очень мало.
В настоящее время не существует единого протокола криоконсервации или универсальной криопротекторной смеси, которая могла бы позволить одинаково успешно замораживать репродуктивные клетки всех видов хищных вне зависимости от принадлежности к тому или иному семейству. Анализ опубликованных работ позволяет сделать заключение о том, что внутри отряда хищных существуют межвидовые различия, которые могут повлиять на эффективность криоконсервации гамет и преимплантационных эмбрионов. Наличие доместицированных видов, как в случае кошачьих, псовых и куньих существенно облегчает подбор наиболее эффективных репродуктивных технологий и создание криобанка генетических ресурсов для диких видов этих семейств.
Наибольший прогресс среди диких видов хищных достигнут в области криоконсервации сперматозоидов, о чем свидетельствует большое число опубликованных статей. Гораздо меньше успешных работ по криоконсервации преимплантационных эмбрионов диких видов хищных, причем, даже в случае успеха, эти работы, как правило, были выполнены лишь единожды. Что касается ооцитов, то, на сегодняшний день, успешных работ по их криоконсервации у хищных лишь единицы. Одной из важных причин этого состоит в том, что клетки преимплантационных эмбрионов и ооцитов всех видов отряда хищных имеют повышенное содержание внутриклеточных липидов, что усложняет процесс их успешной криоконсервации. Роль внутриклеточных липидов в развитии ооцитов и эмбрионов активно изучают на разных моделях. Между тем, необходимы дополнительные эксперименты для понимания роли внутриклеточных липидов в ходе криоконсервации ооцитов и эмбрионов хищных.
В целом, можно заключить, что благодаря прогрессу репродуктивных технологий, их применение является перспективным подходом к сохранению генетических ресурсов и решения репродуктивных проблем некоторых представителей отряда Carnivora. Криоконсервация сперматозоидов уже на сегодняшний день применяется в программах, направленных на сохранение некоторых уязвимых и исчезающих видов хищных и восполнение генетического разнообразия существующих популяций ex situ. Между тем, требуются дополнительные эксперименты на доступных экспериментальных моделях, в частности, на домашней кошке, собаке и хорьке, направленные на разработку эффективных протоколов криоконсервации ооцитов и преимплантационных эмбрионов диких видов хищных.
Список литературы
Амстиславский С.Я., Брусенцев Е.Ю., Окотруб К.А., Рожкова И.Н. Криоконсервация эмбрионов и гамет для сохранения генетических ресурсов лабораторных животных // Онтогенез. 2015. Т. 46. № 2. С. 47–59.
Брусенцев Е.Ю., Чуйко Э.А., Окотруб К.А., Игонина Т.Н., Рожкова И.Н., Рагаева Д.С., Раннева С.В., Напримеров В.А., Амстиславский С.Я. Влияние диеты с повышенным содержанием жира на липидный профиль ооцитов мышей // Вавиловский журнал генетики и селекции. 2020. Т. 24. № 5. С. 533–538.
Брусенцев Е.Ю., Мокроусова В.И., Игонина Т.Н., Рожкова И.Н., Амстиславский С.Я. Роль липидных гранул в развитии ооцитов и эмбрионов млекопитающих // Онтогенез. 2019. Т. 50. № 5. С. 297–305.
Кулешова Л.Г., Гоpдиенко Е.А., Коваленко И.Ф. Проницаемость плазматических мембран, изолированных гепатоцитов крыс для молекул диметилсульфоксида // Биофизика. 2014. Т. 59. № 3. С. 474–480.
Aardema H., van Tol H.T.A., Wubbolts R.W., Brouwers J.F.H.M., Gadella B.M., Roelen B.A.J. Stearoyl-CoA desaturase activity in bovine cumulus cells protects the oocyte against saturated fatty acid stress // Biol. Reprod. 2017. V. 96. № 5. P. 982–992.
Agca Y. Genome resource banking of biomedically important laboratory animals // Theriogenology. 2012. V. 78. P. 1653–1665.
Andraszek K., Banaszewska D., Szeleszczuk O., Kuchta-Gładysz M., Grzesiakowska A. Morphometric characteristics of the spermatozoa of blue fox (Alopex lagopus) and silver fox (Vulpes vulpes) // Animals. 2020. V. 10. 1927.
Ambarli H., Erturk A., Soyumert A. Current status, distribution, and conservation of brown bear (Ursidae) and wild canids (gray wolf, golden jackal, and red fox; Canidae) in Turkey // Turkish J. Zoology. 2016. V. 40. № 6. P. 944–956.
Amstislavsky S., Mokrousova V., Brusentsev E., Okotrub K., Comizzoli P. Influence of cellular lipids on cryopreservation of mammalian oocytes and preimplantation embryos: a review // Biopreserv. Biobank. 2019. V. 17. № 1. 76–83.
Amstislavsky S., Brusentsev E., Kizilova E. et al. Sperm cryopreservation in the Far-Eastern wildcat (Prionailurus bengalensis euptilurus) // Reprod. Domest. Anim. 2018. V. 53. № 5. P. 1219–1226.
Amstislavsky S., Lindeberg H., Luvoni G. Reproductive technologies relevant to the genome resource bank in Carnivora // Reprod. Domest. Anim. 2012. V. 47. № 1. P. 164–175.
Amstislavsky S., Lindeberg H., Aalto J., Kennedy M.W. Conservation of the European mink (Mustela lutreola): focus on reproduction and reproductive technologies // Reprod. Domest. Anim. 2008. V. 43. № 4. P. 502–513.
Anel-Lopez L., Ortega-Ferrusola C., Alvarez M. et al. Improving sperm banking efficiency in endangered species through the use of a sperm selection method in brown bear (Ursus arctos) thawed sperm // BMC Vet. Res. 2017. V. 13. № 1. P. 200.
Apparicio M., Ruggeri E., Luvoni G.C. Vitrification of immature feline oocytes with a commercial kit for bovine embryo vitrification // Reprod. Domest. Anim. 2013. V. 48. № 2. P. 240–244.
Bateman H.L., Swanson W.F. Interaction of extender composition and freezing method for effective semen cryopreservation in the North American river otter (Lontra canadensis) // Theriogenology. 2017. V. 101. P. 26–34.
Baudi D.L.K., Jewgenow K., Pukazhenthi B.S. et al. Influence of cooling rate on the ability of frozen-thawed sperm to bind to heterologous zona pellucida, as assessed by competitive in vitro binding assays in the ocelot (Leopardus pardalis) and tigrina (Leopardus tigrinus) // Theriogenology. 2008. V. 69. № 2. P. 204–211.
Bjorndahl L., Soderlund I., Kvist U. Evaluation of the one-step eosin-nigrosin staining technique for human sperm vitality assessment // Hum. Reprod. 2003. V. 18. № 4. P. 813–816.
Boutelle S., Lenahan K., Krisher R., Bauman K.L., Asa C.S., Silber S. Vitrification of oocytes from endangered Mexican gray wolves (Canis lupus baileyi) // Theriogenology. 2011. V. 75. № 4. P. 647–654.
Brusentsev E., Kizilova E., Mokrousova V. et al. Characteristics and fertility of domestic cat epididymal spermatozoa cryopreserved with two different freezing media // Theriogenology. 2018. V. 110. P. 148–152.
Buranaamnuay K. Protocols for sperm cryopreservation in the domestic cat: A review // Anim. Reprod. Sci. 2017. V. 183. P. 56–65.
Cai Z.G., An J.H., Liu Y.L. et al. Single layer centrifugation improves the quality of frozen-thawed sperm of giant panda (Ailuropoda melanoleuca) // Anim. Reprod. Sci. 2018. V. 195. P. 58–64.
Cao X., Li J., Xue H. et al. Effect of vitrification on meiotic maturation, mitochondrial distribution and glutathione synthesis in immature silver fox cumulus oocyte complexes // Theriogenology. 2017. V. 91. P. 104–111.
Chastant-Maillard S., Viaris de Lesegno C., Chebrout M. et al. The canine oocyte: uncommon features of in vivo and in vitro maturation // Reprod. Fertil. Dev. 2011. V. 23. № 3. P. 391–402.
Chatdarong K. Retained fertilizing capability in cryopreserved feline spermatozoa // Reprod. Dom. Anim. 2017. V. 52. P. 261–264.
Cheuqueman C., Faundez R., Sanchez R., Risopatron J. Changes in sperm function and structure after freezing in domestic cat spermatozoa // Andrologia. 2018. V. 50. № 9. e13080.
Cocchia N., Ciani F., El-Rass R. et al. Cryopreservation of feline epididymal spermatozoa from dead and alive animals and its use in assisted reproduction // Zygote. 2009. V. 18. P. 1–8.
Comizzoli P., Holt W.V. Breakthroughs and new horizons in reproductive biology of rare and endangered animal species // Biol. Reprod. 2019. V. 101. № 3. P. 514–525.
Comizzoli P., Holt W.V. Recent advances and prospects in germplasm preservation of rare and endangered species. Reproductive sciences in animal conservation, advances in experimental medicine and biology / Eds. Holt W.V., et al. N.Y.: Springer Science, 2014. 753. P. 331–356.
Conforti V., Adania C.H., Gonzalez P.G. et al. Novel recipient synchronization regimens for successful embryo transfer in the Brazilian ocelot following long-term frozen embryo storage // Reprod. Fertil. Dev. 2008. V. 21. № 1.
Crichton E.G., Bedows E., Miller-Lindholm A.K. et al. The efficacy of porcine gonadotropins for repeated stimulation of ovarian activity for oocyte retrieval and in vitro embryo production and cryopreservation in Siberian tigers (Panthera tigris altaica) // Biol. Reprod. 2003. V. 68. P. 105–113.
Damiani P., Gomez M.C., Cole A. et al. The production of intracytoplasmic sperm injection lion (Pantera leo) embyros using spermatozoa collected by percutaneous epididymal sperm aspiration from vasectomized males // Reprod. Fertil. Dev. 2003. V. 16. № 2. P. 223–224.
Donoghue A.M., Johnston L.A., Seal U.S. et al. Ability of thawed tiger (Panthera tigris) spermatozoa to fertilize conspecific eggs and bind and penetrate domestic cat eggs in vitro // Reproduction. 1992. V. 96. № 2. P. 555–564.
Dresser B.L., Gelwicks E.J., Wachs K.B., Keller G.L. First successful transfer of cryopreserved feline (Felis catus) embryos resulting in live offspring // J. Exp. Zool. 1988. V. 246. № 2. P. 180–186.
Elliott G.D., Wang S., Fuller B.J. Cryoprotectants: A review of the actions and applications of cryoprotective solutes that modulate cell recovery from ultra-low temperatures // Cryobiology. 2017. V. 76. P. 74–91.
Erdmann R.H., Blank M.H., Ribeiro R.N., et al. Cryopreservation of margay (Leopardus wiedii) spermatozoa: Effects of different extenders and frozen protocols // Theriogenology. 2019. V. 143. P. 27–34.
Fernandez-Gonzalez L., Hribal R., Stagegaard J., Zahmel J., Jewgenow K. Production of lion (Panthera leo) blastocysts after in vitro maturation of oocytes and ICSI // Theriogenology. 2015. V. 83. № 6. P. 995–999.
Franklin A.D., Waddell W.T., Goodrowe K.L. Red wolf (Canis rufus) sperm quality and quantity is affected by semen collection method, extender components, and post-thaw holding temperature // Theriogenology. 2018. V. 116. P. 41–48.
Galiguis J., Gomez M.C., Leibo S.P., Pope C.E. Birth of a domestic cat kitten produced by vitrification of lipid polarized in vitro matured oocytes // Cryobiology. 2014. V. 68. № 3. P. 459–466.
Ganan N., Gonzalez R., Garde J.J. et al. Assessment of semen quality, sperm cryopreservation and heterologous IVF in the critically endangered Iberian lynx (Lynx pardinus) // Reprod. Fertil. Devel. 2009a. V. 21. № 7. P. 848–859.
Ganan N., Gonzalez R., Sestelo A. et al. Male reproductive traits, semen cryopreservation, and heterologous in vitro fertilization in the bobcat (Lynx rufus) // Theriogenology. 2009b. V. 72. № 3. P. 341–352.
Gomez M.C., Pope E., Harris R., Mikota S., Dresser B.L. Development of in vitro matured, in vitro fertilized domestic cat embryos following cryopreservation, culture and transfer // Theriogenology. 2003. V. 60. № 2. P. 239–251.
Guaitolini C.R., Taffarel M.O., Teixeira N.S., Sudano M.J., Freitas P.M., Lopes M.D., Landin-Alvarenga Fda C., de Oliveira C.A., Luz M.R. Post-thaw viability of in vivo-produced canine blastocysts cryopreserved by slow freezing // Theriogenology. 2012. V. 78. № 3. P. 576–582.
Gundu E.G., Adia J.E. Conservation methods of endangered species // J. Res. Fores. Wildl. Envir. 2014. V. 6. № 2. P. 76–83.
Guraya S.S. A histochemical analysis of lipid yolk deposition in the oocytes of cat and dog // J. Exp. Zool. 1965. V. 160. № 1. P. 123–135.
Ha A.N., Jo A.R., Kim Y.G. et al. Establishment of cryopreservation of leopard cat semen collected by electro-ejaculation method // J. Emb. Trans. 2011. V. 26. № 4. P. 245–250.
Hori T., Ushijima H., Kimura T. et al. Intrauterine embryo transfer with canine embryos cryopreserved by the slow freezing and the Cryotop method // J. Vet. Med. Sci. 2016. V. 78. № 7. P. 1137–1143.
Howard J.G., Lynch C., Santymire R., Marinari P., Wildt D.E. Recovery of gene diversity using long-term, cryopreserved spermatozoa in the endangered black-footed ferret // Anim. Conserv. 2015. V. 19. P. 102–111.
Howard J.G., Wildt D.E. Approaches and efficacy of artificial insemination in felids and mustelids // Theriogenology. 2009. V. 71. P. 130–148.
https://www.canids.org/5.
https://www.iucn.org.
https://www.iucnredlist.org/search?taxonomies=100041& searchType=species.
https://www.ncbi.nlm.nih.gov/Taxonomy/Browser/wwwtax.cgi.
Hwang I.S., Hochi S. Recent progress in cryopreservation of bovine oocytes // Biomed. Res. Int. 2014. V. 2014. P. 570 647.
Ishigaki M., Kawasaki S., Ishikawa D., Ozaki Y. Near-infrared spectroscopy and imaging studies of fertilized fish eggs: in vivo monitoring of egg growth at the molecular level // Sci. Rep. 2016. V. 6. P. 20 066.
Jalkanen L. Sperm abnormalities in silver fox (Vulpes vulpes) semen selected for artificial insemination // J. Reprod. Fertil. 1993. P. 287–290.
Jara B., Merino O., Sanchez R., Risopatron J. Positive effect of butylated hydroxytoluene (BHT) on the quality of cryopreserved cat spermatozoa // Cryobiology. 2019. V. 89. P. 76–81.
Jayaprakash D., Patil S.B., Kumar M.N., Majumdar K.C., Shivaji S. Semen characteristics of the captive Indian leopard, Panthera pardus // Journal of Andrology. 2001. V. 22. № 1. P. 25–33.
Jeong D.H., Kim J.H., Na K.J. Characterization and cryopreservation of Amur leopard cats (Prionailurus bengalensis euptilurus) semen collected by urethral catheterization // Theriogenology. 2018. V. 119. P. 91–95.
Johnson A.E., Freeman E.W., Wildt D.E., Songsasen N. Spermatozoa from the maned wolf (Chrysocyon brachyurus) display typical canid hyper-sensitivity to osmotic and freezing-induced injury, but respond favorably to dimethyl sulfoxide // Cryobiology. 2014. V. 68. № 3. P. 361–370.
Johnston L.A., Donoghue A.M., Igo W., Simmons L.G., Wildt D.E., Rieffenberger J. Oocyte recovery and maturation in the American black bear (Ursus americanus): a model for endangered ursids // J. Exp. Zool. 1994. V. 269. P. 53–61.
Karja N.W.K., Fahrudin M., Agus Setiadi M. et al. Characteristics and fertility of sumatran tiger spermatozoa cryopreserved with different sugars // Cryoletters. 2016. V. 37. № 4. P. 264–271.
Karpegina Y.A., Okotrub K.A., Brusentsev E.Y., Amstislavsky S.Y., Surovtsev N.V. Cryoprotectant redistribution along the frozen straw probed by Raman spectroscopy // Cryobiology. 2016. V. 72. № 2. P. 148–153.
Kheirkhah M.S., Mollapour Sisakht M., Mohammadsadegh M., Moslemi H.R. Sperm evaluation of Jungle Cat (Felis chaus) obtained by urethral catheterization (CT) after medetomidine administration // Theriogenology. 2017. V. 91. P. 17–20.
Kim S. Oocyte biology in fertility preservation. Vitrification of oocytes: from basic science to clinical application // Adv. Exp. Med. Biol. 2013. V. 761. Chapter 6. P. 69–83.
Kochan J., Nizanski W., Moreira N. et al. ARTs in Wild Felid Conservation Programmes in Poland and in the World // J. Vet. Res. 2019. V. 63. № 3. P. 457–464.
Komatsu K., Iwasaki T., Murata K. et al. Morphological reproductive characteristics of testes and fertilization capacity of cryopreserved sperm after the Fukushima accident in raccoon (Procyon lotor) // Reprod. Domest. Anim. 2021. V. 56. № 3. P. 484–497.
Lamberski N. Felidae // Fowler’s Zoo and Wild Animal Medicine. 2015. V. 8. P. 467–476.
Larson J.L., Miller D.J. Simple histochemical stain for acrosomes on sperm from several species // Mol. Reprod. Dev. 1999. V. 52. № 4. P. 445–449.
Leibo S.P., Songsassen N. Cryopreservation of gametes and embryos of nondomestic species // Theriogenology. 2002. V. 57. P. 303–326.
Lindeberg H., Aalto J., Amstislavsky S. et al. Surgical recovery and successful surgical transfer of conventionally frozen-thawed embryos in the farmed European polecat (Mustela putorius) // Theriogenology. 2003. V. 60. № 8. P. 1515–1525.
Luciano A.M., Chigioni S., Lodde V., Franciosi F., Luvoni G.C., Modina S.C. Effect of different cryopreservation protocols on cytoskeleton and gap junction mediated communication integrity in feline germinal vesicle stage oocytes // Cryobiology. 2009. V. 59. № 1. P. 90–95.
Lueders I., Ludwig C., Schroeder M., Mueller K., Zahmel J., Dehnhard M. Successful nonsurgical artificial insemination and hormonal monitoring in an Asiatic golden cat (Catopuma temmincki) // J. Zoo. Wildl. Med. 2014. V. 45. № 2. P. 372–379.
Lueders I., Luther I., Scheepers G., van der Horst G. Improved semen collection method for wild felids: urethral catheterization yields high sperm quality in African lions (Panthera leo) // Theriogenology. 2012. V. 78. № 3. P. 696–701.
Luther I., Jakop U., Lueders I. et al. Semen cryopreservation and radical reduction capacity of seminal fluid in captive African lion (Panthera leo) // Theriogenology. 2017. V. 89. P. 295–304.
Luvoni G.C. Gamete cryopreservation in the domestic cat // Theriogenology. 2006. V. 66. № 1. P. 101–111.
Luvoni G.C., Pellizzari P. Embryo development in vitro of cat oocytes cryopreserved at different maturation stages // Theriogenology. 2000. V. 53. № 8. P. 1529–1540.
Macente B.I., Gutierrez R.R., Apparicio M. et al. Cat epididymal semen cryopreserved with and without vitamin E: effect on sperm parameters and lipid peroxidation // Anim. Reprod. AR. 2018. V. 15. № 4. P. 1193–1198.
Mastromonaco G.F., Songsasen N. Reproductive technologies for the conservation of wildlife and endangered species // Reproductive Technologies in Animals. 2020. pp. 99–117.
Mazur P. Equilibrium, quasi-equilibrium, and nonequilibrium freezing of mammalian embryos // Cell Biophys. 1990. V. 17. № 1. P. 53–92.
Mikolajewska N., Muller K., Nizanski W., Jewgenow K. Vitrification of domestic cat oocytes-effect on viability and integrity of subcellular structures // Reprod. Domest. Anim. 2012. V. 47. P. 295–299.
Minter L.J., DeLiberto T.J. Influence of extender, freezing rate, and thawing rate on post-thaw motility, viability and morphology of coyote (Canis latrans) spermatozoa // Theriogenology. 2005. V. 64. № 9. P. 1898–1912.
Mokrousova V.I., Okotrub K.A., Brusentsev E.Yu. et al. Effects of slow freezing and vitrification on viability in domestic cat embryos // Reprod. Dom. Anim. 2020a. V. 55. P. 1328–1336.
Mokrousova V.I., Okotrub K.A., Amstislavsky S.Y., Surovtsev N.V. Raman spectroscopy evidence of lipid separation in domestic cat oocytes during freezing // Cryobiology. 2020b. V. 95. P. 177–182.
Moro L.N., Sestelo A.J., Salamone D.F. Evaluation of cheetah and leopard spermatozoa developmental capability after interspecific ICSI with domestic cat oocytes // Reprod. Dom. Anim. 2014. V. 49. № 4. P. 693–700.
Nagashima J.B., Sylvester S.R., Nelson J.L. et al. Live births from domestic dog (Canis familiaris) embryos produced by in vitro fertilization // PLoS One. 2015. V. 10. № 12. e0143930.
Nowak A., Kochan J., Prochowska S., Partyka A., Młodawska W., Witarski W., Skotnicki J., Grega T., Pałys M., Nizanski W. The viability of serval (Leptailurus serval) and pallas cat (Felis manul) oocytes after cryopreservation using the Rapid-I method // Cryo Letters. 2019. V. 40. № 4. P. 226–230.
Nunez-Martinez I., Moran J.M., Pena F.J. A three-step statistical procedure to identify sperm kinematic subpopulations in canine ejaculates: changes after cryopreservation // Reprod. Domest. Anim. 2006. V. 41. № 5. P. 408–415.
Ochota M., Nizanski W. Effect of vitrification on apoptotic changes in feline embryos // Czech. J. Anim. Sci. 2018. V. 63. P. 144–151.
Okano T., Murase T., Yayota C. et al. Characteristics of captive Japanese black bears (Ursus thibetanus japonicus) semen collected by electroejaculation with different voltages for stimulation and frozen-thawed under different conditions // Anim. Reprod. Sci. 2006. V. 95. № 1–2. P. 134–143.
Okotrub K.A., Mokrousova V.I., Amstislavsky S.Y., Surovtsev N.V. Lipid droplet phase transition in freezing cat embryos and oocytes probed by Raman spectroscopy // Biophys. J. 2018. V. 115. № 3. 577–587.
Pederson M.J., Watson C.A., Blevins B.A., Loskutoff N.M. Domestic cat (Felis catus) embryo cryopreservation: slow-slowing versus vitrification // Reprod. Fertil. Dev. 2009. V. 21. P. 180.
Piltti K., Lindeberg H., Aalto J., Korhonen H. Live cubs born after transfer of OPS vitrified-warmed embryos in the farmed European polecat (Mustela putorius) // Theriogenology. 2004. V. 61. № 5. P. 811–820.
Polge C., Smith A.U., Parkes A.S. Revival of spermatozoa after vitrification and dehydration at low temperatures // Nature. 1949. V. 164. P. 666.
Pope C.E. Aspects of in vivo oocyte production, blastocyst development, and embryo transfer in the cat // Theriogenology. 2014. V. 81. P. 126–137.
Pope C.E., Gomez M.C., Galiguis J., Dresser B.L. Applying embryo cryopreservation technologies to the production of domestic and black-footed cats // Reprod. Dom. Anim. 2012. V. 47. P. 125–129.
Pope C.E., Crichton E.G., Gomez M.C., Dumas C., Dresser B.L. Domestic cat kittens born after transfer of cryopreserved embryos produced by in vitro fertilization of oocytes with flow sorted sperm // Reprod. Fertil. Dev. 2011. V. 23. P. 148.
Pope C.E., Gomez M.C., Dresser B.L. In vitro embryo production and embryo transfer in domestic and non-domestic cats // Theriogenology. 2006. V. 66. № 6–7. P. 1518–1524.
Pope C.E. Embryo technology in conservation efforts for endangered felids // Theriogenology. 2000. V. 53. P. 163–174.
Pukazhenthi B.S., Neubauer K., Jewgenow K., Howard J.G., Wildt D.E. The impact and potential etiology of teratospermia in the domestic cat and its wild relatives // Theriogenology. 2006. V. 66. P. 112–121.
Qamar A.Y., Fang X., Kim M.J., Cho J. Myoinositol supplementation of freezing medium improves the quality-related parameters of dog sperm // Animals (Basel). 2019. V. 9. № 12. pii: E1038.
Rajan R., Matsumura K. Development and application of cryoprotectants // Adv. Exp. Med. Biol. 2018. V. 1081. P. 339–354.
Rall W.F., Fahy G.M. Ice-free cryopreservation of mouse embryos at –196 degrees C by vitrification // Nature. 1985. V. 313. № 6003. P. 573–575.
Ramu S., Jeyendran R.S. The hypo-osmotic swelling test for evaluation of sperm membrane integrity // Spermatogenesis. N.J.: Totowa. Humana Press, 2013. P. 21–25.
Ranneva S.V., Okotrub K.A., Amstislavsky S.Y., Surovtsev N.V. Deuterated stearic acid uptake and accumulation in lipid droplets of cat oocytes // Arch. Biochem. Biophys. 2020. V. 692. P. 108 532.
Regehr E.V., Laidre K.L., Akçakaya H.R., Amstrup S.C., Atwood T.C., Lunn N.J., Obbard M., Stern H., Thiemann G.W., Wiig O. Conservation status of polar bears (Ursus maritimus) in relation to projected sea-ice declines // Biol. Lett. 2016. V. 12. № 12. P. 20160556.
Rodrigues da Paz R.S., dos Santos Avila H.B. Coatis (Nasua nasua) semen cryopreservation // Braz. J. Vet. Res. Anim. Sci. 2015. V. 52. №. 2. P. 151–157.
Saragusty J., Arav A. Current progress in oocyte and embryo cryopreservation by slow freezing and vitrification // Reproduction. 2011. V. 141. № 1. P. 1–19.
Sestelo A.J., Rodriguez M.D., Ganan N. et al. Functionality evaluation of two extenders for Leopardus geoffroyi sperm cryopreservation by interspecific IVF with domestic cat oocytes // Reprod. Fertil. Devel. 2018. V. 31. № 1. P. 178–179.
Shaw J.M., Jones G.M. Terminology associated with vitrification and other cryopreservation procedures for oocytes and embryos // Hum. Reprod. Update. 2003. V. 9. № 6. P. 583–605.
Sichtar J., Simonik O., Folkova P. et al. The quality of frozen-thawed canine semen with respect to semen extender composition and sequence of ejaculate collection in dogs // Act. Univ. Agricult. Silvicult. Mend. Brun. 2015. V. 64. P. 169–175.
Silva H.V.R., Nunes T.G.P., Brito B.F. et al. Influence of different extenders on morphological and functional parameters of frozen-thawed spermatozoa of jaguar (Panthera onca) // Cryobiology. 2019. pii: S0011-2240(19)30195-6.
Stasiak K., Glogowski J., Demianowicz W. et al. Use of biochemical markers to evaluate the quality of fresh and cryopreserved semen from the arctic fox (Vulpes lagopus) // Pol. J. Vet. Sci. 2014. V. 17. № 3. P. 427–432.
Stoops M.A., Bond J.B., Bateman H.L. et al. Comparison of different sperm cryopreservation procedures on post-thaw quality and heterologous in vitro fertilisation success in the ocelot (Leopardus pardalis) // Reprod. Fertil. Devel. 2007. V. 19. № 5. P. 685–694.
Sun X., Li Z., Yi Y. et al. Efficient term development of vitrified ferret embryos using a novel pipette chamber technique // Biol. Reprod. 2008. V. 79. № 5. P. 832–840.
Swanson W.F., Stoops M.A., Magarey G.M., Herrick J.R. Sperm cryopreservation in endangered felids: developing linkage of in situ-ex situ populations // Society of Reproduction and Fertility supplement. 2007. V. 65. P. 417–423.
Swanson W.F. Research in nondomestic species: experiences in reproductive physiology research for conservation of endangered felids // ILAR J. 2003. V. 44. P. 307–316.
Terrell K.A., Wildt D.E., Anthony N.M. et al. Different patterns of metabolic cryo-damage in domestic cat (Felis catus) and cheetah (Acinonyx jubatus) spermatozoa // Cryobiology. 2012. V. 64. № 2. P. 110–117.
Tipkantha W., Thuwanut P., Morrell J., Comizzoli P., Chatdarong K. Influence of living status (single vs. paired) and centrifugation with colloids on the sperm morphology and functionality in the clouded leopard (Neofelis nebulosa) // Theriogenology. 2016. V. 86. № 9. P. 2202–2209.
Thuwanut P., Tipkantha W., Siriaroonrat B., Comizzoli P., Chatdarong K. Beneficial effect of extracellular adenosine 5'-triphosphate treatment on the Indochinese leopard (Panthera pardus delacouri) sperm quality after cryopreservation // Reprod. Dom. Anim. 2017. V. 52. P. 269–274.
Thuwanut P., Chatdarong K., Bergqvist A.S. et al. The effects of antioxidants on semen traits and in vitro fertilizing ability of sperm from the flat-headed cat (Prionailurus planiceps) // Theriogenology. 2011. V. 76. № 1. P. 115–125.
Tsujioka T., Otzdorff C., Braun J., Hochi S. Effect of post-IVF developmental kinetics on in vitro survival of vitrified-warmed domestic cat blastocysts // Reprod. Dom. Anim. 2008. V. 43. № 3. P. 323–327.
Turathum B., Roytrakul S., Changsangfa C. et al. Missing and overexpressing proteins in domestic cat oocytes following vitrification and in vitro maturation as revealed by proteomic analysis // Biol. Res. 2018. V. 51. № 1. P. 27.
Turathum B., Saikhun K., Sangsuwan P., Kitiyanant Y. Effects of vitrification on nuclear maturation, ultrastructural changes and gene expression of canine oocytes // Reprod. Biol. Endocrinol. 2010. V. 8. P. 70.
Vajta G., Rienzi L., Ubaldi F.M. Open versus closed systems for vitrification of human oocytes and embryos // Reprod. Biomed. Online. 2015. V. 30. № 4. P. 325–333.
Van den Berghe F., Paris M.C.J., Briggs M.B., Farstad W.K., Paris D.B.B.P. A two-step dilution tris-egg yolk extender containing Equex STM significantly improves sperm cryopreservation in the African wild dog (Lycaon pictus) // Cryobiology. 2018. V. 80. P. 18–25.
Van der Horst G., Kitchin R.M., van der Horst M., Atherton R.W. The effect of the breeding season, cryopreservation and physiological extender on selected sperm and semen parameters of four ferret species: implications for captive breeding in the endangered black-footed ferret // Reprod. Fertil. Dev. 2009. V. 21. № 2. P. 351–363.
Vansandt L.M., Moresco A., Gonzalez R. et al. Sperm cryopreservation with a soy lecithin-based medium in black-footed cats (Felis nigripes) and sand cats (Felis margarita) // Reprod. Fertil. Devel. 2018. V. 31. P. 177–177.
Vansandt L.M., Bateman H.L., Newsom J., Swanson W.F. Getting the yolk out: the use of a soy lecithin-based cryomedium for semen banking in the pallas’ cat and fishing cat // Reprod. Fertil. Devel. 2016. V. 29. № 1. P. 165–166.
Veprintsev B.N., Rott N.N. Conserving genetic resources // Nature. 1979. V. 280. P. 633–634.
Whittingham D.G., Leibo S.P., Mazur P. Survival of mouse embryos frozen to –196 degrees and –269 degrees C // Science. 1972. V. 178. № 4059. P. 411–414.
Wildt D.E., Roth T.L. Assisted reproduction for managing and conserving threatened felids // Int. Zoo Yb. 1997. V. 35. P. 164–172.
Wildt D., Monfort S., Donoghue A., Johnston L., Howard J. Embryogenesis in conservation biology – or, how to make an endangered species embryo // Theriogenology. 1992. V. 37. P. 161–184.
Wood T.C., Wildt D.E. Effect of the quality of the cumulus-oocyte complex in the domestic cat on the ability of oocytes to mature, fertilize and develop into blastocysts in vitro // J. Reprod. Fertil. 1997. V. 110. № 2. P. 355–360.
Yatu M., Sato M., Kobayashi J. et al. Collection and frozen storage of semen for artificial insemination in red foxes (Vulpes vulpes) // J. Vet. Med. Sci. 2018. V. 80. № 11. P. 1762–1765.
Yin X.J., Lee H.S., Choi E.G., Yu X.F., Park G.Y., Bae I., Yang C.J., Oh D.H., Kim N.H., Kong I.K. In vitro maturation of oocytes derived from the brown bear (Ursus arctos) // J. Reprod. Dev. 2007. V. 53. № 3. P. 685–690.
Zambelli D., Cunto M. Semen collection in cats: techniques and analysis // Theriogenology. 2006. V. 66. № 2. P. 159–165.
Zindl C., Asa C.S., Gunzel-Apel A.R. Influence of cooling rates and addition of Equex pasta on cooled and frozen-thawed semen of generic gray (Canis lupus) and Mexican gray wolves (C. l. baileyi) // Theriogenology. 2006. V. 66. № 6–7. P. 1797–1802.
Дополнительные материалы отсутствуют.