Онтогенез, 2022, T. 53, № 3, стр. 214-223
Катехоламинергические структуры конечного мозга крысы в ходе раннего постнатального развития и при старении
В. А. Разенкова a, *, Д. Э. Коржевский a
a ФГБНУ “Институт экспериментальной медицины”
197376 Санкт-Петербург, ул. Академика Павлова, 12, Россия
* E-mail: valeriya.raz@yandex.ru
Поступила в редакцию 18.11.2021
После доработки 11.01.2022
Принята к публикации 16.01.2022
Аннотация
Цель настоящего исследования состояла в изучении динамики морфологических изменений катехоламинергических структур коры головного мозга крыс на протяжении постнатального онтогенеза. С применением методов иммуногистохимии были изучены препараты конечного мозга крыс на сроках: 7-е, 30-е сут постнатального развития, 4–6 мес., 23 мес. Было показано, что отдельные области коры благодаря своим функциональным особенностям имеют уникальное распределение катехоламинергических волокон. Была проанализирована возрастная динамика изменения плотности распределения ТГ-положительных волокон и установлено, что плотность катехоламинергических волокон в сенсомоторной коре возрастает при старении. Продемонстрировано, что метод конфокальной лазерной сканирующей микроскопии обладает широкими возможностями для качественного и количественного анализа результатов иммуноцитохимического исследования и может использоваться для анализа распределения тирозингидроксилазы.
ВВЕДЕНИЕ
Катехоламинергические структуры коры конечного мозга позвоночных животных представлены, в основном, отростками норадренергических нейронов группы A6 голубого пятна и отростками дофаминергических нейронов группы A10 вентральной области покрышки (ventral tegmental area, VTA) и группы A9 черной субстанции (substantia nigra, SN) (Сухорукова и др., 2014). Их нейротрансмиттеры: дофамин и норадреналин, – играют ключевую роль в регуляции многих физиологических (таких как локомоторная, эндокринная) (Баришполец и др., 2009) и когнитивных (в частности, обучение и память) (Cools, 2008) функций центральной нервной системы. Развитие катехоламинергической системы у крыс начинается к концу второй недели эмбрионального онтогенеза (Gates et al., 2006; Bissonette, Roesch, 2016), а окончательное формирование катехоламинергических структур головного мозга приходится на конец четвертой недели постнатального развития (Kalinina et al., 2012). Однако критическими периодами развития этой медиаторной системы считается именно первый месяц постнатального онтогенеза, что подтверждается долговременным изменением системы и регулируемых ею функций при воздействии на организм лабораторных животных в данный период (Bonnin et al., 1996; Калинина, Дыгало, 2013; Сухарева и др., 2016).
Вместе с закладкой катехоламинергических нейронов мозга, в этих клетках начинается экспрессия тирозингидроксилазы (ТГ) – фермента, катализирующего первый этап биосинтеза как дофамина, так и норадреналина (Ugrumov et al., 1989, 2002). Вследствие этого, присутствие в клетке тирозингидроксилазы свидетельствует о ее способности к синтезу катехоламинов, что позволяет считать данной фермент маркером катехоламинергических нейронов. Низкие при рождении уровни мРНК тирозингидроксилазы у грызунов увеличиваются с возрастом, однако у динамики изменения экспрессии, активности фермента и характера его распределения существуют региональные особенности (Kalinina et al., 2012).
Наряду с развитием, важным фактором, влияющим на функционирование нервной системы, является старение. Этот естественный процесс характеризуется прогрессирующим снижением физиологических функций организма. В ходе исследований было доказано, что прогрессирующие поражения ЦНС при старении как на структурном, так и на функциональном уровне напрямую связаны с нейродегенеративными расстройствами, развитие которых обусловлено изменением активности катехоламинергической системы головного мозга (Hamezah et al., 2017).
Особую роль катехоламины играют в функционировании лимбической системы головного мозга. Одной из ключевых ее структур является цингулярная кора, которая находится на медиальной поверхности мозга между поясной бороздой и мозолистым телом. Цингулярная кора – высокофункциональная область головного мозга с особой структурной организацией (Vogt et al., 2004). Она принимает участие в регуляции многих функций организма, от обработки информации до сложных когнитивных и социальных реакций (Rushworth et al., 2011). Еще один отдел коры головного мозга, тесно связанный с лимбической системой – инсулярная кора – у грызунов располагается на боковой поверхности полушария над носовой бороздой. Это – особый сайт мультимодальной интеграции сенсорных, эмоциональных и когнитивных систем ЦНС, связанный с корой (лобная, теменная и височную доли, а также лимбическая кора), базальными ганглиями и другими отделами мозга (такими как таламус) (Gogolla, 2017; Kortz, Lillehei, 2021; Livneh, Andermann, 2021). Как и цингулярная кора, инсулярная область имеет свои структурные особенности. Многие анатомические и функциональные свойства этой области считаются у грызунов и людей общими (Gogolla, 2017). Эти факторы обеспечивают области инсулярной коры пристальное внимание как в фундаментальных нейробиологических, так и в клинических исследованиях.
Несмотря на важность выяснения процессов, обеспечивающих развитие катехоламинергической системы обозначенных областей головного мозга, механизмы, лежащие в их основе, до сих пор остаются не вполне понятными. Предполагается, что всесторонняя характеристика морфологических процессов, происходящих в катехоламинергической системе неокортекса в ходе развития и нормального старения, может помочь сформировать представление об организации малоизученных отделов коры.
В связи с этим, целью настоящего исследования стало изучение динамики морфологических изменений катехоламинергических структур коры головного мозга крыс, происходящих в постанатальном онтогенезе, с применением иммуногистохимического окрашивания на тирозингидроксилазу.
МАТЕРИАЛЫ И МЕТОДЫ
В качестве материала для исследования использовали срезы головного мозга крыс-самцов породы Вистар, взятые на разных сроках постнатального онтогенеза: 7-е (P7), 30-е (P30) постнатальные сутки, половозрелые (5–6 мес.) и старые (23 мес.) животные (n = 3 для каждого срока). При содержании и умерщвлении животных соблюдали основные принципы Европейской Конвенции о защите позвоночных животных, используемых для экспериментов или в иных научных целях (Страсбург, 1986 г.), “Правила проведения работ с использованием экспериментальных животных” (приказ № 755 от 12.08.1977 г. МЗ СССР) и “Правила надлежащей лабораторной практики” (приказ № 199н от 01.04.2016 г. Минздрава России). Исследование одобрено локальным этическим комитетом ФГБНУ ИЭМ (заключение № 1/20 от 27.02.2020). Материал фиксировали в цинк-этанол-формальдегиде (Korzhevskii et al., 2015) и заливали в парафин по общепринятой методике. Изготавливали фронтальные срезы толщиной 5 мкм и наклеивали их на предметные стекла с адгезивным покрытием “Superfrost Ultra Plus” (Menzel Gläser, Германия). После депарафинирования и регидратации препаратов проводили тепловое демаскирование антигена в модифицированном цитратном буфере (S1700, Agilent, США) в течение 24 мин. Ингибирование эндогенной пероксидазы осуществляли путем обработки срезов 3%-ным водным раствором перекиси водорода в течение 10 мин. Для выявления катехоламиергических структур использовали кроличьи поликлональные антитела к тирозингидроксилазе (ab112, Abcam, Великобритания) в разведении 1 : 1000. В качестве вторичных реагентов использовали козьи антикроличьи антитела, конъюгированные с пероксидазой хрена из набора Mouse and Rabbit Specific HRP/DAB IHC Detection Kit (ab236466, Abcam, Великобритания). Для визуализации продукта реакции использовали хромоген 3,3'-диаминобензидин из набора DAB+ (Agilent, США). Часть срезов подкрашивали квасцовым гематоксилином. Полученные препараты анализировали с использованием микроскопа Leica DM750 (Германия) и фотографировали с помощью фотокамеры ICC50 (Leica, Германия). Для анализа изображений использовали программу ImageJ (Wayne Rasband (NIH), США).
Чтобы получить препараты для исследования на конфокальном сканирующем микроскопе, срезы после инкубации во вторичных антителах и отмывки в буфере обрабатывали раствором козьих антител против пероксидазы хрена, конъюгированные с флуорохромом Cy3, в который добавляли ДНК-связывающий краситель SYTOX Green до конечной концентрации красителя 0.6 мкг/мл (Invitrogen, США). Анализ и фотографирование гистологических препаратов проводили с помощью сканирующего конфокального микроскопа Zeiss LSM 800, оснащенного системой Airyscan (Carl Zeiss AG, Германия). Использовали объективы Plan-Apochromat 20×/0.8 M27 и Plan-Apochromat 63×/1.40 Oil DICM27 (масляная иммерсия). Для возбуждения флуоресценции Cy3 применяли лазер с длинной волны 561 нм, для SYTOX Green – 488 нм. Анализ полученных изображений проводили при помощи компьютерной программы Zen-2012 (Zeiss, Германия).
Для оценки плотности распределения волокон измеряли общую площадь (area), занимаемую отростками катехоламинергических клеток (в квадратных мкм) в рамке 175 × 198 мкм на увеличении ×40, затем стандартизировали по длине шкалы в 1 мм. Статистическую обработку проводили в программе GraphPad Prism 8 (GraphPad Software, США). Данные представляли в виде среднего значения ± ошибки средней. На основании проверки на соответствие нормальному распределению с помощью критерия Шапиро–Уилка, для сравнения данных применяли однофакторный дисперсионный анализ (one-way ANOVA), с последующим сравнением групп с помощью post-hoc-критерия Тьюки, либо однофакторный дисперсионный анализ Краскела–Уоллиса с применением post-hoc-критерия Данна. Распределение считали соответствующим нормальному при P > 0.05. Различия считали достоверными при P < 0.05.
РЕЗУЛЬТАТЫ
В результате иммуногистохимической реакции на срезах переднего мозга крыс выявляются отростки и тела катехоламинергических нейронов.
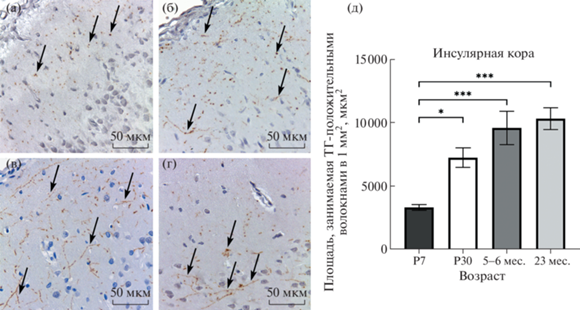
В слоях неокортекса на 7-е постнатальные сутки распределены редкие ТГ-иммунореактивные волокна. В первом слое коры они представлены, в основном перерезанными поперек отростками нейронов (рис. 1). В низлежащих слоях расположены тонкие волокна с четкообразными утолщениями. Отдельные волокна могут прослеживаться на небольшом расстоянии в толще нейропиля. Плотность их распределения неравномерна в различных слоях коры: наиболее высокая в верхних и нижних слоях, низкая – в средних. В шестом слое коры содержится большое количество горизонтальных катехоламинергических волокон. Область пояса и первый слой цингулярной коры заполнены крупными перерезанными поперек интенсивно окрашенными отростками. Что касается различий между разными регионами кортекса, наибольшей плотностью распределения ТГ-иммунопозитивных отростков отличается инсулярная область коры (в сравнении с сенсомоторной корой, Shapiro–Wilk test P < 0.05, Kruskal–Wallis test, post-hoc критерий Данна P < 0.05) (рис. 2, 3).
Рис. 1.
Возрастные изменения катехоламинергических волокон в цингулярной коре. (а) – 7-е сут постнатального развития, (б) – 30-е сут постнатального развития, (в) – половозрелое животное, (г) – старое животное, (д) – динамика изменения плотности распределения ТГ-положительных волокон цингулярной коры в ходе постнатального онтогенеза и при старении. Стрелки указывают на катехоламинергические волокна. P7, P30 – 7, 30 сут постнатального развития соответственно. P-value: ** – <0.01; *** – <0.001.
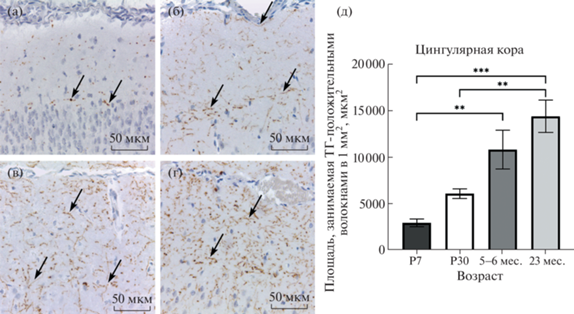
Рис. 2.
Морфологические изменения, происходящие с ТГ-положительными волокнами в области сенсомоторной коры в ходе постнатального онтогенеза и при старении. (а) – 7-е сут постнатального развития, (б) – 30-е сут постнатального развития, (в) – половозрелое животное, (г) – старое животное, (д) – динамика изменения плотности распределения ТГ-положительных волокон сенсомоторной области коры. Стрелки указывают на катехоламинергические волокна. P7, P30 – 7, 30 сут постнатального развития соответственно. P-value: * – <0.05; ** – <0.01.
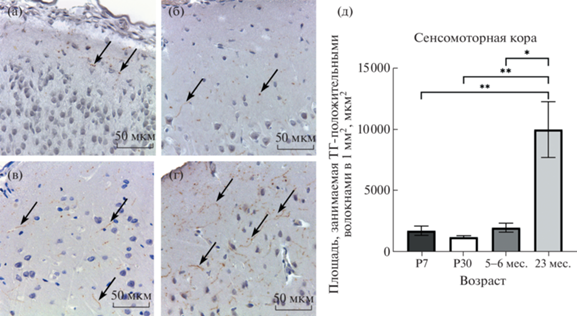
Рис. 3.
ТГ-положительные волокна инсулярной коры в ходе постнатального онтогенеза и при старении. (а) – 7-е сут постнатального развития, (б) – 30-е сут постнатального развития, (в) – половозрелое животное, (г) – старое животное, (д) – динамика изменения плотности распределения ТГ-положительных волокон инсулярной коры в ходе постнатального онтогенеза и при старении. Стрелки указывают на катехоламинергические волокна. P7, P30 – 7, 30 сут постнатального развития соответственно. P-value: * – <0.05; *** – <0.001.
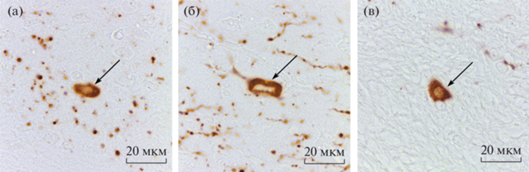
Помимо отростков, в коре могут располагаться единичные тела катехоламинергических нейронов. Это довольно крупные клетки овальной или звездчатой формы, от сомы которых отходит один ветвящийся отросток. Наиболее часто они встречаются в VI слое M2 области сенсомоторной коры и в пириформной коре (рис. 4).
Рис. 4.
ТГ-иммунопозитивные клетки в коре головного мозга крыс разного возраста. (а) – 7-е сут постнатального развития, VI слой цингулярной коры, (б) – 7-е сут постнатального развития, III слой пириформной коры, (в) – старое животное, белое вещество. Стрелки указывают на катехоламинергические клетки.
К 30-м постнатальным суткам незначительно возрастает интенсивность реакции за счет усиления ветвления ТГ-положительных отростков в пределах коры. В первом слое поясной коры волокна активно ветвятся (см. рис. 1б), однако, их ветви в большинстве случаев не выходят за пределы слоя, что подтверждается методами конфокальной микроскопии. Данное наблюдение неприменимо для вертикально направленных редковетвящихся волокон III–V слоев, которые могут проходить через несколько слоев коры. В VI слое и поясе наблюдали в основном перерезанные попeрeк волокна с высокой интенсивностью иммуногистохимической реакции.
Плотность волокон резко снижается в сенсомоторной коре (Shapiro–Wilk test P > 0.05, ANOVA, post-hoc критерий Тьюки P < 0.05). Интенсивность реакции в этой области коры невысокая и возрастает в прилегающем к белому веществу VI слое за счет наличия в нем умеренного количества горизонтальных волокон. Как и у 7-ми дневных животных, у крыс, достигших возраста 1 мес., ярковыраженной иммуногистохимической реакцией обладает инсулярная кора (рис. 3б). Для ее первого слоя характерно наличие поперечноперерезанных отростков катехоламинергических клеток. В отличие от области поясной коры, длинных ветвящихся волокон в первом слое почти не встречается. Средние слои инсулярной коры заполнены большим количеством тонких сильноветвящихся волокон. В основном эти ветви не выходят за пределы своих слоев. Для инсулярной и цингулярной областей коры на этом сроке характерна примерно одинаковая интенсивность послойного распределения ТГ-иммунопозитивных волокон. ТГ-иммуноположительные нейроны на этом сроке не наблюдали.
У половозрелых животных происходит увеличение плотности распределения волокон в нейропиле инсулярной и цингулярной областей коры (а также в M2 области сенсомоторной коры, прилежащей к цингулярной). В остальной сенсомоторной коре наблюдали очень слабую реакцию во всех слоях кроме шестого. Наиболее плотно в цингулярной коре располагаются волокна в верхних и средних слоях, и наоборот, в области инсулярной коры большое количество сильноветвящихся отростков выявляли в средних и нижних слоях. На этом исследуемом сроке также выявляются единичные катехоламинергические нейроны. Их наблюдали реже, чем у 7-дневных животных и только в нижних слоях прилежащей к цингулярной коре M2 области сенсомоторной коры.
В ходе исследования препаратов коры старых животных визуально отмечалось увеличение ТГ-положительных волокон в сенсомоторной коре при снижении общей интенсивности окрашивания. При старении отростки сенсомоторной и цингулярной областей коры начинают более интенсивно ветвиться (рис. 1г, 2г). С помощью морфометрического анализа было показано, что площадь, занимаемая отростками катехоламинергических нейронов, увеличивается в сенсомоторной коре (Shapiro–Wilk test P > 0.05, ANOVA, post-hoc критерий Тьюки, P < 0.05), однако, остается примерно одинаковой в цингулярной и инсулярной областях коры в сравнении с половозрелыми животными (Shapiro–Wilk test P > 0.05, ANOVA, post-hoc критерий Тьюки, P > 0.05). На этом сроке, как и у 30-дневных животных, ТГ-положительных клеток в неокортексе не выявляли, но наблюдали редкие нейроны в прилегающих к коре проводящих путях мозолистого тела (рис. 4в).
Данные результаты были проверены с использованием методов конфокальной микроскопии. Для этого проводили последовательное сканирование участков сенсомоторной коры по оси Z с шагом 0.2 мкм, что позволило получить трехмерные реконструкции выбранных областей с конечной толщиной 3 мкм. Было выявлено, что описанное на световом уровне распределение ТГ-иммунопозитивных волокон в области сенсомоторной коры наблюдается и при применении высокоточных методов сканирующей конфокальной лазерной микроскопии (рис. 5). Как показал анализ оптических срезов, для области сенсомоторной коры старых животных характерно усиление иммуногистохимической реакции вследствие более активного ветвления катехоламинергических волокон.
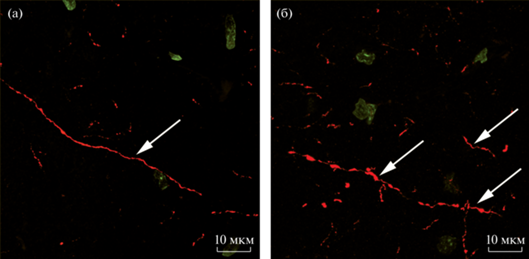
Рис. 5.
Первый слой сенсомоторной коры у половозрелых и старых животных. Конфокальная лазерная микроскопия, иммуногистохимическая реакция на ТГ (красный цвет) с подкраской SYTOX Green (зеленый цвет), двухмерная проекция Z-серии толщиной 3 мкм. (а) – половозрелое животное, (б) – старое животное. Стрелки указывают на ТГ-положительные волокна.
ОБСУЖДЕНИЕ
Проведенное исследование показало неоднородность распределения ТГ-иммуноположительных волокон и терминалей в конечном мозге. Наиболее интенсивно окрашенные области соответствуют корковым отделам лимбической системы, тесно связанными с мезокортикальными дофаминергическими нейронами в VTA и SN и норадренергических нервных клеток голубого пятна (Fallon, 1981; Ohara et al., 2003). Довольно интенсивно окрашены нижние слои коры и область пояса, в которых проходят проводящие пути (Григорьев и др., 2018). При этом катехоламинергические волокна распределены по всему неокортексу старых животных примерно с одинаковой интенсивностью.
Важно упомянуть, что, согласно литературным данным (Brownstein et al., 1974; Nomura et al., 2014), кора головного мозга крысы получает достаточно интенсивную норадренергическую иннервацию. Наряду с этим, недостатком используемого метода является невозможность определить точную медиаторную принадлежность наблюдаемых в коре терминалей. Помимо ТГ, которая является ферментом, лимитирующим скорость синтеза катехоламинов, существуют также специфические ферменты, катализирующие реакции синтеза дофамина, норадреналина и адреналина: декарбоксилаза ароматических аминокислот, дофамин β-гидроксилаза и фенилэтаноламин-N-метилтрансфераза соответственно. Однако, декарбоксилаза ароматических аминокислот также катализирует образование серотонина из 5-гидрокситриптофана, а наличие в коре головного мозга адренергической иннервации остается дискуссионным вопросом. Определенной трудностью в оценке отдельных элементов катехоламинергической системы с помощью исследования экспрессии тирозингидроксилазы является также и наличие в головном мозге так называемых моноферментных нейронов, содержащих только один из ферментов каскада синтеза дофамина и участвующих в кооперативном синтезе нейротрансмиттера (Угрюмов, 2009). Таким образом, использование предложенной методики позволяет опосредованно анализировать как развитие катехоламинергической системы головного мозга, так и влияние на нее нормального старения.
Особый интерес к изучению постнатального развития катехоламинергической системы коры головного мозга возник из-за данных, иллюстрирующих постепенное улучшение результатов в когнитивных задачах, опосредуемых дофаминергической системой, в течение молодого возраста и до достижения половой зрелости (Reynolds, Flores, 2021). Так было выявлено, что активность дофамина в лобных отделах коры линейно увеличивается от рождения и до достижения половой зрелости, предположительно в ходе позднего формирования катехоламинергической иннервации (Berger et al., 1985; Reynolds et al., 2018; Reynolds, Flores, 2021). Сообщается, что созревание дофаминергической иннервации коры продолжается в постнатальном развитии и созревает к 60-м постнатальным суткам (Areal, Blakely, 2020). В отличие от коры, изменения активности дофамина после первого месяца постнатального развития и до взрослого возраста в подкорковых структурах (а именно, в полосатом теле и обонятельном бугорке) не связано с изменениями плотности иннервации катехоламинергическими нейронами, поскольку мезолимбический и нигростриарный пути у грызунов формируются к 20-м постнатальным суткам (Voorn et al., 1988; Björklund, 1992), поэтому после этого периода плотность TГ-положительных волокон в подкорковых структурах не изменяется так, как в коре. В отношении же норадренергической системы головного мозга отмечают достаточно быстрое градуальное созревание норадренергической иннервации неокортекса. При этом уже на 9-е постнатальные сутки активность норадренергической системы достигает уровня, характерного для половозрелых крыс (Levitt, Moore, 1979). Другие исследования с применением методов иммуногистохимии показывают, что несмотря на то, что морфологическая картина распределения норадренергических волокон в коре к 14-му дню постнатального развития соответствует таковой у половозрелых крыс, плотность их иннервации устанавливается лишь к концу третьей недели постнатального онтогенеза (Latsari et al., 2002). С помощью количественного анализа, проведенного в настоящем исследовании, показано, что плотность ТГ-положительных волокон с возрастом имеет тенденцию к увеличению в областях коры, относящихся к лимбической системе. Таким образом, полученные нами данные косвенно иллюстрируют этот феномен.
В соответствии с отмеченным ранее, для сенсомоторной коры характерна другая морфологическая картина: в данной области сохраняются относительно постоянные значения плотности волокон с первой недели постнатального онтогенеза и до взрослого возраста с последующим резким увеличением этих значений при старении. Интересно, что в остальных изученных областях в ходе нормального старения не наблюдается видимых морфологических и морфометрических изменений. При этом, общая интенсивность окрашивания срезов головного мозга старых животных в сравнении с половозрелыми, снижается.
Можно предположить, что это изменение может быть компенсаторными и связанными с уменьшением общего числа катехоламинергических нейронов в ходе старения. Одним из процессов, развивающихся в ходе старения, является усиление окислительного стресса. Окислительный стресс, по-видимому, в большей степени влияет на области, связанные с контролем движений (Cardozo-Pelaez et al., 1999; Norrara et al., 2018). Нейродегенеративный процесс развивается в ходе аутоокислительного процесса при образовании радикалов, которые в конечном итоге ухудшают биохимическое, физиологическое и морфологическое состояние тканей (Finkel, Holbrook, 2000; Luo, Roth, 2004). Поэтому представляется логичным возникновение компенсаторных механизмов, препятствующих развивающимся в ходе старения нейродегенеративным процессам.
И наоборот, увеличение плотности ТГ-положительных волокон может быть признаком развивающихся когнитивных нарушений. Так, например, увеличение количества глутаматергических пресинапсов в лобных долях коры положительно коррелировало с ухудшением когнитивных функций у пациентов со слабыми когнитивными нарушениями (Bell et al., 2007). Хотя это интересное наблюдение, его физиологические и поведенческие последствия для организма еще недостаточно изучены. Известно, что уровни катехоламинов положительно регулируются такой сигнальной молекулой как глиальный нейротрофический фактор (Glial cell line-derived neurotrophic factor, GDNF) (Arenas et al., 1995; Zaman et al., 2003; Grondin et al., 2019). Исследование Матсунаги и соавт. показало, что при старении уровень экспрессии GDNF в лобной коре увеличивается (Matsunaga et al., 2006), что может способствовать росту волокон, и, таким образом, может частично объяснить наблюдаемое увеличение плотности катехоламинергических отростков. Предполагается также возможным, что данное компенсаторное увеличение плотности волокон связано со снижением количества рецепторов катехоламинов на клетках-мишенях при старении (Weiss et al., 1979). Отдельно необходимо отметить тот факт, что ТГ-положительные отростки в сенсомоторной коре у половозрелых животных представлены, в основном, норадренергическими волокнами (Nomura et al., 2014). Однако, в связи с ограничениями метода, не представляется возможным проверить, сохраняется ли подобное медиаторное соотношение у стареющих крыс или, наоборот, рост волокон связан с активностью дофаминергической системы. Таким образом, данное наблюдение нуждается в дальнейших исследованиях.
Неожиданный результат, полученный нами в ходе исследования срезов на световом уровне, заставил нас предпринять дополнительную проверку с помощью анализа оптических срезов конфокального микроскопа, толщина которых задается с помощью программного обеспечения настройками сканирования. Таким образом, изображения, полученные с конфокального микроскопа, нивелируют возможные погрешности толщины изготовляемых парафиновых срезов, и сводит к минимуму связанное с этими погрешностями получение ложноположительных результатов. Поскольку описанные нами на световом уровне результаты воспроизводятся с применением высокоточных методов сканирующей конфокальной микроскопии, мы действительно можем полагать, что у катехо-ламинергических волокон сенсомоторной коры существуют свои структурные особенности, которые проявляются в ходе старения.
Что касается ТГ-иммунопозитивных нейронов, которые наблюдали в коре, то отмечается, что эти клетки присутствуют у разных видов (Berger et al., 1985; Satoh, Suzuki, 1990; Weihe et al., 2006), причем особенно многочисленны они в неокортексе человека (Benavides-Piccione, DeFelipe, 2007). У грызунов катехоламинергические нейроны обнаруживают в глубоких слоях кортекса на разных сроках раннего постнатального развития, включая 60-е сут, причем количество их достигает максимума к концу второй недели, и затем постепенно снижается (Berger et al., 1985; Satoh, Suzuki, 1990). По всей видимости, наличие этих клеток характерно для кортекса на любом сроке постнатального развития, а отсутствие их на срезах скорее связано с низкой частотой встречаемости у более взрослых животных по сравнению с 7‑дневными. Предполагается, что снижение количества ТГ-иммунопозитивных клеток происходит не из-за программируемой клеточной гибели, а вследствие изменений количества базального уровня фермента, присутствующего в этих клетках. Также высказывается предположение, что по крайней мере некоторые клетки коры, продуцирующие тирозингидроксилазу принадлежат к субпопуляции кальретинин-содержащих ГАМК-ергических интернейронов (Asmus et al., 2008). Другие исследования показывают, что тирозингидроксилаза колокализуется в клетках кортекса с холиацетилтранзферазой (ХАТ) и вазоактивным интестинальным пептидом (ВИП) (Asmus et al., 2011). Подобная колоколазация, однако, по-видимому, нехарактерна для нейронов коры головного мозга человека (Asmus et al., 2016). Поскольку известно, что ХАТ, кальретинин и ВИП экспрессируют интернейроны, относящиеся к большой группе клеток, содержащих рецептор 5HT3a, а экспрессирующие кальретинин, но не ХАТ и ВИП – к соматостатин-содержащим интернейронам (Tremblay et al., 2016), можно полагать, что клетки, наблюдаемые нами в коре, относятся к двум крупнейшим систематическим группам ГАМК-ергических интернейронов коры мозга крысы.
ВЫВОДЫ
В настоящем исследовании проведена сравнительная характеристика катехоламинергической системы трех отделов коры головного мозга на протяжении постнатального онтогенеза.
Проанализированы различия между областями коры, относящимся к разным функциональным системам и установлено, что плотность катехоламинергических волокон в сенсомоторной коре возрастает при старении.
Наши результаты показывают, что при старении возрастает плотность катехоламинергических волокон в сенсомоторной коре. Этот процесс подразумевает изменения уровней катехо-ламинов (дофамина и норадреналина) в головном мозге и может оказывать влияние на связанные с когнитивными нарушениями поведенческие изменения, которые наблюдаются при старении.
В настоящем исследовании показано, что метод конфокальной микроскопии обладает более широкими возможностями для количественного анализа результатов иммуноцитохимического исследования и может использоваться для анализа распределения тирозингидроксилазы.
Список литературы
Баришполец В.В., Федотова Ю.О., Сапронов Н.С. Структурно-функциональная организация дофаминергической системы головного мозга // Эксп. клин. фармакол. 2009. Т. 72. № 3. С. 44–49.
Григорьев И.П., Алексеева О.С., Кирик О.В. и др. Распределение низкомолекулярных белков нейрофиламентов в поясной коре головного мозга крысы // Морфология. 2018. Т. 154. № 5. С. 7–12.
Калинина Т.С., Дыгало Н.Н. Развитие норадренергической системы мозга крыс после пренатального воздействия кортикостероном // Изв. Ак. Наук. Сер. биол. 2013. Т. 2013. № 4. С. 447–452.
Сухарева Е.В., Калинина Т.С., Булыгина В.В. и др. Тирозингидроксилаза мозга и ее регуляция глюкокортикоидами // Вавиловский журн. генетики и селекции. 2016. Т. 20. № 2. С. 212–219.
Сухорукова Е.Г., Алексеева О.С., Коржевский Д.Э. Катехоламинергические нейроны головного мозга млекопитающих и нейромеланин // Журн. эвол. биох. и физиол. 2014. Т. 50. № 5. С. 336–342.
Угрюмов М.В. Синтез моноаминов немоноаминергическими нейронами: иллюзия или реальность? // Физиол. журн. им. И.М. Сеченова. 2009. Т. 95. № 3. С. 273–282.
Areal L.B., Blakely R.D. Neurobehavioral changes arising from early life dopamine signaling perturbations // Neurochem. Int. 2020. V. 137. P. 104747.
Arenas E., Trupp M., Åkerud P. et al. GDNF prevents degeneration and promotes the phenotype of brain noradrenergic neurons in vivo // Neuron. 1995. V. 15. № 6. P. 1465–1473.
Asmus S.E., Anderson E.K., Ball M.W. et al. Neurochemical characterization of tyrosine hydroxylase-immunoreactive interneurons in the developing rat cerebral cortex // Brain Res. 2008. V. 1222. P. 95–105.
Asmus S.E., Cocanougher B.T., Allen D.L. et al. Increasing proportions of tyrosine hydroxylase-immunoreactive interneurons colocalize with choline acetyltransferase or vasoactive intestinal peptide in the developing rat cerebral cortex // Brain Res. 2011. V. 1383. P. 108–119.
Asmus S.E., Raghanti M.A., Beyerle E.R. et al. Tyrosine hydroxylase-producing neurons in the human cerebral cortex do not colocalize with calcium-binding proteins or the serotonin 3A receptor // J. Chem. Neuroanat. 2016. V. 78. P. 1–9.
Bell K.F.S., Bennett D.A., Cuello A.C. Paradoxical upregulation of glutamatergic presynaptic boutons during mild cognitive impairment // J. Neurosci. 2007. V. 27. № 40. P. 10810–10817.
Benavides-Piccione R., DeFelipe J. Distribution of neurons expressing tyrosine hydroxylase in the human cerebral cortex // J. Anat. 2007. V. 211. № 2. P. 212–222.
Berger B., Verney C., Febvret A. et al. Postnatal ontogenesis of the dopaminergic innervation in the rat anterior cingulate cortex (area 24). Immunocytochemical and catecholamine fluorescence histochemical analysis // Brain Res. 1985. V. 353. № 1. P. 31–47.
Berger B., Verney C., Gaspar P. et al. Transient expression of tyrosine hydroxylase immunoreactivity in some neurons of the rat neocortex during postnatal development // Brain Res. 1985. V. 355. № 1. P. 141–144.
Bissonette G.B., Roesch M.R. Development and function of the midbrain dopamine system: What we know and what we need to // Genes Brain Behav. 2016. V. 15. № 1. P. 62–73.
Björklund A. Handbook of Chemical Neuroanatomy, Volume 21, Dopamine. Amsterdam: Elsevier, 1992. 418 p.
Bonnin A., Miguel R. de, Castro J.G. et al. Effects of perinatal exposure to delta 9-tetrahydrocannabinol on the fetal and early postnatal development of tyrosine hydroxylase-containing neurons in rat brain // J. Mol. Neurosci. 1996. V. 7. № 4. P. 291–308.
Brownstein M., Saavedra J.M., Palkovits M. Norepinephrine and dopamine in the limbic system of the rat // Brain Res. 1974. V. 79. № 3. P. 431–436.
Cardozo-Pelaez F., Song S., Parthasarathy A. et al. Oxidative DNA damage in the aging mouse brain // Mov. Disord. 1999. V. 14. № 6. P. 972–980.
Cools R. Role of dopamine in the motivational and cognitive control of behavior // Neuroscientist. 2008. V. 14. № 4. P. 381–395.
Fallon J. Collateralization of monoamine neurons: mesotelencephalic dopamine projections to caudate, septum, and frontal cortex // J. Neurosci. 1981. V. 1. № 12. P. 1361–1368.
Finkel T., Holbrook N.J. Oxidants, oxidative stress and the biology of ageing // Nature. 2000. V. 408. № 6809. P. 239–247.
Gates M.A., Torres E.M., White A. et al. Re-examining the ontogeny of substantia nigra dopamine neurons // Eur. J. Neurosci. 2006. V. 23. № 5. P. 1384–1390.
Gogolla N. The insular cortex // Curr. Biol. 2017. V. 27. № 12. P. R580–R586.
Grondin R., Littrell O.M., Zhang Z. et al. GDNF revisited: A novel mammalian cell-derived variant form of GDNF increases dopamine turnover and improves brain biodistribution // Neuropharmacology. 2019. V. 147. P. 28–36.
Hamezah H.S., Durani L.W., Ibrahim N.F. et al. Volumetric changes in the aging rat brain and its impact on cognitive and locomotor functions // Exp. Gerontol. 2017. V. 99. P. 69–79.
Kalinina T.S., Shishkina G.T., Dygalo N.N. Induction of tyrosine hydroxylase gene expression by glucocorticoids in the perinatal rat brain is age-dependent // Neurochem. Res. 2012. V. 37. № 4. P. 811–818.
Kortz M.W., Lillehei K.O. Insular Cortex. FL: StatPearls Publishing, 2021.
Korzhevskii D.E., Sukhorukova E.G., Kirik O.V. et al. Immunohistochemical demonstration of specific antigens in the human brain fixed in zinc-ethanol-formaldehyde // Eur. J. Histochem. 2015. V. 59. № 3. P. 5–9.
Latsari M., Dori I., Antonopoulos J. et al. Noradrenergic innervation of the developing and mature visual and motor cortex of the rat brain: a light and electron microscopic immunocytochemical analysis // J. Comp. Neurol. 2002. V. 445. № 2. P. 145–158.
Levitt P., Moore R.Y. Development of the noradrenergic innervation of neocortex // Brain Res. 1979. V. 162. № 2. P. 243–259.
Livneh Y., Andermann M.L. Cellular activity in insular cortex across seconds to hours: Sensations and predictions of bodily states // Neuron. 2021. V. 109. P. 1–18.
Luo Y., Roth G.S. The roles of dopamine oxidative stress and dopamine receptor signaling in aging and age-related neurodegeneration // Antioxid. Redox Signal. 2004. V. 2. № 3. P. 449–460.
Matsunaga W., Isobe K., Shirokawa T. Involvement of neurotrophic factors in aging of noradrenergic innervations in hippocampus and frontal cortex // Neurosci. Res. 2006. V. 54. № 4. P. 313–318.
Nomura S., Bouhadana M., Morel C. et al. Noradrenalin and dopamine receptors both control cAMP-PKA signaling throughout the cerebral cortex // Front. Cell. Neurosci. 2014. V. 8. Article 247.
Norrara B., Fiuza F.P., Arrais A.C. et al. Pattern of tyrosine hydroxylase expression during aging of mesolimbic pathway of the rat // J. Chem. Neuroanat. 2018. V. 92. P. 83–91.
Ohara P.T., Granato A., Moallem T.M. et al. Dopaminergic input to GABAergic neurons in the rostral agranular insular cortex of the rat // J. Neurocytol. 2003. V. 32. № 2. P. 131–141.
Reynolds L.M., Flores C. Mesocorticolimbic dopamine pathways across adolescence: diversity in development // Front. Neural Circuits. 2021. V. 15. P. 94–111.
Reynolds L.M., Pokinko M., Torres-Berrío A. et al. DCC receptors drive prefrontal cortex maturation by determining dopamine axon targeting in adolescence // Biol. Psychiatry. 2018. V. 83. № 2. P. 181–192.
Rushworth M.F.S., Noonan M.A.P., Boorman E.D. et al. Frontal cortex and reward-guided learning and decision-making // Neuron. 2011. V. 70. № 6. P. 1054–1069.
Satoh J., Suzuki K. Tyrosine hydroxylase-immunoreactive neurons in the mouse cerebral cortex during the postnatal period // Brain Res. Dev. Brain Res. 1990. V. 53. № 1. P. 1–5.
Tremblay R., Lee S., Rudy B. GABAergic interneurons in the neocortex: From cellular properties to circuits // Neuron. 2016. V. 91. № 2. P. 260–292.
Ugrumov M.V., Melnikova V., Ershov P. et al. Tyrosine hydroxylase- and/or aromatic L-amino acid decarboxylase-expressing neurons in the rat arcuate nucleus: ontogenesis and functional significance // Psychoneuroendocrinology. 2002. V. 27. № 5. P. 533–548.
Ugrumov M.V., Taxi J., Tixier-Vidal A. et al. Ontogenesis of tyrosine hydroxylase-immunopositive structures in the rat hypothalamus. An atlas of neuronal cell bodies // Neuroscience. 1989. V. 29. № 1. P. 135–156.
Vogt B.A., Vogt L., Farber N.B. Cingulate cortex and disease models // The Rat Nervous System. N.Y.: Elsevier, 2004. Chapter 22. P. 705–727.
Voorn P., Kalsbeek A., Jorritsma-Byham B. et al. The pre- and postnatal development of the dopaminergic cell groups in the ventral mesencephalon and the dopaminergic innervation of the striatum of the rat // Neuroscience. 1988. V. 25. № 3. P. 857–887.
Weihe E., Depboylu C., Schütz B. et al. Three types of tyrosine hydroxylase-positive CNS neurons distinguished by dopa decarboxylase and VMAT2 co-expression // Cell. Mol. Neurobiol. 2006. V. 26. № 4. P. 657–676.
Weiss B., Greenberg L., Cantor E. Age-related alterations in the development of adrenergic denervation supersensitivity // Fed. Proc. 1979. V. 38. № 5. P. 1915–1921.
Zaman V., Li Z., Middaugh L. et al. The noradrenergic system of aged GDNF heterozygous mice // Cell Transplant. 2003. V. 12. № 3. P. 291–230.
Дополнительные материалы отсутствуют.


