Онтогенез, 2022, T. 53, № 3, стр. 196-202
Анализ развития преимплантационных эмбрионов мыши, нокаутных по гену insrr
Е. А. Ганцова a, *, И. Е. Деев a, А. Г. Петренко a, О. В. Серова a
a Институт биоорганической химии им. акад. М.М. Шемякина и Ю.А. Овчинникова РАН
117997 Москва, ул. Миклухо-Маклая, 16/10, Россия
* E-mail: gantsova@mail.ru
Поступила в редакцию 16.11.2021
После доработки 13.01.2022
Принята к публикации 18.01.2022
Аннотация
Поддержание оптимального кислотно-щелочного равновесия организма играет ключевую роль в регуляции метаболизма, и обеспечивается функционированием эндогенных pH-сенсоров – молекул, активность которых регулируется при изменении pH среды. Рецепторная тирозинкиназа IRR (рецептор, подобный рецептору инсулина) является сенсором щелочного pH, активируется при повышении pH внеклеточной среды выше 7.9. Экспрессия IRR специфична, рецептор обнаруживается в некоторых органах, в определенных типах клеток. Установлено, что рецептор IRR вовлечен в экскрецию бикарбоната почками. Механизм действия и функция рецептора IRR как сенсора щелочного pH в других органах не известна. Для выявления роли рецептора IRR в эмбриогенезе мы провели эксперименты по оценке развития преимплантационных эмбрионов мышей дикого типа и мышей, нокаутных по гену insrr, с использованием МЕА-теста (mouse embryo assay). Оценку развития осуществляли с помощью индекса выхода бластоцист – процент образования бластоцист от общего количества извлеченных зигот. Выход бластоцист у нокаутных животных оказался значительно ниже, чем у животных дикого типа, 6.7% от общего количества извлеченных клеток у нокаутных животных и 43.8% у животных дикого типа. Отличалось и количество извлеченных зигот у мышей дикого типа и нокаутных по гену insrr. В среднем, количество извлеченных зигот из одной самки составило 18.9 зигот для мышей дикого типа, и 11.8 зигот для нокаутных по insrr мышей. Полученные нами результаты указывают на потенциальную роль рецепторной тирозинкиназы IRR в развитии преимплантационных эмбрионов.
ВВЕДЕНИЕ
Одним из важнейших свойств живого организма является поддержание оптимального кислотно-щелочного равновесия и ионного состава внутренней среды, необходимого для жизнедеятельности клеток в условиях влияния внешних и внутренних факторов. Регуляция кислот и оснований обеспечивается множеством молекулярных механизмов, многие из которых до сих пор не изучены. В организме существует большое количество эндогенных pH-сенсоров – молекул, свойства и активность которых регулируется при изменении pH среды (Serova et al., 2020). Одним из сенсоров щелочного рН является рецептор, подобный рецептору инсулина (IRR), член семейства рецептора инсулина, которое также включает рецептор инсулина (IR) и рецептор инсулиноподобного фактора роста (IGF-IR) (Deyev et al., 2011). IRR может напрямую активироваться слабощелочной внеклеточной средой, что разительно отличает рецептор от других рецепторных тирозинкиназ, которые имеют лиганды белковой или пептидной природы.
В отличие от своих близких гомологов рецепторов IR и IGF-IR, которые экспрессируются в широком спектре тканей и клеток, экспрессия IRR специфична, рецептор обнаруживается в некоторых органах, в определенных типах клеток. Наибольшее количество IRR было обнаружено в почке, где IRR экспрессируется в β-вставочных клетках, выстилающих дистальные канальцы (Petrenko et al., 2013), которые секретируют бикарбонат. В меньших концентрациях мРНК IRR была обнаружена в мозге, желудке, поджелудочной железе (Petrenko et al., 2013; Deyev et al., 2017). С использованием метода РНК-секвенирования отдельных клеток была показана экспрессия IRR в нейронах спинномозговых ганглиев мышей (Usoskin et al., 2015).
Установлено, что IRR вовлечен в секрецию бикарбоната почками. У мышей, нокаутных по гену insrr, кодирующему рецептор IRR, щелочная нагрузка на организм сопровождалась метаболическим алкалозом и пониженной секрецией бикарбоната в мочу (Deyev et al., 2011). Механизм действия и функция рецептора IRR как сенсора щелочного pH в других органах не установлена. По данным литературы, рецепторная тирозинкиназа IRR связана с репродуктивной системой и ранним эмбриональным развитием. У крыс наблюдается активация экспрессии IRR в текальных клетках фолликулов перед овуляцией при стимуляции гонадотропином. После овуляции экспрессия IRR не обнаруживается (Dissen et. al., 2006). Известно, что IRR экспрессируется в большом количестве на эмбриональных стадиях развития мыши в ганглиях тройничного, языкоглоточного и спинномозгового нервов и поджелудочной железе, в меньшем количестве в почечных канальцах (Diez-Roux et al., 2011). На роль рецептора IRR в эмбриогенезе указывает экспрессия IRR, а также других членов семейства IR и IGF-IR, на стадии одноклеточных эмбрионов мыши и бластоцистах (Erickson, Strnatka, 2011; Brusentsev et al., 2021). Было показано, что функционирование всех трех рецепторов семейства IR (IR, IGF-IR, IRR) необходимо для формирования семенников во время эмбриогенеза у мышей. У мышей с тройным нокаутом генов семейства рецептора инсулина наблюдается смена пола эмбрионов от самца к самке, характеризующаяся пониженной экспрессией локусов sry, sox9, которые определяют развитие мужского пола (Nef et al., 2003).
Целью работы является изучение влияния нокаута гена insrr, кодирующего рецепторную тирозинкиназу IRR, на развитие преимплантационных эмбрионов мыши in vitro. В данной работе мы провели эксперименты по оценке развития преимплантационных эмбрионов мышей дикого типа и нокаутных по гену insrr с использованием МЕА-теста (mouse embryo assay). Параметром для оценки развития является выход бластоцист – процент образования бластоцист от общего числа выделенных зигот.
МАТЕРИАЛЫ И МЕТОДЫ
Содержание и разведение лабораторных животных. Для поддержания генетического фона и минимизации эффекта накопления мутаций, был использован метод разведения однопометных мышей. Мыши с нокаутом гена insrr–/– были получены ранее на основе линии мышей C57Bl/6J (Kitamura et al., 2001). Затем, в питомнике лабораторных животных в филиале ИБХ в Пущино путем скрещивания нокаутных мышей insrr–/– и диких мышей линии C57Bl/6J была получена линия гетерозиготных мышей insrr+/– со статусом без специфических патогенов (SPF). При скрещивании гетерозигот получали мышей потомков одного поколения – гомозиготный дикий тип, гетерозиготы и гомозиготный нокаутный тип. Генотип полученного при скрещивании потомства определяли при помощи ПЦР с геномной ДНК, выделенной из ушей и хвостов мышей. Дикую аллель детектировали, используя праймеры mwt1 (5'-GCAAGCTACACAGGCTCGAGGG-3') и mwt2 (5'-TGGGTTCTGATCCTCTCAAGGAG-3'). Для выявления нокаутной аллели использовали праймеры ko1 (5'-CAAAACCAAATTAAGGGCCAGCTC-3') и ko2 (5'-AGCCTGAAGACCCTCGTCGACT-3'). Был определен генотип у 94 мышей с целью выявления необходимых для работы животных. Из них было 26 мышей гомозиготного дикого типа, 27 мышей гомозиготного нокаутного типа и 41 мышь гетерозиготного типа. Самок гомозиготных мышей использовали для сравнительного анализа.
Лабораторные животные содержались в виварии ИБХ РАН, со свободным доступом к еде и питью, соотношение светлого и темного времени суток 1 : 1 (12 ч). В экспериментах использовали мышей потомков одного поколения дикого типа и нокаутных по гену insrr. Все эксперименты с животными проводили в соответствии с протоколом комитета по уходу и использованию животных, утвержденным Комиссией по биоэтике Института биоорганической химии им. академиков М.М. Шемякина и Ю.А. Овчинникова РАН (ИБХ РАН).
Анализ развития преимплантационных эмбрионов. В качестве метода оценки развития преимплантационных эмбрионов использовали МЕА-тест. У самок мышей дикого типа и нокаутных по гену insrr в возрасте 2–3 мес. стимулировали суперовуляцию (Luo et al., 2011). Для стимуляции суперовуляции самкам мышей внутримышечно вводили поочередно гормональные препараты. Первая инъекция 5 МЕ гонадотропного гормона сыворотки крови жеребых кобыл (ГСЖК) (препарат “Фоллимаг”, ЗАО “Мосагроген”, Россия), через 48 ч, 5 МЕ гормона ХГЧ (препарат “Хорионический гонадотропин”, ФГУП “Московский эндокринный завод”, Россия). Сразу после второй инъекции самок подсаживали на ночь к самцам, на следующее утро по копулятивной пробке определяли успешно спарившихся самок, которых отбирали в эксперимент. Животных усыпляли с помощью анестезирующих препаратов, золетил 15 мг/кг, ксилазин 5 мг/кг в 0.9% растворе NaCl. Затем умерщвляли методом цервикальной дислокации.
У самок мышей извлекали яйцевод и вскрывали ампулы яйцевода в среде ЭКО1 “Ооклин” (ООО НПП “ПанЭко”, Россия) в которой собирали ооцит-кумулюсные комплексы. Данные комплексы обрабатывали ферментативной средой ЭКО1 “Гиаза” (ООО НПП “ПанЭко”, Россия) и продолжали отмывку ооцитов в среде ЭКО1 “Ооклин”. Очищенные от клеток кумулюса ооциты помещали в каплю среды ЭКО ПРО “Дробление” (ООО НПП “ПанЭко”, Россия), покрытую жидким парафиновым маслом. Эмбрионы культивировали в инкубаторе при условиях 5% CO2 и температуре 37°С. Деление эмбрионов анализировали каждые сутки в течение 96 часов после извлечения зигот с использованием микроскопа. Оценку развития осуществляли с помощью индекса выхода бластоцист – процента образования бластоцист из общего количества извлеченных эмбрионов. МЕА тест проводили в трех повторах для каждого генотипа.
Статистическая обработка данных экспериментов. Статистическую обработку результатов исследования проводили с помощью программного обеспечения Prism 8 (GraphPad Software, USA). Данные, полученные для животных двух генотипов, соответствовали критерию нормальной выборки (критерий Шапиро–Уилка). Поэтому для расчета статистической значимости двух выборок использовали t-критерий Стьюдента, результаты считали статистически значимыми при p < 0.05.
РЕЗУЛЬТАТЫ
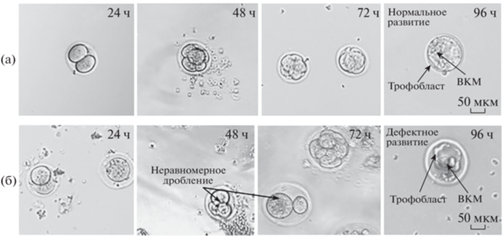
Для выявления роли нокаута гена рецептора IRR в раннем эмбриональном развитии был проведен анализ развития эмбрионов мышей дикого типа и нокаутных по гену insrr, с использованием МЕА-теста. В эксперименте были использованы 12 самок дикого типа и 10 самок, нокаутных по гену insrr, потомков одного поколения. У самок мышей в возрасте 2–3 мес. стимулировали суперовуляцию. После подсадки к самцам у самок извлекали яйцеводы, выделяя из них зиготы. Деление эмбрионов анализировали каждые сутки в течение 96 часов после извлечения с использованием микроскопа (рис. 1). Анализируя развитие эмбрионов дикого типа, мы наблюдали типичное деление бластомеров, спустя 24 ч образовывались двухклеточные эмбрионы, спустя 48 ч – четырехклеточные и т.д. Бластоцисты у животных дикого типа имели типичное строение, выраженный трофобласт и внутриклеточную массу, все проходили вылупление (рис. 1а). Для зигот, извлеченных из мышей, нокаутных по гену insrr, наблюдалась задержка в развитии, а также неравномерное дробление бластомеров (см. рис. 1б, 48 и 72 ч). Эмбрионы, достигшие стадии бластоцисты имели аномальное строение, внутриклеточная масса и трофобласт были неявно выражены, вылупление из оболочки происходило не во всех случаях. Оценку развития эмбрионов осуществляли с помощью индекса выхода бластоцист – процента образования бластоцист из общего количества извлеченных зигот.
Рис. 1.
Анализ развития преимплантационных эмбрионов мыши: панель изображений преимплантационных эмбрионов через 24, 48, 72, 96 ч после извлечения зигот. (а) – эмбрионы мышей дикого типа, (б) – эмбрионы мышей, нокаутных по гену insrr. Стрелками обозначены трофобласт и ВКМ – внутриклеточная масса; для нокаутных преимплантационных эмбрионов показаны отклонения от нормального развития – неравномерное дробление.
Результаты этих экспериментов показали, что выход бластоцист у нокаутных по гену insrr животных значительно ниже, чем у животных дикого типа, 6.7% от общего количества извлеченных клеток у нокаутных животных и 43.8% у животных дикого типа (t-тест, p < 0.05) (рис. 2а). Отличалось и количество извлеченных зигот у мышей дикого типа и нокаутных по insrr – 231 клетка из 12 самок, и 119 клеток из 10 самок, соответственно (табл. 1). В среднем количества извлеченных зигот из одной самки составили 18.9 зигот для мышей дикого типа, и 11.8 зигот для нокаутных по insrr мышей (рис. 2б). Процент развития эмбрионов (количество дробящихся зигот) у нокаутных животных также был ниже – 34.9%, тогда как у мышей дикого типа – 62.7% (рис. 2в). Если рассчитывать выход бластоцист от количества двухклеточных эмбрионов, то он составил 68.4 и 23.3% для мышей дикого типа и нокаутных по insrr соответственно (рис. 2а).
Рис. 2.
Результаты МЕА теста. (а) – Гистограмма выхода бластоцист от количества выделенных зигот и от количества дробящихся эмбрионов, в процентном соотношении (* p < 0.05); (б) – гистограмма среднего количества зигот, выделенных из одной самки мыши; (в) – % развития, количество дробящихся зигот, в процентном соотношении от общего количества выделенных зигот; (г) – гистограмма процентного соотношения дефектных клеток и эмбрионов с нарушенным развитием. Черным цветом указано количество дефектных клеток, в которых наблюдались множественные вакуоли, гранулы, деформация цитоплазмы. Серым – эмбрионы с нарушенным развитием (неравномерное дробление бластомеров, остановка развития на различных стадиях) (* p < 0.05). Отрезками отмечены значения среднеквадратической ошибки (SEM). WT – мыши дикого типа, КО – мыши, нокаутные по гену insrr.
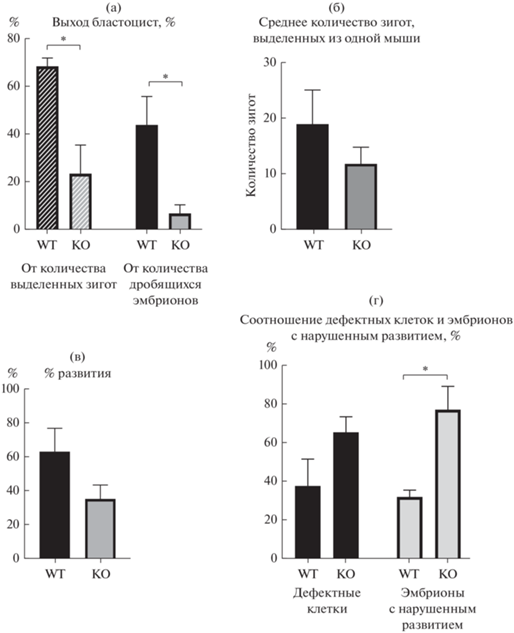
Таблица 1.
Суммарные данные МЕА-теста, полученные в результате трех экспериментов, для мышей дикого типа (WT) и нокаутных по гену insrr (KO)
| WT | KO | |
|---|---|---|
| Количество мышей | 12 | 10 |
| Количество извлеченных зигот | 231 | 119 |
| Количество двухклеточных эмбрионов | 124 | 38 |
| Количество четырехклеточных эмбрионов | 108 | 30 |
| Количество морул | 96 | 22 |
| Количество бластоцист | 83 | 10 |
Если суммировать данные трех экспериментов для каждого генотипа (табл. 1), то у животных дикого типа четырехклеточные эмбрионы образовались в количестве 108 из 124 дробящихся клеток, морулы в количестве 96 шт. Для нокаутных по IRR животных образовалось 30 четырехклеточных эмбрионов из 38 двухклеточных, количество морул – 22 шт. У нокаутных животных наблюдалось большее количество дефектных зигот в процентном соотношении от общего количества выделенных клеток (рис. 2г). Дефектными считали клетки, в которых наблюдались множественные вакуоли, гранулы, деформация цитоплазмы. Нарушенное развитие, а именно, неравномерное дробление, остановка развития на различных стадиях, чаще наблюдались у нокаутных эмбрионов (рис. 2г). Качество бластоцист также различалось: Bl2Bb/Bl2Bc/Bl2Cc в нокаутных эмбрионах, и Bl4Ab/Bl4Aa в эмбрионах дикого типа.
ОБСУЖДЕНИЕ
В данной работе нами были впервые проведены эксперименты по оценке развития преимплантационных эмбрионов мышей дикого типа и нокаутных по гену insrr с использованием МЕА-теста (mouse embryo assay). В условиях MEA-теста мы наблюдали у нокаутных животных более низкий процент развития (количество дробящихся клеток от общего числа извлеченных зигот) и более низкие значения выхода бластоцист, в том числе от количества двухклеточных эмбрионов, чем у животных дикого типа (рис. 2а). В контроле дикого типа мы наблюдали невысокий выход бластоцист 68.4% от количества дробящихся клеток. Это можно объяснить тем, что эксперимент проводился на линии мышей C57Bl/6J, тогда как протокол МЕА-теста предполагает использование линии CBA, либо гибридов первого поколения C57Bl/6J-CBA. Большее количество извлеченных зигот у мышей дикого типа по сравнению с мышами, нокаутными по гену insrr (18.9 и 11.8 зигот в среднем из одного животного, соответственно) может быть связано с активацией экспрессии рецептора IRR в яичниках мышей дикого типа под действием гонадотропина и указывает на потенциальную роль рецептора IRR в процессах овуляции. Наблюдаемый эффект может быть связан с активностью IRR как сенсора щелочного pH на преимплантационных стадиях развития или низким качеством исходных зигот ввиду его активности на более ранних этапах – в оогенезе.
Ионный состав и pH жидкой среды в половых путях самок имеет большое физиологическое значение для ряда репродуктивных событий, включая транспорт спермы, оплодотворение, транспорт эмбрионов, развитие и имплантацию бластоцист (Liu et al., 2012). Известно, что маточные жидкости содержат в два-четыре раза больше ионов бикарбоната, чем плазма крови. При этом во время эструса значение pH маточной жидкости достигает значения больше 8 (щелочная среда), в то время как при диэструсе значение pH среды понижается и становится близким к нейтральному (He et al., 2010). Повышение pH маточной жидкости во время эструса связано с увеличением экспрессии ряда белков, участвующих в регуляции ионов бикарбоната, в том числе ${{{\text{C}}{{{\text{l}}}^{--}}} \mathord{\left/ {\vphantom {{{\text{C}}{{{\text{l}}}^{--}}} {{\text{HCO}}_{3}^{ - }}}} \right. \kern-0em} {{\text{HCO}}_{3}^{ - }}}$ обменника SLC26A6 (He et al., 2010).
Поддержание кислотно-щелочного баланса в клетках преимплантационных эмбрионов также играет важную роль. Так, например, была показана высокая экспрессия ${{{\text{C}}{{{\text{l}}}^{--}}} \mathord{\left/ {\vphantom {{{\text{C}}{{{\text{l}}}^{--}}} {{\text{HCO}}_{3}^{ - }}}} \right. \kern-0em} {{\text{HCO}}_{3}^{ - }}}$ обменников SLC4A2, SLC4A42 на стадиях преимплантационного эмбрионального развития мышей. Данные обменники регулируют внутриклеточный pH, обеспечивая механизм защиты клеток от алкалоза. Активность ${{{\text{C}}{{{\text{l}}}^{--}}} \mathord{\left/ {\vphantom {{{\text{C}}{{{\text{l}}}^{--}}} {{\text{HCO}}_{3}^{ - }}}} \right. \kern-0em} {{\text{HCO}}_{3}^{ - }}}$ обменников снижается в ходе развития, активность на стадиях морулы и бластоцисты значительно ниже по сравнению с одно- и двухклеточной стадиями. Таким образом преимплантационные эмбрионы адаптируются к окружающей среде при переходе от щелочной среды яйцевода в среду матки с более низкими значениями pH (Dagilgan et al., 2015).
Ранее нами было показано (Deyev et al., 2011), что нокаут гена insrr приводит к снижению экспрессии ${{{\text{C}}{{{\text{l}}}^{--}}} \mathord{\left/ {\vphantom {{{\text{C}}{{{\text{l}}}^{--}}} {{\text{HCO}}_{3}^{ - }}}} \right. \kern-0em} {{\text{HCO}}_{3}^{ - }}}$ обменника SLC26A4. Ионообменник пендрин (SLC26A) локализуется β-вставочных клетках почечных канальцев, которые участвуют в экскреции ионов бикарбоната почками. Можно предположить, что pH-чувствительный рецептор IRR, активируясь в ответ на повышение pH внеклеточной среды, может запускать сигнальные каскады в клетке, которые приводят к изменению экспрессии и/или активности ионных каналов, непосредственно участвующих в регуляции концентрации кислот и оснований, в частности ионов ${\text{HCO}}_{3}^{ - }.$ Ионы ${\text{HCO}}_{3}^{ - },$ как известно, играют критически важную роль в процессах, связанных с размножением у млекопитающих, при этом нарушение кислотно-основного гомеостаза в репродуктивной системе часто вызывает бесплодие/субфертильность у млекопитающих (Liu et al., 2012).
Полученные нами результаты, а также ранее опубликованные данные указывают на потенциальную роль рецепторной тирозинкиназы IRR в развитии преимплантационных эмбрионов посредством неизвестных на данный момент молекулярных механизмов.
Список литературы
Brusentsev E.Yu., Kizilova E.A., Igonina T.N. et al. Effects of Insulin-like Growth Factor 1 on the in vitro development of mouse embryos after cryopreservation // Russ. J. Dev. Biol. 2021. V. 52. P. 120–124.
Danglion S., Dundar-Yenilmez E., Tuli A. et al. Evaluation of intracellular pH regulation and alkalosis defense mechanisms in preimplantation embryos // Theriogenology. 2015. V. 83. P. 1075–1084.
Deyev I.E., Sohet F., Vassilenko K.P. et al. Insulin receptor-related receptor as an extracellular alkali sensor // Cell Metab. 2011. V. 13. P. 679–689.
Deyev I.E., Popova N.V., Serova O.V. et al. Alkaline pH induces IRR-mediated phosphorylation of IRS-1 and actin cytoskeleton remodeling in a pancreatic beta cell line // Biochimie. 2017. V. 138. P. 62–69.
Diez-Roux G., Banfi S., Sultan M. et al. A high-resolution anatomical atlas of the transcriptome in the mouse embryo // PLoS Biol. 2011. V. 9. P. e1000582.
Dissen G.A., Garcia-Rudaz C., Tapia V. et al. Expression of the insulin receptor-related receptor (IRR) is induced by the preovulatory surge of LH in thecal-interstitial cells of the rat ovary // Endocrinology. 2006. V. 147. P. 155–165.
Erickson R.P., Strnatka D. Insulin receptor-related (Irr) is expressed in pre-implantation embryos: a possible relationship to “growth factor Y” and sex determination // Mol. Reprod. Dev. 2011. V. 78. P. 552.
He Q., Chen H., Wong C.H. et al. Regulatory mechanism underlying cyclic changes in mouse uterine bicarbonate secretion: role of estrogen // Reproduction. 2010. V. 140. P. 903–910.
Kitamura T., Kido Y., Nef S. et al. Preserved pancreatic beta-cell development and function in mice lacking the insulin receptor-related receptor // Mol. Cell. Biol. 2001. V. 21. P. 5624–5630.
Liu Y., Wang D.K., Chen L.M. The physiology of bicarbonate transporters in mammalian reproduction // Biol. Reprod. 2012. V. 86. P. 99.
Luo C., Zuniga J., Edison E. et al. Superovulation strategies for 6 commonly used mouse strains // J. Am. Assoc. Lab. Anim. Sci. 2011. V. 50. P. 471–478.
Nef S., Verma-Kurvari S., Merenmies J. et al. Testis determination requires insulin receptor family function in mice // Nature. 2003. V. 426. P. 291–295.
Petrenko A.G., Zozulya S.A., Deyev I.E. et al. Insulin receptor-related receptor as an extracellular pH sensor involved in the regulation of acid-base balance // Biochim Biophys. Acta. 2013. V. 1834. P. 2170–2175.
Serova O.V., Gantsova E.A., Deyev I.E. et al. The value of pH sensors in maintaining homeostasis of the nervous system // Russian J. Bioorganic Chemistry. 2020. V. 46. P. 506–519.
Usoskin D., Furlan A., Islam S. et al. Unbiased classification of sensory neuron types by large-scale single-cell RNA sequencing // Nat. Neurosci. 2015. V. 18. P. 145–153.
Дополнительные материалы отсутствуют.


