Онтогенез, 2022, T. 53, № 3, стр. 203-213
Особенности репродуктивной биологии инвазионного вида Gmelinoides fasciatus (Crustacea: Amphipoda) в Онежском озере
А. И. Сидорова *
Институт водных проблем Севера Карельского научного центра Российской академии наук
185030 Петрозаводск, пр. А. Невского, 50, Россия
* E-mail: bolt-nastya@yandex.ru
Поступила в редакцию 15.12.2021
После доработки 16.01.2022
Принята к публикации 24.01.2022
Аннотация
В статье рассмотрены особенности репродуктивной биологии инвазионного вида Gmelinoides fasciatus (Stebbing 1899) (Crustacea: Amphipoda), способствующие натурализации в водоемах-реципиентах. Для популяции этого вида, обитающей в Петрозаводской губе Онежского озера характерно преобладание доли самок над долей самцов и образование “гаремов”. Данное явление способствует быстрому нарастанию численности чужеродной амфиподы в новых условиях. Плодовитость рачка варьирует от 3 до 24 яиц на самку. Исследование динамики эмбрионального развития G. fasciatus показывает, что в условиях Онежского озера за вегетативный сезон происходят два массовых выхода молоди из яиц. Выявлена размерно-возрастная структура участвующих в размножении самок. Индивидуальная плодовитость самок в течение сезона снижается и уменьшаются средние размеры самок, что связано с двумя массовыми выходами молоди. С конца июля самки новой генерации текущего года начинают достигать половой зрелости и постепенно замещают самок родительского поколения.
ВВЕДЕНИЕ
Вселение чужеродных видов в водные экосистемы представляет собой глобальный фактор, охвативший своим влиянием практически все континенты (Walther et al., 2009; Panov et al., 2010; Дгебуадзе и др., 2018). Это связано с глобальными изменениями природы Земли (климатическими и антропогенными), а также с возрастающей экономической интеграцией всей планеты. Расширение и интенсификация коммуникаций между разными странами часто ведет как к преднамеренному, так и к случайному вселению организмов в регионы, находящимися за пределами их нативного (исторического) ареала. В этих регионах они зачастую попадают в условия, благоприятные для натурализации (Дгебуадзе и др., 2018).
Амфипода Gmelinoides fasciatus (Stebbing 1899) – байкальский субэндемик (рис. 1) (Чертопруд, 2006). Это единственный вид рода Gmelinoides, имеющий байкальское происхождение. До начала 1960-х гг. ареал этого вида был ограничен бассейнами сибирских рек: Ангара, Баргузин, Иртыш, Лена, Пясина, Тунгуска, Селенга, Енисей (Березина и др., 2012).
В 1960-ых годах амфиподу G. fasciatus из оз. Байкал в массовых количествах интродуцировали в западные регионы России с целью увеличения кормовой базы рыб (Бекман, 1962; Иоффе, 1968). В последние 50 лет этот инвазионный вид постоянно расширяет свой ареал, продвигаясь из мест вселения вверх и вниз по течению водотоков (Панов, 1994; Panov et al., 2000; Березина, 2001; Panov, Berezina, 2002; Berezina, 2007). Распространение G. fasciatus в западном регионе России происходило в два этапа: в 1962–1965 гг. рачок был заселен в р. Волга (Горьковское водохранилище) (Иванов, 2005); в 1970-х гг. – в ряд озер Карельского перешейка. Впоследствии этот вид стал заселять другие водоемы северо-западного региона России. Из озер Карельского перешейка рачок проник в крупнейший водоем Европы – Ладожское озеро, где был впервые обнаружен в 1988 г. в прибрежных зарослях рдеста и тростника у мыса Осиновец в губе Петрокрепость. За время исследований в 1988–1990 гг. G. fasciatus был зарегистрирован во многих литоральных сообществах макробентоса западного и северного побережий Ладожского озера (Панов, 1994).
За короткое время байкальская амфипода распространилась от Ладожского озера на запад (эстуарий Невы) и на восток (Онежское озеро). Вселение рачков байкальского происхождения в Финский залив могло произойти естественным путем из озера Ладожского и озер Карельского перешейка (Berezina, 2007). В пресноводной части Невской губы G. fasciatus был впервые обнаружен в 1996 г. (Барков, 2006). В 1999 году эта амфипода была зарегистрирована в олигогалинном эстуарии Невы, где рачок впервые отмечен в солоноватых водах (Berezina, Panov, 2003). В настоящее время этот вид стал обычным видом (Orlova et al., 2006), встречающимся в разных местах обитания, в том числе, в самой восточной части Финского залива с соленостью 0.05–2.00‰ (Berezina, 2007).
В 2001 г. G. fasciatus был впервые обнаружен в западной части литорали Онежского озера (Березина, Панов, 2003). Н.А. Березина и В.Е. Панов (Березина, Панов, 2003) считают, что вселение G. fasciatus в Онежское озеро могло произойти через р. Свирь из Ладожского озера или из оз. Белого по Волго-Балтийскому каналу. В настоящее время, донные сообщества литоральной зоны Онежского озера претерпевают значительные преобразования в результате инвазии бокоплава байкальского происхождения G. fasciatus (Калинкина и др., 2006; Sidorova, Belicheva, 2017), который распространился практически по всему водоему, является массовым видом в литоральной зоне и является кормовым объектом рыб (Lobanova et al., 2017; Georgiev et al., 2021). Показано, что в различных биотопах Онежского озера численность G. fasciatus сильно варьирует – от 1.22 до 18.79 тыс. экз./м2 (Кухарев и др., 2008). Причины столь сильной изменчивости пространственного распределения популяции вселенца были неизвестны. Чужеродные виды амфипод, которые по характеристикам близки к видам-оппортунистам, или r-стратегам, значительно увеличивают свою численность за короткий период времени и могут становиться доминирующими видами в водоеме-реципиенте. Такие виды, как амфипода G. fasciatus, характеризуются коротким жизненным циклом и коротким временем производства следующей генерации, высокой плодовитостью, быстрым ростом и ранним созреванием, преобладанием самок в период размножения, высокой генетической вариабельностью, широким пищевым спектром и эврибионтностью (Berezina, Panov, 2003; Березина, 2004).
Однако, мало что известно об особенностях биологических характеристик, которые способствуют успеху амфипод в водоемах-реципиентах (Alves et al., 2019). В литературе имеются сведенья, посвященные биологии размножения вида G. fasciatus (главным образом, характеристикам плодовитости), в основном касающиеся животных, обитающих в оз. Байкал (Бекман, 1962), Братского водохранилища (Калматынов, Томилов, 2001) и в Невской губе Финского залива (Березина, 2005). Детальная информация о репродуктивной биологии в Ладожском озере получена Д.В. Барковым и Е.А. Курашовым (Барков, 2006; Барков, Курашов, 2011). Однако, в Онежском озере особенности размножения чужеродного вида до настоящего времени остаются мало изученными.
В последние годы усилился интерес к изучению репродуктивных стратегий и эмбриогенеза ракообразных (Kalinina, 2015; Kelly, Taylor, 2018; Alves et al., 2019). Проведено исследование нарушений развития у амфипод Monoporeia affinis (Lindström) в озерах Швеции (Sundelin et al., 2008). Бокоплавы G. fasciatus начали использоваться в качестве нового биомаркера. Так, при изучении эффектов загрязнения водной среды в Балтийском море, учитывают долю эмбрионов G. fasciatus с нарушениями развития (Березина и др., 2016; Березина, 2018). Знания о репродуктивных стратегиях и других особенностях жизненного цикла могут быть важны при интерпретации данных, связанных с биоиндикацией и экотоксикологией (Rinderhagen et al., 2000). Репродуктивные показатели, такие как плодовитость, могут быть использованы и при биооценке качества воды (Castro et al., 2006). Кроме того, выявление особенностей репродуктивной биологии, которые способствуют созданию новых популяций вида за пределами его естественного ареала, необходимо для прогнозирования инвазий потенциально опасных видов.
Онежское озеро представляет собой северную границу ареала распространения байкальской амфиподы G. fasciatus в северо-западной части России. Изучение биологии байкальского рачка в Онежском озере позволяет проследить процессы акклиматизации вида-вселенца к условиям, существенно отличающимся от исходного водоема – оз. Байкал. Адаптация вида к условиям среды за счет эволюции репродуктивной стратегии – одна из актуальных проблем экологической эволюционной биологии развития (Eco-Devo). Инвазионная амфипода G. fasciatus может стать перспективным модельным объектом для исследований в этом направлении.
В связи с вышеизложенным, цель настоящей работы заключалась в исследовании сезонной динамики половой структуры, стадий эмбрионального развития и плодовитости байкальского вселенца G. fasciatus в водоеме-реципиенте оз. Онежское на северной границе ареала Европейской части России.
МАТЕРИАЛЫ И МЕТОДЫ
Местообитание объекта исследования
Онежское озеро расположено в зоне Европейского севера России и является вторым по величине пресноводным озером Европы. В естественном состоянии площадь зеркала составляла 9720 км2, из которых 250 км2 приходилось на 1500 островов. Протяженность озера с севера на юг составляет 248 км, с запада на восток – 96 км. Объем водной массы озера достигает 295 км3, средняя глубина – 30 м, максимальная – 120 м. Длина береговой линии составляет 1810 км, изрезанность береговой линии – 5.12 (Филатов, 2010).
Петрозаводская губа – один из наиболее крупных заливов Онежского озера, составляющий 1.3% площади озера (Сабылина, Рыжаков, 2007). Длина ее составляет 19 км, средняя ширина – 7, площадь водной поверхности около 125 км2, средняя глубина – 18.2 м (Малинина, Солнцева, 1972). К литоральной зоне относится 20.8% от общей площади Петрозаводской губы, она представляет собой участок шириной в 400–450 м, со сравнительно большими уклонами дна (0.022 м/км), равномерно тянущийся вдоль всей береговой линии (Кириллова, 1975). На западном берегу Петрозаводской губы располагается крупный населенный пункт – г. Петрозаводск (столица Республики Карелия), численность населения, которого составляет около 260 000 человек.
Методы исследования макрозообентоса
На литорали Петрозаводской губы было организовано наблюдение за сезонной динамикой популяционных показателей G. fasciatus в 2010 г. (рис. 2). Мониторинговая станция представлена песчано-каменистой затишной литоралью с зарослями макрофитов, главным образом, тростника обыкновенного Phrágmites austrális (Cav.). Площадь зарастания на станции составила около 5 м2. Отмечено обрастание камней нитчатыми водорослями. Станция защищена от волн двумя мысами с юго-восточной и северной сторон, которые образуют небольшую бухту с затишными условиями. С учетом характера распределения вида G. fasciatus по глубине станция наблюдения в Петрозаводской губе была приурочена к глубине 0.4 м, где численность рачков максимальная (Сидорова, 2013).
Гидробиологический материал собирали в период с конца мая по начало октября каждые 10 дней. Отбор и обработку проб осуществляли в соответствии с руководствами по сбору пресноводного бентоса (Винберг, Лаврентьева, 1984). Для отбора проб бентоса использовали трубчатый металлический пробоотборник Панова-Павлова площадью захвата 0.07 м2 и высотой 0.65 м (Панов, Павлов, 1986). Сборы проводились на глубине до 0.4 м из 3 точек, находящихся друг от друга на расстоянии примерно 5 м. Всего было собрано на станции 45 проб. Идентификация организмов макрозообентоса производилась с помощью микроскопа ЛОМО Микмед-6, в соответствии с определителем (Алексеев, Цалолихин, 2016). В лаборатории рачков измеряли с помощью стереомикроскопа МСП-2 вариант 2 с точностью 0.1 мм, определяли пол по наличию или отсутствию оостегитов. Сырую массу фиксированных в формалине особей G. fasciatus определяли путем взвешивания после сушки на фильтровальной бумаге с точностью 0.0001 г., используя лабораторные аналитические весы ВЛ-124В. Всего измерено и взвешено 411 экземпляров самцов и 577 экземпляров самок.
Статистическую обработку данных, полученных в ходе исследований, выполняли согласно методическим указаниям (Ивантер, Коросов, 2010).
Эмбриональное развитие и плодовитость
Для оценки плодовитости яйца 420 самок были извлечены из выводковых камер и посчитаны с помощью стереомикроскопа. Стадии эмбрионального развития идентифицировали по Weygoldt (1924) и Skadsheim (1982) (цит. по Pockl, 1993). Первая стадия: недавно отложенные яйца, которые могут быть окружены гиалиновой оболочкой, видны отдельные бластомеры, число которых не больше 64; 2 стадия: гиалиновая оболочка исчезла, яйцо выглядит однородным, яйцевые мембраны плотно прилегают к эмбриону; 3 стадия: у эмбриона появляется вентральная щель, продолжающаяся в подковообразную борозду и отделяющая брюшко от цефалоторакса; 4 стадия: видны зачатки конечностей; 5 стадия: пищеварительная система эмбриона содержит желтые пигментные клетки, зачатки конечностей членистые; 6 стадия: видны оранжево-красный цефалоторакс, глаза, двуветвистые сегментированные конечности; 7 стадия: вылупление из яиц и свободно плавающая молодь.
РЕЗУЛЬТАТЫ
Сезонная динамика численности и биомассы G. fasciatus
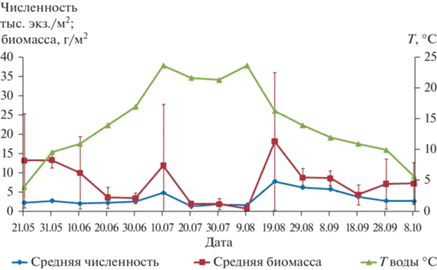
В Петрозаводской губе средняя численность амфиподы составила 3454 экз./м2 (максимум – 13 500 экз./м2), а средняя биомасса – 7.7 г/м2, (максимум – 38.7 г/м2). Максимальные значения численности и биомассы отмечены в середине августа (рис. 3).
Сезонная динамика половой структуры популяции G. fasciatus
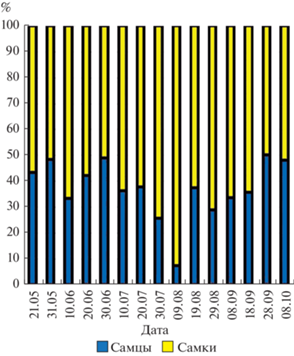
Динамика полового состава популяции G. fasciatus в условиях песчано-каменистой литорали с зарослями макрофитов представлена на рис. 4. Соотношение самцов и самок в течение сезона размножения чаще всего было 1 : 1.7. По критерию χ2 Пирсона (6.6–22.5), доля самок в этих случаях была достоверно (p < 0.05) выше, чем доля самцов. Особенно ярко выраженное доминирование численности самок G. fasciatus отмечалось в августе, в период второго массового выхода молоди из яиц, когда доля самок достигала 93% (1 : 13). В другие даты отбора проб (21, 31 мая, 20, 30 июня, 20 июля и 28 сентября) процентное соотношение между самками и самцами достоверно не отличалось от 1 : 1.
Необходимо отметить, у самок диапазон размеров и массы тела уже, чем у самцов, как в Онежском, так и в Ладожском озерах (Барков, Курашов, 2011). Так, в Онежском озере средний размер самцов на станции наблюдения составил 6.3 ± 0.1 мм, при средней биомассе – 5.7 ± 0.2 мг. Для самок средний размер был ниже – 4.9 ± 0.1 мм, при средней биомассе 3.6 ± 0.1 мг. Наибольшая длина тела самцов составила 11.5 мм с биомассой 24 мг. Максимальные размеры самок в Онежском озере достигали 9.5 мм с биомассой 10.7 мг. В Ладожском озере максимальный размер самцов G. fasciatus, встреченных в озере, достигал 11.8 мм при массе 29.5 мг. Преобладали особи длиной 3–7 мм и массой 0.7–6.7 мг. Подавляющее большинство самок были длиной 5.0– 6.5 мм. За период исследования размеры самок с яйцами в выводковой сумке колебались от 3.8 до 9.0 мм, плодовитость – от 3 до 35 яиц (Барков, Курашов, 2011).
Эмбриональное развитие G. fasciatus
Особенности репродуктивной биологии популяции G. fasciatus на литорали Онежского озера свидетельствуют о том, что в новом водоеме вселенец нашел вполне благоприятные условия для своего существования. Размножение в популяции G. fasciatus начинается в начале мая. В это время встречалось большое количество копулирующих пар. В последней декаде мая в пробах доминировали самки с яйцами на 2 стадии развития (согласно классификации Weygoldt (1924) и Skadsheim (1982) (цит. по Pockl, 1993)). Эти яйца недавно отложены, так как выглядели внешне однородными и не имели гиалиновых мембран. Это свидетельствует о том, что процесс размножения у данного вида начинается именно в последней декаде мая (рис. 5).
Рис. 5.
Доля яйценосных самок с яйцами разных стадий эмбрионального развития в популяции в течение сезона размножения (разными цветами показаны 1–7 стадии эмбрионального развития).
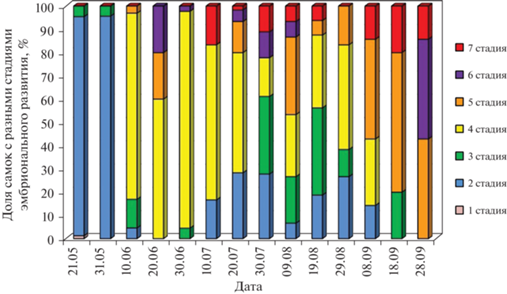
В июне в пробах присутствовали самки с яйцами на 3, 4, 5 и 6 стадиях развития, а именно: эмбрионы с вентральной щелью (3 стадия); эмбрионы с зачатками конечностей (4 стадия); эмбрионы, у которых пищеварительная система содержит желтые пигментные клетки (5 стадия); эмбрионы с отчетливо видимыми глазами, конечностями и сегментацией (6 стадия) (см. рис. 5).
В первой декаде июля доля самок с полностью развитыми эмбрионами, готовыми к выходу из яиц (7 стадия развития), достигала 20%. Кроме того, именно в конце первой декады (10 июля) был отмечен массовый выход молоди из яиц. В это же время в пробах доминировали самки с эмбрионами 4-й стадии развития (65%). Кроме того, было зарегистрировано новое массовое появление самок с начальными стадиями эмбрионального развития (15%). Этот факт указывает на вторую волну размножения G. fasciatus.
Со второй половины июля до начала сентября отмечены самки со всеми стадиями развития яиц. В этот период начали размножаться достигшие половозрелости самки летней генерации, которые постепенно замещают размножающихся самок прошлогодних генераций.
В конце сентября самки с яйцами на ранних стадиях развития (2, 3 и 4 стадии) отсутствовали, однако увеличилась доля самок с яйцами на поздних стадиях развития (5, 6, 7 стадии). Так, доля самок с яйцами 4 стадии развития достигала 40%. Доминировали самки с яйцами на 6 стадии (до 45%). Часть яйценосных самок с яйцами на 7 стадии эмбрионального развития составила 15% от общего количества яйценосных самок. Эти данные свидетельствуют о завершении процесса размножения G. fasciatus.
Плодовитость G. fasciatus
Средняя плодовитость самок G. fasciatus в течение сезона размножения характеризовалась четко выраженной динамикой, связанной со сменой генераций в популяции (табл. 1).
Таблица 1.
Сезонное изменение линейных размеров и плодовитости яйценосных самок G. fasciatus в течение сезона размножения
| Месяц | Количество определений | Средняя длина тела, мм (x ± mx) | Средняя плодовитость, яиц/самку (x ± mx) | Колебания плодовитости, яиц/самку |
|---|---|---|---|---|
| Май | 167 | 5.4 ± 1.3 | 8.1 ± 3.0 | 3–17 |
| Июнь | 95 | 5.4 ± 0.8 | 12.2 ± 5.2 | 4–24 |
| Июль | 50 | 5.1 ± 0.6 | 10 ± 4.6 | 4–24 |
| Август | 65 | 4.6 ± 0.8 | 8.5 ± 3.4 | 3–17 |
| Сентябрь | 43 | 4.9 ± 0.8 | 9.8 ± 4.3 | 4–19 |
В конце мая – начале июня преобладали самки генерации прошлого года. Для них в начале сезона размножения характерна относительно небольшая плодовитость (8.1 яиц на самку), которая возрастает до 12.2 яиц на самку. С конца июля по сентябрь постепенно приступают к размножению самки новой генерации. Об этом свидетельствует уменьшение средних размеров самок: в конце мая средний размер самок составил 5.4 мм, в августе он снизился до 4.6–4.9 мм. Это отражает смену генераций, начало размножения самок нового поколения. Плодовитость самок новой генерации составляет 8.5–9.8 яиц на самку.
Индивидуальная плодовитость самок G. fasciatus в Онежском озере на станции наблюдения варьировала от 3 до 24 яиц/самку.
ОБСУЖДЕНИЕ
Чужеродный вид G. fasciatus способен размножаться в условиях водоема-реципиента – Онежского озера. Об этом свидетельствует то, что его численность и биомасса сопоставима с популяционными показателями вида в других водоемах (табл. 2). Показано, что в озере Байкал численность G. fasciatus варьировала в пределах 10 000–20 000 экз./м2, при биомассе 63–100 г/м2 (Бекман, 1962). В Ладожском озере в 2004–2005 гг. численность составила 936–3141 экз./м2, при биомассе 4.2–10.3 г/м2 (Барков, 2006). В 2009 г. численность изменялась от 8 до 7160 экз./м2, при биомассе – 0.024–15.3 г/м2 (Курашов и др., 2010), что сопоставимо с результатами, полученными для Онежского озера.
Таблица 2.
Популяционные показатели G. fasciatus в разных водоемах
| Водоемы, год исследований | Численность популяции, экз./м2 | Биомасса популяции, г/м2 | Плодовитость яиц/самку |
Глубины с максимальной плотностью, м | Источники |
|---|---|---|---|---|---|
| Озеро Байкал (Посольский Сор) | 10 000–20 000 | 63–100 | 3–32 | 0–1.0 | Бекман, 1962 |
| Оз. Псковско-Чудское, 1996 | 50–17 300 | 0.1–102 | – | 0.3 | Panov et al., 2000 |
| Оз. Отрадное | 26–692 | – | 3–34 | 1.0–1.2 | Нилова, 1976 |
| Ладожское озеро, 1988–1990 гг. | 8–53800 | 0.02–158.60 | – | 0–1.0 | Панов, 1994 |
| Ладожское озеро, 1992 г. |
6000–7000 | 80–100 | – | – | Slepukhina et al., 1996 |
| Ладожское озеро, 2004–2005 гг. | 936–3141 | 4.2–10.3 | 3–35 | 0.3–0.5 | Барков, 2006 |
| Ладожское озеро, 2006 г. | 9090 ± 2024 | 18.65 ± 3.61 | – | – | Курашов, 2011 |
| Ладожское озеро, 2009 г. | 8–7160 | 0.024–15.3 | – | – | Курашов и др., 2010 |
| Финский залив Балтийского моря, 1998–2001 гг. | 300–3000 | 0.4–8.8 | 3–46 | 0.4–1.2 | Березина, 2005 |
| Рыбинское водохранилище, 1990 г. | 6800 | 19.8 | 3–20 | – | Скальская, 1994 |
| Западное побережье оз. Онежское, 2001 г. | 1696–8256 | 3.9–40.3 | 8–18 | 0.2–0.5 | Березина, Панов, 2003 |
| Оз. Онежское, 2005 г. Петрозаводская губа |
132–462 | 0.2–6.2 | 4–15 | 0.5 | Калинкина и др., 2006 |
| Оз. Онежское, 2006 г. | 310–18 740 | 0.2–12.2 | – | – | Кухарев и др., 2008 |
Показано, что максимальные популяционные показатели инвазионного вида G. fasciatus отмечены, как в естественном ареале (оз. Байкал), так и вторичном ареале (оз. Псковско-Чудское, оз. Отрадное, оз. Ладожское, Финский залив Балтийского моря, Рыбинское водохранилище и Горьковское водохранилище) на глубине около 1 м.
Особенности полового состава популяции – преобладание самок в период размножения и образование “гаремов” – способствует быстрому нарастанию численности популяции (Березина, 2004). Такие же случаи доминирования доли самок над долей самцов были отмечены в зоне зарослей тростника Невской губы Финского залива Балтийского моря (Березина, 2005).
Исследование динамики эмбрионального развития проводили в озере Арахлей (Матафонов, 2020). Однако, идентификация стадий развития эмбрионов выполнялась по другим признакам. Авторы выделяли самок со свежеотложенными яйцами, самок с эмбрионами на стадии “полоски”, самок с молодью. Авторами показано, что в 2017 и 2018 гг. основной выход молоди G. fasciatus в оз. Арахлей происходил в июне. Последующие когорты ни в 2017, ни в 2018 гг. не были многочисленными (Матафонов, 2020). В условиях Ладожского озера массовый выход молоди в 2004 г. был отмечен 30 мая (Барков, Курашов, 2011). Продолжительность эмбрионального развития G. fasciatus зависит от температурных условий. Так, по экспериментальным данным, при средней температуре воды 12°С для развития необходимы 3 нед. (Барков, 2006). Следовательно, для водоемов оз. Онежское, оз. Ладожское и оз. Арахлей первый массовый выход молоди инвазионного вида приходится на конец мая или начало июня в зависимости от прогрева воды.
Плодовитость животных следует рассматривать как важнейший фактор, в значительной степени определяющий динамику численности популяции (Алимов, 1989). Знание границ репродуктивных показателей того или таксона необходимо, прежде всего, для выявления потенциальных возможностей популяций этого таксона к стабильному воспроизводству.
Полученные нами показатели индивидуальной плодовитости самок G. fasciatus в Онежском озере варьировали от 3 до 24 яиц на самку, что сопоставимо с данными, полученными ранее для данного водоема (табл. 2). Так, при первом обнаружении чужеродного вида на юго-западном побережье Онежского озера в 2001 г., плодовитость варьировала в пределах 8–18 яиц на самку (Березина, Панов, 2003). В 2005 г. на литорали в районе города Петрозаводска плодовитость рачков составила 4–15 яиц на самку (Калинкина и др., 2006). В целом, показатели плодовитости рачков, обитающих в Онежском озере, близки к показателям G. fasciatus Братского водохранилища, где максимальная плодовитость достигала 26 яиц на самку (Калмыков, Томилов, 2001). В озере Байкал плодовитость самок вида G. fasciatus составила 3–32 яиц на самку (Бекман, 1962). В Ладожском озере плодовитость колебалась в пределах от 3 до 35 яиц на самку (Барков, Курашов, 2011). Максимальное количество яиц в марсупиуме G. fasciatus зарегистрировано в Невской губе Финского залива – 46 яиц на самку (Березина, 2005).
ЗАКЛЮЧЕНИЕ
Половой состав G. fasciatus в Петрозаводской губе Онежского озера характеризуется образованием “гаремов” и преобладанием доли самок над долей самцов. Данное явление способствует быстрому нарастанию численности чужеродной амфиподы в новых условиях. Плодовитость рачка варьирует от 3 до 24 яиц на самку. Детальное исследование динамики эмбрионального развития G. fasciatus помогло выявить два массовых выхода молоди из яиц за сезон размножения в условиях Онежского озера. Индивидуальная плодовитость самок в течение сезона размножения снижается, также уменьшаются средние размеры самок, что связано с двумя массовыми выходами молоди. С конца июля самки новой генерации начинают достигать половой зрелости и постепенно замещают самок родительского поколения.
Список литературы
Алексеев В.А., Цалолихин С.Я. (ред.) Определитель зоопланктона и зообентоса пресных вод Европейской России. Т. 2. Зообентос. М.–СПб.: Товарищество научных изданий КМК, 2016. 457 с.
Алимов А.Ф. Введение в продукционную гидробиологию. Л. Гидрометеоиздат, 1989. 152 с.
Барков Д.В. Экология и биология байкальского вселенца Gmelinoides fasciatus (Stebbing, 1899) и его роль в экосистеме Ладожского озера: Автореф. дис. … канд. биол. наук. СПб., 2006. 26 с.
Барков Д.В., Курашов Е.А. Популяционная характеристика и жизненный цикл байкальского вселенца Gmelinoides fasciatus (Stebbing, 1899) (Сrustacea: Amphipoda) в Ладожском озере // Биология внутренних вод. 2011. № 2. С. 46–56.
Бекман М.Ю. Экология и продукция Micruropus possolsii Sow. и Gmelinoides fasciatus Stebb. // Труды Лимнологического института Сибирского отделения АН СССР. 1962. Т. 2. Ч. 1. С. 141–155.
Березина Н.А. Петряшев В.В., Шаров А.Н. Значение чужеродных видов высших ракообразных в континентальных водоемах Северо-запада России // Сборник лекций и докладов международной школы-конференции. Ин-т биологии внутр. вод им. И.Д. Папанина РАН, Борок, 5–9 ноября 2012 г. Кострома: ООО Костромской печатный дом, 2012. С. 137–140.
Березина Н.А. Применение новых биомаркеров эмбриональных нарушений у амфипод для оценки экологического состояния Балтийского моря // Загрязнение морской среды: экологический мониторинг, биоиндикация, нормирование. Сборник статей Всероссийской научной конференции с международным участием, посвященной 125-летию профессора В.А. Водяницкого. Севастополь, 28 мая–1 июня, 2018 г. – Севастополь : “Колорит”, 2018. С. 29–33.
Березина Н.А. Причины, особенности и последствия распространения чужеродных видов амфипод в водных экосистемах Европы // Биологические инвазии в водных и наземных экосистемах. М.: Товарищество научных изданий КМК, 2004. С. 254–268.
Березина Н.А. Сезонная динамика структуры и плодовитость популяции байкальского бокоплава (Gmelinoides fasciatus, Ampipoda, Crustacea) в зарослевой зоне Невской губы // Зоологический журн. 2005. Т. 84. № 4. С. 411–419.
Березина Н.А., Панов В.Е. Вселение байкальской амфиподы Gmelinoides fasciatus (Amphipoda, Crustacea) в Онежское озеро // Зоологический журн. 2003. Т. 82. № 6. С. 731–734.
Березина Н.А., Губелит Ю.И., Поляк Ю.М. и др. Комплексная оценка состояния прибрежных местообитаний Финского залива Балтийского моря // Морские биологические исследования: достижения и перспективы. Сборник материалов Всероссийской научно-практической конференции с международным участием, приуроченной к 145-летию Севастопольской биологической станции: в 3 томах. ЭКОСИ-Гидрофизика. 2016. С. 252–255.
Березина Н.А., Хлебович В.В., Панов В.Е. и др. Соленостная резистентность интродуцированной в бассейн Финского залива (Балтийское море) амфиподы Gmelinoides fasciatus (Stebb.) // Доклады Академии Наук. 2001. Т. 379. № 3. С. 414–416.
Винберг Г.Г., Лаврентьева Г.М. (ред.) Методические рекомендации по сбору и обработке материалов при гидробиологических исследованиях на пресноводных водоемах. Зообентос и его продукция. Л.: ГосНИОРХ, 1984. 52 с.
Дгебуадзе Ю.Ю., Петрозян В.Г., Хляп Л.А. (ред.) Самые опасные инвазионные виды России (ТОП-100). М.: Тов-во научных изданий КМК, 2018. 688 с.
Иванов В.К. Структура и взаимодействие в сообществе макробеспозвоночных прибрежья Рыбинского водохранилища при доминировании Gmelinoides fasciatus (Stebbing) // Чужеродные виды в Голарктике (БОРОК-2). Тез. док. Второго международного Симпозиума по изучению инвазийных видов. Борок, Россия 27 сентября–10 октября 2005 г. Рыбинск-Борок, 2005. С. 81–82.
Ивантер Э.В., Коросов А.В. Элементарная биометрия. Петрозаводск, 2010. 104 с.
Иоффе Ц.И. Обзор выполненных работ по акклиматизации кормовых беспозвоночных для рыб в водохранилищах // Изв. ГосНИОРХ. 1968. Т. 67. С. 7–29.
Калинкина Н.М., Сярки М.Т., Федорова А.С. Динамика популяционных показателей инвазионного вида Gmelinoides fasciatus (Stebbing) в Петрозаводской губе Онежского оз. // Северная Европа в XXI веке: природа, культура, экономика. Мат. междун. конф., посвящ. 60-летию КарНЦ РАН (24–27 окт. 2006 г.). Петрозаводск, 2006. С. 269–271.
Калматынов Р.М., Томилов А.А. Динамика популяции Gmelinoides fasciatus (Stebbing, 1899) (Crustacea, Amphipoda) в Братском водохранилище // Природные ресурсы Забайкалья и проблемы природопользования. Материалы научной конференции 10–15 сентября 2001 г. Чита, 2001. С. 490–491.
Кириллова В.А. Морфометрическая характеристика литоральной зоны Онежского озера // Литоральная зона Онежского озера. Ленинградское отд. Л.: Наука, 1975. С. 15–21.
Курашов Е.А., Панов В.Е., Барбашова М.А. Первое обнаружение инвазивной амфиподы Chelicorophium curvispinum (G.O. Sars, 1895) (Amphipoda, Crustacea) в Ладожском озере // Российский журн. биологических инвазий. 2010. № 3. С. 62–71
Курашов Е.А. (ред.) Литоральная зона Ладожского озера. СПб.: Нестор-История, 2011. 416 с.
Кухарев В.И., Полякова Т.Н., Рябинкин А.В. Распространение байкальской амфиподы Gmelinoides fasciatus (Ampipoda, Crustacea) в Онежском озере // Зоологический журн. Т. 87. № 10. 2008. С. 1270–1273.
Малинина Т.И., Солнцева Н.О. Сейши Онежского озера // Динамика водных масс Онежского озера. Л., 1972.
Матафонов П.В. Жизненный цикл бокоплавов Gmelinoides fasciatus (Stebbing, 1899) и Gammarus lacustris (Sars, 1863) в оз. Арахлей в экстремально маловодную фазу гидрологического цикла // Амурский зоологический журн. 2020. Т. XII. № 1. С. 16–25.
Нилова О.И. Некоторые черты экологии и биологии Gmelinoides fasciatus Stebb., акклиматизированных в озере Отрадное Ленинградской области // Изв. Гос. научн.-исслед. ин-та озерн. и речн. хоз-ва. 1976. Т. 110. С. 10–15.
Панов В.Е. Байкальская эндемичная амфипода Gmelinoides fasciatus Stebb. в Ладожском озере // Доклады Академии Наук. 1994. Т. 336. № 2. С. 279–282.
Панов В.Е., Павлов А.М. Методика количественного учета водных беспозвоночных в зарослях камыша и тростника // Гидробиологический журн. 1986. Т. 22. № 6. С. 87–88.
Сабылина А.В., Рыжаков А.В. Онежское озеро и его притоки. Общая характеристика // Состояние водных объектов Республики Карелия по результатам мониторинга 1998–2006 гг. Петрозаводск, 2007. С. 29–40.
Сидорова А.И. Структурно-функциональные характеристики популяции байкальского вселенца Gmelinoides fasciatus Stebbing (Crustacea: Amphipoda) на северной границе ареала (Онежское озеро). Автореферат дис. … канд. биол. наук. Петрозаводск, 2013. 25 с.
Скальская И.А. Расселение байкальского бокоплава Gmelinoides fasciatus (Stebbing) в Рыбинском водохранилище // Биология внутренних вод. Информационный бюллетень № 96. СПб.: Наука, 1994. С. 35–40.
Филатов Н.Н. (ред.) Онежское озеро. Атлас. Петрозаводск: Карельский научный центр РАН, 2010. С. 151.
Чертопруд М.В. Фауна бокоплавов (Crustacea, Amphipoda) Московской области // Биология внутренних вод. 2006. № 4. С. 17–21.
Alves D.F.R., Greco L.S.L., Barros-Alves S.P. et al. Sexual system, reproductive cycle and embryonic development of the red-striped shrimp Lysmata vittata, an invader in the western Atlantic Ocean // PLoS One. 2019. V. 14(1): e0210723.
Berezina N.A. Changes in aquatic ecosystems of the north-western Russia after introduction of Baikalian amphipod Gmelinoides fasciatus // Biological Invaders in Inland Waters: Profiles, Distribution, and Threats / Ed. Gherardi F. Springer, Dordrecht, the Netherlands, 2007. P. 479–493.
Berezina N.A., Panov V.E. Establishment of new gammarid species in the eastern Gulf of Finland (Baltic Sea) and their effects on littoral communities // Proc. Estonian Acad. Sci. Biol. Ecol. 2003. V. 52(3). P. 284–304.
Castro H., Ramalheira F., Quintino V. et al. Amphipod acute and chronic sediment toxicity assessment in estuarine environmental monitoring: an example from Ria de Aveiro, NW Portugal // Marine Pollution Bulletin. 2006. № 53. P. 91–99.
Georgiev A.P., Sidorova A.I., Shustov Yu.A. et al. The Baikal amphipod Gmelinoides fasciatus (Amphipoda, Crustacea) in the diet of perch in the littoral zone of Lake Onega (age and seasonal characteristics) // Biology Bulletin. 2021. V. 48. Suppl. 1. P. S24–S32.
Kalinina M.V. Fertility and embryonic mortality level of the Japanese mitten crab Eriocheir japonica (Crustacea: Decapoda: Varunidae) in Primorye // Russian J. Developmental Biology. 2015. V. 46. P. 333–341.
Kelly K.L., Taylor Car M. Effects of crude oil on survival and development in embryonated eggs in Callinectes sapidus Rathbun, 1896 (Decapoda, Portunidae) // PeerJ. 2018. V. 6. P. 123–146.
Lobanova A.S., Sidorova A.I., Georgiev A.P. et al. The role of invasive amphipod Gmelonoides fasciatus (Stebbing) in the feeding of perch Perca fluviatilis L. in the littoral zone of Lake Onega // Russian J. Biological Invasions, 2017. V. 8. № 3. P. 261–265.
Orlova M.I., Telesh I.V., Berezina N.A. et al. Effects of nonindigenous species on diversity and community functioning in the eastern Gulf of Finland (Baltic Sea) // Helgoland Marine Research. 2006. V. 2. P. 98–105.
Panov V.E., Alexandrov B., Arbaiauskas K. et al. Risk assessment of aquatic invasive species introductions via European inland waterways // Atlas of Biodiversity Risk / Eds. Josef Settele, Lyubomir Penev, Teodor Georgiev, Ralf Grabaum, Vesna Grobelnik, Volker Hammen, Stefan Klotz, Mladen Kotarac, Ingolf Kuhn. Pensoft. Sofia. 2010. P. 140-143.
Panov V.E., Berezina N.A. Invasion history, biology and impacts of the Baikalian amphipod Gmelinoides fasciatus (Stebb.) // Invasive Aquatic Species of Europe / Eds. Leppäkoski E., Olenin S., Gollasch S. Dordrecht: Kluwer Publisher, 2002. P. 96–103.
Panov V.E., Timm T., Timm H. Current status of an introduced Baikalian amphipod Gmelinoides fasciatus Stebbing, in the littoral communities of Lake Peipsi // Proceedings of Estonian Academy of Sciences, Biology, Ecology. 2000. V. 49. P. 71–80.
Pockl M. Reproductive potential and lifetime potential fecundity of the freshwater amphipods Gammarus fossarum and G. roeseli in Austrian streams and rivers // Freshwater Biology. 1993. V. 30. P. 73–91.
Rinderhagen M., Ritterhoff J., Zauke G.P. Crustaceans as bioindicators // Biomonitoring of PollutedWater – Reviews on Actual Topics / Ed. Geerhardt A. Trans Tech Publications/Scitech Publications, Zurich. 2000. P. 161–194.
Sidorova A., Belicheva L. Distribution and population structure of the invasive amphipod Gmelinoides fasciatus (Stebbing) in Lake Onego // Environment. Technology. Resources, Rezekne, Latvia Proceedings of the 11th International Scientific and Practical Conference. 2017. V. I. P. 259–264.
Skadsheim A. The ecology of intertidal amphipods in the Oslofjord // The Life Cycles of Chaetogammarus marinus and C. stoerensis. Publicazloni Stazioni Zoologici di Napoli (Marine Ecology). 1982. № 3. P. 213–222.
Slepukhina T.D., Belyakova I.V., Chichikalyuk Y.A. et al. Bottom sediments and biocoenoses of northern Ladoga and their changes under human impact // Hydrobiologia. 1996. V. 322. P. 23–28.
Sundelin B., Rosa R., Eriksson Wiklund A.-K. Reproduction disorders in a benthic amphipod, Monoporeia affinis, an effect of low food quality and availability // Aquatic Biology. 2008. V. 2. P. 179–190.
Walther G.R., Roques A., Hulme P.E. et al. Alien species in a warmer world – risks and opportunities // Trends in Ecology and Evolution. 2009. № 24. P. 686–693.
Weygoldt P. Die Embryonalentwicklung des Amphipoden Gammarus pulex // Zoologische Jahrbucher (Abteilung Allgemeine Zoologie und Physiologie der Tiere). 1924. № 77. P. 51–110.
Дополнительные материалы отсутствуют.