Почвоведение, 2019, № 10, стр. 1198-1202
Особенности трансформации соединений азота и углерода в олиготрофной торфяной почве
А. Ю. Климова a, *, А. Л. Степанов a, Н. А. Манучарова a
a МГУ им. М.В. Ломоносова
119991 Москва, Ленинские горы, 1, Россия
* E-mail: nastyakli@rambler.ru
Поступила в редакцию 13.12.2018
После доработки 28.02.2019
Принята к публикации 15.03.2019
Аннотация
В ходе полевых и лабораторных исследований проведена оценка активности процессов азотфиксации, денитрификации, эмиссии СО2 и метанообразования в олиготрофной торфяной почве (Fibric Histosol) стационара “Старосельский мох” Центрально-лесного государственного природного биосферного заповедника Тверской области. Обнаружена высокая интенсивность окисления метана в олиготрофной торфяной почве. Сделано предположение о том, что метан в этих условиях может быть использован диазотрофными бактериями в качестве энергетического источника. Определение активности азотфиксации олиготрофной торфяной почвы в присутствии метана показало резкий рост нитрогеназной активности. Важно отметить, что в присутствии метана нитрогеназная активность оказалась более высокой, даже по сравнению с вариантом с глюкозой. Установлено преимущественное поглощение закиси азота верхним горизонтом олиготрофного торфяника, что позволяет рассматривать эти экосистемы как природный сток для N2O.
ВВЕДЕНИЕ
Олиготрофные торфяники играют значимую роль в регуляции газового состава атмосферы, являясь с одной стороны мощным резервуаром органического углерода, а с другой – источником углеродсодержащих парниковых газов: CH4 и CO2. Токсичность фенольных соединений, содержащихся в сфагнуме, ингибирует деятельность многих гидролитических ферментов и является основной причиной медленной деструкции сфагнового торфа [2].
В то же время микроорганизмы фиксируют азот из атмосферы, осуществляют процессы нитрификации и денитрификации, тем самым микробные комплексы болот выполняют особую роль в глобальном круговороте углерода и азота в биосфере [6]. Микробная фиксация азота служит одним из главных путей поступления в болотные экосистемы азотных соединений, доступных для растений и микроорганизмов, и является одним из факторов, лимитирующим их рост. Такие экосистемы адаптированы к низким концентрациям доступного азота, свыше 80% ежегодно фиксированного азота остается внутри торфяников [10]. При этом основная масса азота переходит в нижележащие торфяные слои и там иммобилизуется. Потеря фиксированного азота в атмосферу происходит в верхних аэрированных слоях торфа, главным образом, в форме N2O [12].
Существующие оценки нитрогеназной активности для сфагновых болот часто противоречивы. Полученные на основе ацетиленового и изотопного методов величины азотфиксирующей активности низки и не превышают 0.5–1.5 кг азота/(га год) [11]. В то же время есть сведения о высокой интенсивности азотфиксациии на осоковых участках верхового болота до 40–90 кг азота/га за вегетационный сезон [10]. По другим оценкам ежегодное количество фиксированного азота в верховых торфяных почвах составляет 0.7 кг азота/га. В низинных торфяниках эти показатели значительно больше, они варьируют от 5.3 до 21 кг азота/га [17]. Формирующиеся здесь сообщества диазотрофов немногочисленны, в их структуре преобладают анаэробные формы. Возможно, процесс азотфиксации обеспечивается другими формами диазотрофов. В частности, в нем могут принимать участие метанотрофные бактерии, использующие большие запасы метана [5].
В анаэробных условиях болот часто развиваются денитрифицирующие бактерии. Численность культивируемых денитрификаторов составляет около 107 кл./г, в то время как плотность железовосстанавливающих бактерий и метаногенов значительно ниже – 104–105 кл./г почвы [15]. В грибной составляющей микробной биомассы по всему профилю залежи преобладают споры, в то время как мицелий был обнаружен лишь до глубины 175 см. Проведенный корреляционный анализ показал прямую зависимость количества грибного мицелия от содержания легкогидролизуемых веществ [7].
Денитрификация в почве регулируется температурой, влажностью, количеством углерода, реакцией среды. Наибольшее влияние на активность денитрификаторов в торфяных почвах оказывают температура и содержание нитратов. Причем низкие температуры ограничивают активность N2О-редуктазы больше, чем других ферментов [1, 9].
Метан образуется в торфяной залежи в анаэробных условиях в ходе разложения органического вещества под действием анаэробов. Явитт с соавт. [18] обнаружили, что образование метана на глубине 30–40 cм происходит в основном через восстановление СО2, и скорость процесса ограничена доступностью Н2. Добавление глюкозы, Н2 и СО2 в торфяные почвы стимулировало образование метана, в то время как добавление ацетата ингибировало метаногенез.
Метан является высокоэнергетическим субстратом, который используется метанотрофами в качестве единственного источника углерода и энергии [16]. Эмиссия CH4 может значимо регулировать азотфиксацию в качестве энергетического субстрата для азотфиксирующих метилотрофов, поскольку эти микроорганизмы в лесных и болотных экосистемах проявляют высокую активность на протяжении всего вегетационного периода [13].
Верховые болота с малой интенсивностью обменных процессов рассматриваются как наиболее мощный источник метана. Разнообразные болотные системы продуцируют метан в разных количествах: олиготрофные сосново-кустарничково-сфагновые – 0.04–0.91, мезотрофные крупнобугристые – 0.01–0.45, согры – 0.01–0.91 мгC/(м2 ч). Интенсивность выделения метана на этих же болотах значительно меньше интенсивности выделения CO2 [4].
В задачи исследования входило определение интенсивности дыхания олиготрофной торфяной почвы, активности азотфиксации и денитрификации, активности поглощения N2O в процессе денитрификации, скорости окисления CH4 микробным сообществом, а также изучение влияния метана на активность азотфиксации в олиготрофном торфянике.
ОБЪЕКТЫ И МЕТОДЫ
Исследования интенсивности процессов биологической трансформации азота и углерода осуществляли в образцах, отобранных из олиготрофной торфяной почвы (Fibric Histosol) Центрально-лесного государственного природного биосферного заповедника Тверской области Нелидовского района. Отбор образцов производили на территории открытого грядово-мочажинного комплекса болотного массива “Старосельский мох”. Растительный покров типичен для верховых болот этой зоны: окрайки на пологих склонах формируются лесными сообществами Vacinio uliginosi-Pinetum sylvestris, первый ярус которых сформирован относительно высокими (до 20 м) деревьями сосны, а в нижних ярусах преобладают кустарнички. На плоских участках окраины формируются сообщества из Caricetum rostratae с разреженным древостоем сосны, реже березы или вовсе без древостоя.
Исследуемая почва относится к типу торфяные подтипу торфяные олиготрофные (ТО–ТТ), имеет олиготрофно-торфяный горизонт мощностью до 50 см, состоящий преимущественно из сфагновых мхов разной степени разложения. Олиготрофно-торфяный горизонт имеет светлую окраску, низкую (менее 6%) зольность и сильнокислую или кислую реакцию. В течение значительной части вегетационного периода насыщен водой. Торфяной горизонт сменяется органогенной породой, которая представляет собой торфяную толщу. Степень разложения обычно увеличивается с глубиной. Соответственно меняется цвет торфа – от желто-бурого до темно-бурого или коричневого. С глубиной происходит уменьшение биологической активности и изменяется водопроницаемость почвы.
Торфяная олиготрофная почва характеризуется кислой реакцией среды (величина pH 3.2–4.2), низкой зольностью (2.4–6.0% на сухое вещество), очень низкой плотностью твердой фазы (0.03–0.10 г/см3). Твердая фаза в торфяном горизонте составляет 0.14–0.65% объема почвы. Влагоемкость почв достигает 700–1500% влаги на сухое вещество. Емкость поглощения – 80–90 смоль(экв)/кг. Валовое содержание CaO, K2O составляет от сотых до десятых долей процента. Валового азота содержатся довольно много, но из подвижных форм присутствует только аммоний.
При определении активности дыхания образцы (2 г), отобранные с глубины 10–15 см торфяной олиготрофной почвы, помещали в пятикратной повторности в пенициллиновые флаконы объемом 15 мл и инкубировали в термостате при 28°С в течение суток. Активность дыхания почв определяли по скорости накопления CO2 в газовой фазе флаконов [3].
Для измерения актуальной азотфиксации в пенициллиновые флаконы с теми же образцами почвы (2 г) вводили ацетилен 1 см3 и, проинкубировав в тех же условиях, проводили измерения. Для измерения субстрат-индуцированной (потенциальной) азотфиксации в пенициллиновые флаконы добавляли раствор глюкозы из расчета 2.5 мг глюкозы/г почвы.
Для измерения интенсивности поглощения CH4 в пенициллиновые флаконы с образцами почвы (2 г) в трехкратной повторности вводили по 1 см3 CH4. Для измерения интенсивности поглощения N2O в газовую фазу вводили шприцем 0.5 мл N2O в качестве конечного акцептора электронов.
Для измерения субстрат-индуцированной (потенциальной) активности денитрификации в пенициллиновые флаконы с образцами почвы (2 г) вносили раствор глюкозы (2.5 мг/г) и нитрата калия (0.4 мг/г) в пятикратной повторности, затем флаконы герметично закрывали. Условия пониженной концентрации кислорода, необходимые для процесса денитрификации, создавали путем добавления воды до полного погружения исследуемых образцов очеса, с последующим вытеснением воздуха потоком аргона. Инкубацию проводили при 28°С в течение 24 ч. Затем из газовой фазы каждого флакона шприцем отбирали пробы воздуха объемом 0.5 мл. В отобранных газовых пробах измеряли концентрацию N2O на газовом хроматографе с детектором по теплопроводности [8].
Концентрацию CO2 и N2O определяли на хроматографе Московского опытного завода “Хроматограф”, модель 3700/4, с детектором по теплопроводности (катарометром) на колонке с адсорбентом Полисорб-1 из нержавеющей стали внутренним диаметром 2.0 мм и длиной 3.2 м. В качестве газа-носителя служил гелий, поступающий со скоростью 30 мл/мин. Температура детектора составляла 100°С, ток измерительных элементов 148 мА. Температура термостата 30°С, температура камеры впрыска 40°С.
Активность азотфиксации определяли методом ацетилен-редукции [3]. Скорость накопления этилена исследовали на хроматографе Chrom-41 с пламенно-ионизационным детектором. Длина колонки – 2.2 м, наполнитель –Spherosil, температура термостата 30°С, газ-носитель – аргон, расход газа-носителя – 30 мл/мин, водорода – 20 мл/мин, кислорода – 10 мл/мин. Объем анализируемой пробы – 0.5 см3.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Определение активности азотфиксации показало протекание процесса, но с крайне низкой скоростью. Активность азотфиксации не превышала 0.15 нм C2H4/(г сут) (рис. 1).
Рис. 1.
Определение активности актуальной, потенциальной и азотфиксации в присутствии метана в олиготрофной торфяной почве.

Оценка активности азотфиксации после добавления глюкозы свидетельствует о возрастании активности процесса и его зависимости от недостатка легкодоступного органического вещества в олиготрофной торфяной почве. Полученные данные свидетельствуют о высоком потенциале азотфиксации, подавленной отсутствием энергетического источника для деятельности диазотрофных бактерий.
В олиготрофных болотах в качестве доступного углерода азотфиксирующие бактерии могут использовать метан. Оценка нитрогеназной активности в присутствии метана показала рост нитрогеназной активности до 3.6 нмоль C2H4/(г сут), что связано с присутствием метанотрофных бактерий, формирующих метановый фильтр [14]. По мнению Клевенской [5], процесс азотфиксации в данном случае обеспечивается именно этими микроорганизмами, использующими большие запасы метана, которые образуются в процессе метаногенеза в торфяной залежи.
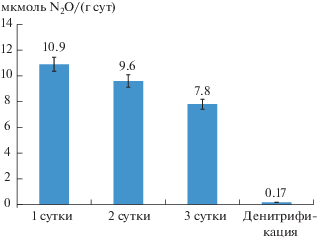
Определение активности денитрификации по интенсивности эмиссии N2O показало протекание процесса на низком уровне (в среднем 0.17 мкмоль N2O/(г сут)) (рис. 2). Это объясняется тем, что активность денитрифицирующих бактерий определяется не столько концентрацией нитратов, которые всегда в определенном количестве присутствуют в почве, а, прежде всего, лимитируется наличием легкодоступного энергетического материала (например, в виде корневых выделений) [9]. С другой стороны, введение в газовую фазу N2O сопровождалось ее быстрым исчерпанием. В отобранных образцах поглощение N2O составило от 10.9 до 7.8 мкмоль N2O/(г сут) в зависимости от срока измерения. Это позволяет предположить интенсивное поглощение N2O олиготрофными болотами и рассматривать эти экосистемы как природный сток для N2O в окружающей среде.
Рис. 2.
Посуточное поглощение N2O и определение активности денитрификации в олиготрофной торфяной почве.
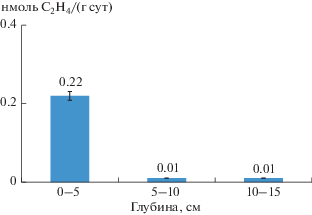
Определение активности азотфиксации также свидетельствует о снижении нитрогеназной активности с глубиной (рис. 3), что может указывать на значимую роль фототрофных диазатрофов (цианобактерий) в верховом олиготрофном болоте, при этом активность после добавлении глюкозы резко возрастала, особенно в образцах из более глубоких горизонтов сфагнума, что подтверждает выдвинутую нами гипотезу о вкладе фототрофных диазатрофов в процесс азотфиксации в верхних горизонтах олиготрофного болота.
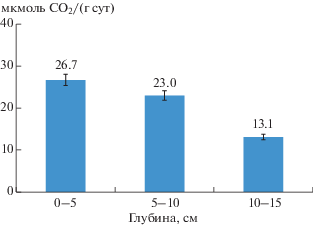
Определение интенсивности выделения углекислого газа из образцов, взятых с глубины (0, 5–10 и 15–20 см), показало, что дыхание олиготрофной торфяной почвы в зависимости от глубины отбора проб заметно уменьшалось от 26.7 на поверхности до 13.1 мкмоль СO2/(г сут)на глубине 15 см (рис. 4).
ЗАКЛЮЧЕНИЕ
Активность азотфиксации протекает в олиготрофной торфяной почве с низкой скоростью (не превышает 0.15 нмоль C2H4/(г сут)). Добавление глюкозы значительно стимулирует активность процесса, что свидетельствует о высоком потенциале азотфиксации, подавленной отсутствием энергетического источника для деятельности диазотрофных бактерий.
Обнаружена высокая интенсивность окисления метана в олиготрофной торфяной почве. Сделано предположение о том, что метан в этих условиях может быть использован диазотрофными бактериями в качестве энергетического источника. Определение активности азотфиксации олиготрофной торфяной почвы в присутствии метана показало резкий рост нитрогеназной активности. Важно отметить, что в присутствии метана нитрогеназная активность была больше, даже по сравнению с вариантом с глюкозой.
Установлено преимущественное поглощение закиси азота верхним горизонтом олиготрофного торфяника, что позволяет рассматривать эти экосистемы как природный сток для N2O.
Список литературы
Гришакина И.Е., Трофимов С.Я., Степанов А.Л., Дорофеева Е.И. Микробная трансформация соединений азота в почвах южной тайги // Почвоведение. 2006. № 11. С. 1369–1374.
Добровольская Т.Г., Головченко А.В., Звягинцев Д.Г. Анализ экологических факторов, ограничивающих деструкцию верхового торфа // Почвоведение. 2014. № 3. С. 304. https://doi.org/10.7868/S0032180X14030046
Звягинцев Д.Г. Методы почвенной микробиологии и биохимии. М.: Изд-во Моск. ун-та, 1991. С. 386.
Инишева Л.И., Головацкая Е.А. Элементы углеродного баланса олиготрофных болот // Экология. 2002. № 4. С. 261–266.
Клевенская И.Л. Влияние экологических факторов на активность азотфиксации // Биологическая фиксация азота. Новосибирск: Наука, Сиб. отд-ние, 1991. С. 251–263.
Меняйло О.В., Матвиенко А.И., Макаров М.И., Ченг Ш.-К. Роль азота в регуляции цикла углерода в лесных экосистемах // Лесоведение. 2018. № 2. С. 143–159.
Порохина Е.В., Сергеева М.А., Голубина О.А. Химический состав и биологическая активность торфяной залежи олиготрофного болота // Самарский научный вестник. 2018. С. 82–87.
Степанов А.Л., Лысак Л.В. Методы газовой хроматографии в почвенной микробиологии. М.: МАКС-Пресс, 2002. С. 88.
Умаров М.М., Кураков А.В., Степанов А.Л. Микробиологическая трансформация азота в почве. М.: ГЕОС, 2007.138 с.
Aerts R., Verhoeven J.T.A., Whigham D.F. Plant-mediated controls on nutrient cycling in temperate fens and bogs // Ecology. 1999. V. 80. № 7. P. 2170–2181.
Bowden W.B. The biogeochemistry of nitrogen in freshwater wetlands // Biogeochemistry. 1987. V. 4. P. 313–348.
Chapman R.R., Hemond H.F. Dinitrogen fixation by surface peat and Spagnum in an ombrotrophic bog // Can. J. Bot. 1982. V. 60. P. 538–543.
Dedysh S.N., Knief C., Dunfield P.F. Methylocella species are facultatively methanotrophic // J. Bacteriol. 2005. V. 187. P. 4665–4670.
Menyailo O.V., Hungate B.A., Abraham W.-R., Conrad R. Changing land use reduces soil CH4 uptake by altering biomass and activity but not composition of high-affinity methanotrophs // Global Change Biology. 2008. V. 14. P. 2405–2419.
Palmer K., Drake H.L., Horn M.A. Association of Novel and Highly Diverse acid-tolerant denitrifiers with N2O fluxes of an acid fen // Appl. Environ. Microbiol. 2010. V. 76. № 4. P. 1125–1134.
Sullivan B.W., Selmants P.C., Hart S.C. Does dissolved organic carbon regulate biological methane oxidation in semiarid soils? // Glob. Change Biol. 2013. V. 19. P. 2149–2157. https://doi.org/10.1111/gcb.12201
Waughman G.J., Bellamy D.J. Nitrogen Fixation and the Nitrogen Balance in Peatland Ecosystems // Ecology. 1980. V. 61. P. 1185–1198.
Yavitt J.B., Lang G.E., Sexstone A.J. Methane fluxes in wetland and forest soils, beaver ponds, and low-order streams of a temperate forest ecosystem // J. Geophysical Res. 1990. V. 95. № 22. P. 463–474.
Дополнительные материалы отсутствуют.