Почвоведение, 2019, № 10, стр. 1185-1197
Изотопный состав азота в почвах и растениях горно-тундровых экосистем Хибин
М. И. Макаров a, *, И. С. Бузин a, А. В. Тиунов b, Т. И. Малышева a, М. С. Кадулин a, Н. Е. Королева c
a МГУ им. М.В. Ломоносова
199991 Москва, Ленинские горы, 1, Россия
b Институт проблем экологии и эволюции им. А.Н. Северцова РАН
117071 Москва, Ленинский пр-т, 33, Россия
c Полярно-альпийский ботанический сад-институт им. Н.А. Аврорина
184209 Апатиты, Мурманской обл., а/я 159, Россия
* E-mail: mmakarov@soil.msu.ru
Поступила в редакцию 22.01.2019
После доработки 02.03.2019
Принята к публикации 03.04.2019
Аннотация
Изотопный состав азота в почвах и растениях может служить индикатором процессов трансформации азотсодержащих соединений и источников азотного питания растений. Величина δ15N определена в почве (общий, аммонийный и нитратный азот), листьях и корнях растений четырех биогеоценозов горной тундры Хибин. Изученные почвы (Folic Leptic Entic Podzol and Leptosols) различаются по доступности азота, а растения представлены видами, образующими микоризу разных типов (экто-, эрикоидную, арбускулярную), а также видами, обычно не образующими микоризу. Диапазон варьирования δ15N в минеральных соединениях почвы составляет от –16.2‰ в нитратах до +6.4‰ в аммонии, демонстрируя взаимосвязь между активностями N-минерализации и нитрификации и изотопным составом аммонийного азота, а также потенциально сильное влияние на формирование изотопного состава азота в растениях. Величина δ15N в листьях и корнях растений изменяется в более узком диапазоне (от –7.3 до +2.4‰), что может быть связано с поглощением азота из разных источников и с фракционированием изотопов в процессе питания. Для большинства изученных видов характерно обогащение корней изотопом 15N по сравнению с листьями, что соответствует представлению об участии микоризы в азотном питании растений. Вне зависимости от типа микоризного симбиоза, разница в δ15N корней и листьев у большинства видов растений уменьшается при увеличении доступности азота в почвах.
ВВЕДЕНИЕ
Доступность азота является важным фактором, определяющим продуктивность наземных экосистем и регулирующим структуру фитоценозов [8]. Изотопный состав N в почвах и растениях рассматривается в качестве показателя, с помощью которого можно характеризовать активности процессов азотного цикла [5], глобальные тренды его изменения [11], а также особенности азотного питания растений (преимущественные формы поглощаемых соединений, роль микоризного симбиоза) [3, 4, 9].
Большинство растений имеют механизмы адаптации, помогающие им успешно функционировать при низкой доступности азота. Одним из самых распространенных механизмов является формирование микоризного симбиоза [7]. Грибы, образующие эктомикоризу (ЭКМ) и эрикоидную микоризу (ЭРМ), способны улучшать азотное питание растений в условиях низкой обеспеченности минеральными формами элемента, выделяя в почву окислительные и гидролитические ферменты, которые деполимеризуют крупные органические молекулы и обеспечивают растениям доступ к N, минуя стадию минерализации [27]. Считается, что более легкий изотопный состав N в листьях растений с ЭКМ и ЭРМ по сравнению с растениями, образующими арбускулярную микоризу (АРМ) или лишенными микоризы, является следствием преимущественной аккумуляции тяжелого изотопа 15N в мицелии и передачи 14N от гриба к растению-хозяину и отражает, таким образом, участие микоризных грибов в азотном питании растений [22, 23]. Грибы, образующие АРМ, не обладают или обладают очень ограниченной способностью выделять гидролитические ферменты, разлагающие высокомолекулярные органические соединения [26]. Поэтому роль этого типа микоризы в азотном питании растений считается несущественной, что подтверждается слабым эффектом АРМ на изотопный состав N растений [12, 13]. В то же время появляются исследования, демонстрирующие, что растения с АРМ могут иметь такие же низкие значения δ15N в листьях, как и растения с ЭКМ и ЭРМ [29, 33]. Такой результат может объясняться предпочтительным поглощением растениями с АРМ неорганических соединений азота, обедненных тяжелым изотопом [9], хотя не исключается и фракционирование изотопов между АРМ грибами и растениями-хозяевами так же, как это характерно для растений с ЭКМ и ЭРМ [23, 29].
Определение изотопного состава N в микоризном мицелии затруднено, но косвенное представление о фракционировании изотопов N между грибами и растением-хозяином можно получить на основании сравнительного анализа листьев и корней растений, поскольку до 20% объема или массы тонких корней может быть представлено мицелием микоризных грибов [2, 21]. Такая возможность используется не в полной мере, так как в корнях растений изотопный состав N определяют намного реже, чем в надземных органах.
Поэтому мы поставили своей целью изучить изотопный состав N в почвах, корнях и листьях растений с разными типами микоризы в четырех горно-тундровых биогеоценозах Хибин, которые отличаются по обеспеченности лабильными соединениями N. На этой основе предполагается оценить закономерности формирования изотопного состава азота в почве, возможность определения преимущественных источников азотного питания у разных видов растений в разных биогеоценозах и роль микоризы разного типа во фракционировании изотопов азота.
ОБЪЕКТЫ И МЕТОДЫ
Изучен изотопный состав N в почвах, тонких корнях (<1 мм) и листьях 12 видов сосудистых растений разных горно-тундровых экосистем Хибин на территории Полярно-альпийского ботанического сада-института им. Н.А. Аврорина (Мурманская область). Четыре экосистемы располагались в пределах геоморфологического профиля: расстояние между крайними элементами профиля не превышало 100 м, а относительное превышение – 10 м.
Кустарничково-лишайниковая пустошь (КЛП) занимает наиболее автоморфную позицию в ландшафте. Здесь преобладают лишайники Flavocetraria nivalis, F. cucullata, Cetraria islandica, Alectoria ochroleuca, а из сосудистых растений представлены преимущественно кустарнички Empetrum nigrum, Vaccinium vitis-idaea, V. uliginosum, кустарник Betula nana, единично представлены граминоиды Carex bigelowii и Juncus trifidus и полупаразит Bartsia alpina.
Кустарниковая пустошь (КП) расположена ниже по склону в автоморфно-транзитных условиях. Кустарниковый ярус образован Betula nana, а в травяно-кустарничковом ярусе преобладают E. nigrum, V. myrtillus. Граминоиды (Nardus stricta, J. trifidus) встречаются чаще, чем в КЛП; также присутствуют отдельные особи разнотравья – Solidago virgaurea. В мохово-лишайниковом ярусе представлены Polytrichum juniperinum, C. islandica, Cladonia arbuscula.
Злаковый луг (ЗЛ) располагается на выположенной нижней части склона в транзитно-аккумулятивных позициях. Здесь преобладают злаки Deschampsia flexuosa, N. stricta, J. trifidus, из разнотравья обычны Gnaphalium norvegicum и S. virgaurea. Мхи представлены Racomitrium microcarpon, лишайники – C. islandica, Cetrariella delisei, Stereocaulon alpinum. Отдельными куртинами встречаются кустарнички и B. nana.
На дне и берегах временного водоема, образующегося после снеготаяния в локальной зоне геохимической аккумуляции, расположен осоковый луг (ОЛ). Здесь преобладают C. bigelowii, D. flexuosa, J. trifidus. Мохово-лишайниковый покров не развит.
Почвы представлены сухоторфяно-подбуром иллювиально-гумусовым (Folic Leptic Entic Podzol (Siltic)) в КЛП, сухоторфяно-литоземом перегнойно-грубогумусовым (Folic Leptosol) в КП и литоземами перегнойно-темногумусовыми (Eutric Leptosols) в луговых экосистемах. Они различаются по содержанию экстрагируемых неорганических и органических соединений N, концентрации которых возрастают в 36–62 и 3–8 раз соответственно при переходе от почв пустошей к почвам лугов (табл. 1). В почвах КЛП и КП экстрагируемый N представлен в основном органическими соединениями, концентрация аммонийного азота (N–${\text{NH}}_{4}^{ + }$) невелика, а азот нитратов (N–${\text{NO}}_{3}^{ - }$) содержится в следовых количествах. Почвы луговых экосистем характеризуются преобладанием N неорганических соединений [1].
Таблица 1.
Содержание углерода и азота в горно-тундровых почвах, среднее ± стандартное отклонение [1]
| Сооб-щество | Гори-зонт | Cобщ | Nобщ | $\frac{{{{{\text{C}}}_{{{\text{общ}}}}}}}{{{{{\text{N}}}_{{{\text{общ}}}}}}}$ | Cорг | Nорг | $\frac{{{{{\text{C}}}_{{{\text{орг}}}}}}}{{{{{\text{N}}}_{{{\text{орг}}}}}}}$ | N–${\text{NH}}_{4}^{ + }$ | N–${\text{NO}}_{3}^{ - }$ |
|---|---|---|---|---|---|---|---|---|---|
| % | мг/кг | мг/кг | |||||||
| КЛП | TJ | 23.6 ± 5.2а | 1.12 ± 0.20ав | 21.0 ± 1.1а | 166 ± 41а | 9.7 ± 1.2а | 17.0 ± 2.5абв | 1.81 ± 0.98а | 0.121 ± 0.003а |
| Bh | 10.8 ± 4.3б | 0.50 ± 0.16б | 20.8 ± 3.4а | 101 ± 21б | 7.9 ± 1.6а | 12.9 ± 2.2а | 1.62 ± 0.96а | 0.112 ± 0.003б | |
| КП | TJ | 32.2 ± 2.2в | 1.23 ± 0.04а | 26.3 ± 2.0б | 466 ± 106в | 25.5 ± 5.1б | 18.3 ± 1.4бв | 2.37 ± 3.27а | 0.221 ± 0.004в |
| AOh | 9.3 ± 2.2б | 0.43 ± 0.08б | 21.2 ± 1.2а | 124 ± 19аб | 8.4 ± 1.3а | 14.9 ± 1.8ав | 1.88 ± 0.71а | 0.112 ± 0.003б | |
| ЗЛ | О | 40.7 ± 2.6г | 1.38 ± 0.19аг | 29.8 ± 3.8б | 1402 ± 333г | 73.5 ± 19.1в | 19.0 ± 3.1вг | 86.2 ± 16.3б | 0.96 ± 0.77г |
| АH | 14.6 ± 4.6б | 0.91 ± 0.26вд | 15.9 ± 0.7в | 248 ± 40д | 16.4 ± 3.2г | 15.2 ± 0.9аг | 13.7 ± 3.8в | 2.72 ± 1.01д | |
| ОЛ | О | 36.0 ± 1.5д | 1.72 ± 0.21г | 21.1 ± 1.9а | 1290 ± 303г | 77.5 ± 33.2в | 15.1 ± 4.5абвг | 113 ± 40б | 4.64 ± 2.94д |
| АH | 11.0 ± 0.7б | 0.79 ± 0.04д | 14.0 ± 0.2в | 461 ± 41в | 30.1 ± 3.2б | 15.4 ± 0.6аг | 7.7 ± 1.0г | 1.93 ± 0.43г | |
Примечание. Здесь и в табл. 2 одинаковые буквенные индексы в пределах каждого столбца указывают на отсутствие статистически значимых различий, Р < 0.05.
Изотопный состав азота (общего (δ15Nобщ), аммонийного (δ15N–${\text{NH}}_{4}^{ + }$) и нитратного (δ15N–${\text{NO}}_{3}^{ - }$)) определяли в образцах поверхностных органических и верхних минеральных горизонтов почв. Образцы отбирали в каждом биогеоценозе на участке 5 × 5 м случайным образом в пяти повторностях. Они представляли собой средний образец почвенного горизонта, не позволяющий охарактеризовать почву в ризосфере индивидуальных видов растений, что является чрезвычайно сложной задачей, особенно при изучении полидоминантных фитоценозов луговых экосистем. В почвах пустошей δ15N–${\text{NO}}_{3}^{ - }$ не определяли из-за очень низкой концентрация этой формы азота. Для определения изотопного состава неорганических соединений использовали экстракты 0.05 М K2SO4 [1], которые концентрировали методом диффузии аммиака [24, 40]. Детали метода подготовки образцов для изотопного анализа описаны в ранее опубликованных работах [5, 6].
При выборе растений для анализа ориентировались на виды, образующие разные типы микоризы и, по возможности, встречающиеся одновременно в нескольких биогеоценозах. Листья собирали с пяти отдельных экземпляров растений в пределах тех же участков, где отбирали образцы почв. Корни также отбирали в пяти повторностях, отмывая их из почвенных монолитов, содержащих изучаемые виды растений. Листья и корни высушивали и измельчали на вибрационной мельнице Retsch MM 200 до состояния пудры.
Содержание и δ15Nобщ в почвах и растениях определяли на элементном анализаторе Carlo Erba NC 2500 с масс-спектрометром Deltaplus в центре коллективного пользования оборудованием Института проблем экологии и эволюции им. А.Н. Северцова РАН. Величины δ15N–${\text{NH}}_{4}^{ + }$ и δ15N–${\text{NO}}_{3}^{ - }$ определяли в Центре исследований и анализа стабильных изотопов Геттингенского университета.
Полученные результаты подвергали однофакторному дисперсионному анализу с последующим определением НЗР с помощью теста Тьюки в пакете Statistica. Для установления взаимосвязей между разными параметрами проводили корреляционный анализ.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Изотопный состав азота в почвах. Величина δ15N существенно различается между разными формами N и в пределах одной формы между разными горизонтами и почвами (табл. 2). Так, δ15Nобщ в органических горизонтах значимо меньше, чем в минеральных, что является общей закономерностью для всех почв и связано с легким изотопным составом азота растительного опада и его утяжелением в процессе гумификации [25]. Однако то, что δ15Nобщ в органических горизонтах почв пустошей больше, чем в почвах лугов, не поддается объяснению, так как более высокая активность процессов трансформации азотсодержащих соединений в почвах лугов [1] и более легкий изотопный состав азота растений пустошей (см. ниже) должны способствовать формированию обратной закономерности. В верхних минеральных горизонтах всех почв δ15Nобщ значимо не различается.
Таблица 2.
Изотопный состав разных форм азота в горно-тундровых почвах, ‰, среднее ± стандартное отклонение
| Сообщество | Горизонт | δ15Nобщ | δ15N–${\text{NH}}_{4}^{ + }$ | δ15N–${\text{NO}}_{3}^{ - }$ |
|---|---|---|---|---|
| КЛП | TJ | 2.4 ± 1.4а | –5.1 ± 4.5аб | Не опр. |
| Bh | 4.6 ± 0.8б | –1.5 ± 2.9а | » | |
| КП | TJ | –0.3 ± 0.8в | –7.0 ± 2.5б | » |
| AOh | 5.4 ± 0.3б | 0.4 ± 3.9а | » | |
| ЗЛ | О | –2.1 ± 0.9г | 0.1 ± 2.3а | –13.9 ± 3.9а |
| АH | 5.3 ± 0.5б | 6.4 ± 1.8в | –14.0 ± 1.4а | |
| ОЛ | О | –1.7 ± 0.7г | 0.9 ± 2.0а | –16.2 ± 5.2а |
| АH | 5.2 ± 0.1б | 6.0 ± 1.5в | –11.4 ± 1.7а |
Величина δ15N–${\text{NH}}_{4}^{ + }$ заметно изменяется в разных горизонтах и почвах. Она значимо меньше в органических горизонтах по сравнению с минеральными, а также меньше в почвах пустошей в сравнении с почвами лугов. Профильное изменение δ15N лабильных соединений азота до сих пор является малоизученным. Полученный результат соответствует предположению, что величина δ15N неорганических соединений должна увеличиваться с глубиной в почвенном профиле аналогично изменению δ15Nобщ, так как Nобщ является источником N–${\text{NH}}_{4}^{ + }$ [32]. Однако для альпийских и тундровых почв ранее была установлена обратная закономерность профильного изменения δ15N–${\text{NH}}_{4}^{ + },$ предположительно связанная с большей активностью нитрификации вблизи поверхности почвы [28].
Меньшие значения δ15N–${\text{NH}}_{4}^{ + }$ в почвах пустошей хорошо соответствуют представлению о контролировании изотопного состава N–${\text{NH}}_{4}^{ + }$ процессом нитрификации [25], активность которого в десятки раз выше в почвах лугов [1]. Кроме того, в почвах пустошей δ15N–${\text{NH}}_{4}^{ + }$ значительно меньше, чем δ15Nобщ как в органических, так и в минеральных горизонтах, что в целом характерно для почв с невысокой активностью нитрификации [5, 18, 31]. В почвах лугов величина δ15N–${\text{NH}}_{4}^{ + }$ возрастает вследствие активной нитрификации N–${\text{NH}}_{4}^{ + }$ и значимо не отличается от δ15Nобщ.
Величина δ15N–${\text{NO}}_{3}^{ - }$ характеризуется выраженными отрицательными значениями и значимо не различается в двух горизонтах и в почвах разных луговых биогеоценозов. Это свидетельствует об одинаково низкой активности денитрификации, контролирующей изотопный состав N–${\text{NO}}_{3}^{ - }$ [16], в разных горизонтах и почвах.
Содержание азота в листьях растений. Концентрация N в растениях сильно варьирует. Среди видов растений КЛП минимальное содержание N в листьях составляет 0.83% у V. vitis-idaea. Другие виды рода Vaccinium содержат гораздо больше N (около 1.9%). Травянистые растения, образующие АРМ (J. trifidus и B. alpina), содержат около 1.7% N, а максимальная концентрация элемента (2.29%) отмечена в листьях C. bigelowii (табл. 3). Хотя микориза в тундровых экосистемах улучшает азотное питание растений [20], максимальная концентрация N в листьях безмикоризной (БМ) C. bigelowii может быть связана с прямым (без участия микоризы) поглощением из почвы аминокислот, возможность которого неоднократно демонстрировалась ранее на примере растений семейства осоковых (Cyperaceae) [35, 36].
Таблица 3.
Концентрация азота в листьях (над чертой) и корнях (под чертой) растений горно-тундровых экосистем, %, среднее ± стандартное отклонение
| Вид (микориза) |
КЛП | КП | ЗЛ | ОЛ |
|---|---|---|---|---|
| Betula nana (ЭКМ) |
$\frac{{2.03 \pm {{{0.09}}^{{\text{a}}}}}}{{0.77 \pm {{{0.06}}^{{\text{a}}}}}}$ | $\frac{{2.37 \pm {{{0.13}}^{{\text{б}}}}}}{{0.71 \pm {{{0.04}}^{{\text{a}}}}}}$ | $\frac{{3.60 \pm {{{0.24}}^{{\text{в}}}}}}{{0.72 \pm {{{0.08}}^{{\text{a}}}}}}$ | $\frac{ - }{ - }$ |
| Empetrum nigrum (ЭРМ) |
$\frac{{1.20 \pm {{{0.05}}^{{\text{a}}}}}}{{0.53 \pm {{{0.03}}^{{\text{a}}}}}}$ | $\frac{{1.67 \pm {{{0.25}}^{{\text{б}}}}}}{{0.62 \pm {{{0.04}}^{{\text{б}}}}}}$ | $\frac{{1.54 \pm {{{0.07}}^{{\text{б}}}}}}{{0.67 \pm {{{0.14}}^{{\text{б}}}}}}$ | $\frac{ - }{ - }$ |
| Vaccinium vitis-idaea (ЭРМ) |
$\frac{{0.83 \pm {{{0.11}}^{{\text{a}}}}}}{{0.73 \pm {{{0.08}}^{{\text{a}}}}}}$ | $\frac{{1.37 \pm {{{0.13}}^{{\text{б}}}}}}{{1.04 \pm {{{0.02}}^{{\text{б}}}}}}$ | $\frac{{1.10 \pm {{{0.09}}^{{\text{в}}}}}}{{0.67 \pm {{{0.06}}^{{\text{а}}}}}}$ | $\frac{ - }{ - }$ |
| Vaccinium myrtillus (ЭРМ) |
$\frac{{1.86 \pm {{{0.06}}^{{\text{a}}}}}}{{0.82 \pm {{{0.11}}^{{\text{a}}}}}}$ | $\frac{{1.82 \pm {{{0.11}}^{{\text{a}}}}}}{{0.64 \pm {{{0.07}}^{{\text{б}}}}}}$ | $\frac{{2.47 \pm {{{0.12}}^{{\text{б}}}}}}{{0.89 \pm {{{0.05}}^{{\text{a}}}}}}$ | $\frac{ - }{ - }$ |
| Vaccinium uliginosum (ЭРМ) |
$\frac{{1.93 \pm {{{0.01}}^{{\text{a}}}}}}{{0.79 \pm {{{0.06}}^{{\text{a}}}}}}$ | $\frac{{2.11 \pm {{{0.23}}^{{\text{a}}}}}}{{1.05 \pm {{{0.07}}^{{\text{б}}}}}}$ | $\frac{{2.76 \pm {{{0.34}}^{{\text{б}}}}}}{{1.11 \pm {{{0.03}}^{{\text{б}}}}}}$ | $\frac{ - }{ - }$ |
| Bartsia alpina (АРМ) |
$\frac{{1.69 \pm {{{0.16}}^{{\text{a}}}}}}{{0.95 \pm {{{0.09}}^{{\text{a}}}}}}$ | $\frac{{2.30 \pm {{{0.16}}^{{\text{б}}}}}}{{1.39 \pm {{{0.38}}^{{\text{a}}}}}}$ | $\frac{{1.96 \pm {{{0.21}}^{{{\text{aб}}}}}}}{{1.23 \pm {{{0.09}}^{{\text{a}}}}}}$ | $\frac{ - }{ - }$ |
| Juncus trifidus (АРМ) |
$\frac{{1.69 \pm {{{0.03}}^{{\text{a}}}}}}{{0.45 \pm {{{0.05}}^{{{\text{аб}}}}}}}$ | $\frac{{1.81 \pm {{{0.10}}^{{\text{a}}}}}}{{0.46 \pm {{{0.04}}^{{{\text{аб}}}}}}}$ | $\frac{{2.36 \pm {{{0.13}}^{{\text{б}}}}}}{{0.42 \pm {{{0.04}}^{{\text{a}}}}}}$ | $\frac{{2.16 \pm {{{0.11}}^{{\text{б}}}}}}{{0.49 \pm {{{0.02}}^{{\text{б}}}}}}$ |
| Nardus stricta (АРМ) |
$\frac{ - }{ - }$ | $\frac{{1.57 \pm {{{0.03}}^{{\text{a}}}}}}{{0.48 \pm {{{0.04}}^{{\text{a}}}}}}$ | $\frac{{1.79 \pm {{{0.17}}^{{\text{б}}}}}}{{0.57 \pm {{{0.06}}^{{\text{a}}}}}}$ | $\frac{{2.38 \pm {{{0.05}}^{{\text{в}}}}}}{{0.74 \pm {{{0.03}}^{{\text{б}}}}}}$ |
| Deschampsia flexuosa (АРМ) |
$\frac{ - }{ - }$ | $\frac{{1.50 \pm {{{0.08}}^{{\text{a}}}}}}{{0.29 \pm {{{0.02}}^{{\text{a}}}}}}$ | $\frac{{1.34 \pm {{{0.20}}^{{\text{a}}}}}}{{0.32 \pm {{{0.02}}^{{\text{a}}}}}}$ | $\frac{{2.48 \pm {{{0.22}}^{{\text{б}}}}}}{{0.62 \pm {{{0.20}}^{{\text{б}}}}}}$ |
| Solidago virgaurea (АРМ) |
$\frac{ - }{ - }$ | $\frac{{2.49 \pm {{{0.21}}^{{\text{a}}}}}}{{0.64 \pm {{{0.07}}^{{\text{a}}}}}}$ | $\frac{{3.28 \pm {{{0.19}}^{{\text{б}}}}}}{{0.81 \pm {{{0.08}}^{{\text{б}}}}}}$ | $\frac{{4.28 \pm {{{0.85}}^{{\text{в}}}}}}{{1.34 \pm {{{0.14}}^{{\text{в}}}}}}$ |
| Gnaphalium norvegicum (АРМ) |
$\frac{ - }{ - }$ | $\frac{{1.97 \pm {{{0.10}}^{{\text{a}}}}}}{{0.61 \pm {{{0.11}}^{{\text{a}}}}}}$ | $\frac{{2.26 \pm {{{0.20}}^{{\text{б}}}}}}{{0.55 \pm {{{0.11}}^{{\text{a}}}}}}$ | $\frac{{3.09 \pm {{{0.16}}^{{\text{в}}}}}}{{0.94 \pm {{{0.12}}^{{\text{б}}}}}}$ |
| Carex bigelowii (БМ) |
$\frac{{2.29 \pm {{{0.12}}^{{\text{a}}}}}}{{0.44 \pm {{{0.08}}^{{\text{a}}}}}}$ | $\frac{ - }{ - }$ | $\frac{{3.12 \pm {{{0.19}}^{{\text{б}}}}}}{{0.53 \pm {{{0.04}}^{{\text{a}}}}}}$ | $\frac{{3.35 \pm {{{0.18}}^{{\text{б}}}}}}{{0.66 \pm {{{0.07}}^{{\text{б}}}}}}$ |
Примечание. Здесь и в табл. 4 одинаковые буквенные индексы в пределах строки указывают на отсутствие статистически значимого различия, Р < 0.05.
Среди растений КП минимальная концентрация N в листьях также характерна для V. vitis-idaea (1.37%), а максимальная (2.49%) отмечена у S. virgaurea. Для большинства изученных видов (пять из семи), присутствующих одновременно в сообществах КЛП и КП, наблюдается значимо более высокая концентрация N в листьях при произрастании в сообществе КП. Средние концентрации N в листьях семи общих видов составили 1.60 ± 0.43% для КЛП и 1.92 ± 0.36% для КП.
В фитоценозе ЗЛ минимальная концентрация N отмечена также в листьях V. vitis-idaea (1.10%), а максимальная в листьях B. nana (3.60%). Семь из одинадцати общих для КП и ЗЛ видов и семь из восьми видов общих для КЛП и ЗЛ имеют значимо большее содержание N в листьях при произрастании в луговом сообществе. При этом повышение концентрации N характерно для видов со всеми типами микоризы. Средние для сообщества концентрации N в листьях всех общих видов составили 1.91 ± 0.37% для КП и 2.30 ± 0.79% для ЗЛ.
Практически все изученные виды растений ОЛ (за исключением J. trifidus) имели наибольшую концентрацию N в листьях. Среднее значение составило 2.96 ± 0.79%.
Таким образом, для большинства изученных видов растений вне зависимости от типа микоризного симбиоза характерно повышение концентрации N в листьях при переходе от КЛП к КП и далее к луговым биогеоценозам в соответствии с ростом концентраций лабильных форм элемента в почве.
Содержание азота в корнях растений. В корнях растений содержится значительно меньше N по сравнению с листьями. Среди растений КЛП этот показатель варьирует от 0.44 до 0.95%. Оба значения характерны для травянистых растений: минимальная концентрация получена для C. bigelowii, листья которой содержат наибольшее количество N, а максимальная – для B. alpina. Таким образом, для растений, содержащих наименьшее и наибольшее количество N в листьях (V. vitisidaea и B. nana соответственно), не проявляется такая же закономерность для корней. Кроме того, если у разных видов растений с ЭКМ и ЭРМ концентрация N в листьях сильно варьирует, то в корнях она близка для большинства видов (0.73–0.82%) и только в корнях E. nigrum снижается до 0.53%.
У растений КП содержание N в корнях составило от 0.29 у D. flexuosa до 1.39 у B. alpina, то есть виды с одним типом микоризы (АРМ) резко отличаются по содержанию N в корнях. Среди видов растений с ЭКМ и ЭРМ также есть представители как с относительно небольшим содержанием N (0.62–0.71% у B. nana, E. nigrum, V. myrtillus), так и с более высоким (около 1.0% у V. vitis-idaea и V. uliginosum). В этом сообществе виды, содержащие минимальное и максимальное количество N в листьях и корнях, также не совпадают. Для большинства видов с ЭРМ, присутствующих одновременно в сообществах КЛП и КП, наблюдается статистически значимое повышение концентрации N в корнях при произрастании в сообществе КП. При этом виды, у которых возрастала или не менялась концентрация N в листьях, не обязательно демонстрируют ту же закономерность для корней. Средние концентрации N в корнях семи общих видов составили 0.72 ± 0.17% для растений КЛП и 0.84 ± 0.33% у растений КП.
В корнях растений ЗЛ минимальная (0.32%) и максимальная (1.23%) концентрации N отмечены у тех же видов, что и в сообществе КП (D. flexuosa и B. alpina соответственно). При переходе к луговому сообществу, несмотря на резкое увеличение концентраций лабильных форм N в почве и рост концентрации N в листьях большинства видов растений, концентрация элемента в корнях повышается только у одного вида с АРМ (S. virgaurea). Средние концентрации N в корнях 11 общих видов КП и ЗЛ составили 0.72 ± 0.32 и 0.72 ± 0.27% соответственно.
Среди растений ОЛ минимальная концентрация N в корнях характерна для J. trifidus (0.49%), а максимальная – для S. virgaurea (1.34%). Если при переходе от КП к ЗЛ концентрация N в корнях не возрастает у абсолютного большинства видов растений с разными типами микоризы, то при переходе от ЗЛ к ОЛ она повышается у всех видов за исключением J. trifidus. Средние концентрации N в корнях 6 общих видов ЗЛ и ОЛ составили 0.53 ± 0.17 и 0.80 ± 0.30% соответственно. При этом изменение концентраций лабильных форм N в почве при переходе от ЗЛ к ОЛ не столь значительно, как при переходе от пустошей к лугам.
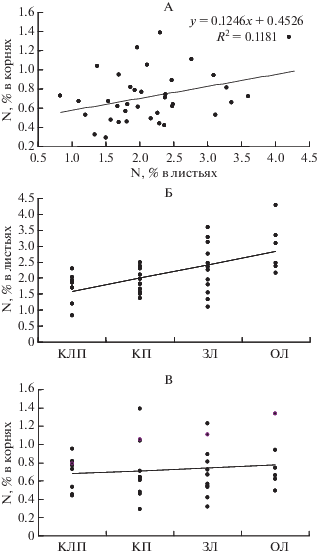
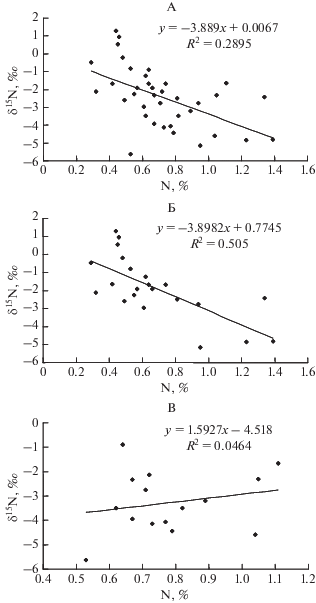
Таким образом, высокая или низкая концентрация N в листьях конкретных видов растений не означает, что их корни также содержат соответственно много или мало элемента. Тем не менее, для всей совокупности изученных видов при их произрастании в разных условиях обеспеченности азотом обнаруживается значимая связь между содержанием N в листьях и корнях (r = 0.34, P < 0.05, рис. 1, А). В корнях растений в гораздо меньшей степени, чем в листьях прослеживается связь между концентрацией N и произрастанием в условиях разной обогащенности почвы его лабильными формами (рис. 1, Б, 1, В).
Рис. 1.
Взаимосвязь между содержанием азота в листьях и корнях растений (А), и содержание азота в листьях (Б) и корнях (В) при произрастании в условиях разной обогащенности почвы его лабильными соединениями.
Изотопный состав азота в листьях растений. Величина δ15N в листьях растений в пределах каждого сообщества, а также у одного вида в разных сообществах заметно различается (табл. 4). Это может быть связано с преимущественным использованием разными видами разных источников азота, с использованием одним видом разных источников при произрастании в разных условиях (биогеоценозах) и с разным фракционированием изотопов при поглощении и ассимиляции N разными видами и одним видом в разных условиях.
Таблица 4.
Изотопный состав азота в листьях и корнях растений горно-тундровых экосистем δ15N, ‰, среднее ± стандартное отклонение
| Вид (микориза) |
Часть растения | КЛП | КП | ЗЛ | ОЛ |
|---|---|---|---|---|---|
| Betula nana (ЭКМ) |
Листья | –6.28 ± 0.29a | –3.62 ± 0.41б | –1.94 ± 0.62в | – |
| Корни | –4.07 ± 0.78a | –2.75 ± 0.21б | –2.13 ± 0.49б | – | |
| Δ15N | 2.21* | 0.87* | –0.19 | – | |
| Empetrum nigrum (ЭРМ) |
Листья | –7.29 ± 1.39a | –4.84 ± 0.95б | –2.51 ± 0.58в | – |
| Корни | –5.63 ± 0.64a | –3.49 ± 0.40б | –2.33 ± 1.09б | – | |
| Δ15N | 1.66 | 1.35* | 0.18 | – | |
| Vaccinium vitis-idaea (ЭРМ) |
Листья | –6.32 ± 1.31a | –5.33 ± 0.54a | –4.09 ± 0.13б | – |
| Корни | –4.13 ± 0.19a | –4.59 ± 0.28a | –3.93 ± 0.39a | – | |
| Δ15N | 2.20* | 0.74 | 0.16 | – | |
| Vaccinium myrtillus (ЭРМ) |
Листья | –5.86 ± 0.52a | –2.98 ± 0.56б | –2.72 ± 0.51б | – |
| Корни | –3.49 ± 0.51a | –0.90 ± 0.57б | –3.02 ± 0.34a | – | |
| Δ15N | 2.38* | 1.93* | –0.30 | – | |
| Vaccinium uliginosum (ЭРМ) |
Листья | –4.52 ± 0.62a | –3.23 ± 0.37б | –2.37 ± 0.53б | – |
| Корни | –4.44 ± 0.57a | –2.31 ± 0.61б | –1.65 ± 0.15б | – | |
| Δ15N | 0.08 | 0.92 | 0.71* | – | |
| Bartsia alpina (АРМ) |
Листья | –4.90 ± 0.71a | –4.50 ± 0.68a | –1.60 ± 0.55б | – |
| Корни | –5.14 ± 0.93a | –4.81 ± 0.42a | –4.84 ± 0.31a | – | |
| Δ15N | –0.24 | –0.31 | –3.24* | – | |
| Juncus trifidus (АРМ) |
Листья | 2.41 ± 0.37a | 1.53 ± 0.62a | 0.10 ± 0.84б | –1.95 ± 0.65в |
| Корни | 0.55 ± 0.84a | 0.95 ± 0.30a | –1.66 ± 0.40б | –2.58 ± 0.30в | |
| Δ15N | –1.86* | –0.58 | –1.56* | –0.63 | |
| Nardus stricta (АРМ) |
Листья | – | –2.56 ± 0.23a | –2.80 ± 0.28a | –2.69 ± 0.23a |
| Корни | – | –0.21 ± 0.24a | –1.90 ± 0.31б | –1.67 ± 0.47б | |
| Δ15N | – | 2.35* | 0.90* | 1.02* | |
| Deschampsia flexuosa (АРМ) |
Листья | – | 0.62 ± 0.37a | –1.68 ± 0.51б | –1.49 ± 0.21б |
| Корни | – | –0.47 ± 0.27a | –2.12 ± 0.77б | –1.23 ± 0.36б | |
| Δ15N | – | –1.09* | –0.44 | 0.26 | |
| Solidago virgaurea (АРМ) |
Листья | – | –2.33 ± 0.40aб | –3.40 ± 0.80a | –2.06 ± 0.45б |
| Корни | – | –1.68 ± 0.25a | –2.48 ± 0.37б | –2.43 ± 0.86аб | |
| Δ15N | – | 0.65* | 0.92 | –0.37 | |
| Gnaphalium norvegicum (АРМ) |
Листья | – | –5.05 ± 0.28a | –3.85 ± 0.64б | –2.70 ± 0.51в |
| Корни | – | –2.96 ± 0.38a | –2.26 ± 0.53a | –2.77 ± 0.15a | |
| Δ15N | – | 2.09* | 1.59* | –0.07 | |
| Carex bigelowii (БМ) |
Листья | 1.93 ± 0.51a | – | –0.24 ± 0.17б | –3.15 ± 0.81в |
| Корни | 1.28 ± 0.28a | – | –0.81 ± 0.34б | –1.92 ± 1.08б | |
| Δ15N | –0.65 | – | –0.57* | 1.23 |
Среди растений КЛП все изученные виды, образующие ЭКМ и ЭРМ, характеризуются выраженными отрицательными значениями δ15N в листьях (от –7.29 для E. nigrum до –4.52‰ V. uliginosum). Это хорошо соотносится с представлением о фракционировании изотопов азота между микоризными грибами и растениями-хозяевами и невозможностью, поэтому, изотопной индикации источников азотного питания растений с ЭКМ и ЭРМ [23]. Одновременно δ15N в листьях хорошо соотносится с изотопным составом N–${\text{NH}}_{4}^{ + }$ в поверхностном органическом горизонте, где сосредоточены корневые системы тундровых кустарников и кустарничков. Исходя из упомянутого представления, такое совпадение может быть случайным, однако надо иметь в виду, что результатов определения изотопного состава N–${\text{NH}}_{4}^{ + }$ в тундровых почвах очень мало, а ведущее значение фракционирования изотопов в определении изотопного состава азота растений с ЭКМ и ЭРМ опирается на косвенные данные (тяжелый изотопный состав азота микоризных грибов). Поэтому причина обнаруженного изотопного соответствия между N–${\text{NH}}_{4}^{ + }$ и азотом растений с ЭКМ и ЭРМ нуждается в дополнительном уточнении. Из травянистых растений с АРМ только B. alpina имеет отрицательное значение δ15N (–4.90‰), близкое к растениям с ЭКМ и ЭРМ. Это может быть связано с тем, что B. alpina, будучи полупаразитом, способна получать дополнительное азотное питание от растения-хозяина, вероятнее всего, какого-то из вересковых кустарничков [30]. Возможно, этим обусловлена и наибольшая среди изученных видов концентрация N в корнях B. alpina. Виды граминоидов КЛП (J. trifidus и C. bigelowii) характеризуются положительными значениями δ15N в листьях. Ранее факт более тяжелого изотопного состава N у растений с АРМ и БМ в тундровых экосистемах связывался с их питанием более тяжелым N–${\text{NH}}_{4}^{ + }$ из минерального горизонта за счет более глубокой корневой системы [32, 39], что соответствует и нашим результатам. Кроме того, C. bigelowii, вероятно, способна поглощать органические соединения азота [35, 36], характеризующиеся тяжелым изотопным составом [5, 34].
Виды растений КП, образующие ЭКМ и ЭРМ, также имеют отрицательные значения δ15N в листьях (от –5.33‰ у V. vitis-idaea до –2.98‰ у V. myrtillus), а у растений с АРМ этот показатель сильно варьирует: от –5.05‰ у G. norvegicum и ‒4.50‰ у B. alpina до 0.62‰ у D. flexuosa и 1.53‰ у J. trifidus. Все изученные виды растений с ЭКМ и ЭРМ, за исключением V. vitis-idaea, демонстрируют значимое увеличение δ15N в листьях при произрастании в сообществе КП в сравнении с КЛП, хотя изотопный состав N–${\text{NH}}_{4}^{ + }$ в почвах не отличается. Средние для сообщества величины δ15N в листьях этих видов составили –6.1 ± 1.0‰ в КЛП и –4.0 ± 1.0‰ в КП. У растений же с АРМ величина δ15N в двух биогеоценозах пустошей значимо не отличается.
При переходе к ЗЛ наблюдается дальнейшее увеличение δ15N в листьях растений с ЭКМ и ЭРМ (до –4.09‰ у V. vitis-idaea и до –1.94‰ у B. nana). Среднее для этой группы растений значение δ15N составило –2.7 ± 0.8‰. У растений с АРМ и БМ величина δ15N в листьях изменилась разнонаправлено. Так, у видов с наиболее низкими значениями δ15N (B. alpina, G. norvegicum) этот показатель в луговом сообществе значимо увеличился, тогда как у видов с наибольшими значениями (J. trifidus, D. flexuosa, C. bigelowii) он уменьшился, а у видов со средними показателями (N. stricta, S. virgaurea) – не изменился. В результате диапазон варьирования δ15N у этих растений уменьшился с 6.58‰ в сообществе КП до 3.95‰ в сообществе ЗЛ.
Тенденция уменьшения диапазона варьирования δ15N в листьях травянистых растений сохранилась и при переходе к ОЛ, где он составил всего 1.66‰. Подобно ЗЛ, у индивидуальных видов происходят разнонаправленные изменения δ15N, приводящие к выравниванию изотопного состав азота в листьях всех растений, который характеризуется величиной δ15N ~ –2…–3‰.
Средний по всем исследованным участкам изотопный состав N в листьях растений с разным типом микоризы значимо различается. Так, δ15N у растений с ЭКМ и ЭРМ составляет –4.3 ± 1.6‰, а у растений с АРМ и БМ этот показатель составил –1.8 ± 2.1‰. Полученное различие хорошо соответствует известной закономерности возрастания величины δ15N в листьях в ряду растений с ЭРМ < ЭКМ < АРМ < БМ, определяемой, прежде всего, фракционированием изотопов между ЭРМ/ЭКМ грибами и растением-хозяином [10]. Вместе с тем при сравнении растений с разным типом микоризы в пределах отдельных сообществ значимое различие отмечается только для растений КЛП, тогда как у растений КП и ЗЛ оно не значимо.
Изменение изотопного состава N в листьях растений при повышении доступности элемента в последовательности биогеоценозов КЛП < КП < < ЗЛ ≤ ОЛ может быть связано с несколькими причинами. Общая закономерность увеличения δ15N в листьях растений с ЭКМ и ЭРМ (рис. 2), вероятно, является следствием уменьшения участия микоризы в азотном питании растений. Так, в случае низкой доступности элемента преобладающая его часть поступает в растение через микоризу, подвергаясь выраженному изотопному фракционированию и формируя “легкий” изотопный состав азота растений. При повышении доступности азота возрастает доля элемента, поглощаемого растением напрямую без участия микоризы, транспорт азота, обедненного изотопом 15N, от грибов к растениям уменьшается, что и приводит к повышению значений δ15N [22, 23]. Кроме того, преобладающий в составе неорганических соединений N–${\text{NH}}_{4}^{ + }$ имеет более тяжелый изотопный состав в почвах лугов (табл. 2), что также может способствовать увеличению δ15N растений.
Рис. 2.
Изотопный состав азота в листьях растений при произрастании в условиях разной обогащенности почвы его лабильными соединениями.
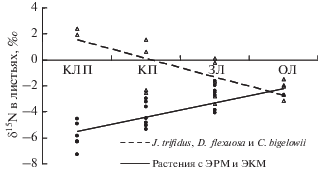
Отсутствие общей закономерности изменения изотопного состава N в листьях растений с АРМ и БМ при разной доступности элемента свидетельствует о более разнообразных механизмах его контролирования. Помимо обсужденных на примере растений с ЭКМ и ЭРМ факторов, определяющих увеличение δ15N (снижение участия микоризы в азотном питании и более тяжелый изотопный состав N–${\text{NH}}_{4}^{ + }$), в этом случае проявляется и фактор, определяющий уменьшение δ15N в листьях J. trifidus, D. flexuosa и C. bigelowii. Вероятно, это связано со значительным участием N–${\text{NO}}_{3}^{ - },$ характеризующимся легким изотопным составом, в азотном питании этих видов растений. Разнонаправленное влияние этих двух факторов может быть ответственным за достаточно стабильный изотопный состав N в листьях N. stricta, S. virgaurea.
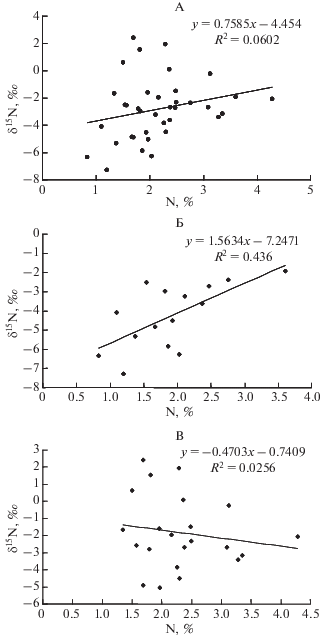
Между изотопным составом N и его концентрацией в листьях часто обнаруживается положительная связь, которая показана как на глобальном [10], так и на ландшафтном [23, 29] уровнях. Такая взаимосвязь объясняется повышенной ролью микоризы в азотном питании растений (низкие значения δ15N в листьях) при низкой доступности N (низкие концентрации N в листьях), или большими значениями δ15N источников азотного питания (высокие значения δ15N в листьях) при высокой доступности N (большие концентрации N в листьях). Вместе с тем эта взаимосвязь может быть существенно ослаблена за счет видов растений, характеризующихся низкой концентрацией N, но повышенными значениями δ15N, или, напротив, усилена, если присутствуют виды бобовых с высокой концентрацией N и повышенными значениями δ15N, у которых эти показатели не связаны с микоризой и доступностью почвенного азота [29]. Для всей совокупности изученных растений горно-тундровых экосистем взаимосвязь между изотопным составом N (δ15N) и его концентрацией в листьях весьма слабая (r = 0.25, P > > 0.05) (рис. 3, А). Однако если рассмотреть отдельно виды, образующие ЭКМ и ЭРМ, с одной стороны, и виды с АРМ – с другой, то оказывается, что для первых характерна значимая положительная корреляция (r = 0.66, P < 0.01) (рис. 3, Б), тогда как для вторых корреляция отсутствует (r = = –0.16, P > 0.05) (рис. 3, В). Таким образом, для кустарничков и кустарников с ЭКМ и ЭРМ можно предположить снижение участия микоризы в азотном питании при повышении доступности элемента, тогда как для трав с АРМ участие в азотном питании контрастных по изотопному составу источников (N–${\text{NH}}_{4}^{ + }$ и N–${\text{NO}}_{3}^{ - }$) в луговых экосистемах способствует формированию разнонаправленных изменений δ15N при повышении доступности азота.
Рис. 3.
Взаимосвязь между содержанием и изотопным составом азота в листьях растений: А – все изученные виды, Б – виды с ЭКМ и ЭРМ, В – виды с АРМ и БМ.
Изотопный состав азота в корнях растений. Все виды растений КЛП, образующих ЭКМ и ЭРМ, характеризуются отрицательными значениями δ15N корней (от –5.63‰ E. nigrum до –3.49‰ у V. myrtillus). Среди растений с АРМ-симбиозом B. alpina также имеет отрицательное значение δ15N (–5.14‰), близкое к растениям с ЭКМ и ЭРМ. Корни злака J. trifidus и безмикоризной C. bigelowii, напротив, имеют положительные значения δ15N (табл. 4), что соответствует закономерностям, обнаруженным для изотопного состава азота в листьях.
В сообществе КП виды с ЭКМ и ЭРМ также имеют отрицательные значения δ15N в корнях (от –4.59 V. vitis-idaea до –0.90‰ V. myrtillus). При этом растения, образующие АРМ, преимущественно, характеризуются схожими значениями δ15N: от –4.81 B. alpina до –0.21‰ N. stricta и только в корнях J. trifidus δ15N имеет положительное значение (0.95‰). Все изученные виды растений с ЭКМ и ЭРМ, за исключением V. vitis-idaea, демонстрируют значимое увеличение δ15N (менее отрицательные значения) в корнях растений КП по сравнению с КЛП, подобно тому, как это происходит и в листьях. Средние для сообщества величины δ15N в корнях этих видов составили –4.4 ± 0.8‰ в КЛП и –2.8 ± 1.4‰ в КП. В растениях с АРМ δ15N в корнях не меняется при переходе от КЛП к КП.
При переходе к ЗЛ увеличение δ15N в корнях растений с ЭКМ и ЭРМ, в отличие от листьев, не происходит (среднее значение для растений ЗЛ составило –2.7 ± 0.9‰), тогда как в корнях большинства видов растений с АРМ и БМ этот показатель уменьшается подобно его поведению в листьях (средние значения в корнях растений КП и ЗЛ составили –1.5 ± 2.1 и –2.3 ± 1.3‰ соответственно). Эта тенденция сохраняется и для растений ОЛ.
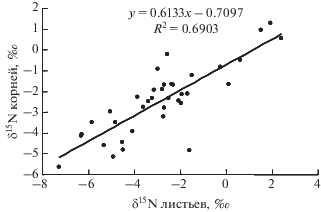
Изотопный состав N в корнях растений в целом варьирует меньше, чем в листьях. При этом наибольшие различия (6.91‰), подобно листьям, отмечаются в корнях растений КЛП, а при повышении доступности N в почвах других биогеоценозов диапазон варьирования δ15N заметно уменьшается, достигая наименьшего (1.54‰) у растений ОЛ. Для изотопного состава N в корнях и листьях (рис. 4) характерна более тесная положительная связь (r = 0.83, P < 0.001), чем для концентрации элемента (r = 0.34, P < 0.05) (рис. 1).
В корнях растений наблюдается отрицательная связь между величиной δ15N и концентрацией N (r = –0.54, P < 0.001) (рис. 5, А), в противоположность известной из литературы и показанной в данном исследовании положительной связи между этими параметрами в листьях (рис. 3, А). Ранее, насколько нам известно, подобная взаимосвязь в литературе не обсуждалась. Обнаруженная закономерность определяется видами, образующими АРМ или БМ (r = –0.71, P < 0.001) (рис. 5, Б), тогда как для видов с ЭКМ и ЭРМ взаимосвязь между концентрацией азота и δ15N не выражена (r = 0.22, P > 0.05) (рис. 5, В). Вероятно, причина установленного факта кроется в значительном участии изотопнолегкого N–${\text{NO}}_{3}^{ - }$ в питании АРМ и БМ растений при более высокой доступности азота в почвах луговых экосистем. При этом в корнях этот эффект проявляется в большей степени, по-видимому, из-за преимущественной приуроченности нитратредуктазы к корневым системам.
Рис. 5.
Взаимосвязь между содержанием и изотопным составом азота в корнях растений: А – все изученные виды, Б – виды с АРМ и БМ, В – виды с ЭКМ и ЭРМ.
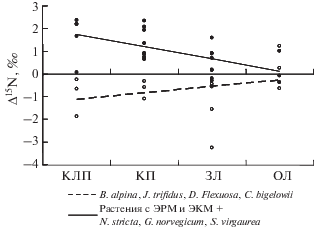
Фракционирование изотопов азота между корнями и листьями. Все изученные виды растений демонстрируют значимые различия в изотопном составе N корней и листьев при произрастании хотя бы в одном биогеоценозе. Для большинства видов наблюдается схожая закономерность – значимые различия обнаруживаются в условиях меньшего содержания экстрагируемых органических и неорганических соединений N в почве и не обнаруживаются при увеличении их концентраций. Исключениями явились B. alpina (АРМ) и V. uliginosum (ЭРМ), у которых значимые различия в изотопном составе N листьев и корней проявляются в условиях высокой обеспеченности азотом. При этом закономерности формирования разницы в изотопном составе N листьев и корней у разных растений отличаются. Так, у всех видов растений с ЭКМ и ЭРМ δ15N в листьях меньше, чем в корнях, и это различие уменьшается при увеличении концентраций экстрагируемых соединений N в почве (рис. 6). Подобная закономерность характерна и для некоторых видов растений с АРМ (N. stricta, G. norvegicum, S. virgaurea). Однако у других видов растений, образующих АРМ, листья характеризуются более тяжелым изотопным составом N, чем корни. При этом у B. alpina это проявляется в условиях повышенной доступности N, у J. trifidus – вне зависимости от доступности элемента, а у D. flexuosa – при более низкой доступности.
Рис. 6.
Взаимосвязь между фракционированием изотопов азота между корнями и листьями растений и их произрастанием в условиях разной обогащенности почвы лабильными соединениями азота.
Таким образом, для всех растений, образующих ЭКМ и ЭРМ, а также для некоторых растений с АРМ более тяжелый изотопный состав N в корнях соответствует представлению о фракционировании изотопов между микоризными грибами (корни) и растением-хозяином (листья). Подобно увеличению δ15N в листьях, уменьшение фракционирования изотопов между корнями и листьями в условиях большей доступности N, вероятно, является следствием уменьшения участия микоризы в азотном питании растений, так как при аммонийном питании, как правило, не наблюдается заметное фракционирование изотопов N [15, 42].
В то же время более тяжелый изотопный состав N в листьях ряда растений, образующих АРМ, не соответствует описанной закономерности. Ранее свидетельства относительного, как обеднения, так и обогащения изотопом 15N растения-хозяина с АРМ были получены в тепличных экспериментах [17, 19]. Наиболее известный механизм относительной аккумуляции 15N в листьях растений связан с их нитратным питанием [15, 38, 41], поскольку растения могут проявлять нитратредуктазную активность, как в корнях, так и в листьях. Нитратредуктаза в корнях восстанавливает преимущественно $^{{14}}{\text{NO}}_{3}^{ - }$, тогда как нитрат, относительно обогащенный 15N, перемещается в листья и восстанавливается там, формируя более тяжелый азот листьев по сравнению с корнями. Если доступность нитратов повышается, то большее их количество поступает в листья, обогащение которых изотопом 15N возрастает [37]. Следуя этой гипотезе, было высказано предположение, что обогащение изотопом 15N листьев по сравнению с корнями у растений в естественных экосистемах может быть также связано с высокой доступностью нитратов [14]. Однако более тяжелый изотопный состав N в листьях J. trifidus и D. flexuosa в биогеоценозах пустошей при очень низкой концентрации N–${\text{NO}}_{3}^{ - }$ в почве не может быть объяснен действием этого механизма фракционирования. Таким образом, очевидно, что фракционирование изотопов N в растениях, образующих АРМ, не определяется действием единого механизма и остается не до конца выясненным, какие процессы ответственны за фракционирование в каждом конкретном случае.
ЗАКЛЮЧЕНИЕ
Фракционирование изотопов N в системе ЭРМ/ЭКМ микориза–растение (корни–листья) проявляет индикаторные свойства в отношении разной обеспеченности растений горно-тундровых экосистем доступным азотом. В случае низкой доступности элемента происходит выраженное фракционирование с большей аккумуляцией 15N в корнях, а при повышении доступности N роль микоризы во фракционировании изотопов уменьшается, и изотопный состав N растений в большей степени соответствует изотопному составу N преимущественных источников азотного питания в почве. Схожие закономерности формирования изотопного состава N в листьях и корнях характерны и для некоторых растений, образующих АРМ (N. stricta, G. norvegicum, S. virgaurea), что может свидетельствовать о фракционировании изотопов N АРМ грибами так же, как это происходит в ЭРМ/ЭКМ симбиозе. Однако особенности изотопного состава N у других растений с АРМ, включая более тяжелый изотопный состав N в листьях по сравнению с корнями, свидетельствуют о большем разнообразии механизмов, контролирующих наличие, отсутствие и направление фракционирования изотопов N в АРМ симбиозе, которые требуют дополнительного изучения.
Список литературы
Бузин И.С., Макаров М.И., Малышева Т.И., Кадулин М.С., Королева Н.Е., Маслов М.Н. Трансформация соединений азота в почвах горно-тундровых экосистем Хибин // Почвоведение. 2019. № 5. С. 570–577. https://doi.org/10.1134/S0032180X1903002X
Веселкин Д.В. Соотношение объемов гриба и древесных тканей в эктомикоризных корнях хвойных // Лесоведение. 2015. № 2. С. 140–146.
Макаров М.И. Изотопный состав азота в почвах и растениях: использование в экологических исследованиях (обзор) // Почвоведение. 2009. № 12. С. 1432–1445.
Макаров М.И. Роль микоризы в трансформации соединений азота в почве и в азотном питании растений (обзор) // Почвоведение. 2019. № 2. С. 220–233. https://doi.org/10.1134/S0032180X19020102
Макаров М.И., Малышева Т.И., Меняйло О.В. Изотопный состав азота и трансформация азотсодержащих соединений в горно-луговых альпийских почвах // Почвоведение. 2019. № 9. С. 1039–1048. https://doi.org/10.1134/S0032180X19090053
Макаров М.И., Мулюкова О.С., Малышева Т.И., Меняйло О.В. Влияние высушивания образцов горно-луговых альпийских почв на процессы трансформации соединений азота и углерода // Почвоведение. 2013. № 7. С. 850–859. https://doi.org/10.7868/S0032180X1307006X
Смит С.Э., Рид Д.Дж. Микоризный симбиоз. Пер. с англ. Ворониной Е.Ю. М.: Товарищество научных изданий КМК, 2012.
Chapin F.S., Vitousek P.M., Vancleve K. The nature of nutrient limitation in plant-communities // Am. Naturalist. 1986. V. 127. P. 48–58.
Craine J.M., Brookshire E.N.J., Cramer M.D., Hasselquist N.J. Koba K., Marin-Spiotta E., Wang L. Ecological interpretations of nitrogen isotope ratios of terrestrial plants and soils // Plant Soil. 2015. V. 396. P. 1–26.
Craine J.M., Elmore A.J., Aidar M.P.M., Bustamante M., Dawson T.E., Hobbie E.A., Kahmen A., Mack M.C., McLauchlan K.K., Michelsen A., Nardoto G.B., Pardo L.H., Peñuelas J., Reich P.B., Schuur E.A.G., Stock W.D., Templer P.H., Virginia R.A., Welker J.M., Wright I.J. Global patterns of foliar nitrogen isotopes and their relationships with climate, mycorrhizal fungi, foliar nutrient concentrations, and nitrogen availability // New Phytol. 2009. V. 183. P. 980–992.
Craine J.M., Elmore A.J., Wang L., Aranibar J., Bauters M., Boeckx P., Crowley B.E., Dawes M.A., Delzon S., Fajardo A., Fang Y., Fujiyoshi L., Gray A., Guerrieri R., Gundale M.J., Hawke D.J., Hietz P., Jonard M., Kearsley E., Kenzo T., Makarov M., Marañón-Jiménez S., McGlynn T.P., McNeil B.E., Mosher S.G., Nelson D.M., Peri P.L., Roggy J.C., Sanders-DeMott R., Song M., Szpak P., Templer P.H., Van der Colff D., Werner C., Xu X., Yang Y., Yu G., Zmudczyńska-Skarbek K. Isotopic evidence for oligotrophication of terrestrial ecosystems // Nature Ecology Evolution. 2018. V. 2. P. 1735–1744.
Craine J.M., Lee W.G., Bond W.J., Williams R.J., Johnson L.C. Environmental constraints on a global relationship among leaf and root traits of grasses // Ecology. 2005. V. 86. P. 12–19.
Dijkstra P., Williamson C., Menyailo O., Doucett R., Koch G., Hungate B.A. Nitrogen stable isotope composition of leaves and roots of plants growing in a forest and a meadow // Isotopes Environ. Health Stud. 2003. V. 39. P. 29–39.
Emmerton K.S., Callaghan T.V., Jones H.E., Leake J.R., Michelsen A., Read D.J. Assimilation and isotopic fractionation of nitrogen by mycorrhizal fungi // New Phytol. 2001. V. 151. P. 503–511.
Evans R.D., Bloom A.J., Sukrapanna S.S., Ehleringer J.R. Nitrogen isotope composition of tomato (Lucopersicon esculentum Mill. Cv. T-5) grown under ammonium or nitrate nutrition // Plant Cell Environ. 1996. V. 19. P. 1317–1323.
Farrell R.E., Sandercock P.J., Van Kessel C. Landscape-scale variations in leached nitrate: Relationship to denitrification and natural nitrogen-15 abundance // Soil Sci. Soc. Am. J. 1996. V. 60. P. 1410–1415.
Fonseca H.M., Berbara R.L., Daft M.J. Shoot δ15N and δ13C values of non-host Brassica rapa change when exposed to Glomus etunicatum inoculum and three levels of phosphorus and nitrogen // Mycorrhiza. 2001. V. 11. P. 151–158.
Garten C.T., Jr. Variation in foliar 15N abundance and the availability of soil nitrogen on Walker Branch Watershed // Ecology. 1993. V. 74. P. 2098–2113.
Handley L., Azcon R., Lozano J.R., Scrimgeour C. Plant δ15N associated with arbuscular mycorrhization, drought and nitrogen deficiency // Rapid Comm. Mass Spectr. 1999. V. 13. P. 1320–1324.
Heijden M.G., Martin F.M., Selosse M.A., Sanders I.R. Mycorrhizal ecology and evolution: the past, the present, and the future // New Phytologist. 2015. V. 205. P. 1406–1423.
Hepper C.M. A colorimetric method for estimating vesicular-arbuscular mycorrhizal infection in roots // Soil Biol. Biochem. 1977. V. 9. P. 15–18.
Hobbie E.A., Jumpponen A., Trappe J. Foliar and fungal 15N:14N ratios reflect development of mycorrhizae and nitrogen supply during primary succession: testing analytical models // Oecologia. 2005. V. 146. P. 258–268.
Hobbie E.A., Macko S.A., Williams M. Correlations between foliar δ15N and nitrogen concentrations may indicate plant-mycorrhizal interactions // Oecologia. 2000. V. 122. P. 273–283.
Holmes R.M., McClelland J.M., Sigman D.M., Fry B., Petersen B.J. Measuring 15N–NH4+ in marine, estuarine and fresh waters: An adaptation of the ammonia diffusion method for samples with low ammonium concentrations // Marine Chemistry. 1998. V. 60. P. 235–243.
Högberg P. 15N natural abundance in soil-plant systems // New Phytol. 1997. V. 137. P. 179–203.
Leigh J., Hodge A., Fitter A.H. Arbuscular mycorrhizal fungi can transfer substantial amounts of nitrogen to their host plant from organic material // New Phytologist. 2009. V. 181. P. 199–207.
Lucas R.W., Casper B.B. Ectomycorrhizal community and extracellular enzyme activity following simulated atmospheric N deposition // Soil Biol. Biochem. 2008. V. 40. P. 1662–1669.
Makarov M.I., Malysheva T.I., Cornelissen J.H.C., van Logtestijn R.S.P., Glasser B. Consistent patterns of 15N distribution through soil profiles in diverse alpine and tundra ecosystems // Soil Biol. Biochem. 2008. V. 40. P. 1082–1089.
Makarov M.I., Onipchenko V.G., Malysheva T.I., van Logtestijn R.S.P., Soudzilovskaia N.A., Cornelissen J.H.C. Determinants of 15N natural abundance in leaves of co-occurring plant species and types within an alpine lichen heath in the Northern Caucasus // Arctic, Antarctic, Alpine Res. 2014. V. 46. P. 581–590.
Michelsen A., Schmidt I.K., Jonasson S., Quarmby C., Sleep D. Leaf 15N abundance of subarctic plants provides field evidence that ericoid, ectomycorrhizal and non- and arbuscular mycorrhizal species access different sources of soil nitrogen // Oecologia. 1996. V. 105. P. 53–63.
Miller A.E., Bowman W.D. Variation in nitrogen-15 natural abundance and nitrogen uptake traits among co-occurring alpine species: do species partition by nitrogen form? // Oecologia. 2002. V. 130. P. 609–616.
Nadelhoffer K., Shaver G., Fry B., Giblin A., Johnson L., McKane R. 15N natural abundances and N use by tundra plants // Oecologia. 1996. V. 107. P. 386–394.
Pardo L.H., Templer P.H., Goodale C.L., Duke S., Groffman P.M., Adams M.B., Boeckx P., Boggs J., Campbell J., Colman B., Compton J., Emmett B., Gundersen P., Kjonaas J., Lovett G., Mack M., Magill A., Mbila M., Mitchell M.J., McGee G., McNulty S., Nadelhoffer K., Ollinger S., Ross D., Rueth H., Rustad L., Schaberg P., Schiff S., Schleppi P., Spoelstra J., Wessel W. Regional assessment of N saturation using foliar and root delta N-15 // Biogeochemistry. 2006. V. 80. P. 143–171.
Pörtl K., Zechmeister-Boltenstern S., Wanek W., Ambus P., Berger T.W. Natural 15N abundance of soil N pools and N2O reflect the nitrogen dynamics of forest soils // Plant Soil. 2007. V. 295. P. 79–94.
Raab T.K., Lipson D.A., Monson R.K. Non-mycorrhizal uptake of amino acids by roots of the alpine sedge Kobresia myosuroides: implications for the alpine nitrogen cycle // Oecologia. 1996. V. 108. P. 488–494.
Raab T.K., Lipson D.A., Monson R.K. Soil amino acid utilization among species of the Cyperaceae: plant and soil processes // Ecology. 1999. V. 80. P. 2408–2419.
Robinson D. δ15N as an integrator of the nitrogen cycle // Trends Ecol. Evol. 2001. V. 16. P. 153–162.
Robinson D., Handley L.L., Scrimgeour C.M. A theory for 15N/14N fractionation in nitrate-grown vascular plants // Planta. 1998. V. 205. P. 397–406.
Schulze E.-D., Chapin F.S. III, Gebauer G. Nitrogen nutrition and isotope differences among life forms at the northern treeline of Alaska // Oecologia. 1994. V. 100. P. 406–412.
Sigman D.M., Altabet M.A., Michener R., McCorkle D.C., Fry B., Holmes R.M. Natural abundance-level measurement of the nitrogen isotopic composition of oceanic nitrate: An adaptation of the ammonia diffusion method // Marine Chemistry. 1997. V. 57. P. 227–242.
Yoneyama T., Kaneko A. Variations in the natural abundance of 15N in nitrogenous fractions in komatsuna plants supplied with nitrate // Plant Cell Physiol. 1989. V. 30. P. 957–962.
Yoneyama T., Omata T., Nakata S., Yazaki J. Fractionation of nitrogen isotopes during the uptake and assimilation of ammonia by plants // Plant Cell Physiol. 1991. V. 32. P. 1211–1217.
Дополнительные материалы отсутствуют.