Почвоведение, 2019, № 9, стр. 1081-1091
Эмиссия СО2, микробная биомасса и базальное дыхание чернозема при различном землепользовании
С. В. Сушко 1, Н. Д. Ананьева 1, *, К. В. Иващенко 1, 2, В. Н. Кудеяров 1
1 Институт физико-химических и биологических проблем почвоведения РАН
142290 Московская область, Пущино, ул. Институтская, 2, Россия
2 Российский университет дружбы народов, Аграрно-технологический институт
117198 Москва, ул. Миклухо-Маклая, 8/2, Россия
* E-mail: ananyeva@rambler.ru
Поступила в редакцию 05.02.2018
После доработки 17.01.2019
Принята к публикации 23.01.2019
Аннотация
В черноземе под степной растительностью, лесом (дубрава), в чистом пару (территория заповедника) и в урбаноземе города Курск (Курская область) изучали взаимосвязь эмиссии СО2 из почвы и ее микробиологических показателей. Измерения эмиссии СО2 с поверхности почвы (ЭМпов) и из двух нижележащих слоев почвы (глубина 10 и 20 см, ЭМ10, ЭМ20) проводили ежемесячно (май–октябрь), одновременно регистрировали температуру и влажность почвы. В отобранных образцах почвы слоев 0–10, 10–20, 20–30 см (всего 360) измеряли микробиологические показатели (углерод микробной биомассы (Смик), базальное дыхание). Химические свойства почвы (содержание Сорг; общего С, N, Р, К, Са; рН) определяли в образцах, отобранных в июле. Показано, что ЭМпов степи составила в среднем 24 г СО2/(м2 сут), леса, города и пара – в 1.6, 1.5 и 6 раза меньше соответственно. ЭМ10 и ЭМ20 леса оказалась в среднем в 2 раза больше таковой с поверхности, пара и города – примерно одинаковой, а степи – на 34% меньше. Эмиссия СО2 из почвы изученных экосистем за наблюдаемый период слабо зависела от ее температуры и влажности. Смик и базальное дыхание почвы (0–10 см) ненарушенных экосистем (степи, леса) в среднем в 3–5 и 2–4 раза, соответственно, превышали таковые нарушенных (пара, города). Показана положительная корреляция ЭМпов изученных экосистем с Смик и базальным дыханием (0–10 см, r = 0.56 и 0.74 соответственно). ЭМпов чернозема разного землепользования за вегетационный период на 78% была обусловлена их базальным дыханием (линейная регрессия). Следовательно, ЭМпов чернозема разного землепользования за вегетационный период можно в определенной степени прогнозировать на основе экспериментальных данных о базальном дыхании его верхнего слоя (0–10 см).
ВВЕДЕНИЕ
Почва является весомым наземным источником двуокиси углерода (СО2), поступление которого в атмосферу составляет от 75 до 100 Гт С/год [15, 47]. Эмиссия СО2 из почвы обусловлена в основном дыханием микроорганизмов, корней растений и почвенной фауны [44]. В почве этот газ может образовываться и при фотодеградации ее органического вещества, выветривании карбонатов, а также в результате его миграции из глубоких слоев Земли [45].
Дыхание почвенных микроорганизмов (микробное дыхание) составляет существенную долю эмиссии СО2 почвы. Вклад микробного дыхания в этот процесс достигает в среднем 57% в древесных и травянистых экосистемах арктической зоны, 63% – бореальной, 56% – умеренной, 53% – средиземноморской и 48% – тропической [48], то есть не менее половины. Есть основание полагать определенную взаимосвязь между эмиссией СО2 почвами и их микробиологическими характеристиками. Однако информация о такой взаимосвязи весьма ограничена и противоречива. Между эмиссией СО2 почвы и ее микробной биомассой показана положительная корреляция для сосновых лесов США, Канады и Китая [28, 37, 53], плантаций зеленого чая, каштана и апельсинового дерева Китая [28], пашен и залежей разного возраста России [3]. Вместе с тем взаимосвязь между эмиссией СО2 и содержанием микробной биомассы почв разных локализаций (Австралия, Китай, Индонезия) оказалась слабой [12, 40, 50].
Образование СО2 почвой происходит во всех горизонтах ее профиля, однако с глубиной скорость этого процесса, как правило, снижается [17, 22, 30, 31]. Миграция СО2 из нижних горизонтов почвы к ее поверхности в основном осуществляется посредством диффузии [25]. Показано, что эмиссия СО2 с поверхности почвы экваториальных лесов на 70–80% происходила из ее метрового профиля [17], хвойных лесов – на 75 и 87% из верхних 20- и 30-сантиметровых слоев [22, 30], пашен (пшеница, кукуруза) – на 95 и 80% из верхних 10- и 30-сантиметровых слоев соответственно [52]. Можно считать, что эмиссия СО2 с поверхности почвы обеспечивается продукцией этого газа преимущественно в верхних слоях, имеющих наибольшие запасы доступного для микроорганизмов органического углерода.
В современном мире около половины площади суши преобразовано антропогенной деятельностью, в которой земли сельскохозяйственных угодий и поселений составляют около 40 и 6% соответственно [26]. Распашка земель и образование городских экосистем существенно изменяют углеродный цикл [23, 39] и приводят к увеличению концентрации СО2 в атмосфере [34]. Подсчитано, что дополнительный поток углерода в атмосферу от такого преобразования составляет в среднем 1.14 ± 0.18 Гт С/год [27]. Так, интенсивное сельскохозяйственное использование одной из самых плодородных почв мира – чернозема – привело к потере 30–50% исходного содержания почвенного углерода за последние полвека [9, 35, 42]. При этом отмечено, что распашка чернозема прерий Аргентины вызывала кратковременное увеличение эмиссии СО2 в 16 раз [9], а внесение органических удобрений в пашни Китая – почти в 2 раза [35]. Указывают, что эмиссия СО2 из почв городов часто превышает таковую естественных аналогов [18, 32, 33, 46, 51].
Принимая во внимание упомянутые научные аспекты, наше исследование было сфокусировано на оценке эмиссии СО2 чернозема разного землепользования, содержания микробной биомассы и ее дыхательной активности, а также взаимосвязи эмиссии СО2 чернозема и его микробиологических свойств.
ОБЪЕКТЫ И МЕТОДЫ
Схема эксперимента
Изучали чернозем типичный (Haplic Chernozem (Loamic, Pachic), WRB 2014) леса (дубрава), степи некосимой и чистого пара (Центрально-Черноземный биосферный заповедник (ЦЧБЗ)) и урбанозем (Urbic Technosoils) г. Курска (санитарно-защитная зона завода “Курскрезинотехника”) лесостепной растительной подзоны Среднерусской возвышенности России (Курская область 51°33′–51°39′ N, 36°04′–36°07′ E). Климат исследуемой территории умеренно континентальный, среднегодовая температура воздуха 5.7°С, сумма осадков – 570 мм (данные метеостанции ЦЧБЗ). Расстояние между изученными экосистемами ЦЧБЗ составляет 0.4–0.8 км, от ЦЧБЗ до г. Курск – 12 км. Доминирующая растительность и история использования изученных экосистем представлены в табл. 1.
Таблица 1.
Локализация, доминирующая растительность и история менеджмента разных экосистем Курской области
| Экосистема | Локализация | Доминирующая растительность | История использования (лет) |
|---|---|---|---|
| Лес | ЦЧБЗ* | Дуб (Quercus robur), клен (Acer campestre), бересклет (Euonymus europaea) | Без вырубки (60) |
| Степь | ЦЧБЗ | Вейник (Calamagrostis epigeios), райграс (Arrhenatherum elatius), кострец (Bromopsis riparia) | Без выпаса, кошения и сжигания (80) |
| Чистый пар | ЦЧБЗ | Без растительности | Вспашка 1–2 раза в месяц, без удобрений (70) |
| Город Курск | Близ завода | Овсяница (Festuca pratensis), одуванчик (Taraxacum officinale) | Кошение 1–2 раза в месяц (70) |
В каждой экосистеме (каждом типе землепользования) выбирали участок ровной поверхности (~25 м2) с однородным растительным покровом, на котором с мая по октябрь 2015 г. (начало каждого месяца) измеряли эмиссию СО2 почвы с поверхности и после последовательного удаления двух ее верхних 10-сантиметровых слоев (рис. 1). Эмиссию СО2 почвы с поверхности измеряли в пяти пространственно удаленных точках (2–5 м между ними) каждой экосистемы, а после удаления верхних слоев – в трех из них. Точки измерения в экосистеме смещали от таковых предыдущего месяца не более чем на 0.1–0.2 м. Образцы почвы трех верхних слоев 0–10, 10–20 и 20–30 см отбирали ежемесячно после измерения эмиссии СО2 (всего 360) и доставляли в лабораторию. Почву просеивали (ячейки 2 мм) и делили на две части, одну из которой хранили в свежем состоянии при температуре 4°С не более 4 недель перед микробиологическим анализом (ISO 10381-6:2009). Другую часть почвы высушивали до воздушно-сухого состояния (22°С) и использовали для химического анализа.
Эмиссия СО2 из почвы
Эмиссию СО2 из почвы измеряли методом закрытой камеры. Для этого в почву на глубину 2–3 см помещали пластиковое основание (Ø20 см), на которое через 0.5 ч устанавливали камеру (объем 4.7 л), соединенную с ИК-газовым анализатором LI-820 (Li-Cor Inc., США). Перемешивание воздуха в камере обеспечивалось вентилятором, а его циркулирование между камерой и анализатором – насосом. Эмиссию СО2 из почвы изученных экосистем измеряли в интервале между 10:00 и 16:00 ч, для которого ее значение было близко к среднесуточному [6]. С поверхности почвы эмиссию СО2 измеряли не раньше, чем через 15 мин после срезания надземной растительности, с глубины 10 и 20 см – через 30 мин после удаления каждого из верхних 10-сантиметровых слоев. Скорость эмиссии СО2 из почвы (г СО2/(м2 сут)) рассчитывали по линейному увеличению концентрации этого газа в воздухе камеры после ее закрытия в интервале от 30 до 60 с (ppm CO2 c–1, R2 ≥ 0.98). Температуру (Checktemp, HANNA Instruments Inc., Германия) и объемную влажность (HH2 Moisture Meter, Delta-T Devices Ltd., Великобритания) почвы каждой экосистемы регистрировали в слоях 0–10, 10–20 и 20–30 см.
Химические свойства почвы
Содержание органического углерода (Сорг, бихроматное окисление), общего углерода и азота (Собщ и Nобщ, кислородное сжигание, анализатор CHN-932, LECO Corp., США), общего Р, К и Сa (рентген-флуоресцентный метод, спектрометр Спектроскан Макс-GVM, Россия) и значение рН (почва : вода = 1 : 2.5, потенциометрия) определяли в образцах почвы, отобранных в июле (n = = 60). Рассчитывали отношение Собщ/Nобщ (С/N).
Микробиологические свойства почвы
Содержание углерода микробной биомассы (Смик) измеряли методом субстрат-индуцированного дыхания (СИД), основанного на регистрации начальной максимальной скорости образования СО2 микроорганизмами почвы при обогащении глюкозой [10, 11]. Навеску почвы (1 г) помещали во флакон объемом 15 мл, добавляли по каплям раствор глюкозы (0.1 мл/г, 5 мг глюкозы/г), герметично закрывали и инкубировали (22°C) не более 5 ч. Время инкубации образца строго фиксировали. За этот период происходит окисление и соокисление глюкозы микроорганизмами, исключая ее потребления для роста. По окончании инкубации образца почвы измеряли концентрацию СО2 газовой фазы флакона (газовый хроматограф Кристаллюкс-4000М, Россия). Скорость СИД почвы (мкл СО2/(г почвы ч)) рассчитывали с учетом концентрации СО2 в газовой фазе флакона, ее объема, навески образца и времени инкубации. Величину Смик (мкг С/г почвы) определяли согласно формуле: СИД × 40.04 + + 0.37 [11].
Скорость базального (микробного) дыхания (БД) измеряли в нативной почве (навеска 1 г, без обогащения глюкозой), инкубированной 24 ч при 22°С [10]. Измерение БД выполняли как описано для СИД, только вместо раствора глюкозы в почву добавляли воду (0.1 мл/г почвы). Величину БД выражали в мкг С–СО2/(г почвы ч).
Навески для определения Смик и БД отбирали одновременно из предварительно инкубированного образца почвы (масса 100–300 г, 50–60% полной влагоемкости, 22°С, 7 сут), чтобы исключить избыточное образование СО2 почвой в результате просеивания и реувлажнения [10, 16].
Статистический анализ данных
Измерение Смик и БД почвы проводили в трех повторностях, химический анализ – в двух, расчет их величин выполнен на вес сухой почвы (105°C, 8 ч). Соответствие экспериментальных данных нормальному распределению проверяли графически (гистограмма) и критерием Шапиро–Уилка. Оказалось, что величины эмиссии СО2 почвы, Смик и БД не соответствовали нормальному распределению, поэтому для дисперсионного и корреляционного анализов их логарифмировали. Различие экспериментальных данных между изученными экосистемами (независимые группы) оценивали однофакторным дисперсионным анализом (ANOVA) с последующим попарным множественным сравнением средних (критерий Тьюки). Взаимосвязь между эмиссией СО2 почвы, ее температурой, влажностью, содержанием Смик и скоростью БД оценивали корреляционным (Пирсон) и регрессионным анализами. Статистическую обработку экспериментальных данных и их визуализацию (точечная диаграмма, диаграмма рассеивания, box-plot) выполняли в среде программирования R 3.5.0.
РЕЗУЛЬТАТЫ
Химические свойства почвы
Содержание Сорг верхнего 10-сантиметрового слоя почвы леса и степи составило в среднем 4%, а пара и города – было в 2 раза меньше. Отношение С/N почвы было почти одинаковым для леса, степи, пара и составило в среднем 12–13, а в городе оно было на 4–5 ед. больше. Значение рН почвы леса, степи, пара почти не различалось и составило в среднем 6.1–6.3, а города – было почти на 2 ед. больше. Содержание P и K изученных экосистем не различалось значимо и составило 0.95–1.17 и 17.3–18.5 г/кг соответственно. Содержание Ca в урбаноземе города достигало 30 г/кг, что почти в 3 раза больше такового в черноземе леса, степи и пара.
В нижележащих слоях почвы (10–20, 20–30 см) леса, степи и города содержание Сорг уменьшалось в среднем на 11–33%, а на пару – не менялось. Отношение С/N, значение рН, содержание P, K (все экосистемы) и Ca (лес, степь, пар) в нижележащих слоях почвы почти не отличалось от соответствующего верхнего. Однако в урбаноземе содержание Ca с глубиной увеличивалось в среднем на 12–18%.
Эмиссия СО2
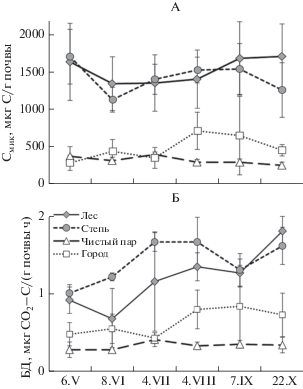
Эмиссия СО2 с поверхности почвы (ЭМпов) разных экосистем варьировала от 2.0 до 35.8 г СО2/(м2 сут) за 6 мес. наблюдения (рис. 2, А). Экстремально высокую ЭМпов (87.9 г СО2/(м2 сут), сентябрь) отмечали на пару спустя сутки после вспашки, значение которой не включали в статистические анализы. ЭМпов за вегетационный период была в среднем наибольшей в степи (23.8 г СО2/(м2 сут), меньшей – в лесу и городе (15.0 и 15.3 г СО2/(м2 сут) соответственно), а наименьшей – на пару (3.7 г СО2/(м2 сут)). Температура почвы верхнего 10-сантиметрового слоя изученных экосистем за наблюдаемый период варьировала от 4 до 32°С, в среднем она составила 16°С (рис. 2, Б). Влажность почвы верхнего 10-сантиметрового слоя почвы изученных экосистем за наблюдаемый период варьировала от 12 до 38% и составила в среднем 23% (рис. 2, В).
Рис. 2.
Временная динамика эмиссии СО2 с поверхности почвы (ЭМпов, А), ее температуры (Б) и влажности (В) в слое 0–10 см для разных экосистем Курской области.

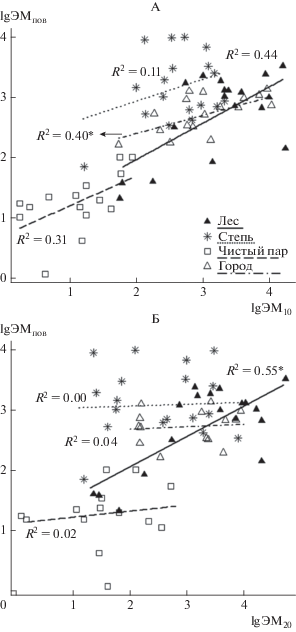
Эмиссия СО2 из почвы после удаления верхнего 10- и 20-сантиметровых слоев (ЭМ10 и ЭМ20) разных экосистем за наблюдаемый период варьировала от 1.4 до 57.3 и от 1.2 до 67.1 г СО2/(м2 сут) соответственно. Показано, что ЭМ10 (или ЭМ20) леса было в среднем в 2 раза больше соответствующей ЭМпов, чистого пара и города – почти не различались (p = 0.06), а в степи – было даже на 34% меньше (рис. 3). В целом, нижележащие слои почвы изученных экосистем содержали весомое количество СО2. Выявлена положительная корреляция между ЭМпов и ЭМ10 леса и города (R2 = 0.44 и 0.40 соответственно), а для степи и пашни такой взаимосвязи не обнаружено (рис. 4, A). Корреляция между ЭМпов и ЭМ20 выявлена только для леса (R2 = 0.55, рис. 4, Б).
Рис. 3.
Эмиссия СО2 из почвы с поверхности (0 см), глубины 10 и 20 см (Курская область, с мая по октябрь). Величины с разными буквами различаются значимо (p ≤ 0.05) для каждой экосистемы отдельно.

Рис. 4.
Взаимосвязь между эмиссией СО2 из почвы с поверхности (ЭМпов) и глубины 10 (ЭМ10, А), 20 см (ЭМ20, Б) для разных экосистем Курской области (с мая по октябрь, p ≤ 0.05).
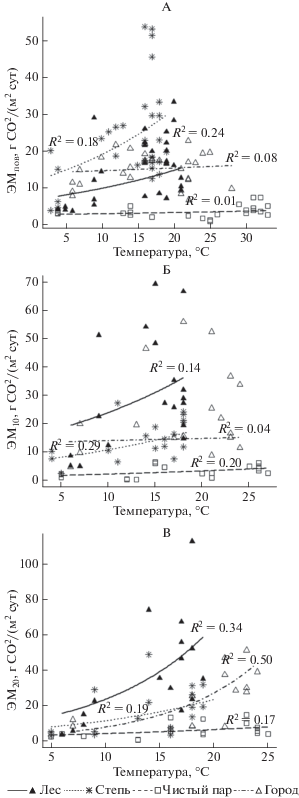
Температура нижележащих слоев почвы леса, степи и пара в основном была меньше на 1–8°С соответствующего верхнего. В городе температура почвы почти не менялась с глубиной (данные не показаны). Оказалось, что ЭМпов и ЭМ10 изученных экосистем за наблюдаемый период слабо зависела от температуры соответствующего слоя (R2 = 0.01–0.024, 0.04–0.029 соответственно) (рис. 5, А, 5Б), однако ЭМ20 – зависела значимо только для леса (R2 = 0.50, рис. 5, В).
Рис. 5.
Экспоненциальная регрессия между эмиссией СО2 из почвы (ЭМ) и температурой: поверхность (ЭМпов) и слой 0–10 см (А), глубина 10 см (ЭМ10) и слой 10–20 см (Б), глубина 20 см (ЭМ20) и слой 20–30 см (В) в разных экосистемах Курской области (с мая по октябрь).
Влажность нижележащих слоев почвы леса и степи была в основном на 1–14% меньше соответствующего верхнего, на пару и в городе – напротив, на 1–23% больше. Установлено, что ЭМпов изученных экосистем за наблюдаемый период почти не зависела от влажности верхнего слоя почвы (р >0.05, данные не показаны). Взаимосвязи между ЭМ10 (ЭМ20) и влажностью соответствующего слоя почвы также не была выявлено.
Таким образом, эмиссия СО2 с поверхности почвы степи, леса и города оказалась в среднем в 4–6 раза выше чистого пара. Удаление верхних слоев почвы приводило к дополнительному выбросу СО2 в атмосферу, который оказался наибольшим в лесу. Эмиссия СО2 из почвы изученных экосистем за наблюдаемый период слабо зависела от ее температуры и влажности.
Микробиологические свойства почвы
Содержание Смик верхнего 10-сантиметрового слоя почвы изученных экосистем за наблюдаемый период варьировало от 251 (пар, октябрь) до 1713 мкг С/г (лес, октябрь). При этом содержание Смик почвы каждой экосистемы за вегетационный период значимо не менялось (рис. 6, А). Кроме того, в ненарушенных экосистемах (лес, степь) величина Смик была в среднем в 3–5 раз больше таковой нарушенных (город, чистый пар). Скорость БД почвы леса, степи, пара и города составила за наблюдаемый период от 0.28 (пар, май–июнь) до 1.81 мкг СО2–С/(г ч) (лес, октябрь). Причем, скорость БД почвы чистого пара и города за этот период не менялась, леса – была большей в октябре, а степи – в июле и августе (рис. 6, Б). В почве ненарушенных экосистем скорость БД в среднем в 2–4 раза превышала таковую нарушенных. Показатели микробиологической активности (Смик, БД) нижележащих слоев почвы леса, степи и города были в среднем на 27–63 и 12–56% меньше соответствующего верхнего, однако чистого пара – не различались значимо.
Взаимосвязь эмиссии СО2 и микробиологических показателей почвы
Показано, что ЭМпов изученных экосистем за вегетационный период коррелировала положительно с Смик и БД слоя 0–10 см, r = 0.49 и 0.57 соответственно (табл. 2). Однако корреляция между ЭМ10, ЭМ20 и микробиологическими показателями этих слоев в изученных экосистемах не обнаружена. Затем экспериментальные данные октября исключили из корреляционного анализа, поскольку температура почвы этого месяца составила ≤7°C (неблагоприятные условия для микробной активности). Оказалось, что корреляция между ЭМпов и Смик (или БД) стала теснее (r = 0.56 и 0.74 соответственно). Более того, между ЭМ10 (ЭМ20) и величинами БД соответствующих слоев корреляция оказалась также значимой (r = 0.44–0.46).
Таблица 2.
Коэффициент корреляции (Пирсона) между эмиссией СО2 почвы с поверхности (ЭМпов), глубины 10, 20 см (ЭМ10, ЭМ20) и микробиологическими показателями трех верхних 10-сантиметровых слоев почвы леса, степи, чистого пара и города Курской области. Значимый коэффициент (p ≤ 0.001) выделен полужирным
| Показатель | Май–октябрь, 3–33°С (n) |
Май–сентябрь, 9–33°С (n) |
|---|---|---|
| ЭМпов и Смик(0–10) | 0.49 (115) | 0.56 (95) |
| ЭМ10 и Смик(10–20) | 0.32 (71) | 0.29 (59) |
| ЭМ20 и Смик(20–30) | 0.34 (67) | 0.31 (55) |
| ЭМпов и БД (0–10) | 0.57 (115) | 0.74 (95) |
| ЭМ10 и БД (10–20) | 0.36 (71) | 0.44 (59) |
| ЭМ20 и БД (20–30) | 0.37 (67) | 0.46 (55) |
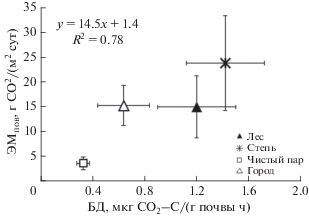
Далее был выполнен регрессионный анализ, который иллюстрировал отличие ЭМпов разных экосистем в зависимости от микробиологических показателей верхнего 10-сантиметрового слоя почвы. Оказалось, что ЭМпов чернозема разного землепользования за вегетационный период определялось Смик всего на 52% (данные не показаны), а БД – на 78% (рис. 7).
Рис. 7.
Регрессионная зависимость эмиссии СО2 из почвы с поверхности (ЭМпов) и скорости базального дыхания (БД, 0–10 см) для разных экосистем Курской области. Значения представлены как среднее ± стандартное отклонение, май–октябрь.
Таким образом, на протяжении вегетационного периода между эмиссией СО2 чернозема разного землепользования лесостепной подзоны и ее микробиологическими свойствами показана тесная взаимосвязь. Поэтому поверхностную эмиссию СО2 из почвы разных экосистем можно рассчитать на основе экспериментальных значений базального дыхания ее верхнего 10-сантиметрового слоя. Такой подход будет полезен для оценки эмиссионной активности почвы большого ряда экосистем, типов землепользования на территории лесостепной подзоны. Следовательно, отбор образцов почвы в теплый период года с последующим измерением их базального дыхания в лабораторных условиях может служить основанием для расчета эмиссионной активности почвенного покрова определенной территории.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Эмиссия СО2 почвы разного землепользования
Наибольшая эмиссия СО2 почвы изученных экосистем отмечена в некосимой заповедной степи Курской области, которая достигала в среднем за вегетационный сезон почти 24 г СО2/(м2 сут). Чернозем степи Монголии, России (Курская область), Канады и США эмитировал в среднем за теплый период года от 15 до 28 г СО2/(м2 сут) [4, 19, 31, 49], что вполне сопоставимо с нашими результатами. Однако распашка чернозема приводила к снижению эмиссии СО2 в среднем в 2 раза по сравнению с естественными аналогами [4, 49, 54]. В наших экспериментах пахотный чернозем был представлен чистым паром, эмиссия СО2 из которого в среднем была почти в 6 раз меньше целинного аналога. Кроме того, вспашка чистого пара способствовала активизации минерализационных процессов и более интенсивному кратковременному поступлению углерода в атмосферу (почти 88 г СО2/(м2 сут)). Эффект высокой эмиссии СО2 почвы в первые несколько суток после вспашки (увеличение в 2–16 раз) отмечали и другие исследователи [9, 20]. Считают, что вспашка почвы сопровождается усилением процессов окисления ее органического вещества [9] и, возможно, более свободной миграцией СО2 из нижележащих слоев [20].
Известно, что концентрация СО2 в нижних слоях почвы существенно выше таковой атмосферного воздуха, что во многом обусловлено различием скорости образования этого газа и его диффузии к поверхности [5]. Так, концентрация СО2 на глубине почвы 15–30 см под древесной и травянистой растительностью с мая по октябрь (Московская область, Россия) варьировала от 1300 до 20400 ppmv [5], что значительно больше таковой в атмосферном воздухе (400 ppmv). Поэтому последовательное удаление верхних слоев почвы (10, 20 см) изученных экосистем способствовало высокой скорости эмиссии СО2 (большой градиент концентрации СО2 между атмосферным и почвенным воздухом). Кроме того, другими исследователями показано, что удаление верхнего 10-сантиметрового культурного слоя почвы вызывало увеличение эмиссия СО2 в 6–37 раз в интервале 1–30 мин [7]. В нашем исследовании ЭМ10 и ЭМ20 почвы была в основном выше ЭМпов, причем в лесу это превышение было наибольшим, что может быть связано с более глубоким проникновением корней по почвенному профилю [17, 24]. Кроме того, следует отметить, что выделение СО2 из нижних слоев почвы обусловлено и более сложными механизмами его миграции по почвенному профилю, связанными, в свою очередь, с физическими и химическими процессами. Изучение последних не входило в задачу нашего исследования, поскольку важно было оценить количественное различие эмиссии СО2 нижних слоев в черноземе разного землепользования.
Микробиологические свойства и эмиссия СО2 почвы разного землепользования
Изучение отклика микробного сообщества почвы на изменение землепользования отражено в многочисленных публикациях. Так, преобразование естественных экосистем в пахотные приводило к ухудшению функционирования микробного сообщества почвы, выраженное снижением его обилия [1, 29, 43], дыхательной и ферментативной активности [8, 43] и, напротив, – увеличению удельного дыхания микробной биомассы [43]. В почве городских экосистем отмечают также снижение общей численности микроорганизмов [14, 38, 55] и активности разных ферментов [2] по сравнению с естественными аналогами.
Принимая во внимание, что не менее половины потока СО2 почвы обеспечивают микроорганизмы [48], а преобразование наземных экосистем сопровождается, как правило, ухудшением их функционирования (уменьшением биомассы, подавлением дыхательной активности) и потерей запасов легкодоступного органического углерода, можно полагать определенную взаимосвязь между эмиссией СО2 и микробными показателями. Для изученных экосистем лесостепной подзоны показана высокая взаимосвязь между эмиссией СО2 и базальным дыханием почвы (R2 = 0.78). Другими словами, эмиссию СО2 чернозема разного землепользования можно на 78% объяснить скоростью микробного дыхания, измеренного в лабораторных условиях. Следует отметить также, что исследований, связанных с одновременным определением эмиссии СО2 разных почв и их микробными свойствами, крайне мало. Так, указывают на положительную корреляцию между эмиссией СО2 и обилием микробной биомассы в почве сосновых лесов США, Канады и Китая [28, 37, 53]. Отмечают взаимосвязь эмиссии СО2 и ферментативной активности почвы дубового леса, соснового редколесья, кустарниковой залежи, виноградника, пастбища и оливковой плантации Испании [21, 41] и пашен Китая [36]. Вместе с тем другие исследователи обнаруживают слабую взаимосвязь эмиссии СО2 пахотных почв Китая и Индонезии и их микробной биомассы [12, 40], что, по нашему мнению, очевидно из-за небольших различий измеряемых показателей для этого типа экосистемы. Считаем, что получение информации о взаимосвязи эмиссии СО2 почвы и ее микробных показателей для разных экосистем и растительных зон может быть востребовано для прогнозной оценки их баланса углерода. Моделирование эмиссии СО2 почвы на основе экстраполяции ее микробиологических свойств позволило бы существенно расширить эмиссионный банк данных территории нашей страны.
ЗАКЛЮЧЕНИЕ
Оценена эмиссия СО2 чернозема разного землепользования и ее микробиологические показатели (обилие микробной биомассы, ее базальная дыхательная активность) за период с мая по октябрь. Выявлена высокая эмиссионная активность почвы степи, леса и города по сравнению с чистым паром. Содержание микробной биомассы и скорость базального дыхания почвы степи и леса (ненарушенные экосистемы) в среднем в 3–5 и 2–4 раза превышали соответственно таковые чистого пара и города (нарушенные). Выявлена тесная взаимосвязь между эмиссией СО2 чернозема разного землепользования и его базальным дыханием, что позволит прогнозировать эмиссионную активность почвы in situ в лесостепной подзоне.
ФИНАНСИРОВАНИЕ РАБОТЫ
Полевые исследования почвы выполнены при частичной финансовой поддержке программы Президиума РАН № 51. Микробный и химический анализ почвенных образцов выполнен при финансовой поддержке гранта РНФ № 19-77-30012. Обработка данных и подготовка публикации выполнена в рамках темы Государственного задания РФ рег. № 0191-2019-0045.
Список литературы
Благодатский С.А., Богомолова И.Н., Благодатская Е.В. Микробная биомасса и кинетика роста микроорганизмов в черноземах при различном сельскохозяйственном использовании // Микробиология. 2008. № 77. С. 113–120.
Горбов С.Н., Безуглова О.С. Биологическая активность почв городских территорий (на примере г. Ростов-на-Дону) // Научный журн. КубГАУ. 2013. № 85. С. 1–15.
Карелин Д.В., Горячкин С.В., Кудиков А.В., Лопес де Гереню В.О., Лунин В.Н., Долгих А.В., Люри Д.И. Изменение запасов углерода и эмиссии СО2 в ходе постагрогенной сукцессии растительности на серых почвах в европейской части России // Почвоведение. 2017. № 5. С. 580–594.
Карелин Д.В., Люри Д.И., Горячкин С.В., Лунин В.Н., Кудиков А.В. Изменение почвенной эмиссии диоксида углерода в ходе постагрогенной сукцессии в черноземной лесостепи // Почвоведение. 2015. № 11. С. 1354–1366.
Макаров Б.Н. Воздушный режим дерново-подзолистой почвы // Почвоведение. 1966. № 11. С. 98–107.
Саржанов Д.А., Васенев В.И., Сотникова Ю.Л., Тембо А., Васенев И.И., Валентини Р. Краткосрочная динамика и пространственная неоднородность эмиссии СО2 почвами естественных и городских экосистем Центрально-Черноземного региона // Почвоведение. 2015. № 4. С. 469–478.
Смагин А.В., Долгих А.В., Карелин Д.В. Экспериментальные исследования и физически обоснованная модель эмиссии диоксида углерода из вскрытого культурного слоя в Великом Новгороде // Почвоведение. 2016. № 4. С. 489–495.
Acosta-Martinez V., Cruz L., Sotomayor-Ramırez D., Perez-Alegria L. Enzyme activities as affected by soil properties and land use in a tropical watershed // Appl. Soil Ecol. 2007. V. 35. P. 35–45. https://doi.org/10.1016/j.apsoil.2006.05.012
Alvarez R., Alvarez C.R., Lorenzo G. Carbon dioxide fluxes following tillage from a mollisol in the Argentine Rolling Pampa // Eur. J. Soil Biol. 2001. V. 37. P. 161–166. https://doi.org/10.1016/S1164-5563(01)01085-8
Ananyeva N.D., Susyan E.A., Chernova O.V., Wirth S. Microbial respiration activities of soils from different climatic regions of European Russia // Eur. J. Soil Biol. 2008. V. 44(2). P. 147–157. https://doi.org/10.1016/j.ejsobi.2007.05.002
Anderson J.P.E., Domsch K.H. A physiological method for the quantitative measurement of microbial biomass in soils // Soil Biol. Biochem. 1978. V. 10(3). P. 215–221. https://doi.org/10.1016/0038-0717(78)90099-8
Arai H., Hadi A., Darung U., Limin S.H., Takahashi H., Hatano R., Inubushi K. Land use change affects microbial biomass and fluxes of carbon dioxide and nitrous oxide in tropical peatlands // Soil Sci. Plant Nutr. 2014. V. 60. P. 423–434. https://doi.org/10.1080/00380768.2014.903576
Bekele A., Kellman L., Beltrami H. Soil profile CO2 concentrations in forested and clear cut sites in Nova Scotia // Canada Forest Ecology and Management. 2007. V. 242. P. 587–597. https://doi.org/10.1016/j.foreco.2007.01.088
Beyer L., Blume H.P., Elsner D.C., Willnow A. Soil organic matter composition and microbial activity in urban soils // Sci. Total Environ. 1995. V. 168. P. 267–278. https://doi.org/10.1016/0048-9697(95)04704-5
Bond-Lamberty B., Thomson A. A global database of soil respiration data // Biogeosciences. 2010. V. 7. P. 1915–1926. https://doi.org/10.5194/bg-7-1915-2010
Creamer R.E., Schulte R.P.O., Stone D., Gal A., Krogh P.H., Papa G.L., Murray P.J., Peres G., Foerster B., Rutgers M., Sousa J.P., Winding A. Measuring basal soil respiration across Europe: Do incubation temperature and incubation period matter? // Ecol. Indic. 2014. V. 36. P. 409–418. https://doi.org/10.1016/j.ecolind.2013.08.015
Davidson E.A., Trumbore S.E. Gas diffusivity and production of CO2 in deep soils of the eastern Amazon // Tellus. 1995. V. 47. P. 550–565. https://doi.org/10.3402/tellusb.v47i5.16071
Decina S.M., Hutyra L.R., Gately C.K., Getson J.M., Reinmann A.B., Gianotti A.G.S., Templer P.H. Soil respiration contributes substantially to urban carbon fluxes in the greater Boston area // Environ. Pollut. 2016. V. 212. P. 433–439. https://doi.org/10.1016/j.envpol.2016.01.012
Dong Y., Zhang S., Qi Y., Chen Z., Geng Y. Fluxes of CO2, N2O and CH4 from a typical temperate grassland in Inner Mongolia and its daily variation // Chin. Sci. Bull. 2000. V. 45(17). P. 1590–1594. https://doi.org/10.1007/BF02886219
Ellert B.H., Janzen H.H. Short-term influence of tillage on CO2 fluxes from a semi-arid soil on the Canadian Prairies // Soil Tillage Res. 1999. V. 50. P. 21–32. https://doi.org/10.1016/S0167-1987(98)00188-3
Gispert M., Emran M., Pardini G., Doni S., Ceccanti B. The impact of land management and abandonment on soil enzymatic activity, glomalin content and aggregate stability // Geoderma. 2013. V. 202–203. P. 51–61. https://doi.org/10.1016/j.geoderma.2013.03.012
Goffin S., Aubinet M., Maier M., Plain C., Schack-Kirchner H., Longdoz B. Characterization of the soil CO2 production and its carbon isotope composition in forest soil layers using the flux-gradient approach // Agric for Meteorol. 2014. V. 188. P. 45–57. https://doi.org/10.1016/j.agrformet.2013.11.005
Guo L.B., Gifford M. Soil carbon stocks and land use change: a meta analysis // Glob. Chang. Biol. 2002. V. 8. P. 345–360. https://doi.org/10.1046/j.1354-1013.2002.00486.x
Hamada Y., Tanaka T. Dynamics of carbon dioxide in soil profiles based on long-term field observation // Hydrol. Process. 2001. V. 15. P. 1829–1845. https://doi.org/10.1002/hyp.242
Hashimoto S., Komatsu H. Relationships between soil CO2 concentration and CO2 production, temperature, water content, and gas diffusivity: implications for field studies through sensitivity analyses // J. For Res. 2006. V. 11. P. 41–50. https://doi.org/10.1007/s10310-005-0185-4
Hooke R.L.B., Martin-Duque J.F., Pedraza J. Land transformation by humans: A review // GSA Today. 2012. V. 22(12). P. 4–10. https://doi.org/10.1130/GSAT151A.1
Houghton R.A., House J.I., Pongratz J., Werf G.R., DeFries R.S., Hansen M.C., Quere C.L., Ramankutty N. Carbon emissions from land use and land-cover change // Biogeosciences. 2012. V. 9. P. 5125–5142. https://doi.org/10.5194/bg-9-5125-2012
Iqbal J., Hu R., Feng M., Lin S., Malghani S., Ali I.M. Microbial biomass, and dissolved organic carbon and nitrogen strongly affect soil respiration in different land uses: A case study at Three Gorges Reservoir Area, South China // Agriculture, Ecosystems and Environment. 2010. V. 137. P. 294–307. https://doi.org/10.1016/j.agee.2010.02.015
Jangid K., Williams M.A., Franzluebbers A.J., Sch-midt T.M., Coleman D.C., Whitman W.B. Land-use history has a stronger impact on soil microbial community composition than aboveground vegetation and soil properties // Soil Biol. Biochem. 2011. V. 43. P. 2184–2193. https://doi.org/10.1016/j.soilbio.2011.06.022
Jassal R., Black A., Novak M., Morgenstern K., Nesic Z., Gaumont-Guay D. Relationship between soil CO2 concentrations and forest-floor CO2 effluxes // Agric for Meteorol. 2005. V. 130. P. 176–192. https://doi.org/10.1016/j.agrformet.2005.03.005
Jong E., Schappert H.J.V. Calculation of soil respiration and activity from CO2 profiles in the soil // Soil Sci. 1972. V. 113(5). P. 328–333.
Kaye J.P., McCulley R.L., Bu I.C. Carbon fluxes, nitrogen cycling, and soil microbial communities in adjacent urban, native and agricultural ecosystems // Glob. Chang. Biol. 2005. V. 11. P. 575–587. https://doi.org/10.1111/j.1365-2486.2005.00921.x
Koerner B., Klopatek J. Anthropogenic and natural CO2 emission sources in an arid urban environment // Environ. Pollut. 2002. V. 116. P. 45–51.
Lal R. Why carbon sequestration in agricultural soils // Agricultural practices and policies for carbon sequestration in soil. Taylor & Francis Group, 2012. P. 21–30.
Li H., Han X., Qiao Y., Hou X., Xing B. Carbon dioxide emission from Black Soil as influenced by land-use change and long-term fertilization // Commun. Soil Sci. Plant. Anal. 2009. V. 40. P. 1350–1368. https://doi.org/10.1080/00103620902761585
Liang G., Wu H., Houssou A.A., Cail D., Wu X., Gao L., Wang B., Li S. Soil respiration, glomalin content, and enzymatic activity response to straw application in a wheat-maize rotation system // J. Soils Sediments. 2017. https://doi.org/10.1007/s11368-017-1817-y
Litton C.M., Ryan M.G., Knight D.H., Stanl P.D. Soil-surface carbon dioxide efflux and microbial biaomass in relation to tree density 13 years after a stand replacing fire in a lodgepole pine ecosystem // Glob Change Biol. 2003. V. 9. P. 680–696. https://doi.org/10.1046/j.1365-2486.2003.00626.x
Lorenz K., Kandeler E. Microbial biomass and activities in urban soils in two consecutive years // J. Plant Nutr. Soil Sci. 2006. V. 169. P. 799–808. https://doi.org/10.1002/jpln.200622001
Lorenz K., Lal R. Biogeochemical C and N cycles in urban soils // Environment International. 2009. V. 35. P. 1–8. https://doi.org/10.1016/j.envint.2008.05.006
Lou Y., Li Z., Zhang T., Liang Y. CO2 emissions from subtropical arable soils of China // Soil Biol. Biochem. 2004. V. 36. P. 1835–1842. https://doi.org/10.1016/j.soilbio.2004.05.006
Mariscal-Sancho I., Santano J., Mendiola M.A., Peregrina F., Espejo R. Carbon dioxide emission rates and ß‑glucosidase activity in Mediterranean Ultisols under different soil management // Soil Sci. 2010. V. 175. P. 453–460. https://doi.org/10.1097/SS.0b013e3181f51704
Mikhalkova E.A., Post C.J. Organic carbon stocks in the Russian Chernozem // Eur. J. Soil Sci. 2006. V. 57. P. 330–336. https://doi.org/10.1111/j.1365-2389.2005.00741.x
Nsabimana D., Haynes R.J., Wallis F.M. Size, activity and catabolic diversity of the soil microbial biomass as affected by land use // Appl. Soil Ecol. 2004. V. 26. P. 81–92. https://doi.org/10.1016/j.apsoil.2003.12.005
Rastogi M., Singh S., Pathak H. Emission of carbon dioxide from soil // Current Science. 2002. V. 82(5). P. 510–517.
Rey A. Mind the gap: non-biological processes contributing to soil CO2 efflux // Glob. Change Biol. 2015. V. 21. P. 1752–1761. https://doi.org/10.1111/gcb.12821
Sarzhanov D.A., Vasenev V.I., Vasenev I.I., Sotnikov Y.L., Ryzhkov O.V., Morin T. Carbon stocks and CO2 emissions of urban and natural soils in Central Chernozemic region of Russia // Catena. 2017. V. 158. P. 131–140. https://doi.org/10.1016/j.catena.2017.06.021
Schlesinger W.H., Andrews J.A. Soil respiration and the global carbon cycle // Biogeochemistry. 2000. V. 48. P. 7–20. https://doi.org/10.1023/A:1006247623877
Subke J.A., Ingima I., Cotrufo M.F. Trends and methodological impacts in soil CO2 efflux partitioning: A metaanalytical review // Glob Change Biol. 2006. V. 12. P. 921–943. https://doi.org/10.1111/j.1365-2486.2006.01117.x
Tate C.M., Striegl R.G. Methane consumption and carbon dioxide emission in tallgrass prairie: effects of biomass burning and conversion to agriculture // Global Biogeochem. Cycles. 1993. V. 7(4). P. 735–748. https://doi.org/10.1029/93GB02560
Wang W.J., Dalal R.C., Moody P.W., Smith C.J. Relationships of soil respiration to microbial biomass, substrate availability and clay content // Soil Biol. Biochem. 2003. V. 35. P. 273–284. https://doi.org/10.1016/S0038-0717(02)00274-2
Weissert L.F., Salmond J.A., Schwendenmann L. Variability of soil organic carbon stocks and soil CO2 efflux across urban land use and soil cover types // Geoderma. 2016. V. 271. P. 80–90. https://doi.org/10.1016/j.geoderma.2016.02.014
Wiaux F., Vanclooster M., Oost K.V. Vertical partitioning and controlling factors of gradient-based soil carbon dioxide fluxes in two contrasted soil profiles along a loamy hillslope // Biogeosciences. 2015. V. 12. P. 4637–4649. https://doi.org/10.5194/bg-12-4637-2015
Xu M., Qi Y. Soil-surface CO2 efflux and its spatial and temporal variations in a young ponderosa pine plantation in northern // California Global Change Biology. 2001. V. 7. P. 667–677. https://doi.org/10.1046/j.1354-1013.2001.00435.x
You M., Yuan Y., Li L., Xu Y., Han X. Soil CO2 emissions as affected by 20-year continuous cropping in Mollisols // J. Integr. Agric. 2014. V. 13(3). P. 615–623. https://doi.org/10.1016/S2095-3119(13)60719-4
Zhao D., Li F., Wang R., Yang Q., Ni H. Effect of soil sealing on the microbial biomass, N transformation and related enzyme activities at various depths of soils in urban area of Beijing, China // J. Soils Sediments. 2012. V. 12. P. 519–530. https://doi.org/10.1007/s11368-012-0472-6
Дополнительные материалы отсутствуют.