Почвоведение, 2019, № 9, стр. 1070-1080
Микробиологические особенности почв торфяных пятен бугристых торфяников севера Западной Сибири
А. В. Якушев 1, *, Г. В. Матышак 1, М. О. Тархов 1, А. В. Качалкин 1, 2, А. Р. Сефилян 1, Д. Г. Петров 1
1 МГУ им. М.В. Ломоносова
119991 Москва, Ленинские горы, 1, Россия
2 Институт биохимии и физиологии микроорганизмов им. Г.К. Скрябина РАН
142290 Московская область, Пущино, пр-т Науки, 5, Россия
* E-mail: a_yakushev84@mail.ru
Поступила в редакцию 13.06.2018
После доработки 12.12.2018
Принята к публикации 27.03.2019
Аннотация
Своеобразный торфяно-деструктивный горизонт почв оголенных торфяных пятен бугристых торфяников севера Западной Сибири (Tmd) отличается от торфяных горизонтов типичной торфяной почвы большей плотностью, влажностью и диспергированностью, меньшей микробной биомассой, низкой минерализационной и гидролазной активностью, низким физиологическим разнообразием трофически неспециализированного гидролитического бактериального блока и особым видовым составом грибного блока с нехарактерно высокой долей и обилием психрофильных дрожжей Leucosporidium drummii. Схожие в горизонте Tmd и торфяных горизонтах типичной почвы удельная дыхательная и гидролазная активности указывают на сохранение метаболической активности у микроорганизмов пятна, разлагающих органическое вещество торфа и увеличивающих тем самым степень его разложения.
ВВЕДЕНИЕ
Формирование и трансформация органического вещества почв торфяников требует детального изучения из-за их широкого распространения, значительных запасов органического вещества, а также возможного значительного влияния на климат [6]. В теории торфообразовательного процесса ведущее место отводится вопросам превращения растительных остатков в торф, происхождению органической и минеральной частей в торфах и их трансформации, процессам накопления, превращения и передвижения веществ в торфяном профиле, раскрытию форм их аккумуляции и миграции [7]. Большинство этих процессов осуществляется при участи микроорганизмов.
В Западной Сибири торфяные болота занимают местами до 80% площади [11]. Малоизученное преобразование торфа в этом регионе носит усложненный характер из-за разномасштабных и разновременных криогенных процессов. В результате криогенного пучения здесь широко распространены плоско- и крупнобугристые торфяники, в которых торфяные почвы активно трансформируются как в результате смены условий почвообразования, так и под действием различных криогенных процессов, прямо или косвенно определяющих характер и интенсивность почвообразования [12]. Бугристые торфяники – распространенная форма мерзлотного рельефа, состоящая из мерзлых торфяных бугров и разделяющих их переувлажненных понижений (мочажин). Высота плоских бугров 1–1.5 м, крупные бугры достигают высоты 3–5 м и более, конфигурация бугров бывает разнообразная – округлая, грядообразная, лопастная, и может занимать площадь от единиц и нескольких десятков до сотен квадратных метров [16]. В их пределах в отличие от окружающих болотных ландшафтов развиваются участки с условиями, благоприятствующими минерализации и трансформации торфяных отложений. В результате поднятия болотных массивов из-за криогенного пучения, почвы могут развиваться в полугидроморфных и даже в автоморфных условиях. Совокупность криогенных процессов и изменение гидротермических условий обусловливает развитие здесь специфических почвенных горизонтов и вариантов торфяных почв, в том числе торфяно-деструктивных почв торфяных пятен (ПТП). Они встречаются на вершинах и склонах бугристых торфяников и отличаются многолетним отсутствием растительного покрова на поверхности. Однозначный механизм образования торфяных пятен не установлен, однако существует несколько гипотез их возникновения, в которых основными причинами рассматриваются как по отдельности, так и в совокупности: иссушение, корразия, дефицит биофильных элементов, криогенное пучение [3, 15, 26, 31]. Несомненным является отличие параметров функционирования ПТП от окружающих почв в результате отсутствия растительного покрова. В связи с этим вопрос специфичности данного местообитания для микроорганизмов является ключевым в данной работе. Служит ли пятно особым местообитанием в таксономическом плане для микроорганизмов или нет? Можно ли считать ПТП местообитанием с повышенной или пониженной микробиологической активностью? Не ясно, является ли ПТП особым местообитанием для дрожжей и мицелиальных грибов? Вопрос особо интересен в рамках представления о микроочаговом характере распространения микроорганизмов северных территорий. Тем более, что информации о микробиологических особенностях ПТП крайне мало. Установлена повышенная по сравнению с прилегающими почвами эмиссия закиси азота, указывающая на интенсивную денитрификацию в торфяных пятнах в весенний период [26].
Цель исследования – выяснить специфику функционирования микробного сообщества деструктивного горизонта почв торфяных пятен бугристых торфяников северной тайги. В задачи исследования входило: сравнить микробную биомассу в ПТП и в почве под растительностью (в фоновой почве (ФП) бугристого торфяника); установить разницу в потенциальной гидролитической активности микробных сообществ по эстеразной активности; оценить катаболическую (минерализационную) активность микроорганизмов; установить особенности таксономического состава грибного блока в ПТП и ФП; оценить физиологическое разнообразие и трофическую специализацию гидролитического бактериального блока.
ОБЪЕКТЫ
Район исследования расположен на севере Западной Сибири (Надымский район, Тюменская область, ЯНАО; 65°20′ N, 72°55′ E) на северном пределе распространения тайги, в краевой части III озерно-аллювиальной равнины р. Надым, на междуречье рек Хейгияха–Левая Хетта. Территория относится к зоне прерывистого распространения многолетнемерзлых пород, которые приурочены к торфяникам, торфяным болотам и буграм пучения [10]. Для района характерны суровые климатические условия: продолжительный зимний период, низкие среднегодовые температуры воздуха (–5°С), количество осадков от 450 до 650 мм/год.
Наибольшее распространение получили автоморфные лесные экосистемы, в которых многолетнемерзлые породы отсутствуют, и гидроморфные экосистемы, представленные как собственно олиготрофными болотами, так и специфическими вариантами мерзлых плоскобугристых и крупнобугристых торфяников с расположением многолетнемерзлых пород на глубине 1–2 м [10]. На бугристых торфяниках развиты кустарничково-багульниково-лишайниковые и кустарничково-багульниково-сфагновые сообщества, на болотах распространены пушицево-осоково-сфагновые и кустарничково-осоково-моховые фитоценозы [13]. Почвообразующие породы преимущественно песчаные и супесчаные с линзами легкого и среднего суглинка.
На исследуемой территории оголенные торфяные пятна являются характерным элементом поверхности торфяников. Как правило они располагаются небольшими группами на вершинах и в верхних частях склонов бугристых торфяников, имеют овальную или округлую форму, площадью до 25 м2, и легко диагностируются по отсутствию растительного покрова. Исследованные торфяные пятна представляли из себя расположенную на площади более 100 м2 сеть круглых микропонижений (глубиной 5–10 см и 0.5–1 м диаметром), окруженных развитым растительным покровом, и располагались в средней, выположенной части склона торфяника. Для них характерна своеобразная структура поверхности с неровностями 2–5 см высотой и большим количеством крупных вертикальных трещин. В ряде оголенных торфяных пятен были обнаружены погребенные прослои свежей растительности. Все эти явления обусловлены, вероятно, активно идущими в торфяных пятнах криогенными процессами пучения, растрескивания и образования стебелькового льда, трансформирующими (турбирующими) поверхность торфяных пятен. Об этом свидетельствуют также встречающиеся на исследованных торфяных пятнах погибшие растения и их разорванные корни [23].
В пределах одного бугристого торфяника в качестве объекта исследований выбраны торфяные олиготрофные деструктивные почвы (Sapric Cryic Histosols) оголенных торфяных пятен – ПТП (рис. 1) и фоновые почвы– торфяные олиготрофные остаточно эутрофные (Fibric Cryic Histosols), развивающиеся под типичным растительным покровом. Детальные описания их морфологии и параметров функционирования даны в предыдущей работе [15].
Рис. 1.
Типичное торфяное пятно без растительного покрова (А) и бугристый торфяник с сетью торфяных пятен (Б).

Для ФП характерна большая мощность торфяной толщи (более 1 м), наличие в верхней части профиля современного слаборазложенного олиготорофного торфяного горизонта, переходный или низинный тип торфа в нижней части профиля, сильное разложение нижних торфяных горизонтов, высокое содержание общего углерода и азота (до 50 и 2.5% соответственно). Основным отличием ПТП является отсутствие верхнего современного торфяного горизонта. Верхний горизонт представлен оземляющимся, сильноизмельченным (гомогенным), с высокой степенью разложения торфяно-деструктивным горизонтом (Tmd) неопределенного ботанического состава. Под влиянием комплекса криогенных и эрозионных процессов в ПТП идут выраженные процессы деструкции и преобразования верхней части торфяного профиля. Результатом их действия является разрушение верхнего современного торфяного горизонта (аналогичного гор. Т1 в ФП) и активная физическая и биохимическая трансформация нижележащих торфяных горизонтов с формированием специфического горизонта Tmd.
Профиль ПТП имеет следующий тип строения: Tmd–TT:
Tmd, 0–7 см. Коричневый, сильноизмельченный, рыхлый, мелкопористый, влажный (верхние 1–2 см иногда иссушены), корней нет. Слабовыраженная комковатая структура, которая при незначительном механическом воздействии рассыпается/размазывается в однородную, гомогенную, оземляющуюся массу неопределенного ботанического состава. Заметно небольшое количество среднеразложенных растительных остатков (2–3 мм), равномерно распределенных по горизонту. Переход постепенный, граница карманная.
Т1, 8–25 см. Темно-коричневый, сильноразложенный, мелкопористый, плотный, слабослоистый, неопределенного ботанического состава, влажный, редкие корни, много вертикальных трещин до 2 см шириной, заполненных однородным, гомогенным сильноразложенным темно-коричневым торфом. Переход постепенный, граница карманная.
Т2, 26–45 см. Темно-коричневый, сильноразложенный, содержит березовые остатки (кусочки коры, щепки 1–10 см), сильнослоистый, плотный, влажный, корней нет, много вертикальных трещин до 1 см шириной, заполненные однородным, гомогенным, сильноразложенным темно-коричневым торфом. Переход постепенный, граница волнистая.
ТT┴, 46–60 см – коричневый, среднеразложенный, содержит еще больше по сравнению с вышележащим горизонтом березовых остатков, слоистый, плотный, мокрый, корней нет. Переходит в плотный, мерзлый торфяный горизонт аналогичного состава, льдистостью более 30%.
Отсутствие растительного покрова определяет отличия в параметрах функционирования ПТП. Сезонно-талый слой ПТП более развит, чем под ФП, и в среднем составляет 60–65 см (40–50 см под ФП), обусловливая формирование под ПТП локальных понижений уровня залегания многолетнемерзлых пород и повышенную влажность нижней части профиля. В предыдущих работах показано, что для ПТП характерны более высокие экстремумы и среднегодовые температуры [15]. Летние и зимние экстремумы, среднегодовая температура на глубине 10 см в профиле ПТП (+0.3°C) выше, чем в профиле ФП (–0.3°C). ПТП характеризуются высокой степенью разложения торфа во всем профиле, объемная масса торфа ПТП в среднем выше, чем в ФП (табл. 1).
Таблица 1.
Полимеры, используемые в качестве источника органического вещества в селективных средах
| Полимер | Происхождение | Легкость разложения |
|---|---|---|
| Кератин порошковый | Животное | Трудно |
| Хитин порошок для приготовления коллоидного | Животное и грибное | Трудно |
| Целлюлоза порошковая (0.1–0.25 мкм) | Растительное | Трудно |
| Пектин лимонный | Растительное | Легко |
| Крахмал растворимый | Растительное | Легко |
| Ксилан березовый | Растительное | Легко |
| Инулин | Растительное | Легко |
| Декстран 500 хроматограф | Бактериальное | Легко |
| Агароза легкоплавкая | Водоросли | Трудно |
| Твин 20 | Общее | Легко |
| Казеин по Гаммерстену | Общее | Легко |
| Нуклеиновая кислота | Общее | Легко |
В данной работе изучены торфяные гор. Tmd и Т2 ПТП и аналогичные им по глубине залегания гор. T1 и T2 ФП, развитых под растительностью на непосредственно прилегающих к оголенным торфяным пятнам участках бугристого торфяника.
МЕТОДЫ ПОЛЕВЫХ ИССЛЕДОВАНИЙ
В августе 2014–2017 г. на бугристых торфяниках изучено более 20 почвенных разрезов под торфяными пятнами и под растительным покровом в непосредственной близости от пятен. Названия почв и почвенных горизонтов даны по классификации почв России [9]. Температурные наблюдения проводили с использованием термозондов и логгеров Thermochron iButtonTM. Глубину протаивания измеряли методом зондирования щупом (ГОСТ 26262-2014). Эмиссия диоксида углерода с поверхности почв в полевых условиях измерялась в августе 3 раза в день в одно и то же время с пятикратной повторностью в течение 10 дней методом закрытых камер [17]. Концентрацию газов определяли портативным газоанализатором с инфракрасным датчиком RMT DX6210.
Образцы почв естественной влажности отбирали по горизонтам в полиэтиленовые пакеты и доставляли в лабораторию, где хранили при температуре +4°С до начала экспериментов. Степень разложения торфяных образцов определяли в полевых условиях по методике фон Поста [27]. Содержание сырой золы и ${\text{p}}{{{\text{H}}}_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}}$ изучали стандартными методами (соотношение торф : : раствор 1 : 25) [4]. Влажность определяли термогравиметрически на приборе OHAUS MB. Содержание Собщ, Nобщ исследовали на элементном анализаторе Vario El III (Elementar).
Измерение минерализационной активности микроорганизмов
В лабораторных условиях измеряли минерализационную активность микроорганизмом по скорости базального дыхания (Vbasal) гомогенизированных (2 мм) образцов торфа естественной влажности. Образцы инкубировали 24 ч в герметично закрывающихся флаконах объемом 125 мл при +22°С, после предынкубации при температуре +22°С в течение недели. Vbasal, мкг С–СО2/(ч г почвы) определяли по формуле:
Метаболический коэффициент, qCO2, мкг С–СО2/(мкг Сбиомассы ч), характеризующий удельную дыхательную активность микроорганизмов, рассчитывали по формуле qCO2 = $\frac{{{{V}_{{{\text{basal}}}}}}}{{{{{\text{C}}}_{{{\text{mic}}\,\,{\text{SIR}}}}}}}.$
Определение почвенной биомассы микроорганизмов
Углерод биомассы почвенных микроорганизмов CmicSIR, мкг Сбиомасы/г почвы определяли методом субстрат-индуцированного дыхания [1] и методом фумигации-экстракции (Cmic F-E). Скорость субстрат-индуцированного дыхания, VSIR, мкг С–СО2/(ч г почвы), определяли в закрытых флаконах (125 мл) через 3 ч после внесения 0.1 мл раствор глюкозы (концентрация 10 мг/г почвы) в образцы почвы, предынкубированные в течение недели при 22°С. VSIR рассчитывали по той же формуле, что и Vbasal. Полученное значение пересчитывали на Сmic SIR по формуле: Сmiс SIR = VSIR × × 40.04 + 0.37 [2].
Определение эстеразной активности
В качестве субстрата ферментативной реакции выбрали 3',6'-диацетат флюоресцеина (ФДА) [24] для 1) неспецифических эстераз, 2) липаз – расщепляющих жиры с образованием глицерина и жирных кислот, 3) ацетилэстераз – использующих в качестве субстратов сложные эфиры уксусной кислоты. Бесцветный ФДА в результате реакции деэтерификации переходит во флюоресцеин желтого света, концентрация которого определяется колориметрически. В работе была использовали методику [19]. Скорость гидролиза ФДА рассчитывали по формуле:
где VФДА– скорость реакции, нмоль флюоресцеина/(г почвы ч); с – концентрация флюоресцеина, нмоль л; v – объем приливаемого к навеске дистиллированной воды, л; t – время инкубации, ч; m – навеска исследуемой почвы в пересчете на абсолютно сухое вещество, г. Среди различных способов определения гидролазной активности метод, основанный на реакции ферментативного гидролиза ФДА, привлекает простотой, экспрессностью и связью с активной микробной биомассой. Показана [28, 29] зависимость между биомассой микроорганизмов в субстрате и VФДА. Поскольку образование флюоресцеина в растворе связано с активностью не только экзоферментов, но и мембранно-закрепленными ферментов микроорганизмов [30], то скорость гидролиза может служить характеристикой общей гидролитической активности почвы и активной гетеротрофной микробной биомассы. Удельную гидролазную активность (qFDA, нмоль флюоресцеина/(мкг Сбиомассы ч)) [32] определяли по формуле qFDA = $\frac{{{{V}_{{{\text{Ф Д А }}}}}}}{{{{C}_{{{\text{mis}}\,\,{\text{SIR}}}}}}}.$Определение концентрации грибных спор и мицелия в почве
Использовали модернизированный вариант методики [14]. Помещали 1 г почвы в пробирку с 10 мл стерильной воды. Для десорбции клеток суспензию встряхивали на лабораторном встряхивателе типа “Вортэкс” при 2000 об./мин, в течение 20 мин. Затем микропипеткой наносили 0.01 мл суспензии на обезжиренное предметное стекло и равномерно распределяли петлей на площади 4 см2. Для одного образца готовили по 6 препаратов. Далее препараты высушивали при комнатной температуре, а затем фиксировали легким нагреванием над пламенем газовой горелки. Готовые препараты окрашивали 2–4 мин водным раствором (1 : 10 000) акридина оранжевого. Избыток красителя удаляли промыванием препарата в воде. Окрашенные препараты высушивали при комнатной температуре и просматривали на люминесцентном микроскопе “Биомед 6 пр. Люм” (возбуждающий светофильтр с длиной света пропускания 455 нм, объектив ×40). Подсчитывали число грибных спор и измеряли длину обрывков грибного мицелия (мкм). На каждом препарате для учета просматривали по 100 полей зрения. Концентрацию спор N в 1 г почвы вычисляли по уравнению:
где S1 – площадь препарата, мкм2; а – среднее арифметическое число спор в поле зрения; n – показатель разведения суспензии, мл; v – объем капли, наносимой на стекло, мл; S2 – площадь поля зрения микроскопа, мкм2; с – масса образца, г. Длину грибного мицелия L в 1 г образца определяли по уравнению: L = S1ln/vS2c × 106, где l – средняя длина обрывков грибного мицелия в поле зрения, мкм.Обилие и таксономический состав грибного сапротрофного блока
Таксономический состав грибного блока определяли методом микробиологического посева на глюкозо-пептонно-дрожжевую среду с хлорамфениколом – для подавления роста бактерий [14]. Для посева использовали почвенную суспензию, в которой десорбцию клеток с поверхности почвенных частиц проводили на лабораторном встряхивателе типа “Вортэкс” при 2000 об./мин в течение 20 мин. Посевы инкубировали в интервале температур +1…+2°С в течение 4 мес., чтобы приблизиться к естественным температурным условиям исследуемых почв. Обилие грибных зачатков выражали в колониеобразующих единицах (КОЕ) на 1 г почвы. Идентификацию выделенных в чистую культуру штаммов до рода (некоторых грибов до вида) проводили по результатам секвенирования нуклеотидных последовательностей фрагмента гена ITS1-5.8S-ITS2 рРНК по методике, описанной ранее [8], с последующим анализом, используя данные генбанка NCBI (ncbi.nlm.nih.gov) и базы данных MycoID (www.mycobank.org).
Изучение физиологического разнообразия и трофической специализации гидролитического бактериального блока
Сравнение трофической специализации и физиологического разнообразия ключевого для разложения растительных остатков гидролитического бактериального блока ПТП и ФП проводили комплексным структурно-функциональным методом [18]. Метод не исследует микроорганизмы на классических для почвенной микробиологии уровнях изучения: операционных таксономических единицах, целых сообществах или биохимических процессах, проводимых микробным комплексом. Вместо этого он изучает неисследованные ранее, временно возникающие в микролокусе из пула микроорганизмов ассоциации (смешанные культуры), которые непосредственно осуществляют большинство процессов в природе. В “комплексном методе” эти консорции микроорганизмов воссоздаются посредством создания инициированных сообществ в лабораторных микрокосмах после внесения суспензии исследуемого природного сообщества в набор селективных жидких питательных сред. При этом анализируются кинетические параметры сукцессионных изменений, возникающих в инициированных сообществах. Поскольку сукцессия сообществ происходит в более контролируемых условиях, чем в классических почвенных инициированных сообществах, то ее можно представить как рост и отмирание смешанной периодической культуры, описываемой классическими кинетическими параметрами: микробным экономическим коэффициентом, максимальной удельной скоростью роста, метаболическим коэффициентом и т. д. На основе этих кинетических параметров выводятся интегральные показатели, по которым различаются между собой исследуемые природные сообщества. Если эти интегральные показатели позволяют отличать разные природные сообщества для большого числа образцов, то они имеют биологический смысл. В данной работе исследуются инициированные бактериальные сообщества, содержащие аэробные и факультативно-анаэробные культивируемые микроорганизмы, использующие как труднодоступные, так и легкодоступные полимеры (филумы Cytophaga-Flavibacterium-Bacteroides, Firmicutes, Proteobacteria, Actinobacteria). В эти ассоциации входят не только гидролитические бактерии, но и их спутники, представленные как копиотрофами, так и олиготрофами. Для формирования подобных сообществ использовали 12 жидких селективных питательных сред, содержащих антигрибные антибиотики нистатин и циклогексимид, в которые в качестве единственного источника углерода вносили биополимеры (табл. 1).
По кривым роста инициированных сообществ рассчитывали микробный экономический коэффициент Y, кл./гполимера инициированных гидролитических бактериальных сообществ на питательных средах по формуле Y = $\frac{{{{x}_{m}} - {{x}_{0}}}}{{{{s}_{0}}}},$ где xm – x0 – урожай бактерий на питательной среде с полимерами, s0 – исходная концентрация полимеров в среде 2.5 г/л, xm – максимальная концентрация клеток, достигаемая на питательной среде, x0 – исходная концентрация “культивируемых” бактерий в инокулируемой суспензии, которую определяли методом посева исходной почвенной суспензии на агаризованную глюкозо-пептонно-дрожжевую среду.
Анализ Y методом главных компонент большого массива данных для бактериальных сообществ различных типов почв [20] выявил два интегральных параметра, объясняющих 64% дисперсии Y для этого массива данных: $\overline Y $ – среднеарифметическое значение Y на всех 12 средах с полимерами, ${{\overline Y }_{{{\text{р а з н }}}}}$ – разность средних Y на средах с труднодоступными (хитин, целлюлоза, агароза, кератин) и легкодоступными (декстран, инулин, пектин, ксилан, крахмал, твин 20, казеин) полимерами. Когда Y высок – микроорганизмы эффективно усваивают полимер, и продуктивность инициированных гидролитических сообществ высока на среде с тем или иным полимером. Большая продуктивность обусловлена большим биоразнообразием инициированных сообществ. Это возможно в том случае, когда в исходном природном бактериальном комплексе есть физиологически разнообразные гидролитики, которые могут расти, разлагая полимер в различных условиях окружающей среды, в том числе в селективных условиях жидких питательных сред, использованных в работе. Таким образом, $\overline Y $ – показатель физиологического разнообразия, а разность Y на разных средах с полимерами $\left( {{{{\overline Y }}_{{{\text{р а з н }}}}}} \right)$ отражает трофическую специализацию гетеротрофных бактерий природного сообщества.
Математическую обработку данных выполняли в программе Statistica 8.0. Результаты статистической обработки представлены в виде средних арифметических ± доверительный интервал (при р = 0.95). Для вычисления доверительных интервалов у частного двух величин А/В (например, отношения С/N в почве), ошибку частного рассчитывали по формуле:
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Химические свойства горизонтов
Исследуемые торфяные почвы, в целом, обладают свойствами, характерными для района исследований [12]. Отличительной чертой торфяных профилей изученных почв являются существенные отличия верхней части профиля: верхних гороризонтов ФП (Т1) и ПТП (Tmd), при схожей нижней части профиля. В гор. T1 минимальные величины разложения растительных остатков и плотности, меньше содержание общего и лабильного углерода и азота и выше соотношение С/N, что указывает на его современное образование в олиготрофных условиях (табл. 2). Гор. Tmd, наоборот, характеризуется максимальным разложением, степенью измельчения торфяных частиц, плотностью, он наиболее кислый и по своим свойствам ближе к нижним горизонтам (Т2). Отличия в его свойствах обусловлены разницей в параметрах функционирования, а также активно идущими в ПТП процессами иссушения/увлажнения и криогенеза, более выраженными из-за отсутствия защитного растительного покрова.
Таблица 2.
Химические свойства торфяных горизонтов изученных почв
| Горизонт | Степень разложения (по Фон–Посту) | Влажность массовая, % | Плотность, г/см3 | Зольность, % | ${\text{pH}}\,\,{{{\text{H}}}_{{\text{2}}}}{\text{O}}$ | Собщ, % | Nобщ, % | С/N | Слов, мкг/г |
|---|---|---|---|---|---|---|---|---|---|
| Торфяная деструктивная почва | |||||||||
| Tmd | 7.7 ± 1.1 | 267 ± 119 | 0.18 ± 0.05 | 8 ± 3 | 3.5 ± 0.3 | 49 ± 3 | 2.5 ± 0.5 | 20 ± 2 | 1001 ± 265 |
| T2 | 6.7 ± 1.6 | 326 ± 91 | 0.17 ± 0.04 | 7 ± 4 | 3.6 ± 0.3 | 51 ± 2 | 2.5 ± 0.3 | 20 ± 3 | 1201 ± 178 |
| Остаточно-эутрофная почва | |||||||||
| T1 | 4.4 ± 2.0 | 195 ± 11 | 0.05 ± 0.07 | 10 ± 5 | 3.7 ± 0.2 | 41 ± 6 | 1.6 ± 0.4 | 26 ± 4 | 743 ± 108 |
| Т2 | 7.2 ± 0.6 | 305 ± 62 | 0.17 ± 0.08 | 8 ± 7 | 4.0 ± 0.5 | 51 ± 7 | 2.7 ± 0.6 | 20 ± 2 | 1404 ± 355 |
Биомасса и минерализационная активность микроорганизмов
Особенности формирования ПТП отражаются как на их физико-химических свойствах, так и на их биологической активности. Так, эмиссия СO2, являясь интегральным показателем, отражает естественную биологическую активность почв в целом, и для ПТП в среднем в 2 раза меньше, чем для ФП (71.1 ± 58.2 и 155.3 ± 68.6 мг CO2/(м2 ч) соответственно). Это обусловлено не только меньшим вкладом дыхания корней растений в продукцию СO2 в ПТП, но и низкой микробиологической активностью торфяных горизонтов ПТП. Это подтверждает тот факт, что Vbasal в гор. Tmd существенно меньше, чем в T1 ФП (табл. 3). Сmic SIR и Cmic F-E в Tmd также ниже, чем в T1. По биомассе и минерализационной активности гор. Tmd ближе к гор. T2.
Таблица 3.
Биомасса и минерализационная активность гор. Tmd, T1 и T2
| Горизонт | Vbasal, мкг С–СО2/(ч г почвы) | Cmic SIR, мкг С/г почвы |
Cmic F-E, мкг Сбиомассы/г почвы |
qFDA, нмоль флюоресцеина/Cmic F-E | qCO2, мкг С–СО2/(мкг Cmic SIR ч) |
|---|---|---|---|---|---|
| Торфяная деструктивная почва | |||||
| Tmd | 1.9 ± 0.3 | 197.6 ± 32.2 | 1267 ± 642 | 0.4 ± 0.2 | 0.7 ± 0.1 |
| T2 | 2.3 ± 0.3 | 235.5 ± 33.2 | 1336 ± 1517 | 0.04 ± 0.03 | 0.7 ± 0.2 |
| Остаточно-эутрофная почва | |||||
| Т1 | 5.0 ± 0.2 | 456.8 ± 32.6 | 2597 ± 1001 | 0.3 ± 0.1 | 0.8 ± 0.2 |
| T2 | 2.8 ± 0.5 | 372.1 ± 50.9 | 821 ± 807 | 0.05 ± 0.02 | 0.5 ± 0.1 |
При этом величины метаболических коэффициентов, рассчитанных как удельная дыхательная активность, схожи для всех горизонтов. Близкие значения qCO2 в гор. Tmd и T1 можно объяснить тем, что микроорганизмы в гор. Tmd специализируются в большей степени на разложении органического вещества торфа, в то время как в гор. T1 – на разложении растительных остатков. Это также может быть причиной максимального преобразования (разложения) торфа в гор. Tmd. По профилю ПТП величины Vbasal и Сmic распределены относительно равномерно. Для ФП характерны высокие значения Vbasal и Сmic олиготрофного гор. T1 и снижение значений к гор. T2.
Гидролитический потенциал микробного комплекса
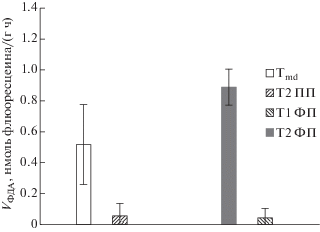
Участвуя в реакциях гидролитического распада высокомолекулярных соединений, эстеразы играют важную роль в снабжении микроорганизмов легкоусваиваемыми продуктами гидролиза. Поэтому данные по определению эстеразной активности можно рассматривать как интегральный показатель гидролитической активности микроорганизмов [28, 29]. Эстеразная активность ПТП и ФП очень низка (рис. 2). Так, эстеразная активность лиственного опада (Московская область) составляет по нашим данным порядка n × × 102 нмоль флюоресцеина/(г почвы ч). Можно утверждать о снижении эстеразной активность вниз по профилю в ПТП и ФП. Более низкая величина эстеразной активности гор. Tmd по сравнению с гор. Т1 связана с небольшой (из-за отсутствия растительности на ПТП) величиной поступления растительных остатков – основного пищевого субстрата для гидролитических микроорганизмов.
Низкая микробиологическая активность ПТП (по Vbasal и VФДА) может быть вызвана тем, что гор. Tmd отличается меньшей величиной Сmic. Однако qFDA для микроорганизмов гор. Tmd и T1 близко (табл. 3). Таким образом, гидролазная активность микроорганизмов гор. Tmd направлена на медленное разложение органического вещества торфа, а не растительных остатков как в гор. T1. Вероятно, подобные особенности возникли, за счет кумулятивного эффекта гидротермических условий, свойств субстрата и активного течения криогенных процессов.
Обилие грибных спор и грибного мицелия
Грибных спор и дрожжеподобных клеток существенно больше в верхних гор. Tmd и T1, чем в нижних гор. T2 (табл. 4). Скорее всего, споры попадают на поверхность гор. Tmd с прилегающей территории, покрытой растительностью, и захораниваются при активизации криогенных процессов (криотурбаций, растрескивания). Грибной мицелий, окрашенный акридином оранжевым (с цитоплазмой внутри клеток), встречается на регистрируемом уровне только в гор. T1, что связано с поступлением растительных остатков – благоприятного пищевого субстрата для грибов.
Таблица 4.
Концентрация грибных спор и мицелия в почве
| Горизонт | Концентрация спор и дрожжеподобных клеток, 105 кл./г почвы | Длина грибных гиф, м/г почвы |
|---|---|---|
| Торфяная деструктивная почва | ||
| Tmd | 43.2 ± 4.3 | – |
| T2 | 0.7 ± 0.4 | – |
| Остаточно-эутрофная почва | ||
| T1 | 81.4 ± 5.2 | 183.4 ± 24.6 |
| T2 | 0.5 ± 0.2 | – |
Примечание. Здесь и в табл. 5 прочерк – не регистрировали.
Таксономический состав грибного комплекса
Исследования, проведенные на образцах, отобранных в августе 2015, 2016 и 2017 гг., дали стабильные результаты (несмотря на значительные отличия в климатических условиях: температуре воздуха и количестве осадков). В горизонтах ФП выявляются преимущественно светлоокрашенные мицелиальные грибы на уровне 105 КОЕ/г почвы в гор. T1 и 104 КОЕ/г почвы в гор. T2 (табл. 5). Все культуры – очень медленно растущие: на 5–6 сут роста при 26–28°C колонии достигают в диаметре всего около 40 мм (возможно это связано с их психротолерантностью). В гор. T1 и T2 встречаются фитопатогенные оомицеты из рода Pythium. В гор. T1 преобладает патогенный для почвенных нематод вид Pochonia sp. (99% сходства с P. bulbillosa и P. goniodes), являющийся анаморфой рода Metacordyceps, а также Calycellina sp. (97–98% сходства с С. herbarum и C. populina) – пока неописанный вид, но регистрируемый ранее при метагеномных исследованиях корней Phyllodoce aleutica в Японии; альпийской почвы в зоне тундры в Скалистых горах в США; почв Мичигана и Канады (данные генбанка NCBI). Известные представители Calycellina образуют макроскопические плодовые тела и являются активными деструкторами растительных остатков. Дрожжевые грибы (Aureobasidium pullulans) регистрируются единично.
Таблица 5.
Таксономический состав грибного блока исследованных горизонтов почв
| Вид гриба | Доля в грибном блоке, % | |||
|---|---|---|---|---|
| ПТП | ФП | |||
| Tmd | T2 | Т1 | Т2 | |
| Aerobasidium pullulans | – | – | 3 | – |
| Aspergillus oryzae | – | 40 | – | – |
| Aspergillus sp. | – | 7 | – | 11 |
| Calycellina sp. | – | – | 24 | – |
| Catenulifera sp. | 0.4 | – | – | – |
| Cladosporium cladosporioides | – | – | 5 | – |
| Geotrichium sp. | – | 7 | – | – |
| Lenzytes betulinus | 1 | – | – | – |
| Leucosporidium drummii | 89 | 7 | – | – |
| Mortierella sp. | – | 27 | – | 8 |
| Myriangium sp. | 3 | – | – | – |
| Oidiodendron sp. | 1 | – | – | – |
| Paecilomyces sp. | – | 13 | – | – |
| Penicillium chrysogenum | 3 | – | 7 | 10 |
| Penicillium purpurascens | 0.7 | – | 4 | 5 |
| Penicillium sp. | – | – | 10 | 16 |
| Pythium sp. | – | – | 10 | 14 |
| Pythium elongatum | – | – | 3 | – |
| Pythium nayoroense | – | – | 3 | 17 |
| Pytium rostratum | – | – | 3 | 20 |
| Pochonia sp. | – | – | 31 | – |
| Rhizoscyphus ericae | 1 | – | – | – |
| Tolypocladium sp. | 2 | – | – | – |
| Vishniacozima victoriae | 1 | – | – | – |
Обособленный грибной комплекс наблюдается в гор. Tmd ПТП – преобладает один психрофильный вид (некоторые из выделенных штаммов не росли при 22–25°С) дрожжевых грибов – Leucosporidium drummii [33] (100% сходство) на уровне 105 КОЕ/г почвы, его обилие снижается в гор. T2 до 103 КОЕ/г почвы (табл. 5). Это только четвертый (после почв Германии, литорали Белого моря и почв Альп Италии) случай выделения данного вида в природе [25, 33]. В гор. Tmd обнаружен неописанный дрожжеподобный гриб Myriangium sp., зарегистрированный исследователями ранее только единично в Бразилии (100% сходство с Myriangium sp. UFMG-BRO197). Из дрожжей также встречается широко распространенный в Антарктике и Арктике психрофильный вид Vishniacozyma victoriae, выделенный ранее из мхов, лишайников и почв, а также представитель еще неописанного вида Catenulifera sp. (сходство 96% с Catenulifera brachyconia). Мицелиальные грибы в гор. Tmd и T2 ПТП учитываются на уровне 103 КОЕ/г почвы. В Tmd из мицелиальных грибов наиболее многочисленно был представлен Tolypocladium sp. (100% сходство с T. inflatum и T. sinense). Анаморфа этого гриба обитает в почве, в то время как его телеоморфа – Elaphocordyceps – является энтомопатогенными грибом. Обилие представителей Tolypocladium и Pochonia подтверждает установленную ранее [22] отличительную черту северных олиготрофных торфяных почв – обилие патогенных для беспозвоночных животных грибов. Также из гор. Tmd выделился Rhizoscyphus sp. (сходство 98% с R. ericae), формирующий эрикоидную микоризу с вересковыми кустарничками. Выявлен Oidiodendron sp. (99% сходство c O. tenuissimum и O. rhodogenum). O. tenuissimum – широко распространенный вид, встречающийся в основном в почвах и разлагающий растительные остатки в холодных и кислых местообитаниях, в том числе и торфах. O. rhodogenum образует эрикоидную микоризу на корнях вересковых [21]. Еще одна необычная черта гор. Tmd заключается в том, что в 2015 г. в нем был выделен базидиомицет – Lenzites betulinus (99% сходство) – широко распространенный в природе березовый трутовик. Колонии этого медленнорастущего, не характерного для торфов гриба, развиваются только на третьем месяце низкотемпературной инкубации; для колоний этого гриба характерно образование очень сильно ветвящегося мицелия, склонного к обильному образованию хламидоспор.
Доминирование в гор. Tmd ПТП дрожжевых и дрожжеподобных грибов в составе грибного блока обусловлено, вероятно, большей плотностью горизонта, высокой влажностью и постоянными активными криотурбационными процессами, рвущими грибные гифы и тем самым угнетающими мицелиальные грибы. Видимо, именно в одноклеточной форме грибам легче приспосабливаться к условиям интенсивных криогенных процессов. Обнаруженная прямым методом высокая численность спор грибов и дрожжеподобных клеток при отсутствии мицелия также является доказательством этого предположения (табл. 4).
Физиологическое разнообразие и трофическая специализация гидролитического бактериального блока
Наиболее физиологически разнообразен (наибольшие значения) гидролитический бактериальный блок гор. T1, так как именно в этот горизонт наиболее интенсивно поступают биополимеры вместе с растительными остатками (рис. 3). Гидролитические микроорганизмы в гор. T1 в наибольшей степени вовлечены в разложение растительных биополимеров. Менее физиологически разнообразны гор. T2 ФП и ПТП. По всей видимости, бактерии в этих горизонтах разлагают законсервированные растительные биополимеры торфа. Наименее физиологически разнообразен гидролитический бактериальный блок гор. Tmd, в котором почти не осталось биополимеров растительных остатков из-за отсутствия растительности на торфяном пятне и сильного разложения торфа. Поэтому микроорганизмы, скорее всего, специализируются на разложении сложных гуминовых и прогуминовых веществ. Трофическая специализация в бактериальном гидролитическом блоке выражена слабо из-за неблагоприятных условий для активности гидролитических микроорганизмов: по ${{\bar {Y}}_{{{\text{р а з н }}}}}$ комплексы ПТП и ФП не различаются.
ЗАКЛЮЧЕНИЕ
Своеобразный генезис почв торфяных пятен обусловливает формирование торфяно-деструктивного гор. Tmd, отличающегося по физическим и химическим свойствам от остальных торфяных горизонтов большей плотностью, сильным разложением, измельчением торфа и рядом других химических параметров. Эти особенности, наряду с отсутствием растительности на поверхности почвы, определяют формирование местообитания микроорганизмов с меньшей величиной микробной биомассы и низкой минерализационной и гидролазной активностью. При этом микроорганизмы почв пятен не менее активны, чем в почвах под растительностью, но специализируются, вероятно, на разложении органического вещества почвы, а не растительных остатков. На это указывает низкое физиологическое разнообразие неспециализированного гидролитического бактериального блока. Под растительностью физиологически данный блок более разнообразен, что указывает на его большую вовлеченность в разложение биополимеров растительных остатков. Специфика формирования гор. Tmd определяет уникальный состав грибного блока. Активные криогенные процессы (пучение, растрескивание, турбации) в гор. Tmd, разрушают не только растительные корни, но и могут рвать грибные гифы, а низкая температура почвы и недостаток питания не позволяет мицелиальным грибам восстановиться за короткий теплый период. Это приводит к угнетению мицелиальных грибов, сохраняющихся в форме спор, и к большой доле и обилию в грибном блоке психрофильных болотных дрожжей Leucosporidium drummii. Одноклеточные формы грибов в отличие от мицелиальных более устойчивы к пучению, растрескиванию, турбации, так как мицелий, адгезированный на почвенных частицах, рвется при их перемещении в почве, а для одноклеточных организмов таких проблем нет. Таким образом, исследованные оголенные участки торфяников – локальное местообитание микроорганизмов со специфическими условиями развития, обусловленными в первую очередь активным течением комплекса криогенных процессов. Это определяет особенности состава и структуры микробных сообществ и может быть перспективным для выделения из природы в культуру необычных грибов.
Список литературы
Ананьева Н.Д., Благодатская Е.В., Демкина Т.С. Влияние высушивания–увлажнения и замораживания–оттаивания на устойчивость микробных сообществ почвы // Почвоведение. 1997. № 9. С. 1132–1137.
Ананьева Н.Д., Полянская Л.М., Сусьян Е.А., Васенькина И.В., Вирт С., Звягинцев Д.Г. Сравнительная оценка микробной биомассы почв, определяемой методами прямого микроскопирования и субстрат-индуцированного дыхания // Микробиология. 2008. Т. 77. № 3. С. 404–412.
Василевская В.Д., Иванов В.В., Богатырев Л.Г. Почвы севера Западной Сибири. М.: Изд-во Моск. ун-та, 1986. 227 с.
Воробьева Л.А. Химический анализ почв Москва: Изд-во Моск. ун-та, 1998. 272 с.
Дмитриев Е.А. Математическая статистика в почвоведении. М.: Изд-во Моск. ун-та, 1995. 320 с.
Инишева Л.И. Болотоведение. Томск: ТГПУ, 2010. 210 с.
Инишева Л. И. Торфяные почвы: их генезис и классификация // Почвоведение. 2006. № 7. С. 781–786.
Качалкин А.В. Новые данные о распространении некоторых психрофильных дрожжевых грибов в Московской области // Микробиология. 2010. Т. 79. № 6. С. 843–847.
Классификация и диагностика почв России. Смоленск: Ойкумена, 2004. 342 с.
Ландшафты криолитозоны Западно-Сибирской нефтегазоносной провинции / Под ред. Е.С. Мельникова. Новосибирск: Наука, 1983. 165 с.
Лисс О.Л., Абрамова Л.И., Аветов Н.А., Березина Н.А., Инишева Л.И., Курнишкова Т.В., Слука 3.А., Толпышева Т.Ю., Шведчикова Н.К. Болотные системы Западной Сибири и их природоохранное значение. Тула: Гриф и Ко, 2001. 584 с.
Матышак Г.В., Богатырев Л.Г., Гончарова О.Ю., Бобрик А.А. Особенности развития почв гидроморфных экосистем северной тайги Западной Сибири в условиях криогенеза // Почвоведение. 2017. № 10. С. 1155–1164. https://doi.org/10.7868/S0032180X17100069
Москаленко Н.Г. Антропогенная динамика растительности равнин криолитозоны России Новосибирск: Наука, 1999. 280 с.
Методы почвенной микробиологии и биохимии / Под ред. Д.Г. Звягинцева. М.: Изд-во Моск. ун-та, 1991. 303 с.
Огнева О.А., Матышак Г.В., Гончарова О.Ю., Бобрик А.А., Пономарева О.Е. Почвы торфяных пятен бугристых торфяников севера Западной // Криосфера Земли. 2016. Т. 20. № 2. С. 61–68.
Пьявченко Н.И. Бугристые торфяники М.: Изд-во АН СССР, 1955. 280 с.
Смагин А.В. Газовая фаза почв. М.: Изд-во Моск. ун-та, 2005. 301 с.
Якушев А.В. Комплексный структурно-функциональный метод характеристики микробных популяций // Почвоведение. 2015. № 4. С. 429–446. https://doi.org/10.7868/S0032180X15040115
Якушев А.В., Бызов Б.А. Гидролазная активность как показатель состояния микробного сообщества вермикомпоста // Вестн. Моск. ун-та. Сер. 17. Почвоведение. 2009. № 2. С. 41–46.
Якушев А.В. Экофизиологические особенности бактериальных комплексов кишечника диплопод различных трофических групп // Устойчивое развитие территорий: теория и практика: материалы IX Всерос. науч.-пр. конф. 24–26 мая 2018 г. Сибай, 2018. С. 331–334.
Dalpe Y. Axenic synthesis of ericoid mycorrhiza in Vaccinium angustifolium ait. by Oidiodendron species // New Phytol. 1986. V. 103. P. 391–396.
Grum-Grzhimaylo O.A., Debets A.J.M., Bilanenko E.N. The diversity of microfungi in peatlands originated from the White Sea // Mycologia. 2016. V. 108. № 2. P. 233–254. https://doi.org/10.3852/14-346
Goulet F. Frost heaving of forest tree seedlings: a review // New For. 1995. V. 9. P. 67–94. https://doi.org/10.1007/BF00028927
Kramer D.N., Guilbault G.G. A substrate for the fluorimetric determination of lipase activity // Anal. Chem. 1963. V. 35. P. 588–589.
Kachalkin A.V. Yeasts of the White Sea intertidal zone and description of Glaciozyma litorale sp. nov. // Antonie van Leeuwenhoek. 2014. V. 105. № 6. P. 1073–1083. https://doi.org/10.1007/s10482-014-0165-9
Repo M.E., Susiluoto S., Lind S.E., Jokinen S., Elsakov V., Biasi C., Virtanen T., Martikainen P.J. Large N2O emissions from cryoturbated peat soil in tundra // Nature Geoscience. 2009. V. 2. P. 189–192.
Stanek W., Silc T. Comparisons of four methods for determination of degree of peat humification (decomposition) with emphasis on the von Post method // Can. J. Soil Sci. 1977. V. 57. P. 109–117.
Swisher R., Carroll G.C. Fluorescein diacetate hydrolysis as an estimator of microbial biomass on coniferous needle surfaces // Microbial Ecology. 1980. V. 6. P. 217–226.
Schnurer J., Rosswall T. Fluorescein diacetate hydrolysis as a measure of total microbial activity in soil and litter // Appl. Environ. Microbiol. 1982. V. 43. P. 1256–1261.
Stubbereld L.C.F., Shaw P.J.A. A comparison of tetrazolium reduction and FDA hydrolysis with other measurements of microbial activity // J. Microbiological Methods. 1990. V. 12. P. 151–162.
Seppälä M. Palsa mires in Finland // The Finnish environment. 2006. V. 23. P. 155–162.
Sanchez-Monedero M.A., Mondini C., Cayuela M.L., Roig A., Contin M., De Nobili M. Fluorescein diacetate hydrolysis, respiration and microbial biomass in freshly amended soil // Biol. Fertil. Soils. 2008. V. 44. P. 885–890.
Yurkov A.M., Schafer A.M., Begerow D. Leucosporidium drummii sp. nov., a member of the Microbotryomycetes isolated from soil // Int. J. Systematic and Evolutionary Microbiol. 2012. V. 62 P. 728–734. https://doi.org/10.1099/ijs.0.027102-0
Дополнительные материалы отсутствуют.