Почвоведение, 2020, № 10, стр. 1276-1286
Микробное дыхание почв подтайги и лесостепи европейской части России: полевой и лабораторный подходы
Н. Д. Ананьева a, *, С. В. Сушко a, b, c, К. В. Иващенко a, b, В. И. Васенев b
a Институт физико-химических и биологических проблем почвоведения РАН
142290 Московская область, Пущино, ул. Институтская, 2, Россия
b Российский университет дружбы народов, Аграрно-технологический институт
117198 Москва, ул. Миклухо-Маклая, 8/2, Россия
c Агрофизический научно-исследовательский институт
195220 Санкт-Петербург, Гражданский пр-т, 14, Россия
* E-mail: ananyeva@rambler.ru
Поступила в редакцию 10.02.2020
После доработки 21.04.2020
Принята к публикации 27.04.2020
Аннотация
Проведена проверка лабораторной экспресс-оценки микробного дыхания почвы для его прогнозирования в естественных условиях. Микробное дыхание почв подтайги (смешанный лес, луг) и лесостепи (широколиственный лес, целинная степь) измеряли ежемесячно с мая по октябрь в полевых (МДполе) и лабораторных (МДлаб) условиях. Величину МДполе определяли методом субстрат-индуцированного дыхания, МДлаб – традиционной оценкой базального дыхания почвы (верхний слой 0–10 см) при 22°C и 60% полной влагоемкости. Вклад МДполе в почвенную эмиссию СО2 подтайги и лесостепи за наблюдаемый период составил 25–85 и 41–88% соответственно. МДполе и МДлаб обеих подзон изменялись в близком диапазоне: 2.2–21.7 и 3.5–18.6 г СО2/(м2 сут). Причем величины были одинаковыми в 50% наблюдений для подтайги и 20% – лесостепи. Важно, что средние за вегетационный сезон величины МДполе и МДлаб не различались значимо для всех изученных экосистем. Полученные результаты демонстрируют возможность использования лабораторных измерений микробного дыхания почвы в течение вегетационного периода для целей аппроксимации и прогноза этого процесса в полевых условиях для различных экосистем.
ВВЕДЕНИЕ
Микробное дыхание почвы – процесс минерализации почвенного органического вещества разными группами микроорганизмов: микроскопические грибы, бактерии, археи и простейшие [10]. Микробное дыхание почвы наряду с дыханием корней растений является основным составляющим почвенной эмиссии СО2$\left( {{\mathbf{Э}}{{{\mathbf{М}}}_{{{\mathbf{С}}{{{\mathbf{О}}}_{{\text{2}}}}}}}} \right),$ обеспечивая крупнейший поток этого газа из наземных экосистем в атмосферу [28]. Именно микробное дыхание является ключевым показателем для оценки почвы как источника или стока атмосферного CO2 [24]. Кроме того, существует опасение, что глобальное потепление климата может привести к микробному разложению больших запасов почвенного органического вещества и усилить парниковый эффект [12, 18]. В модельных экспериментах показано, что отклик микробного дыхания почвы на климатические изменения может различаться для разных биомов, экосистем и типов почв [21]. Поэтому для региональных оценок баланса углерода и моделирования его динамики важно знать точную величину микробного дыхания для разных почв и экосистем.
Прямое измерение микробного дыхания почвы в полевых условиях (МДполе) сопряжено с разделением общей $Э{{М}_{{С{{О}_{{\text{2}}}}}}}$ на составные потоки. Существующие для этой цели подходы связаны в основном с механическим исключением корней растений (метод интеграции компонентов, применение корнеизолирующих материалов), прекращением поступления в них свежих фотоассимилятов (надрезание корней или флоэмы, затенение) и использованием изотопов [24, 29]. Однако перечисленные методы имеют ряд теоретических и технических недостатков, связанных с нарушением структуры почвы, частичным угнетением или исключением ризомикробного дыхания, трудоемкостью их выполнения, высокой стоимостью масс-спектрометрического оборудования и изотопно-меченых субстратов, что и ограничивает их широкое использование [11, 24]. В качестве альтернативного подхода для разделения $Э{{М}_{{С{{О}_{{\text{2}}}}}}}$ на микробную и корневую составляющие можно рассматривать технику субстрат-индуцированного дыхания (СИД), которую впервые предложили Паников с соавт. [8]. Ее сущность связана с дыхательным откликом почвенных микроорганизмов на внесение в почву глюкозы и отсутствием такового для корней растений. Основными преимуществами подхода являются: минимальное нарушение почвы, учет ризомикробного дыхания, применимость для разных экосистем, низкая стоимость и воспроизводимость [23, 24]. Вместе с тем прямое определение МДполе методом СИД является трудоемким процессом, что ограничивает количество наблюдений и масштаб исследования.
Микробное дыхание почвы, измеренное в лабораторных условиях (базальное дыхание), позиционировали как МДлаб. Его величину обычно определяют в почвенных образцах (корни удалены) при оптимальных для микробной активности гидротермических условиях [20]. Техника измерения МДлаб легко воспроизводима и позволяет оценивать большое количество почвенных образцов за короткий промежуток времени, что особенно важно в региональных исследованиях [1, 34, 35]. Показатель МДлаб рассматривают как индикатор качества почвы, он включен во многие европейские программы экологического мониторинга наземных экосистем [13, 25]. Поэтому в настоящее время имеется обширный массив данных о пространственном варьировании МДлаб почв разных биоклиматических регионов. Однако вопросы, связанные с корреляцией этих величин с таковыми МДполе, а также правомерности их использование в балансовых расчетах углерода, остаются открытыми. В настоящее время в научной литературе крайне мало исследований, направленных на оценку взаимосвязи полевых и лабораторных измерений микробного дыхания [2, 14].
В нашем исследование проведено измерение почвенного микробного дыхания в полевых и лабораторных условиях для разных экосистем (лесной и травянистой), растительных подзон (подтайги и лесостепи) и почв (дерново-подзолистой и чернозема) в течение вегетационного сезона, и оценена взаимосвязь между их величинами. Проверяли следующие гипотезы: 1) микробное дыхание обеспечивает не менее половины общего дыхания почвы в течение вегетационного сезона, 2) отсутствие значимых различий между величинами микробного дыхания, измеренного в полевых и лабораторных условиях.
ОБЪЕКТЫ И МЕТОДЫ
Локализация и характеристика объектов исследования. Объекты исследования расположены в подтаежной (Московская область; Московский аграрный университет им. K.A. Тимирязева; 55°50′ N, 37°33′ E) и лесостепной (Курская область; Центрально-Черноземный биосферный заповедник; 51°34′ N, 36°05′ E) растительных подзонах европейской части России. В каждой подзоне выбраны две экосистемы: смешанный лес и луг (подтайга), широколиственный лес и целинная степь (лесостепь). Климат изученных территорий является умеренно континентальным [31] со среднегодовой температурой воздуха 5.0 и 5.7°C и количеством осадков 696 и 570 мм для подтайги и лесостепи соответственно (данные метеостанций университета и заповедника). Почву изученных экосистем подтайги и лесостепи диагностировали как дерново-подзолистую (Albic Retisols) и чернозем типичный (Haplic Chernozems) [16]. Некоторые химические, физические и микробиологические свойства изученных почв представлены в табл. 1. В древостое смешанного леса подтайги доминировали сосна (Pinus sylvestris), дуб (Quercus robur), липа (Tilia cordata) и клен (Acer platanoides) возрастом около 60–70 лет. Изученный луг был представлен косимым участком (два раза за вегетационный сезон), в травостое которого преобладали тимофеевка (Phleum pretense), овсяница (Festuca rubra) и мятлик (Poa pratensis). В лесостепи широколиственный лес был представлен преимущественно дубом (Quercus robur) и кленом (Acer campestre), возраст которых составлял около 80 лет. Изученный участок целинной степи имел “абсолютно заповедный режим” (без кошения и выпаса) на протяжении последних 75 лет, в его растительном покрове доминировали вейник (Calamagrostis epigeios), райграсс (Arrhen atherumelatius) и кострец (Bromopsis riparia).
Таблица 1.
Химические, физические и микробиологические свойства почв (0–10 см, n = 2), их эмиссия СО2 (${\text{Э}}{{{\text{М}}}_{{{\text{С}}{{{\text{О}}}_{{\text{2}}}}}}};$ май–октябрь 2015 г., n = 12) в разных экосистемах подтайги и лесостепи, среднее ± стандартное отклонение
| Экосистема | Cобщ, % | C/N | ${\text{p}}{{{\text{H}}}_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}}$ | Cмик, мкг C/г | ${\text{Э}}{{{\text{М}}}_{{{\text{C}}{{{\text{O}}}_{{\text{2}}}}}}}$, г CO2/(м2 сут) | ρ, г/см3 | Песок | Суг-линок | Глина |
|---|---|---|---|---|---|---|---|---|---|
| % | |||||||||
| Подтайга | |||||||||
| Лес смешанный | 2.5 ± 0.6 | 13.8 ± 0.8 | 4.7 ± 0.1 | 433 ± 194 | 17.4 ± 8.5 | 0.95 | 50.5 | 43.2 | 6.3 |
| Луг | 2.3 ± 1.1 | 11.6 ± 0.4 | 5.4 ± 0.1 | 501 ± 139 | 35.5 ± 3.9 | 1.10 | 51.3 | 40.2 | 8.5 |
| Лесостепь | |||||||||
| Лес широколиственный | 4.7 ± 0.0 | 13.0 ± 0.4 | 6.3 ± 0.3 | 1324 ± 256 | 15.9 ± 2.4 | 0.93 | 30.3 | 59.5 | 10.2 |
| Степь | 5.2 ± 0.1 | 11.9 ± 0.1 | 6.3 ± 0.4 | 1431 ± 275 | 21.3 ± 0.3 | 0.93 | 26.7 | 64.0 | 9.3 |
В каждой экосистеме были выбраны две площадки (1 × 1 м) на расстоянии 5 м друг от друга, на которых в течение вегетационного периода (май–октябрь 2015 г.) измеряли скорость $Э{{М}_{{С{{О}_{{\text{2}}}}}}}$ и МДполе. Дату измерения для каждого месяца выбирали случайным образом (в основном в начале месяца в лесостепи, в конце – в подтайге). Одновременно с измерением МДполе регистрировали температуру и влажность почвы в верхнем слое 0–10 см. Затем из этого слоя на каждой площадке отбирали смешанный образец почвы (метод конверта) для последующего определения МДлаб. В почвенных образцах, отобранных в июле, определяли химические и физические показатели, содержание микробной биомассы. Свежеотобранные образцы почвы просеивали (ячейки 2 мм) и делили на две части, одну из которых хранили при 4°C не более двух недель до использования в микробиологических анализах [19]. Другую часть высушивали до воздушно-сухого состояния (22°C) и использовали в физико-химических анализах.
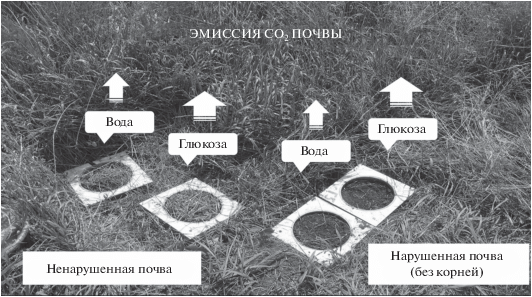
Определение микробного дыхания почвы в полевых условиях. Величину МДполе определяли техникой СИД, основанной на сравнении почвенной $Э{{М}_{{С{{О}_{{\text{2}}}}}}}$ с добавлением глюкозы и без таковой [8, 15]. В настоящем исследовании использовали модифицированный нами вариант метода СИД, согласно которому в почву на глубину 10 см врезаются четыре пластиковых “воротника-основания” (Ø 20 cм) на расстоянии друг от друга не более 10 см (рис. 1). В двух воротниках содержится ненарушенная почва (с корнями), в двух других – нарушенная (корни удалены просеиванием, ячейки 3 мм). Подготовленная таким образом почва оставляется не менее чем на 24 ч, чтобы минимизировать избыточное образование СО2. Затем в почву двух воротников (ненарушенную и нарушенную) добавляли воду, а двух других (ненарушенную и нарушенную) – водный раствор глюкозы (5 мг/г почвы). Объем жидкости, равномерно промачивающий слой почвы не менее чем на 10 см, определяли в предварительных экспериментах. Для наших объектов исследования такой объем жидкости составил 0.6–1.0 л. Концентрацию глюкозы, обеспечивающую наибольшее СИД при температуре от 4 до 22°C, также определяли в предварительных экспериментах. Измерение $Э{{М}_{{С{{О}_{{\text{2}}}}}}}$ с поверхности почвы каждого воротника выполняли через 4 ч после внесения в нее воды или раствора глюкозы. Величину МДполе (г СО2/(м2 сут)) ненарушенной и увлажненной водой почвы рассчитывали согласно формуле:
(1)
${\text{М}}{{{\text{Д}}}_{{{\text{поле}}}}}~ = {{{{{({\text{ГЛ\;--\;В}})}}_{{{\text{НН}}}}}} \mathord{\left/ {\vphantom {{{{{({\text{ГЛ\;--\;В}})}}_{{{\text{НН}}}}}} {\left( {\frac{{{\text{ГЛ}}{{{\text{\;}}}_{{\text{Н}}}}}}{{{{{\text{В}}}_{{\text{Н}}}}}} \times \frac{{{{{({\text{ГЛ\;--\;В}})}}_{{{\text{НН}}}}}}}{{{{{({\text{ГЛ\;--\;В}})}}_{{\text{Н}}}}}}} \right)}}} \right. \kern-0em} {\left( {\frac{{{\text{ГЛ}}{{{\text{\;}}}_{{\text{Н}}}}}}{{{{{\text{В}}}_{{\text{Н}}}}}} \times \frac{{{{{({\text{ГЛ\;--\;В}})}}_{{{\text{НН}}}}}}}{{{{{({\text{ГЛ\;--\;В}})}}_{{\text{Н}}}}}}} \right)}},$Рис. 1.
Схема разделения почвенной эмиссии СО2 на ее микробную и корневую составляющие в полевых условиях методом субстрат-индуцированного дыхания.
Скорость $Э{{М}_{{С{{О}_{{\text{2}}}}}}}$ с поверхности почвы воротников измеряли методом закрытой камеры с использованием инфракрасного газового анализатора LI-820 (Li-Cor Inc., USA). Для этого пластиковую камеру (объем 4.7 л) герметично устанавливали на воротник и соединяли с анализатором. Перемешивание воздуха в камере обеспечивали вентилятором, а его циркуляцию между камерой и анализатором – насосом. Концентрацию CO2 в воздухе камеры регистрировали ежесекундно в течение 90 с. Скорость $Э{{М}_{{С{{О}_{{\text{2}}}}}}}$ (мкмоль/(м2 с)) рассчитывали по формуле:
(2)
${\text{Э}}{{{\text{М}}}_{{{\text{С}}{{{\text{О}}}_{2}}}}} = \frac{{VP}}{{RST}} \times \frac{{\partial C}}{{\partial t}},$Химические и физические свойства почвы. Содержание общего углерода и азота в почве (Собщ, Nобщ, навеска 0.002 г) определяли методом ИК-спектроскопии после кислородного сжигания образца (1100°С; анализатор CHNS-932 LECO Corp., США), затем рассчитывали отношение C/N. Значение pH (почва : вода 1 : 2.5) измеряли потенциометрическим методом (Sartorius Basic Meter PB-11, Германия). Для определения плотности почвы (г/см3) отбирали образец верхнего 10 см слоя с помощью металлического цилиндра (500 см3, естественное сложение почвы не нарушали), высушивали до абсолютно сухого состояния (105°С, 8 ч) и взвешивали. Гранулометрический состав почвы определяли методом пипетки с последующей дифференциацией ее частиц: глина (<0.002 мм), суглинок (0.002–0.05 мм) и песок (0.05–2.0 мм).
Микробиологический анализ почвы. Содержание углерода микробной биомассы (Смик) почвы измеряли методом СИД, основанном на регистрации наибольшего первоначального продуцирования CO2 почвенными микроорганизмами после внесения глюкозы [9]. Навеску почвы (2 и 1 г для дерново-подзолистой и чернозема) помещали в стеклянный флакон (15 мл) и добавляли по каплям раствор глюкозы (0.1 мл/г, 5 мг глюкозы/г), герметично закрывали и инкубировали при 22°C в течение 3.5–4.0 ч. За этот период в почве происходит окисление и соокисление глюкозы почвенными микроорганизмами, исключая ее потребление для их роста. После инкубации флакона с почвой отбирали шприцем образец воздуха, который вводили в газовый хроматограф для измерения в нем концентрации CO2 (детектор по теплопроводности, Кристаллюкс 4000M, Россия). Скорость СИД (мкл CO2/(г ч)) рассчитывали с учетом концентрации CO2, объема газовой фазы флакона, навески почвенного образца и времени его инкубации. Содержание Смик (мкг C/г почвы) определяли по формуле: СИД × 40.04 + 0.37 [9].
Величину МДлаб измеряли как базальное дыхание почвы с использованием газовой хроматографии [20]. Анализ выполняли аналогично технике определения СИД, только вместо раствора глюкозы в почву вносили дистиллированную воду (0.1 мл/г) и инкубировали 24 ч при 22°C. Скорость МДлаб (мкг СО2/(г ч)) рассчитывали согласно ISO 16072:2002–Section 5.5.6 [20]. Затем величину МДлаб выражали на единицу площади почвы (м2), принимая во внимание объемный вес ее верхнего слоя 0–10 см:
(3)
${\text{М}}{{{\text{Д}}}_{{{\text{лаб}}}}} = {\text{МД}}_{{{\text{лаб}}}}^{*} \times {\text{ 1}}{{0}^{{--{\text{3}}}}}V\rho \times {\text{24}},$Образцы почвы для измерения МДлаб и Смик предварительно инкубировали (50–60% полной влагоемкости, 22°C, 7 сут), чтобы исключить избыточное образование CO2 в результате ее просеивания и реувлажнения [13].
Статистический анализ данных. Пространственное и временное варьирование МДполе и МДлаб изученных почв оценивали коэффициентом вариации (CV, %), который рассчитывали как отношение стандартного отклонения к среднему. В качестве пространственного варьирования МДполе (или МДлаб) рассматривали различие этого процесса между двумя экспериментальными площадками каждой экосистемы на момент измерения. Временное варьирование определяли как изменчивость МДполе (или МДлаб) в течение наблюдаемого вегетационного периода для каждой экосистемы. Величины МДполе и МДлаб каждого срока наблюдения считали сопоставимыми, если различие их средних для двух экспериментальных площадок экосистемы было меньше или равно их стандартному отклонению: $\sqrt {{{{\left( {{\text{среднее}}\,\,\,\,{\text{М}}{{{\text{Д}}}_{{{\text{поле}}}}} - {\text{среднее}}\,\,\,\,{\text{М}}{{{\text{Д}}}_{{{\text{лаб}}}}}} \right)}}^{2}}} $ ≤ ≤ ст. откл. МДполе или МДлаб. Значимость различий между среднесезонными значениями МДполе и МДлаб каждой экосистемы определяли парным t-критерием Стьюдента. Соответствие экспериментальных данных нормальному распределению проверяли критерием Шапиро–Уилка (P > 0.05). Зависимость МДполе от температуры и влажности почвы за наблюдаемый вегетационный период оценивали простым регрессионным анализом. При этом характер такой связи (линейная или нелинейная зависимость) определяли графически, а качество регрессионного уравнения – коэффициентом детерминации (R2). Выполняли анализ остатков регрессии: проверяли их на соответствие нормальному распределению и однородность дисперсий. Статистический анализ и визуализация экспериментальных данных выполняли в программной среде R 3.5.0 (R Foundation for Statistical Computing, Vienna, Austria, 2017).
РЕЗУЛЬТАТЫ
Общая характеристика почв. Дерново-подзолистая почва изученных экосистем подтайги отличалась от чернозема лесостепи меньшим содержанием Собщ, Смик, значением рН и более легким гранулометрическим составом (табл. 1). В травянистых экосистемах изученных почв отношение C/N оказалось ниже по сравнению с соответствующими лесными, а ${\text{Э}}{{{\text{М}}}_{{{\text{С}}{{{\text{О}}}_{{\text{2}}}}}}}$ – выше. Плотность почвы верхнего слоя 0–10 см изученных экосистем двух растительных подзон была близка 1 г/см3.
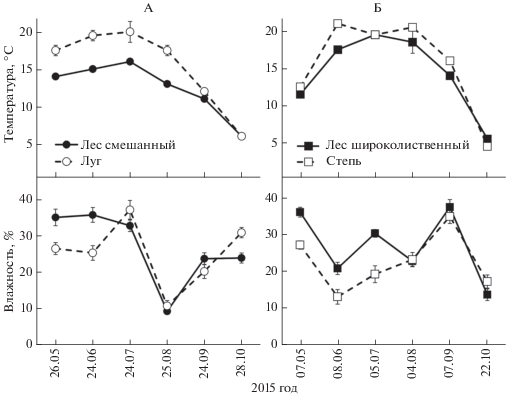
Температура верхнего слоя 0–10 см почвы за наблюдаемый вегетационный период изменялась от 6 до 20°C в подтайге и от 5 до 22°C в лесостепи (рис. 2). В обеих подзонах температура почвы лесных экосистем была в среднем на 2°С ниже по сравнению с травянистыми (13 и 14°С для смешанного и широколиственного лесов; 15 и 16°С для луга и степи). Влажность почвы подтайги и лесостепи за наблюдаемый период изменялась в близком диапазоне: 9–38 и 11–35% соответственно. В обеих подзонах влажность почвы лесных экосистем в среднем на 2–5% превышала таковую травянистых (27% – смешанный и широколиственный лес; 25 и 22% – луг и степь).
Рис. 2.
Временная динамика температуры и влажности почвы (слой 0–10 см) в подтайге (А) и лесостепи (Б). Значения представлены как среднее ± стандартное отклонение (n = 2) для каждого срока измерения.
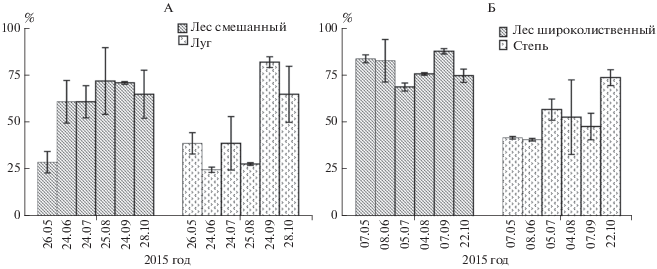
Вклад микробного дыхания в почвенную эмиссию СО2. Временное варьирование вклада МДполе в ${\text{Э}}{{{\text{М}}}_{{{\text{С}}{{{\text{О}}}_{{\text{2}}}}}}}$ изученных экосистем показано на рис. 3. В подтайге его величина составила 29–72 и 25–82% для леса и луга соответственно. При этом высокий вклад МДполе (>50%) отмечали в течение длительного периода (июнь–октябрь) для леса, и, напротив, короткого (сентябрь–октябрь) – для луга. В лесостепи вклад МДполе в ${\text{Э}}{{{\text{М}}}_{{{\text{С}}{{{\text{О}}}_{{\text{2}}}}}}}$ леса и степи составил 69–88 и 41–74% соответственно. Его величину, превышающую 50%, регистрировали в лесу в течение всего наблюдаемого периода, на лугу – только в июле, августе и октябре. Следует отметить, что в обеих растительных подзонах вклад МДполе в ${\text{Э}}{{{\text{М}}}_{{{\text{С}}{{{\text{О}}}_{{\text{2}}}}}}}$ лесных экосистем был выше (в среднем 60 и 79%, смешанный и широколиственных лес), чем травянистых (46 и 52%, луг и степь).
Рис. 3.
Вклад микробного дыхания в почвенную эмиссию СО2 подтайги (А) и лесостепи (Б) в течение вегетационного периода. Значения представлены как среднее ± стандартное отклонение (n = 2) для каждого срока измерения.
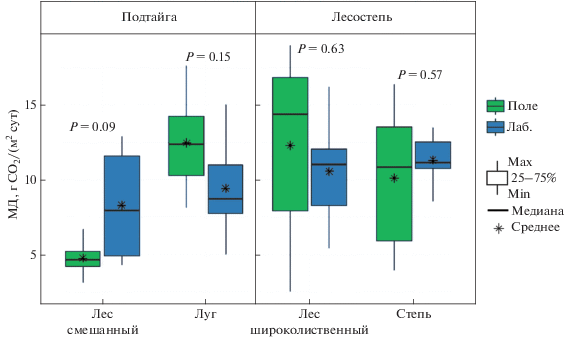
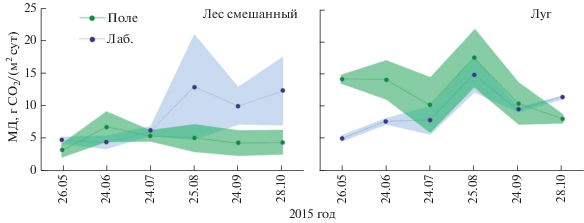
Микробное дыхание почвы: полевое и лабораторное измерения. Микробное дыхание дерново-подзолистой почвы подтайги, измеренное в полевых и лабораторных условиях в течение вегетационного периода, показано на рис. 4. В смешанном лесу диапазон значений МДполе оказался более узким по сравнению с МДлаб (2.2–8.5 и 3.5–18.6 г CO2/(м2 сут) соответственно). Кроме того, временное варьирование МДполе было меньше (CV = 26%) такового МДлаб (CV = 46%). Оказалось, что в смешанном лесу величины МДполе и МДлаб были близки в первой половине вегетационного периода (май–июль) и различались почти в три раза – во второй (август–октябрь). Пространственное варьирование МДполе и МДлаб было также сопоставимо в мае–июле (CV = 17–39 и 11–26%), но заметно различалось – в августе–октябре (44–48 и 29–64%). На лугу диапазон значений МДполе и МДлаб за наблюдаемый период оказался весьма близким: 7.1–20.8 и 4.6–16.9 г CO2/(м2 сут) соответственно. Причем, их временное варьирование было также сопоставимым (CV = 28 и 36%, МДполе и МДлаб). Интересно отметить, что величины почвенного микробного дыхания луга, полученного двумя подходами, в мае–июне различались в 2–3 раза, а в остальные сроки (июль–сентябрь) – были почти одинаковыми. Пространственное варьирование МДполе изученного луга почти вдвое превышало таковое МДлаб (CV = 5–43 и 3–28%). Следует отметить, что значения МДполе и МДлаб в экосистемах подтайги были сопоставимы в 50% наблюдений (три измерения из шести для каждой экосистемы). Однако для другой половины наблюдений величины МДполе были существенно ниже (смешанный лес) или выше (луг) соответствующих МДлаб.
Рис. 4.
Микробное дыхание дерново-подзолистой почвы подтайги, измеренное в полевых и лабораторных условиях, в течение вегетационного периода. Точкой обозначено среднее значение (n = 2) для каждого срока наблюдения, цветная область – стандартное отклонение.
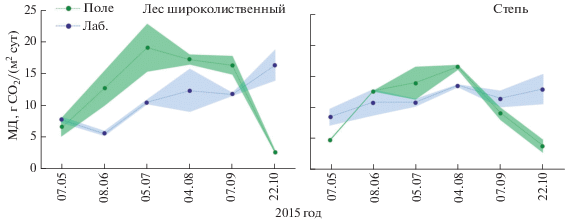
Результаты полевого и лабораторного измерений микробного дыхания чернозема лесостепи показаны на рис. 5. В широколиственном лесу МДполе и МДлаб за наблюдаемый период составили 2.4–21.7 и 5.2–17.9 г CO2/(м2 сут) соответственно. При этом временное варьирование полевых и лабораторных экспериментальных данных заметно различалось (CV = 53 и 35%), а пространственное было почти одинаковым (CV = 7–23 и 7–28%). Величина МДполе широколиственного леса была сопоставима с таковой МДлаб только в мае, с июня по сентябрь она была в 1.4–2.0 раза выше, а в октябре, напротив, – в 6 раз ниже. В степи диапазон значений МДполе за наблюдаемый период был почти вдвое шире такового МДлаб (2.9–16.6 и 7.5–14.6 г CO2/(м2 сут)). Причем, временное варьирование МДполе и МДлаб различалось в большей степени (CV = 50 и 16%), чем пространственное (CV = 1–34 и 2–19%). В степи величина МДполе была сопоставима с МДлаб только в июне, в другие сроки наблюдения она оказалось либо в 1.3–3.3 раза ниже (май, сентябрь, октябрь), либо в 1.2–1.3 раза выше (июль, август). Таким образом, в лесостепи результаты полевого и лабораторного измерения микробного дыхания почвы оказались сопоставимыми только в одном из шести наблюдений, что соответствует примерно 20% уровню вероятности.
Рис. 5.
Микробное дыхание чернозема лесостепи, измеренное в полевых и лабораторных условиях в течение вегетационного периода. Точкой обозначено среднее значение (n = 2) для каждого срока наблюдения, цветная область – стандартное отклонение.
Далее оценили влияние температуры и влажности почвы на варьирование МДполе, а таковое для МДлаб (оптимальные гидротермические условия) не рассматривали. Оказалось, что величина МДполе подтайги слабо зависела от гидротермических условий, однако для лесостепи она сильно зависела от температуры и слабо – от влажности почвы (табл. 2).
Таблица 2.
Зависимость микробного дыхания почвы от ее температуры и влажности (0–10 см) за наблюдаемый вегетационный период (май–октябрь 2015, n = 6) в экосистемах подтайги и лесостепи
| Экосистема | Температура, °C | Влажность, % | ||||
|---|---|---|---|---|---|---|
| уравнение | R2 | P | уравнение | R2 | P | |
| Подтайга | ||||||
| Лес смешанный | y = 0.12x + 3.2 | 0.14 | 0.47 | y = 0.01x + 4.5 | 0.01 | 0.86 |
| Луг | y = 0.40x + 6.3 | 0.39 | 0.18 | y = –0.3x + 19.4 | 0.52 | 0.11 |
| Лесостепь | ||||||
| Лес широколиственный | y = 1.34e0.14x | 0.88 | 0.005 | y = –0.07x2 + 4.1x – 40 | 0.61 | 0.07 |
| Степь | y = 1.34e0.14x | 0.89 | 0.005 | y = –0.12x + 12.8 | 0.03 | 0.73 |
Следующий этап интерпретации данных связан с проверкой возможности использования лабораторного подхода для аппроксимации и прогнозирования среднесезонной величины МДполе изученных экосистем. Оказалось, что средние МДполе и МДлаб за вегетационный период не различались значимо в обеих растительных подзонах (рис. 6). При этом в лесу подтаежной зоны МДполе было вдвое меньше соответствующего МДлаб, а на лугу, напротив, – на 30% больше. В экосистемах лесостепи различие между среднесезонными значениями МДполе и МДлаб оказалось в среднем незначительным (11–14%).
ОБСУЖДЕНИЕ
Вклад микробного дыхания в почвенную эмиссию СО2, определенный методом субстрат-индуцированного дыхания. Метод СИД для разделения ${\text{Э}}{{{\text{М}}}_{{{\text{С}}{{{\text{О}}}_{{\text{2}}}}}}}$ на микробную и корневую составляющие предложен почти 20 лет назад Паниковым с соавт. [8] и успешно апробирован в полевых условиях [15]. С тех пор опубликован ряд научных работ с использованием данного подхода [3, 4, 6, 7, 36]. Согласно этим исследованиям, вклад МДполе в ${\text{Э}}{{{\text{М}}}_{{{\text{С}}{{{\text{О}}}_{{\text{2}}}}}}}$ составил в среднем 60% для горных лугов Австрии [36], 64% – средиземноморских лугов Италии [17], 58 и 61% – суббореальных лугов и лесов [3, 4, 7] и 65% – бореальных лесов европейской части России [6]. В нашем исследовании вклад МДполе в ${\text{Э}}{{{\text{М}}}_{{{\text{С}}{{{\text{О}}}_{{\text{2}}}}}}}$ для изученных растительных подзон был сопоставим, однако заметно различался между типами экосистем (лесной и травянистой). Этот факт можно объяснить различием доли корневого дыхания в ${\text{Э}}{{{\text{М}}}_{{{\text{С}}{{{\text{О}}}_{{\text{2}}}}}}}$ лесных и травянистых экосистем, что связано с различием биомассы тонких корней в их верхнем почвенном слое [27].
Варьирование микробного дыхания почвы подтайги и лесостепи. Известно, что дыхательная активность почвенных микроорганизмов характеризуется высокой пространственной и временной изменчивостью. В нашем исследовании в качестве пространственного варьирования МДполе (или МДлаб) рассматривали различие между двумя экспериментальными участками каждой экосистемы. Оказалось, что экосистемы подтайги отличались от лесостепных аналогов большей пространственной неоднородностью МДполе и МДлаб, что связано, по-видимому, с особенностями распределения элементов питания в дерново-подзолистых почвах и черноземах. Ранее показано, что пространственное варьирование МДлаб хорошо коррелирует с содержанием в почве C и N [1, 35]. Однако сведений об определяющих факторах пространственного варьирования МДполе в научной литературе крайне мало [30].
Временное варьирование МДполе контролируется в основном гидротермическими условиями [26, 30], количеством и качеством поступающих в почву корневых экссудатов и отмерших растительных остатков [5, 22]. Однако такое варьирование МДлаб определяется во многом изменчивостью содержания органического вещества в свободной от корней почве. В нашем исследовании временная динамика МДполе в лесостепи строго контролировалась температурой почвы. Однако в подтайге такой зависимости не обнаружено, что может быть связано со слабым варьированием температуры ее почвы за наблюдаемый период. Наши результаты показали, что влажность почвы слабо влияла на варьирование МДполе в обеих изученных подзонах, что, по-видимому, обусловлено измерением этого процесса в предварительно увлажненной почве (в среднем 33% содержания воды). Следует отметить, что наибольшие значения МДполе и МДлаб в изученных экосистемах подтайги обнаружены в засушливый период наблюдения (август, рис. 4). Этот результат соответствует классическому представлению о кратковременном усилении микробного дыхания реувлажненной почвы, которое связано с увеличением содержания в ней легкодоступного питательного субстрата (мертвых микробных клеток, выщелоченного из подстилки органического вещества, десорбированных с поверхности почвенных частиц питательных элементов) [32, 33].
Микробное дыхание почвы, измеренное полевым и лабораторным методами. Измеренная величина МД в полевых условиях зависит от гидротермических факторов, а в лабораторных условиях МД измеряется при постоянных влажности и температуре. Кроме того, пулы углерода почвы, утилизируемые микроорганизмами при измерении МДполе и МДлаб, также различаются. Так, МДполе обеспечивается в основном за счет разложения гумусового вещества почвы, мертвых растительных остатков и корневых экссудатов, в то время как МДлаб – разных фракций органического вещества в свободной от корней почве [24]. Полагаем, что выявленные нами различия МДполе и МДлаб почв разных экосистем подтайги и лесостепи в течение вегетационного периода обусловлены в той или иной степени вышеупомянутыми факторами и их комбинацией. Следует отметить, что высокая временная изменчивость МДполе и МДлаб маскирует различие их среднесезонных величин. Вместе с тем результаты нашего исследования демонстрируют возможность использования лабораторного подхода для прогностической оценки среднесезонного МДполе для разных экосистем подтаежной и лесостепной растительных подзон.
ЗАКЛЮЧЕНИЕ
Микробное разложение органического вещества почвы (микробное дыхание) является важным компонентом баланса углерода в наземных экосистемах, оценка которого особенно актуальна в условиях современного изменения климата. Выявлено, что микробное дыхание является доминирующей составляющей почвенной эмиссии СО2 в изученных экосистемах. Техника определения микробного дыхания почвы в полевых условиях является время- и трудозатратной, поэтому поиск альтернативных подходов для экспресс-оценки этого процесса – актуальная научная задача. В настоящем исследовании проверили лабораторный подход для определения микробного дыхания почвы, который может в определенной степени служить его предиктором в естественных условиях. Оказалось, что лабораторное и полевое измерения микробного дыхания почвы подтайги и лесостепи показали сопоставимые величины в среднем за вегетационный период. Эти результаты демонстрируют возможность использования лабораторных измерений микробного дыхания почв для оценки региональных потоков углерода и его балансовых расчетов.
Список литературы
Гавриленко Е.Г., Сусьян Е.А., Ананьева Н.Д., Макаров О.А. Пространственное варьирование содержания углерода микробной биомассы и микробного дыхания почв южного Подмосковья // Почвоведение. 2011. № 10. С. 1231–1245. https://doi.org/10.1134/s106422931110005x
Гончарова О.Ю., Матышак Г.В., Бобрик А.А., Тимофеева М.В., Сефилян А.Р. Оценка вклада корневого и микробного дыхания в общий поток СО2 из торфяных почв и подзолов севера Западной Сибири методом интеграции компонентов // Почвоведение. 2019. № 2. С. 234–245. https://doi.org/10.1134/S1064229319020054
Евдокимов И.В., Ларионова А.А., Шмитт М., Лопес де Гереню В.О., Бан М. Определение вклада дыхания корней растений в эмиссию СО2 из почвы методом субстрат-индуцированного дыхания // Почвоведение. 2010. № 3. С. 349–355. https://doi.org/10.1134/S1064229310030105
Евдокимов И.В., Ларионова А.А., Шмитт М., Лопес де Гереню В.О., Бан М. Экспериментальная оценка вклада дыхания корней растений в эмиссию углекислого газа из почвы // Почвоведение. 2010. № 10. С. 1479–1488. https://doi.org/10.1134/S1064229310120070
Иванова А.Е., Николаева В.В., Марфенина О.Е. Изменение целлюлозолитической активности городских почв в связи с изъятием растительного опада (на примере Москвы) // Почвоведение. 2015. № 5. С. 562–570. https://doi.org/10.1134/s1064229315030059
Карелин Д.В., Замолодчиков Д.Г., Каганов В.В., Почикалов А.В., Гитарский М.Л. Микробная и корневая составляющие дыхания дерново-подзолистых почв южной тайги // Лесоведение. 2017. № 3. С. 183–195. https://doi.org/10.1134/s199542551707006x
Ларионова А.А., Сапронов Д.В., Лопес де Гереню В.О., Кузнецова Л.Г., Кудеяров В.Н. Вклад дыхания корней растений в эмиссию СО2 из почвы // Почвоведение. 2006. № 10. P. 1248–1257. https://doi.org/10.1134/S1064229306100103
Паников Н.С., Палеева М.В., Дедыш С.Н., Дорофеев А.Г. Кинетические методы определения биомассы и активности различных групп почвенных микроорганизмов // Почвоведение. 1991. № 8. С. 109–120.
Anderson J.P.E., Domsch K.H. A physiological method for the quantitative measurement of microbial biomass in soils // Soil Biol. Biochem. 1978. V. 10. P. 215–221. https://doi.org/10.1016/0038-0717(78)90099-8
Anderson J.P.E. Soil respiration // Methods of soil analysis. Part 2. Chemical and microbiological properties / Ed. Page A.L. Wisconsin USA, Madison: American Society of Agronomy. 1982. P. 831–853.
Bond-Lamberty B., Wang C., Gower S.T. A global relationship between the heterotrophic and autotrophic components of soil respiration? // Global Change Biology. 2004. V. 10. P. 1756–1766. https://doi.org/10.1111/j.1365-2486.2004.00816.x
Cox P.M., Betts R.A., Jones C.D., Spall S.A., Totterdell I.J. Acceleration of global warming due to carbon-cycle feedbacks in a coupled climate model // Nature. 2000. V. 408. P. 184–187. https://doi.org/10.1038/35047138
Creamer R.E., Schulte R.P.O., Stone D., Gal A., Krogh P.H., Lo Papa G., Winding A. Measuring basal soil respiration across Europe: Do incubation temperature and incubation period matter? // Ecological Indicators. 2014. V. 36. P. 409–418. https://doi.org/10.1016/j.ecolind.2013.08.015
Dilly O., Mogge B., Kutsch W.L., Kappen L., Munch J.C. Aspects of carbon and nitrogen cycling in soils of the Bornhöved Lake district II. Microbial characteristics and emissions of carbon dioxide and nitrous oxide of arable and grassland soils // Biogeochemistry. 1997. V. 39. P. 189–205. https://doi.org/10.1023/A:1005867931015
Ekblad A., Högberg P. Analysis of δ13C of CO2 distinguishes between microbial respiration of added C4-sucrose and other soil respiration in a C3-ecosystem // Plant and Soil. 2000. V. 219. P. 197–209. https://doi.org/10.1023/A:1004732430929
FAO. World Reference Base for Soil Resources. Rome: FAO, 2014. Retrieved from http://www.fao.org/3/ i3794en/I3794en.pdf
Gavrichkova O. Drivers of soil respiration of root and microbial origin in grasslands. Ph.D. dissertation. Viterbo: Universitadegli Studidella Tuscia, 2009.
Heimann M., Reichstein M. Terrestrial ecosystem carbon dynamics and climate feedbacks // Nature. 2008. V. 451. P. 289–292. https://doi.org/10.1038/nature06591
ISO 10381-6. Soil quality – sampling: Part 6. Guidance on the collection, handling and storage of soil for the assessment of aerobic microbial processes in the laboratory. Geneva: International Standards Organization, 1993.
ISO 16072. Soil quality – laboratory methods for determination of microbial soil respiration. Geneva: International Standards Organization, 2002.
Karhu K., Auffret M.D., Dungait J.A.J., Hopkins D.W., Prosser J.I., Singh B.K., Hartley I.P. Temperature sensitivity of soil respiration rates enhanced by microbial community response // Nature. 2014. V. 513. P. 81–84. https://doi.org/10.1038/nature13604
Kuzyakov Y., Cheng W. Photosynthesis controls of rhizosphere respiration and organic matter decomposition // Soil Biol. Biochem. 2001. V. 33. P. 1915–1925. https://doi.org/10.1016/S0038-0717(01)00117-1
Kuzyakov Y., Larionova A.A. Root and rhizomicrobial respiration: A review of approaches to estimate respiration by autotrophic and heterotrophic organisms in soil // J. Plant Nutrition Soil Sci. 2005. V. 168. P. 503–520. https://doi.org/10.1002/jpln.200421703
Kuzyakov Y. Sources of CO2 efflux from soil and review of partitioning methods // Soil Biol. Biochem. 2006. V. 38. P. 425–448. https://doi.org/10.1016/j.soilbio.2005.08.020
Nielsen M.N., Winding A. Microorganisms as indicators of soil health. NERI Technical Report No. 388. Denmark: Ministry of the Environment, National Environmental Research Institute, 2002.
Prolingheuer N., Scharnagl B., Graf A., Vereecken H., Herbst M. Spatial and seasonal variability of heterotrophic and autotrophic soil respiration in a winter wheat stand // Biogeosciences Discuss. 2010. V. 7. P. 9137–9173. https://doi.org/10.5194/bgd-7-9137-2010
Rodeghiero M., Cescatti A. Indirect partitioning of soil respiration in a series of evergreen forest ecosystems // Plant and Soil. 2006. V. 284. P. 7–22. https://doi.org/10.1007/s11104-005-5109-8
Schlesinger W.H., Andrews J.A. Soil respiration and the global carbon cycle // Biogeochemistry. 2000. V. 48. P. 7–20. https://doi.org/10.1023/A:1006247623877
Subke J.A., Ingima I., Cotrufo M.F. Trends and methodological impacts in soil CO2 efflux partitioning: A meta-analytical review // Global Change Biology. 2006. V. 12. P. 921–943. https://doi.org/10.1111/j.1365-2486.2006.01117.x
Tang J., Baldocchi D.D. Spatial-temporal variation in soil respiration in an oak-grass savanna ecosystem in California and its partitioning into autotrophic and heterotrophic components // Biogeochemistry. 2005. V. 73. P. 183–207. https://doi.org/10.1007/s10533-004-5889-6
Trewartha G.T., Horn L.H. An Introduction to Climate. N.Y.: McGraw-Hill Book Company, 1980.
Van Gestel M., Ladd J.N., Amato M. Carbon and nitrogen mineralization from two soils of contrasting texture and micro-aggregate stability: Influence of sequential fumigation, drying and storage // Soil Biol. Biochem. 1991. V. 23. P. 313–322. https://doi.org/10.1016/0038-0717(91)90185-m
Van Gestel M., Merckx R., Vlassak K. Microbial biomass and activity in soils with fluctuating water contents // Geoderma. 1993. V. 56. P. 617–626. https://doi.org/10.1016/0016-7061(93)90140-G
Vasenev V.I., Stoorvogel J.J., Plyushchikov V.G., Ananyeva N.D., Ivashchenko K.V., Romzaykina O.N. Basal respiration as a proxy to understand spatial trends in CO2 emissions in the Moscow region // Vestnik RUDN. J. Agronomy and Animal Industrie. 2016. V. 4. P. 94–106. https://doi.org/10.22363/2312-797X-2016-4-94-107
Wirth S. Regional-scale analysis of soil microbial biomass and soil basal CO2 respiration in northeastern Germany // Sustaining the Global Farm / Eds. D.E. Stott, R.H. Mohtar, G.C. Steinhardt West Lafayette, IN, 2001. P. 486–493.
Yevdokimov I., Larionova A., Bahn M. A novel approach for partitioning root and microbial respiration in soil // Abstracts of the CarboEurope-IP Open Science Conference on the GHG Cycle in the Northern Hemisphere. Crete, Sissi-Lassithi, 2006.
Дополнительные материалы отсутствуют.