Почвоведение, 2020, № 5, стр. 618-626
Структура микробных сообществ почв немерзлотного регрессивного болота
А. В. Головченко a, *, Т. А. Семенова b, О. В. Анисимова a, Т. Г. Добровольская b, Т. В. Глухова c, А. Л. Степанов a
a МГУ им. М.В. Ломоносова
119991 Москва, Ленинские горы, 1, Россия
b Институт проблем эволюции и экологии РАН
117071 Москва, Ленинский пр-т, 35, Россия
c Институт лесоведения РАН
143030 Московская область, с. Успенское, ул. Советская, 21, Россия
* E-mail: golovchenko.alla@gmail.com
Поступила в редакцию 11.07.2019
После доработки 17.09.2019
Принята к публикации 27.12.2019
Аннотация
Широкое распространение регресса на болотах северного полушария дало основание выделить, наряду с общепринятыми низинным, переходным и верховым типами, регрессивный тип болот. Цель работы – выявление структурно-функциональной организации микробных сообществ почв регрессивного болота немерзлотного типа (пробная площадь Западнодвинского лесоболотного стационара Института лесоведения РАН, Тверская область). Регрессивные явления выражены в виде многочисленных (черных) пятен торфа без сфагнового очеса площадью от 0.05 до 1 м2. Численность и биомассу микроорганизмов выявляли прямым методом с использованием люминесцентной микроскопии. Таксономический состав бактериальных и грибных сообществ определяли методом посева, альгологических – методом прямого микроскопирования. Эмиссию CO2 и CH4 анализировали камерным методом. Установлено, что в почвах под регрессивными пятнами суммарная биомасса выше, чем в почвах без признаков регрессии за счет биомассы регрессивной пленки, которая составляет 1/2 от суммарной биомассы деятельного слоя. В структуре биомассы пленки доминируют водоросли, на долю бактерий и грибов приходится от 13 до 26%. Регрессивные пленки характеризуются высокой численностью водорослей и бактерий. Все таксоны водорослей, обнаруженные в регрессивных пленках, являются характерными обитатели болот. Грибы в регрессивных пленках представлены мицелием и спорами. Обилие грибного мицелия во влажный период увеличивается на 1–2 порядка и составляет 2–4 км/г. Особенностью микромицетного комплекса регрессивных пленок является доминирование видов Penicillium miczynskii и Umbelopsis vinacea, входящих в комплекс доминантов низинного торфяника. Регрессивные пленки характеризуются большей скоростью минерализации растительных остатков вследствие аккумуляции азота, что ведет к увеличению эмиссии СО2 с одной стороны и ингибированию метаногенеза – с другой.
ВВЕДЕНИЕ
В жизни болотных массивов олиготрофного типа наступает регрессивная стадия, основным проявлением которой является локальное прекращение торфонакопления в связи с замещением мхов-торфообразователей видами растений, не образующими торф [13, 16]. Широкое распространение регресса на болотах северного полушария дало основание Брадис [6] выделить, наряду с общепринятыми низинным, переходным и верховым типами, регрессивный тип болот. К факторам, способствующим болотному регрессу, относят ухудшение водного режима, приводящее к усилению обводненности поверхности болот; появление растений, аккумулирующих азот, избыток которого является причиной исчезновения мохового покрова; истощение минеральных солей в торфе; выделение газов, разрушающих участки торфяной залежи и приводящих к отравлению растительности и т.д. [2, 5, 15, 16, 24, 28].
Вопросы диагностики и классификации почв регрессивных болот обсуждаются в литературе. Предлагается в рамках типа олиготрофных почв выделить новый подтип торфяных олиготрофных регрессивных почв, приуроченных к немерзлотным типам болотных биогеоценозов [22]. Однако отсутствуют данные по микробиологическому анализу почв этого типа.
Цель работы – выявление структурно-функциональной организации микробных сообществ почв регрессивного болота немерзлотного типа.
ОБЪЕКТЫ И МЕТОДЫ
Исследования проводили на пробной площади Западнодвинского лесоболотного стационара Института лесоведения РАН в Тверской области [7]. Анализируемый участок – часть грядово-мочажинного сфагнового безлесного болота “Большой Роговской Мох” (56°08′20″ N, 32°06′06″ E) на олиготрофной торфяной почве (Dystric Fibric Histosols). Отложения болота представлены торфом, возраст которого 8590 ± 179 тыс. лет; подстилаются органо-минеральным сапропелем. Залежь сложена до 2 м верховым торфом слаборазложившимся (степень разложения 3–15%); от 2 до 3 м – среднеразложившимся (25–35%). Значения рНKCl варьируют сверху вниз по профилю от 2.7 до 4.3. Регрессивные явления выражены в виде многочисленных (черных) пятен торфа без сфагнового очеса преимущественно округлой, в меньшей степени вытянутой формы площадью от 0.05 до 1 м2. Образцы отбирали в конце августа 2015 г. (характеризовался как сухой период: за месяц количество выпавших осадков составило 6.9 мм) и в конце августа 2017 г. (характеризовался как влажный период: за месяц количество выпавших осадков достигло 87.9 мм).
Образцы регрессивной пленки (ее толщина варьирует в пределах 2 см) отбирали из пяти пятен, удаленных друг от друга на расстоянии 3–7 м в 10‑кратной повторности. Для сравнительного анализа дополнительно проводили отбор образцов очеса Sphagnum magellanicum Bird. с участков болота, не затронутых регрессией. Анализировали также трехметровые скважины непосредственно под регрессивными пятнами и на участках без регрессии (далее контрольные участки). Отбор образцов осуществляли с глубин 0–5, 5–20, 20–50, 50–100, 100–150, 150–200, 200–225, 225–250, 250–275, 275–300 см. Образцы пленок и верхних слоев (0–20 см) извлекали из торфяного массива вручную, все остальные – с помощью бура с пробоотборником. Затем образцы помещали в стерильные пластиковые чашки, которые в тот же день в охлажденном виде доставляли в лабораторию для дальнейших исследований.
Общую численность и биомассу микроорганизмов определяли прямым методом с использованием люминесцентной микроскопии [20]. Предварительно десорбировали клетки на ультразвуковом диспергаторе Bandelin Sonopuls HD 2070 (Германия) в течение 2 мин при мощности 50%. Для одного образца готовили 18 препаратов (6 – на грибы, 6 – на бактерии и 6 – на водоросли). При количественном учете клеток бактерий препараты окрашивали водным раствором акридина оранжевого (1 : 10 000), для учета мицелия и спор грибов применяли калькофлуор белый (1 : 10 000). Водоросли учитывали на стеклах без окрашивания. Препараты просматривали на люминесцентном микроскопе ЛЮМАМ-ИЗ (Россия) (светофильтры ЖС-19, ЖС-18, объектив ×90 Л, окуляры ×4 или ×5): по 50 полей зрения для учета грибов и водорослей и по 20 полей зрения – для учета бактерий.
Численность и биомассу микроорганизмов вычисляли по формулам, приведенным в статье [9]. Осуществляли пересчет показателей обилия микроорганизмов на 1 г сухого образца. Влажность определяли, высушивая образцы при 105°С в течение 6 ч.
Численность и таксономический состав бактерий сапротрофного блока определяли методом посева из серийных разведений на агаризованную глюкозо-пептонно-дрожжевую среду [12] в пятикратной повторности. Для ингибирования роста грибов в среду добавляли 50 мг нистатина на 0.5 л среды. Посевы инкубировали при комнатной температуре в течение 2–3 нед. Общую численность бактерий выражали в колониеобразующих единицах (КОЕ) на 1 г образца. Проводили дифференцированный учет колоний бактерий разных таксономических групп. Основных представителей бактерий выделяли в чистую культуру и идентифицировали до вида по результатам секвенирования нуклеотидных последовательностей гена 16S рРНК с использованием программы BLAST [18]. Доминирующими считали таксоны бактерий, колонии которых составляли более 30% от общего числа колоний на чашке [12].
Численность и видовой состав культивируемых микромицетов определяли методом посева из серийных разведений на среду Чапека и сусло-агар в пятикратной повторности [20]. Данные по общей численности микроскопических грибов выражали количеством КОЕ на 1 г субстрата. Видовую идентификацию грибов проводили по общепринятым определителям на основе культурально-морфологических признаков [26, 27, 29, 31, 36]. Наименование видов микромицетов и их систематическое положение даны по базам данных: The MycoBank Fungal databases (http:/www.mycobank.org) и GABI Bioscience Databases Index Fungorum (indexfungorum.org). Названия телеоморфной (половой) стадии грибов приведены для тех видов, которые формировали ее при культивировании, для остальных видов из отдела Ascomycota приведены названия анаморфной (бесполой) стадии [33]. Видовое разнообразие микромицетов оценивали по показателям пространственной частоты встречаемости и относительного обилия. Частоту встречаемости характеризовали числом образцов, в которых был обнаружен данный вид грибов, к общему числу исследованных образцов. Для анализа сходства видового состава микромицетных комплексов исследуемых субстратов использовали коэффициент Серенсена [19].
Видовой состав водорослей определяли методом прямого микроскопирования свежих образцов и образцов из влажных камер после 5 и 30 сут инкубирования [8]. Идентификацию проводили по отечественным и зарубежным определителям [25, 32, 35]. Наименование видов водорослей и их систематическое положение даны по базе данных AlgaeBase [30].
Эмиссию CO2 измеряли портативной фотосинтетической системой Li 6400 (Li COR Biosciences, Inc., USA), оснащенной штатной непрозрачной камерой для измерения потоков СО2 из почвы.
Эмиссию CH4 определяли камерным методом. Камеры, накопители метана из полиэтиленового материала, снабженные пробоотборниками с силиконовыми шлангами, емкостью 33 л и площадью основания 0.1075 м2, устанавливали на металлические основания с гидрозатвором для герметизации. Отобранные шприцом пробы воздуха анализировали на газовом хроматографе Кристалл 2000 М (Россия). Измерения проводили еженедельно в первой половине дня.
Процентное содержание углерода и азота в различных вариантах опыта определяли на приборе Vario EL III (Elementar, Germany) в токе кислорода при 1150°С.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
На первом этапе анализировали данные по численности и таксономическому составу водорослей, бактерий, грибов в регрессивных пленках и очесе сфагнового мха, отобранном с площадок без признаков регрессии.
Методом прямого счета в регрессивных пленках установлена высокая численность водорослей, которая с учетом пространственного фактора варьировала от 202 × 106 до 531 × 106 кл./г субстрата. В очесе сфагнового мха водоросли обнаружить не удалось.
Общее число видов водорослей, известных для почв болотных экосистем, приближается к 500 [8]. Наиболее распространены представители отделов Chlorophyta, Charophyta (конъюгаты), Ochrophyta (диатомовые и желто-зеленые), Euglenophyta и Cyanoprokaryota. В регрессивных пленках были обнаружены представители трех отделов: Charophyta, Ochrophyta и Euglenophyta. Основу биомассы составляли зеленые нитчатые водоросли (Microspora floccosa (Vaucher) Thuret), формирующие плотный войлок, и скопления коккоидных форм (Mesotaenium chlamydosporum De Bary и Mesotaenium macrococcum (Kützing ex Kützing) J. Roy & Bisset), образующие обильные студенистые обрастания на поверхности и внутри пленок. Найденные в пленках водоросли Microspora floccosa являются типичными представителями сфагновых болот. Коккоидные формы заселяют мелкие водоемы на болотах, поверхность скал, мертвой древесины, мхов; могут развиваться самостоятельно или в скоплении водорослей (Mesotaenium macrococcum). Некоторые из них считаются типичными аэрофитами [13], колонизируют обрастания мхов, образуют желатинообразные скопления на поверхности почвы в ацидных условиях (Mesotaenium chlamydosporum).
В качестве минорных представителей в альгологических сообществах исследуемых пленок встречались: Penium polymorphum (Perty) Perty (частый обитатель обводненных участков сплавин заболоченных озер разной трофности); Actinotaenium crassiusculum (De Bary) Teiling (ацидофил, олиготроф, часто встречающийся в сфагновых болотах); Cylindtocystis brebissonii (Ralfs) De Bary и Cylindrocystis gracilis I. Hirn (обитатели слабо- и сильнообводненных участков сфагновых болот); Euglena mutabilis F. Schmitz (представитель, обитающий на сыром торфянистом грунте окраин болот или на песчаных, богатых гумусом почвах при рН 4–4.8); Kobayasiella parasubtilissima (H. Kobayasi & T. Nagumo) Lange-Bertalot (типичный почвенный вид). Приуроченность этих видов к болотным местам обитания известна из литературы [1, 25, 32] и подтверждается настоящим исследованием.
Следует отметить низкое видовое разнообразие желто-зеленых водорослей и отсутствие цианобактерий в исследуемом субстрате. Очевидно, регрессивные пленки исследуемого торфяника не богаты питательными веществами, о чем свидетельствует бедность их альгологического сообщества. Известно, что с уменьшением трофности болот снижается видовое разнообразие водорослей и происходит переход от многодоминантного сообщества к малодоминантному [3, 4].
В регрессивных пленках выявлена высокая численность бактерий, которая с учетом пространственного фактора варьировала от 50 × 109 до 144 × 109 кл./г субстрата и была в 3–7 раз выше, чем в очесе сфагнового мха. Появление на поверхности пленок растений, аккумулирующих азот, создает благоприятные условия для развития бактерий, прежде всего, за счет подщелачивания среды. Численность бактерий, выявленная в регрессивных пленках, сравнима с таковой в низинных торфяниках [10, 11].
Диапазон численности сапротрофных бактерий (установленный методом посева) в пленках был широк и составил (13–92) × 104 КОЕ/г, что в 2–4 раза выше, чем в очесе мха – (7–21) × 104 КОЕ/г. Максимальные показатели численности бактерий для обоих субстратов были выявлены во влажные периоды исследования.
Анализ таксономической структуры бактериальных комплексов регрессивных пленок выявил доминирование протеобактерий во влажный период и протеобактерий и бацилл – в сухой. На основании результатов секвенирования последовательностей гена 16S рРНК протеобактерии были отнесены к видам: Chryseobacterium gregarium, Chryseobacterium yeoncheonense, Stenotrophomonas rhizophila, Pseudomonas koreensis, Chromobacterium vacinii.
Представители изолированных из пленок родов протеобактерий являются типичными копиотрофами, ассоциированными с растениями и почвами. Они обладают способностью разлагать легкодоступные полимеры, а проводить деструкцию таких труднодоступных полимеров, как хитин и целлюлоза не могут [23, 34]. У бактерий вида Stenotrophomonas rhizophila выявлена способность стимулировать рост растений и подавлять рост фитопатогенных грибов [37]. Гидролитический бактериальный блок представлен в пленках преимущественно бациллами, частота доминирования которых высока в сухие периоды исследования.
В очесе мха обнаружены представители тех же родов бактерий, что в пленках: Pseudomonas, Stenotrophomonas, Chryseobacterium. Отличалась их видовая принадлежность – Pseudomonas sp. и Chryseobacterium soli, кроме Stenotrophomonas rhizophila.
В регрессивных пленках прямым методом обнаружены как мицелий, так и споры грибов. В сухой период длина грибного мицелия была минимальной и не превышала 50 м/г субстрата. Во влажный период его длина увеличивалась на 1–2 порядка и была сравнима с таковой в очесе сфагнума. Обратная тенденция была выявлена для спор грибов. В сухой период их численность характеризовалась максимальными значениями, в период повышенной влажности – минимальными (табл. 1). В очесе мха показатели обилия грибов характеризовались близкими значениями, как в сухой, так и влажный периоды. Длина грибного мицелия варьировала от 2 до 5 км/г, численность спор – от 115 × 106 до 223 × 106 спор/г.
Таблица 1.
Показатели обилия грибов в регрессивных пленках и в очесе сфагнума в сухой (СП) и влажный (ВП) периоды отбора образцов
| Субстрат | Грибной мицелий, км/г | Споры грибов, 106 спор/г | ||
|---|---|---|---|---|
| СП | ВП | СП | ВП | |
| Регрессивные пленки | 0.05–0.1 | 2–4 | 141–314 | 43–50 |
| Очес сфагнума | 2–3 | 2–5 | 170–212 | 115–223 |
Численность микромицетов (определена методом посева) в регрессивных пленках составила (364 ± 37) × 103 КОЕ/г субстрата и была в 2–3 раза ниже, чем в очесе сфагнума. Видовое разнообразие, напротив было выше в пленках: 12 видов, тогда как в очесе сфагнума – 7. Видовой состав микромицетов в исследуемых субстратах значительно различался, о чем свидетельствует коэффициент Серенсена, который составил всего 0.3. В очесе сфагнума доминировали Penicillium aurantiogriseum Dierckx, Penicillium thomii Maire, Talaromyces funiculosus (Thom) Samson et al., в регрессивных пленках – Penicillium miczynskii Zal., Umbelopsis vinacea (Dixon-Stew.) Arx и тонкий стерильный светлый мицелий. В группе с частотой встречаемости 30–60% общими для исследуемых субстратов оказались Mortierella sp. и P. aurantiogriseum. В пленках к ним добавлялись Phoma sp. и Lecanicillium lecanii (Zimm.) Zare & W. Gams, а в очесе сфагнума – Aureobasidium pullulans (de Bary) Arnaud. Спектр редко встречающихся видов был шире в пленках и насчитывал четыре вида, тогда как в очесе сфагнума только один – Trichoderma atroviride P. Karst (табл. 2). Сравнивая видовой состав микромицетных комплексов регрессивных пленок с данными, полученными для верховых и низинных торфяников, следует отметить, что среди микромицетов, встречающихся в пленках, обнаружены виды (P. miczynskii и Umbelopsis vinacea), которые входят в группу, доминирующих в низинных торфяниках. Основным отличием микобиоты пленок от микобиоты низинных торфов является встречаемость грибов из рода Trichoderma. В пленках они входят в группу редко встречающихся, тогда как в низинных – в группу доминантов.
Таблица 2.
Таксономическая структура микобиоты в исследуемых субстратах
| Классы обилия по частоте встречаемости | Регрессивные пленки | Очес сфагнума |
|---|---|---|
| Доминирующие (>60%) |
Penicillium miczynskii Zal., Penicillium dierckxii Biourge, Umbelopsis vinacea (Dixon-Stew.) Arx, стерильный мицелий светлый |
Penicillium aurantiogriseum Dierckx, Penicillium thomii Maire, Talaromyces funiculosus (Thom) Samson et al. |
| Часто встречающиеся (30–60%) |
Lecanicillium lecanii (Zimm.) Zare & W. Gams, Mortierella sp., Penicillium aurantiogriseum Dierckx, Phoma sp. |
Aureobasidium pullulans (de Bary) Arnaud, Mortierella sp., Penicillium aurantiogriseum Dierckx |
| Редко встречающиеся (10–30%) |
Mucor hiemalis Wehmer, Talaromyces purpureogenus Samson et al., Trichoderma atroviride P. Karst., Trichoderma koningii Oud. |
Trichoderma atroviride P. Karst. |
На втором этапе проанализируем целиком почвенные профили на контрольных участках и под регрессивными пятнами.
Биомасса в регрессивных пленках варьировала от 20 до 55 мг/г субстрата и была в 3–5 раза выше, чем в очесе сфагнума (табл. 3). В слое непосредственно под пленкой она характеризовалась меньшими величинами, чем в самой пленке. В слое 4–50 см запасы биомассы были несколько выше в контрольном торфянике. Нижние слои торфяных профилей (от 50 см до 3 м) по концентрации микробной биомассы не различались.
Таблица 3.
Запасы биомассы (мг/г) в профилях почв под регрессивными пятнами (А) и контрольными участками (Б) исследуемого болота
| Глубина, см | А | Б |
|---|---|---|
| 0–2 | 20–55 | 6–10 |
| 2–4 | 5–31 | 7–12 |
| 4–50 | 13–24 | 21–43 |
| 50–300 | 8–10 | 8–10 |
Таким образом, различия между торфяниками проявлялись только в верхней полуметровой толще (деятельном слое). В слое 0–50 см суммарная биомасса была выше под регрессивными пятнами за счет биомассы регрессивных пленок. Она составляла 50% от суммарного микробного пула, выявляемого в полуметровой толще.
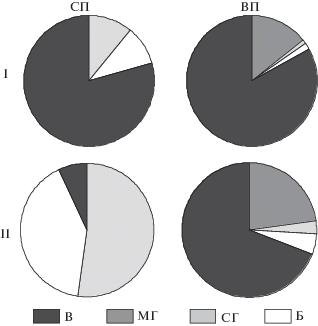
В структуре биомассы регрессивных пленок во все периоды доминировала биомасса водорослей. Грибной компонент был представлен в сухие периоды – преимущественно спорами, во влажные – мицелием. Доля бактерий варьировала от 2 до 10%. Что касается слоя непосредственно под пленками, то он во влажные периоды не отличался от самой пленки. В сухие периоды в этом слое основными компонентами становились грибные споры и бактерии, доля водорослей не превышала 7% (рис. 1).
Рис. 1.
Процентное соотношение компонентов биомассы в регрессивных пленках (I) и слое под пленками (II) в сухие (СП) и влажные периоды (ВП), В – водоросли; МГ – мицелий грибов; СГ – споры грибов; Б – бактерии.
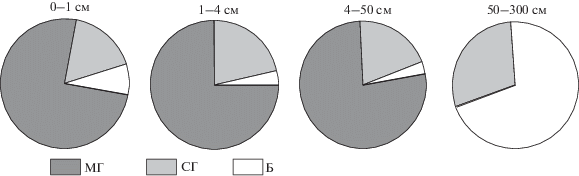
Иной была структура микробной биомассы в очесе сфагнового мха. Ее отличительной чертой было доминирование грибного мицелия, на долю грибных спор приходилось около 20%, бактерий – не более 8%. Структура микробной биомассы, выявленная для очеса сфагнума, сохранялась в слоях торфа до 50 см. В остальной толще преобладала бактериальная составляющая, на долю грибных спор приходилось около 30% (рис. 2).
Рис. 2.
Процентное соотношение компонентов микробной биомассы в почве контрольных участков. МГ – мицелий грибов; СГ – споры грибов; Б – бактерии.
Следует отметить, что верховые торфяники, дошедшие до регрессивной стадии, характеризуются низкими запасами микробной биомассы (300 г/м2 – в метровой толще; 600 г/м2 – в трехметровой толще), а в большей части их профиля доминирует бактериальная составляющая.
Эмиссия СО2 с поверхности регрессивных пятен с учетом сезонной динамики колебалась от 17 до 207 мгC/(м2 ч), с контрольных участков – от 9 до 177 мгC/(м2 ч) (табл. 4). Среднемесячная эмиссия СH4 с поверхности регрессивных пятен варьировала в широком диапазоне: от 0.01 до 2 мгC/(м2 ч), тогда как с контрольных участков – в пределах 0.2–2.5 мгC/(м2 ч). Поток метана и диоксида углерода из регрессивных пятен подчиняется общим закономерностям сезонной динамики парниковых газов. Величина эмиссии СО2, низкая в весенний период, постепенно возрастала, достигая наибольших значений в июле, после чего поток диоксида углерода снижался до минимальных значений в октябре. Эмиссия метана достигала максимальных величин в весенне-летний период наблюдений и снижалась в осенние месяцы. Важно отметить, что на участках под регрессивными пятнами, суммарная величина потока СО2 оказалась выше, чем на контрольных участках. Это можно объяснить большей скоростью минерализации растительных остатков вследствие аккумуляции азота в регрессивных пленках (табл. 5). Дополнительный азот позволяет ассимилировать большее количество углерода в микробной биомассе, что неизбежно сопровождается ростом потока конечных продуктов микробного окисления органического вещества – диоксида углерода. С другой стороны, аккумуляция азота оказывает совершенно иной характер на процесс метаногенеза. По данным Кравченко и Сирина [14], нитраты выступают ингибиторами метаногенеза, а изменение их концентрации имеет ведущее значение в регуляции потока метана из болотных экосистем. Накопление азота в регрессивных пленках ингибирует процесс метаногенеза, что приводит к снижению суммарной величины годового потока метана из регрессивных пятен по сравнению с участками без признаков регрессии.
Таблица 4.
Среднемесячная эмиссия СО2 и СН4 с поверхности регрессивных пятен и контрольных участков исследуемого болота, мг С/(м2 ч) ± ошибка среднего
| Участок | Месяц 2017 г. | Сумма | |||||
|---|---|---|---|---|---|---|---|
| май | июнь | июль | август | сентябрь | октябрь | ||
| Эмиссия СО2 | |||||||
| Под пятнами | 16.5 ± 1.8 | 133.6 ± 4.1 | 206.5 ± 3.6 | 156.9 ± 2.7 | 19.0 ± 2.9 | 11.4 ± 1.9 | 401.0 |
| Контрольные | 33.7 ± 2.1 | 87.4 ± 3.0 | 177.3 ± 4.8 | 110.7 ± 4.9 | 17.3 ± 1.9 | 8.8 ± 1.3 | 321.3 |
| Эмиссия СН4 | |||||||
| Под пятнами | 1.87 ± 0.03 | 0.52 ± 0.02 | 1.34 ± 0.03 | 0.56 ± 0.02 | 0.02 ± 0.004 | 0.01 ± 0.003 | 3.21 |
| Контрольные | 1.94 ± 0.04 | 0.23 ± 0.02 | 1.73 ± 0.03 | 2.50 ± 0.05 | 2.00 ± 0.04 | 2.28 ± 0.04 | 7.90 |
Таблица 5.
Содержание C, N и атомное отношение C/N в регрессивных пленках (А) и в слое торфа (0–4 см) контрольных участков (Б) исследуемого болота
| № участка | Вариант | C | N | C/N |
|---|---|---|---|---|
| 1 | А | 3.71 | 0.12 | 32 |
| Б | 3.83 | 0.04 | 101 | |
| 2 | А | 3.78 | 0.11 | 33 |
| Б | 3.81 | 0.04 | 97 | |
| 3 | А | 3.98 | 0.12 | 34 |
| Б | 3.69 | 0.04 | 83 | |
| 4 | А | 3.91 | 0.12 | 33 |
| Б | 3.86 | 0.05 | 84 | |
| 5 | А | 3.86 | 0.12 | 31 |
| Б | 3.81 | 0.04 | 97 |
ЗАКЛЮЧЕНИЕ
Анализ почв регрессивного болота немерзлотного типа показал, что если разделить профиль под регрессивным пятном на три части: регрессивная пленка, слой непосредственно под пленкой и нижележащие слои – то от образцов с контрольных участков по микробиологическим показателям будет резко отличаться только регрессивная пленка. Для нее характерны высокие запасы биомассы, которые составляют 1/2 от суммарной биомассы деятельного слоя. В структуре биомассы регрессивной пленки доминируют водоросли, на долю микроорганизмов приходится от 13 до 26%.
Регрессивные пленки характеризуются высокой численностью и низким видовым разнообразием водорослей. Все таксоны водорослей, обнаруженные в пленках – характерные обитатели болот.
Регрессивная пленка – это благоприятный субстрат не только для водорослей, но и для бактерий. О чем свидетельствует высокая численность бактерий, сравнимая с таковой в низинных торфяниках. Гидролитический бактериальный блок представлен бациллами.
В регрессивной пленке грибы представлены как мицелием, так и спорами. Численность и соотношение компонентов грибного комплекса зависит от влажности субстрата. Так, в увлажненной пленке в грибной биомассе доминирует мицелий, в подсохшей – споры. Показатели обилия грибного мицелия достигают максимальных значений во влажные периоды исследования.
Структура микобиоты регрессивной пленки имеет схожие черты с низинным торфом: низкая численность микромицетов, высокое видовое разнообразие, общие виды среди доминантов.
Поскольку в регрессивных пленках степень разложения, рНKCl, содержание азота выше, чем в слоях верхового торфа, в них складываются условия, близкие к низинным торфам. Это обстоятельство находит отражение в полученных результатах. Ряд микробиологических характеристик, выявленных для регрессивной пленки, имеет общие черты с низинными торфами.
Вследствие аккумуляции азота регрессивная пленка характеризуются большей скоростью минерализации растительных остатков, что ведет к увеличению эмиссии СО2, с одной стороны, и ингибированию метаногенеза – с другой.
Список литературы
Анисимова О.В. Десмидиевые водоросли сфагновых болот Московской области: видовое разнообразие и экологическая приуроченность // Тр. ИБВВ РАН. 2017. Вып. 79(82). С. 10–18.
Бахнов В.К. Биогеохимические аспекты болотообразовательного процесса. Новосибирск: Наука, 1986. 192 с.
Благодатнова А.Г. Структура группировок почвенных водорослей как возможный показатель состояния олиготрофного болота // Тр. междунар. форума по проблемам науки, техники и образования. М.: Акад. наук о Земле, 2009. С. 78–80.
Благодатнова А.Г. Тенденции изменения организации альгогруппировок // ДОСиГИК. Т. 7. 2016. № 1(13). С. 5–17.
Боч М.С., Мазинг В.В. Экосистемы болот СССР. Л.: Наука, 1979. 188 с.
Брадис Е.М. Растительный покров болот как показатель их типа по условиям питания // Основные принципы изучения болотных биогеоценозов. Л.: Наука, 1972. С. 29–38.
Вомперский С.Э., Сирин А.А., Глухов А.И. Формирование и режим стока при гидролесомелиорации. М.: Наука, 1988. 168 с.
Голлербах М.М., Штина Э.А. Почвенные водоросли. Л.: Наука, 1969. 142 с.
Головченко А.В., Волкова Е.М. Запасы и структура микробной биомассы в торфяниках карстовых ландшафтов Тульской области // Почвоведение. 2019. № 3. С. 370–376.
Головченко А.В., Тихонова Е.Ю., Звягинцев Д.Г. Численность, биомасса, структура и активность микробных комплексов низинных и верховых торфяников // Микробиология. 2007. Т. 76. № 5. С. 711–719.
Добровольская Т.Г., Головченко А.В., Кухаренко О.С., Якушев А.В., Семенова Т.А., Инишева Л.И. Структура микробных сообществ верховых и низинных торфяников Томской области // Почвоведение. 2012. № 3. С. 317–326.
Добровольская Т.Г., Головченко А.В., Лысак Л.В., Зенова Г.М. Физикохимия и биология торфа. Методы оценки численности и разнообразия бактериальных и актиномицетных комплексов торфяных почв. Томск: Изд-во ТГПУ, 2010. 100 с.
Косинская Е.К. Конъюгаты или сцеплянки (1). Мезотениевые и гонатозиговые водоросли // Флора споровых растений СССР. M.: Изд-во АН СССР, 1952. Т. 2. Ч. 1. 164 с.
Кравченко И.К., Сирин А.А. Активность и метаболическая регуляция метанообразования в глубоких торфяных профилях бореальных болот // Микробиология. 2007. Т. 76. № 6. С. 888–895.
Лисс О.Л., Абрамова Л.И., Аветов Н.А. и др. Болотные системы Западной Сибири и их природоохранное значение. Тула: Гриф и К, 2001. 584 с.
Лопатин В.Д. О наиболее существенных экологических особенностях болот // Экология. 1997. № 6. С. 419–422.
Лопатин В.Д. О новой трактовке определения болот // Экология. 1986. № 1. С. 70–72.
Манучарова Н.А., Власенко А.Н., Турова Т.П., Пантелеева А.Н., Степанов А.Л., Зенова Г.М. Термофильные хитинолитические микроорганизмы бурой полупустынной почвы // Микробиология. 2008. Т. 77. № 5. С. 683–688.
Мегарран Э. Экологическое разнообразие и его измерение. М.: Мир, 1992. 181 с.
Методы почвенной биохимии и микробиологии. М.: Изд-во Моск. ун-та, 1991. 304 с.
Ниценко А.А. Краткий курс болотоведения. М.: Высшая школа, 1967. 148 с.
Шишконакова Е.А., Аветов Н.А., Толпышева Т.Ю. Торфяные почвы регрессивных болот Западной Сибири: проблемы биологической диагностики и систематики // Бюл. Почв. ин-та им. В.В. Докучаева. 2016. Вып. 84. С. 61–74.
Behrendt U., Ulrich A., Schumann P. Chryseobacterium gregarium sp. nov., isolated from decaying plant material // Int. J. Syst. Evol. Microbiol. 2008. V. 58. P. 1069–1074.
Belyea L.R., Lancaster J. Inferring landscape dynamics of bog pools from scaling relationship and spatial patterns // J. Ecology. 2002. V. 90. P. 223–234.
Coesel P.F.M., Meesters K.J. Desmids of the Lowlands Mesotaeniaceae and Desmidaceae of the European Lowlands. Zeist: KNNV Publishing, 2007. 351 p.
Domsch K.H., Gams W., Anderson T. Compendium of Soil Fungi. V. 1. IHW-Verlag. 1993. 860 p.
Ellis M.B. Dematiaceous Hyphomycetes. Kew: Commonw. Mycol. Inst., 1971. 607 p.
Foster D.R., Fritz S.C. Mire development, pool formation and landscape processes on patterned fens in Dalarna, central Sweden // J. Ecology. 2002. V. 75. P. 409–437.
Gams W. von. Cephalosporium-artige Schimmelpilze (Hyphomycetes). Stuttgart: Fischer, 1971. 262 p.
Guiry M.D., Guiry G.M. AlgaeBase. World-wide electronic publication. Galway: National University of Ireland, 2019. http://www.algaebase.org
Hoog G.S. de. The genera Beauveria, Isaria, Tritirachium and Acrodontium gen. nov. // Studies in Mycology. 1972. V. 1. 41 p.
John D.M. Phylum Chlorophyta. Orders Chaetophorales, Microsporales, Ulotrichales // The freshwater algal flora of the British Isles. An identification guide to freshwater and terrestrial algae / Eds.: John D.M., Whitton B.A., Brook A.J. Cambridge: Cambridge University Press, 2011. P. 524–554.
Kirk P.M., Cannon P.F., Minter D.W., Stalpers J.A. et al. Ainsworth & Bisby’s Dictionary of the Fungi. CAB International, 2008. 771 p.
Kwon S.W., Kim J.S., Park I.C., Yoon S.H., Park D.H., Lim C.K., Go S.J. Pseudomonas koreensis sp. nov., Pseudomonas umsongensis sp. nov. and Pseudomonas jinjuensis sp. nov., novel species from farm soils in Korea // Int. J. Syst. Evol. Microbiol. 2003. № 53. P. 21–27.
Lange-Bertalot H., Hofmann G., Werum M., Cantonati M. Freshwater benthic diatoms of Central Europe: over 800 common species used in ecological assessments. Schmitten-Oberreifenberg: Koeltz Botanical Books, 2017. 942 p.
Pitt J.I. The Genus Penicillium and its teleomorphic states Eupenicillium and Talaromyces. L.: Acad. press, 1979. 634 p.
Wolf A., Fritze A., Hagemann M., Berg G. Stenotrophomonas rhizophila sp. nov., a novel plant-associated bacterium with antifungal properties // Int. J. Syst. Evol. Microbiol. 2002. V. 52. P. 1937–1944.
Дополнительные материалы отсутствуют.


