Почвоведение, 2021, № 4, стр. 429-435
Прокариотный комплекс копролитов Aporrectodea caliginosa и Lumbricus terrestris
В. Ю. Шахназарова a, b, А. В. Якушев c, *, К. Л. Якконен a, А. А. Кичко b, Т. С. Аксенова b, Н. П. Битюцкий a
a Санкт-Петербургский государственный университет
199178 Санкт-Петербург, Университетская наб., 7/9, Россия
b ВНИИСХМ
196608 Санкт-Петербург, шоссе Подбельского, 3, Пушкин-8, Россия
c МГУ им. М.В. Ломоносова
119991 Москва, Ленинские горы, 1, Россия
* E-mail: a_yakushev84@mail.ru
Поступила в редакцию 20.05.2020
После доработки 01.10.2020
Принята к публикации 27.10.2020
Аннотация
Впервые с помощью методов метагеномики проведено сравнительное исследование влияния дождевых червей двух видов (Aporrectodea caliginosa и Lumbricus terrestris) на состав прокариотного комплекса дерново-подзолистой почвы. Прокариоты в почве и копролитах были представлены преимущественно филами Acidobacteria, Actinobacteria, Bacteroidetes, Chloroflexi, Gemmatimonadetes, Planctomycetes, Proteobacteria, Verrucomicrobia. Пассаж почвы через кишечник дождевых червей отражался на обилии некоторых таксонов ее прокариотного блока, но не на общих показателях биоразнообразия. В копролитах червей обоих видов регистрировали уменьшение обилия фил Acidobacteria и Gemmatimonadetes, включающих преимущественно олиготрофные бактерии, в копролитах L. terrestris – увеличение доли фил Actinobacteria и Firmicutes, представленных в основном копиотрофами и гидролитиками. Кроме того, в копролитах L. terrestris возрастало обилие анаэробных бактерий Clostridiaceae и способных к нитратному дыханию Flavobacterium, по-видимому, вследствие возникновения в трансформированной червями почве анаэробных условий. В целом изменения таксономической структуры прокариот в почве, обработанной L. terrestris, были более масштабными, чем в почве, обработанной A. caliginosa. Эти различия между копролитами червей изученных видов могут быть обусловлены особенностями функционирования их пищеварительных систем, приспособленных к трансформации отличающихся по составу источников питания.
ВВЕДЕНИЕ
Дождевые черви – одна из важнейших групп почвенных животных, существенно влияющая на плодородие почв и рост растений [12]. Благодаря высокой локомоторной и пищевой активности, дождевые черви модифицируют структуру почвы и стабильность ее агрегатов, скорость гумификации органического материала и доступность элементов минерального питания растениям [10, 11]. В процессах минерализации органического вещества ключевую роль играют почвенные микроорганизмы. Дождевые черви способны модифицировать структуру и свойства микробного сообщества почвы [2, 23], что в комбинации с непосредственным измельчением и перевариванием пищи этими беспозвоночными животными стимулирует разложение ими растительных остатков [22].
Молекулярно-генетический анализ микроорганизмов открывает новые перспективы в изучении механизмов воздействия дождевых червей на почвенные процессы. Исследования подобного рода уже проводились в отношении червей отдельных видов, обитающих в некоторых почвах [8, 9, 20]. Однако сравнительные молекулярно-генетические исследования влияния на таксономический состав почвенных микроорганизмов дождевых червей, принадлежащих к разным экологическим группам, до сих пор не предпринимались. Недостаточно исследован состав прокариотного комплекса копролитов двух самых распространенных на Северо-Западе России видов дождевых червей: Aporrectodea caliginosa (Savigny) и Lumbricus terrestris. Если A. сaliginosa – из группы эндогейных дождевых червей, предпочитающих поглощать почву [5], то L. terrestris – типичный “норник”, питающийся в основном растительным опадом с поверхности почвы [6].
Цель работы – изучить влияние дождевых червей двух видов (A. caliginosa и L. terrestris) на биологическое разнообразие и таксономическую структуру прокариотического сообщества дерново-подзолистой почвы.
ОБЪЕКТЫ И МЕТОДЫ
Объекты исследования. Исследовали дождевых червей двух видов: A. caliginosa и L. terrestris, отобранных вручную в Ломоносовском районе Ленинградской области. В качестве субстрата для содержания червей использовали гумусово-аккумулятивный горизонт дерново-подзолистой глееватой супесчаной почвы (Albic Glossic Retisol (Epiarenic Endoloamic, Cutanic, Ochric)). Ее отбор осуществляли в местах обитания дождевых червей исследованных видов. Агрохимическая характеристика почвы: ${\text{р}}{{{\text{Н}}}_{{{{{\text{Н}}}_{{\text{2}}}}{\text{O}}}}}$ 5.9, рНKCl 4.9, Cорг 2.4%, Nобщ 0.1%, Р2O5 77.7 мг/кг, K2O 160.7 мг/кг. Общее содержание азота и углерода в почве определяли с помощью CHN-анализатора LECO CHN628 (США). Реакцию среды почв и копролитов измеряли в водной вытяжке с помощью pH-метра. Подвижные формы фосфора и калия извлекали 0.2 М раствором HCl при соотношении почва : : раствор 1 : 5.
Инкубация дождевых червей в почве и получение копролитов. Дождевых червей предварительно выдерживали в воде при 6°С в течение трех суток до полного очищения их пищеварительного тракта от почвы, поглощенной в местах обитания [1]. У дождевых червей газообмен осуществляется через покровы тела (кожное дыхание), и погружение этих беспозвоночных животных в воду не приводит к нарушению их дыхания. С уменьшением температуры растворимость в воде кислорода возрастает. Поэтому низкая температура воды способствовала сохранению высокой активности дождевых червей в период очищения их пищеварительного тракта. Затем дождевых червей помещали в наполненные почвой пластиковые сосуды объемом 1 л и инкубировали их при комнатной температуре 7 сут. Влажность почвы поддерживали на уровне 60% от ее полной влагоемкости. Контрольную почву инкубировали в идентичных условиях, но без червей. Затем червей извлекали из почвы, помещали в чашки Петри на увлажненную фильтровальную бумагу и инкубировали еще в течение суток для получения копролитов и их последующего анализа.
Микробиологическое исследование. Таксономический состав бактерий и архей в почве и копролитах определяли с помощью анализа нуклеотидной последовательности фрагмента гена 16s рРНК. Сырой экстракт ДНК извлекали из почвы (0.25 г) экстрагирующим буфером (700 мкл) и смесью фенола и хлороформа (1 : 1 по объему, 400 мл) при встряхивании с керамическими шариками диаметром 0.1 и 0.5 мм в гомогенизаторе FastPrep 24 (MP Medicals, США). В качестве экстрагирующего буфера использовали смесь двух растворов: А − 200 мМ натрий-фосфатный буфер, 240 мМ гуанидин изотионат, рН 7.0; Б − 500 мМ Tris-HСl, 1%-ный раствор додецилсульфата натрия в соотношении 1 : 1 (по массе к объему). Далее образцы центрифугировали 5 мин при 14 000 g, отбирали супернатант и проводили повторную экстракцию в хлороформ-изоамиловом спирте с последующим центрифугированием. С целью осаждения ДНК к супернатанту добавляли изопропиловый спирт в объемном соотношении 1 : 1, после чего полученную смесь перемешивали встряхиванием и центрифугировали 5 мин до получения плотного осадка ДНК. Осадок промывали 70%-ным этанолом, высушивали при комнатной температуре и растворяли в деионизированной воде в течение 10 мин при 65°С. Полученный сырой экстракт ДНК очищали при помощи электрофореза в 1%-агарозном геле с последующей сорбцией ДНК на SiO2.
Библиотеки ампликонов создавали методом полимеразной цепной реакции с использованием широкоспецифичных универсальных праймеров на вариабельный участок V4 гена 16S рРНК (ferier_F515: GTGCCAGCMGCCGCGGTAA/ferier_R806:GGACTACVSGGGTATCTAAT) с добавлением линкеров и уникальных баркодов [15]. Дальнейшую подготовку проб и пиросеквенирование проводили на платформе Roshe GS Junior (Roshe, Швейцария) в соответствии с рекомендациями производителя. Для обработки полученных библиотек использовали инструментарий программного пакета QIIME: демультиплексирование, фильтрацию последовательностей по качеству прочтения и количеству гомополимеров, объединение в операционные таксономические единицы (ОТЕ) при пороге сходства 97%, удаление химер и таксономический анализ [13]. Для оценки разнообразия прокариотного сообщества рассчитывали индексы Симпсона, Шеннона, Менхиника, Маргалефа, Чао и коэффициент выравненности [7].
Математическая обработка данных. Повторность опытов для анализа прокариотной ДНК пятикратная. Достоверность различий между средними значениями долей амплифицированных фрагментов ДНК оценивали с помощью однофакторного дисперсионного анализа в программе IBM SPSS Statistics Version 25 с использованием непараметрического Т3-критерия Даннета. Выбор этого критерия был обусловлен неоднородностью дисперсий данных, которую оценивали с помощью критерия Левена. Достоверным считались различия при p < 0.05. В таблицах и тексте статьи приведены средние значения ± стандартные отклонения.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Среднеарифметические значения числа ОТЕ и индексов биоразнообразия прокариотических комплексов копролитов дождевых червей достоверно не отличались от таковых в контрольной почве (табл. 1). Очевидно, пассаж почвы через кишечник существенно не изменял биоразнообразие ее прокариотного блока. Согласно расчетам, доля ОТЕ бактерий в почве составила 98.5 ± 0.3%, в копролитах А. caliginosa – 96.9 ± 1.8%, в копролитах L. terrestris – 97.4 ± 1.6%. Доля архей, представленных в основном классом Thaumarchaeota, в почве, копролитах А. caliginosa и L. terrestris – 0.2 ± 0.4, 0.8 ± 1.6 и 0.8 ± 1.4% соответственно. Следовательно, пассаж почвы через пищеварительную систему дождевых червей не сопровождался значительными изменениями соотношения архей и бактерий в ее составе.
Таблица 1.
Индексы альфа-разнообразия и число ОТЕ прокариотного сообщества в почве и копролитах L. terrestris и A. caliginosa. Приведены средние значения ± стандартное отклонение. Идентичные буквы обозначают отсутствие достоверных различий между средними значениями обилия для данного таксона в вариантах опыта
| Индекс | Почва | Копролиты | |
|---|---|---|---|
| L. terrestris | A. caliginosa | ||
| Среднеарифметическое число ОТЕ | 920 ± 198a | 716 ± 36a | 768 ± 49a |
| Менхиника | 13.9 ± 2.8a | 13.5 ± 0.8a | 14.8 ± 2.2a |
| Маргалефа | 61.6 ± 15.6a | 54.8 ± 3.9a | 61.6 ± 10.7a |
| Симпсона | 0.992 ± 0.003a | 0.993 ± 0.001a | 0.993 ± 0.003a |
| Шеннона | 5.5 ± 0.3a | 5.5 ± 0.1a | 5.6 ± 0.3a |
| Выравненности | 0.91 ± 0.02a | 0.93 ± 0.01a | 0.93 ± 0.02a |
| Чао1 | 1095 ± 316a | 948 ± 116a | 1051 ± 184a |
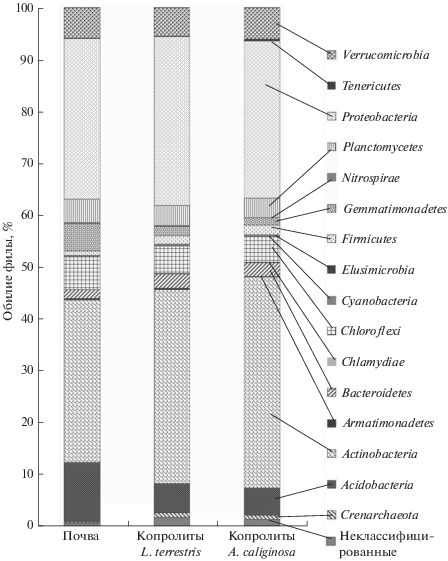
Бактерии в почве и копролитах были преимущественно представлены филами Acidobacteria, Actinobacteria, Bacteroidetes, Chloroflexi, Gemmatimonadetes, Planctomycetes, Proteobacteria, Verrucomicrobia (рис. 1, табл. 2). В копролитах червей обоих видов доли фил Acidobacteria и Gemmatimonadetes были в 2–3 раза меньше по сравнению с исходной почвой, а в копролитах L. terrestris возрастала доля фил Actinobacteria и Firmicutes.
Таблица 2.
Бактериальные таксоны в почве и копролитах L. terrestris и A. caliginosa, доля представителей которых различалась достоверно (по непараметрическому критерию T3 Даннета, p < 0.05). Приведены средние арифметические значения ± стандартное отклонение. Идентичные буквы обозначают отсутствие достоверных различий между средними значениями обилия для данного таксона в вариантах опыта
| Таксон | Почва | Копролиты | |
|---|---|---|---|
| L. terrestris | A. caliginosa | ||
| Филы | |||
| Acidobacteria | 11.5 ± 1.3a | 5.0 ± 1.0b | 6.2 ± 1.0b |
| Actinobacteria | 31.0 ± 1.3a | 40.4 ± 2.0b | 37.2 ± 2.0ab |
| Firmicutes | 0.9 ± 0.2a | 1.9 ± 0.3b | 1.6 ± 0.3ab |
| Gemmatimonadetes | 5.2 ± 0.5a | 1.3 ± 0.2b | 1.8 ± 0.4b |
| Классы | |||
| DA052 (Acidobacteria) | 0.7 ± 0.2a | 0.1 ± 0.05b | 0.1 ± 0.04b |
| Acidobacteria-5 | 0.3 ± 0.1b | 0.1 ± 0.05a | 0.2 ± 0.02a |
| Acidobacteria-6 | 2.8 ± 0.3a | 1.6 ± 0.4b | 2.0 ± 0.7ab |
| Acidobacteriia | 5.2 ± 1.9a | 1.9 ± 0.6b | 1.5 ± 0.5b |
| Chloroflexi | 1.0 ± 0.4a | 0.2 ± 0.2b | 0.4 ± 0.5ab |
| Anaerolineae | 0.5 ± 0.1a | 0.1 ± 0.06b | 0.2 ± 0.06a |
| Gemm-1 (Gemmatimonadetes) | 1.7 ± 0.7a | 0.2 ± 0.2b | 0.3 ± 0.2b |
| Gemmatimonadetes | 3.5 ± 0.8a | 1.1 ± 0.5b | 1.4 ± 0.9b |
| Deltaproteobacteria | 5.9 ± 0.8a | 4.1 ± 0.6b | 5.1 ± 0.9ab |
| Pedosphaerae | 1.6 ± 0.5a | 0.7 ± 0.6b | 0.7 ± 0.4b |
| Actinobacteria | 7.4 ± 0.4a | 13.4 ± 1.2b | 13.1 ± 0.8b |
| Phycisphaerae | 0.7 ± 0.1a | 0.2 ± 0.09b | 0.5 ± 0.02a |
| Flavobacteriia | 0.04 ± 0.02a | 0.4 ± 0.08b | 0.1 ± 0.07a |
| Порядки | |||
| iii1-15 (Acidobacteria) | 2.6 ± 0.4a | 1.5 ± 0.4b | 1.9 ± 0.7ab |
| Acidobacteriales | 5.1 ± 1.9a | 1.9 ± 0.5b | 1.5 ± 0.4b |
| Ellin6513 (Acidobacteria) | 0.7 ± 0.3a | 0.1 ± 0.1b | 0.1 ± 0.1b |
| Actinomycetales | 7.4 ± 0.8a | 13.4 ± 2.6b | 13.0 ± 1.8b |
| Flavobacteriales | 0.02 ± 0.02a | 0.4 ± 0.09b | 0.1 ± 0.07a |
| Roseiflexales | 0.9 ± 0.4a | 0.1 ± 0.1b | 0.3 ± 0.3ab |
| N1423WL (Gemmatimonadetes) | 0.7 ± 0.4a | 0.04 ± 0.05b | 0.08 ± 0.08ab |
| Myxococcales | 4.0 ± 0.2a | 3.0 ± 0.2b | 3.0 ± 0.2b |
| Pedosphaerales | 1.6 ± 0.5a | 0.7 ± 0.2b | 0.7 ± 0.4b |
| Семейства | |||
| Microbacteriaceae | 0.2 ± 0.2a | 1.1 ± 0.4b | 0.7 ± 0.4ab |
| Streptomycetaceae | 0.4 ± 0.1a | 1.2 ± 0.4b | 0.7 ± 0.3ab |
| Sinobacteraceae | 0.3 ± 0.1a | 0.8 ± 0.4b | 0.5 ± 0.2ab |
| Micrococcaceae | 0.4 ± 0.1a | 1.1 ± 0.4ab | 1.8 ± 0.5b |
| Intrasporangiaceae | 0.7 ± 0.09a | 1.0 ± 0.5ab | 1.5 ± 0.3b |
| Iamiaceae | 0.02 ± 0.04a | 0.02 ± 0.04a | 0.12 ± 0.04b |
| Koribacteraceae | 4.7 ± 1.8a | 1.7 ± 0.7b | 1.1 ± 0.4b |
| Kouleothrixaceae | 0.8 ± 0.3a | 0.1 ± 0.1b | 0.2 ± 0.2ab |
| Clostridiaceae | 0.02 ± 0.05a | 0.3 ± 0.06b | 0.06 ± 0.02a |
| Flavobacteriaceae | 0.02 ± 0.02a | 0.4 ± 0.09b | 0.08 ± 0.03a |
| Роды | |||
| Iamia | 0.02 ± 0.04a | 0.02 ± 0.04a | 0.12 ± 0.04b |
| Kribbella | 0.1 ± 0.07a | 0.28 ± 0.04b | 0.12 ± 0.04a |
| Candidatus Koribacter | 3.3 ± 1.2a | 1.2 ± 0.5ab | 0.7 ± 0.4b |
| Flavobacterium | 0.02 ± 0.04a | 0.4 ± 0.12b | 0.08 ± 0.08a |
| Pirellula | 0.2 ± 0.1a | 0 ± 0.0b | 0 ± 0.0b |
По сравнению с исходной почвой в копролитах червей обоих видов уменьшалась доля входящих в филу Acidobacteria классов DA052, Acidobacteria, Acidobacteria-5, а также порядков Acidobacteriales. Кроме того, в копролитах L. terrestris снижалась доля класса Acidobacteriia-6, а в копролитах A. caliginosa – Candidatus Koribacter. В составе филы Actinobacteria также происходили зоогенные изменения. В копролитах A. caliginosa возрастала доля семейств Micrococcaceae, Intrasporangiaceae, Iamiaceae и рода Iamia, в копролитах L. terrestris – семейств Microbacteriaceae, Streptomycetaceae, Sinobacteraceae и рода Kribbella, в копролитах обоих червей – классов Actinobacteria, порядка Actinomycetales на фоне уменьшения обилия семейства Koribacteraceae. В филе Gemmatimonadetes оба червя уменьшали доли классов Gemmatimonadetes и Gemm-1, а L. terrestris – еще и порядка N1423WL. В филе Chloroflexi доля порядка Roseiflexales и семейства Kouleothrixaceae уменьшилась в копролитах L. terrestris. Доля класса Pedosphaerae и порядка Pedosphaerales (фила Verrucomicrobia), а также порядка Myxococcales (фила Рroteobacteria) снизилась после прохождения почвы через кишечный тракт червей обоих видов. В то же время доля бактерий класса Deltaproteobacteria (фила Рroteobacteria) уменьшилась лишь в копролитах L. terrestris. Кроме того, в копролитах L. terrestris возросла доля семейства Clostridiaceae (фила Firmicutes), а также класса Flavobacteriia, порядка Flavobacteriales, семейства Flavobacteriaceae, рода Flavobacterium (фила Bacteroidetes). При этом снизилась доля класса Phycisphaerae филы Planctomycetes. В то же время обилие относящегося к этой филе рода Pirellula уменьшилось в копролитах червей обоих видов.
Отмеченный эффект уменьшения под влиянием A. caliginosa и L. terrestris обилия филы Acidobacteria характерен, по-видимому, для червей многих видов. Недавно опубликованы аналогичные данные об сокращении обилия филы Acidobacteria в копролитах A. caliginosa [9]. Снижение доли филы Acidobacteria и входящих в нее класса Acidobacteria-6, а также порядка iii1-15 обнаружено при пассаже почвы через кишечник Eisenia fetida [14] и Lumbricus rubellus [21].
Фила Acidobacteria представляет собой типичные некультивируемые почвенные бактерии, значительная часть которых – умеренные ацидофилы. Для таких бактерий могут быть одинаково неблагоприятны как подщелачивание почвы при ее прохождении через кишечник дождевых червей [1, 3], так и перемешивание в кишечнике червей почвы, вызывающее уменьшение в ней количества локусов с низкими значениями рН. Отмеченное уменьшение в копролитах обилия представителей Acidobacteria, а также филы Gemmatimonadetes и отдельных представителей фил Verrucomicrobia и Planctomycetes может быть связано с зоогенной активизацией в почве гидролитических процессов [24]. В результате копролиты червей обогащаются лабильными формами органического вещества, что и приводит к уменьшению доли олиготрофов в почвенном сообществе микроорганизмов. Не случайно, обилие олиготрофных бактерий в копролитах A. caliginosa вновь возрастает по мере их старения [9].
В отличие от филы Acidobacteria доля филы Actinobacteria достоверно возрастала в копролитах L. terrestris по сравнению с исходной почвой. Аналогичные результаты получены при изучении червя L. rubellus [16]. Многие представители Actinobacteria – активные гидролитики. По-видимому, перемешивание и измельчение органических остатков в процессе прохождения почвы и детрита через кишечник дождевых червей способствует снабжению этих бактерий более доступным пищевым субстратом и тем самым активизирует их развитие. Кроме того, многие актинобактерии способны продуцировать антибиотики. Интенсификация развития Actinobacteria могла привести к уменьшению в копролитах доли ряда других фил из-за подавления их развития антибиотиками актинобактерий [16].
Обнаружено достоверное увеличение в копролитах L. terrestris обилия бактерий филы Firmicutes и относящегося к ней семейства Clostridiaceae. Представители Clostridiaceae – одна из доминирующих групп бактерий в кишечнике и копролитах E. fetida [17]. Высокая метаболическая активность этих бактерий отмечена в содержимом кишечника L. terrestris [26]. Развитию клостридий могут способствовать анаэробные условия в кишечнике дождевых червей, наличие в нем растительных остатков, в деструкции которых задействованы Clostridiaceae и другие представители филы Firmicutes [25].
Обнаруженное увеличение доли флавобактерий при пассаже почвы через кишечник L. terrestris отмечено и у червей A. trapezoides, обитающих в почвах Австралии [19]. Кроме того, флавобактерии выделены из кишечного гомогената A. caliginosa [18]. Увеличение в кишечнике дождевых червей обилия флавобактерий связывают с их способностью к нитратному дыханию, что позволяет этим бактериям не только адаптироваться к недостатку кислорода, характерному для этой среды обитания, но и успешно конкурировать с микроорганизмами других видов [18].
ЗАКЛЮЧЕНИЕ
Различия в составе прокариотного комплекса в исходной почве и свежих копролитах дождевых червей изученных видов были относительно невелики, предположительно, из-за непродолжительного по времени прохождения почвы через пищеварительную систему червей. Наиболее масштабные изменения в составе сообщества прокариот отмечены после пассажа почвы через кишечник L. terrestris, а не A. caliginosa. Возможно, это связано с различиями в пищеварительных системах червей этих видов, приспособленных к трансформации отличающихся по составу источников питания. Черви L. terrestris питаются преимущественно опадом, а A. caliginosa – более разложенным детритом [4].
Список литературы
Битюцкий Н.П., Кайдун П.И. Влияние дождевых червей на подвижность микроэлементов в почве и их доступность растениям // Почвоведение. 2008. № 12. С. 1479–1486.
Битюцкий Н.П., Соловьева А.Н., Лукина Е.И., Лапшина И.Н., Власов Д.Ю., Кудряшова Н.В. Влияние дождевых червей различных видов на модификацию популяции микроорганизмов и активность ферментов в почве // Почвоведение. 2005. № 1. С. 82–91.
Пономарева С.И. Влияние жизнедеятельности дождевых червей на создание устойчивой структуры дерново-подзолистой почвы // Тр. Почв. ин-та им. В.В. Докучаева. 1953. Т. 41. С. 304–376.
Стриганова Б.Р. Питание почвенных сапрофагов. М.: Наука, 1980. 244 с.
Тиунов А.В. Влияние нор дождевых червей Lumbricus terrestris на пространственное распределение и таксономическую структуру почвенных сообществ // Экологический журн. 2003. Т. 81. № 2. С. 269–274.
Чекановская О.В. Дождевые черви и почвообразование. М.: Изд-во АН СССР, 1960. 212 с.
Чернов Т.И., Тхакахова А.К., Кутовая О.Д. Оценка различных индексов разнообразия для характеристики почвенного прокариотного сообщества по данным метагеномного анализа // Почвоведение. 2015. № 4. С. 462–468.
Aira M., Bybee S., Perez-Losada M., Dominguez J. Feeding on microbiomes: effects of detritivory on the taxonomic and phylogenetic bacterial composition of animal manures// FEMS Microbiol. Ecol. 2015. V. 91. № 11. P. 1–10. https://doi.org/10.1093/femsec/fiv117
Aira M., Perez-Losada M., Dominguez J. Microbiome dynamics during cast ageing in the earthworm Aporrectodea caliginosa // Appl. Soil Ecol. 2019. V. 139. P. 56–63. https://doi.org/10.1016/j.apsoil.2019.03.019
Bityutskii N.P., Maiorov E.I., Orlova N.E. The priming effects induced by earthworm mucus on mineralization and humification of plant residues// Eur. J. Soil Biol. 2012. V. 5. P. 1–6. https://doi.org/10.1016/j.ejsobi.2011.11.008
Bityutskii N.P., Kaidun P., Yakkonen K. Earthworms can increase mobility and bioavailability of silicon in soil // Soil Biol. Biochem. 2016. V. 99. P. 47–53. https://doi.org/10.1016/j.soilbio.2016.04.022
Brown G.G., Doube B.M. Functional interactions between earthworms, microorganisms, organic matter, and plants // Earthworm Ecology. CRC Press, Boca Raton, 2004. P. 213–239.
Caporaso J.G., Kuczynski J., Stombaugh J. et al. QIIME allows analysis of highthroughput community sequencing data // Nature Methods. 2010. V. 7. № 5. P. 335–336. https://doi.org/10.1038/nmeth.f.303
Delgado-Balbuena L., Bello-López J.M., Navarro-Noya Y.E., Rodríguez-Valentín A., Luna-Guido M.L., Dendooven L. Changes in the Bacterial Community Structure of Remediated Anthracene-Contaminated Soils // PLOS ONE. 2016. V. 11. № 10. P. 1–28. https://doi.org/10.1371/journal.pone.0160991
Fierer N., Jackson R.B. The diversity and biogeography of soil bacterial communities // PNAS USA. 2006. V. 103. P. 626–631 https://doi.org/10.1073/pnas.0507535103
Furlong M.A., Singleton D.R., Coleman D.C., Whitman W.B. Molecular and Culture-Based Analyses of Prokaryotic Communities from an Agricultural Soil and the Burrows and Casts of the Earthworm Lumbricus rubellus // Appl. Environ. Microbiol. 2002. P. 1265–1279. https://doi.org/10.1128/AEM.68.3.1265-1279.2002
Hong H.N., Rumpel C., Henry des Tureaux T., Bardoux G., Billou D., Duc T.T., Jouquet P. How do earthworms influence organic matter quantity and quality in tropical soils? // Soil Biol. Biochem. 2011. V. 43. P. 223–230. https://doi.org/10.1016/j.soilbio.2010.09.033
Horn M.A., Drake H.L., Schramm A. Nitrous Oxide Reductase Genes (nosZ) of Denitrifying Microbial Populations in Soil and the Earthworm Gut Are Phylogenetically Similar // Appl. Environ. Microbiol. 2006. P. 1019–1026. https://doi.org/10.1128/AEM.72.2.1019-1026.2006
Menezes de A.B., Prendergast-Miller M.T., Macdonald L. M., Toscas P., Baker G., Farrell M., Wark T., Richardson A. E., Thrall P.H. Earthworm-induced shifts in microbial diversity in soils with rare versus established invasive earthworm populations // FEMS Microbiol. Ecol. 2018. V. 94. P. 1–14. https://doi.org/10.1093/femsec/fiy051
Natal-da-Luz T., Lee I., Verweij R.A., Morais P.V., Van Velzen M.J.M., Sousa J.P., Van Gestel C.A.M. Influence of earthworm activity on microbial communities related with the degradation of persistent pollutants // Environ. Toxicol. 2012. V. 31. № 4. P. 794–803. https://doi.org/10.1002/etc.1738
Pass D.A., Morgan A.J., Read D.S., Field D., Weightman A.J., Kille P. The effect of anthropogenic arsenic contamination on the earthworm microbiome // Environ. Microbiol. 2015. V. 17. № 6. P. 1884–1896. https://doi.org/10.1111/1462-2920.12712
Satchell J.E. Earthworm ecology: From Darwin to Vermiculture. London: Chapman and Hall, 1983.
Scheu S., Schlitt N., Tiunov A.V., Newington J.E., Jones H.T. Effects of the presence and community composition of earthworms on microbial community functioning // Oecologia. 2002. V. 133. № 2. P. 254–260. https://doi.org/10.1007/s00442-002-1023-4
Shweta Ms. Cellulolysis: A transient property of earthworm or symbiotic/ingested microorganisms? // Int. J. Scien. Res. Publ. 2012. V. 2. № 11. P. 1–8.
Singleton D.R., Hendrix P.F., Coleman D.C., Whitman W.B. Identification of uncultured bacteria tightly associated with the intestine of the earthworm Lumbricus rubellus (Lumbricidae; Oligochaeta) // Soil Biol. Biochem. 2003. V. 35. P. 1547–1555. https://doi.org/10.1016/S0038-0717(03)00244-X
Wüst P.K, Horn M.A., Drake H.L. Clostridiaceae and Enterobacteriaceae as active fermenters in earthworm gut content // ISME. 2011. V. 5. № 1. P. 92–106. https://doi.org/10.1038/ismej.2010.99
Дополнительные материалы отсутствуют.