Почвоведение, 2022, № 3, стр. 337-346
Микобиота низинных торфяников
А. В. Головченко a, *, Т. А. Семенова b, А. А. Морозов a, Т. В. Глухова c, Л. И. Инишева d
a МГУ им. М.В. Ломоносова
119991 Москва, Ленинские горы, 1, Россия
b Институт проблем эволюции и экологии РАН
117071 Москва, Ленинский пр-т, 35, Россия
c Институт лесоведения РАН
143030 Московская область, с. Успенское, ул. Советская, 21, Россия
d Томский государственный педагогический университет
634061 Томск, ул. Киевская, 60, Россия
* E-mail: golovchenko.alla@gmail.com
Поступила в редакцию 25.08.2021
После доработки 09.10.2021
Принята к публикации 29.10.2021
- EDN: QAYXUK
- DOI: 10.31857/S0032180X22030054
Аннотация
Для расширения знаний о биоразнообразии и особенностях функционирования микроорганизмов в болотных экосистемах проведено комплексное изучение микобиоты полных профилей низинных торфяников на основании показателей обилия и разнообразия. Объектами исследования послужили мощные низинные торфяники лесного и пойменного заболачивания (Тверская и Томская области России). Показатели обилия грибов выявляли люминесцентно-микроскопическим и чашечным методом. Идентификацию культивируемых грибов проводили на основании фенотипических признаков. Все получаемые показатели рассматривали с учетом деления профиля торфяников на деятельный и инертный слои. Образцы из торфяников отбирали послойно с учетом ботанического состава торфов в конце сентября 2019 г. В исследуемых торфяниках длина грибного мицелия варьировала от 195 до 2300 м/г, численность спор – от 8 до 45 млн/г сухого торфа. Торфяники существенно различались по биомассе грибного мицелия (в 2–24 раз), тогда как по биомассе спор грибов характеризовались близкими значениями. Запасы грибной биомассы, рассчитанные на весь профиль, составляли от 2 до 18.7 т/га. Доля грибной биомассы деятельного слоя составляла 52–72% от грибной биомассы всего профиля торфяников. Культивируемые грибы были представлены 52 видами из 32 родов. Наиболее часто встречались представители родов Mortierella, Cladosporium, Penicillium и Trichoderma. Приведены списки видов грибов и частота их встречаемости. Индекс Шеннона варьировал от 1.8 до 2.5. Таксономическое сходство (по коэффициенту Сьеренсена) грибных комплексов исследуемых торфяников не превышало 0.65.
ВВЕДЕНИЕ
Грибы следует рассматривать как важные движущие силы механистических процессов, лежащих в основе биоразнообразия, поглощения растениями питательных веществ и потерь углерода в торфяниках [27].
Грибы зависят от поступления углерода в почву и играют активную роль в его мобилизации и стабилизации. Торф как питательная среда удовлетворяет потребности грибов в углероде, однако в торфяниках различного генезиса существуют факторы, ингибирующие их активность. В деятельном слое верховых торфяников основным фактором является прочность клеточных стенок сфагновых мхов, обусловленная наличием трудно разлагаемых полисахаридов – сфагнанов [21]. В инертном слое сказывается дефицит кислорода и накопление различных соединений фенольной природы, а также антиокислителей, блокирующих активность ферментов, как гидролитических, так и окислительных [5, 9].
Низинные торфяники, в отличие от верховых, исследуются в меньшей степени, так как скорость разложения растительных остатков в верхних слоях высока и дальнейшей консервации подвергается уже хорошо разложившийся торф.
Цель настоящей работы – изучение микобиоты полных профилей низинных торфяников для расширения знаний о биоразнообразии и для формирования более глубокого понимания многообразно-функциональных взаимосвязей в экосистемах болот.
Данная работа продолжает цикл статей, отражающих результаты исследования микробных сообществ низинных торфяников России [2–4, 6, 10, 11].
ОБЪЕКТЫ И МЕТОДЫ
Объектами исследования были низинные торфяники с мощностью профиля 3 м, подстилаемые суглинками, которые были классифицированы как эутрофные перегнойно-торфяные мощные почвы [20], по WRB – Sapric Histosols [17].
Низинный торфяник Т-1 (56°10′15″ N; 32°08′16″ E) лесного заболачивания является частью болотного массива “Петушиха” (Тверская область). Растительная ассоциация – черноольшанник крупнотравно-папоротниковый. Залежь этого торфяника сложена древесным ольховым торфом с высокой степенью разложения (45–50%). рНвод по всему профилю близка к нейтральной. Отношение C/N в большей части профиля составляет 18–22 (табл. 1).
Таблица 1.
Соответствия между глубинами отбора образцов, почвенными горизонтами и границами деятельного и инертных слоев исследуемых торфяников, а также ботанический состав, степень разложения (СРТ), рНвод, C/N низинных торфов, слагающих профиль
| Название слоя | Горизонты почвы | Глубина отбора образца (см) | Т-1 | Т-2 | Т-3 | ||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| ботаничес-кий состав (СРТ, %) |
рНвод | C/N | ботанический состав (СРТ, %) | рНвод | C/N | ботани-ческий состав (СРТ, %) | рНвод | C/N | |||
| Деятельный | ТЕ | 0–20 | Древесный (45–50) |
6.3 | 19 | Травяной (25) | 4.4 | 38 | Осоковый (25–27) |
6.1 | 17 |
| 20–50 | 6.4 | 22 | Осоковый (35) | 4.7 | 23 | 5.9 | 15 | ||||
| Инертный | ТТ | 50–75 | 6.5 | 20 | Травяной (30) | 4.9 | 21 | 5.7 | 25 | ||
| 75–100 | 6.5 | 18 | 5.4 | 20 | 5.7 | 20 | |||||
| 100–150 | 6.6 | 18 | Вахтовый (25) | 5.6 | 19 | 7.2 | 22 | ||||
| 150–200 | 6.5 | 19 | Травяно-гипновый (20–25) | 6.5 | 18 | Осоково-гипновый (35–40) | 7.2 | 17 | |||
| 200–250 | 6.5 | 19 | 7.3 | 18 | 7.3 | 23 | |||||
| 250–300 | 6.6 | 30 | 7.4 | 21 | Древесный (45) | 7.3 | 22 | ||||
Низинный торфяник Т-2 (56°23′25″ N; 84°38′47″ E) лесного заболачивания является частью болотного массива “Клюквенное” (Томская область). Растительная ассоциация – березняк сосново-сфагновый. Его толща сложена преимущественно среднеразложившимися (18–23%) торфами травяной группы. Значение рНвод нарастает с глубиной от 4.4 до 7.4. Отношение C/N уменьшается по профилю с 38 до 18.
Низинный торфяник Т-3 (56°31′09″ N; 84°38′27″ E) пойменного заболачивания является частью болотного массива “Карбышевское” (Томская область); он почти полностью покрыт смешанным лесом, сформировавшим лесной комплексный фитоценоз. Древесный ярус состоит из ели, кедра, сосны, березы, пихты, полнота древостоя 0.6–0.7. Кустарничковый ярус (брусника, костяника) угнетен. Травяной покров густой (80%), состоит из осоки, вахты, сабельника, хвоща, лабазника, крапивы. Моховой ярус развит фрагментарно и представлен в основном зелеными мхами. Степень разложения торфов увеличивается с глубиной – от 25 до 45%. Карбонатность подстилающих пород определяет смену рНвод по профилю – от слабокислой реакции в верхней 1.5 м толще до нейтральной и слабощелочной в слое 1.5–3 м. Отношение C/N меняется по профилю от 15 до 25.
Максимальный уровень залегания болотных вод во время летнего высыхания для Т-1 – 45 см, для Т-2 – 63 см, для Т-3 – 47 см. Граница между деятельным и инертным слоями совпадает с этим уровнем, поэтому за деятельный слой исследуемых торфяников принимали верхний слой, мощностью 50 см. Мощность инертного слоя составила 250 см. Соответствия между глубинами отбора образцов, почвенными горизонтами и границами деятельного и инертных слоев торфяников представлены в табл. 1.
На каждом из объектов исследования в конце сентября 2019 г. торфяным буром были пробурены 3 колонки. Из них методом смешанного образца осуществляли отбор с глубин 0–20, 20–50, 50–75, 75–100, 100–150 см и т. д. до 3 м. Образцы помещали в стерильные пластиковые емкости, которые загружали в сумки-холодильники и доставляли в лабораторию.
Длину мицелия и численность спор грибов определяли люминесцентно-микроскопическим методом [15]. Для анализа одного образца торфа готовили 2 предметных стекла с тремя препаратами на каждом. На препарат площадью 4 см2 микропипеткой наносили 0.02 мл торфяной суспензии и равномерно распределяли. Торфяную суспензию (1 г свежего торфа/100 мл стерильной воды) предварительно обрабатывали на ультразвуковом диспергаторе Bandelin Sonopuls HD 2070 (Германия) в течение 1 мин при мощности 50%. Полученные препараты высушивали при комнатной температуре и фиксировали над пламенем горелки. Для окрашивания препаратов использовали водный раствор калькофлуора белого. После экспозиции препаратов в красителе в течение 10 мин, их промывали в стоячей воде и высушивали при комнатной температуре. Просмотр препаратов осуществляли на микроскопе “ЛЮМАМ-ИЗ” (Россия). На каждом препарате в 50-ти полях зрения измеряли длину грибного мицелия и подсчитывали количество спор. Расчет численности и биомассы грибов осуществляли по формулам, приведенным в статье [2].
Численность микромицетов определяли чашечным методом [15]. Посев осуществляли на среду Чапека в пятикратной повторности из торфяной суспензии, оставшейся после приготовления препаратов для люминесцентно-микроскопического метода. Засеянные чашки инкубировали при комнатной температуре в течение недели, затем вели общий подсчет выросших колоний. Рассчитывали численность микромицетов, которую выражали в КОЕ (колониеобразующих единицах)/г торфа.
Проводили пересчет показателей обилия грибов на 1 г сухого торфа. Для этого определяли влажность образцов торфа, высушивая их при 105°С в течение 6 ч.
На чашках осуществляли также дифференцированный учет колоний микромицетов.
Таксономическую идентификацию микромицетов проводили на основании фенотипических признаков с помощью классических определителей [22–24, 26, 28]. Таксономическое положение видов микромицетов сверяли с базами данных: The MycoBank Fungal databases (http:/www.mycobank.org) и GABI Bioscience Databases Index Fungorum (indexfungorum.org). Для таксономической единицы (рода, вида) микромицетов рассчитывали частоту встречаемости (ЧВ) – отношение числа образцов, в которых присутствовал данный род или вид, к общему числу проанализированных образцов. На основании величины ЧВ выделяли следующие классы обилия: доминирующие (ЧВ > > 60%), частые (ЧВ = 30–60%), редкие (ЧВ = 10–30%), случайные (ЧВ < 10%).
Комплексы микромицетов исследуемых торфяников сравнивали с помощью индексов Шеннона и Пиелу, а также по коэффициенту Сьеренсена [14].
Виды низинного торфа и степень их разложения, рНвод определяли по гостам (ГОСТ 28245.2-89; ГОСТ 11306-83) в Научно-исследовательском институте биологии и биофизики при Томском государственном университете.
Содержание углерода и азота в различных слоях исследуемых торфяников выявляли с помощью CHNS-анализатора Vario EL III (Германия) в токе кислорода при 1150°С.
Обработку массивов данных проводили с использованием пакета программ StatSoft statistica 8.0 и Microsoft Excel 10.0.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Люминесцентно-микроскопический метод, используемый в данном исследовании, позволяет дифференцировать и проводить одновременный учет мицелия и спор грибов. С помощью этого метода можно получить и проанализировать такие показатели обилия грибов, как длина и биомасса грибного мицелия, численность и биомасса спор грибов; выявить запасы грибной биомассы и определить ее популяционную структуру (соотношение мицелия и спор). Преимущество люминесцентно-микроскопического метода заключается в возможности учета активного компонента грибного комплекса – мицелия, в отличие от метода посева, учитывающего в основном споры грибов [32]. Установлено, что на агаризованных средах 90% колоний грибов вырастают из грибных спор [15].
Рассмотрим последовательно показатели обилия грибов в исследуемых торфяниках.
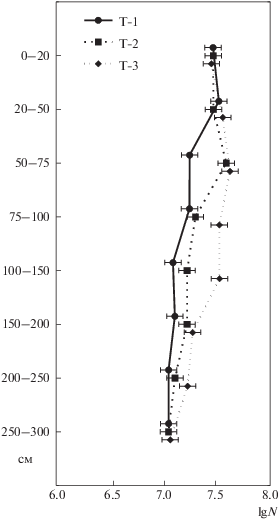
Грибной мицелий обнаруживали преимущественно в деятельном слое (0–50 см) торфяников. Его длина варьировала от 195 до 2312 м/г сухого торфа. Особенностью торфяника 1 является обнаружение грибного мицелия в метровой толще инертного слоя (рис. 1). Для этого торфяника показано, что отсутствие осадков в течение 2–3 недель приводит к снижению уровня грунтовых вод на 30–40 см, что влечет за собой увеличение мощности аэрируемого слоя и суммарного за сезон дыхания почвы на 7–48% [25]. Теплый и сухой сентябрь (41.2 мм осадков в месяц) анализируемого года способствовал подсушке верхнего слоя этого торфяника, что привело к формированию трещин, через которые и осуществлялось проникновение мицелия в торфяную толщу. Следует отметить, что в другие годы и сезоны грибной мицелий в этом торфянике выявляли только в деятельном слое [6]. Кроме погодных условий, факторами, регулирующими численность и профильное распределение мицелия в низинных торфяниках, могут быть дефицит кислорода в болотных водах [19]; выявляемая в верхних слоях высокая биомасса представителей мезофауны, способных питаться грибным мицелием [18]; доминирование ультрамикропор в структуре порового пространства [1] и т. д.
Рис. 1.
Распределение грибного мицелия (N, м/г сухого торфа) по профилю исследуемых торфяников (Т-1, Т-2 и Т-3).

Споры грибов, в отличие от грибного мицелия, обнаруживали по всему трехметровому профилю торфяников (рис. 2). Их численность в пределах профиля колебалась (от 8 до 45) × 106 спор/г сухого торфа и уменьшалась с глубиной. Область с максимальными значениями численности спор грибов в Т-1 приходилась на слой 0–50 см, в Т-2 – на слой 0–75 см, в Т-3 – на слой 0–150 см.
Рис. 2.
Распределение спор грибов (N, спор/г сухого торфа) по профилю исследуемых торфяников (Т-1, Т-2 и Т-3).
Достоверность выявленных различий подтверждена результатами двухфакторного дисперсионного анализа. Динамику показателей обилия грибного мицелия и спор в исследуемых торфяниках при рассмотрении их в один сезон одного года достоверно определяли, как “тип торфяника”, так и “глубина отбора образцов”. Обилие грибного мицелия в большей степени зависело от торфяника (70% от общей дисперсии), тогда как обилие спор грибов – от глубины отбора образцов (54% от общей дисперсии).
Если рассчитать грибную биомассу на грамм сухого торфа, то ее значения попадают в диапазон от 0.1 до 12.7 мг/г в зависимости от глубины отбора образцов и объекта исследования. Наибольшие значения выявлены в деятельном слое торфяников (1–12.7 мг/г). Установлена тенденция уменьшения грибной биомассы вниз по профилю. На глубине 2–3 м биомасса грибов не превышала 0.2 мг/г торфа.
Осуществлен поиск корреляционных связей между грибной биомассой и такими свойствами торфяников, как степень разложения торфа, рНвод, C/N. Выявлены как положительные, так и отрицательные связи. Уменьшение грибной биомассы вниз по профилю коррелировало с увеличением рНвод и степенью разложения торфа. Коэффициент корреляции (r) между этими параметрами варьировал от –0.60 до –0.93. Установленная корреляция закономерна, так как грибы предпочитают кислые и слаборазложившиеся субстраты [27, 29]. Положительная сильная корреляционная связь между грибной биомассой и C/N была выявлена в Т-2 лесного заболачивания (r = 0.89).
Запасы грибной биомассы, рассчитанные на весь профиль, колеблются от 2 до 18.7 т/га. Максимально обогащен грибной биомассой Т-1 лесного заболачивания, минимально – Т-3 пойменного заболачивания. Несмотря на разные запасы грибной биомассы, эти торфяники характеризуются равным вкладом деятельного (53 и 52% соответственно) и инертного (47 и 48%) слоев в общую грибную биомассу, тогда, как в Т-2 большая доля грибной биомассы (72%) сосредоточена в деятельном слое (табл. 2).
Таблица 2.
Запасы грибной биомассы (мицелия, спор, общей) (г/м2) в различных слоях и в профиле исследуемых торфяников
| Слой, см | Мицелий | Споры | Общая | ||||||
|---|---|---|---|---|---|---|---|---|---|
| Т-1 | Т-2 | Т-3 | Т-1 | Т-2 | Т-3 | Т-1 | Т-2 | Т-3 | |
| 0–50 | 975 | 172 | 73 | 24 | 25 | 33 | 999 (53*) | 197 (72) | 106 (52) |
| 50–300 | 791 | 0 | 0 | 79 | 77 | 97 | 870 (47) | 77 (28) | 97 (48) |
| 0–300 | 1766 | 172 | 73 | 103 | 102 | 130 | 1869 | 274 | 203 |
Дробный анализ структуры грибной биомассы, основанный на отдельном выделении биомассы грибного мицелия и спор грибов, выявил различия как между слоями, так и между торфяниками. В деятельном слое всех торфяников превалировала биомасса грибного мицелия, которая превосходила биомассу грибных спор в 2–41 раз. В инертном слое преобладала биомасса спор грибов, кроме Т-1, в котором грибной мицелий выявляли не только в деятельном слое, но и на некоторых глубинах инертного слоя. При рассмотрении всего профиля оказалось, что исследуемые торфяники существенно различались только по биомассе грибного мицелия (в 2–24 раз), тогда как биомасса спор грибов характеризовалась близкими значениями. Во всех торфяниках биомасса грибного мицелия превосходила биомассу грибных спор, кроме Т-3 пойменного заболачивания, в грибной биомассе которого преобладала биомасса спор.
Ранее, осенью 2018 г., для Т-2 и Т-3 были получены данные по запасам грибной биомассы [4]. Они оказались в 1.5–3 раза больше, чем полученные в этом исследовании. Таким образом, в низинных торфяниках имеет место годовая динамика грибного пула и в основном за счет варьирования показателей в деятельном слое.
Закономерности относительно запасов, популяционной структуры и профильного распределения грибной биомассы в исследуемых торфяниках подтверждаются данными, полученными для низинных торфяников других регионов [2, 10].
Метод посева дает представление о численности культивируемых грибов. Он также незаменим для выявления таксономической структуры микобиоты.
Численность культивируемых грибов (микромицетов) в исследуемых торфяниках варьировала в широком диапазоне – (от 2 до 144) × 103 КОЕ/г сухого торфа. Наибольшие значения были отмечены в деятельном слое – (41–144) × 103 КОЕ/г. При переходе к инертному слою численность этих грибов резко уменьшалась и была в 6–14 раз меньше, чем в деятельном. Вниз по профилю Т-1 и Т-3 происходило дальнейшее сокращение численности, но оно имело менее выраженный характер. В Т-2 в большей части инертного слоя численность микромицетов поддерживалась на уровне (7–10) × 103 КОЕ/г торфа (табл. 3).
Таблица 3.
Численность культивируемых грибов (103 КОЕ/г торфа) на разных глубинах исследуемых торфяников
| Глубина взятия образца, см | Торфяник | ||
|---|---|---|---|
| 1 | 2 | 3 | |
| 0–20 | 68.2 ± 7.8* | 89.9 ± 5.3 | 129.3 ± 29.3 |
| 20–50 | 72.3 ± 6.8 | 40.7 ± 3.7 | 144.0 ± 21.1 |
| 50–75 | 10.4 ± 0.8 | 7.1 ± 0.3 | 10.2 ± 1.7 |
| 50–100 | 5.8 ± 0.9 | 7.2 ± 1.2 | 14.1 ± 2.8 |
| 100–150 | 3.8 ± 0.4 | 9.9 ± 1.1 | 3.4 ± 0.5 |
| 150–200 | 2.7 ± 0.4 | 8.9 ± 1.9 | 2.7 ± 0.4 |
| 200–250 | 0 | 8.1 ± 1.0 | 2.3 ± 0.3 |
| 250–300 | 0 | 4.7 ± 0.9 | 1.7 ± 0.5 |
В исследуемых торфяниках обнаружены представители 32-х родов культивируемых грибов. Наибольшее количество родов (26) выявлено в Т-3 пойменного заболачивания, по 18 и 17 родов соответственно – в Т-1 и Т-2 лесного заболачивания.
Наиболее часто в торфяниках встречались роды: Cladosporium, Mortierella, Penicillium и Trichoderma. В деятельном слое частота встречаемости этих родов была больше (44, 58, 40 и 40% соответственно), чем в инертном (39, 33, 22, 34%). В деятельном слое с максимальной частотой встречались представители рода Mortierella (58%), в инертном – представители рода Cladosporium (39%). О доминировании родов Trichoderma и Cladosporium в микромицетных комплексах низинных торфяников сообщалось также в работах [5, 10, 11].
Общее количество выявленных морфотипов в исследуемых торфяниках – 52. Из них 44 идентифицированы до вида, 5 – до рода, 3 – не определены. Общими являются 8 видов: Cladosporium cladosporioides, Cylindrocarpon didymum, Exophiala jeanselmei, Mortierella verticillata, Mortierella sp., Mucor hiemalis, Penicillium aurantiogriseum, Trichoderma polysporum.
В исследуемых торфяниках оказалась невысокой доля темноокрашенных микромицетов (22–29% от всех видов). Эту особенность отмечали в низинных торфяниках и другие исследователи [5, 10, 11].
Индекс видового разнообразия (индекс Шеннона) в исследуемых торфяниках варьировал от 1.8 до 2.5, различия между деятельным и инертным слоем были сглажены. Индекс Пиелу (показатель выравненности сообщества) в большинстве из проанализированных вариантов приближался к 1, что свидетельствует о равномерном представлении видов в сообществе.
В деятельном слое торфяников в группу доминирующих по частоте встречаемости видов входили Acremonium charticola, Cladosporium cladosporioides, Cylindrocarpon didymum, Mammaria echinobotryoides, Metarhizium carneum, Penicillium aurantiogriseum, в нем также высока доля видов микромицетов, входящих в группы частых и редких. В инертном слое при более высоких показателях видового богатства идет смещение в сторону группы случайных видов (табл. 4).
Таблица 4.
Видовой состав и частота встречаемости (%) микромицетов в деятельном (Д) и инертном (И) слоях исследуемых торфяников
| № | Виды микромицетов | Т-1 | Т-2 | Т-3 | |||
|---|---|---|---|---|---|---|---|
| Д | И | Д | И | Д | И | ||
| 1 | Acremonium charticola (Lindau) Gams | 80 | 35 | 60 | 43 | ||
| 2 | Acremonium sp. | 30 | 55 | 50 | 13 | ||
| 3 | Akanthomyces lecanii (Zimm.) Spatafora, Kepler & B. Shrestha | 42 | |||||
| 4 | Alternaria alternata (Fr.) Keissl. | 3 | |||||
| 5 | Aureobasidium pullulans (de Bary & Löwenthal) G. Arnaud | 13 | 8 | 27 | |||
| 6 | Cadophora fastigiata Lagerb. & Melin | 4 | 30 | 3 | |||
| 7 | Cladosporium cladosporioides (Fresen.) G.A. de Vries | 90 | 80 | 25 | 29 | 90 | 27 |
| 8 | Cladosporium sphaerospermum Penz. | 4 | |||||
| 9 | Clonostachys rosea (Link) Schroers, Samuels, Seifert & Gams | 10 | 17 | ||||
| 10 | Cordyceps farinosa (Holmsk.) Kepler, B. Shrestha & Spatafora | 10 | 10 | 33 | |||
| 11 | Cylindrocarpon didymum (Harting) Wollenw. | 80 | 30 | 50 | 8 | 10 | 20 |
| 12 | Cylindrocarpon magnusianum Wollenw. | 13 | |||||
| 13 | Cephalotrichum stemonitis (Pers.) Nees | 4 | |||||
| 14 | Dipodascus geotrichum (Butler & Petersen) Arx | 4 | |||||
| 15 | Exophiala jeanselmei (Langeron) McGinnis & Padhye | 20 | 15 | 8 | 17 | ||
| 16 | Fusarium avenaceum (Fr.) Sacc. | 8 | |||||
| 17 | Fusarium oxysporum Schltdl. | 30 | 10 | ||||
| 18 | Fusarium sp. | 10 | 7 | ||||
| 19 | Mammaria echinobotryoides Ces. | 80 | 60 | 4 | |||
| 20 | Metarhizium carneum (Duché & R. Heim) Kepler, Rehner & Humber | 10 | 63 | 63 | |||
| 21 | Mortierella elongata Linnem. | 7 | |||||
| 22 | Mortierella hyalina (Harz) Gams | 50 | 13 | ||||
| 23 | Mortierella verticillata Linnem. | 10 | 50 | 50 | 50 | 17 | |
| 24 | Mortierella sp. | 40 | 30 | 13 | 42 | 50 | 10 |
| 25 | Mucor hiemalis Wehmer | 40 | 10 | 25 | 17 | 20 | 3 |
| 26 | Nemania serpens (Pers.) Gray | 4 | |||||
| 27 | Oidiodendron griseum Robak | 10 | 33 | 40 | 3 | ||
| 28 | Paecilomyces variotii Bain. | 5 | |||||
| 29 | Paraphoma fimeti (Brunaud) Gruyter, Aveskamp & Verkley | 8 | |||||
| 30 | Penicillium aurantiogriseum Dierckx | 70 | 25 | 4 | 40 | 10 | |
| 31 | Penicillium brevicompactum Dierckx | 10 | 5 | 25 | 10 | ||
| 32 | Penicillium janczewskii Zaleski | 7 | |||||
| 33 | Penicillium sp. | 13 | 38 | 10 | 7 | ||
| 34 | Phialophora cinerescens (Wollenw.) J.F.H. Beyma | 5 | |||||
| 35 | Phoma sp. | 4 | 40 | 17 | |||
| 36 | Pseudogymnoascus pannorum (Link) Minnis & Lindner | 25 | 3 | ||||
| 37 | Purpureocillium lilacinum (Thom) Luangsa-ard, Houbr., Hywel-Jones & Samson | 4 | |||||
| 38 | Sarocladium strictum (W. Gams) Summerb. | 30 | |||||
| 39 | Sclerotinia sclerotiorum (Lib.) de Bary | 10 | |||||
| 40 | Talaromyces pinophilus (Hedgc.) Samson, Yilmaz, Frisvad & Seifert | 20 | 10 | 25 | |||
| 41 | Talaromyces purpureogenus Samson, Yilmaz, Houbraken et al. | 10 | |||||
| 42 | Talaromyces verruculosus (Peyronel) Samson, Yilmaz, Frisvad & Seifert | 13 | 4 | ||||
| 43 | Tolypocladium inflatum Gams | 8 | |||||
| 44 | Trichoderma hamatum (Bonord.) Bainier | 54 | |||||
| 45 | Trichoderma harzianum Rifai | 8 | |||||
| 46 | Trichoderma polysporum (Link) Rifai | 10 | 13 | 10 | 7 | ||
| 47 | Trichoderma virens (Mill., Giddens & Foster) Arx | 25 | |||||
| 48 | Trichoderma viride Pers. | 25 | 20 | ||||
| 49 | Umbelopsis isabellina (Oudem.) W. Gams | 38 | 8 | ||||
| 50 | Стерильный мицелий 1 | 20 | 25 | 7 | |||
| 51 | Стерильный мицелий 2 | 20 | 15 | 10 | 20 | ||
| 52 | Неидентифицированный мицелий | 15 | 20 | 3 | |||
| Количество видов в слое | 19 | 22 | 17 | 29 | 17 | 26 | |
| Количество видов в торфянике | 27 | 35 | 28 | ||||
Анализируя таксономический состав культивируемых микромицетов исследуемых торфяников, можно отметить, что в инертном слое обнаруживали виды, которые не встречались в деятельном слое – от 8 видов в Т-1 до 18 и 11 – в Т-2 и Т-3 соответственно, что косвенно свидетельствует о развитии грибов, способных существовать в условиях дефицита кислорода. О способности отдельных видов микромицетов развиваться в микроаэрофильных условиях сообщалось в ряде работ [5, 7, 8, 12, 13, 22, 30]. Однако большая часть видов грибов находится в толще в неактивном состоянии, в виде спор и других покоящихся структур.
При сравнении торфяников между собой выявлены особенности таксономической структуры микобиоты. Т-1 лесного заболачивания под черноольшанником отличался от остальных широким спектром доминирующих по частоте встречаемости видов. Среди них 2 вида (Cladosporium cladosporioides и Mammaria echinobotryoides) были общими для деятельного и инертного слоя. Т-2 лесного заболачивания под березняком характеризовался максимальным видовым богатством (35) и наибольшей разницей по количеству видов, обнаруживаемых в деятельном (17) и инертном (29) слоях. В этом торфянике по всему профилю отмечали доминирование Metarhizium carneum. В инертном слое Т-3 пойменного заболачивания при высоких значениях видового богатства выявляли преимущественно редкие (12) и случайные (12) виды.
Сравнение видовой структуры микромицетных комплексов торфяников путем расчета коэффициента Сьеренсена обнаружило наибольшее таксономическое сходство Т-1 и Т-3 (0.65). Сходство Т-1 и Т-2, а также Т-2 и Т-3 было несколько меньшим (0.55).
Функции грибов, выделенных из исследуемых торфяников, обширны и многогранны. Грибы обладают большим набором разнообразных гидролитических ферментов, способных разлагать любые органические субстраты [16, 29, 31]. На основании литературных данных [8, 22–24, 26, 28] способностью к деструкции целлюлозы обладали 37% коллекционных видов (выделенных из исследуемых торфяников), хитина – 31%, ароматических углеводородов – 41% (лигнина – 24%).
ЗАКЛЮЧЕНИЕ
Проведено комплексное исследование микобиоты низинных торфяников различного генезиса и региона в один сезон одного года. Показано, что запасы грибной биомассы в них могут различаться на порядок. Максимальных значений грибная биомасса достигала в торфянике лесного заболачивания под черноольшанником, минимальных – в пойменном торфянике. Большая часть грибной биомассы была сосредоточена в деятельном слое (52–72%). Исследуемые торфяники существенно различались по биомассе грибного мицелия, тогда как по биомассе спор грибов имели близкие значения. Глубокое проникновение грибного мицелия в толщу инертного слоя одного из торфяников могло быть следствием погодных условий анализируемого сезона.
Выявляемые в деятельном слое высокие показатели обилия грибного мицелия свидетельствуют об активном функционировании грибов. Именно здесь благодаря им активно перерабатываются растительные остатки, и поэтому дальнейшей консервации подвергается уже хорошо разложившийся торф. В инертном слое в грибной биомассе доминируют споры, о жизнеспособности которых косвенно свидетельствует обнаружение грибов методом посева.
Культивируемые грибы в исследуемых торфяниках были представлены 52 видами из 32 родов, из них с высокой частотой встречаемости выявляли представителей родов Mortierella, Cladosporium, Penicillium и Trichoderma. Индекс видового разнообразия был высок и варьировал от 1.8 до 2.5. В деятельном слое преобладали виды микромицетов, входящие по частоте встречаемости в группы частых и редких, в инертном слое происходило смещение в сторону группы случайных видов.
Таксономическое сходство (по коэффициенту Сьеренсена) микромицетных комплексов низинных торфяников различного происхождения составляет 0.55–0.65, для торфяников одного происхождения, но из различных регионов – 0.55 (при максимуме 1).
Низинные торфяники, в отличие от верховых, как правило, содержат меньшие запасы грибной биомассы, и они сосредоточены преимущественно в деятельном слое, а не распределены по профилю равномерно. Однако таксономическое разнообразие микромицетов, а также спектр их функций в низинных торфяниках больше, чем в верховых. Среди микромицетов есть целлюлозолитики, хитинолитики и деструкторы ароматических соединений.
Список литературы
Алехина Л.К., Головченко А.В., Початкова Т.Н., Добровольская Т.Г., Звягинцев Д.Г. Влияние гидрофизических свойств почв на структуру микробных комплексов // Почвоведение. 2002. № 8. С. 1002–1009.
Головченко А.В., Волкова Е.М. Запасы и структура микробной биомассы в торфяниках карстовых ландшафтов Тульской области // Почвоведение. 2019. № 3. С. 370–376.
Головченко А.В., Дмитриенко Ю.Д., Добровольская Т.Г., Грачева Т.А., Инишева Л.И., Кожевин П.А. Численность, таксономическая структура и активность бактериальных комплексов низинных торфяников Томской области // Вестник Моск. ун-та. Сер. 17. Почвоведение. 2020. № 4. С. 43–51.
Головченко А.В., Дмитриенко Ю.Д., Морозов А.А., Поздняков Л.А., Глухова Т.В., Инишева Л.И. Микробная биомасса в низинных торфяниках: запасы, структура, активность // Почвоведение. 2021. № 7. С. 838–848.
Головченко А.В., Кураков А.В., Семенова Т.А., Звягинцев Д.Г. Обилие, разнообразие, жизнеспособность и факторная экология грибов в торфяниках // Почвоведение. 2013. № 1. С. 80–97.
Головченко А.В., Тихонова Е.Ю., Звягинцев Д.Г. Численность, биомасса, структура и активность микробных комплексов низинных и верховых торфяников // Микробиология. 2007. Т. 76. № 5. С. 711–719.
Грум-Гржимайло О.А., Биланенко Е.Н. Микромицеты торфяников верховых болот на побережье Кандалакшского залива в окрестностях ББС МГУ // Мат-лы научной конф., посвященной 70-летию Беломорской биологической станции МГУ. М.: Гриф и К, 2008. С. 233–239.
Грум-Гржимайло О.А., Биланенко Е.Н., Бубнова Е.И., Георгиева М.Л. Актуальные направления в изучении грибов северных торфяных болот в связи с изменением климата и таянием многолетней и вечной мерзлоты // Вестник РФФИ. 2020. Т. 106. № 2. С. 101–114.
Добровольская Т.Г., Головченко А.В., Звягинцев Д.Г., Инишева Л.И., Кураков А.В., Смагин А.В., Зенова Г.М., Лысак Л.В., Семенова Т.А., Степанов А.Л., Глушакова А.М., Початкова Т.Н., Кухаренко О.С., Качалкин А.В., Якушев А.В., Поздняков Л.А., Богданова О.Ю. Функционирование микробных комплексов верховых торфяников – анализ причин медленной деструкции торфа. М.: Товарищество научных изданий КМК, 2013. 128 с.
Добровольская Т.Г., Головченко А.В., Кухаренко О.С., Якушев А.В., Семенова Т.А., Инишева Л.И. Структура микробных сообществ верховых и низинных торфяников Томской области // Почвоведение. 2012. № 3. С. 317–326.
Добровольская Т.Г., Головченко А.В., Семенова Т.А., Кухаренко О.С., Инишева Л.И. Влияние аэрации на структуру микробных комплексов низинных торфяников // Вестник ТГПУ. 2011. Вып. 5(107). С. 117–125.
Кураков А.В., Лаврентьев Р.Б., Нечитайло Т.Ю., Голышин П.Н., Звягинцев Д.Г. Разнообразие факультативно-анаэробных мицелиальных микроскопических грибов в почвах // Микробиология. 2008. Т. 77. № 1. С. 103–112.
Кураков А.В., Хидиров К.С., Садыкова В.С., Звягинцев Д.Г. Способность к анаэробному росту и активность спиртового брожения у микроскопических грибов // Прикладная биохимия и микробиология. 2011. Т. 47. № 2. С. 187–192.
Мегарран Э. Экологическое разнообразие и его измерение. М.: Мир, 1992. 181 с.
Методы почвенной биохимии и микробиологии. М.: Изд-во Моск. ун-та, 1991. 304 с.
Мирчинк Т.Г. Почвенная микология. М.: Изд-во Моск. ун-та, 1988. 219 с.
Национальный атлас почв Российской Федерации / Под ред. С.А. Шобы. М.: Астрель: АСТ, 2011. 632 с.
Рахлеева А.А., Седова Т.С. Почвенные беспозвоночные (мезофауна) заболоченных ельников южной тайги (Центрально-Лесной заповедник, Тверская обл.) // Russ. Entomol. J. 2002. Т. 11. № 1. С. 93–100.
Сирин А.А. Водообмен и структурно-функциональные особенности лесных болот. Автореф. дис. … докт. биол. н. М., 1999. 44 с.
Шишов Л.Л., Тонконогов В.Д., Лебедева И.И., Герасимова М.И. Классификация и диагностика почв России. Смоленск: Ойкумена, 2004. 342 с.
Ballance S., Borsheim K.Y., Inngjerdingen K., Paulsen Bs., Christensen B.E. Partial characterization and reexamination of polysaccharides released by mild acid hydrolysis from the chlorite-treated leaves of Sphagnum papillosum // Carbohyd. Polym. 2007. V. 67. P. 104–115. https://doi.org/10.1016/j.carbpol.2006.04.020
Domsch K.H., Gams W. Compendium of soil Fungi. IHW-Verlag. 1993. V. 1. 860 p.
Ellis M.B. Dematiaceous Hyphomycetes. Kew: Commonw. Mycol. Inst., 1971. 607 p.
Gams W. Cephalosporium-artige Schimmelpilze (Hyphomycetes). Stuttgart: Fischer, 1971. 262 p.
Glukhova T.V., Ilyasov D.V., Vompersky S.E., Golovchenko A.V., Manucharova N.A., Stepanov A.L. Soil Respiration in Alder Swamp (Alnus glutinosa) in Southern Taiga of European Russia Depending on Microrelief // Forests. 2021. V. 12. № 4. P. 496. https://doi.org/10.3390/f12040496
Hoog G.S. The genera Beauveria, Isaria, Tritirachium and Acrodontium gen. nov. // Studies in Mycology. 1972. V. 1. 41 p.
Juan-Ovejero R., Briones M.J.I., Opic M. Fungal diversity in peatlands and its contribution to carbon cycling // Appl. Soil Ecology. 2020. V. 146. P. 103393. https://doi.org/10.1016/j.apsoil.2019.103393
Pitt J.I. The Genus Penicillium and its teleomorphic states Eupenicillium and Talaromyces. L.: Acad. Press, 1979. 634 p.
Thormann M.N. Diversity and function of fungi in peatlands: A carbon cycling perspective // Can. J. Soil Sci. 2006. V. 86. P. 281–293. https://doi.org/10.4141/s05-082
Thormann M.N., Currah R.S., Bayley S.E. Succession of microfungal assemblages in decomposing peatland plants // Plant and Soil. 2003. V. 250. P. 323–333. https://doi.org/10.1023/a:1022845604385
Thormann M.N., Rice A.V. Fungi from peatlands // Fungal Diversity. 2007. V. 24. P. 241–299.
Wainwright M., Ali T.A., Killham K. Anaerobic growth of fungal mycelium from soil particles onto nutrient-free silica gel // Mycol. Res. 1994. V. 98(7). P. 761–762.
Дополнительные материалы отсутствуют.


