Поверхность. Рентгеновские, синхротронные и нейтронные исследования, 2019, № 2, стр. 49-55
Анализ везикулярной структуры наночастиц фосфолипидной системы транспорта лекарств на основе данных МУРР
М. А. Киселев 1, *, Е. В. Земляная 1, **, А. Ю. Грузинов 2, Е. И. Жабицкая 1, 4, О. М. Ипатова 3, В. Л. Аксенов 1, 5
1 Объединенный институт ядерных исследований,
Дубна, Россия
2 European Molecular Biology Laboratory, Hamburg Outstation, DEZY,
Гамбург, Германия
3 Научно-исследовательский институт биомедицинской химии,
Москва, Россия
4 Государственный университет “Дубна”,
Дубна, Россия
5 Петербургский институт ядерной физики,
НИЦ “Курчатовский институт”,
Гатчина, Россия
* E-mail: elena@jinr.ru
** E-mail: kiselev@jinr.ru
Поступила в редакцию 15.06.2018
После доработки 15.06.2018
Принята к публикации 15.06.2018
Аннотация
Методом малоуглового рентгеновского синхротронного рассеяния проанализирована везикулярная структура фосфолипидной транспортной наносистемы (ФТНС) для трех значений концентраций ФТНС в воде: 25, 31.25, 37.5%. Рассчитаны параметры везикул: радиус, полидисперсность радиуса, толщина липидного бислоя, внутренняя структура липидного бислоя для двух моделей распределения плотности длины рассеяния фотона. Расчеты проводились двумя различными методами: по формфактору сферической неоднородной оболочки и по методу разделенных формфакторов. Два метода расчета спектров и два используемых приближения для описания внутренней структуры липидного бислоя дают совпадающие результаты, которые демонстрируют уменьшение радиуса везикулы, толщины липидного бислоя и толщины области углеводородных цепочек при увеличении концентрации мальтозы в воде. Показано, что уменьшение толщины липидного бислоя при увеличении концентрации мальтозы происходит за счет взаимопроникновения углеводородных цепочек. Установлено, что гидрофобный объем одной везикулы, пригодный для размещения водонерастворимых лекарств, имеет максимальное значение 14.55 × 106 Å3 при концентрации ФТНС в воде 25%. Увеличение концентрации ФТНС в воде до 37.5% приводит к уменьшению гидрофобного объема до 6.16 × 106 Å3.
ВВЕДЕНИЕ
Одним из способов повышения эффективности существующих лекарств является разработка для них систем транспорта с применением современных нанотехнологий. В настоящее время ряд готовых лекарственных форм на основе различных систем транспорта уже внедрены в медицинскую практику. Эти препараты отличаются высокой эффективностью и широко востребованы на рынке лекарственных средств.
Наибольший интерес представляют системы транспорта лекарств на основе фосфолипидов, так как они биодеградируемы, биологически инертны, не вызывают аллергических, антигенных или пирогенных реакций [1]. В отличие от мицелл, везикулы на основе фосфолипидов позволяют транспортировать как водонерастворимые, так и водорастворимые молекулы лекарств, что делает их наиболее перспективным переносчиком [2].
Везикулы представляют собой полые частицы, содержимое которых ограничено одним или несколькими бислоями фосфолипидов. Диаметр везикул варьируется от 200 Å (однослойные везикулы, у которых стенка состоит из одного бислоя) до 10–50 мкм (многослойные везикулы, стенка состоит из десятков, сотен или тысяч бислоев – липосомы). Для разработки систем транспорта лекарств используют как однослойные, так и многослойные везикулы (липосомы). В последние годы для транспорта лекарственных соединений стараются использовать частицы малых размеров, т.к. установлено, что уменьшение размера липосом в 8 раз продлевает их циркуляцию в кровотоке почти в 40 раз. Уменьшение размера частиц приводит к уменьшению площади их поверхности, лекарства, связанные с такими наночастицами, должны изменять свою фармакокинетику [3].
Лекарственная субстанция, в зависимости от своего химического строения может встраиваться либо в гидрофобную область фосфолипидного бислоя, либо адсорбироваться на поверхности и/или включаться во внутреннюю область везикулы. Поэтому достоверная информация о размерах и структуре бислоя везикул является необходимой для их эффективного практического применения в качестве переносчика лекарств.
В институте биомедицинской химии (ИБМХ) на основе растительных (соевых) фосфолипидов разработана технология получения транспортных наночастиц предельно малого размера (150–250 Å) в виде лиофильно высушенного порошка, стабильного при хранении [4]. Показано, что встраивание некоторых лекарственных субстанций в эти наночастицы существенно увеличивает их биодоступность и терапевтическую эффективность [5]. В [6] путем сравнительного анализа спектров малоуглового синхротронного рентгеновского рассеяния (МУРР) на образцах вышеупомянутой фосфолипидной транспортной наносистемы (ФТНС) и “классической” везикулярной системы димиристоилфосфатидилхолина (ДМФХ) показано, что наночастицы ФТНС имеют морфологию однослойных везикул. В этой работе, а также в [7] и [8] на основе различных подходов сделаны предварительные оценки основных структурных параметров везикулярной системы ФТНС (средний радиус везикул, полидисперсность среднего радиуса, толщина бислоя).
В настоящей работе представлены результаты анализа структуры полидисперсной популяции однослойных везикул ФТНС по данным МУРР в зависимости от концентрации мальтозы в водном растворе.
ЭКСПЕРИМЕНТ
Метод малоуглового рассеяния известен как весьма эффективных экспериментальных методов исследования структуры везикулярных систем [9–12]. При использовании малоуглового рассеяния нейтронов (МУРН) применение тяжелой воды в качестве растворителя дает усиление контраста. Недостатком применения МУРН является некогерентный фон от ядер водорода в измеряемом образце [13]. Лиофилизированная ФТНС состоит из соевых фосфолипидов и мальтозы с весовым соотношением компонент 1/4. Увеличение концентрации ФТНС в тяжелой воде ведет к увеличению концентрации недейтерированной мальтозы и, соответственно, увеличению некогерентного фона, что ограничивает возможность измерения кривой малоуглового рассеяния в области больших значений вектора рассеяния. Тем самым, ухудшается пространственное разрешение эксперимента в определении структуры липидного бислоя везикулы. МУРН наиболее эффективно применять при низких концентрациях ФТНС в воде, 20% по весу и менее.
Трудности применения МУРР для случая однослойных везикул в водной среде связаны с тем, что средняя плотность электронов в фосфолипидном бислое близка к плотности электронов в воде, что делает везикулу практически “невидимой” для фотонов. Добавление дисахаридов в водные растворы существенно увеличивает контраст (разность в плотности электронов в липидном бислое и водной среде) [14–17]. Например, интенсивность рассеяния от везикул ДМФХ в 40% водном растворе сахарозы в 100 раз превышает интенсивность рассеяния от тех же самых везикул в воде [14]. Применение МУРР наиболее эффективно при концентрациях ФТНС в воде равной и выше 25%. Начиная с концентрации мальтозы в воде (20%), обеспечивается хороший контраст. При этом не происходит увеличения некогерентного фона. Малая величина некогерентного фона является существенным преимуществом рентгеновского синхротронного эксперимента. Это позволяет получать более достоверную информацию о структуре липидного бислоя по сравнению с нейтронным экспериментом [7, 13].
Фосфолипидная транспортная наносистема (ФТНС) была разработана в ИБМХ на основе растительных фосфолипидов. ФТНС состоит из соевого фосфатидилхолина (95–97% чистоты) и мальтозы в весовом соотношении 1 : 4. При растворении лиофилизата в воде образуется эмульсия фосфолипидных наночастиц в водном растворе мальтозы. Концентрация мальтозы в образце зависит от степени растворения, что позволяет варьировать рентгеновский контраст. Таким образом, методики контрастирования везикулярных систем дисахаридами, развитые в работах [14–17], открывают возможность исследования водных растворов ФТНС методом МУРР при их терапевтических концентрациях.
Образец приготавливали путем растворения лиофилизированного порошка ФТНС в воде с концентрацией препарата 25, 31.25, 37.5%. При этом, концентрация мальтозы после растворения препарата составляла соответственно 20, 25, 30%. Наличие в образце 20–30% дисахарида (мальтоза) обеспечивает необходимый контраст для проведения эксперимента методом МУРР.
Исследования ФТНС проводили на установке ДИКСИ Курчатовского источника синхротронного излучения (КИСИ) в Национальном исследовательском центре “Курчатовский институт”. Измерения проводили при расстояниях “образец–детектор” Lsd = 30, 56 и 241.5 см. Длина волны фотона λ = 1.625 Å. Использовался двухмерный детектор MarCCD. В эксперименте измерялась зависимость интенсивности рассеянного излучения I(q) от величины модуля вектора рассеяния $q = \frac{{4\pi \sin \left( {\frac{\theta }{2}} \right)}}{\lambda },$ где θ – угол рассеяния фотона на образце.
МОДЕЛЬ
Интенсивность малоуглового рассеяния для монодисперсной популяции сферических везикул радиуса R с бислоем толщины d записывается как [10]:
где I0 – интенсивность фотонов в падающем на образец пучке, n – количество везикул в см3, A – амплитуда рассеяния фотона на одной везикуле, определяемая с учетом сферической симметрии везикулы следующим образом:(2)
$A(q) = 4\pi \int\limits_0^\infty {{{\rho }_{{\text{c}}}}(r)\frac{{\sin (qr)}}{{qr}}{{r}^{2}}dr} .$Факторизация исходного выражения для амплитуды рассеяния приводит к методу разделенных формфакторов (РФФ), существенно упрощающему вычисления, позволяя выбрать фактически любую подходящую функцию для моделирования плотности длины рассеяния. РФФ успешно использовался для анализа различных везикулярных систем [13, 19–22]. Подробное описание этого подхода дано, например, в [11–13]. Здесь мы ограничимся только основным выражением для интенсивности ISFF:
(4)
${{I}_{{{\text{SFF}}}}}(q) = {{I}_{0}}n{{F}_{{\text{s}}}}(q,R){{F}_{{\text{b}}}}(q,\rho )S(q,R),$(5)
$\begin{gathered} {{F}_{{\text{s}}}}(q,R) = {{\left( {4\pi \frac{{{{R}^{2}}}}{{qR}}\sin (qR)} \right)}^{2}}{\text{,}} \\ {{F}_{{\text{b}}}}(q,{{\rho }_{{\text{c}}}}) = {{\left( {\int\limits_{{{ - d} \mathord{\left/ {\vphantom {{ - d} 2}} \right. \kern-0em} 2}}^{{d \mathord{\left/ {\vphantom {d 2}} \right. \kern-0em} 2}} {{{\rho }_{{\text{c}}}}(x)\cos (qx)dx} } \right)}^{2}}. \\ \end{gathered} $Отметим, что метод РФФ, вообще говоря, имеет ограничения, так как предназначен для анализа структуры везикул с большим радиусом и малой толщиной бислоя. Поскольку частицы ФТНС имеют малый размер, мы провели вычисления как на основе “полной” модели (ПМ), определяемой выражением (1), так и на основе РФФ с использованием формул (4, 5). Как будет показано в следующем разделе, результаты близки между собой.
Среднеквадратичное отклонение σ от среднего радиуса 〈R〉 везикул ФТНС рассчитывалось на основе распределения Шульца с коэффициентом m:
(6)
$\begin{gathered} G(R,\left\langle R \right\rangle ) = \frac{{{{R}^{m}}}}{{m!}}{{\left( {\frac{{m + 1}}{{\left\langle R \right\rangle }}} \right)}^{{m + 1}}}\exp \left[ { - \frac{{(m + 1)R}}{{\left\langle R \right\rangle }}} \right], \\ \sigma = \sqrt {\frac{1}{{(m + 1)}}} . \\ \end{gathered} $Тогда макроскопическое сечение Ip полидисперсной популяции везикул имеет вид
(7)
${{I}_{{\text{p}}}}(q) = n\frac{{\int\limits_{{{R}_{{\min }}}}^{{{R}_{{\max }}}} {I(q,R,\left\langle R \right\rangle )G(R,\left\langle R \right\rangle )dR} }}{{\int\limits_{{{R}_{{\min }}}}^{{{R}_{{\max }}}} {G(R,\left\langle R \right\rangle )dR} }},$Окончательное выражение для интенсивности макроскопического сечения I формируется с учетом некогерентного фона IB и разрешения спектрометра [23]:
(8)
$I(q) = {{I}_{{\text{p}}}}(q) + \frac{1}{2}{{\Delta }^{2}}\frac{{{{d}^{2}}}}{{d{{q}^{2}}}}{{I}_{{\text{p}}}}(q) + {{I}_{{\text{B}}}}.$Здесь Δ = 6 × 10–4 Å–1 – второй момент функции разрешения спектрометра.
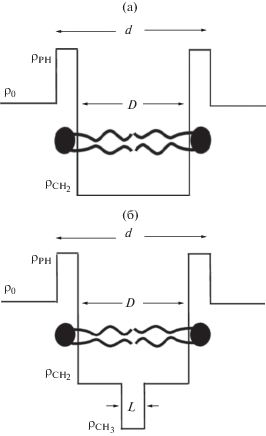
В расчетах использовались две представленные на рис. 1 модели плотности длины рассеяния ρ, учитывающие различное рассеяние фотонов на области полярных голов (PH) и углеводородных цепочек (CH). В 1-ступенчатой модели, показанной на рис. 1а, область углеводородных цепочек предполагается однородной. В двухступенчатой модели на рис. 2б выделены области, соответствующие углеводородным цепочкам двух типов: СН2 и СН3. Значения ${{\rho }_{{{\text{С }}{{{\text{Н }}}_{2}}}}}$ и ${{\rho }_{{{\text{С }}{{{\text{Н }}}_{3}}}}}$ фиксированы и составляют ${{{\rho }}_{{{\text{С }}{{{\text{Н }}}_{{\text{2}}}}}}}$ = 7.95 × 1010 cм–2, ${{{\rho }}_{{{\text{С }}{{{\text{Н }}}_{{\text{3}}}}}}}$ = 4.71 × × 1010 cм–2. Значения ρ0 в зависимости от концентрации ФТНС в растворе даны в табл. 1.
Рис. 2.
Расчетные и экспериментальные спектры МУРР на образцах везикул ФТНС в водных растворах мальтозы концентрации 20, 25, 30%. Расчет сделан с использованием одноступенчатой (а) и двухступенчатой (б) моделей бислоя.
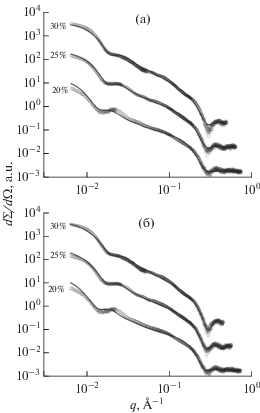
Таблица 1.
Значения концентрации мальтозы и соответствующие значения плотности длины рассеяния фотона в зависимости от концентрации ФТНС в воде при температуре 20°C
| Концентрация ФТНC | Концентрация мальтозы, % | Плотность, г/cм3 | ρ0, 1010 cм–2 |
|---|---|---|---|
| 25 | 20 | 1.081 | 10.11 |
| 31.25 | 25 | 1.100 | 10.27 |
| 37.5 | 30 | 1.125 | 10.48 |
Свободными параметрами модели, подгоняемыми к экспериментальным данным, являются средний радиус 〈R〉, коэффициент полидисперсности m, толщина бислоя d, плотность длины рассеяния на области полярных голов ρРН, толщина D области углеводородных цепочек СН2, толщина L области углеводородных цепочек CН3, плотность длины рассеяния на области полярных голов ρPH, некогерентный фон IB, число везикул на единицу объема n. Эти параметры рассчитывались путем минимизации функции:
(9)
${{\chi }^{2}} = \frac{1}{{N - k}}\sum\limits_{i = 1}^N {{{{\left( {\frac{{I({{q}_{i}}) - {{I}_{{\exp }}}({{q}_{i}})}}{{\delta ({{q}_{i}})}}} \right)}}^{2}}} ,$РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Результаты расчетов параметров полидисперсной популяции однослойных везикул ФТНС в зависимости от концентрации мальтозы, полученные с использованием двух моделей бислоя, представлены в табл. 2 и 3 и на рис. 2.
Таблица 2.
Расчет по полной модели (ПМ) и по модели РФФ для везикулярной системы ФТНС с одноступенчатой функцией распределения электронов (рис. 1а)
| Мальтоза, % | Модель | $\left\langle R \right\rangle $, Å | m | d, Å | D, Å | ρPH, 1010 см–2 | χ2 |
|---|---|---|---|---|---|---|---|
| 20 | ПМ | 207 ± 2 | 18 ± 1 | 52.0 ± 0.8 | 19.7 ± 0.3 | 10.7 ± 0.3 | 0.65 |
| РФФ | 208 ± 3 | 18 ± 1 | 51.3 ± 0.8 | 19.9 ± 0.3 | 10.7 ± 0.3 | 0.66 | |
| 25 | ПМ | 164 ± 2 | 19 ± 1 | 48.1 ± 0.7 | 20.7 ± 0.2 | 10.9 ± 0.2 | 0.37 |
| РФФ | 165 ± 2 | 19 ± 1 | 47.8 ± 0.7 | 20.7 ± 0.2 | 10.9 ± 0.3 | 0.37 | |
| 30 | ПМ | 149 ± 2 | 19 ± 1 | 36.3 ± 0.6 | 22.7 ± 0.2 | 11.6 ± 0.1 | 0.42 |
| РФФ | 148 ± 2 | 19 ± 1 | 36.6 ± 0.6 | 22.6 ± 0.2 | 11.6 ± 0.2 | 0.42 |
Таблица 3.
Расчет по полной модели (ПМ) и по модели РФФ для везикулярной системы ФТНС с двухступенчатой функцией распределения электронов (рис. 1б)
| Мальтоза, % | Модель | R, Å | m | d, Å | D, Å | L, Å | ρPH, 1010 см–2 | χ2 |
|---|---|---|---|---|---|---|---|---|
| 20 | ПМ | 206 ± 3 | 18 ± 1 | 44.4 ± 0.4 | 27.3 ± 0.2 | 10.5 ± 0.9 | 12.4 ± 0.2 | 0.70 |
| РФФ | 205 ± 3 | 18 ± 1 | 44.9 ± 0.4 | 27.1 ± 0.2 | 11.2 ± 0.9 | 12.4 ± 0.2 | 0.70 | |
| 25 | ПМ | 161 ± 2 | 18 ± 1 | 40.8 ± 0.3 | 25.4 ± 0.2 | 2.9 ± 0.3 | 11.9 ± 0.2 | 0.36 |
| РФФ | 160 ± 2 | 18 ± 1 | 40.0 ± 0.3 | 26.4 ± 0.1 | 3.2 ± 0.2 | 11.9 ± 0.2 | 0.36 | |
| 30 | ПМ | 147 ± 2 | 19 ± 1 | 37.0 ± 0.3 | 22.7 ± 0.2 | 1.0 ± 0.1 | 11.5 ± 0.4 | 0.42 |
| РФФ | 146 ± 2 | 19 ± 1 | 37.0 ± 0.2 | 22.6 ± 0.7 | 1.0 ± 0.1 | 11.5 ± 0.4 | 0.41 |
Из таблиц видно, что результаты расчетов по ПМ и модели РФФ очень близки и отличаются не больше чем на 1 Å. Это свидетельствует о применимости метода РФФ даже в случае достаточно малых размеров везикул и подтверждает возможность его использования для исследования дальнейшего структуры ФТНС и лекарств на этой основе.
Для двух моделей бислоя наблюдается существенное (до 1.4 раз) уменьшение размера везикул ФТНС при увеличении концентрации мальтозы с 20 до 30%. При этом полидисперсность среднего радиуса меняется незначительно и остается достаточно низкой: 22–23%. Видно, что обе модели бислоя обеспечивают в целом неплохое согласие с экспериментальными данными и близкие значения χ2. Расчетные кривые, полученные в рамках двух моделей, практически не различаются в левой части спектра. Однако осцилляции в правой части спектра лучше воспроизводятся в рамках двухступенчатой модели. Поэтому результаты, полученные на этой основе, представляются более реалистичными. Толщина бислоя d уменьшается от 44 до 37 Å с ростом концентрации мальтозы от 20 до 30%. Область полярных голов h = = (d – D)/2 также уменьшается приблизительно на 20%, от 8.6 до 7.5 Å. Сильное уменьшение области L углеводородных цепочек СН3 (с 11 Å при концентрации мальтозы 20% до 1 Å при концентрации 30%) можно объяснить перекрытием областей СН3 двух липидных слоев в центре бислоя. Тем самым с ростом концентрации мальтозы снижается вклад области СН3 в расчетную интенсивность МУРР. Соответственно, размеры бислоя d и области D углеводородных цепочек для случая 30%-ной концентрации мальтозы, полученные в рамках двухступенчатой модели, практически совпадают со значениями, полученными на основе одноступенчатой модели, не учитывающей вклад области СН3.
ВЫВОДЫ
Проведенные на установке ДИКСИ эксперименты методом МУРР для концентраций ФТНС от 25 до 37.5% подтвердили, что терапевтические концентрации раствора лиофилизата ФТНС в воде (25%) позволяют измерять спектры малоуглового рассеяния от образцов без существенных искажений и с достаточным контрастом, что обеспечивает возможность проводить на этой основе анализ структуры везикулярной системы как ФТНС, так и лекарств, построенных на основе ФТНС.
Основным результатом анализа экспериментальных данных МУРР, полученных на установке ДИКСИ, является определение базовых структурных параметров везикулярной системы ФТНС в зависимости от концентрации мальтозы в водном растворе. Показано, что средний размер везикул меняется от 410 Å при концентрации мальтозы 20% до 280 Å при концентрации 30%. Показано, что система везикул ФТНС имеет низкую полидисперсность (22–23%) при всех исследованных концентрациях мальтозы. Определены параметры липидного бислоя, что позволяет рассчитывать гидрофобный объем везикулярного переносчика лекарства, доступный для размещения водонерастворимых лекарств. Гидрофобный объем одной везикулы имеет максимальное значение 14.55 × 106 Å3 при концентрации ФТНС в воде 25%. Увеличение концентрации ФТНС в воде до 37.5% приводит к уменьшению гидрофобного объема до 6.16 × 106 Å3.
Полученные результаты будут использованы для исследования структуры нанолекарств на основе ФТНС.
Список литературы
Das S., Chaudhury A. // AAPS Pharm. Sci. Tech. 2011. V. 12. P. 62.
Martins S., Sarmento B., Ferreira D.C. et al. // Int. J. Nanomedicine. 2007. V. 2. P. 595.
Стрекалова О.С. Фосфолипидные наночастицы: получение, характеристика, использование для транспорта лекарств в организме: автореферат дис. … к. б. н.: 03.01.04. Москва, 2010. 24 с.
Арчаков А.И., Гусева М.К., Учайкин В.Ф. и др. // Патент 2 463 057. Российская Федерация, МПК A61K 31/685 A61K 9/127 A61K 1/16 B82B 1/00.
Ipatova O.M., Torkhovskaya T.I., Medvedeva N.V. et al. // Biomedical Chemistry. 2010. V. 4. P. 82.
Kiselev M.A., Zemlyanaya E.V., Ipatova O.M. et al. // J. Pharmaceutical and Biomedical Analysis. 2015. V. 114. P. 288.
Zhabitskaya E., Zemlyanaya E., Kiselev M., Gruzinov A. // EPJ Web of Conferences. 2016. V. 108. P. 02047.
Zemlyanaya E.V., Kiselev M.A., Zhabitskaya E.I. et al. // J. Physics: Conference Series 2016. V. 724. P. 012056.
Киселев М.А. // Физика элементарных частиц и атомного ядра. 2011. V. 42. P. 578.
Свергун Д.И., Фейгин Л.А. Рентгеновское и нейтронное малоугловое рассеяние. М.: Наука, 1986. 276 с.
Kucerka N., Mu-Ping Nieh, John Katsaras J. // Advances in Planar Lipid Bilayers and Liposomes. Elsevier; Burlington: Academic Press, 2010. V. 12. P. 201.
Kiselev M.A., Lombardo D. // Biochim. Biophys. Acta. 2017. V. 1861. P. 3700.
Kiselev M.A., Zemlyanaya E.V., Aswal V.K. et al. // Europ. Biophys. J. 2006. V. 35. P. 477.
Kiselev M.A., Lesieur P., Kisselev A.M. et al. // Nucl. Instum. Method A. 2001. V. 470. P. 409.
Kiselev M.A., Lesieur P., Kisselev A.M. et al. // J. Alloys Compounds. 2001. V. 328. P. 71.
Kiselev M.A., Wartewig S., Janich M. et al. // Chemistry and Physics of Lipids. 2003. V. 123. P 31.
Kiselev M.A., Zbytovska J., Matveev D., et al. // Colloids and Surfaces A: Physicochemical and Engineering Aspects. 2005. V. 256. P. 1.
Киселев М.А., Ломбардо Д., Киселев А.М. и др. // Поверхность. Рентген., синхротр. и нейтр. исслед. 2003. № 11. С. 20.
Zemlyanaya E.V., Kiselev M.A., Zbytovska J. et al. // Crystallography Reports. 2006. V. 51. Suppl. 1. P. S22
Земляная Е.В., Киселев М.А., Нойберт Р. и др. // Поверхность. Рентген., синхротр. и нейтрон. исслед. 2008. № 11. С. 14
Kiselev M.A., Zemlyanaya E.V., Ryabova N.Y. et al. // Appl. Phys. A. 2014. V. 116. P. 319.
Киселев М.А., Земляная Е.В., Жабицкая Е.И., и др. // Кристаллография. 2015. Т. 60. № 1. С. 140.
Ostanevich Y.M. // Makromol. Chem., Macromol. Symp. 1988. V. 15. P. 91.
Dymov S.N., Kurbatov V.S., Silin I.N., Yaschenko S.V. // Nucl. Instrum. Methods. Phys. Res. A. 2000. V. 440. P. 431.
Zhabitskaya E.I., Zhabitsky M.V. // Lecture Notes in Computer Science, Springer. 2012. V. 7125. P. 328.
Жабицкая Е.И., Жабицкий M.В. // Математическое Моделирование. 2012. Т. 24. № 12. С. 33.
Дополнительные материалы отсутствуют.
Инструменты
Поверхность. Рентгеновские, синхротронные и нейтронные исследования