Поверхность. Рентгеновские, синхротронные и нейтронные исследования, 2019, № 3, стр. 97-100
Взаимодействие гидроксиапатита (ГАП) с поверхностью различной природы – важнейший аспект поверхностной инженерии
Е. А. Богданова 1, *, А. Г. Широкова 1, В. М. Скачков 1, Н. А. Сабирзянов 1
1 Институт химии твердого тела Уральского отделения РАН
620990 Екатеринбург, Россия
* E-mail: chemi4@rambler.ru
Поступила в редакцию 10.04.2018
После доработки 14.06.2018
Принята к публикации 14.06.2018
Аннотация
Проведены работы по созданию композиционных материалов с биологически активным покрытием. Биоактивное покрытие сформировано из водной суспензии гидроксиапатита. Предложены различные способы его нанесения: вакуумное импрегнирование, его модификация, ультразвук. Произведена сравнительная оценка. Изучено влияние различных факторов (материал матрицы, способ нанесения покрытия, термический отжиг) на особенности формирования поверхностного слоя и его прочностные характеристики.
ВВЕДЕНИЕ
Гидроксиапатит (ГАП) является одним из лучших материалов, применяемых в качестве биоактивных покрытий. Использование биосовместимой металлической основы (нержавеющая сталь, титан, сплавы кобальта или титана) позволяет компенсировать недостаточную прочность чистого ГАП и получить композиционный материал с требуемыми характеристиками [1].
В настоящее время перспективным направлением является использование высокопористых ячеистых материалов (ВПЯМ), структура которых представляет систему открытых и взаимосвязанных пор, обеспечивающую постоянный контакт биологических жидкостей с активным веществом.
Наряду с пористыми металлами матрицей может служить и полимер, образующий с ГАП органоминеральный композит (ОМК) [2]. Свойства полимерной матрицы (ПМ) будут определять функциональные характеристики ОМК. Использование биосовместимой ПМ позволит получать не только композиты с высокими связующими и прочностными характеристиками [2], но и биосорбенты, поскольку ГАП обладает высокой адсорбционной способностью к ионам тяжелых металлов и может успешно применяться для очистки крови и восстановления функциональности печени и почек [3]. ОМК-сорбенты на основе ГАП также могут быть использованы для очистки сточных вод, утилизации промышленных отходов, восстановления загрязненных почв [4].
МАТЕРИАЛЫ И МЕТОДЫ
В экспериментальных исследованиях был использован высокопористый ячеистый никелид титана (NiTi) [5]. Кроме никелида титана для создания металлического каркаса имплантата использовали пористый титан с характеристиками пористости 28, 40 и 45% и полимерную матрицу [6].
В качестве материала покрытия брали устойчивую к седиментации суспензию ГАП с концентрацией по основному веществу 1−10 мас. %, полученную стандартным методом осаждения из растворов [7]. Взаимодействие осуществляли путем смешивания 0.02 М водного раствора гидроксида кальция и 0.07 М-раствора фосфорной кислоты при объемном соотношении компонентов, равном (3.75−5) : 1. Исходную смесь перемешивали при комнатной температуре в течение 15 мин. Полученную дисперсную систему подвергали фильтрации с последующим старением выделенного осадка на воздухе при комнатной температуре. В процессе высыхания происходит переход дисперсной системы в суспензию ГАП, которая при дальнейшем старении образует кристаллический ГАП, состава Ca10(PO4)6(OH)2.
Для выбора оптимального способа нанесения ГАП на полученные образцы из ВПЯМ были опробованы три метода. В случае первого способа образец помещали на границу н. у./вакуум и пропускали через него дозированное количество суспензии ГАП. Для создания вакуума 1 × 10–10 − 8 × × 10–1 мм рт. ст. был использован насос 2НВР-1ДМ. Образец сушили на воздухе. При втором способе после вакуумной пропитки образец в суспензии ГАП обрабатывали на центрифуге CM-6M-ELMI в течение 1 мин при скорости 3500 об./мин, а затем сушили в муфельной печи Nabertherm L 9/11 с контроллером B 180 (скорость нагрева 10°C/мин) при 100°C в течение одного часа. В случае третьего способа покрытие получали путем ультразвуковой обработки образца в водной суспензии ГАП в ультразвуковой ванне “САПФИР 1.3 ТТЦ” при мощности 35 кГЦ с нагревом до температуры 40°C при перемешивании в течение 1 ч с последующей сушкой на воздухе.
Количество сорбированного ГАП определяли по разнице веса образца до и после нанесения при всех методах.
Морфологию поверхности образцов, покрытых ГАП, изучали на сканирующем электронном микроскопе JSM-6390 LA, JEOL (Увеличение от ×5 до ×300 000, разрешающая способность 3.0 нм при ускоряющем напряжении 30 кВ).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
При выборе метода нанесения ГАП авторы руководствовались исключением возможности снижения его биоактивности, связанной с увеличением размера зерен и частичным разложением при термообработке выше 800°C, характерным для ГАП, полученным осаждением из растворов [1, 7].
Было исследовано нанесение ГАП-покрытия на образцы пористых никелида титана (NiTi), титана и ПМ в щадящих условиях методами вакуумного импрегнирования (способ 1), этим же способом, но дополненным центрифугированием (способ 2) и ультразвуковой обработкой в ультразвуковой ванне (способ 3). Результаты исследований по дозированному заполнению ГАП порового пространства металлических матриц представлены на рис. 1.
Рис. 1.
Прирост массы ГАП-покрытия, нанесенного различными способами на пористые металлические матрицы: 1 − никелид титана; 2 − титан, пористость 28%; 3 − титан, пористость 40%; 4 − титан, пористость 45%.

Анализ полученных данных свидетельствует, что наилучшие сорбционные свойства при всех способах обработки проявили образцы NiTi с пористость ~90% и Ti с пористостью 45%. При выборе способа нанесения предпочтение можно отдать вакуумному импрегнированию. Прирост массы образца на третьей стадии обработки составил 26.75% в случае никелида титана и 11.41% для титана с пористостью 45%. Данный способ является наиболее эффективным для всех исследуемых образцов, обеспечивает получение равномерного и прочного покрытия. Дополнительные центрифугирование и ультразвуковая обработка в способах 2 и 3 не повышают полноту покрытия.
На примере пористого титана (45%) были исследованы особенности формирования поверхностного слоя при сочетании, признанного наиболее эффективным, метода вакуумного импрегнирования (способ 1) и термического отжига, который, как правило, используют для улучшения функциональных и эксплуатационных характеристик композиционных материалов.
Установлено, что термическая обработка при температуре 600°С в процессе нанесения покрытия оказывает негативное влияние на сорбционную способность пористого титанового каркаса, препятствует образованию развитой пористой поверхности, необходимой для успешного вживления имплантата, и более чем в два раза снижает адгезионную прочность покрытия [8]. Прирост массы образца в этом случае обеспечивается не только образованием биоактивного слоя, но и окислением титановой матрицы в процессе отжига. Вклад “окислительной” составляющей прямо пропорционален количеству стадий термообработки (рис. 2).
Рис. 2.
Прирост массы покрытия при нанесении ГАП методом вакуумного импрегнирования на пористый титан (45%): 1 − вакуумное импрегнирование, отжиг после первой стадии обработки; 2 − вакуумное импрегнирование, отжиг после завершающей стадии обработки; 3 − вакуумное импрегнирование, отжиг после каждой стадии обработки; 4 − вакуумное импрегнирование, без термообработки поверхности.
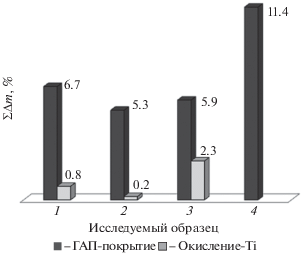
Экспериментально было установлено, что метод вакуумного импрегнирования, обеспечивающий получение равномерного и прочного покрытия на металлических матрицах, является непригодным для полимерной матрицы, поскольку приводит к ее механическому разрушению. При нанесении ГАП на ПМ необходимо исключить механические нагрузки из-за ее малой прочности, поэтому способ 1 был заменен на пропитку при комнатной температуре в течение одного часа.
Проведенные исследования показали, что наиболее эффективным способом нанесения покрытия на ПМ является ультразвуковая обработка при использовании способа 3 (табл. 1), обеспечивающая быстрый рост покрытия на начальном этапе обработки, что также характерно и для металлических матриц (табл. 2).
Таблица 1.
Результаты обработки ПМ-суспензией ГАП различными способами
| № опыта | mисходная, г | mконечная, г | ∆m, г | ∆m, % | Σ∆m, г | Σ∆m, % |
|---|---|---|---|---|---|---|
| Способ 1: пропитка (Т = 25°С, 1 ч), сушка на воздухе, н. у. | ||||||
| 1 | 0.12600 | 0.13325 | 0.00725 | 5.75 | 0.00725 | 5.75 |
| 2 | 0.13325 | 0.13000 | −0.00325 | −2.44 | 0.00400 | 3.17 |
| 3 | 0.13000 | 0.12560 | −0.00440 | −3.38 | −0.00040 | −0.32 |
| Способ 2: пропитка (Т = 25°С, 1 ч), центрифугирование (1 мин, 3500 об./мин), сушка на воздухе, н. у. | ||||||
| 1 | 0.09700 | 0.10200 | 0.00500 | 5.15 | 0.00500 | 5.15 |
| 2 | 0.10200 | 0.09850 | −0.00350 | −3.43 | 0.00150 | 1.55 |
| 3 | 0.09850 | 0.09860 | 0.00100 | 1.02 | 0.00160 | 1.65 |
| Способ 3: ультразвуковая обработка, сушка на воздухе, н. у. | ||||||
| 1 | 0.06555 | 0.07745 | 0.01190 | 18.15 | 0.01190 | 18.15 |
| 2 | 0.07745 | 0.07100 | −0.00645 | −8.32 | 0.00545 | 8.31 |
| 3 | 0.07100 | 0.06300 | −0.00800 | −11.27 | −0.00255 | −3.89 |
Таблица 2.
Результаты однократной обработки NiTi суспензией ГАП различными способами
| Способ нанесения покрытия |
mисходная, г | mконечная, г | ∆m, г | ∆m, % | Σ∆m, г | Σ∆m, % |
|---|---|---|---|---|---|---|
| Способ 1 | 0.72550 | 0.78100 | 0.05550 | 7.65 | 0.05550 | 7.65 |
| Способ 2 | 0.57850 | 0.63800 | 0.05950 | 10.29 | 0.05950 | 10.29 |
| Способ 3 | 0.89600 | 1.00735 | 0.11135 | 12.43 | 0.11135 | 12.43 |
На перспективность использования однократной ультразвуковой обработки полимерной матрицы указывает тот факт, что последующая обработка и дальнейшее увеличение слоя ГАП приводит к разрушению матрицы (табл. 1).
ЗАКЛЮЧЕНИЕ
Таким образом, проведен цикл работ по созданию композиционных материалов, где ГАП выступает в роли функционального покрытия. Изучено влияние различных факторов (материал матрицы, способ нанесения покрытия, термический отжиг) на особенности формирования поверхностного слоя и его прочностные характеристики. Полученные в работе результаты позволяют сделать вывод о перспективности метода вакуумного импрегнирования для создания имплантатов с биоактивным покрытием на пористой металлической матрице [9, 10]. Использование данного метода при нанесении ГАП на малопрочные каркасы ПМ ведут к разрушению последних и могут быть рекомендованы только для ограниченного использования.
БЛАГОДАРНОСТИ
Авторы выражают благодарность научному сотруднику лаборатории свободнорадикальной полимеризации Федерального государственного бюджетного учреждения науки Института металлоорганической химии им. Г.А. Разуваева РАН, к. х. н. Батенькину М.А. за предоставленный для исследований полимерный материал.
Работа выполнена в соответствии с государственным заданием и планами НИР ИХТТ УрО РАН.
Список литературы
Баринов С.М., Комлев В.С. Биокерамика на основе фосфатов кальция. М.: Наука, 2006. 204 с.
Захаров Н.А., Сенцов М.Ю. Краткие сообщения / Сорбционные и хроматографические процессы. 2011. Т. 11. Вып. 2. С. 177.
Abdel-Gawad E.I., Awwad S.A. // J. of American Science. 2011. V. 7(1). P. 105.
Janga S.H., Jeonga Y.G., Mina B.G., Lyoob W.S., Leea S.L. // J. Hazardous Materials. 2008. V. 159. P. 294. doi 10.1016/j.jhazmat.2008.02.018
Патент 2465018 (РФ). Способ получения покрытия на биоспице для остеосинтеза / Учреждение Российской Академии Наук Институт химии твердого тела УрО РАН. Борисов С.В., Шепатковский О.П., Тарасов В.В. и др. // Б.И. 2012. № 30. С. 6.
Батенькин М.А., Конев А.Н., Менсов С.Н. и др. // ВМС. Сер. А. 2011. Т. 53. № 7. С. 1033. doi 10.1134/S0965545X11070029
Патент 2406693 (РФ). Способ получения суспензии гидроксиапатита / Институт химии твердого тела УрО РАН. Сабирзянов Н.А., Богданова Е.А., Хонина Т.Г. // Б.И. 2010. № 35. С. 5.
Богданова Е.А., Сабирзянов Н.А. // Материаловедение. 2015. № 1. С. 52.
Богданова Е.А., Широкова А.Г., Скачков В.М., Григоров И.Г., Сабирзянов Н.А. // Физико-химические аспекты изучения кластеров, наноструктур и наноматериалов. 2016. № 8. С. 64.
Патент 2541171 (РФ). Биосовместимый пористый материал и способ его получения / Федеральное государственное бюджетное учреждение науки Институт химии твердого тела УрО РАН. Борисов С.В., Богданова Е.А., Григоров И.Г. и др. // Б.И. 2015. № 4. С. 9.
Патент 2599039 (РФ). Способ получения биомедицинского материала / Федеральное государственное бюджетное учреждение науки Институт химии твердого тела УрО РАН. Широкова А.Г., Богданова Е.А., Скачков В.М. и др. // Б.И. 2016. № 28. С. 7.
Дополнительные материалы отсутствуют.
Инструменты
Поверхность. Рентгеновские, синхротронные и нейтронные исследования


