Поверхность. Рентгеновские, синхротронные и нейтронные исследования, 2019, № 3, стр. 101-105
Термодинамический анализ процессов межфазного взаимодействия в структуре кремний/карбид кремния при электронно-лучевой обработке
Е. Ю. Гусев 1, *, С. П. Авдеев 1, О. А. Агеев 1
1 Южный федеральный университет, Научно-образовательный центр “Нанотехнологии”
347928 Таганрог, Россия
* E-mail: eyugusev@sfedu.ru
Поступила в редакцию 20.01.2018
После доработки 24.04.2018
Принята к публикации 24.04.2018
Аннотация
Проведен термодинамический расчет температурных зависимостей энергии Гиббса процессов межфазного взаимодействия расплава Si с поверхностью подложки SiC при электронно-лучевой обработке. Определены температурные режимы формирования фаз. На основе термодинамического анализа предложен ряд возможных трансформаций карбидов высшей и низшей стехиометрии в SiC. Установлены наиболее вероятные реакции синтеза и растворения SiC в кремнии, определен диапазон растворимых концентраций материала подложки от 263 ppm при Т = 1685 K до 990 ppm при Т = 1873 K.
ВВЕДЕНИЕ
Для изготовления приборов экстремальной электроники, в частности МОП-транзисторов, HEMT-транзисторов, диодов Шоттки и светодиодов применяются материалы с особыми свойствами. Одним из них является карбид кремния (SiC) – перспективный материал электронной техники, который обладает высокой механической, химической и тепловой стойкостью [1, 2]. Однако высокая твердость и хрупкость карбида кремния затрудняет получение чистой, атомарно-гладкой, стехиометрической поверхности подложек для экстремальной электроники и электронной техники.
Для подготовки поверхности подложек SiC используют различные способы механической, химической, электрофизической и термической обработок, которые приводят к формированию слоя с нарушенной стехиометрией [3, 4].
Для получения бездефектной поверхности подложек SiC используется метод жидкофазного растворения приповерхностного слоя подложки в кремнии, а также в растворах кремния со скандием [2]. При этом сообщается о возможности формирования силицидов и карбидов металла, способных менять кинетику процесса роста/растворения, а также приводить к дефектообразованию в монокристаллах SiC. Использование беспримесного Si в качестве растворителя позволяет формировать карбид кремния высшей и низшей стехиометрии.
Анализ известных работ [3–5] в области подготовки поверхности показал перспективность лучевых технологий, в частности, электронно-лучевой обработки, что объясняется локальным воздействием на поверхность и целенаправленным изменением ее характеристик. Рабочий диапазон температур с использованием электронно-лучевой обработки может составлять 1100–2400 K.
Вопросы анализа реакций в системе Si–Si1–хCх и формирования различных соединений раскрыты недостаточно [2, 5]. Более того, рассматриваемые области температур, в системе, приведенной ранее, мало изучены. Поэтому исследование процессов межфазного взаимодействия карбида кремния с кремнием на основе термодинамического анализа ряда возможных реакций в широком интервале температур (298–3000 K) имеет практический и научный интерес, так как позволяет расширить физико-химические основы и наметить пути дальнейшего совершенствования электронно-лучевой технологии получения чистой атомарно-гладкой стехиометрической поверхности подложек SiC.
В реакциях Si с подложкой SiC участвуют два компонента (углерод и кремний), которые, в зависимости от температуры, могут иметь различные фазовые состояния. В соответствии с данными работ [6–10] в системе Si–Si1–хCх возможно формирование высших и низших карбидов кремния (Si1–хCх): SiC3, SiC2, Si2C3, SiC, Si2C, Si3C в твердофазном состоянии, а также SiC2, SiC, Si2C, Si, Si2, Si3 в газообразном состоянии, которые могут оказывать влияние на кинетику протекания взаимодействия.
Для установления всех возможных направлений трансформации и изменений фазового состава системы Si–C при нагреве был проведен анализ реакций формирования карбидов и их взаимодействия с монокристаллическим карбидом кремния, кремнием и углеродом в области температур 298–3259 K [11].
МЕТОДИКА РАСЧЕТА
Все возможные реакции (более 60) процессов межфазного взаимодействия в системе Si–Si1–хCх представлены в виде системы:
(1)
$\left\{ \begin{gathered} 1)\,A({\text{т в ,ж }}) \leftrightarrow A({\text{г }}),\,B({\text{т в }}) \leftrightarrow B({\text{г }}); \hfill \\ 2)\,\left\{ {A({\text{т в ,ж }}) + B({\text{т в }}),\,A({\text{т в ,ж }}) + AB'({\text{т в }}),\,B({\text{т в }}) + A'B({\text{т в }})} \right\} \leftrightarrow AB({\text{т в ,г }}); \hfill \\ 3)\,\left\{ {A({\text{т в ,ж }}) + B({\text{т в }}),\,\left\{ {A({\text{т в ,ж }}),\,B({\text{т в }}),\,A({\text{т в ,ж }}) + B({\text{т в }})} \right\} + AB({\text{т в ,г }})} \right\} \leftrightarrow \hfill \\ \leftrightarrow \left\{ {AB'({\text{т в ,г }}),\,A'B({\text{т в ,г }})} \right\}, \hfill \\ \,\,\,\,A({\text{т в ,ж }})\left( {B({\text{т в }})} \right) + AB({\text{т в }}) \leftrightarrow A'B({\text{т в }})\left( {AB'({\text{т в }})} \right) + B({\text{т в }})\left( {A({\text{т в ,ж }})} \right); \hfill \\ 4)\,AB({\text{т в ,г }}) + AB'({\text{т в ,г }})\left( {AB'({\text{т в ,г }})} \right) \leftrightarrow AB'({\text{т в }})\left( {AB'({\text{т в ,г }})} \right) + A({\text{т в ,ж }})\left( {B({\text{т в }})} \right), \hfill \\ \end{gathered} \right.$В системе (1) учтены реакции фазовых переходов, формирования монокарбида кремния, карбидов вышей и низшей стехиометрии, взаимодействия монокарбида кремния со всеми возможными фазами {кремнием, углеродом, карбидами}.
Критерием, характеризующим направление и термодинамическую вероятность протекания химической реакции, принята величина изменения изобарно-изотермического потенциала [12]:
(2)
$\begin{gathered} \Delta G\left( T \right) = \Delta H_{{298}}^{0} + \\ + \,\,\int\limits_{298}^T {\Delta {{c}_{p}}} \left( T \right)dT - T\Delta S_{{298}}^{0} - T\int\limits_{298}^T {\frac{{\Delta {{c}_{p}}\left( T \right)}}{T}} dT, \\ \end{gathered} $В случае плавления кремния в (2) учитывалось приращение энтальпии плавления $\Delta {{H}_{{\text{m}}}}$ и соответствующего изменения энтропии ${{\Delta {{H}_{{\text{m}}}}} \mathord{\left/ {\vphantom {{\Delta {{H}_{{\text{m}}}}} {{{T}_{{\text{m}}}}}}} \right. \kern-0em} {{{T}_{{\text{m}}}}}}$ (${{T}_{{\text{m}}}}$ – температура плавления кремния).
Термодинамический анализ процессов межфазного взаимодействия в структуре Si/SiC (1) проведен в соответствии с технологическими режимами электронно-лучевой обработки для температур 298–3259 K. Верхняя граница температурного интервала соответствует температуре полного разложения SiC [6, 10].
При проведении расчетов использовали справочные данные термодинамических величин веществ [8, 10]. Для конденсированных соединений Si1–хCх, не представленных в справочнике, использовали данные, полученные расчетным путем по формуле Неймана–Коппа на основании значений образующих компонентов [6].
Расчет энергии Гиббса реакции растворения x мас. % углерода
(3)
${\text{SiC}}({\text{т в }}) \to {\text{Si}}({\text{ж }}) + {\text{С }}(x\,\,{\text{м а с }}{\text{.}}\,\,\% ,\,\,\,\,{\text{в }}\,\,{\text{Si}}({\text{ж }}))$(4)
$\begin{gathered} \lg \frac{C}{{{\text{м а с }}{\text{.}}\,\,\% }} = 3.66 - {{9660} \mathord{\left/ {\vphantom {{9660} T}} \right. \kern-0em} T} \pm 0.02, \\ (T \leqslant 1873\,\,{\text{K}}), \\ \end{gathered} $(5)
$\Delta {{G}_{p}}\left( T \right) = 1.85 \times {{10}^{5}} - 69.5T + \ln \left( {\frac{x}{{{\text{м а с }}{\text{.}}\,\,\% }}} \right)RT.$Выражение (5) справедливо для концентрации углерода менее 400 ppm [7], что соответствует 1333 ppm SiC.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
С целью установления фазового состава систем Si–C и Si–SiC при электронно-лучевом нагреве рассчитаны зависимости $\Delta G(T)$ по уравнению (2) для системы всех возможных реакций (1), описывающих процесс межфазного взаимодействия в структуре Si/SiC, в области существования низкотемпературных карбидов кремния. Выделены реакции формирования карбидов Si1–хCх, которые являются термодинамически наиболее вероятными (табл. 1).
Таблица 1.
Значения энергии Гиббса для наиболее вероятных реакций в области существования низкотемпературных карбидов
| № | Реакция | ∆Gf (298 K), кДж/моль | ∆Gf (1140 K), кДж/моль |
|---|---|---|---|
| 1 | Si + С ↔ SiC | –69.135 | –63.587 |
| 2 | 2Si + С ↔ Si2C | –72.807 | –63.564 |
| 3 | Si + 2С ↔ SiC2 | –72.559 | –63.300 |
| 4 | Si + С ↔ Si3C | –73.242 | –63.529 |
| 5 | Si + 3С ↔ SiC3 | –72.869 | –63.157 |
| 6 | 2Si + 3С ↔ Si2C3 | –144.150 | –126.994 |
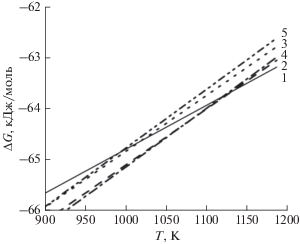
Анализ полученных зависимостей ($\Delta G$) реакций (1) и данных табл. 1 в области температур 298–1140 K показывает, что при температуре порядка 1130 K карбиды высшей и низшей стехиометрии разлагаются. При этом термодинамически наиболее вероятны: формирование твердофазных соединений SiC и Si2C3 (табл. 1, рис. 1), а с учетом данных стабильности карбидных фаз [6], – только SiC [11]; и соответствующие цепочки трансформации карбидов в SiC (рис. 1):
Рис. 1.
Температурные зависимости изменения свободной энергии Гиббса реакций формирования карбидов кремния, соответствующих номерам в табл. 1.
Термодинамический анализ показал, что в области температур предварительного нагрева вплоть до 1140 K, возможным стационарным равновесным соединением является SiC.
При дальнейшем повышении температуры структуры Si/SiC происходит плавление Si, при этом теоретически обосновано существование ряда реакций, представленных в табл. 2 (массовая доля газообразных фаз Si2(г), Si2(г), Si3(г) незначительна в сравнении с Si(ж), поэтому при выполнении анализа их влияние не учитывалось).
Таблица 2.
Возможность протекания реакций формирования газообразных веществ и жидкой фазы Si в системе Si–SiC
| № | Равновесная реакция | Изменение энергии Гиббса |
|---|---|---|
| 7 | Si(тв) ↔ Si(ж) | ∆G < 0 при T > 1685 K |
| 8 | Si(тв,г) + С(тв) ↔ SiC(г) | ∆G > 0 |
| 9 | С(тв) + SiC(г) ↔ SiС2(г) | ∆G < 0 |
| 10 | 1/2Si(тв,г) + 3/2С(тв) + 1/2SiC(г) ↔ SiC2(г) | ∆G < 0 при T > 2541 K |
| 11 | Si(тв,г) + SiC(г) ↔ Si2C(г) | ∆G < 0 |
| 12 | 3/2Si(тв,г) + 1/2С(тв) + 1/2SiC(г) ↔ Si2C(г) | ∆G < 0 при T > 2110 K |
| 13 | SiC(тв) + Si2C(г) ↔ SiC2(г) + 2Si(тв,г) | ∆G < 0 при T > 3055 K |
| 14 | SiC(г) + Si2C(г) ↔ SiC2(г) + 2Si(тв,г) | ∆G < 0 |
| 15 | SiC(тв) + SiC2(г) ↔ Si2C (г) + 2С(тв) | ∆G < 0 при T < 1530 K |
| 16 | SiC(г) + SiC2(г) ↔ Si2C (г) + 2С(тв) | ∆G < 0 |
Анализ данных табл. 2 показал, что реакции (13) и (15), где SiC представлен твердой фазой, термодинамически возможны при наличии Si2C(г) и SiC2(г), формирование которых по реакциям (11) и (9) определяется наличием SiC(г). В случае же реакций (9)–(12), (14) и (16), термодинамически возможных в широком температурном интервале требуется наличие SiC(г). Однако реакция (8), описывающая формирование SiC(г), не протекает (рис. 2). Отсутствие фазы SiC(г) во всем температурном интервале позволяет заключить, что из реакций (7)–(16) в прямом направлении идет только реакция (7).
Рис. 2.
Температурные зависимости изменения энергии Гиббса реакций для газообразных фаз Si1–хCх, соответствующих номерам в табл. 2.

Термодинамический анализ показал отсутствие формирования конденсированных карбидов кремния высшей и низшей стехиометрии, а также газообразных фаз в системе Si–Si1–хCх в интервале температур 1130 < T < 2400 K.
При температуре более 1685 K в системе расплав Si–подложка SiC устанавливается равновесие между процессами синтеза и растворения SiC по выражению (3), при этом в жидкой фазе Si растворена некоторая доля углерода (равновесная относительно SiC).
Расчет по модели (4), (5) показывает, что при температуре 1685 K, растворенными оказываются 79 ppm углерода или 263 ppm SiC (рис. 3). При повышении температуры до 1873 K, растворяются 297 ppm углерода или 990 ppm SiC.
Рис. 3.
Изменение энергии Гиббса термодинамически наиболее вероятных реакций в системe Si–SiC: 1 – синтеза SiC (реакция 1), 2 – плавления Si (реакция 7), 3 – растворения 263 ppm SiC и 4 – растворения 990 ppm SiC.
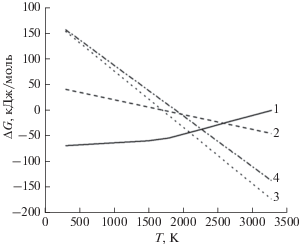
Обобщение полученных данных уравнения (5) и системы термодинамически наиболее вероятных реакций (рис. 3) позволило установить:
– существование температуры (Т ≥ 1685 K) равновесия реакций синтеза и растворения SiC (соответствует точкам пересечениям кривой 2 с линиями 3 и 4 на рис. 3), при котором в расплаве Si растворен материал подложки определенной концентрации;
– диапазон концентраций растворенного в Si материала подложки SiC от 263 ppm (1685 K) до 990 ppm (1873 K).
ЗАКЛЮЧЕНИЕ
Проведен термодинамический расчет температурных зависимостей энергии Гиббса процессов межфазного взаимодействия расплава Si с подложкой SiC при электронно-лучевой обработке. На основании расчетов предложены схемы химических реакций, протекающих в системе Si–SiхC1–х в диапазоне температур 298–3259 K.
Определены области формирования фаз. Установлено, что карбиды высшей и низшей стехиометрии разлагаются при температуре 873–1130 K. Показано, что формирование газообразных фаз Si2C(г) и SiC2(г) возможно при температурах более 2600 K при наличии фазы SiC(г), которая отсутствует в анализируемом диапазоне температур для данной системы. Таким образом, единственно возможными устойчивыми фазами в системе Si–SiхC1–х являются Si(тв), Si(ж) и SiC(тв).
Определено изменение энергии Гиббса реакции растворения SiC в жидкой фазе Si. Получены количественные значения растворенного вещества при заданной температуре (263 ppm SiC при 1685 K и 990 ppm SiC при 1873 K).
Термодинамический анализ показал отсутствие формирования твердых и газообразных карбидов кремния в области режимов электронно-лучевой обработки структур Si/SiC в диапазоне температур 1685–2400 K. Синтез и растворение монокристаллического карбида кремния термодинамически вероятны по реакции ${\text{Si}}({\text{ж }}) + {\text{С }}({\text{т в }})$ ↔ ${\text{SiC}}({\text{т в }}).$
Установлен диапазон степени растворения материала подложки от 263 до 990 ppm.
Отсутствие синтеза карбидов кремния высшей и низшей стехиометрии делает Si перспективным растворителем SiC в технологии электронно-лучевого формирования чистой атомарно-гладкой стехиометрической поверхности монокристаллических подложек карбида кремния.
Изучение химических процессов, протекающих в системе Si–Si1–хCх, позволяет оптимизировать технологические параметры процесса получения такой поверхности подложек SiC для изготовления приборов электронной техники.
Список литературы
Лучинин В.В., Таиров Ю.М. // Известия вузов. Электроника. 1997. № 1. С. 10.
Yakimova R., Syvajarvi M. Liquid Phase Epitaxy of Silicon Carbide // Liquid Phase Epitaxy of Electronic, Optical and Optoelectronic Materials / Eds. Capper P., Mauk M. Chichester: John Wiley & Sons Ltd, 2007. P. 179.
Патент. 2389109 (РФ). Способ обработки поверхности волоконных материалов / Южный федеральный университет. Авдеев С.П., Агеев О.А., Гусев Е.Ю., и др. № 2008113559/28; заявл. 07.04.2008; опубл. 10.05.2010 // БИ. 2010. № 13. 8 с.
Agueev O.A., Avdeev S.P., Svetlichnyi A.M. et al. // Materials Science Forum. 2005. V. 483–485. P. 725.
Авдеев С.П., Агеев О.А., Гусев Е.Ю. и др. // Тезисы докладов VI междунар. науч. семинара “Карбид кремния и родственные материалы, ISSCRM-2009” (Великий Новгород, 27–29 мая, 2009). Великий Новгород: Изд-во НовГУ, 2009. С. 138.
Nagamori M., Boivin J.-A., Claveau A. // Metallurg. Mater. Trans. B. 1996. V. 27 B. P. 322.
Yanaba K., Akasaka M., Takeuchi M. et al. // Mater. Trans., JIM. 1997. V. 38. № 11. P. 990.
Chase M.W., Jr. NIST-JANAF Themochemical Tables: Fourth Edition // J. Phys. Chem. Ref. Data. 1998. Monograph № 9. P. 1–1951. [Electronic resource]. URL: http://webbook.nist.gov/chemistry/ (access date: 16.03.2017).
Electronic archive “New Semiconductor Materials. Characteristics and Properties” by Ioffe Institute [Electronic resourse]. URL: http://www.ioffe.ru/SVA/NSM/Semicond/ (access date: 21.03.2017).
Термодинамические свойства индивидуальных веществ; справочное издание в 4-х т. / Ред. Гурвич Л.В. и др. Т. II. Кн. 1. М.: Наука, 1979. 440 с.
Гусев Е.Ю. Термодинамический анализ в структуре Si/SiC при обработке электронным лучом // ЮНЦ РАН: материалы V ежегод. науч. конф. студентов и аспирантов базовых кафедр Южного научного центра РАН (Ростов-на-Дону, 8–27 апреля, 2009). Ростов-на-Дону: Изд-во ЮНЦ РАН, 2009. С. 148.
Морачевский А.Г., Сладков И.Б. Термодинамические расчеты в металлургии. М.: Металлургия, 1993. 304 с.
Дополнительные материалы отсутствуют.
Инструменты
Поверхность. Рентгеновские, синхротронные и нейтронные исследования


