Поверхность. Рентгеновские, синхротронные и нейтронные исследования, 2019, № 5, стр. 80-88
Адсорбция и взаимодействие молекул Co и No на поверхности чистого и оксидированного сплава Al−Mо(110)
Г. С. Григоркина 1, А. Г. Рамонова 1, В. Б. Заалишвили 2, О. Г. Бурдзиева 2, Т. Т. Магкоев 1, 2, *
1 Северо-Осетинский государственный университет им. К.Л. Хетагурова
362025 Владикавказ, Россия
2 Геофизический институт Владикавказского научного центра РАН
362002 Владикавказ, Россия
* E-mail: t_magkoev@mail.ru
Поступила в редакцию 15.04.2018
После доработки 25.04.2018
Принята к публикации 25.04.2018
Аннотация
Совместная адсорбция и взаимодействие молекул оксидов углерода и азота на поверхности сплава Al−Mo(110) и системы, полученной ее окислением (Al−Mo−O), исследованы методами РФЭС, ЭОС, ИКС, ТДС и ДМЭ. Работа выхода в условиях сверхвысокого вакуума также измерена. Сплав Al−Mo(110) получен в результате отжига при 800 К системы, образующейся при напылении тонкой пленки алюминия на поверхность кристалла Мо(110). Атомы Al проникают в подложку, образуя с ней приповерхностный сплав гексагональной симметрии, характерной для стехиометрического сплава Al2Mo. В отличие от диссоциативной адсорбции СО и NO на поверхности Мо(110) и Al(111), на поверхности сплава Al–Mo(110) имеет место молекулярная адсорбция. Адсорбция СО на поверхности сплава с предадсорбированными молекулами NO при температуре подложки 200 К кардинально меняет состоянием последних, смещая их в более высококоординированные адсорбционные центры с одновременным наклоном молекулярной оси к плоскости поверхности адсорбента. Нагрев такой системы до температуры 320 К приводит к восстановлению оксида азота монооксидом углерода с образованием СО2 и азотированию подложки. Данный процесс может быть обусловлен реконструкцией поверхности, приводящей к появлению дополнительных адсорбционных/реакционных центров на границе Al/Mo, а также изменению степени заполнения d-зоны подложки. На поверхности оксидированной системы Al−Mo−O, получаемой выдержкой системы Al−Mo(110) при температуре 700 К в атмосфере кислорода до экспозиции 1500 Л, эффективность процесса окисления СО оксидом азота заметно возрастает.
ВВЕДЕНИЕ
В последние годы с целью снижения стоимости гетерогенных катализаторов активно исследуются материалы, не содержащие драгоценных металлов [1]. Одним из используемых при этом подходов является сплавление переходных d-металлов середины или конца периода с s-, sp-элементами. Это позволяет достичь более высокой степени заполнения d-зоны металла, таким образом приблизиться к свойствам, характерным для благородных металлов и создать дополнительные адсорбционные/реакционные центры на границе раздела компонент сплава [2, 3]. Такой подход позволяет, например, достичь высокой каталитической активности карбидов вольфрама и молибдена в восстановлении СО, сопоставимой с той, которую проявляют благородные металлы [4]. Кроме того, Мо2С является стимулятором в процессе электрокатализа на основе карбида вольфрама в метанольных топливных элементах [5]. Исследования другого сплава (Fe−Co) показали, что в зависимости от соотношения компонент сплава можно варьировать активность реакции синтеза Фишера−Тропша, дополнительно подавляя образование карбидов, тем самым снижая скорость деградации катализатора [6]. Другим перспективным катализатором в реакциях превращения углеводородов и оксида углерода признан нитрид молибдена [7]. В частности, нестехиометрический нитрид молибдена проявляет высокую активность при селективном окислении метана в высшие алканы и спирты [8]. С целью снижения вредных автомобильных выбросов значительное внимание уделяется реакциям каталитического превращения СО + NO [9]. Показано, например, что наряду с благородными металлами (Rh, Pt, Pd, Ir), карбиды вольфрама и молибдена также могут быть активными катализаторами для нейтрализации автомобильных выбросов [10, 11]. Несмотря на достаточно активные исследования, проводимые в этом направлении, практически неизученными остаются системы, образующиеся при сплавлении переходных металлов середины периода с sp-металлами (например, W или Мо c Al). Вместе с тем, следует ожидать, что именно такое сочетание компонент должно обеспечить максимальное заполнение d-зоны переходного металла за счет высокой плотности свободных электронов в алюминии, и, как следствие, повышение каталитической активности [9]. В пользу данного предположения свидетельствуют результаты недавних исследований, продемонстрировавших повышение каталитической активности при окислении СО на поверхности Мо(110) при сплавлении с бором – материалом, изоэлектронным алюминию [12]. Целью настоящей работы являлось установление механизмов возможных превращений при адсорбции и взаимодействии молекул СО и NO на поверхности сплава Al−Mo(110), а также системы полученной in situ окислением данного сплава Al−Mo−O.
МЕТОДЫ ИССЛЕДОВАНИЙ
Исследования проведены в двухуровневой сверхвысоковакуумной камере, на основе системы VGS Escalab MkII, оборудованной методами анализа поверхности: рентгеновской фотоэлектронной спектроскопии (РФЭС) с использованием полусферического дефлектора, электронной оже-спектроскопии (ЭОС) на основе однокаскадного цилиндрического анализатора с коаксиальной электронной пушкой, термодесорбционной спектроскопии (ТДС) с использованием квадрупольного масс-спектрометра, инфракрасной спектроскопии (ИКС), дифракции медленных (ДМЭ) электронов на основе стандартной полусферической четырехсеточной оптики. Работа выхода ϕ измерялась методом Андерсона, для чего в камере была смонтирована специальная низкоэнергетическая электронная пушка, с помощью которой регистрировались кривые задержки в тормозящем поле, образованном за счет контактной разности потенциалов между катодом пушки и исследуемым образцом. Для определения абсолютных значений ϕ работа выхода чистой поверхности Мо(110) принималась равной 5.0 эВ. Оже-спектры регистрировались в режиме dN/dE при энергии первичных электронов 2 кэВ и величине напряжения модуляции 2 В. ИК-спектроскопия реализована в конфигурации скользящего инфракрасного луча, поляризованного в плоскости падения (угол падения на исследуемую поверхность 85°). Такая конфигурация обеспечивает чувствительность к колебаниям адсорбированных молекул с ненулевой проекцией дипольного момента вдоль нормали к поверхности. Это значит, что метод ИКС в данном случае чувствителен к молекулам СО и NO, оси которых расположены в нормальном поверхности направлении или наклонены по отношению к ней. К молекулам, “лежащим” на поверхности адсорбента, метод при данном ходе лучей не чувствителен. Термодесорбционные спектры регистрировались при скорости роста температуры подложки 2 К/с с помощью квадрупольного масс-спектрометра, ось которого ориентирована вдоль нормали к поверхности. При этом спектрометр настраивался на одновременную регистрацию нескольких величин атомных масс (m/z) десорбирующихся частиц.
Поверхность Мо(110) очищали стандартной процедурой отжига при 1700 К в атмосфере кислорода при парциальном давлении 10–7 мбар для удаления углерода и серы, затем проводили ряд высокотемпературных “вспышек” в сверхвысоком вакууме (2 × 10–10 мбар) до тех пор, пока в оже-спектре исчезали линии, соответствующие чужеродным примесям на всех шкалах усиления спектрометра. Пленка Al in situ наносились на поверхность Мо(110) термическим напылением навески чистотой 99.9999% из ячейки Кнудсена. Скорость напыления и степень покрытия подложки пленкой θ определялись по ослаблению оже-сигнала подложки и по концентрационной зависимости работы выхода ϕ(θ) в субмонослойной области в процессе напыления атомов Al на поверхность Мо(110). Известно, что особенности зависимости ϕ(θ) коррелируют c поверхностным покрытием адатомов [13, 14]. С учетом размеров атомов Мо и Al принималось, что единичное (монослойное) покрытие θ = 1 соответствует поверхностной концентрации атомов Al, равной 1.5 × × 1015 см–2 [14]. Как известно, при этом покрытии пленка алюминия на поверхности Мо(110) имеет структуру Al(111), которая сохраняется до нескольких монослоев, после чего происходит ее разупорядочивание [14, 15]. Поверхностный сплав Al−Mo(110) получали отжигом при 800 К в течение 3 мин пленки алюминия толщиной в два монослоя на поверхности Мо(110). Образующийся сплав стабилен в процессе отжига до температуры 1300 К. Адсорбция молекул СО и NO осуществлялась посредством напуска соответствующих газов в сверхвысоковакуумную камеру до парциального давления на уровне 10–7−10–8 мбар. Экспозиция молекул газов составляла 1 Лэнгмюр при парциальном давлении соответствующего газа 10–6 Тор в течение 1 секунды (1Л = 10–6 Тор · с). Для того, чтобы иметь возможность различать возможные термодесорбционные сигналы от СО и N2 (в обоих случаях m/z = 28) в качестве оксида азота использован изотоп 15NO. Держатель образца позволял выполнять охлаждение жидким азотом до температуры 90 К. Для получения оксидированной системы Al−Mo−O сформированный сплав Al−Mo(110) подвергался воздействию молекулярного кислорода, напускаемого в сверхвысоковакуумную камеру до парциального давления 5 × 10–10 мбар до достижения экспозиции порядка 1500 Л при температуре подложки 700 К. Адсорбция молекул СО и NO осуществлялась на поверхности системы Al−Mo−O после прекращения доступа кислорода и охлаждения подложки до 90 К.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
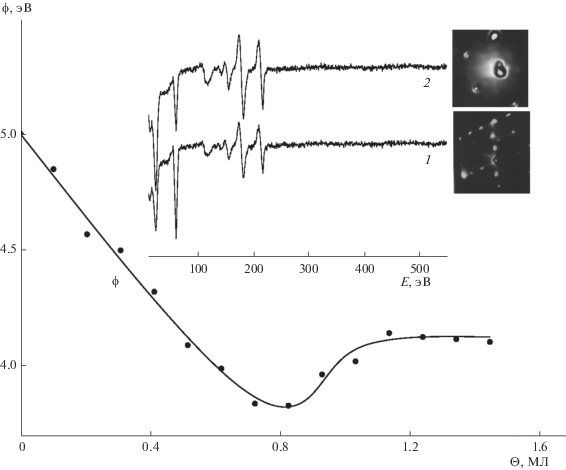
Концентрационная зависимость работы выхода ϕ(θ) при нанесении атомов алюминия на поверхность Мо(110), поддерживаемой при комнатной температуре, представлена на рис. 1. Начальное снижение работы выхода свидетельствует об электроположительном характере адсорбции, обусловленном поляризацией хемосорбционного заряда Al−Mo в сторону подложки. Это подтверждается и формой зависимости ϕ(θ), характеризуемой минимумом величины работы выхода с последующей ее стабилизацией при монослойном покрытии. Такая форма присуща для щелочных и щелочноземельных металлов, характер адсорбции которых практически всегда электроположителен [16]. Следует отметить, что, несмотря на интенсивные исследования адсорбции атомов металлов на металлических подожках, адсорбция атомов Al на поверхности Мо(110) и ряда других тугоплавких металлов остается малоизученной. В одной из немногих работ, посвященных этой теме (Колашкевич и др. [14]), наблюдалась концентрационная зависимость работы выхода, близкая к приведенной на рис. 1. Величина начального дипольного момента (μ) адатомов Al, полученная из зависимости ϕ(θ) при θ → 0 на основе соотношения Гельмгольца Δϕ = 4πθeμ, равна 0.19 Д, что согласуется с величиной, полученной в работе [14] (0.182 Д). На поверхности Мо(110) при комнатной температуре пленка алюминия растет послойно с образованием структуры Al(111) [13, 14]. При отжиге происходит диффузия атомов алюминия в подложку с образованием сплава [14], сопровождаемая повышением величины работы выхода с 4.15 до 4.4 эВ. Как показано ранее [17], отжиг тонкопленочной системы Al−Mo приводит к взаимной диффузии компонент системы с образованием сплава МоAl12. В целом, при сплавлении Al c Mo образуется 12 равновесных фаз [18]. В то же время, как показано Ивковым и др. [19], возможно формирование тонкопленочных сплавов AlxMo100– x с широким диапазоном величины x. Оже-спектры и картины ДМЭ двухмонослойной пленки Al на поверхности Мо(110) до и после отжига при 800 К приведены на вставке (рис. 1). Согласно результатам ДМЭ, структура пленки алюминия до отжига соответствует Al(111). Наблюдаемое снижение интенсивности оже-сигнала Al свидетельствует о его диффузии в подложку. При этом, как следует из смещения энергии оже-перехода Al LVV в сторону меньших кинетических энергий на величину 1.5 эВ, происходит химическое взаимодействие атомов Al и Мо. Согласно наблюдаемой после отжига дифракционной картине, происходит реконструкция поверхности с образованием структуры (√3 × √3)R30°. Подобная же картина ДМЭ наблюдалась Кэмпбеллом и Гудманом [20] при отжиге пленки Al на поверхности Ru(1000), которая была интерпретирована как слегка искаженная гексагональная плотноупакованная поверхность сплава Al2Ru. Этот сплав имеет орторомбическую структуру с чередующимися плоскостями гексагональной симметрии, состоящих из упорядоченной смеси атомов Al и Ru, соответствующих величине покрытия Al 2/3. Избыточный алюминий при образовании такого поверхностного сплава диффундирует в объем подложки при отжиге. Принимая во внимание близость дифракционных картин, полученных в настоящей работе и в работе Кэмпбелла и Гудмана [20], а также близкие величины постоянных решеток базальных плоскостей кристаллов Mo и Ru, можно предположить, что поверхностный сплав подобного же типа образуется и в случае системы Al−Mo(110)–Al2Mo. Это предположение подтверждается и указанным фактом повышения работы выхода с величины 4.15 до 4.4 эВ, что согласно зависимости ϕ(θ) (рис. 1), соответствует покрытию 0.55, которое близко с величиной содержания алюминия в сплаве Al2Mo – 0.67 [20].
Рис. 1.
Концентрационная зависимость работы выхода при нанесении атомов алюминия на поверхность Мо(110), поддерживаемой при комнатной температуре. На вставке приведены оже-спектры и картины ДМЭ пленок алюминия толщиной в два монослоя до (спектр 1) и после отжига при температуре 800 К в течение 3 мин (спектр 2).
Сплавление (как правило) приводит к существенной трансформации электронного состояния компонент сплава, в частности, повышению степени заполнения d-зоны переходного металла и эффективному снижению ее центра относительно уровня Ферми за счет переноса заряда от электроположительного металла [2, 9]. Это, наряду с изменением атомной структуры подложки, может иметь существенное влияние на процесс адсорбции и превращения молекул на поверхности. Как указано выше, наиболее широко используемыми тестовыми частицами для изучения адсорбционных и каталитических свойств тех или иных подложек являются молекулы СО и NO. ИК-спектры, соответствующие адсорбции СО и NO в отдельности (экспозиция – 20 Л) на поверхности сплава Al−Mo(110), поддерживаемой при температуре 200 К, приведены на рис. 2. Видно, что в обоих случаях спектры состоят из одной линии, расположенной при 2026 см–1 для СО и 1753 см–1 для NO, которая соответствует внутримолекулярным колебаниям С−О и N−O. При адсорбции же на поверхности отдельно Mo(110) и Al(111) колебательные линии в ИК-спектрах поглощения не наблюдались. Это можно объяснить тем, что в обоих случаях на поверхности как Мо(110), так и Al(111), происходит диссоциация молекул [21]. Таким образом, сплавление Мо(110) с Al кардинально меняет адсорбционные свойства подложки. Аналогичным образом Рен и др. [22] обнаружили, что при образовании соединения молибдена с углеродом диссоциация молекул NO полностью подавлена. Такая же ситуация имеет место и при сплавлении Pd(111) с Al [23]. Согласно принятой точке зрения, это обусловлено увеличением степени заполнения d-зоны переходного металла, эффективным смещением ее центра вниз и снижением плотности состояний на уровне Ферми. В соответствии с известной моделью Блухолдера [24], это приводит к ослаблению переноса заряда из d-зоны подложки на разрыхляющую 2π*-орбиталь молекул СО и NO. Наблюдаемые величины колебательных волновых чисел (рис. 2, спектры 1, 2) соответствуют перпендикулярной поверхности геометрии адсорбции с ориентацией атомов кислорода обеих молекул в сторону вакуума [25]. Более высококоординированные мостиковые, тетраэдрические или октаэдрические адсорбционные центры характеризуются существенно меньшими значениями колебательных волновых чисел [25]. Отсутствие связанных с подложкой таким образом молекул обусловлено, по-видимому, блокировкой соответствующих адсорбционных центров Мо(110) атомами алюминия при сплавлении. Согласно результатам работы Кэмпбелла и Гудмана [20], именно в таких высококоординированных узлах решетки располагаются атомы алюминия при образовании сплава. В то же время, нельзя исключить влияние изменения электронной структуры подложки в целом на изменение ее адсорбционных свойств. Подобный эффект наблюдался, в частности, при сплавлении Pt(111) с незначительным количеством Ge (5%), что привело к существенному изменению адсорбционных свойств СО и NO (по сравнению с чистой поверхностью Pt(111)) за счет изменения электронной структуры сплава [26].
Рис. 2.
ИК-спектры молекул СО и NO, адсорбированных в отдельности (спектры 1 и 2) и совместно (спектр 3) на поверхности сплава Al−Mo(110), поддерживаемого при температуре 200 К. ИК-спектр 3 соответствует адсорбции молекул СО на поверхности с предадсорбированными молекулами NO.
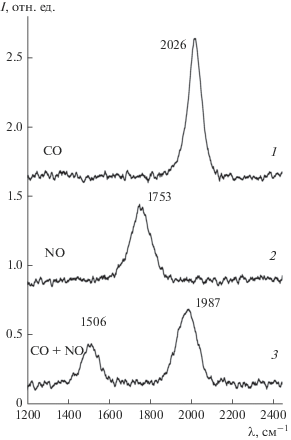
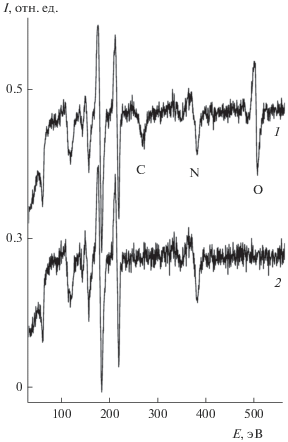
Инфракрасный спектр поглощения при адсорбции СО (20 Л) на поверхности Al−Mo(110) с предадсорбированными молекулами NO (20 Л) приведен на рис. 2 (спектр 3). Соответствующий оже-спектр, состоящий из линий Al, Mo, C, N, O, приведен на рис. 3 (спектр 1). Видно, что совместная адсорбция молекул СО и NO приводит к появлению особенностей, не наблюдающихся в случае адсорбции отдельных компонент: происходит существенное смещение колебательных особенностей в сторону меньших значений волновых чисел (на 250 и 40 см–1 для NO и СО соответственно). Наблюдаемое волновое для NO (1506 см–1) присуще молекулам, адсорбированным в мостиковых или дырочных адсорбционных центрах, в то время как наблюдаемая величина для СО − линейно адсорбированным молекулам [25]. Более низкую интенсивность колебательных линий NO и СО для случая совместной адсорбции, по сравнению со случаем адсорбции молекул NO и СО в отдельности, следует приписать реализации наклонной геометрии адсорбции молекул. Это объясняет указанное красное смещение волнового числа молекулы СО: молекула, оставаясь в линейной геометрии адсорбции, отклоняется от направления вдоль нормали к поверхности. Для молекулы NO ситуация меняется более кардинально: происходит не только наклон молекулярной оси от нормали к поверхности, но и изменение адсорбционного центра от линейного к мостиковому или дырочному. Наличие только одной колебательный особенности NO на поверхности Al-Mo(110) (рис. 2, спектр 2), соответствующей заполнению линейных адсорбционных центров, свидетельствует о непредпочтительности заполнения более высококоординированных мостиковых или дырочных центров адсорбции. Однако, при совместной адсорбции с молекулами СО последние существенно влияют на адсорбированные молекулы NO, смещая их из линейных в мостиковые или дырочные адсорбционные центры, одновременно наклоняя молекулярную ось NO ближе к плоскости поверхности адсорбента. Смещаясь в такие более высококоординированные центры адсорбции молекула NO подвержена большему локальному воздействию как Мо, так и Al, что усиливает обратный перенос заряда с поверхности адсорбента на разрыхляющую 2π*-орбиталь NO, тем самым ослабляя внутримолекулярную связь. Изменение адсорбционного центра молекулы NO при адсорбции СО имеет место, как показано ранее, и на поверхности системы Ni/MgO(111) [27]. Подобный же эффект наблюдался и для системы (NO + CO) на поверхности Ni(111) [28]. Незначительный прогрев системы (NO + CO)/Al−Mo(110) до температуры 350 К приводит к исчезновению всех колебательных особенностей в ИК-спектре. Соответствующий этому оже-спектр приведен на рис. 3 (кривая 2), из которого видно, что линии С и О практически полностью исчезают, в то время как сигнал N остается практически неизменным за исключением сдвига в сторону больших кинетических энергий на 1.6 эВ.
Рис. 3.
Оже спектры системы (СО + NO)/Al−Mo(110), поддерживаемой при температуре 200 К (спектр 1) и после отжига при температуре 380 К (спектр 2). Для наглядности приведена область N KLL оже-сигнала, демонстрирующая энергетический сдвиг линии при отжиге.
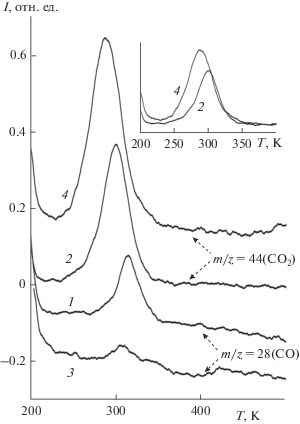
Термодесорбционные спектры для систем, характеризуемым ИК-спектром 3 (рис. 2) и оже-спектром 1 (рис. 3), приведены на рис. 4. В спектрах зарегистрированы только сигналы, соответствующие СО (m/z = 28) и СО2 (m/z = 44). Это свидетельствует о том, что в процессе нагрева часть молекул СО превращается в СО2 предположительно за счет восстановления NO. Такой процесс хорошо известен, например, для системы (NO + CO)/Rh, прогрев которой приводит к образованию СО2 и N2 [29]. В качестве первого этапа данного процесса можно предположить диссоциацию NO. Это предположение основано на результатах предыдущих исследований систем (CO + NO) на поверхности карбидов молибдена и вольфрама, для которых показано, что молекулы NO, а не СО, практически полностью диссоциируют [10, 11]. И в данном случае, как можно видеть из ИК-спектра 3 (рис. 2), молекула NO находится в состоянии преддиссоциации. Находясь в высококоординированном состоянии, она испытывает воздействия как Мо, так и Al (материалов, которые адсорбируют NO диссоциативно). Соадсорбированные молекулы СО, находящиеся также в наклонной геометрии адсорбции, которое можно рассматривать как предреакционное состояние, взаимодействуют с кислородом, выделившимся при диссоциации NO. Атомы азота вместо предполагаемого процесса их рекомбинации с образованием N2, образуют связи с подложкой, о чем свидетельствует приведенный на вставке (рис. 3) оже-сдвиг линии N KLL. Образующаяся таким образом подложка (Al/Mo(110)/N) может проявлять активность в окислении СО, согласно предыдущим работам, демонстрирующим высокую каталитическую активность нитридов алюминия и молибдена к преобразованию СО [7, 8, 30, 31]. Тот факт, что кислород, выделяющийся при диссоциации NO, окисляет СО, а не Al или Мо, может быть обусловлен конкуренцией атомов О и N за адсорбционный центр: известно, например, что в некоторых случаях азот может заменять кислород в оксиде алюминия с образованием AlN [32]. Существенную трансформацию адсорбционных и реакционных свойств молекул СО и NO при сплавлении Al с Мо(110) можно приписать реконструкции поверхности (с одной стороны) и изменению электронного строения сплава в целом (с другой). Реконструкция поверхности с образованием структуры (√3 × √3)R30° приводит к появлению низкокоординированных центров и межфазных адсорбционных центров между Al и Мо. Эти центры являются преимущественными центрами адсорбции молекул NO, о чем свидетельствует наличие вышеуказанной низкоэнергетической колебательной линии при 1506 см–1. Кроме этого, сплавление приводит к понижению энергии эффективного центра d-зоны подложки относительно уровня Ферми, что оказывает существенно влияние на перераспределение внутримолекулярного заряда молекул NO и СО при адсорбции [33].
Рис. 4.
Термодесорбционные спектры СО и СО2 систем, образованных после адсорбции 20 Л СО на поверхности Al−Mo(110) (спектры 1, 2) и Al−Mo−O (спектры 3, 4) с предадсорбированными молекулами NO (20 Л. На вставке для наглядности приведено соотношение интенсивностей линий СО2 для Al−Mo(110) (спектр 2) и Al−Mo−O (спектр 4).
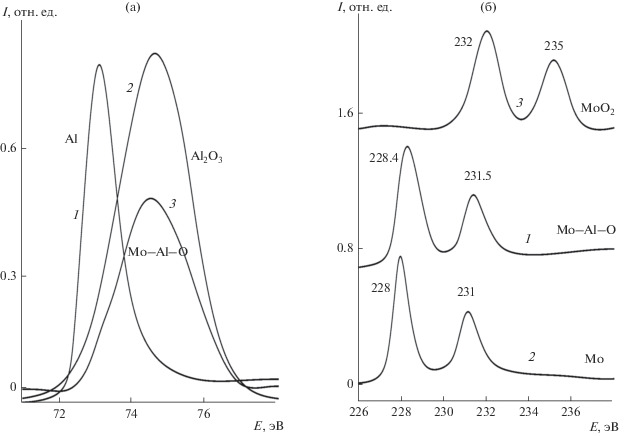
Рентгеновские фотоэлектронные спектры системы, полученной окислением сплава Al−Mo(110) посредством экспозиции в атмосфере кислорода при парциальном давлении 5 × 10–7 мбар и температуре подложки 700 К, приведены на рис. 5a, 5б (спектры под номером 1). Для интерпретации спектров системы Al−Mo−O представлялось информативным сопоставить их со спектрами оксидов алюминия и молибдена. Для этого были реализованы хорошо известные способы in situ окисления пленки алюминия, напыленной на поверхность Мо(110) для получения Al2O3 и окисления непосредственно поверхности Мо(110) для получения МоО2 [34, 35]. Соответствующие спектры Al2O3 и МоО2 приведены на рис. 5а, 5б (спектры под номером 2). Для сравнения также приведены спектры металлического Al и Мо (спектры под номером 3). Как видно из сопоставления спектров 1 и 2 (рис. 5а), электронное состояние атомов алюминия в окисленном сплаве Al−Mo−O практически полностью соответствует таковому, которое наблюдается в оксиде алюминия Al2O3. В то же время, как видно из рис. 5б, состояние атомов Мо в системе Al−Mo−O (спектр 1) и оксиде молибдена МоО2 (спектр 2) заметно различается. Соответствие вида спектров и положения линий Мо 2р для Al−Mo−O (спектр 1) и для Мо (спектр 3) указывает на то, что состояние атомов Мо в тройной системе, в отличие от Al, близко к наблюдаемому в металлическом Мо. Вместе с тем небольшие различия в спектрах 1 и 3 (рис. 5б) (небольшое смещение линий в сторону больших энергий связи и их уширение) указывают на то, что происходит определенная трансформация электронного состояния атомов Мо при окислении сплава Al−Мо(110), хотя и в существенно меньшей степени, чем для Al. Приведенные результаты свидетельствуют о том, что при взаимодействии сплава Al−Мо(110) с кислородом происходит практически полное окисление алюминия до Al2O3, с одной стороны, и незначительное изменение состояния атомов Мо, с другой. С точки зрения тройных соединений можно предположить формирование поверхностного нестехиометрического алюмината молибдена Mo1– x × nAl2O3, характеризуемого качественно подобным состоянием алюминия и молибдена как в рассматриваемой системе Al−Mo−O [36]. Как следует из данных ДМЭ, поверхность этой системы не обладает дальним порядком: окисление приводит к аморфизации первоначально упорядоченной структуры Al−Mo(110).
Рис. 5.
Рентгеновские фотоэлектронные линии Al 2p: система Al−Mo−O (спектр 1), пленка оксида алюминия Al2O3 толщиной порядка 10 нм на поверхности Mo(110), полученная реактивным напылением алюминия (спектр 2), пленка металлического алюминия толщиной порядка 8 нм на поверхности Мо(110) (спектр 3) – (а). Рентгеновские фотоэлектронные линии Mo3d, система Al−Mo−O (спектр 1), оксид молибдена МоО2, полученный окислением Мо(110) в атмосфере кислорода (спектр 2) и металлический Мо(110) (спектр 1) – (б).
Окисление поверхности сплава Al−Mo(110) приводит и к заметному изменению характера взаимодействия адсорбированных молекул СО и NO. Это иллюстрируется сопоставлением приведенных на рис. 4 термодесорбционных спектров, соответствующих (СО + NO) на поверхности Al−Mo(110). (спектры 1 и 2) и Al−Mo−O (спектры 3 и 4). Видно, что эффективность преобразования СО в СО2 на поверхности оксидированной системы Al−Mo−O заметно выше, чем на поверхности сплава Al−Mo(110)): интенсивность сигнала СО2 возрастает (спектр 4 относительно спектра 2), сопровождается практически полным исчезновением десорбционного сигнала СО (спектр 3 относительно спектра 1). Рассматриваемую систему Al−Mo−O можно рассматривать как модельную для нанесенной металлооксидной системы Mo/Al2O3, обладающей повышенной каталитической эффективностью за счет особенностей частиц металла, находящихся в контакте с оксидом, и свойств межфазной границы раздела металл/оксид [37]. Таким образом, системы Al−Mo(110) и Al−Mo−O могут рассматриваться как альтернатива платиноидным катализаторам нейтрализации смеси (СО + NO).
ЗАКЛЮЧЕНИЕ
При отжиге двухмонослойной пленки алюминия на поверхности Мо(110) при температуре порядка 800 К происходит формирование поверхностного сплава MoAl2 гексагональной симметрии, соответствующего относительной поверхностной концентрации атомов Al 2/3. На поверхности этого сплава, поддерживаемого при температуре 200 К, молекулы NO и СО адсорбируются молекулярно в отличие от диссоциативной адсорбции на поверхности как алюминия, так и молибдена в отдельности. Адсорбция молекул СО на поверхности сплава Al−Mo(110) с предадсорбированными молекулами СО существенно меняет состояние последних, смещая их в более высококоординированные мостиковые и/или дырочные адсорбционные центры, одновременно приводя к наклону молекулярной оси к плоскости поверхности адсорбента. Нагрев данной системы до температуры 320 К приводит к восстановлению оксида азота, нитрированию подложки, окислению СО и десорбции образовавшихся молекул СО2 в газовую фазу. Существенную трансформацию адсорбционных и реакционных свойств молекул СО и NO при сплавлении Al с Мо(110) можно приписать как реконструкции поверхности, так и изменению электронного строения сплава в целом. На поверхности системы Al−Mo−O эффективность процесса окисления СО оксидом азота заметно возрастает.
Список литературы
Du P., Eisenberg R. // Energy Environ. Sci. 2012. V. 5. P. 6012. http://dx.doi.org/https://doi.org/10.1039/C2EE03250C.
Rodriguez J.A. // Surf. Sci. Reports. 1996. V. 24. P. 223. https://doi.org/https://doi.org/10.1016/0167-5729(96)00004-0.
Whitten J.L., Yang H. // Surf. Sci. Reports. 1996. V. 24. P. 55. https://doi.org/https://doi.org/10.1016/0167-5729(96)80004-5.
Qi K.-Z., G.-C. Wang G.-C., Zheng W.-J. // Surf. Sci. 2013. V. 614. P. 53. https://doi.org/https://doi.org/10.1016/ j.susc.2013.04.001.
Hwu H.H., Chen J.G. // Surf. Sci. 2003. V. 536. P. 75. https://doi.org/https://doi.org/10.1016/S0039-6028(03)00607-1.
Rochana P., Wilcox J. // Surf. Sci. 2011. V. 605. P. 681. https://doi.org/https://doi.org/10.1016/j.susc.2011.01.003.
Choi J.-G, Cur R.L., Thompson L.T. // J. Catal. 1994. V. P. 218. https://doi.org/https://doi.org/10.1016/0021-9517(94)90025-6.
Awad M.K., Anderson A.B. // Surf. Sci. 1989. V. 218. P. 543. https://doi.org/https://doi.org/10.1016/0039-6028(89)90167-2.
Zhdanov V.P., B. Kasemo B. // Surf. Sci. Reports. 1997. V. 29. P. 31. https://doi.org/https://doi.org/10.1016/S0167-5729(97)00009-5.
Wang J., Castonguay M., Deng J., McBreen P.H. // Surf. Sci. 1997. V. 374. P. 197. https://doi.org/https://doi.org/10.1016/ S0039-6028(96)01228-9.
Brillo J., Sur R., Kuhlenbeck H., Freund H.-J. // Surf. Sci. 1998. V. 397. P. 137. https://doi.org/https://doi.org/10.1016/ S0039-6028(97)00725-5.
Tvauri I.V., Khubezhov S.A., Demeev Z.S. et al. // Vacuum. 2013. V. 88. P. 8. https://doi.org/https://doi.org/10.1016/j.vacuum.2012.08.004.
Baierle R.J., Schmidt T.M., Fazzio A. // Solid State Commun. 2007. V. 42. P. 49. https://doi.org/https://doi.org/10.1016/ 0038-1098(82)91027-4.
Kolaczkiewicz J., Hoch M., Zuber S. // Surf. Sci. 1991. V. 247. P. 284. https://doi.org/https://doi.org/10.1016/0039-6028(91)90139-J.
Jackson A.G., Hooker M.P. // Surf. Sci. 1971. V. 28. P. 373. https://doi.org/https://doi.org/10.1016/0039-6028(71)90050-1.
Muscat J.P., Newns D.M. // Solid State Commun. 1972. V. 11. P. 737. https://doi.org/https://doi.org/10.1016/0038-1098(72)90498-X.
Singh R.N., Brown D.M., Kim M.J., Smith G.A. // J. Appl. Phys. 1985. V. 58. P. 4598. https://doi.org/https://doi.org/10.1063/ 1.336227.
Brewer L., Lamoreaux R.H. Al-Mo (Aluminum-Molybdenum), in: Massalski T.B., Murray J.L., Bennett L.H., Baker H. (Eds.), Binary Alloy Phase Diagrams. V. 1, American Society of Metals, Ohio, 1987. P. 133. ISBN-13: 978-1-61503-046-0.
Ivkov J., Salamon K., Radic N., Soric M. // J. Alloys Comp. 2015. V. 646. P. 1109. https://doi.org/https://doi.org/10.1016/ j.jallcom.2015.06.022.
Campbell C.T., Goodman D.W. // J. Phys. Chem. 1988. V. 92. P. 2569. https://doi.org/10.1021/j100320a034.
Henry C.R. // Surf. Sci. Reports. 1988. V. 31. P. 231. https://doi.org/https://doi.org/10.1016/S0167-5729(98)00002-8.
Ren J., Wang J., Huo C.-F. et al. // Surf. Sci. 2007. V. 601. P. 1599. https://doi.org/https://doi.org/10.1016/j.susc.2007.01.036.
Matolin V., Stara I., Tsud N., Johanek V. // Progr. Surf. Sci. 2001. V. 67. P. 167. https://doi.org/https://doi.org/10.1016/ S0079-6816(01)00022-3.
Hammer B., Morikawa Y., Norskov J.K. // Phys. Rev. Lett. 1996. V. 76. P. 2141. https://doi.org/https://doi.org/10.1103/ PhysRevLett.76.2141.
Hoffmann F.M. // Surf. Sci. Reports. 1983. V. 3. P. 107. https://doi.org/https://doi.org/10.1016/0167-5729(83)90001-8.
Fukutani K., Magkoev T.T., Murata Y., Terakura K. // Surf. Sci. 1996. V. 363. P. 185. https://doi.org/https://doi.org/10.1016/ 0039-6028(96)00136-7.
Magkoev T.T. // Solid State Commun. 2004. V. 132. P. 93. https://doi.org/https://doi.org/10.1016/j.ssc.2004.07.023.
Beniya A., Isomura N., Hirata H., Watanabe Y. // Surf. Sci. 2013. V. 613. P. 28. https://doi.org/https://doi.org/10.1016/ j.susc.2013.03.001.
Hendershot R.E., Hansen R.S. // J. Catal. 1986. V. 98. P. 150. https://doi.org/https://doi.org/10.1016/0021-9517(86)90305-2.
Toyoshima R., Yoshida M., Monya Y. et al. // Surf. Sci. 2013. V. 615. P. 33. https://doi.org/https://doi.org/10.1016/ j.susc.2013.04.009.
Wichtendahl R., Rodriguez-Rodrigo M., Härtel U. et al. // Surf. Sci. 1999. V. 423. P. 90. https://doi.org/https://doi.org/10.1016/ S0039-6028(98)00915-7.
Saito M., Anderson R.B. // J. Catal. 1980. V. 63. P. 438. https://doi.org/https://doi.org/10.1016/0021-9517(80)90098-6.
Schaidle J.A., Thompson L.T. // J. Catal. 2015. V. 329. P. 325. https://doi.org/https://doi.org/10.1016/j.jcat.2015.05.020.
Chen P.J., Goodmann D.W. // Surf. Sci. 1994. V. 312. P. L767. https://doi.org/https://doi.org/10.1016/0039-6028(94)90719-6.
Radican K., Berdunov N., Shvets I.V. // Phys. Rev. B. 2008. V. 77. P. 085 417. https://doi.org/https://doi.org/10.1103/PhysRevB.77.085417.
Natishan P.M., McCafferty E., Hubler G.K. // Corrosion Sci. 1991. V. 32. P. 721. https://doi.org/https://doi.org/10.1016/0010-938X(91)90086-5.
Wang Y., Gao F., Tysoe W.T. // Surf. Sci. 2005. V. 590. P. 181. https://doi.org/https://doi.org/10.1016/j.susc.2005.06.019.
Дополнительные материалы отсутствуют.
Инструменты
Поверхность. Рентгеновские, синхротронные и нейтронные исследования


