Поверхность. Рентгеновские, синхротронные и нейтронные исследования, 2019, № 5, стр. 89-98
Состав, морфология и механизмы формирования кислородсодержащих фаз в поверхностных гетеросегрегационных процессах
Ю. Я. Томашпольский 1, *, В. М. Матюк 1, Н. В. Садовская 1, С. Г. Лакеев 1, Н. В. Козлова 1
1 Филиал акционерного общества “Ордена Трудового красного знамени
Научно-исследовательский физико-химический институт имени Л.Я. Карпова”
105064 Москва, Россия
* E-mail: tomashpols@yandex.ru
Поступила в редакцию 22.06.2018
После доработки 15.07.2018
Принята к публикации 15.07.2018
Аннотация
Методами рентгеноспектрального микроанализа, рентгенофазового анализа, инфракрасной спектроскопии, высокоразрешающей растровой электронной микроскопии, атомно-силовой микроскопии исследовалась поверхностная термостимулированная гетеросегрегация с участием кислорода в бескислородных и кислородсодержащих кристаллах. Установлено, что на поверхности хлорида натрия (NaCl) формируются хлорид натрия (NaClO2) и гидрокарбонат натрия (NaHCO3); на поверхности арсенида галлия (GaAs) – оксид галлия (Ga2O3); на поверхности титаната свинца (PbTiO3) – диоксид титана (TiO2) и оксид свинца (PbO); на поверхности титаната висмута (Bi4Ti3O12) – сложный оксид (Bi2Ti4O11) и оксид висмута (Bi2O3); на поверхности феррита висмута (BiFeO3) – сложные оксиды (Bi2Fe4O9, Bi26– xFexO39) и оксид висмута (Bi2O3); на поверхности германата свинца (Pb5Ge3O11) – сложный оксид (Pb3GeO5) и оксид свинца (PbO). Рассмотрены механизмы формирования поверхностных кислородсодержащих фаз, включающих диффузию собственных атомов матричных кристаллов к поверхности, миграцию сегрегированных атомов по поверхности, возгонку, адсорбцию молекул воды, оксидов углерода, углеводородов, кислорода и поверхностные реакции сегрегированных атомов с участием, как собственного решеточного кислорода, так и кислорода внешней среды.
ВВЕДЕНИЕ
Процессы гетеросегрегации на поверхности играют важную роль в новых технологиях получения функциональных материалов. Недавно [1] на монокристалле арсенида галлия как матрице путем термостимулированной поверхностной гетеросегрегации (ТПГС) в азотсодержащей газовой среде удалось сформировать слои нитрида галлия в виде нанокристаллитов, игл, нитей, лент и пластин. В процессе ТПГС формирование фаз на поверхности матрицы в результате поверхностных реакций сегрегантов сложным образом зависит от многих процессов: диффузии сегрегантов к поверхности, их миграции по поверхности, возгонки, адсорбции инородных атомов [2]. Для лучшего понимания данных процессов следует более детально рассмотреть типичные и широко распространенные реакции на поверхности различных классов матричных кристаллов с участием кислородсодержащих адсорбатов либо решеточного кислорода, приводящие к образованию кислородсодержащих соединений, в том числе оксидных фаз, с составом, отличным от матричного. В этих процессах крайне мало изучены вопросы эволюции состава и морфологии кислородсодержащих поверхностных образований в нано- и микрометровом масштабах, механизмов их формирования, роли адсорбции и решеточного кислорода в реакциях окисления в зависимости от условий термической активации.
В настоящей работе на примере монокристаллов щелочно-галлоидных соединений, соединений AIIIBV и соединений сложных оксидов изложены и обсуждены с использованием литературных данных результаты исследований состава и морфологии, синтезированных в процессе ТПГС поверхностных кислородсодержащих соединений, и рассмотрены возможные механизмы их образования.
МЕТОДИЧЕСКАЯ ЧАСТЬ
Матричные монокристаллы. В табл. 1 показаны использованные в работе объекты исследования и представлены их основные характеристики.
Таблица 1.
Характеристики монокристаллов
| № | Формула | Метод выращивания | Вид поверхности | Способ очистки поверхности | Ориентация |
|---|---|---|---|---|---|
| 1 | NaCl | Из насыщенного водного 36% раствора | Скол | Скалывание | {001} |
| 2 | GaAs | Метод Чохральского | Поперечный cкол {100}среза | Скалывание | {100} |
| 3 | PbTiO3 | Из раствора в расплаве | Естественная грань | Ультразвук + растворители | {100} |
| 4 | Bi4Ti3O12 | Из раствора в расплаве | Естественная грань | Ультразвук + растворители | {100} |
| 5 | BiFeO3 | Из раствора в расплаве | Естественная грань | Ультразвук + растворители | {100} |
| 6 | Pb5Ge3O11 | Из раствора в расплаве | Естественная грань | Ультразвук + растворители | (000.1) |
Препарирование поверхности матричных монокристаллов. Очищенные естественные грани или сколы монокристаллов отжигали в печи сопротивления Labotherm в воздушной атмосфере с программируемыми режимами отжига в интервале температур 150–1050°С в течение от 0.5 до 20 ч в зависимости от классов кристаллов, а также в вакууме ~10–3 Па при температуре от 300°С до 600°С в течение от 0.5 до 5 ч с использованием вакуумного поста ВУП-5 с последующим охлаждением и проведением измерений при комнатной температуре.
Методы характеризации поверхности матричных монокристаллов. Элементный состав поверхностных микрослоев измеряли методом рентгеноспектрального микроанализа (РСМА) с помощью рентгеноспектральной приставки INCA в растровом электронном микроскопе высокого разрешения JSM 7500F фирмы JEOL с модернизированной программой расчета поправок ZAF при энергии зонда 20 кэВ. Такая энергия обусловливает для исследованных соединений проникновение зонда на глубину от десятых долей до нескольких мкм, что обозначает аналитическую зону по толщине. Для уменьшения погрешности в количественном микроанализе спектра CoKα использовали повышение точности измерений путем контроля тока зонда и энергетического смещения спектра. Практически, дрейф тока не превышал 1% за 4–6 ч работы. Концентрации элементов измеряли в ат. %. Относительная погрешность определения концентрации в методе РСМА лежит около 1 отн. %, абсолютная погрешность значения концентрации практически составляет 1–2 знака после запятой. Такой погрешности соответствуют данные по концентрациям, выдаваемые программой. Из этих значений рассчитывали состав, определяемый как отношение атомных концентраций составляющих элементов. Точность анализа отношения концентраций для морфологически гомогенной поверхности составляла ±(0.01–0.1). Для морфологически гетерогенной поверхности производили локальные измерения с вышеназванной точностью, если размеры выделений заметно превышали диаметр электронного зонда, в случае размеров выделений частиц поверхностных фаз, сравнимых или меньших по сравнению с диаметром электронного зонда (несколько мкм), значения отношения носили оценочный характер, точность составляла ±(0.1–1). Тотальный состав определяли как усредненные значения измерений локального состава. Площадь локальных участков измерений на кристаллах составляла от 5 × 5 до 250 × 250 кв. мкм, количество измеренных участков после отжигов при заданной температуре составляло от 5 до 30. Фазовый состав поверхности отдельных кристаллов хлорида натрия был исследован методом ИК-спектроскопии зеркального отражения на приборе Perkin-Elmer-580. Рентгенофазовый анализ поверхности (РФА) осуществляли на дифрактометре URD-63 с шаговой разверткой 0.02°. Морфологию поверхности кристаллов изучали в растровом электронном микроскопе JSM 7500 F фирмы JEOL вплоть до максимальных увеличений ×650 000 с разрешением до 1 нм (метод ВРЭМ), используя катод с холодной полевой эмиссией и режим Gentle Beam. Энергия зонда в обычном режиме составляла до 20 кэВ, в режиме Gentle Beam до 2 кэВ. Исследования наноморфологии проводили также в атомно-силовом микроскопе SOLVER-47 (метод АСМ) в топографическом и фазовом режимах с площадью участков измерения от 1.4 до 100 кв. мкм. Дополнительно наноморфологию поверхности исследовали с использованием сканирующей зондовой нанолаборатории ИНТЕГРА-Терма (ЗАО “НТ-МДТ”) в полуконтактном режиме. Предельное разрешение в методе АСМ по осям X–Y составляло до 0.1 нм, по оси Z до 0.01 нм.
ЭКСПЕРИМЕНТАЛЬНЫЕ РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Гетеросегрегация на поверхности монокристаллов бескислородных соединений. Хлорид натрия. Методом ИК-спектроскопии нами обнаружено наличие молекул воды H2O (линии 3300, 1550, 1600 см–1) на поверхности скола исходного монокристалла хлорида натрия, не подвергаемого отжигу. Методом РСМА на поверхности скола (при толщине анализируемого слоя до 4 мкм) установлено соотношение натрия к хлору, близкое к единице (1 × 0.3), и наличие углерода и кислорода. Методом высокоразрешающей растровой электронной микроскопии (ВРЭМ) на исходном кристалле визуализированы округлые частицы размером в несколько десятков нм, концентрация частиц составила 3 × 109 см–2 (рис. 1а).
Рис. 1.
Поверхность сколов монокристалла хлорида натрия: а – при Ткомн (линейный масштаб 100 нм); б – после отжига на воздухе при Т = 750°С в течение 3 ч (линейный масштаб 1 мкм); в – после отжига в вакууме 10–3 Па при Т = = 450°С в течение 5 ч (линейный масштаб 100 нм). Метод ВРЭМ.
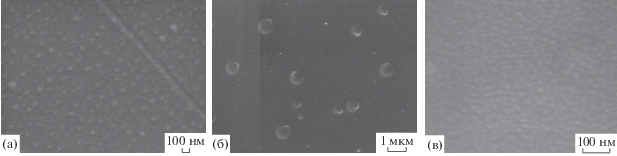
Интерпретация этих результатов основана на том, что поверхность хлорида натрия гигроскопична, после образования скола на воздухе, начиная с комнатных температур, происходит сорбция молекул воды активными центрами, в которых при определенной концентрации молекул воды формируются скопления, а затем нанокапли воды. Участки матрицы, на которых расположены нанокапли, растворяются в нанокаплях воды с образованием насыщенного раствора хлорида натрия. После естественного, либо принудительного (в электронном микроскопе) испарения воды высохшие образования сохраняют округлую форму. Одновременно на поверхности скола имеет место адсорбция углеродсодержащих молекул (CO, CO2, CH–CH–…), присутствие которых выявляется методом ВРЭМ по наличию прямоугольных участков растра с измененным контрастом, вследствие полимеризации этих молекул под электронным зондом. Основная реакция на поверхности хлорида натрия при адсорбции воды:
Образуется раствор гидратированных ионов, которые слабо взаимодействуют между собой и препятствуют формированию в растворе кристаллического соединения NaCl. Однако при выпаривании воды в условиях вакуума (в том числе в электронном микроскопе) реакция смещается влево с образованием соединения NaCl.
После отжига свежего скола при температуре 750°С в течение 3 ч методом ИК-спектроскопии на поверхности хлорида натрия, как и в случае исходного кристалла, обнаружены молекулы H2O (линия 1600 см–1). Кроме этого на поверхности установлено наличие кислород-содержащего соединения NaClO2 (линия 840 см–1). Методом РСМА выявлена нестехиометрия основных компонентов (отношение натрия к хлору 0.95), и определено наличие углерода и кислорода. В табл. 2 приведен состав поверхности (при толщине анализируемого слоя до 4 мкм) по натрию, хлору и кислороду в зависимости от условий отжига.
Таблица 2.
Содержание кислорода и состав поверхности (слои толщиной до 4 мкм) монокристалла хлорида натрия в функции температуры, длительности и атмосферы отжига. Метод РСМА
| Температура, °С и длительность отжига, ч | Атмосфера | Содержание кислорода, ат. % | Отношение Na, ат. %/Cl, ат. % |
|---|---|---|---|
| Исходный (без отжига) | 4.5 ± 0.5 | 1.035 ± 0.008 | |
| 150 × 3 | Воздух | 4.3 ± 0.8 | 1.12 ± 0.08 |
| 250 × 3 | Воздух | 6.5 ± 0.5 | 1.099 ± 0.002 |
| 350 × 3 | Воздух | 6.5 ± 0.5 | 1.132 ± 0.007 |
| 450 × 3 | Воздух | 4.6 ± 0.3 | 1.05 ± 0.01 |
| 450 × 5 | Вакуум 10–3 Па | 8.6 ± 0.3 | 0.89 ± 0.02 |
| 550 × 3 | Воздух | 8.4 ± 0.7 | 1.07 ± 0.01 |
| 750 × 3 | Воздух | 7 ± 2 | 0.95 ± 0.06 |
| 750 × 10 | Воздух | 8.9 ± 0.9 | 087 ± 0.01 |
| 750 × 20 | Воздух | 8.0 ± 0.9 | 1.05 ± 0.01 |
Методом ВРЭМ обнаружены две группы округлых частиц (рис. 1б) в микрометровом и нанометровом диапазонах. Первая группа имела выраженную сферическую форму с размером частиц до микрометра и их концентрацию 1 × × 107 см–2, при этом на поверхности частиц визуализированы также сферические частицы меньшего размера. Вторая группа частиц отличалась малыми размерами частиц (десятки нм) и их большей концентрацией: 5 × 107 см–2.
После отжига свежего скола в вакууме 10–3 Па при 450°С в течение 5 ч методом ИК-спектроскопии на поверхности кристалла обнаружены кислородсодержащие соединения NaHCO3 (линия 1400 см–1) и ClO2 (линия 1080 см–1). Методом РСМА установлены повышение степени нестехиометрии (отношение натрия к хлору 0.89) и наличие углерода и кислорода. Методом ВРЭМ на поверхности скола визуализированы ограненные нанокристаллиты размером 10–30 нм и концентрацией частиц 1.5 × 1011 см–2 (рис. 1в). В целом для различных режимов отжига содержание углерода на поверхности варьирует между 34 и 54 ат. %, а содержание кислорода с повышением температуры отжига и при вакуумном отжиге возрастает.
Объяснение этих результатов сводится к следующему. В условиях высоких температур отжига, наряду с имеющимися “старыми” активными центрами, образуются “новые” активные центры (в том числе вследствие нестехиометрии по основным компонентам), характеризуемые усилением взаимодействия с молекулами воды, в результате на “новых” центрах сорбции увеличивается размер каплеобразных частиц до микрометрового масштаба. После растворения в микрокапле воды локального участка поверхности хлорида натрия под этой микрокаплей и испарения воды форма частиц остается сферической, при этом отдельные частицы обнаруживают слабо выраженную огранку. Свежая поверхность частиц способствует усилению сорбции воды и появлению вторичных микрокапель на поверхности сферических частиц, при этом отсутствие коалесценции при вторичной сорбции молекул воды является дополнительным доказательством твердофазности этих частиц. Параллельно идет процесс сорбции воды на “старых” активных центрах, в этом случае размер частиц остается на прежнем нанометровом уровне: порядка десятков нм. Таким образом, в результате сорбции воды на поверхности монокристалла хлорида натрия после отжигов возникают частицы хлорида натрия нанометрового и микрометрового масштаба, которые фиксируют различные типы активных центров. Изменение морфологии поверхностных частиц от сферической к ограненной форме в условиях вакуумного отжига связано с рекристаллизацией структуры сферических частиц хлорида натрия на поверхности монокристалла и образованием нанокристаллитов хлорида натрия.
Обнаруженные методом ИК-спектроскопия поверхностные соединения являются продуктом химических взаимодействий адсорбатов, в частности, воды с поверхностью хлорида натрия. Помимо вышерассмотренной основной реакции на поверхности хлорида натрия, возможны реакции c участием адсорбатов углекислого газа и кислорода:
(a)
$\begin{gathered} {\text{Na(}}{{{\text{H}}}_{2}}{\text{O)}} \to {\text{Na(OH)}} + {\text{C}}{{{\text{l}}}_{2}} \to \\ \to {\text{NaCl}}{{{\text{O}}}_{2}} + {\text{NaCl}} + {{{\text{H}}}_{2}}{\text{O}}, \\ \end{gathered} $(б)
${\text{Na(}}{{{\text{H}}}_{2}}{\text{O)}} \to {\text{Na(OH)}} + {\text{C}}{{{\text{O}}}_{2}} \to {\text{NaHC}}{{{\text{O}}}_{3}},$Реализация этих реакций зависит от условий термоактивации и состояния поверхности. После отжига при температуре 750°С в течение 3 ч и выдержки в атмосфере вероятна реакция (а), после отжига в вакууме при 450°С К в течение 5 ч возможны реакции (б), (в). Возрастание концентрации кислорода с ростом температуры отжига и использованием вакуумного отжига связано, в том числе, с образованием кислородсодержащих соединений NaClO2, NaHCO3.
Арсенид галлия. Ранее нами было установлено [3], что в результате термостимулированной автосегрегации в поверхностном слое арсенида галлия активируются процессы диссоциации арсенида галлия, как химического соединения, диффузия мышьяка к поверхности и его возгонка, что в итоге приводит к поверхностному избытку галлия. При достижении критического значения избытка галлия в решетке арсенида галлия на поверхности возникают капли фазы галлия порядка 10 нм, которые по мере роста температуры отжига увеличиваются в размере до нескольких микрометров, и при температуре отжига 900°С происходит коалесценция микрокапель до сплошного жидкого слоя.
В данной работе сделан упор на более детальное изучение гетеросегрегационных процессов при наличии воздушной атмосферы, которые протекают с участием реакций окисления. В табл. 3 показана зависимость относительной концентрации кислорода на поверхности арсенида галлия и состава поверхности (при толщине анализируемого слоя ~0.7 мкм) от температуры отжига на воздухе. Концентрация кислорода определяется количеством оксидов основных компонентов, как оксида галлия, так и кислородсодержащими адсорбатами. В соответствии с данными РСМА, показывающими высокую степень автосегрегации галлия и его выделение на поверхности арсенида галлия после отжига выше 500°С, где фаза оксида галлия представленa в виде отдельных частиц (светлый контраст), и сосуществует с фазой галлия (более мелкие частицы темного контраста) (рис. 2а). Концентрация кислорода в этих условиях возрастает в 3–4 раза в сравнении с Ткомн, что свидетельствует об активации процесса окисления галлия. При температуре выше 750°С процесс окисления тормозится вследствие формирования сплошного слоя оксида галлия (рис. 2б). Обращает на себя внимание интервал температур отжига 250–450°С, в котором наблюдается увеличение содержания кислорода примерно в два раза по сравнению с Ткомн. Это указывает на то, что возгонка мышьяка, начинающаяся в этом температурном интервале, стимулирует начальную стадию окисления – хемосорбцию кислорода, который реагирует с галлием, образуя поверхностную оксидную фазу. При этом остается часть кислорода, не связанного с оксидом (адсорбаты оксидов углерода, кислорода и др.). Отжиг при 1050°С реконструирует поверхность арсенида галлия. Так как Тплавл оксида галлия составляет 1740°С, вместо жидкой фазы галлия на поверхности формируется рекристаллизованный слой оксида галлия толщиной более 1 мкм с цепочечной структурой из ограненных кристаллитов с размером 100–500 нм (рис. 2в). Эти размеры указывают на значительную толщину оксидного слоя и, как в предыдущем случае, на наличие кислородсодержащих адсорбатов.
Таким образом, на поверхности арсенида галлия в процессе термостимулированной гетеросегрегации на воздухе формируется пленка оксида галлия в виде сплошного слоя с пластинчатой либо цепочечной структурой.
Таблица 3.
Содержание кислорода на поверхности и состав поверхности (слои толщиной ~0.7 мкм) арсенида галлия после отжигов на воздухе в зависимости от температуры и длительности отжига. Данные РСМА
| Температура, °С и длительность отжига, ч | Содержание кислорода, ат. % | Отношение Ga, ат. %/As, ат. % |
|---|---|---|
| Исходная | 14 ± 3 | 1.01 ± 0.01 |
| 150 × 3 | 14 ± 3 | 0.97 ± 0.01 |
| 250 × 3 | 25 ± 2 | 1.04 ± 0.01 |
| 350 × 3 | 27 ± 1 | 1.35 ± 0.02 |
| 450 × 3 | 27 ± 1 | 1.22 ± 0.02 |
| 500 × 3 | 38.7 ± 0.6 | 1.10 ± 0.03 |
| 600 × 3 | 49.6 ± 0.8 | 1.54 ± 0.06 |
| 750 × 3 | 66.6 ± 0.4 | 2.47 ± 0.04 |
| 900 × 3 | 68 ± 1 | 2.4 ± 0.1 |
| 1050 × 3 | 72 ± 2 | 159 ± 1 |
Рис. 2.
Поверхность сколов монокристалла арсенида галлия: а – после отжига на воздухе при Т = 600°С в течение 3 ч (линейный масштаб 100 нм); б – после отжига на воздухе при Т = 750°С в течение 3 ч (линейный масштаб 1 мкм); в – после отжига на воздухе при Т = 1050°С в течение 1 ч (линейный масштаб 100 нм). Метод ВРЭМ.

Гетеросегрегация на поверхности монокристаллов кислород-содержащих соединений: сложные оксиды. Титанат свинца, титанат висмута, феррит висмута, германат свинца. В табл. 4 представлены полученные нами результаты исследований в совокупности с литературными данными по составу поверхностных фаз и условиям их образования при ТПГС в ряде сложных оксидов. Выбор данных соединений обусловлен их высокой склонностью к поверхностной сегрегации и образованию поверхностных фаз [4].
Таблица 4.
Поверхностные оксидные фазы в некоторых сложных оксидах (нано- и микрометровый масштабы), температуры их формирования и методы измерения (дополнительные обозначения: ДБЭ – дифракция быстрых электронов, ДМЭ – дифракция медленных электронов, ВЭЭ – вторично-электронная эмиссиометрия, РФА –рентгенофазовый анализ)
| Соединение | Поверхностная фаза | Интервал формирования поверхностных фаз, Т °С | Методы измерения | Дополнительная литература |
|---|---|---|---|---|
| PbTiO3 | TiO2 | 450–700 | ОЭС, РСМА, ДБЭ, ДМЭ, ВЭЭ | [5–7] |
| TiO2 + PbO | 800–900 | |||
| Bi4Ti3O12 | Bi2Ti4O11 | До 600 | ОЭС, РСМА, РФА | [8–10] |
| Bi2Ti4O11 + TiO2 + Bi2O3 | Выше 600 | |||
| BiFeO3 | Bi2Fe4O9 | До 450 | РСМА, РФА | |
| Bi26 – xFexO39 + Bi2O3 | Выше 450 | |||
| Pb5Ge3O11 | Pb3GeO5 | 300–600 | ОЭС, РСМА, РФА | [11, 12] |
| Pb3GeO5 + PbO | Выше 600 |
На поверхности монокристалла титаната свинца PbTiO3 в интервале 450–700°С в результате термостимулированной автосегрегации титана, как сегреганта и реакции с кислородом формируется фаза оксида титана в слоях нано- и микрометрового масштаба. Это заключение основано на исследованиях кристаллов титаната свинца методом in situ оже-электронной спектроскопии (ОЭС) [5], в которых в интервале 500–700°С в вакууме 10–8 Па на поверхности (в нанометровом слое) наблюдали только титан и кислород. Кроме того, метод дифракция медленных электронов (ДМЭ) в этом интервале температур выявил на поверхности титаната свинца кристаллическую решетку диоксида титана с ориентацией 〈100〉 [6]. Наконец, в керамике PbTiO3–PbZrO3 при обогащении поверхности титаном после нагрева при Т = 600°С методом дифракции быстрых электронов (ДБЭ) на отражение была обнаружена ориентированная фаза со структурой диоксида титана [7]. Выше Т = 800°С, по данным ОЭС, сегрегантом становится свинец, который накапливается на поверхности, реагирует с кислородом и ускоряет процесс возгонки оксида свинца [13].
На поверхности монокристалла Bi4Ti3O12 после автосегрегации при температурах отжига до 600°С методами ОЭС, РФА, РСМА в слоях нано- и микрометрового диапазона обнаружена локальная фаза Bi2Ti4O11. Эта фаза является следствием сегрегации титана, накапливающегося на поверхности, и его реакции с кислородом. При более высоких температурах отжига дополнительным сегрегантом становится висмут, что приводит к диспропорционированию матричной фазы Bi4Ti3O12 и формированию локальных поверхностных фаз Bi2O3 и TiO2 [8–10].
Нами обнаружено, что на поверхности монокристаллов BiFeO3 в результате термостимулированной автосегрегации в микрометровом слое образуется фаза Bi2Fe4O9 (метод РСМА). При дальнейшем нагреве монокристалла BiFeO3 происходит смена сегреганта: железа на висмут, в результате чего на поверхности, наряду с фазой Bi2Fe4O9, возникает фаза типа силленита Bi26– xFexO39 с повышенным содержанием висмута, выделение которой начинается при нагреве в 300°С в вакууме и 450°С в атмосфере, и происходит вплоть до 600°С. Фазой с наибольшим содержанием висмута является оксид Bi2O3, который образуется на поверхности BiFeO3 при 450°С в условиях атмосферного давления. В этих процессах также подразумеваются реакции окисления железа и висмута.
Фазовый состав на поверхности монокристалла германата свинца Pb5Ge3O11 в слоях микро- и нанометрового диапазона после термостимулированной поверхностной автосегрегации был исследован методами РФА и РСМА, а также методом ОЭС [2]. В начальной стадии сегрегации в узком интервале температур 30–100°С сегрегантом является германий, поверхностная концентрация которого растет, при повышении температуры происходит смена сегреганта: германия на свинец, который накапливается на поверхности и реагирует с кислородом. Результатом является фаза Pb3GeO5, содержащая больше свинца по сравнению с матричным кристаллом, эта фаза появляется при 300°С и присутствует на поверхности вплоть до 600°С. При этом с ростом длительности отжига при 300°С и при увеличении температуры отжига до 450°С дополнительно выявляются следы оксида свинца (РФА). Эти данные коррелируют с более ранними результатами, полученными методами ОЭС, РСМА [11, 12]. Было показано, что в глубоком вакууме 10–8 Па поверхностные нанослои монокристаллического германата свинца Pb5Ge3O11 состоят полностью из оксида свинца [11] а поверхностные микрослои эпитаксиальных пленок германата свинца Pb5Ge3O11, полученных аэрозольным распылением металлорганических соединений, при термообработке обогащаются свинцом [12].
Морфология поверхности рассматриваемых оксидных монокристаллов изучена нами методами ВРЭМ, АСМ. Детальные исследования методом АСМ-процесса фазообразования диоксида титана на поверхности монокристаллов титаната свинца показали [5–7], что до температуры 600°С структура нанометрового слоя диоксида титана проявляется сначала в виде неориентированных, а затем слабоориентированных изотропных частиц размером от 10 до 50 нм в матрице титаната свинца, при этом наблюдали отдельные изотропные агломераты размером в несколько сотен нанометров, содержащие более мелкие частицы. Начиная с температуры 600°С, характер расположения частиц радикально менялся. Отдельные частицы и агломераты, независимо от размеров, располагались рядами вдоль определенного направления, при этом большие и малые агломераты имели анизотропную форму. Субструктура анизотропных агломератов состояла из изотропных наночастиц размером от 10 до 50 нм. Форма крупных ориентированных агломератов с максимальным размером до 300 нм представляла собой трехмерный плоский параллелепипед с высотой в несколько десятков нанометров.
На поверхности Bi4Ti3O12 после отжига при 400°С наблюдали в микрометровом диапазоне методом ВРЭМ локальные участки в виде округлых образований и ориентированных полос шириной порядка микрометровых долей и длиной в единицы-десятки микрометров, в которых, по данным [10], наблюдался избыток титана. Так как давление паров оксида висмута в этой области температур еще не существенно [9], можно утверждать, что поверхностная сегрегация обусловлена диффузией титана к поверхности преимущественно в места с повышенной концентрацией ростовых, в том числе ориентированных протяженных дефектов без образования поверхностных фаз. После отжига при 600°С в течение 5 ч на поверхности матричного кристалла формируются как частично ориентированные, так и беспорядочно расположенные микрокристаллы фазы с составом, близким к Bi2Ti4O11. Микрокристаллы имеют выраженные грани и образовывают конфигурацию цепочечного типа, размеры микрокристаллов составляют сотни нм в поперечнике и несколько мкм в длину. При увеличении длительности отжига до 10 ч ориентация нанокристаллитов новой поверхностной фазы усиливалась с сохранением цепочечной конфигурации. После отжига при 800°С морфология поверхности, состав и тип сегреганта вновь менялись: поверхность приобретала складчатый рельеф, на фоне которого возникали сферолитоподобные структуры диаметром 5–10 мкм и ограненные частицы. В свою очередь, тонкая структура сферолитов представляла собой пластинчатые образования толщиной ~100 нм, приблизительно перпендикулярные поверхности сферолитов. Складчатая морфология поверхности и каплеподобный вид частиц указывает на процессы поверхностного плавления, происходящие при более низких, чем в объеме, температурах отжига. Метод РСМА показал, что участки, включавшие сферолиты, обнаруживали значительное повышение концентрации висмута. Исходя из совокупности данных с большой вероятностью, следует считать, что сферолиты являются фазой оксида висмута Bi2O3, а отдельные ограненные частицы представляют собой фазы Bi2Ti4O11 либо TiO2. Таким образом, происходит диспропорционирование поверхности матрицы Bi4Ti3O12, подобно поверхностным процессам в Bi12TiO20 [9].
На поверхности монокристалла BiFeO3, исследованного методом ВРЭМ в нанометровом диапазоне, фаза Bi2Fe2O9 выглядит как сетка кристаллитов удлиненной формы с размером в поперечнике около 50 нм и длиной в несколько сотен нанометров. Морфологию фазы типа силленита Bi26 –xFexO39 можно описать как совокупность неориентированных ограненных нанокристаллитов размером в десятки-сотни нанометров, при этом огранка кристаллитов улучшается с ростом температуры отжига. Степень заполнения поверхности данной фазой значительно увеличивается при отжиге в вакууме. С увеличением длительности отжига на отдельных участках происходит ориентация кристаллитов. Фазой с наибольшим содержанием висмута является оксид висмута Bi2O3, который начинает формироваться при 450°С в условиях атмосферного давления в виде частиц сферолитоподобной формы размером в десятки-сотни нанометров. После высокотемпературного отжига в вакууме, морфология этой фазы эволюционирует от отдельных частиц до пористых сферолитоподобных образований размером порядка 300 нм, а затем сплошного пористого слоя.
Исследованиями морфологии поверхности методами ВРЭМ, АСМ и РФА в нано- и микрометровом диапазонах установлено, что при определенной температуре на поверхности монокристалла Pb5Ge3O11 возникают локальные ориентированные ансамбли наночастиц фазы Pb3GeO5 размером 10–50 нм. Более детальные исследования поверхности этих кристаллов методом ВРЭМ выявили характерные для грани (001) ориентированные микрообласти с поперечным размером порядка нескольких микрометров и длиной в несколько десятков микрометров, часть которых расположены друг к другу под углом 120°, что, по-видимому, отражает гексагональную сингонию решетки германата свинца. Эти области выглядят как нарушения сплошности поверхностного слоя матричного кристалла, их природа предположительно связана с протяженными ростовыми дефектами. Установлено, что эти области заполнены частично ориентированными кристаллитами размером до 50–100 нм, которые относятся к фазе Pb3GeO5. Оценка размеров кристаллитов и их ориентация, проведенная методом АСМ, дает значение 10–50 нм, а сами кристаллиты ориентированы вдоль границ области протяженного дефекта. Наряду с этим выявлены области нарушения сплошности изометрической формы, в которых ориентированно растут анизотропные кристаллиты длиной в несколько сотен и шириной 30–50 нанометров.
Иллюстрация вышерассмотренных данных по морфологии поверхностных оксидных фаз в сложных оксидах представлена на рис. 3. Закономерностью является то, что поверхностные фазы с относительно низким парциальным давлением паров (TiO2, Pb3GeO5, Bi2Ti4O11, Bi2Fe4O9) морфологически представляют собой частично ориентированные нанокристаллиты, расположенные вдоль протяженных дефектов (рис. 3а, 3г), а фазы с высоким парциальным давлением паров (Bi2O3, PbO) имеют вид округлых, в том числе сферолитоподобных образований (рис. 3б, 3в).
Рис. 3.
Поверхность матричных оксидных кристаллов после образования новых фаз в результате ТПГС: а – фаза TiO2 на PbTiO3 после отжига на воздухе при Т = 650°С в течение 15 ч (линейный масштаб 1 мкм); б – фаза Bi2O3 на Bi4Ti3O12 после отжига на воздухе при 800°С × 5 ч (линейный масштаб 1 мкм); в – фазы Bi2O3 и Bi26– xFexO39 на BiFeO3 после отжига при Т = 450°С в течение 3 ч (линейный масштаб 100 нм); г – фаза Pb3GeO5 на Pb5Ge3O11 после отжига при Т = = 300°С в течение 2 ч в вакууме 10–3 Па (линейный масштаб 100 нм). Метод ВРЭМ.
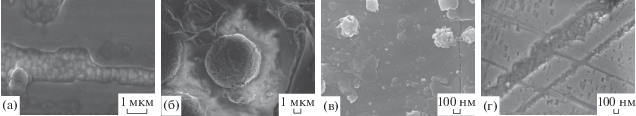
Механизмы формирования поверхностных кислородсодержащих фаз относятся к гетерогенным, многостадийным процессам и являются достаточно сложными. Они включают селективную диффузию собственных компонентов к поверхности, их миграцию по поверхности и селективную возгонку, а также адсорбцию молекул воды, оксидов углерода, углеводородов, кислорода и, конечно, поверхностные реакции сегрегированных атомов с участием как собственного решеточного кислорода, так и кислорода внешней среды. Полученные экспериментальные данные позволяют качественно рассмотреть возможный механизм образования кислородсодержащих фаз, осуществляемый за счет массопереноса собственного компонента на поверхность в зону роста изнутри матричного кристалла. Диффузия на поверхность происходит по междоузлиям решетки [2], также возможна диффузия вдоль протяженных дефектов [14]. Массоперенос собственного компонента подложки на поверхность облегчен вследствие разрыхления структуры поверхности и уменьшения энергии связи атома-сегреганта и его концентрации вблизи поверхности. Выход атомов сегреганта на поверхность кристаллов осуществляется в локальных участках с повышенной концентрацией дефектов, где межатомные связи ослаблены. При невысоких температурах отжига начинают сегрегировать атомы (ионы) малого размера (титана, железа, германия), для которых энергия активации диффузии наименьшая. При повышении температуры аналогичный механизм действует в отношении диффузии к поверхности атомов (ионов) большего размера (свинца, висмута). Диффузия ионов большого радиуса происходит при разрыхлении структуры поверхности до квазижидкого состояния задолго до температуры плавления.
В результате избыток атомов сегреганта концентрируется на поверхности, атомы мигрируют по поверхности, соединяются с решеточным или с адсорбированным кислородом и образуют скопления вблизи поверхностных дефектов матричного кристалла. С увеличением концентрации атомов в скоплениях происходит переход к зародышам, имеющим решетку новой оксидной фазы, в ряде случаев ориентированную по отношению к решетке матрицы. Ориентация нанокристаллитов сегрегированной фазы осуществляется как под воздействием матричной решетки, так и за счет ориентации анизотропных микрообластей. Природа последних предположительно связана с протяженными дефектами, однако для уточнения требуются дальнейшие исследования. Рост трехмерных зародышей осуществляется по механизму Фольмера–Вебера, величина разрастания отдельных зародышей определяется степенью гомогенности поверхностной концентрации новой фазы, значительная дисперсия размеров обусловлена локальной негомогенностью концентрации поверхностных (в частности, протяженных) дефектов. Разброс в размерах частиц новой фазы может быть объяснен неоднородностью поверхности, при которой наибольшие скопления сегрегирующих атомов, а, следовательно, и зародышей, притягивающих соседние атомы, будут наблюдаться вблизи поверхностных дефектов. Эволюция сегрегации происходит по стадиям с образованием сначала фаз с более низким парциальным давлением паров (оксидов титана, оксидов свинца-германия, оксидов висмута-железа, оксидов свинца-германия) и заканчивается стадией образования поверхностных фаз с наибольшим парциальным давлением паров, в данном случае оксидов свинца или висмута. Процесс ускоряется как с ростом температуры отжига, так и глубины вакуума, при этом скорость накопления сегреганта превышает скорость его возгонки. В результате для соединений со значительным различием парциального давления паров компонентов можно предсказать, помимо типа сегреганта в данном температурном интервале, также и склонность к сегрегации данного соединения. Последнюю можно оценить, в частности, по корреляции температур начала сегрегации и плавления (ссылка [2], с. 135), откуда следует, что в ряду Pb5Ge3O11, BiFeO3, PbTiO3, Bi4Ti3O12 склонность к сегрегации убывает.
Химический механизм формирования поверхностной оксидной фазы с составом, отличным от матричного сложного оксида, при поверхностной гетеросегрегации определяется реакциями избытка сегреганта с газовой фазой через адсорбцию кислорода или с твердой фазой через решеточный кислород. Для поверхности сложных оксидов характерным является гетерофазный поверхностный состав с сосуществованием фаз с высоким и низким парциальным давлением паров. После невысоких для данного соединения температур отжига на поверхности будут формироваться фазы компонентов с низким парциальным давлением паров (оксиды титана, сложные оксиды титана-висмута, сложные оксиды железа-висмута, сложные оксиды германия-свинца). После высоких температур отжига на поверхности будут образовываться фазы более летучих компонентов (оксиды свинца, висмута) с высоким парциальным давлением паров.
ВЫВОДЫ
Механизмы формирования поверхностных кислородсодержащих фаз включают диффузию собственных атомов матричных кристаллов к поверхности, миграцию сегрегированных атомов по поверхности, возгонку, адсорбцию молекул воды, кислорода оксидов углерода, углеводородов и поверхностные реакции сегрегированных атомов с участием, как собственного решеточного кислорода, так и кислорода внешней среды.
Образование хлорита натрия и гидрокарбоната натрия является примером гетеросегрегации с участием жидкой фазы: нестехиометрия натрия и хлора на поверхности хлорида натрия, наличие углерод- и кислородсодержащих адсорбатов и адсорбция воды обусловливает термоактивированную реакцию синтеза хлорита и гидрокарбоната натрия.
Формирование оксида галлия, как и нитрида галлия на поверхности арсенида галлия, является примером гетеросегрегации с участием газовой фазы, когда сегрегированный галлий вступает в реакцию соответственно с кислородом воздушной атмосферы либо с газообразным азотом.
Синтез оксидов титана, свинца, висмута, железа с использованием решеточного кислорода поверхности матричных кристаллов титаната свинца, титаната висмута, феррита висмута, германата свинца иллюстрирует гетеросегрегацию с участием твердой фазы.
Список литературы
Томашпольский Ю.Я., Матюк В.М., Садовская Н.В. // Поверхность. Рентген., синхротр. и нейтрон. исслед. 2015. № 6. С. 60. https://doi.org/10.7868/S0207352815060219
Томашпольский Ю.Я. Поверхностная автосегрегация в химических соединениях. М.: Научный мир, 2013. 208 с.
Томашпольский Ю.Я., Садовская Н.В., Григорьева Г.А. // Поверхность. Рентген., синхротр. и нейтрон. исслед. 2013. № 9. С. 95. https://doi.org/10.7868/ S0207352813090175
Томашпольский Ю.Я. // Журн. общей химии. 2004. Т. 72. Вып. 4. С. 678.
Томашпольский Ю.Я., Колотыркин И.Я., Петрова О.В. // Поверхность. Физика, химия, механика. 1985. Вып. 8. С. 103.
Лубнин Е.Н. Дифракция медленных электронов и оже-электронная спектроскопия поверхности сложных титан-содержащих оксидов: Дисс. … кандидата физ.-мат.наук. М.: Физико-химический институт им. Л.Я. Карпова, 1983. 231 с.
Томашпольский Ю.Я., Садовская Н.В. / Поверхность. Рентген., синхротрон. и нейтрон. исслед. 2010. № 9. С. 79.
Каргин Ю.Ф., Бурков В.И., Марьин А.А. и др. Кристаллы Bi12MxO20 ± δ со структурой силленита. Синтез, строение, свойства. М.: Изд-во “Наука” РАН, 2004. 314 с.
Каргин Ю.Ф. Синтез, строение и свойства оксидных соединений висмута со структурой силленита. Диссертация доктора химических наук. М.: Российская Академия наук, Институт общей и неорганической химии им. Н.С.Курнакова, 1998. 305 с.
Tomashpolsky Yu.Ya., Kolotyrkin I.Ya., Lubnin E.N. // J. Microsc. Spectrosc. Electron. 1985. V. 10. P. 521.
Колотыркин И.Я., Петрова О.В., Томашпольский Ю.Я. // Неорганические материалы. 1985. Т. 21. № 11. С. 1968.
Щеглов П.А., Меньших С.А., Прутченко С.Г. и др. // Неорганические материалы. 2000. Т. 6. № 1. С. 77.
Окадзаки К. Технология керамических диэлектриков. М.: Энергия, 1976. 336 с.
Приседский В.В., Комаров В.П., Панько Г.Ф. и др. // Докл. АН СССР. 1979. Т. 247. № 3. С. 620.
Дополнительные материалы отсутствуют.
Инструменты
Поверхность. Рентгеновские, синхротронные и нейтронные исследования


