Поверхность. Рентгеновские, синхротронные и нейтронные исследования, 2020, № 6, стр. 77-81
Взаимодействие молекул воды с монослойной пленкой оксида алюминия – Al2 – xO3 – y
Т. Т. Магкоев a, b, *, Г. С. Григоркина a, В. Б. Заалишвили b, О. Г. Бурдзиева b, Е. Н. Козырев b, Г. Э. Туаев b, K. Fukutani c
a Северо-Осетинский государственный университет им. К.Л. Хетагурова
362025 Владикавказ, Россия
b Российская академия наук, Владикавказский научный центр, Геофизический институт
362002 Владикавказ, Россия
c The University of Tokyo
153-8505 Tokyo, Japan
* E-mail: t_magkoev@mail.ru
Поступила в редакцию 11.10.2019
После доработки 14.12.2019
Принята к публикации 17.12.2019
Аннотация
В условиях сверхвысокого вакуума методами ультрафиолетовой фотоэлектронной и термодесорбционной спектроскопии показано, что молекулы воды на поверхности монослойной пленки оксида алюминия, сформированной на Мо(110), и поддерживаемой при низкой температуре, диссоциируют, и при последующей термостимулированной рекомбинации десорбируются в виде молекул водорода, воды и кислорода. Появление нескольких каналов рекомбинации адсорбированных частиц обусловлено полным разложением молекул воды за счет метастабильного состояния монослойной оксидной пленки, обусловленной не до конца сформированными межионными связями Al(3 – x)+–O(2 – y)– и особенностями взаимодействия с ней частиц H, O, OH.
ВВЕДЕНИЕ
Вопросы адсорбции и превращения молекул воды на поверхности твердых тел привлекают большое внимание, в частности, с точки зрения катализа: вода является реагентом важнейших реакций, таких как, например, реакция водяного газа, процесс Фишера–Тропша и др. [1–5]. При этом, ключевым моментом является диссоциация молекулы Н2О при адсорбции и образование соответствующих интермедиатов. Кроме того, процессы взаимодействия воды с поверхностью адсорбентов имеют и самостоятельное значения с точки зрения активации/пассивации катализатора при протонировании/гидроксилировании или реализации процессов частичного или полного расщепления воды для получения водорода и кислорода. Реализация процессов последнего типа вызывает особые затруднения, связанные с тем, что, зачастую, несмотря даже на полное разложение воды на поверхности соответствующим образом подобранного катализатора, конечная рекомбинация продуктов расщепления (Н, О, ОН) происходит с образованием воды, подавляя каналы образования Н2 и О2 [3, 4]. Главной проблемой при этом является подбор активного в этом плане адсорбента. В связи с этим, целью работы являлось установить тип и особенности адсорбента, который был бы активен с точки зрения разложения молекул воды и образования Н2 и/или О2. При этом, как следует из существующего в этом направлении активного задела, наиболее перспективными являются металлооксидные системы с особыми свойствами поверхности, связанными с контролируемым введением тех или иных дефектов, чужеродных атомов, структурных неоднородностей, размерных эффектов и др. [2–5]. В качестве такового в настоящей работе использована монослойная пленка оксида алюминия, сформированная на поверхности Мо(110) в условиях сверхвысокого вакуума. Ее выбор обусловлен тем, что такая пленка обладает рядом электронных и структурных особенностей, которые не реализуются в случае массивного материала, и которые определяют ее активность для ряда превращений атомов и молекул [6, 7].
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Исследования проведены в модифицированной сверхвысоковакуумной системе анализа поверхности VGS Escalab MII при давлении остаточных газов на уровне (2–3) × 10–10 Торр методами ультрафиолетовой (НеI) и рентгеновской (AlKα1) фотоэлектронной спектроскопии (УФЭС, РФЭС), электронной оже-спектроскопии (ЭОС), термодесорбционной спектроскопии (ТДС), измерения работы выхода методом Андерсона. Для фотоэлектронных измерений использован полусферический анализатор с использованием УФ-источника He I с энергией фотонов 20.4 эВ для УФЭС измерений и монохроматизированного рентгеновского излучения AlKα1 с энергией фотонов 1486.6 эВ для РФЭС. Для ЭОС измерений применен этот же анализатор с использованием электронной пушки при энергии первичных электронов 3 кэВ. Термодесорбционные измерения проведены с использованием квадрупольного масс-спектрометра, электронно-оптическая ось которого ориентирована вдоль нормали к поверхности образца. Скорость роста температуры образца в процессе ТДС измерений составляла около 2 K/с. Пленка оксида алюминия на поверхности кристалла Мо(110) получалась in-situ термическим напылением сапфира высокой степени очистки (99.999%) с использованием ячейки Кнудсена. Скорость роста пленки, согласно степени ослабления интенсивности оже-сигнала, подложки Mo MNV и данным кварцевого микровзвешивания составляет около 0.03 ML/мин. За монослойное покрытие (Θ = 1 ML) принималась поверхностная концентрация условных частиц “Al2O3”, равная 1.40 × 1015 см–2. Стабильная газовая фаза при испарении оксида алюминия состоит из частиц Al2O и AlO, и формирование пленки на поверхности адсорбента происходит за счет их рекомбинации. Адсорбция воды на поверхность адсорбента осуществлялась посредством напуска водяного пара через высокоточный сверхвысоковакуумный клапан в камеру до давления 10–8 Торр. За единицу экспозиции водяного пара 1 Лэнгмюр (L) принималась величина равная произведению парциального давления H2O 10–6 Торр на одну секунду: 1 L = 10–6 Торр ⋅ 1 с. Для исключения суперпозиции возможных термодесорбционных сигналов водорода, связанных с водой, с одной стороны, и остаточным газом – с другой, использовалась вода с изотопом водорода – дейтерием, D2O (Sigma Aldrich).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
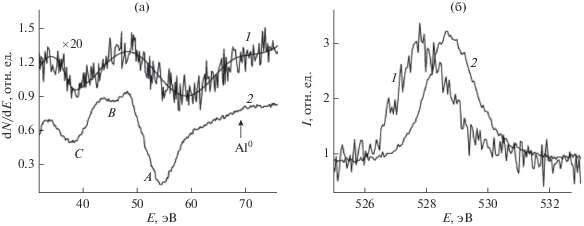
Достаточно хорошим тестом на предмет установления, происходит ли диссоциация частиц оксида алюминия при их осаждении на поверхность Мо(110) является вид регистрируемого оже-спектра, поскольку низкоэнергетические линия Al LVV, соответствующие металлическому алюминию, с одной стороны, и оксиду алюминия – с другой, существенно различаются. В данном случае при напылении оксида алюминия при всех исследованных покрытиях не зарегистрирована линия, соответствующая металлическому алюминию при энергии 68 эВ. Как видно из рис. 1a, при покрытии 0.05 ML и 2 ML в спектре наблюдается лишь межатомные переходы, соответствующие оксиду алюминия при энергии в области 55 эВ. Как показано ранее, в идентичных экспериментальных условиях пленка оксида алюминия растет в виде двумерного слоя и покрытии, близком к монослойному, полностью покрывает поверхность Мо(110) [6]. Вместе с тем, детальный анализ фото- и оже-электронных линий кислорода в субмонослойной области покрытий оксида алюминия свидетельствует о том, что электронное состояние ионов кислорода и алюминия отличается от такового, характерного для более толстых пленок или массивного оксида алюминия. Это видно, в частности, из рис. 1a, иллюстрирующего сдвиг энергии межатомного Al LVV оже-перехода в сторону больших значений кинетической энергии на 4 эВ для субмонослойной пленки (0.05 ML) по сравнению с более толстой пленкой (2 ML). Это указывает на то, что в частицах оксида алюминия, находящихся в непосредственном контакте с поверхностью Мо(110), происходит ослабление межионной Al–O-связи за счет уменьшения степени ее поляризации от алюминия к кислороду. Такое ослабление обусловлено формированием хемосорбционных связей с подложкой за счет частичной разгибридизации полярной межионной связи Al2O3. Другим фактором является то, что в случае монослойной пленки происходит нарушение трехмерной симметрии и координационного окружения ионов, характерного для массивного кристалла, что в свою очередь приводит к деформации углов связи и, соответственно, изменению электронной плотности в области анионов и катионов. На основе анализа тонкой структуры оже-спектров кислорода O KLL показано, что относительное уменьшение величины связывающего заряда в одиночных адсорбированных частицах оксида алюминия составляет порядка 30% и 15% для частиц в случае сплошной монослойной пленки, по сравнению с величиной заряда в толстой пленке (Θ > 2 ML) или массивном кристалле [6]. Качественно эта тенденция просматривается и из различия энергетического положения фотоэлектронных линий O 1s кислорода для тонкой (кривая 1) и толстой (кривая 2) пленки (рис. 1б). Таким образом, монослойную пленку оксида алюминия Al2 – xO3 – y можно рассматривать как метастабильное состояние, релаксирующее при ее дальнейшем росте и приобретающей свойства, близкие к свойствам массивного оксида при покрытии, превышающем 2 ML. Как таковая она представляет интерес в качестве адсорбента, потенциально обладающего новыми свойствами, обусловленными особым электронным состоянием анионов и катионов, а также нарушенной симметрией объемного кристалла оксида алюминия.
Рис. 1.
Межатомные оже-переходы Al (L)–O(VV) (a) и рентгеновские фотоэлектронные линии O 1s (б) пленок оксида алюминия на поверхности Мо(110) при покрытии 0.05 ML (спектры 1) и 2 ML (спектры 2).
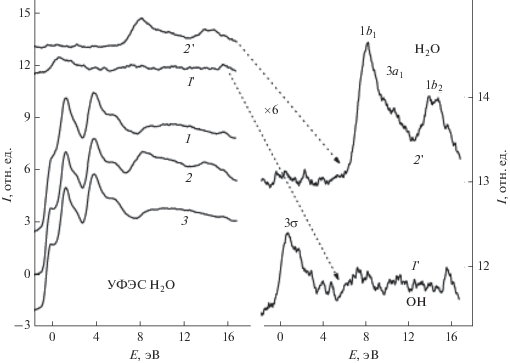
На рис. 2 приведены УФЭ спектры при адсорбции воды (экспозиция 3 L) на поверхности монослойной пленки оксида алюминия (кривая 1), пленке оксида алюминия при толщине, соответствующей покрытию 3 ML (кривая 2), поддерживаемых при температуре 95 К, а также спектр монослойной пленки оксида алюминия до адсорбции воды (кривая 3). Для более наглядного проявления особенностей, связанных с водой, приведены соответствующие спектры (кривые 1 ꞌ и 2 ꞌ) после вычитания спектров подложек, зарегистрированных до адсорбции воды. Видно, что состояние адсорбированных молекул на поверхности монослойной (Θ = 1 ML) и трехслойной (Θ = 3 ML) пленок кардинально различаются. В первом случае спектр можно рассматривать как состоящий из трех компонент при величине энергий связи 8.5, 9.8 и 14.5 эВ, в то время как во втором – в основном из одной особенности при 0.9 эВ. Наблюдаемые компоненты в спектре 2 ꞌ соответствуют молекулярным орбиталям воды D2O – 1b1, 3a1b 1b2, а линия в спектре 1 ꞌ – молекулярной орбитали 3σ гидроксильной группы ОD. Это является указанием на то, что на поверхности монослойной пленки оксида алюминия происходит диссоциация молекул воды, в то время как на поверхности более толстой пленки (Θ = 3 ML) имеет место преимущественно молекулярная, недиссоциативная адсорбция. Движущей силой процесса диссоциации следует считать стремление к релаксации метастабильной монослойной пленки, которая происходит вследствие протонирования и/или гидроксилирования поверхности. Не до конца сформированные межионные связи Al(3 – x)+–O(2 – y)– стремятся к релаксации (x,y → 0) за счет переноса заряда от D к иону кислорода и от OD к иону алюминия для компенсации недостатков зарядов x и y. Немаловажную роль играет и туннелирование электронов из металлической подложки сквозь сверхтонкую пленку оксида на незаполненные разрыхляющие орбитали молекулы D2O. Заметную роль в этом процессе должны играть и неизбежно присутствующие дефекты поверхности, в частности, дефекты двумерной структуры и анионные вакансии, например, F–-центры.
Рис. 2.
Ультрафиолетовые фотоэлектронные спектры при адсорбции воды (экспозиция 3 L) на поверхности монослойной пленки оксида алюминия (спектр 1), пленке оксида алюминия при Θ = 3 ML (спектр 2), поддерживаемых при температуре 95 К, спектр монослойной пленки оксида алюминия до адсорбции воды (спектр 3). Спектры 1 ꞌ и 2 ꞌ в правой части рисунка соответствуют спектрам 1, 2 в левой части после вычитания спектров соответствующих подложек, зарегистрированных до адсорбции воды.
Термодесорбционные спектры адсорбционной системы вода/монослойная пленка Al2 – xO3 – y приведены на рис. 3. Квадрупольный масс-спектрометр настроен на одновременную регистрацию в газовой фазе частиц с величинами m/z = 4 (D2); 20 (D2O); 32 (O2). Видно, что наиболее интенсивный сигнал соответствует молекулярному водороду при температуре десорбции порядка 164 К (кривая 1). Менее интенсивный десорбционный сигнал наблюдается для D2O при Т = 209 К (кривая 2). Наименьшим по интенсивности является сигнал, соответствующий молекулярному кислороду при Т = 271 К (кривая 3). Наличие нескольких типов десорбирующихся молекул свидетельствует о том, что имеет место несколько каналов рекомбинации адсорбированных частиц, преобладающим их которых является D + D → D2. Как установлено в литературе, атомы водорода, кислорода и группы ОН могут при определенных условиях иметь свои индивидуальные каналы поверхностной диффузии вдоль поверхности оксидных подложек [4]. Тот факт, что преобладающим десорбционным сигналам является D2, указывает на наибольшую активность поверхностной диффузии протонов вдоль поверхности пленки оксида алюминия. Это, наряду с рекомбинативной десорбцией D2, приводит, хотя и в меньшей степени, и к рекомбинации D и OD, и десорбции воды. Наличие молекулярного кислорода в десорбционном сигнале может быть обусловлено разложением гидроксильной группы OD на O и D с последующей рекомбинацией части атомов кислорода друг с другом. Как указано выше, группа OD с наибольшей вероятностью взаимодействует с недоокисленным ионом Al(3 – x)+. Это приводит к уменьшению расстояния между гидроксильной группой и подложкой вследствие притяжения связывающей электронной 3σ-орбитали OD к положительному иону алюминия. Данное обстоятельство, в свою очередь, повышает вероятность заполнения разрыхляющей 1π*-орбитали OD за счет обратного переноса делокализованного отрицательного заряда анионной вакансии оксидной пленки (F–-центра) и/или электрона металлической подложки в результате туннелирования сквозь тонкую пленку. В пользу такого переноса заряда свидетельствует зарегистрированное повышение работы выхода на 0.23 эВ при адсорбции воды (экспозиция – 3 L) на поверхности монослойной пленки оксида алюминия. Это приводит к диссоциации гидроксильной группы и последующей поверхностной диффузии продуктов диссоциации по различным каналам, приводящей к рекомбинации атомарного кислорода не только с D, но и друг с другом с образованием О2. Нередко образующийся при диссоциации воды на поверхности металлического или оксидного адсорбента атомарный кислород не десорбируется рекомбинативно, а окисляет/доокисляет подложку [3–5]. В данном случае такой процесс (доокисление метастабильной монослойной пленки оксида алюминия) не является предпочтительным вследствие отсутствия центров встраивания атомарного кислорода в двумерную решетку оксида. Для формирования полноценной объемной структуры кристалла оксида алюминия должны быть сформированы тетраэдрические или октаэдрические анионные решетки, что нереализуемо в случае двумерной монослойной пленки, связанной достаточно прочными хемосорбционными связями с металлической подложкой.
Рис. 3.
Термодесорбционные спектры водорода D2 (спектр 1), воды D2O (спектр 2) и кислорода О2 (спектр 3) системы, полученной при адсорбции воды D2O (экспозиция 3 L) на поверхности монослойной пленки оксида алюминия, поддерживаемой при температуре 95 К. Скорость роста температуры подложки в процессе регистрации ТДС спектров – 2 K/с.

ЗАКЛЮЧЕНИЕ
Особенностью монослойной пленки оксида алюминия на поверхности Мо(110) является то, что на ее поверхности происходит диссоциативная адсорбция молекул воды, сопровождаемая последующей термоактивированной рекомбинативной десорбцией водорода, воды и кислорода. Это связано с особенностями ее электронного строения, обусловленного промежуточным зарядовым состоянием хемосорбированных ионов кислорода O(2 – y)– и алюминия Al(3 – x)+ и пониженной размерностью, что меняет характер взаимодействия на поверхности сверхтонкой пленки оксида по сравнению с массивным материалом.
Список литературы
Ghosh T.K., Nair N.N. // Surf. Sci. 2015. V. 632. P. 20. https://doi.org/10.1016/j.susc.2014.09.009
Wu Z., Zou Z., Huang J., Gao F. // J. Catal. 2018. V. 358. P. 243. https://doi.org/10.1016/j.jcat.2017.12.020
A. Hodgson A., Haq S. // Surf. Sci. Reports. 2009. V. 64. P. 381. https://doi.org/10.1016/j.surfrep.2009.07.001
Henderson M.A. // Surf. Sci. Reports. 2002. V. 46. P. 1. https://doi.org/10.1016/S0167-5729(01)00020-6
Chen Y.-W., Chu I.-H., Wang Y., Hai-Ping Cheng H.-P. // Phys. Rev. B. 2011. V. 84. P. 155 444. https://doi.org/10.1103/PhysRevB.84.155444
Magkoev T.T., Christmann K., Moutinho A.M.C., Murata Y. // Surf. Sci. 2002. V. 515. P. 538. https://doi.org/10.1016/S0039-6028(02)01972-6
Valero C.M., Raybaud P., Sautet P. // Phys. Rev. B. 2007. V. 75. P. 045 427. https://doi.org/ B.75.045427https://doi.org/10.1103/PhysRev
Дополнительные материалы отсутствуют.
Инструменты
Поверхность. Рентгеновские, синхротронные и нейтронные исследования


