Поверхность. Рентгеновские, синхротронные и нейтронные исследования, 2021, № 11, стр. 34-44
Роль высоковалентных форм Fe(IV), Cu(III) и Bi(V) в процессах фазообразования сложных оксидов
Н. В. Барковский *
Институт физики твердого тела РАН
142432 Черноголовка, Россия
* E-mail: barkov@issp.ac.ru
Поступила в редакцию 21.01.2021
После доработки 25.03.2021
Принята к публикации 28.03.2021
Аннотация
С использованием методов рентгенофазового анализа, потенциометрии и химического анализа изучено влияние высоковалентных форм Fe(IV), Cu(III) и Bi(V) на процессы фазообразования в системах Sr–Fe–O, Ba–Cu–O, Y(Eu)–Ba–Cu–O, Ba–Bi–O и K–Ba–Bi–O. Показано, что в зависимости от условий отжига (температуры и парциального давления кислорода) синтезируются сложные оксиды, в которых содержание кислорода определяется “смешанно-валентным” состоянием железа, меди или висмута. Синтезы оксидов в рассматриваемых системах происходят однотипно – через образование при высокотемпературных отжигах обедненных кислородом фаз. В процессе медленного охлаждения или низкотемпературной обработки в кислородсодержащей атмосфере эти фазы насыщаются кислородом с окислением Fe(III) → Fe(IV), Cu(I) → Cu(II) → Cu(III) и Bi(III) → Bi(V) и образуют фазы с магнитными (Sr–Fe–O) и сверхпроводящими (Y(Eu)–Ba–Cu–O и K–Ba–Bi–O) свойствами. Методами химического анализа установлено, что окислительная способность Bi(V) по отношению к восстановителям выше, чем окислительные способности Fe(IV) и Cu(III), у которых они сопоставимы.
ВВЕДЕНИЕ
Оксиды металлов с переменной валентностью представляют собой многочисленный класс соединений с интересными физико-химическими свойствами, среди которых известны сегнетоэлектрики (BaTiO3, Bi4Ti3O12, LiNbO3), мультиферроики (BiFeO3), высокотемпературные сверхпроводники (YBa2Cu3O6 + δ, Ba1 –xKxBiO3), оксиды с колоссальным магнитосопротивлением (LaMnO3), топологические изоляторы, фотокатализаторы (BaBiO3) и прочие соединения. Оксиды металлов являются не только объектами научного исследования (в фундаментальной физике конденсированного состояния вещества, в химии твердого тела), но и перспективными материалами для практического применения. Современный уровень развития техники требует создания новых материалов с функциональными свойствами, необходимых для энергетики, космонавтики, электротехники, микроэлектроники, спинтроники, поэтому поиск, синтез и изучение свойств оксидов металлов с переменной валентностью актуальны на сегодняшний день.
Оксид SrFeO3 –х [1–4] привлекает внимание многих исследователей из-за высокой смешанной кислородной и электронной проводимости, что позволяет рассматривать его как потенциальный материал для создания различных электрохимических устройств (газовых сенсоров, электродов для кислородных датчиков, кислородных насосов, топливных элементов и других). Оксид SrFeO3 –х анионно-дефицитный и находится на сечениях фазовой диаграммы тройной системы SrO–Fe2O3–FeO2 (SrO–Fe2O3–O2 [5]), соответствующих различному парциальному давлению кислорода, т.е. разным соотношениям Fe(IV)/Fe(III) и различной средней степени окисления железа $\overline {{\text{Fe}}} $.
Исследование процессов фазообразования в системе Sr–Fe–O для центрального оксида состава Sr : Fe = 1 : 1 показывает, что кроме стехиометрического по содержанию кислорода оксида Sr FeO3 (пр. гр. Pm$\bar {3}$m) получены обедненные кислородом фазы SrFeO2.875 (Sr8Fe8O23) (пр. гр. I4/mmm, a = 10.929, c = 7.698 Å, V = 919.473 Å3) [3], SrFeO2.75 (Sr4Fe4O11) (пр. гр. Cmmm, a = 10.974, b = = 7.702, c = 5.473 Å, V = 462.588 Å3) [3] и SrFeO2.5 (Sr2Fe2O5), являющиеся членами гомологической серии SrFeO3 – 1/n при n = ∞, 8, 4, 2 соответственно [1].
Насыщение обедненной кислородом фазы SrFeO3 –х до SrFeO3 с кубической структурой перовскита происходит при высоком давлении кислорода (34 МПа, 550°С [6], 30 МПа, 400°С, 24 ч, медленное охлаждение до температуры 200°С [3]) или в процессе электролиза [7]. Содержание кислорода в SrFeO3 определено методами термогравиметрического анализа [3] и цериметрического [6] или дихроматометрического [7] титрования и соответствует формуле SrFeO2.998(5) [3], SrFeO3.0 [6], SrFeO3.00(2) [7]. Приведенные параметры кубической ячейки попадают в интервал a = 3.845–3.851(1) Å [7, 3].
Фаза с ромбической структурой браунмиллерита (минерал состава Ca2Fe2O5), представляющая собой оксид железа(III)-стронция SrFeO2.50, формируется в условиях низкого парциального давления кислорода – в атмосфере аргона (1000°С, 2 ч) [7] и в восстановительных условиях (смесь аргона с 5% H2, 500°С, 12 ч) [3].
Оксид SrFeO3 –х (3 – x = 2.43–2.5) образуется при пониженном давлении кислорода (P(O2) = = 1.4–286 Па) и Т = 700–1000°С [8]. Могут быть получены образцы с 14% Fe(II) от общего содержания железа.
Дальнейшее восстановление в присутствии CaH2 позволяет получить слоистый SrFe2+ O2 (пр. гр. P4/mmm, a = 3.991(1), c = 3.474(1) Å, V = = 55.334 Å3) с необычной квадратно-плоскостной кислородной координацией ионов Fe2 + [9]. Оксид SrFe2+ O2 обратимо окисляется до SrFeO2.5 и затем до SrFeO2.87 в мягких условиях (Т = 130°С, P(O2) = 0.1 MПa).
Как показывает анализ литературы, явления, наблюдаемые при получении оксидов Sr–Fe–O, характерны и для систем, содержащих другие элементы с переменной валентностью, в частности медь (Ba–Cu–O [10], Y–Ba–Cu–O [11], Eu–Ba–Cu–O [12]) и висмут (Ba–Bi–O [13], K–Ba–Bi–O [14]). Оксиды системы BaO–CuOx состава 60.0–66.7 моль. % BaO, являющиеся матрицами для сверхпроводящих оксидов Y–Ba–Cu–O и Eu–Ba–Cu–O, характеризуются значениями $\overline {{\text{Cu}}} $ = 2.10–2.17 [10]. В [15] синтезирована низкотемпературная ромбическая фаза Ba2CuO3.45 (пр. гр. Immm) с параметрами a = 4.0959, b = 3.9047, c = 12.9427 Å, V = 206.996 Å3, характеризующаяся средней степенью окисления меди $\overline {{\text{Cu}}} $ = 2.90. Полностью окисленным можно получить центральный оксид системы Ba–Cu–O. В условиях низкотемпературного отжига в кислороде (550°С) [16] или на воздухе (580°С) [17] синтезирован оксид BaCuO2.5 с сильно различающимися параметрами ячейки: a = 8.550, b = 10.560, c = 7.620 Å, V = = 687.994 Å3 и a = 8.564, b = 7.415, c = 20.827 Å, V = = 1336.456 Å3. Причины не выявлены. По всей вероятности, химический состав синтезированных в [16, 17] оксидов различен.
Обогащенные медью оксиды Ba–Cu–O [10], как и обогащенные висмутом фазы Ba–Bi–O [13], формируются без участия, соответственно, Cu(III) и Bi(V): так, тетрагональный оксид Ba Cu2O2 (пр. гр. P222, a = 5.722, c = 10.064 Å, V = = 329.508 Å3) [18] содержит только Cu(I), а оксиды ряда BamBim+nOy (m = 1–9; n = 0–3, 5, 7, 9) образуются только при участии Bi(III).
В системах Y(Eu)–Ba–Cu–O известны тетрагональные несверхпроводящие, обедненные кислородом оксиды YBa2Cu3O6.5 – δ (Y-123) [11] и EuBa2Cu3O6.5 – δ (Eu-123) [12]. По данным [19] при 700°С состав тетрагональной фазы EuBa2Cu3O6, что соответствует значению $\overline {{\text{Cu}}} $ = 1.67. При медленном охлаждении на воздухе или низкотемпературном отжиге в атмосфере кислорода тетрагональные оксиды Y(Eu)Ba2Cu3O6.5 – δ насыщаются кислородом и претерпевают фазовые превращения в ромбические сверхпроводящие фазы Y(Eu)Ba2Cu3O6.5 + δ. В [19] показано, что тетрагонализация EuBa2Cu3O6.5 + δ наступает, когда кислородный индекс y = 6.35, что соответствует $\overline {{\text{Cu}}} $ = 1.90. Эти значения существенно ниже y = 6.5 ($\overline {{\text{Cu}}} $ = = 2.00), при котором наступает тетрагонализация оксида YBa2Cu3O6.5 + δ [20]. Полностью окисленные фазы YBa2Cu3O8 и EuBa2Cu3O8, содержащие только Cu(III), в литературе не описаны.
В системе Ba–Bi–O установлено [13] существование гомологических рядов изоструктурных оксидов бария-висмута BamBim+nOy (m = 1–9; n = = 0–3, 5, 7, 9), Bam+nBimOy (m = 1–10; n = 0–5, 7–9, 11, 13, 17) с перовскитоподобной структурой и средней степенью окисления висмута $\overline {{\text{Bi}}} $ = 3.0–5.0.
При термическом разложении оксида BaBiO3, являющегося центральным в системе Ba–Bi–O, образуются обедненные кислородом фазы ряда ${\text{B}}{{{\text{a}}}_{{2n}}}{\text{Bi}}_{{n\, + \,1}}^{{3 + }}{\text{Bi}}_{{n\, - \,1}}^{{5 + }}{{{\text{O}}}_{{6n\,--\,1}}}$(n = 1, 2, …) [21]. В отличие от вакансионно-упорядоченных оксидов SrFeO3 – 1/n (n = ∞, 8, 4, 2) [3] члены ряда ${\text{B}}{{{\text{a}}}_{{2n}}}{\text{Bi}}_{{n\, + \,1}}^{{3 + }}{\text{Bi}}_{{n\, - \,1}}^{{5 + }}{{{\text{O}}}_{{6n\,--\,1}}}$ (n = 1, 2, …) катионно-упорядочены, изоструктурны и имеют близкие параметры тетрагональных перовскитоподобных ячеек, что затрудняет их идентификацию по дифракционным картинам. Однако идентификация обедненных кислородом фаз стала возможной благодаря наличию картин электронной дифракции для отдельных членов ряда ${\text{B}}{{{\text{a}}}_{{2n}}}{\text{Bi}}_{{n\, + \,1}}^{{3 + }}{\text{Bi}}_{{n\, - \,1}}^{{5 + }}{{{\text{O}}}_{{6n\,--\,1}}}$ [21]. В структуре оксидов ${\text{B}}{{{\text{a}}}_{{2n}}}{\text{Bi}}_{{n\, + \,1}}^{{3 + }}{\text{Bi}}_{{n\, - \,1}}^{{5 + }}{{{\text{O}}}_{{6n\,--\,1}}}$ упорядочены плоскости Bi–O, содержащие Bi(V) и Bi(III) и только Bi(III).
Оксиды гомологического ряда BamBim + nOy (m = 1–9; n = 0–3, 5, 7, 9) [13] являются матрицами, из которых строятся катионно-упорядоченные перовскитоподобные несверхпроводящие фазы ряда KBam– 1Bim+nOy (m = 4–7; n = 1–6) [22]. Эти фазы обогащены Bi(III) и характеризуются средней степенью окисления висмута $\overline {{\text{Bi}}} $ = 3.06–3.32. Они образуются в атмосфере аргона или на воздухе при Т = 800–970°С. В условиях низкотемпературного (450°С) отжига в атмосфере кислорода или в процессе электролиза формируются фазы ряда KxBamBim+nOy, производного от BamBim+nOy (m = 1–9; n = 0–3, 5, 7, 9) [13], обладающие сверхпроводящими свойствами (Тс = 35–4.2 К) [14]. Cверхпроводящие оксиды KxBamBim+nOy больше обогащены кислородом по сравнению с членами рядов BamBim+nOy и KBam– 1Bim+nOy. Вхождение калия в матрицы оксидов бария-висмута BamBim+nOy, в которых $\overline {{\text{Bi}}} $ = 3.00–3.06 [13], сопровождается окислением Bi(III) → Bi(V) до $\overline {{\text{Bi}}} $ = 4.35–4.56. Эти значения характерны для сверхпроводящих оксидов ряда KnBamBim+nOy и получены на наиболее качественных кристаллах этих оксидов, выращенных методом электролиза [14].
Целью настоящей работы было выявление роли высоковалентных металлов − Fe(IV), Cu(III) и Bi(V) − в формировании сложных оксидов в системах Sr–Fe–O, Ba–Cu–O, Y(Eu)–Ba–Cu–O, Ba–Bi–O и K–Ba–Bi–O и поиск общих закономерностей в процессах фазообразования в этих системах. Интерес представляет сравнение окислительно-восстановительных свойств редокс-систем с участием Fe(IV), Cu(III) и Bi(V), которое в настоящей работе выполнено впервые. Показано, что в зависимости от температуры отжига и парциального давления кислорода синтезируются сложные оксиды, в которых содержание кислорода определяется “смешанно-валентным” состоянием железа, меди или висмута. При синтезе сложных оксидов важную роль играет атмосферный кислород, обеспечивающий в определенных интервалах температур окисление Fe(II) и Fe(III), Cu(I) и Cu(II), Bi(III) и формирование в оксидах оптимального соотношения, соответственно, Fe(III)/Fe(II), Fe(IV)/Fe(III), Cu(II)/Cu(I), Cu(III)/Cu(II) и Bi(V)/Bi(III) и, как следствие, оптимального содержания кислорода.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтезы образцов проводили в алундовых тиглях в высокотемпературной лабораторной печи Nabertherm HTCT 03/15 (Германия) или в горизонтальной трубчатой печи сопротивления, оснащенной прецизионным программным терморегулятором РИФ-101. Для отжигов в атмосфере аргона (P(O2) = 1 кПа) и кислорода (P(O2) = 101 кПа) использовали проточный кварцевый реактор.
Оксид SrFeO2.87 получен твердофазным синтезом из SrСO3 (ч.д.а.) и Fe2O3 (ос.ч. 2-4) по методике, близкой к [1, 2, 7]. Таблетки из шихты стехиометрического состава после двухэтапного отжига при 1000 (47 ч с одной промежуточной гомогенизацией и прессованием) и 1300°С (12 ч) медленно (220 град/ч) охлаждали до 200°С и закаливали на воздухе.
Для синтеза оксидов Eu–Ba–Cu–O использовали Eu2O3 (ТУ 48-4-194-72), BaO2 (Acros Organics) и CuO (ос.ч. 9-2). Оксиды Eu2O3 и CuO для получения массовых форм отжигали на воздухе при 1000 и 800°C в течение 24 и 3 ч соответственно.
Оксиды Ba–Bi–O получены отжигом стехиометрических смесей Ba(NO3)2 (х.ч.) и Bi2O3 (ос.ч. 13-3). Оксид Ba2Bi3O6.55 – член гомологического ряда оксидов BamBim+nOy [13] (m = 2 и n = 1) − синтезирован в атмосфере аргона при последовательном отжиге шихты начиная с 600°C. Гомогенизацию закаленных образцов измельчением и прессованием проводили после каждого отжига с шагом в 100°C в течение 24 ч.
Для синтеза оксидов K–Ba–Bi–O использовали двухступенчатый отжиг смеси предварительно синтезированного Ba2Bi3O6.55 и KNO3 (х.ч.). Определение средней степени окисления висмута $\overline {{\text{Bi}}} $, меди $\overline {{\text{Cu}}} $ и железа $\overline {{\text{Fe}}} $ в синтезированных оксидах проводили методом йодометрического титрования [12, 13, 23].
В качестве эталона по Bi(V) использовали оксид NaBiO3 (ч.д.а), для которого йодометрическое и обратное перманганатометрическое титрование дали согласующиеся значения $\overline {{\text{Bi}}} $ = 5.00(2). Примерно 0.1 М раствора диперйодатокупрата(III) калия K7Cu(IO6)2 (ДПК(III)) синтезировали окислением соли Cu(II) персульфатом калия K2S2O8 (ч.д.а.) по методике [24]. Его использовали как эталон Cu(III). Органические реагенты готовили в соответствии с [25]. Реагенты для химических тестов приготовлены аналогично [26].
Картины рентгеновской дифракции снимали при комнатной температуре на установке Siemens D-500 (излучение CuKα1). Расчет параметров ячеек с погрешностью ±0.002 Å осуществляли методом профильного анализа.
Потенциометрические измерения проводили на иономере И-135М.1. Индикаторным электродом служил платиновый электрод марки ЭПВ-1, электродом сравнения – насыщенный хлоридсеребряный электрод марки ЭВЛ-1М3.1.
Температуру перехода в сверхпроводящее состояние (Тс) образцов K–Ba–Bi–O и Eu-Ba–Cu–O оценивали по началу диамагнитного отклика на кривой температурной зависимости магнитной восприимчивости, измеренной бесконтактным методом.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Фазовый состав синтезированного образца SrFeO2.87 исследован в [23]. Основная фаза (92 мас. %) соответствует оксиду Sr8Fe8O23 (Sr FeO2.88) с тетрагональной структурой (пр. гр. I4/mmm [3], a = 10.932, c = 7.700 Å). По данным йодометрического титрования средняя степень окисления железа $\overline {{\text{Fe}}} $ = 3.74. В соответствии с этим значением ионный состав образца SrFeO2.87 можно представить как ${\text{S}}{{{\text{r}}}^{{2 + }}}{\text{Fe}}_{{0.26}}^{{3 + }}{\text{Fe}}_{{0.74}}^{{4 + }}{\text{O}}_{{2.87}}^{{2 - }}$. Полученное значение кислородного индекса в исследуемом образце согласуется с его фазовым составом.
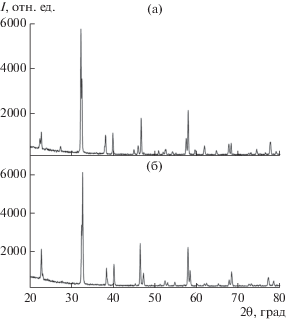
Тетрагональную фазу EuBa2Cu3O6.25 (Eu-123) с параметрами a = 3.881, c = 11.814 Å, V = 177.94 Å3 и $\overline {{\text{Cu}}} $ = 1.78 (рис. 1а) синтезировали на воздухе при 940°C в течение 6 ч с двумя промежуточными гомогенизациями (через 1 и 3 ч отжига) [12]. Сверхпроводящая (Тс = 88 К) ромбическая фаза EuBa2Cu3O6.92 с параметрами a = 3.904, b = 3.844, c = 11.705 Å, V = 175.65 Å3 ($\overline {{\text{Cu}}} $ = 2.24) (рис. 1б) получена отжигом тетрагональной фазы EuBa2Cu3O6.25 в атмосфере кислорода при температуре 450°C (5 ч). Во избежание окисления закалку тетрагональной и ромбической фаз от температуры отжига осуществляли в жидком азоте.
Рис. 1.
Дифрактограммы, демонстрирующие превращение тетрагональной фазы EuBa2Cu3O6.25 в сверхпроводящую (Тс = 88 К) ромбическую фазу EuBa2Cu3O6.92 в процессе отжига в атмосфере кислорода при 450°C в течение 5 ч.
В работе использованы два образца оксидов Ba–Bi–O. Оксид BaBiO3 получен при 600°C в течение 72 ч с измельчением и прессованием через 24 ч. Дифрактограмма полученного BaBiO3 соответствовала моноклинной структуре [27]. Температура окончательного отжига керамического оксида Ba2Bi3O6.55 в атмосфере аргона составила 850°C. Согласно дифрактограмме (рис. 2а) оксид Ba2Bi3O6.55 кристаллизуется в тетрагональной сингонии с параметрами элементарной ячейки a = 4.376, с = 4.493 Å, V = 86.04 Å3. Средння степень окисления висмута $\overline {{\text{Bi}}} $ = 3.03.
Рис. 2.
Дифрактограммы, демонстрирующие фазовые превращения материнского оксида Ba2Bi3O6.55 (а), члена гомологического ряда BamBim+nOy (m = 2, n = 1), полученного в атмосфере аргона при Т = 850°C, в прекурсор KBam– 1Bim+nOy (б) при отжиге смеси исходного Ba2Bi3O6.55: KNO3 (1 : 1) в той же атмосфере при 800°C в течение 1 ч. При последующем низкотемпературном отжиге (450°C, 1 ч) в атмосфере кислорода формируется сверхпроводящий оксид KxBamBim +nOy (Tc = 20 К) (в) с кубической ячейкой. Рефлексы, расположенные слева от основных, принадлежат примесной кубической фазе KxBamBim+nOy с m/(m + n) = 0.72–0.95.
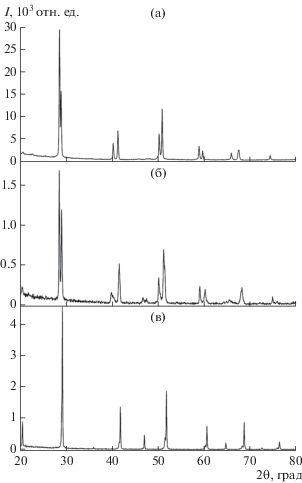
Для синтеза оксидов K–Ba–Bi–O на первом этапе смесь Ba2Bi3O6.55 с KNO3 в соотношении 1 : 1 (мол. %) отжигали в атмосфере аргона при 800°C (1 ч) с целью получения тетрагональных оксидов гомологического ряда KBam– 1Bim+nOy [22]. Дифрактограмма полученного образца приведена на рис. 2б и соответствует тетрагональной структуре с параметрами a = 4.332, с = 4.511 Å, V = 84.65 Å3. По данным йодометрического титрования $\overline {{\text{Bi}}} $ = 3.32.
На втором этапе отжига полученный прекурсор выдерживали в атмосфере кислорода при 450°C в течение 1 ч. В результате формировались сверхпроводящие оксиды (Tc = 20 К) ряда KxBamBim+nOy с m/(m + n) = 0.40–0.67, x < n [14], характеризующиеся усредненной кубической ячейкой (a = 4.306 Å, V = 79.84 Å3) (рис. 2в) и средней степенью окисления $\overline {{\text{Bi}}} $ = 4.16. Рефлексы, расположенные слева от основных, свидетельствуют о присутствии примесной фазы с параметром a = 4.330 Å. Такой параметр характерен для обогащенных барием оксидов KxBamBim+nOy с m/(m + n) = 0.72–0.95.
Потенциометрические измерения в процессе растворения сложных оксидов, содержащих Bi(V), Fe(IV), Cu(III) и Cu(I)
Измерения ЭДС в системе Pt–хлоридсеребряный электрод в процессе растворения оксидов позволяет обнаружить в них окислитель или восстановитель [26]. При растворении в 1 М HCl трех висмутсодержащих оксидов – BaBiO3, сверхпроводящего (Tc = 20 К) KxBamBim+nOy и NaBiO3, используемого в качестве эталона Bi(V) при исследованнии валентного состояния состояния висмута, – наблюдается однотипное поведение, а именно увеличение ЭДС на ≈220 мВ (рис. 3, кривые 1–3). Растворение оксида Bi2O3 не сопровождается изменением потенциала (рис. 3, кривая 4).
Рис. 3.
Изменение потенциала Pt электрода от времени в процессе растворения BaBiO3 (1), сверхпроводящего (Тс = = 20 К) KxBamBim+nOy (2), эталонных NaBiO3 (3), Bi2O3 (4) и SrFeO2.88 (вставка) в 1 М HCl в атмосфере аргона. Момент введения оксидов показан стрелкой.
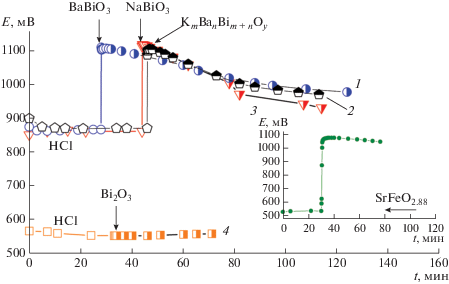
Растворение оксида SrFeO2.87 в 1 М HCl происходит при большем повышении ЭДС на ~500 мВ (рис. 3, вставка). Совершенно очевидно, что повышение ЭДС связано с образованием при растворении оксидов окислителя, которым в первую очередь является хлор, возможно, и кислород:
(1)
$\begin{gathered} {\text{2BaBi}}{{{\text{O}}}_{3}} + 12{{{\text{H}}}^{ + }} + 10{\text{C}}{{{\text{l}}}^{ - }} \to \\ \to \,\,2{\text{B}}{{{\text{a}}}^{{2 + }}} + 2{\text{BiCl}}_{4}^{ - } + {\text{C}}{{{\text{l}}}_{2}} \uparrow + \,6{{{\text{H}}}_{{\text{2}}}}{\text{O}}, \\ \end{gathered} $(2)
$\begin{gathered} {\text{NaBi}}{{{\text{O}}}_{3}} + 6{{{\text{H}}}^{ + }} + 6{\text{C}}{{{\text{l}}}^{ - }} \to \\ \to {\text{N}}{{{\text{a}}}^{ + }} + {\text{BiCl}}_{4}^{ - } + {\text{C}}{{{\text{l}}}_{2}} \uparrow + {\text{ }}3{{{\text{H}}}_{{\text{2}}}}{\text{O}}, \\ \end{gathered} $(3)
$\begin{gathered} {\text{2SrFe}}{{{\text{O}}}_{{3\, - \,х}}} + \left( {10 - 4x} \right){\text{C}}{{{\text{l}}}^{ - }} + \left( {12 - 4x} \right){{{\text{H}}}^{ + }} \to \\ \to 2{\text{FeCl}}_{4}^{ - } + 2{\text{S}}{{{\text{r}}}^{{2 + }}} + \left( {6 - 2x} \right){{{\text{H}}}_{{\text{2}}}}{\text{O}} + \left( {1 - 2x} \right){\text{C}}{{{\text{l}}}_{2}} \uparrow . \\ \end{gathered} $Хлор в продуктах растворения обнаружен с помощью двух реакций: с N,N-диметил-п-фенилендиамином по появлению розового окрашивания и с о-толидином (желтое пятно на фильтровальной бумаге). Снижение потенциала на заключительном этапе растворения (рис. 3) во всех случаях обусловлено удалением хлора из раствора потоком аргона.
В отличие от оксидов висмута при растворении SrFeO2.87 в измеряемом смешанном потенциале присутствуют как минимум две составляющие, обусловленные наличием в растворе двух окислителей – хлора ($E_{{{\text{C}}{{{\text{l}}}_{{\text{2}}}}{\text{/2C}}{{{\text{l}}}^{ - }}}}^{{\text{0}}}$ = 1.3583 В) и железа(III) ($E_{{{{{\text{F}}{{{\text{e}}}^{{{\text{3}} + }}}} \mathord{\left/ {\vphantom {{{\text{F}}{{{\text{e}}}^{{{\text{3}} + }}}} {{\text{F}}{{{\text{e}}}^{{{\text{2}} + }}}}}} \right. \kern-0em} {{\text{F}}{{{\text{e}}}^{{{\text{2}} + }}}}}}}^{{\text{0}}}$ = 0.771 В) [28].
Такой же характер изменения потенциала во времени наблюдается при растворении в аналогичных условиях сверхпроводящего ромбического оксида EuBa2Cu3O6.92 и эталонного ДПК(III) (рис. 4, кривые 3 и 5):
(4)
$\begin{gathered} 2{\text{EuB}}{{{\text{a}}}_{{\text{2}}}}{\text{C}}{{{\text{u}}}_{{\text{3}}}}{{{\text{O}}}_{{6.92}}} + 26{{{\text{H}}}^{ + }} + 24{\text{C}}{{{\text{l}}}^{ - }} \to \\ \to 0.42{{{\text{O}}}_{2}} \uparrow + {\text{ }}13{{{\text{H}}}_{2}}{\text{O}} + 2{\text{E}}{{{\text{u}}}^{{3 + }}} + 4{\text{B}}{{{\text{a}}}^{{2 + }}} + 6{\text{CuCl}}_{4}^{{2 - }}. \\ \end{gathered} $Рис. 4.
Изменение потенциала Pt электрода от времени в процессе растворения CuO (1), Cu2O (2), ромбического (3), тетрагонального Eu-123 (4) и эталонного ДПК(III) (5) в 1 М HCl в атмосфере аргона. Момент введения ДПК(III) и оксидов показан стрелкой.
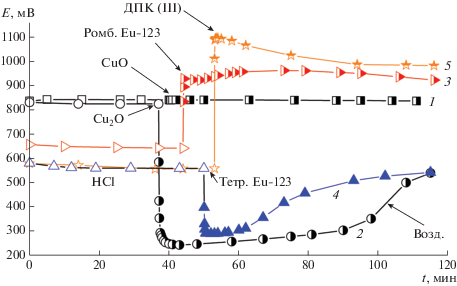
Образование кислорода ранее наблюдали [29] при растворении в 10%-ной HCl образцов ромбических фаз состава YBa2Cu3O6.70–6.94 ($\overline {{\text{Cu}}} $ = 2.13–2.29) и EuBa2Cu3O6.76–6.88 ($\overline {{\text{Cu}}} $ = 2.17–2.25).
Повышение ЭДС при растворении ромбической фазы Eu-123 составляет ~300 мВ, для ДПК(III) еще выше (~450 мВ). При высокой концентрации Cu(III) в растворе окисляются хлорид-ионы:
(5)
$\begin{gathered} {\text{2Cu(I}}{{{\text{O}}}_{6}}{\text{)}}_{2}^{{7 - }} + 16{{{\text{H}}}^{ + }} + 10{\text{C}}{{{\text{l}}}^{ - }} \to \\ \to {\text{C}}{{{\text{l}}}_{2}} \uparrow + \,8{{{\text{H}}}_{2}}{\text{O}} + 2{\text{CuCl}}_{4}^{{2 - }} + 4{\text{IO}}_{4}^{ - } \\ \end{gathered} $При растворении эталонного по Cu(II) оксида CuO (рис. 4, кривая 1) ЭДС, измеренная в 1 М HCl, не меняется во времени, значит, в раствор не переходят ни окислители, ни восстановители, как и в случае растворения Bi2O3 (рис. 3, кривая 4). Этот эксперимент опровергает выводы [30], где наблюдали образование Cu(I) при растворении CuO в HCl. В работе отсутствует информация о характеристиках используемого образца оксида и его предыстории.
Растворение Cu2O происходит с резким снижением потенциала на ~600 мВ, что объясняется образованием в растворе сильного восстановителя – Cu(I) ($E_{{{{{\text{C}}{{{\text{u}}}^{{{\text{2}} + }}}} \mathord{\left/ {\vphantom {{{\text{C}}{{{\text{u}}}^{{{\text{2}} + }}}} {{\text{C}}{{{\text{u}}}^{ + }}}}} \right. \kern-0em} {{\text{C}}{{{\text{u}}}^{ + }}}}}}^{{\text{0}}}$ = 0.159 В) в виде хлоридных комплексов:
(6)
${\text{C}}{{{\text{u}}}_{{\text{2}}}}{\text{O}} + 2{{{\text{H}}}^{ + }} + 4{\text{C}}{{{\text{l}}}^{ - }} \to 2{\text{CuCl}}_{2}^{ - } + {{{\text{H}}}_{{\text{2}}}}{\text{O}}.$Подъем потенциала на заключительном этапе растворения обусловлен окислением Cu(I) в Cu(II) примесью кислорода в аргоне:
(7)
$4{\text{CuCl}}_{2}^{ - } + {{{\text{O}}}_{2}} + 4{{{\text{H}}}^{ + }} + 8{\text{C}}{{{\text{l}}}^{ - }} \to 4{\text{CuCl}}_{4}^{{2 - }} + 2{{{\text{H}}}_{{\text{2}}}}{\text{O}},$С учетом средней степени окисления меди, рассчитанной по результатам йодометрического титрования, ионный состав несверхпроводящей тетрагональной фазы Eu-123 может быть представлен как ${\text{EuB}}{{{\text{a}}}_{2}}{\text{Cu}}_{{0.51}}^{ + }{\text{Cu}}_{{2.49}}^{{2 + }}{{{\text{O}}}_{{6.25}}}$. Растворение этой фазы идет со снижением потенциала на ~300 мВ (рис. 4, кривая 4), что обусловлено образованием в растворе хлоридных комплексов Cu(I):
(8)
$\begin{gathered} {\text{EuB}}{{{\text{a}}}_{{\text{2}}}}{\text{Cu}}_{{0.51}}^{ + }{\text{Cu}}_{{2.49}}^{{2 + }}{{{\text{O}}}_{{{\text{6}}{\text{.25}}}}} + 12.49{{{\text{H}}}^{ + }} + 10.98{\text{C}}{{{\text{l}}}^{ - }} \to \\ \to 6.245{{{\text{H}}}_{{\text{2}}}}{\text{O}} + {\text{E}}{{{\text{u}}}^{{3 + }}} + 2{\text{B}}{{{\text{a}}}^{{2 + }}} + \\ + \,\,0.51{\text{CuCl}}_{2}^{ - } + 2.49{\text{CuCl}}_{4}^{{2 - }}. \\ \end{gathered} $Наличие Cu(I) доказано положительным тестом с батокупроином.
Таким образом, продукты растворения тетрагональной и ромбической фаз Eu-123 в 1 М HCl отличаются своими окислительно-восстановительными свойствами: тетрагональная фаза в растворе образует восстановитель, а ромбическая фаза – окислитель (рис. 4).
Роль кислорода в процессах фазообразования в системах Ba–Bi–O, K–Ba–Bi–O, Y(Eu)–Ba–Cu–O и Sr–Fe–O
В процессе синтеза оксидов SrFeO3 –x атмосферный кислород обеспечивает окисление Fe(III), благодаря чему формируются различные по содержанию кислорода, соотношению Fe(IV)/Fe(III) и по структуре фазы.
В ряде работ [1, 7, 31] независимо от используемого метода (золь-гель, твердофазный синтез) температура окончательного отжига составляет 1300°С. Закаленный от 1300°С образец имеет состав SrFeO2.68 [7] со средней степенью окисления $\overline {{\text{Fe}}} $ = 3.36 и, по всей вероятности, представляет собой смесь фаз SrFeO3 –x, которые при медленном охлаждении на воздухе окисляются до тетрагональной фазы SrFeO2.87 [3]. Содержание Fe(IV) увеличивается от 36 до 74%.
Как показано во введении, в оксиде с катионным соотношением Sr : Fe = 1 : 1 реализуется широкий спектр валентных состояний железа – II, III и IV. Структура и свойства образующихся оксидов зависят от соотношения “разновалентных” форм железа, задающих определенное содержание кислорода в оксиде. С более высокой валентностью, чем Fe(IV), известен оксид SrFeVIO4, который теряет кислород в интервале 80–600°С с восстановлением Fe(VI) до низких степеней окисления [32]. Проследить характер изменения валентного состояния железа в оксидах системы Sr–Fe–O других катионных составов не представляется возможным из-за отсутствия необходимых экспериментальных данных.
В системах Y(Eu)–Ba–Cu–O тетрагональные несверхпроводящие, обедненные кислородом оксиды YBa2Cu3O6.5 – δ (Y-123) [11] и EuBa2Cu3O6.5 – δ (Eu-123) [12] формируются при отжиге на воздухе в области Т ≈ 900–1000°С. Средняя степень окисления меди $\overline {{\text{Cu}}} $ в тетрагональных фазах составляет, соответственно, 1.86 и 1.73–1.83, что предполагает наличие в их структуре 14 и 17–27% Cu(I) от общего количества меди.
При медленном охлаждении на воздухе или низкотемпературном отжиге в атмосфере кислорода (400–500°С) тетрагональные оксиды Y(Eu)Ba2Cu3O6.5 – δ претерпевают фазовые превращения в ромбические сверхпроводящие фазы Y(Eu)Ba2Cu3O6.5 + δ, содержащие часть меди в формальной степени окисления + 3 и характеризующиеся значениями $\overline {{\text{Cu}}} $, равными 2.26 для YBa2Cu3O6.5 + δ [13] и 2.24–2.29 для EuBa2Cu3O6.5 + δ [14].
В матричной системе Ba–Cu–O [10], так же как и в системе Ba–Bi–O [13], с обогащением оксидов щелочноземельным металлом увеличивается доля меди в высшей степени окисления и, соответственно, доля Bi(V) в оксидах Ba–Bi–O. Обогащенные барием члены гомологического ряда Bam+nBimOy (m = 1–10; n = 0–5, 7–9, 11, 13, 17) [13] состава (Ba : Bi) 25 : 8, 3 : 1, 11 : 4 и 5 : 2 содержат близкое к 100% количество Bi(V).
В системе Ba–Bi–O центральный оксид BaBiO2.5 с наибольшим дефицитом кислорода, не содержащий Bi(V), синтезируется в инертной атмосфере и при высокой температуре [13, 21, 33] . Как показано в [33] , образец состава Ba : Bi = 1 : 1 при охлаждении от 1100°С в присутствии кислорода в области ликвидус–солидус претерпевает фазовые превращения в оксиды гомологического ряда Bam+nBimOy состава (Ba : Bi) 17 : 9, 9 : 5, 3 : 2, 4 : 3 и 5 : 4 с последующими твердофазными превращениями с участием оксидов BamBim+nOy (m = = 1–9; n = 0–3, 5, 7, 9) [13, 33] и обедненных кислородом фаз ${\text{B}}{{{\text{a}}}_{{2n}}}{\text{Bi}}_{{n\, + \,1}}^{{3 + }}{\text{Bi}}_{{n\, - \,1}}^{{5 + }}{{{\text{O}}}_{{6n\,--\,1}}}$ (n = 1, 2, …) [21], характеризующихся различным содержанием кислорода и Bi(V). Процесс окисления заканчивается образованием перовскита BaBiO3, в котором средняя степень окисления висмута $\overline {{\text{Bi}}} $ = 4.0 [27]. Аналогичного состояния железа в центральном оксиде системы Sr–Fe–O экспериментально достичь труднее: как указывалось выше, оксид SrFeO3 ($\overline {{\text{Fe}}} $ = 4.0) можно синтезировать только в особых условиях [3, 6, 7]. Если обедненные кислородом фазы ${\text{B}}{{{\text{a}}}_{{2n}}}{\text{Bi}}_{{n\, + \,1}}^{{3 + }}{\text{Bi}}_{{n\, - \,1}}^{{5 + }}{{{\text{O}}}_{{6n\,--\,1}}}$(n = 1, 2, …) [21] легко окислить до BaBiO3, то SrFeO2.87 невозможно окислить до SrFeO3 в условиях длительного (240 ч) низкотемпературного (360°С) отжига в потоке кислорода [31] . Оксид SrFeO2.87 является одной из наиболее термодинамически устойчивых фаз SrFeO3 –x.
Примечательно, что промежуточные по содержанию кислорода (2.5 < (3 – x) < 3.0) фазы SrFeO3 –x и BaBiO3 –x по составу близки между собой. В первом случае состав SrFeO2.69 [34] , SrFeO2.73–2.77 [1–3, 31] , Sr FeO2.80–2.81 [31, 34] , SrFeO2.86–2.87 [1–3, 34] , Sr FeO2.93 [31] , SrFeO2.97 [1, 2, 34] . По всей вероятности, каждая из фаз имеет область гомогенности по кислороду, в пределах которой ее структура остается неизменной. Во втором случае состав первых четырех членов ряда ${\text{B}}{{{\text{a}}}_{{2n}}}{\text{Bi}}_{{n\, + \,1}}^{{3 + }}{\text{Bi}}_{{n\, - \,1}}^{{5 + }}{{{\text{O}}}_{{6n\,--\,1}}}$ (n = 1, 2, …) [21], ВаВiO2.50 (n = 1), ВаВiO2.75 (п = 2), ВаВiO2.83 (n = 3) и ВаВiO2.88 (n = 4) идеально совпадает с составом оксидов SrFeO2.50, SrFeO2.75, Sr FeO2.83 и SrFeO2.88. Оксид ВаВiO2.97 [21], идентичный по химическому составу SrFeO2.97, соответствует члену с n = 15. Если обедненные кислородом фазы SrFeO3 – x, характеризующиеся разными картинами дифракции, легко синтезируются в однофазном состоянии, то индивидуальные тетрагональные перовскитоподобные обедненные кислородом фазы ряда ${\text{B}}{{{\text{a}}}_{{2n}}}{\text{Bi}}_{{n\, + \,1}}^{{3 + }}{\text{Bi}}_{{n\, - \,1}}^{{5 + }}{{{\text{O}}}_{{6n\,--\,1}}}$ с близкими параметрами элементарных ячеек, за исключением оксида ВаВiO2.50, не выделены [21].
Свойства и структура оксидов Ba–Bi–O и K–Ba–Bi–O зависят от валентного состояния висмута и содержания кислорода. Зависимость структуры фаз от состояния висмута наглядно демонстрирует рис. 2, на котором представлены типичные дифрактограммы оксидов BamBim+nOy, KBam– 1Bim+nOy и KxBamBim+nOy. На каждой стадии синтеза происходит поглощение кислорода, о чем свидетельствует увеличение значений $\overline {{\text{Bi}}} $: 3.03 в исходном (BamBim+nOy), 3.32 в KBam– 1Bim+nOy и 4.16 в конечном (KxBamBim+nOy) оксиде. Примечательно, что с увеличением доли Bi(V) в оксиде объем элементарной ячейки V закономерно уменьшается: 86.04 Å3 в исходном матричном оксиде, 84.65 Å3 в промежуточном и 79.84 Å3 в сверхпроводящей фазе.
Окислительная способность Bi(V), Fe(IV) и Cu(III)
Свойства сложных оксидов Ba–Bi–O и K–Ba–Bi–O, содержащих Bi(V), детально ранее описаны в [25, 26]. Поведение в окислительно-восстановительных реакциях Fe(IV), присутствующего в оксиде SrFeO2.87, исследовано в [23]. Все рассматриваемые высоковалентные формы Bi(V), Fe(IV) и Cu(III) способны окислять метиловый красный и основание Арнольда, о чем свидетельствует обесцвечивание первого и образование синих продуктов окисления во втором (табл. 1). Из неорганических ионов они окисляют Cl– (Cu(III) только при высокой концентрации). Сравнение окислительно-восстановительных свойств рассматриваемых систем показывает, что наиболее сильным окислителем является Bi(V), способный окислять Mn(II) с образованием перманганат-ионов и Ce(III) → Ce(IV). Эти свойства характеризуют Bi(V) как более сильный окислитель, чем Fe(IV) и Cu(III). Только Cu(III) способны образовать ДПК(III) с щелочным раствором перйодата, который в присутствии Cu(II) окисляется оксидами, содержащими Bi(V), до ДПК(III) [26].
Таблица 1.
Окислительно-восстановительные свойства Bi(V), Fe(IV) и Cu(III)
| № | Реагент | Аналитический признак | ||
|---|---|---|---|---|
| Bi(V) | Fe(IV) | Cu(III) | ||
| 1 | 1 М HCl | ↑Cl2 | ↑Cl2 | ↑O2 |
| 2 | Mn(II) в среде HNO3 | MnO$_{4}^{ - }$ красно-фиолетовый |
Mn(II) | Mn(II) |
| 3 | Ce(III) в среде HNO3 |
Ce(IV) желтый |
Ce(III) | Ce(III) |
| 4 | ${\text{IO}}_{4}^{ - }$ в щелочной среде | ${\text{IO}}_{4}^{ - }$ | ${\text{IO}}_{4}^{ - }$ | ДПК(III) желто-коричневый |
| 5 | ДПК(II) | ДПК(III) желто-коричневый |
ДПК(II) | ДПК(III) желто-коричневый |
| 6 | Метиловый красный | Бесцветные продукты окисления | ||
| 7 | Основание Арнольда | Синие продукты окисления | ||
В литературе не прекращается дискуссия о природе окислительных свойств сложных висмутатов, ферратов, купратов. Альтернативой Bi(V), Fe(IV) и Cu(III) могут быть необычные валентные формы кислорода, отличные от O2–, такие как ${\text{O}}_{4}^{ - }$, ${\text{O}}_{3}^{ - }$, ${\text{O}}_{2}^{ - }$, ${\text{O}}_{2}^{{2 - }}$, O–, O0 [35, 36] . Выполненные в ряде работ [23, 25, 26] исследования показывают, что окислителем в исследуемых оксидах SrFeO3 – x, BaBiO3, KxBamBim+nOy не могут быть дипероксид-ионы. Эти ионы способны к образованию из других необычных валентных форм кислорода в результате реакций диспропорционирования [35] . Тесты на дипероксид-ионы с известными реагентами (NH4VO3 и Ti(IV) в кислых средах) отрицательны. Потенциометрические измерения показывают: растворение оксидов SrFeO2.87, BaBiO3, KxBamBim+nOy, NaBiO3 и ромбической фазы Eu-123 в 1 М HCl происходит с повышением потенциала Pt-электрода (рис. 1 и 2), что характерно для окислителей. Пероксид-ионы наряду с окислительными свойствами обладают и восстановительными [35] . В процессе растворения пероксида BaO2 в кислой среде наблюдается резкое снижение ЭДС [26], характерное для восстановителей. Исследуемые оксиды, за исключением тетрагональной фазы Eu-123, восстановительные свойства не проявляют. Как показано выше, тетрагональная фаза Eu-123 является восстановителем из-за наличия в его структуре Cu(I).
В купратах ситуация более сложная [37–40] , чем в ферратах и висмутатах. Однако можно привести данные работ, в которых доказывается наличие Cu(III) в сверхпроводящем оксиде Y-123. Так, в результате теста с перманганатом показано [41] , что в этом оксиде отсутствуют дипероксид-ионы. Кроме того, YBa2Cu3O6.5 + δ с щелочным раствором перйодата образует ДПК(III) [42] . Пероксид восстанавливает ДПК(III) и при наличии дипероксид-ионов в оксиде реакция его с KIO4 была бы невозможной.
Окислительно-восстановительные свойства редокс-систем Bi(V)/Bi(III), Fe(IV)/Fe(III),Cu(III)/Cu(II) и Cu(II)/Cu(I)
Высоковалентные состояния Fe(IV), Cu(III), Bi(V) как в простых, так и в сложных оксидах достаточно стабильны при низких температурах. При нагревании оксидов, содержащих Fe(IV), Cu(III), Bi(V), происходит восстановление, соответственно, до Fe(III), Cu(II), Bi(III). Fe(IV) обнаруживается в оксиде SrFeO3 –х до высоких температур (при 1300°С в образце состава SrFeO2.68 [7] содержится 36% Fe(IV)). Авторы [2, 43] предполагали, что в атмосфере азота при 1000°С состав оксида SrFeO2.50. В действительности для восстановления Fe(IV) → Fe(III) в оксиде SrFeO3 –x с образованием SrFeO2.50 достаточно кратковременного (2 ч) отжига в атмосфере аргона (1000°С) [7] или более длительного (12 ч) при 500°С в смеси аргона с 5% H2 [3].
С повышением температуры до ~1350–1440°С [4] в оксидах Sr–Fe–O начинается восстановление Fe(III) → Fe(II). Полное восстановление Fe(III) → Fe(II) в оксиде SrFeO3 –х происходит только в присутствии CaH2 [9]. Таким образом, в отличие от Cu(II) в оксидах Y(Eu)–Ba–Cu–O восстановление Fe(III) до низшего ВС Fe(II) в системе Sr–Fe–O происходит сложнее, поэтому оксид железа(II)-стронция SrFeO2 можно получить только с применением дополнительных восстановителей (CaH2).
В медьсодержащих системах Ba–Cu–O и Y(Eu)–Ba–Cu–O восстановление Cu(II) → Cu(I) происходит достаточно легко. Расплавы системы Ba–Cu–O в значительной степени обогащены Cu(I) (до $\overline {{\text{Cu}}} $ = 1.35 при температуре 1000°C) [10]. Тетрагональные фазы Y(Eu)Ba2Cu3O6.5 – δ, независимо от атмосферы синтеза (воздух, чистый кислород или аргон), обеднены кислородом и содержат Cu(I): в атмосфере кислорода при 800°C средняя степень окисления в оксиде Y-123 $\overline {{\text{Cu}}} $ = 1.96, а при 950°C в Eu-123 составляет 1.90–1.91 [11, 12]. Если простой оксид меди(II) CuO восстанавливается до Cu2O при Т = 1026–1100°C, то в сложных оксидах меди, содержащих Ba, Y или Eu, эта температура снижается на ~150–200°C.
Данные об условиях синтеза и термической устойчивости простого оксида Cu2O3 в литературе крайне противоречивы. По всей вероятности, оптимальные условия синтеза этого оксида не найдены. Cu(III) в ромбических сверхпроводящих фазах Y(Eu)Ba2Cu3O6.5 + δ легко восстанавливается до Cu(II) при Т ≈ 700–800°C, а затем до Cu(I) с образованием несверхпроводящих тетрагональных фаз Y(Eu)Ba2Cu3O6.5 – δ.
Главным фактором, определяющим валентное состояние меди и висмута в сложных оксидах, является температура, а не парциальное давление кислорода. По аналогии с оксидами Ba–Cu–O и Y(Eu)–Ba–Cu–O в системе Ba–Bi–O в области ликвидус–солидус независимо от Р(О2) формируются фазы, практически не содержащие Bi(V) [13]. Медленное охлаждение фаз, включающих Cu(I) и Bi(III), в кислородсодержащей атмосфере приводит к окислению их в субсолидусной области. Это благоприятно для отдельных оксидов, таких как Ba2CuO3.45, BaCuO2.5, Ba2Cu3O5.5, и губительно для фазы BaCu2O2. Обогащенные барием оксиды Ba–Bi–O (ряд фаз Bam + nBimOy, BaBiO3) не разлагаются в аналогичных условиях в отличие от оксидов BamBim+nOy, существующих на воздухе только в области ликвидус–солидус.
Простые высшие оксиды висмута(V) (Bi2O5) и висмута(III,V) (Bi2O4, Bi4O7) при нагревании легко теряют кислород с восстановлением Bi(V) → Bi(III) [44–46] : Bi2O5 термически устойчив до 150°C, Bi2O4 – до ~350°C, а Bi4O7 – до 380°C. Таким образом, температура разложения простого оксида снижается с увеличением в нем доли Bi(V).
Оксиды гомологического ряда Bam+nBimOy состава (Ba : Bi) 15 : 4, 19 : 6, 25 : 8 и 3 : 1, обогащенные Bi(V), стабильны на воздухе до высоких температур (~850–1250°C) [13]. Обогащенные барием в меньшей степени фазы Bam+nBimOy состава (Ba : Bi) 11 : 4, 21 : 8, 5 : 2, 9 : 4 и 2 : 1 не разлагаются только в субсолидусной области (ниже ~850°C). Таким образом, обогащение оксидов Bam+nBimOy барием, как правило, способствует расширению области термической устойчивости практически до области ликвидус–солидус, а это значит, что восстановление Bi(V)→Bi(III) происходит при более высокой температуре (фазы катионного состава (Ba : Bi) 15 : 4 и 19 : 6 термически устойчивы, соответственно, до 1265 и 1235°C). Сложные оксиды системы K–Ba–Bi–O термически менее устойчивы (до ~800°C), чем оксиды Bam+nBimOy, что, по всей вероятности, связано с высокой летучестью оксидов калия. Термическое разложение оксидов систем Ba–Bi–O и K–Ba–Bi–O происходит чаще всего с изменением катионного состава, потерей кислорода и сопровождается восстановлением Bi(V) до Bi(III) [13]. Расплавы оксидов Ba–Bi–O в интервале составов 30–100 мол. % BiO1.5 и K–Ba–Bi–O практически не содержат Bi(V) [13, 22].
ЗАКЛЮЧЕНИЕ
Таким образом, анализ процессов фазообразования в системах Sr–Fe–O, Ba–Cu–O, Y(Eu)–Ba–Cu–O, Ba–Bi–O и K–Ba–Bi–O показывает, что синтезы сложных оксидов происходят однотипно через образование обедненных кислородом фаз в условиях высоких температур. Эти фазы в процессе медленного охлаждения или низкотемпературного отжига в кислородсодержащей атмосфере насыщаются кислородом с окислением Fe(III) → Fe(IV), Cu(I) → Cu(II) → Cu(III) и Bi(III) → Bi(V) и образуют оксиды с магнитными (Sr–Fe–O) и сверхпроводящими (Y(Eu)–Ba–Cu–O и K–Ba–Bi–O) свойствами. Большинство оксидов рассматриваемых систем нестехиометричны по кислороду. Не исключено, что обнаруженные закономерности будут наблюдаться и в других оксидных системах с металлами переменной валентности (титан, ванадий, марганец, никель).
Список литературы
Takano M., Okita T., Nakayama N., Bando Y., Takeda Y., Yamamoto O., Goodenough J.B. // J. Solid State Chem. 1988. V. 73. P. 140. https://doi.org/10.1016/0022-4596(88)90063-1
Takeda Y., Kanno K., Takada T., Yamamoto O., Takano M., Nakayama N., Bando Y. // J. Solid State Chem. 1986. V. 63. № 2. P. 237. https://doi.org/10.1016/0022-4596(86)90174-X
Hodges J.P., Short S., Jorgensen J.D., Xiong X., Dabrowski B., Mini S.M., Kimball C.W. // J. Solid State Chem. 2000. V. 151. P. 190. https://doi.org/10.1006/jssc.1999.8640
Langhof N., Seifert D., Göebbels M.; Töpfer J. // J. Solid State Chem. 2009. V. 182. № 9. P. 2409. https://doi.org/10.1016/j.jssc.2009.05.039
Brisi C., Rolando P. // Ann. Chim. (Rome). 1969. V. 59. № 5. P. 385.
MacChesney J.B., Sherwood R.C., Potter J.F. // J. Chem. Phys. 1965. V. 43. № 6. P. 1907. https://doi.org/10.1063/1.1697052
Wattiaux A., Fournes L., Demourgues A., Bernaben N., Grenier J. C., Pouchard M. // Solid State Commun. 1991. V. 77. № 7. P. 489. https://doi.org/10.1016/0038-1098(91)90726-C
Ващук В.В., Кохановский Л.В., Юшкевич И.И. // Неорган. материалы. 2000. Т. 36. № 1. С. 90.
Tsujimoto Y., Tassel C., Hayashi N., Watanabe T., Kageyama H., Yoshimura K., Takano M., Ceretti M., Ritter C., Paulus W. // Nature. 2007. V. 450. P. 1062. https://doi.org/10.1038/nature06382
Клинкова Л.А., Николайчик В.И., Барковский Н.В., Ван К.В., Федотов В.К. // Журн. неорган. химии. 2011. Т. 56. № 4. С. 553.
Клинкова Л.А., Николайчик В.И., Барковский Н.В., Федотов В.К. // Журн. неорган. химии. 2012. Т. 57. № 9. С. 1278.
Клинкова Л.А., Николайчик В.И., Барковский Н.В., Федотов В.К. // Физика металлов и металловедение. 2018. Т. 119. № 3. С. 232. https://doi.org/10.7868/S0015323018030038
Клинкова Л.А., Николайчик В.И., Барковский Н.В., Федотов В.К. // Журн. неорган. химии. 1999. Т. 44. № 12. С. 2081.
Клинкова Л.А., Николайчик В.И., Барковский Н.В., Федотов В.К. // Журн. неорган. химии. 2001. Т. 46. № 5. С. 715.
Zhang W., Osamura K. // Jpn. J. Appl. Phys. 1990. V. 29. № 7A. P. L1092. https://doi.org/10.1143/JJAP.29.L1092
Wu M., Su Q., Hu G., Ren Y., Wang H. // J. Solid State Chem. 1994. V. 110. № 2. P. 389. https://doi.org/10.1006/jssc.1994.1184
Rao Y., Sunandana C. // J. Solid State Chem. 1995. V. 114. № 2. P. 585. https://doi.org/10.1006/jssc.1995.1088
Dubé D., Champagne B. // Mater. Lett. 1990. V. 9. № 10. P. 353. https://doi.org/10.1016/0167-577X(90)90065-T
Чесноков Г.А., Стебунов А.А., Новичков В.А., Са биров М.Х., Стукан Р.А., Книжник А.Г., Макаров Е.Ф. // Сверхпроводимость: физика, химия, техника. 1990. Т. 3. № 4. С. 725.
Cava R.J., Batlogg B., Chen C.H., Rietman E.A., Zahurak S.M., Werder D. // Nature. 1987. V. 329. P. 423. https://doi.org/10.1038/329423a0
Клинкова Л.А., Николайчик В.И., Барковский Н.В., Федотов В.К. // Журн. неорган. химии. 1997. Т. 42. № 6. С. 905.
Клинкова Л.А., Николайчик В.И., Барковский Н.В., Федотов В.К. // Журн. неорган. химии. 2000. Т. 45. № 10. С. 1605.
Барковский Н.В. // Заводская лаборатория. Диагностика материалов. 2020. Т. 86. № 6. С. 5. https://doi.org/10.26896/1028-6861-2020-86-6-5-13
Jensovšký L. // Coll. Czech. Chem. Commun. 1957. V. 22. № 5. P. 1564. https://doi.org/10.1135/cccc19571564
Барковский Н.В. // Журн. аналитической химии. 2015. Т. 70. № 11. С. 1171. https://doi.org/10.7868/S0044450215090030
Барковский Н.В. // Заводская лаборатория. Диагностика материалов. 2019. Т. 85. № 8. С. 16. https://doi.org/10.26896/1028-6861-2019-85-8-16-28
Cox D.E., Sleight A.W. // Solid State Commun. 1976. V. 19. № 10. P. 969. https://doi.org/10.1016/0038-1098(76)90632-3
Турьян Я.И. Окислительно-восстановительные реакции и потенциалы в аналитической химии. М.: Химия, 1989. 248 с.
Dou S.X., Liu H.K., Bourdillon A.J., Savvides N., Zhou J.P., Sorrell C.C. // Solid State Commun. 1988. V. 68. № 2. P. 221. https://doi.org/10.1016/0038-1098(88)91104-0
Горичев И.Г., Зайцев Б.Е., Шаплыгин И.С., Яшкичев В.И., Егорова О.А. // Неорган. материалы. 1994. Т. 30. № 1. С. 74.
Седых В.Д., Рыбченко О.Г., Некрасов А.Н., Конева И.Е., Кулаков В.И. // Физика твердого тела. 2019. Т. 61. № 6. C. 1099.
Кокаровцева И.Г., Беляев И.Н., Семенякова Л.В. // Успехи химии. 1972. Т. 41. С. 1978.
Klinkova L.A., Nikolaichik V.I., Barkovskii N.V., Fedotov V.K. // J. Solid State Chem. 1999. V. 146. № 2. P. 439. https://doi.org/10.1006/jssc.1999.8390
Adler P., Lebon A., Damljanović V., Ulrich C., Bernhard C., Boris A.V., Maljuk A., Lin C.T., Keimer B. // Phys. Rev. B. 2006. V. 73. № 9. P. 094451. https://doi.org/10.1103/PhysRevB.73.094451
Greenwood N.N., Earnshaw A. Chemistry of the Elements. Oxford: School of Chemistry University of Leeds, 1997. 1342 p.
Hegde M.S., Barboux P., Chang C.C., Tarascon J.M., Venkatesan T., Wu X.D., Inam A. // Phys. Rev. B. 1989. V. 39. № 7. P. 4752. https://doi.org/10.1103/PhysRevB.39.4752
Liang N.T., Lii K.H., Chou Y.C., Tai M.F., Chen T.T. // Solid State Commun. 1987. V. 64. № 5. P. 761. https://doi.org/10.1016/0038-1098(87)90695-8
Bianconi A., Comgiu Castellano A., De Santis M., Delogu P., Gargano A., Giorgi R. // Solid State Commun. 1987. V. 63. № 12. P. 1135. https://doi.org/10.1016/0038-1098(87)91063-5
Shafer M.W., De Groot R.A., Plechaty M.M., Scilla G.J. // Physica C. 1988. V. 153–155. № 2. P. 836. https://doi.org/10.1016/S0921-4534(88)80113-8
Hiratani M., Miyauchi K., Kudo T. // Eur. J. Solid State Inorg. Chem. 1990. V. 27. № 1–2. P. 347.
Harris D.C., Vanderah T.A. // Inorg. Chem. 1989. V. 28. № 6. P. 1198. https://doi.org/10.1021/ic00305a037
Dousek F.P. // Physica C. 1990. V. 171. № 1–2. P. 156. https://doi.org/10.1016/0921-4534(90)90469-U
Mizusaki J., Okayasu M., Yamauchi S., Fueki K. // J. Solid State Chem. 1992. V. 99. № 1. P. 166. https://doi.org/10.1016/0022-4596(92)90301-B
Gattov G., Klipel W. // Z. Anorg. Allg. Chem. 1980. B. 470. H. 1. S. 25. https://doi.org/10.1002/zaac.19804700104
Begemann B., Jansen M. // J. Less Common Met. 1989. V. 156. № 1–2. P. 123. https://doi.org/10.1016/0022-5088(89)90412-8
Kinomura N., Kumada N. // Mat. Res. Bull. 1995. V. 30. № 2. P. 129. https://doi.org/10.1016/0025-5408(94)00123-5
Дополнительные материалы отсутствуют.
Инструменты
Поверхность. Рентгеновские, синхротронные и нейтронные исследования


