Поверхность. Рентгеновские, синхротронные и нейтронные исследования, 2021, № 2, стр. 15-26
Структурно-морфологические и спектральные характеристики гибридных биоактивных медь-, селен- и серебросодержащих наносистем на основе поли-4-акрилоилморфолина
С. В. Валуева a, *, М. Э. Вылегжанина a, К. А. Митусова a, М. А. Безрукова a, О. В. Назарова a, Ю. И. Золотова a, Е. Ф. Панарин a
a Институт высокомолекулярных соединений Российской академии наук
199004 Санкт-Петербург, Россия
* E-mail: svalu67@mail.ru
Поступила в редакцию 20.05.2020
После доработки 17.08.2020
Принята к публикации 25.08.2020
Аннотация
Методами атомно-силовой и просвечивающей электронной микроскопии, УФ/видимой спектроскопии и динамического светорассеяния проведено сравнительное исследование новых гибридных биоактивных наносистем на основе наночастиц различной природы: нуль-валентной меди (Cu0), нуль-валентного селена (Se0) и нуль-валентного серебра (Ag0), стабилизированных водорастворимым гомополимером поли-4-акрилоилморфолином (ПАМ). Показана возможность регулирования структурно-морфологических параметров, а также размерных и спектральных характеристик биоактивных наносистем путем варьирования природы наночастиц. Установлено, что восстановление в воде ионов биогенных элементов в присутствии поли-4-акрилоилморфолина за счет достаточно хорошей экранировки позволяет получать наноструктуры сферической формы диаметром, не превышающим 180 нм (ПАМ/Se0). Наиболее вероятные размеры наночастиц не превышают 12 нм.
ВВЕДЕНИЕ
Получение гибридных наноматерилов полимер-металл/металлоид путем формирования наночастиц (НЧ) металлов/металлоидов в водных растворах высокомолекулярных соединений дифильного строения является динамично развивающимся направлением в последние годы. Одним из наиболее актуальных направлений современной бионанотехнологии является создание полифункциональных лекарственных форм, включающих модифицированные компоненты, поскольку модифицированные препараты обладают рядом преимуществ по сравнению с исходными веществами. Перспективной в этой связи представляется идея модификации водорастворимого биосовместимого гомополимера поли-4-акрилоилморфолина (ПАМ) [1], наночастицами биогенных элементов, с целью создания гибридных биоактивных наносистем – потенциальных лекарственных препаратов. Нанодисперсные системы биогенных элементов таких как медь, серебро и селен представляют особый интерес. Так, медь в нанодисперсном состоянии обладает антимикробными, противовирусными, противоопухолевыми и фунгицидными свойствами, и в тоже время характеризуется сравнительно низкой токсичностью (медь в нуль-валентной форме (Cu0) в 7–50 раз менее токсична, чем медь в ионной форме) [2–9]. Кроме того, НЧ Cu0 стимулируют обменные процессы и проявляют полифункциональную биологическую активность [4]. Соединения меди являются контактными фунгицидами в отношении большинства фитопатогенов, ими обрабатывают сады, виноградники и овощные культуры [6–9].
Наночастицы нуль-валентного серебра (Ag0) проявляют сильно выраженные антимикробные свойства, причем степень антибактериального эффекта в значительной мере определяется морфологией НЧ [10, 11].
Селен – жизненно важный микроэлемент, входит в состав многих ферментов-антиоксидантов и выполняет в организме функцию антиоксиданта с иммуностимулирующим и противоопухолевым действием. Существует зависимость между содержанием селена во внешней среде и частотой поражения населения злокачественными опухолями [12–15]. В клинической медицине показана эффективность использования НЧ селена в нуль-валентной форме (Se0) в комбинации с известными противоопухолевыми веществами [16].
Известно, что наночастицы кинетически неустойчивы в растворе и имеют тенденцию как к агломерации, так и к окислению, поэтому их необходимо стабилизировать. Известными стабилизаторами являются высокомолекулярные соединения [17]. Стабилизация наночастиц полимерами может осуществляться как по стерическому, так и по электростерическому механизму [18], за счет разных по природе нековалентных взаимодействий (гидрофобных и водородных связей, кулоновских и ион-дипольных взаимодействий), при этом тип стабилизации определяется, в первую очередь, природой НЧ. Предполагается, что макромолекулярные экраны, препятствующие дальнейшему росту частиц и предохраняющие их от агрегации, образуются благодаря нековалентным (адсорбционным) взаимодействиям полимерных цепей с поверхностью растущих НЧ. К таким взаимодействиям относятся стерические, электростатические и гидрофобные, а также водородные и координационные связи. Адсорбция макромолекул полимера на НЧ сопровождается формированием органической оболочки на неорганическом ядре и приводит к снижению поверхностного натяжения, стабилизации образующихся НЧ от их агрегации, торможению роста, а также повышению их устойчивости [19]. Кроме того, в таких процессах часто образуются НЧ с достаточно узким распределением по размерам, что важно с практической точки зрения для получения хорошо организованных трехмерных периодических наноструктур. Следует также заметить, что средний размер НЧ, образующихся в присутствии органических соединений, существенно меньше, чем в их отсутствие. Эти факты свидетельствуют о влиянии адсорбции органических молекул на поверхности НЧ металлов/неметаллов на процесс формирования НЧ [20].
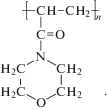
Цель настоящей работы – синтез и сравнительное исследование структурно-морфологических, размерных и спектральных характеристик гибридных биоактивных наносистем на основе НЧ биогенных элементов Cu0, Ag0 и Se0, стабилизированных водорастворимым дифильным гомополимером поли-4-акрилоилморфолином (ПАМ), структурная формула представлена ниже:
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Материалы
Для синтеза наночастиц меди, серебра и селена использовались сульфат меди и аммиак водный (“Реахим”, Москва), гидразин гидрат и нитрат серебра (“ЭкросХим”, Москва), боргидрид натрия и селенистая и аскорбиновая кислоты (“Вектон”, Санкт-Петербург). Вещества растворялись в апирогенной воде для инъекций.
Гомополимер 4-акрилоилморфолина (поли-4-АМ) синтезировали методом свободно-радикальной полимеризации в запаянной ампуле в атмосфере аргона. Процесс проводили в растворе N,N-диметилформамида при 60°С в течение 24 ч. Концентрация мономера составляла 20 мас. %, инициатора – 2,2'-азо-бис-изобутиронитрила – 1% от массы мономера. Полученный полимер очищали от низкомолекулярных примесей диализом против воды. Использовали диализные мембраны Spectra/Por 7 фирмы “Spectrum Lab. Inc.” (США), позволяющие удалять соединения с молекулярной массой М ≤ 1000. Из водного раствора полимер выделяли лиофильной сушкой.
Методы исследования. Изучение морфологии гибридных биоактивных наносистем методом атомно-силовой микроскопии (АСМ)
Исследование морфологии гибридных биоактивных наносистем ПАМ/НЧ проводили методом АСМ на атомно-силовом микроскопе Nanotop NT-206 (ОДО “Микротестмашины”, Беларусь). Измерения выполняли в контактном режиме в атмосферных условиях с использованием кремниевых кантилеверов NSC11/AlBS с коэффициентом жесткости k = 3.0 Н/м и радиусом кривизны кончика острия 10 нм. Экспериментальные данные обрабатывали с помощью программы Surface Explorer. В качестве подложки использовали слюду.
Исследования методом просвечивающей электронной микроскопии (ПЭМ)
Исследования методом просвечивающей электронной микроскопии (ПЭМ) проводили на электронном микроскопе BS-500 (фирмы “Tesla”, Чехия) при ускоряющем напряжении U = 60 кВ, в диапазоне увеличений 9000–30 000. Перед исследованием водные растворы наносистем наносили на медную сетку, покрытую формваровой пленкой, и сушили на воздухе.
Регистрация спектров поглощения
Спектры поглощения в ультрафиолетовой (УФ) и видимой областях измеряли с помощью спектрофотометра Specord M-40 (“Карл Цейс” г. Йена, Германия) в рабочем диапазоне от 220 до 900 нм, в кварцевых кюветах с толщиной фотометрического слоя 1 см. Относительная суммарная погрешность при регистрации спектров не превышала 2%.
Измерения динамического светорассеяния
Гидродинамические радиусы наноструктур ($R_{h}^{*}$) в водных растворах определяли методом динамического светорассеяния (ДСР)на корреляционном спектрометре Photoсor Complex (источник света – гелий-неоновый лазер фирмы “Coherent” мощностью 20 мВт и длиной волны λ = 632.8 нм) с программируемым коррелятором Photocor-FC (число каналов 288, ООО “Фотокор”, Россия). Обработку корреляционной функции осуществляли с помощью программы DynaLS (“Гелиос”, Россия). Величины гидродинамических радиусов $R_{{\text{h}}}^{*}$ рассчитывали из значений коэффициентов диффузии (D *) по уравнению Эйнштейна – Стокса: $R_{{\text{h}}}^{*}$ = kT/6πη0D * (η0 – вязкость растворителя, k – константа Больцмана, T – температура) [21].
Диффузия и скоростная седиментация
Для исследования молекулярно-конформационных характеристик синтезированного гомополимера поли-4-акрилоилморфолина использовались гидродинамические методы – поступательная диффузия и скоростная седиментация. Гидродинамические характеристики определяли в водном растворителе (0.1 н HCl + 0.1 н NaCl). Коэффициент поступательной диффузии D был определен методом дисперсии границы раствор-растворитель на поляризационном диффузометре Цветкова [22] при температуре 24°С. Образование границы раствор–растворитель выполняли в подслаивающей оптической кювете длиной 3 см по ходу луча света. Фотографии интерференционных полос границы раствор–растворитель обрабатывали методом максимальной ординаты и площади под интерференционной полосой [23]. По площадям под интерференционными кривыми рассчитывали инкремент показателя преломления dn/dc (dn/dc = 0.156 см3/г). По измеренным коэффициентам диффузии D рассчитали гидродинамический радиус эквивалентной сферы Rh по уравнению Эйнштейна–Стокса: Rh = kT/6πη0D. Коэффициенты седиментации s макромолекул в центробежном поле измерены на ультрацентрифуге (фирмы “МОМ 3180”, Венгрия), оборудованной поляризационно-интерферометрической приставкой [24], при скорости вращения ротора 40 × 103 об./мин при температуре 24°С. Использовали двухсекторную кювету с образованием искусственной границы методом наслаивания. Толщина кюветы по ходу луча света равнялась 12 мм. Поляризационно-интерферометрическая оптика, установленная на ультрацентрифуге и диффузометре, позволила проводить измерения при концентрациях, не превышающих 0.15 × 10–2 г/см3, и не исследовать концентрационные зависимости. По данным седиментационно-диффузионных измерений определена абсолютная молекулярная масса MsD ПАМ методом Сведберга: MsD = = (s/D)NAkT/(1 – νρ0), где ρ0– плотность растворителя. Для фактора плавучести (1 – νρ0) ПАМ приняли значение 0.254 [23]. Значения гидродинамического инварианта Цветкова–Кленина рассчитывали по формуле [24]: А0 = (η0D/T) × × (MsD[η]/100)1/3. Молекулярно-конформационные характеристики ПАМ, полученные методами вискозиметрии и седиментационно-диффузионного анализа представлены в табл. 1.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Синтез наночастиц нуль-валентной меди
Наночастицы нуль-валентной меди получали восстановлением сульфата меди CuSO4 ⋅ 5H2O гидразин гидратом N2H4 ⋅ H2O в водном растворе в присутствии ПАМ по реакции (1):
(1)
${\text{C}}{{{\text{u}}}^{{2 + }}} + {{{\text{N}}}_{2}}{{{\text{H}}}_{4}} + 4{\text{O}}{{{\text{H}}}^{ - }} \to 2{\text{C}}{{{\text{u}}}^{0}} + {{{\text{N}}}_{2}}{\kern 1pt} \uparrow + \,4{{{\text{H}}}_{2}}{\text{O}}{\text{.}}$Согласно работе [25], кроме наночастиц Cu0 в качестве примесей могут образоваться наночастицы оксидов меди. Чтобы избежать образования примесей реакцию восстановления проводили в два этапа. Сначала к водному раствору CuSO4 и ПАМ добавляли водный аммиак до рН 10.8 (цвет раствора становился ярко синим), чтобы обеспечить полное связывание Cu2+ в комплексный ион:
Затем реакционную смесь нагревали на водяной бане до 60°С при механическом перемешивании и добавляли раствор гидразин гидрата в соотношении Cu : N2H4 ⋅ H2O = 1 : 30, после этого реакционную смесь охлаждали до комнатной температуры (21°С). Реакция завершалась, когда раствор приобретал насыщенный коричнево-красный цвет, характерный для НЧ Cu0. В сильнощелочной среде реакция восстановления аммиаката меди протекает с образованием НЧ меди и выделением азота:
(2)
$\begin{gathered} 2{\text{CuS}}{{{\text{O}}}_{4}} + 4{\text{N}}{{{\text{H}}}_{3}} + {{{\text{N}}}_{2}}{{{\text{H}}}_{4}} = \\ = 2{\text{C}}{{{\text{u}}}^{0}} + 2{{{\text{N}}}_{2}}{\kern 1pt} \uparrow + \,2{{({\text{N}}{{{\text{H}}}_{4}})}_{2}}{\text{S}}{{{\text{O}}}_{4}}. \\ \end{gathered} $Концентрация НЧ меди в наносистеме составляла: $С_{{{\text{C}}{{{\text{u}}}^{0}}}}^{{}}$ = 0.005 маcс. %, концентрация ПАМ СПАМ = = 0.1 маcс. % (ν = $С_{{{\text{C}}{{{\text{u}}}^{0}}}}^{{}}$/СПАМ = 0.05, где ν – массовое соотношение концентраций НЧ и гомополимера) [26]. рН медьсодержащих растворов составляла 10.8.
Синтез наночастиц нуль-валентного селена
Синтез НЧ нуль-валентного селена осуществлялся в результате реакции (3) между селенистой (H2SeO3) и аскорбиновой (C6H8O6) кислотами в присутствии ПАМ:
(3)
${{{\text{H}}}_{2}}{\text{Se}}{{{\text{O}}}_{3}} + 2{{{\text{C}}}_{6}}{{{\text{H}}}_{8}}{{{\text{O}}}_{6}} \to {\text{S}}{{{\text{e}}}^{0}} + 3{{{\text{H}}}_{2}}{\text{O}} + 2{{{\text{C}}}_{6}}{{{\text{H}}}_{8}}{{{\text{O}}}_{6}}.$В реакционную колбу помещали водный раствор ПАМ (СПАМ = 0.1 маcс. %) и раствор H2SeO3 ($С_{{{\text{S}}{{{\text{e}}}^{0}}}}^{{}}$ = = 0.005 маcс. %). Смесь перемешивали при комнатной температуре 20 мин, затем добавляли раствор аскорбиновой кислоты в соотношении 1 : 2. После введения всех компонентов раствор выдерживали при комнатной температуре в течение суток. После завершения реакции раствор приобретал красновато-оранжевый цвет. В отсутствие сополимера происходило образование золя нуль-валентного красного аморфного селена (Se0), который выпадал в осадок через ~24 часа. Кроме того, через 7–10 сут Se0 из аморфной красной формы переходил в другую модификацию – серый металлический селен.
Таким образом, в отсутствие стабилизатора НЧ селена показали низкую агрегативную устойчивость. Введение в реакционную среду ПАМ позволило получить стабильные растворы красновато-оранжевого цвета, сохраняющие свои физико-химические свойства в течение 1–2 месяцев. рН селен-содержащих растворов составляла 3.8.
Синтез наночастиц нуль-валентного серебра
Наночастицы нуль-валентного серебра получали в результате окислительно-восстановительной реакции (4) нитрата серебра (AgNO3) с боргидридом натрия (NaBH4):
(4)
$\begin{gathered} {\text{AgN}}{{{\text{O}}}_{3}} + {\text{NaB}}{{{\text{H}}}_{4}} + {{{\text{H}}}_{2}}{\text{O}} \to \\ \to {\text{A}}{{{\text{g}}}^{0}} + {\text{NaN}}{{{\text{O}}}_{3}} + {\text{B}}{{\left( {{\text{OH}}} \right)}_{3}} + {{{\text{H}}}_{2}}{\kern 1pt} \uparrow {\kern 1pt} . \\ \end{gathered} $В колбу заливали водный раствор гомополимера ПАМ и раствор нитрата серебра (AgNO3). Синтез проводился из расчета $С_{{{\text{A}}{{{\text{g}}}^{0}}}}^{{}}$ = 0.005 маcс. % и ССП = = 0.1 маcс. %. Колбу помещали в ледяную баню на 30–40 мин. Далее при механическом перемешивании в полученную смесь добавляли восстановитель NaBH4 в избытке 1 : 24. Раствор выдерживали в ледяной бане в течение 1ч, а затем еще сутки в холодильнике. В результате восстановления серебра получался раствор желтовато-коричневатого цвета. При смешении растворов AgNO3 и NaBH4, в отсутствие веществ, препятствующих агрегации частиц, происходит быстрая, необратимая реакция с выпадением черного осадка металлического серебра. В присутствии ПАМ растворы НЧ Ag0 стабильны не менее двух месяцев. рН серебросодержащих растворов составляла 10.5.
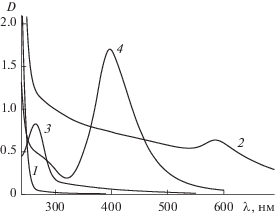
На рис. 1 приведены оптические спектры поглощения в УФ- и видимой областях для свободного гомополимера ПАМ (рис. 1, кривая 1) и для меди-, селен- и серебросодержащих гибридных биоактивных наносистем: ПАМ/Cu0 (рис. 1, кривая 2), ПАМ/Se0 (рис. 1, кривая 3) и ПАМ/Ag0 (рис. 1, кривая 4) при ν = 0.05. На оптических спектрах поглощения, полученных для медьсодержащей наносистемы ПАМ/Cu0 появлялась характерная для НЧ Cu0 полоса поверхностного плазмонного резонанса (ППР) при λ = 580 нм (рис. 1, кривая 2) (согласно работе [27] для наночастиц меди ППР наблюдается в диапазоне длин волн λ = 570–590 нм). Полосы поглощения, характерные для оксидов меди, обычно наблюдаемые в диапазонах λ = 300–450 и 700–750 нм [28, 29], на данном спектре отсутствовали. Следует отметить, что ПАМ в данном диапазоне длин волн не поглощает (рис. 1, кривая 1). В случае селенсодержащей наносистемы ПАМ/Se0 (рис. 1, кривая 3) на оптическом спектре поглощения наблюдается четко выраженный узкий пик при λ = 260 нм, что свидетельствует об образовании в водном растворе НЧ селена в нуль-валентном состоянии (согласно литературным данным пик поглощения для свободных НЧ Se0 наблюдается при λ = 256 нм [30], что мало отличается от ранее исследованных нами селенсодержащих наносистем [17]). Максимум полосы поверхностного плазмонного резонанса для серебросодержащей наносистемы ПАМ/Ag0 наблюдается при λ = 400 нм (рис. 1, кривая 4), что свидетельствует об образовании в водном растворе НЧ серебра в нуль-валентном состоянии [17, 31].
Рис. 1.
УФ/видимые спектры для свободногого гомополимера (кривая 1) и для гибридных биоактивных наносистем: ПАМ/Cu0 (кривая 2), ПАМ/Se0 (кривая 3) и ПАМ/Ag0 (кривая 4) при ν = 0.05.
Важно отметить, что селен представляет собой гидрофобный неорганический полимер, поэтому стабилизация НЧ Se0 происходит преимущественно за счет взаимодействий НЧ с гидрофобными CH2-группами ПАМ. То есть реализуется стерический механизм стабилизации за счет энтропийного эффекта, вызываемого уменьшением конфигурационной свободы полимерных цепей в области между частицами за счет гидрофобных взаимодействий [18, 32]. Для металлсодержащих наносистем ПАМ/Cu0 и ПАМ/Ag0 имеет место стерический механизм стабилизации за счет осмотического эффекта, возникающего из-за повышенной концентрации полимера в области между частицами [18, 32].
В гидродинамических экспериментах для исходного гомополимера были определены значения характеристической вязкости [η] = 0.26 дл/г, коэффициентов поступательной диффузии D = = 4.4 × 10–7 cм2/c (dn/dc = 0.156 см3/г) и скоростной седиментации s = 2.82 Св, оценен гидродинамический радиус Rh = 5нм, рассчитаны молекулярная масса MsD = 60400 и гидродинамический инвариант A0 = 3.6 × 10–10 эрг/град. Найденная величина A0 характерна для гибкоцепных полимеров в хороших растворителях и согласуется с результатами работы [23].
Учитывая, что чем сильнее взаимодействие поверхностных атомов с адсорбированными на НЧ макромолекулами, тем меньше размер частиц, при котором образуется устойчивая в растворе система [33]. Были сопоставлены величины гидродинамических радиусов $R_{{\text{h}}}^{*}$ для медь-, селен- и серебросодержащих гибридных биоактивных наносистем на основе ПАМ. При использовании в качестве стабилизатора НЧ гомополимера ПАМ в водных растворах при ν = 0.05 формируются наноструктуры с гидродинамическим радиусом $R_{{\text{h}}}^{*}$ < 100 нм (табл. 2 и рис. 2), без тенденции к агрегации в течение нескольких месяцев. Анализ данных показал, что величина гидродинамического радиуса наноструктуры $R_{{\text{h}}}^{*}$ уменьшается для изученных наносистем следующим образом: $R_{{\text{h}}}^{*}$ = 17 нм (ПАМ/Ag0) < $R_{{\text{h}}}^{*}$ = 50 нм (ПАМ/Cu0) < $R_{{\text{h}}}^{*}$ = 65 нм (ПАМ/Se0) (табл. 2 и рис. 2), что, обусловлено большей степенью гидрофобности НЧ селена по сравнению с НЧ серебра и меди.
Таблица 2.
Данные по размерным параметрам для гибридных биоактивных наносистем ПАМ/НЧ при ν = 0.05
| ПАМ/НЧ | $R_{{\text{h}}}^{*},$ нм | $R_{{{\text{sp}}}}^{*},$ нм | $R_{{{\text{АСМ}}}}^{*},$ нм | Ra, нм | Rq, нм | $R_{{{\text{ПЭМ}}}}^{*},$ нм |
|---|---|---|---|---|---|---|
| ПАМ/Cu0 | 50 | 65 | 40–50 | 0.8 | 1.1 | 3.5 и 6.5 |
| ПАМ/Se0 | 67 | 86 | 70–90 | 3.0 | 4.2 | 6 и 12 |
| ПАМ/Ag0 | 17 | 22 | 50–80 | 2.3 | 3.7 | 3 |
Рис. 2.
Распределение по размерам $R_{{\text{h}}}^{*}$ для гибридных биоактивных наносистем ПАМ/НЧ: ПАМ/Cu0 (а), ПАМ/Se0 (б) и ПАМ/Ag0 (в) при ν = 0.05 в соответствии с относительной интенсивностью I/I0 динамического светорассеяния.

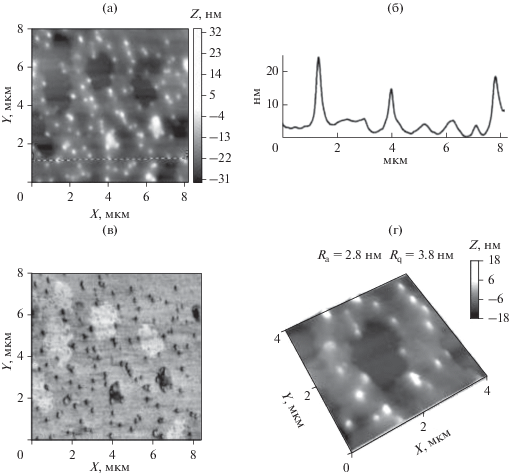
На рис. 3а–3г представлены АСМ-изображения поверхности тонкой пленки, отлитой из водного раствора медьсодержащей наносистемы ПАМ/Cu0, полученные в контактном режиме при комнатной температуре на слюде методом АСМ. На топографии и 3D-изображении (рис. 3а и 3г, соответственно) наблюдаютcя структуры двух морфологических типов: отдельные сферические наноструктуры радиусом 40–50 нм (табл. 2) и высотой над поверхностью подложки около 2 нм; кроме этого четко визуализируются кольцевые агрегаты размером ~0.5–0.7 мкм, имеющими толщину 100–200 нм и высоту над поверхностью подложки не более 1 нм. Ситуация, когда сосуществуют относительно малые наноструктуры меди (сферической формы) с крупными агрегированными образованиями (произвольной формы) возможна при взаимодействиях макромолекул с растущими НЧ, усиливающимися по ходу реакции получения золя [20].
Рис. 3.
АСМ-изображения поверхности тонкой пленки, полученной из водного раствора наносистемы ПАМ/Cu0 на слюде (а–г): а – топография (высота) поверхности, б – профиль выделенного участка, в – контраст латеральных сил (torsion), г – 3D-изображение.

Радиусы сферических наноструктур, оцененные методом АСМ, хорошо коррелируют с геометрическими размерами наноструктур, полученными методом динамического светорассеяния, $R_{{{\text{sp}}}}^{*}$ = 65 нм (где $R_{{{\text{sp}}}}^{*}$ = 1.29 $R_{{\text{h}}}^{*}$ – соотношение, выполняемое для сферической модели наноструктуры) (табл. 2). Расчетные математические параметры шероховатости пленки невелики и имеют следующие значения: среднеарифметическая шероховатость составляет Ra = 0.8 нм, среднеквадратическая шероховатость Rq = 1.1 нм (для матрицы сканирования 4 × 4 мкм) (табл. 2).
Дополнительную информацию дает анализ изображений контраста латеральных сил (рис. 3в, 4в, 5в). Для наносистемы ПАМ/Cu0 (рис. 3в) наблюдается островковая морфология – НЧ меди находятся в полимерной матрице, при этом видно, что пленка не сплошная.
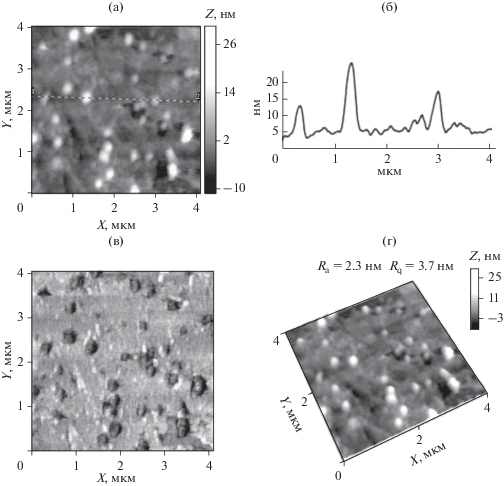
На АСМ-изображениях, полученных для селенсодержащей наносистемы ПАМ/Se0 (рис. 4) хорошо видно, что наноструктуры представляют собой изолированные (дискретные) сферы. Радиусы этих наноструктур, оцененные методом АСМ, $R_{{{\text{АСМ}}}}^{*}$ = 70–90 нм (табл. 2), хорошо коррелируют с геометрическими размерами наноструктур $R_{{{\text{sp}}}}^{*}$ = 86 нм, полученными методом динамического светорассеяния. Высота наноструктур над поверхностью подложки не превосходит 7–10 нм (рис. 4г). Параметры шероховатости в этом случае имеют большие величины, чем для медьсодержащей наносистемы: Ra = 3.0 нм и Rq = = 4.2 нм (для матрицы сканирования 4 × 4 мкм) (табл. 2 и рис. 3г).
Рис. 4.
АСМ-изображения поверхности тонкой пленки, полученной из водного раствора наносистемы ПАМ/Se0 на слюде (а–г); а – топография (высота) поверхности, б – профиль выделенного участка, в – контраст латеральных сил (torsion), г – 3D-изображение.
На рис. 5 представлены АСМ-изображения поверхности тонкой пленки, отлитой из водного раствора серебросодержащей наносистемы ПАМ/Ag0. Здесь так же, как и в случае с селенсодержащей наносистемой, наблюдаются изолированные сферические наноструктуры радиусом 50–90 нм (табл. 2) и высотой над поверхностью подложки около 5 нм. Однако, в этом случае, четкой корреляции размеров $R_{{{\text{ACM}}}}^{*}$ и $R_{{{\text{sp}}}}^{*}$ не наблюдается (табл. 2).
Рис. 5.
АСМ-изображения поверхности тонкой пленки, полученной из водного раствора наносистемы ПАМ/Ag0 на слюде (а–г); а – топография (высота) поверхности, б – профиль выделенного участка, в – контраст латеральных сил (torsion), г – 3D-изображение.
Анализ данных АСМ показал, что размер наноструктуры RАСМ уменьшается для изученных наносистем в ряду RАСМ для ПАМ/Cu0< RАСМ для ПАМ/Ag0< RАСМ для ПАМ/Se0 (табл. 2 и рис. 3–5), что, в целом коррелирует с данными полученными методом ДСР.
Для наносистемы ПАМ/Ag0 (рис. 5в) наблюдается заметная разница коэффициентов трения агрегатов частиц и самой полимерной матрицы, из чего можно сделать вывод, что данные агрегаты не покрыты полимером.
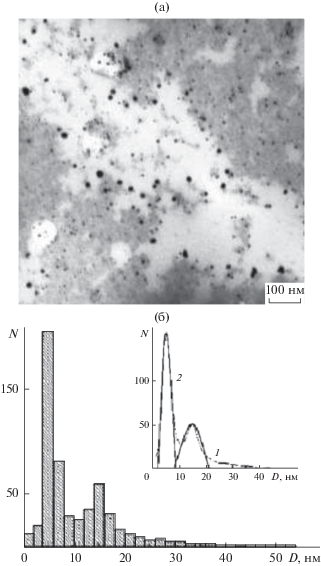
Методом просвечивающей электронной микроскопии (ПЭМ) были изучены НЧ Cu0, стабилизированные ПАМ. Из рис. 6а видно, что сформировавшиеся НЧ Cu0 имеют сферическую форму и дискретны по всей матрице полимера. Распределение НЧ по размерам (гистограмма на рис. 6б) рассчитывали на основе полученных ПЭМ-изображений с помощью программы ImageJ 1.51j8. Анализ полученной гистограммы позволил установить, что диаметр НЧ Cu0 изменялся от 2 до ~10 нм, а наиболее вероятные размеры составляли 3.5 и 6.5 нм (табл. 2), что характерно при использовании в качестве стабилизатора неионогенного полимера, каковым и является ПАМ [34]. Из литературных данных [35] известно о двух принципиально возможных механизмах формирования наночастиц – последовательном и параллельном. В процессе последовательного роста частицы формируются посредством присоединения на каждой стадии одного атома. Случайный процесс присоединения, происходящий на каждой последующей стадии с равной вероятностью, приводит к образованию продукта, подчиняющегося нормальному (Гауссову) распределению:
(5)
$y = {{y}_{0}} + \frac{A}{{w\sqrt {\frac{\pi }{2}} }}\exp \left( { - 2{{{\left( {\frac{{x - xc}}{w}} \right)}}^{2}}} \right).$Рис. 6.
ПЭМ-изображение наноcистемы ПАМ/Cu0(а); гистограмма распределения НЧ Cu0 стабилизированных ПАМ (б). Вставка – экспериментально полученное распределение НЧ Cu0 по размерам (1), распределение частиц, построенное по экспериментальным данным, соответствующим распределению Гаусса (2).

В процессе параллельного роста частиц из двух атомов формируется димер, два димера образуют тетрамер, два тетрамера – октамер и т.д. Случайный процесс, в котором реализуется параллельный механизм роста, приводит к образованию продукта, подчиняющегося логарифмически нормальному распределению (ЛНР) соотношение:
(6)
$y = {{y}_{0}} + \frac{A}{{\sqrt {2\pi } \sigma x}}\exp \left( { - \frac{1}{2}{{{\left( {\frac{{\ln (x) - \ln (\bar {x})}}{\sigma }} \right)}}^{2}}} \right).$Нами был проведен расчет с целью определения механизма роста НЧ меди. Полученное распределение НЧCu0 по размерам было обработано в программе Origin 8 (рис. 6б вставка, кривая 1). Расчеты показали, что построенное по экспериментальным данным распределение имеет тримодальный характер, а каждая из отдельных мод описывается Гауссовым распределением (5) (рис. 6б вставка, кривая 2). Это соответствует последовательному механизму роста НЧ.
Из рис. 7а видно, что сформировавшиеся НЧ Se0 имеют сферическую форму и дискретны по всей матрице полимера. Распределение НЧ по размерам (гистограмма на рис. 7б) показало, что диаметр НЧ Se0 изменялся от 2 до ~20 нм, а наиболее вероятные размеры составляли 6 и 12 нм (табл. 2). Аналогичная ситуация наблюдалась нами для селенсодержащих наносистем на основе других полимерных стабилизаторов различной природы (неионогенные полимеры (ПВП, ОЭЦ), катионный (ПТМАЭМ) и анионные (поли-2-акриламидо-2-метилпро-пансульфокислота и полиметакриловая кислота) полиэлектролиты) [36]: формировались плотные сферические наноструктуры с базовым размером селенового ядра, равным 6 нм и с размером “нанокластеров”, кратным 6 нм (12–30 нм). Построенное по экспериментальным данным распределение (рис. 7б, вставка, кривая 1) имеет бимодальный характер, а каждая из отдельных мод описывается Гауссовым распределением (5) (рис. 7б вставка, кривая 2), т.е. имеет место последовательный механизм формирования НЧ селена.
Рис. 7.
ПЭМ-изображение наноcистемы ПАМ/Se0(а); гистограмма распределения НЧ Se0стабилизированных ПАМ (б). Вставка – экспериментально полученное распределение НЧ Se0по размерам (1), распределение частиц, построенное по экспериментальным данным, соответствующим распределению Гаусса (2).
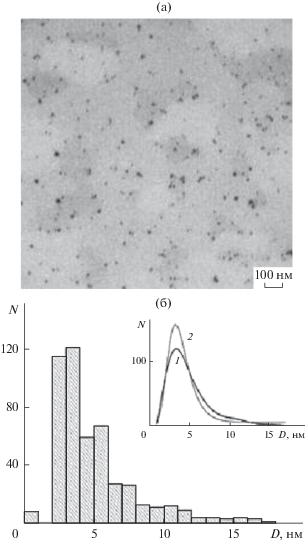
Распределение НЧ Ag0 по размерам, представленное на рис. 8, было обработано в программе Origin 8. Расчеты показали, что построенное по экспериментальным данным распределение (рис. 6б вставка, кривая 1) описывалось формулой (6), соответствующей ЛНР (рис. 8б вставка, кривая 2), т.е. имеет место параллельный механизм формирования НЧ. Анализ полученной гистограммы (рис. 8б) позволил установить, что диаметр НЧ Ag0 изменялся от 2 до ~17 нм, а наиболее вероятные размеры составляли 3 нм (табл. 2).
Рис. 8.
ПЭМ-изображение наноcистемы ПАМ/Ag0 (а); гистограмма распределения НЧ Ag0 стабилизированных ПАМ (б). Вставка – экспериментально полученное распределение НЧ Ag0 по размерам (1), распределение частиц, построенное по экспериментальным данным, соответствующим ЛНР (2).
Таким образом, обнаружено, что серебро- и медьсодержащие наносистемы имеют меньшие размеры наноструктур и наночастиц, чем селенсодержащие наносистемы, что обусловлено большей степенью гидрофобности НЧ селена по сравнению с НЧ серебра и меди.
Полученные результаты составляют физико-химическую основу для модификации полимерных материалов с выраженной физиологической активностью биогенными элементами в нуль-валентной форме.
ВЫВОДЫ
1. Синтезированы новые гибридные биоактивные наносистемы на основе наночастиц биогенных элементов различной природы (меди, селена и серебра) и дифильного гомополимера поли-4-акрилоилморфолина (ПАМ).
2. Методом УФ/видимой спектроскопии для исследованных медь-, селен- и серебросодержащих наносистем на основе ПАМ установлен факт образования в водном растворе наночастиц в нуль-валентном состоянии (Cu0, Se0 и Ag0).
3. Показана возможность регулирования структурно-морфологических и размерных параметров биоактивных наносистем путем варьирования природы наночастиц. Установлено, что в водном растворе изученных наносистем формируются сферические наноструктуры/наночастицы, размеры которых в значительной мере определяются природой НЧ: медь- и серебросодержащие наноструктуры/наночастицы имеют меньшие значения размеров ($R_{{\text{h}}}^{*},$ $R_{{{\text{ACM}}}}^{*}$ и $R_{{{\text{ПЭМ}}}}^{*}$), чем селенсодержащие. Это обусловлено большей степенью гидрофобности наночастиц селена по сравнению с наночастицами меди и серебра.
4. Установлено, что восстановление в воде ионов биогенных элементов в присутствии ПАМ за счет достаточно хорошей экранировки позволяет получать наноструктуры сферической формы диаметром, не превышающим 180 нм (ПАМ/Se0). Наиболее вероятные размеры НЧ/ нанокластеров не превышают 12 нм.
5. Выдвинуто предположение, что стабилизация НЧ селена Se0 происходит по стерическому механизму за счет энтропийного эффекта, а для металлсодержащих наносистем ПАМ/Cu0 и ПАМ/Ag0 имеет место стерический механизм стабилизации за счет осмотического эффекта.
6. Расчеты показали, что построенные по экспериментальным данным распределения НЧ меди и селена имеют, соответственно, тримодальный и бимодальный характер, а каждая из отдельных мод описывается Гауссовым распределением, что соответствует последовательному механизму роста этих НЧ. Распределение НЧ Ag0 по размерам представляет собой логарифмически нормальное распределение, т.е. здесь имеет место параллельный механизм формирования НЧ.
Список литературы
Kipper A.I., Savinov A.G., Valueva S.V. et al. // Polym. Sci. Ser. B. 2003. V. 45. № 3. P. 100.
Borkow G., Gabbay J. // Current Chemical Biology. 2009. V. 3. № 3. P. 272.https://doi.org/10.2174/2212796810903030272
Lansdown A.B.G., Sampson B., Rowe A. // J. Anat. 1999. V. 195. P. 375. https://doi.org/10.1046/j.1469-7580.1999.19530375.x
Shende S., Ingle A.P., Gade A., Rai M. // World Journal of Microbiology and Biotechnology. 2015. V. 31. № 6. P. 865.https://doi.org/10.1007/s11274-015-1840-3
Halevas E.G., Pantazaki A.A. // Nanomed. Nanotechnol. J. 2018. V. 2. № 1. P. 119.
Saharan V., Sharma G., Yadav M. et al. // J. Biol. Macromol. 2015. V. 75. P. 346.https://doi.org/10.1016/j.ijbiomac.2015.01.027
Cioffi N., Torsi L., Ditaranto N. // Appl. Phys. Lett. 2004. V. 85. № 12. P. 2417. https://doi.org/10.1063/1.1794381
Abd-Elsalam K.A., Vasil’kov A.Y., Said-Galiev E.E. et al. // Eur. J. Plant Pathol. 2018. V. 151. P. 57. https://doi.org/10.1007/s10658-017-1349-8
Mekahlia S., Buzid B. // Physics Procedia. 2009. V. 2. P. 1045. https://doi.org/10.1016/j.phpro.2009.11.061
Афиногенов Г.Е., Панарин Е.Ф. Антимикробные полимеры. СПб.: Гиппократ, 1993. 264 с.
Назарова О.В., Ананьева Е.П., Зарубаев В.В., Синегубова Е.О., Золотова Ю.И., Безрукова М.А., Панарин Е.Ф. // Хим.-фарм. журн. 2019. Т. 53. № 11. С. 48.
Yoshizawa K., Willett W.C., Morris S.J. // J. Natl. Cancer Inst. 1998. V. 90. № 16. P. 1219.https://doi.org/10.1093/jnci/90.16.1219
Kok F.J., Hofman A., Witteman J.C.M. et al. // JAMA. 1989. V. 261. № 10. P. 1161. https://doi.org/10.1093/ajcn/45.2.462
Валуева С.В., Боровикова Л.Н., Коренева В.В. и др. // Журн. физ. химии. 2007. Т. 81. № 1. С. 1329. ISSN: 0044-4537.
Валуева С.В., Азизбекян С.Г., Кучинский М.П. и др. // Журн. “Нанотехника”. 2012. № 4(32). С. 53.
Wang Y., Hang H., Yan L. // Colloids and Surfaces B: Biointerfaces. 2016. V. 140. P. 297.https://doi.org/10.1016/j.colsurfb.2016.02.025
Валуева С.В., Вылегжанина М.Э., Плющенко А.В. // Поверхность. Рентген., синхротр. и нейтрон. исслед. 2019. № 7. С. 27. ISSN: 1028-0960. https://doi.org/10.1134/S0207352819070175
Mayer A.B.R. // Polym. Adv. Technol. 2001. V. 12. P. 96.
Тальрозе Р.В., Шандрюк Г.А., Мерекалов А.С., Шаталова А.М., Отмахова О.А. // Высокомолекулярные соединения А. 2009. Т. 51. № 11. С. 1930.
Литманович О.Е. // Высокомолекулярные соединения С. 2008. Т. 50. № 7. С. 1370.
Brown W. Dynamic Light Scattering: the Method and Some Application. Oxford: Clarondon Press, 1993. 305 p.
Eskin V.E., Frenkel S.Ya. Structure of Macromolecules in Solutions, National Lending Library for Sci. and Technol., Boston Spa, Yorkshire, England, 1979. 750 p.
Андреева Л.Н., М.А. Безрукова М.А., Бушин С.В. и др. // ВМС. А. 2014. Т. 56. № 4. С. 372.
Tsvetkov V.N., Lavrenko P.N., Bushin S.V. // J. Polym. Sci.: Polym. Chem. Ed. 1984. V. 22. № 11. P. 3447. https://doi.org/10.1002/pol.1984.170221160
AL-Thabaiti S.A., Obaid A.Y., Khan Z. // Colloid Polym. Sci. 2015. P. 12.https://doi.org/10.1007/s00396-015-3633-5
Valueva S.V., Nazarova O.V., Vylegzhanina M.E., Borovikova L.N., Zolotova Yu. I., Panarin E.F. // Doklady Chemistry. 2019. V. 489. Part 1. P. 264–266.https://doi.org/0.1134/S0012500819110065
Guzman A., Arroyoa J., Verdea L., Rengifoa J. // Procedia Materials Science. 2015. V. 9. P. 298.https://doi.org/10.1016/j.mspro.2015.04.038
Sundaramurthy N., Parthiban C. // IRJET (International Research J. Engineering and Technology). 2015. V. 2. № 6. P. 332.
Rodriguez O.P., Pal. U. // J. Opt. Soc. Am. B. 2008. V. 28. № 11. P. 2375.
Бусев А.И. Колориметрические (фотометрические) методы определения неметаллов. М.: Издательство иностранной литературы, 1963. 467 с.
Низамов Т.Р., Евстафьев И.В., Оленин А.Ю., Лисичкин Г.В. // Коллоидный журн. 2014. Т. 76. № 4. С. 513.https://doi.org/10.1134/S1061933X14040127
Валуева С.В., Боровикова Л.Н., Суханова Т.Е., Вылегжанина М.Э. // Сборник трудов VII Межд. научно-практической конф. “Актуальные достижения европейской науки-2011”, София, Болгария, С. 13.
Kamat P.V. // J. Phys. Chem. B. 2002. V. 106. P. 7729.
Литманович О.Е., Литманович А.А, Паписов И.М. // Высокомолек. соед. Б. 2010. Т. 52. № 6. С. 1066.
Оленин А.Ю. // Российские нанотехнологии. 2012. Т. 7. № 5–6. С. 53.
Валуева С.В., Боровикова Л.Н., Суханова Т.Е., Лаврентьев В.К., Волков А.Я. // Бутлеровские сообщения. 2011. Т. 25. № 7. С. 13.
Дополнительные материалы отсутствуют.
Инструменты
Поверхность. Рентгеновские, синхротронные и нейтронные исследования